Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
La cornée micropoche test: Un modèle de l'angiogenèse dans l'oeil de la souris
Dans cet article
Résumé
Le protocole décrit l'essai de micropoche de la cornée tel que développé chez la souris.
Résumé
L'essai de micropoche de la cornée de la souris est un test robuste et quantitative in vivo pour l'évaluation de l'angiogenèse. En utilisant des pastilles standardisés à libération lente contenant des facteurs de croissance spécifiques qui déclenchent la croissance des vaisseaux sanguins tout au long de la cornée naturelle avasculaire, l'angiogenèse peut être mesurée et quantifiée. Dans cet essai, la réponse angiogénique est généré au cours de plusieurs jours, selon le type et la dose de facteurs de croissance utilisé. L'induction de la néovascularisation est généralement déclenchée soit par le facteur de croissance basique des fibroblastes (bFGF) ou un facteur de croissance endothélial vasculaire (VEGF). La combinaison de ces facteurs de croissance avec le sucralfate et hydron (poly-HEMA (poly (méthacrylate de 2-hydroxyéthyle))) et couler le mélange en pastilles, ils peuvent être implantés chirurgicalement dans l'oeil de la souris. Ces pastilles uniformes libèrent lentement les facteurs de croissance au cours de cinq ou six jours (bFGF ou VEGF respectivement) permettant réponse angiogénique suffisant requis pour la zone de la cuve qUANTIFICATION en utilisant une lampe à fente. Ce dosage peut être utilisé pour différentes applications, y compris l'évaluation de médicaments modulateurs angiogéniques ou des traitements, ainsi que la comparaison entre les différents fonds génétiques qui affectent l'angiogénèse. Un enquêteur qualifié après avoir pratiqué ce test peut implanter une pastille en moins de 5 minutes par œil.
Introduction
Le processus de l'angiogenèse, la formation de nouveaux vaisseaux sanguins se forment des préexistants, est très complexe et est régulée par plusieurs facteurs endogènes qui contrôlent les différentes étapes de la germination et de la morphogenèse de la cuve. L'angiogenèse est déclenchée en raison d'un changement dans l'équilibre entre les facteurs pro et anti-angiogéniques, un équilibre qui maintient normalement le système vasculaire dans un état de repos. L'angiogenèse se produit chez l'adulte dans certaines conditions physiologiques, tels que au cours du cycle ovarien femelle ou dans les processus de réparation tels que la cicatrisation des plaies et la régénération des tissus. Cependant, il est également une caractéristique de nombreuses pathologies, notamment les tumeurs malignes, les conditions auto-immunes et des maladies inflammatoires. L'implication de l'angiogenèse dans les conditions physiologiques et pathologiques, il est un important sujet de recherche et une cible intéressante pour une thérapie.
En raison de la complexité de l'angiogenèse et de l'implication de plusieurs CElls et les facteurs dans le processus, y compris les cellules endothéliales, les péricytes, cellules circulantes et les cellules stromales, des modèles in vitro restent limitées et ne peuvent pas récapituler le microenvironnement in vivo unique. Le principal des essais in vitro de l'angiogenèse sont en grande partie axées sur l'observation des effets directs sur les cellules endothéliales et de mesurer certaines étapes du processus angiogénique dans des conditions contrôlées. Ces analyses comprennent la quantification des cellules endothéliales prolifération une migration 2, la formation du réseau 3, formation du tube 4 et la germination de sphéroïdes 5. Modèles ex vivo, contrairement à celles in vitro, sont plus complexes et intégrer de multiples types de cellules des tissus, un exemple étant le test de l'anneau aortique 6. Néanmoins, comme d'autres systèmes, on ne peut pas capturer la contribution de cellules circulantes du stroma et des cellules endothéliales naturel que celui qui existe in vivo. Tentativespour étudier l'angiogenèse sous flux d'imiter la mise en vivo sont réalisés en utilisant des systèmes microfluidiques 7, mais même ces tests, bien que beaucoup sont améliorées, sont encore incapables de rendre compte de tous les compartiments existants in vivo.
En raison des limitations de l'in vitro et ex vivo de l'angiogenèse des modèles, des modèles in vivo restent les plus fiables de choix pour l'étude de l'angiogenèse. Des exemples de ces modèles comprennent l'implantation des chambres transparentes, des «fenêtres», qui permettent la visualisation des vaisseaux sanguins en croissance sous microscope 8, implants sous-cutanés injectables tels que matrigel et récipient formation dans les tissus normaux tels que l'oreille de la souris et la membrane chorio-allantoïde de poulet (CAM ). Cependant, l'un des modèles les plus acceptables et quantitatives in vivo l'angiogenèse est l'essai de micropoche de néovascularisation de la cornée est décrit ici, qui exploite le naturellement avasculairecornée comme un «écran» de visualiser et d'évaluer une nouvelle croissance angiogénique 9.
Nous décrivons ici le test de micropoche cornéen développé chez la souris. Initialement, le modèle a été utilisé pour mesurer des stimuli angiogéniques non spécifiques dans les cornées de lapin. Cela a été fait par introduction des morceaux de tumeur dans l'humeur aqueuse de la chambre antérieure de l'œil de lapin et de mesurer la néovascularisation induite par une tumeur 11.
Cependant, l'essai a été plus tard évolué pour étudier les effets de croissance spécifique des facteurs 10 de mieux préciser et normaliser l'effet angiogénique. Afin de libérer le facteur de croissance de l'œil, des granulés à libération lente contenant des quantités connues de facteurs de croissance angiogéniques ont été utilisés à la place des tissus. La disponibilité de protéines angiogéniques recombinants purifiés tels que bFGF ou VEGF a permis leur utilisation comme objectifs spécifiques de modulaters de l'angiogenèse 12. Dans un premier temps, le dosage étaitlargement utilisé chez les lapins, qui sont plus faciles à travailler en raison de leur taille, mais plus tard, le modèle a été traduit dans des souris; un modèle animal plus petit et moins coûteux. Le passage de lapin à la souris fournit un avantage important d'être en mesure d'utiliser des animaux génétiquement modifiés, créant ainsi un nouveau domaine de recherche sur les composantes génétiques qui influent angiogenèse 13. En plus de l'utilisation plus acceptable de dosage de cornée dans l'étude de l'angiogenèse, d'autres processus biologiques peuvent également être étudiées en utilisant des tests modifiés. Par exemple, des études de la lymphangiogenèse ont été rendues possibles grâce à l'implantation de pastilles à faible dose bFGF qui a permis la visualisation des vaisseaux lymphatiques par marqueurs moléculaires spécifiques 14. En outre, cet essai a fourni un moyen pour évaluer les effets du rayonnement sur l'angiogenèse 15.
En résumé, l'analyse de l'angiogenèse de la cornée micropoche est une quantitative, représentantroducible, évaluation souple de l'angiogenèse in vivo. Un avantage majeur de cette analyse est que le jaugeage des bateaux de fond n'est pas nécessaire parce que les vaisseaux se développent sur un tissu naturellement avasculaire. Nous décrivons ici le protocole de cet essai dans les détails et discuter de différents scénarios qui peuvent se produire. Le test se compose de 3 segments distincts. Ici, nous allons décrire la préparation de pastilles de facteur compris la croissance, l'implantation chirurgicale ultérieure, et finalement la méthode utilisée pour quantifier la croissance néovasculaire résultant.
Protocole
Tous les protocoles impliquant des animaux sont présentés et approuvés par le Comité de protection des animaux dans les institutions et l'utilisation de l'Hôpital pour enfants de Boston et sont menées en conformité avec les recommandations de l'Association pour l'évaluation et l'accréditation des laboratoires de protection des animaux (AAALAC). Veillez à utiliser des instruments stériles et techniqure aseptique lors de l'exécution de la procédure.
1 Préparation de Pellets
- Peser 10 mg de sucralfate et 60 mg de hydron avec la spatule déplié stérile. Placez-les dans des microtubes séparés.
- Placez un carré de 1 cm de maille dans une boîte de 10 cm stérile. Inverser si maillage repose sur le couvercle peu profond. Mettez de côté.
- Ajouter 500 pi d'éthanol à la hydron et vortex pendant au moins 10 min.
- Ajouter la quantité appropriée du facteur de croissance (standard: 20 pg de bFGF, 50 pg de VEGF) au sucralfate et vortex brièvement. facteur de croissance de magasin dans unCongélateur -80 ° C à une concentration de 1 mg / ml. Volumes ajoutés liquides doivent avoir un minimum de 20 pi pour assurer le sucralfate est complètement imbibé, mais ne doivent pas dépasser 50 pi. Plus grand volume rend l'évaporation du liquide dans l'étape suivante difficile.
- Placer le mélange de sucralfate dans l'évaporateur centrifuge attachée bas jusqu'à ce que le mélange soit complètement sec, normalement 30-50 min en fonction du volume de liquide utilisé.
- Vérifier le mélange de l'humidité résiduelle avec l'extrémité conique d'une spatule stérile. Le mélange doit se sentir "croquant".
- Utiliser l'extrémité effilée de la spatule pour disperser le mélange de sucralfate dans le tube.
- Ajouter 10 ul de la hydron au sucralfate.
- En raison de la nature visqueuse de hydron, couper l'extrémité d'une pointe de pipette 200 pi, puis tirer et libérer les 10 pi avant pipetage à nouveau et ajouter à sucralfate.
- Utiliser rapidement naissain pliéula de mélanger la hydron et sucralfate et de retirer de tube.
- Recueillir le mélange le long du côté inférieur de la pointe de la spatule et ensuite pliée faire tourner le tube en tirant sur la spatule le long de la paroi du tube. Le mélange va sécher rapidement si cette étape doit être fait efficacement.
- Étendre le mélange sur le maillage préparé en utilisant une pince pour le maintenir en place. Le mélange doit être une couche régulière et introduire dans les trous de la maille.
- Plonger la spatule coudée dans le tube contenant hydron et utiliser l'enrober de la maille.
- Placez la maille enduit se penchant sur le côté contre le bord du plat et laisser sécher à température ambiante pendant 30-45 min.
- Placer la grille dans -20 ° C congélateur ou procéder immédiatement à l'étape suivante. Gardez maillage à l'intérieur plat.
- Placez la boîte de 35 mm à l'intérieur de la boîte de Pétri plus grande, couvercle. Utilisez la pince pour tirer délicatement les fibres du maillage à part sur la boîte de 35 mm. Granulés errants cun être collectées à partir de la plus grande plat à la fin.
- Vérifiez pastilles d'uniformité dans la portée. Le procédé permet d'obtenir environ 250 pastilles ainsi la dose standard par pastille pour bFGF et VEGF est de 80 ng et 200 ng, respectivement.
- Rangez les granules en boîte de 35 mm à -20 ° C congélateur jusqu'à 3 mois.
2. implantation chirurgicale de Pellets
- Mettre en place une zone chirurgicale sous microscope opératoire.
- Anesthésier la souris avec Avertin (400-500 mg / kg, par voie intrapéritonéale) et placez la souris au microscope afin œil est visible. Effectuer pincement de l'orteil pour assurer un niveau suffisant de l'anesthésie.
- Anesthésier l'oeil de la souris en plaçant une goutte de solution de proparacaïne sommet globe oculaire. Attendez 20-30 secondes et tamponner avec un tampon de gaze.
- Proptose l'œil de la souris avec le # 1 émoussé bijoutiers forceps étant certain de laisser la peau entre les pinces et les yeux. Il est important d'évaluer la pression appliquée correctement.60; Tenir l'œil trop fermement va l'amener à devenir rouge et irritée, mais trop de laxisme attente permettra œil de se déplacer pendant la chirurgie.
- Utilisez le 30 ° microknife de faire une incision dans la cornée environ 1 mm du limbe. L'incision doit être de 1 à 2 mm de longueur. L'incision doit être suffisamment profond pour pénétrer au-delà de la couche épithéliale dans midstroma mais pas si profonde à la rupture de l'oeil.
- Utilisez le couteau von Graef à faire une poche perpendiculaire à l'incision.
- Faites glisser le couteau sous la couche cornée au site d'incision et de travailler en douceur couteau et de se déplacer le long de l'incision pour agrandir l'espace, formant ainsi la poche. Il permet de déplacer la souris ainsi être en mesure de travailler avec la courbure de l'œil. Attention à ne pas pousser vers le bas avec la pointe pour éviter une rupture de l'œil.
- Mouiller les pinces de la n ° 5 bijoutier avec proparacaïne et prendre une pastille sortir du plat. Placez une pastille sur l'œil.
- Humidifiez le couteau von Graef avec proparacaïne et transférer une partie de liquide sur culot de le faire caoutchouteuse et souple. Retirer l'excès d'humidité avec un tampon de gaze ou un coton-tige.
- Insérez le culot dans la poche à l'aide du couteau von Graef à pousser à l'intérieur au-dessous de la couche cornée. Une fois que tout le culot est à l'intérieur, exécutez le côté plat du couteau von Graef sur site pour vérifier que la pastille est sécurisé.
- Manteau de l'œil avec de l'huile triple antibiotique.
- Retournez la souris et répétez la chirurgie de l'œil opposé.
3 Quantification de néovascularisation cornéenne.
Laissez les animaux de développer les navires sur une période de temps définie. Le jour de navire classement dépend de facteurs de croissance utilisé. Année bFGF au jour 5 et le VEGF faible à J6 Le jour de l'implantation est le jour 0.
- Anesthésier la souris avec Avertin (400-500 mg / kg, par voie intrapéritonéale).
- Utilisation du microscope à lampe à fente pour grading. On a un réticule oculaire, des lignes à l'intérieur de l'oculaire utilisé comme auxiliaire de mesure pour quantifier la longueur du bateau et de la distance autour de la circonférence de l'oeil que les récipients ont germé.
- Maintenez la souris en face de portée, en positionnant la souris afin œil est vu dans oculaire avec culot directement en avant. Stabiliser la tête entre le pouce et l'index pour une peau est serré sur le visage et les yeux légèrement proptosed.
- Placer l'axe des y du réticule le long du navire juste au-dessous du limbe pastille. Mesurer la longueur des navires de branchement vers le haut vers pastilles. Noter cette mesure en dixièmes de millimètres et désigner la longueur de la cuve (VL) (Figure 1A).
- Mettez la souris ou le réticule de sorte que la distance autour de l'œil que ces navires ont germé devient clair. Il est plus facile de penser à l'œil comme une horloge avec des intervalles de 1 à 12 Désigner ce numéro heure d'horloge (CH) (Figure 1B). Il peut s'agir d'un nombre ou de fractions de 0,25 (par exemple, 2, 2,25, 2,5 ou 2,75) ensemble. Remarque: CH est subjective. Par exemple, certains peuvent mesurer la distance autour de l'œil à tous les navires germées à partir du limbe tandis que d'autres peuvent arrêter la mesure à l'endroit où la longueur du navire est la moitié maximale. Le facteur important est d'être cohérent avec la façon dont on choisit de qualité.
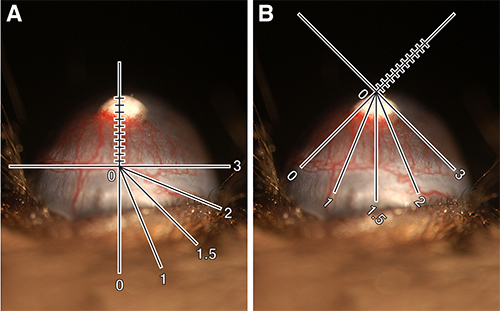
Figure 1: Quantification de la néovascularisation de la cornée. (A) 80 ng bFGF culot implanté dans C57BL / 6J montrant la lampe à fente réticule orienté pour mesurer la longueur du navire. VL = 0,9 mm. (B) Même démontrant des yeux lampe à fente réticule rotation pour mesurer heure d'horloge. CH = 3,25. Calculé zone de la cuve = 1,84 mm 2. Ces images ont été digitalement augmentée pour permettre l'ajout de schématique réticule. Cliquez ici pour agrandir l'image.
- Calculez la surface de la cuve (VA) en utilisant la formule ci-dessous, qui est basé sur la zone d'un ovale (Note, il est utile de garder cela à l'esprit lors de la notation.) Express VA en millimètres carrés. La formule est la suivante:
Navire de longueur x Horloge heure x 0,2 π = zone de navire
Résultats
Des résultats typiques pour le bFGF et VEGF pastilles dans les basses angiogéniques C57BL / 6J normaux sont présentés dans la figure 2A et B, respectivement. Figure 2E montre la distribution normale de la surface de la cuve (VA) dans la / souche 6J C57BL avec des doses variables de ceux-ci la croissance facteurs. 80 pastilles de bFGF ng entraînent normalement dans un VA d'environ 2,0 mm 2, si les valeurs dans une plage de 1,8-2,4 mm 2 sont...
Discussion
Il ya plusieurs étapes critiques dans la réalisation d'une analyse de la cornée réussie. La première consiste à créer des pastilles uniformes susceptibles d'être implanté et en stimulant les vaisseaux. Les parties les plus importantes de la préparation de granulés sont 1) en utilisant le facteur de croissance sans support; 2) assurer un bon mélange de facteur de croissance avec le sucralfate et hydron et 3) le déplacement du mélange final rapidement mais avec précaution du tube Eppendorf à la mai...
Déclarations de divulgation
Les auteurs n'ont rien à divulguer.
Remerciements
Nous remercions Kristin Johnson pour le travail graphique.
matériels
| Name | Company | Catalog Number | Comments |
| Section 1: Pellet preparation | |||
| Sucralfate | Sigma | #S0652 | |
| Hydron (aka Poly(2-Hema)) | Sigma | #P3932-10G | |
| Ethanol | Pharmco Products Inc | #111000200CSGL | |
| Growth factors: | Must be carrier-free (no bovine serum albumin(BSA)) | ||
| Fibroblast growth factor (FGF) | PeproTech | #AF-100-18B | |
| Vascular endothelial growth factor (VEGF) | R & D Systems | #293-VE-050/CF | |
| 35 mm dish | Becton-Dickson | #353001 | Used for storage of pellets |
| 10 cm petri dish | VWR | #25384-342 | Used as work surface for preparing pellets |
| Mesh | Sefar America | #03--300/51 | 300 um nitex nylon, cut into cm square pieces and sterilzed in autoclave |
| Spatulas | Fisher Scientific | #21-401-10 | Use tapered end of one to break up pellet mixture. Bend tapered end of other to help remove mixture from microcentrifuge tube. |
| Microcentrifuge tubes | Fisher Scientific | #05-408-146 | One for hydron, one for sucralfate |
| Jewelers forceps, #5 | Ambler Surgical | #2315E | Need 2 for pulling mesh apart |
| Centrifugal evaporator | ThermoSavant | DNA110 SpeedVac | |
| Section 2: Surgical implantation of pellets | |||
| Operating microscope | Zeiss | ||
| 2.5% Avertin | General anesthetic | ||
| Proparacaine hydrochloride ophthalmic solution 0.5% | Falcon | NDC# 6131401601 | Eye anesthetic |
| Triple Antibiotic Ophthalmic Ointment | Bausch & Lomb | NDC# 2420878055 | Contains neomycin, polymixin and bacitracin |
| Ophthalmic microknife, 5 mm | Surgistar | #924501 | 30 degree angle |
| von Graef knife | Ambler Surgical | #3401E | |
| Jewelers forceps, #1 | Ambler Surgical | #2301E | Must be blunted with sharpening stone for proptosing eye |
| Jewelers forceps, #5 | Ambler Surgical | #2305E | For picking up pellets and placing on eye |
| Small curved scissors | Ambler Surgical | #5636E | For trimming whiskers |
| Gauze | For blotting eye after proparacaine | ||
| Section 3: Grading of Corneal Neovascularization | |||
| 2.5% Avertin | General anesthetic | ||
| Slit lamp | Nikon | FS-2 | Needs an ocular with a reticule to assist in measuring |
Références
- Gospodarowicz, D., Moran, J., Braun, D., Birdwell, C. Clonal growth of bovine vascular endothelial cells: fibroblast growth factor as a survival agent. Proc. Natl. Acad. Sci. USA. 73, 4120-4124 (1976).
- Glaser, B. M., D'Amore, P. A., Seppa, H., Seppa, S., Schiffmann, E. Adult tissues contain chemoattractants for vascular endothelial cells. Nature. 288, 483-484 (1980).
- Kubota, Y., Kleinman, H. K., Martin, G. R., Lawley, T. J. Role of laminin and basement membrane in the morphological differentiation of human endothelial cells into capillary-like structures. J. Cell Biol. 107, 1589-1598 (1988).
- Montesano, R., Orci, L. Tumor-promoting phorbol esters induce angiogenesis in vitro. Cell. 42, 469-477 (1985).
- Korff, T., Augustin, H. G. Integration of endothelial cells in multicellular spheroids prevents apoptosis and induces differentiation. J. Cell Biol. 143, 1341-1352 (1998).
- Nicosia, R. F., Tchao, R., Leighton, J. Histotypic angiogenesis in vitro: light microscopic, ultrastructural, and radioautographic studies. In Vitro. 18, 538-549 (1982).
- Wong, K. H., Chan, J. M., Kamm, R. D., Tien, J. Microfluidic models of vascular functions. Annu Rev Biomed Eng. 14, 205-230 (2012).
- Sandison, J. C. A new method for the microscopic study of living growing tissues by the introduction of a transparent chamber in the rabbit's ear. Anat. Rec. 28, 281-287 (1924).
- Jain, R. K., Schlenger, K., Hockel, M., Yuan, F. Quantitative angiogenesis assays: progress and problems. Nat. Med. 3, 1203-1208 (1997).
- Rogers, M. S., Birsner, A. E., D'Amato, R. J. The mouse cornea micropocket angiogenesis assay. Nat. Protoc. 2 (10), 2545-2550 (2007).
- Gimbrone, M. A., Leapman, S. B., Cotran, R. S., Folkman, J. Tumor dormancy in vivo by prevention of neovascularization. J. Exp. Med. 136, 261-276 (1972).
- Gimbrone, M. A., Cotran, R. S., Leapman, S. B., Folkman, J. Tumor growth and neovascularization: an experimental model using the rabbit cornea. J. Natl. Cancer Inst. 52, 413-427 (1974).
- Rohan, R. M., Fernandez, A., Udagawa, T., Yuan, J., D'Amato, R. J. Genetic heterogeneity of angiogenesis in mice. FASEB J. 14 (7), 871-876 (2000).
- Chang, L. K., et al. Dose-dependent response of FGF-2 for lymphangiogenesis. Proc Natl Acad Sci U S A. 101 (32), 11658-11663 (2004).
- Udagawa, T., Birsner, A. E., Wood, M., D'Amato, R. J. Chronic suppression of angiogenesis following radiation exposure is independent of hematopoietic reconstitution. Cancer Res. 67 (5), 2040-2045 (2007).
- Turner, P. V., Albassam, M. A. Susceptibility of rats to corneal lesions after injectable anesthesia. Med Comp. 55 (2), 175-182 (2005).
- Calderone, L., Grimes, P., Shalev, M. Acute reversible cataract induced by xylazine and by ketamine-xylazine anesthesia in rats and mice. Exp. Eye Res. 42, 331-337 (1986).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon