A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تطوير جهاز 3D الجرافين الكهربائي Dielectrophoretic
In This Article
Summary
ويستخدم microdevice مع إمكانات إنتاجية عالية لإثبات ثلاثية الأبعاد (3D) dielectrophoresis (DEP) مع المواد الجديدة. الجرافين رقة nanoplatelet والشريط مزدوجة من جانب كانت مكدسة بالتناوب؛ تم حفر 700 ميكرون الصغيرة جيدا عرضية إلى طبقات. وقد تجلى السلوك DEP من الخرز البوليسترين في الدقيقة جيدا.
Abstract
يوصف تصميم وتصنيع و3D رواية القطب microdevice باستخدام 50 ميكرون ورقة الجرافين سميكة و 100 ميكرون الشريط مزدوجة من جانب. تفاصيل البروتوكول إجراءات لبناء تنوعا، قابلة لإعادة الاستخدام، وطبقة متعددة، وغرفة dielectrophoresis مغلفة. على وجه التحديد، وستة طبقات من 50 ميكرون العاشر 0.7 سم × 2 سم ورقة الجرافين وخمس طبقات من الشريط مزدوجة من جانب وبالتناوب مكدسة معا، ثم فرضت على شريحة زجاجية. ثم تم حفر 700 ميكرون القطر الصغير جيدا من خلال هيكل مغلفة باستخدام آلة الحفر الصغيرة التي تسيطر عليها الكمبيوتر. وأكد العازلة خصائص طبقة الشريط بين طبقات الجرافين المجاورة عن طريق اختبارات مقاومة. الفضة الايبوكسي موصل متصل طبقات بديلة من الورق الجرافين وشكلت اتصالات مستقرة بين ورقة الجرافين والخارجية أقطاب الأسلاك النحاسية. ثم فرضت الجهاز النهائي ومختومة إلى شريحة زجاجية. كان على غرار التدرج الحقل الكهربائي داخل رانه جهاز متعدد الطبقات. وقد أظهرت السلوكيات Dielectrophoretic من 6 ميكرومتر الخرز البوليسترين في 1 ملم العميق الصغرى جيدا، مع التوصيلات المتوسطة التي تتراوح بين 0.0001 S / م إلى 1.3 S / م، وتطبيقها ترددات إشارة من 100 هرتز إلى 10 ميجا هرتز. وقد لوحظت استجابات dielectrophoretic السلبية في ثلاثة أبعاد على معظم مساحة الموصلية التردد وعبر أكثر من القيم تردد تتسق مع القيم الأدب ذكرت سابقا. لم الجهاز لم يمنع AC electroosmosis والكهروحرارية التدفقات، التي وقعت في المناطق المنخفضة والعالية التردد، على التوالي. ورقة الجرافين المستخدمة في هذا الجهاز هي متعددة ويمكن أن يعمل لاحقا على أنها جهاز الاستشعار البيولوجي بعد الأوصاف dielectrophoretic كاملة.
Introduction
الجرافين هو مادة الرواية تشتهر خصائص عالية الجودة الإلكترونية والتطبيقات الكيميائية وجهاز الاستشعار البيولوجي المحتملة 1. وقد استخدمت nanoplatelets الجرافين للحصول على الدعم المحفز 2، 3، 4 أجهزة الاستشعار، المكثفات الفائقة-5، والأقطاب الكهربائية المركبة، بما في ذلك الجرافين / آنلين والمواد المركبة جسيمات متناهية الصغر السيليكون / الجرافين 6-8. توضح هذه المخطوطة الاستفادة من ورقة الجرافين كما أقطاب في فريدة ثلاثية الأبعاد (3D)، وجهاز ميكروفلويديك الطبقات. ومغلفة أقطاب رقة الجرافين مع ينسولاتيفي الشريط على الوجهين وغرفة حفر داخل التي كان يؤديها dielectrophoresis 3D AC من الخرز البوليسترين.
Dielectrophoresis (DEP) يشير إلى حركة الجزيئات قطوب ضمن الحقول الكهربائية غير موحدة. يحدث DEP إيجابية (pDEP) أو DEP السلبية (NDEP) عندما الجسيمات هي أكثر أو أقل من قطوب المحيطة المتوسطة، دورة الفتشوبlting في التحرك نحو أقوى أو أضعف المجال الكهربائي، على التوالي. وقد استخدمت هذه الأداة كهربي غير الخطية للانفصال، والفرز، ومحاصرة، وتحديد الجزيئات والخلايا البيولوجية 9-15. قوة dielectrophoretic التي يعاني منها الجسيمات المستقطبة هي وظيفة من التدرج الحقل الكهربائي، نصف قطرها الجسيمات والشكل، والجسيمات خصائص عازلة بما في ذلك الموصلية والسماحية، فضلا عن وسائل الإعلام والموصلية السماحية. في التقليدية ثنائية الأبعاد (2D) DEP، حركة الجسيمات الأولية في الطائرة من التدرج الحقل الكهربائي بين الأقطاب الكهربائية عادة شكلت سطح microfabricated؛ الحركة في الاتجاه الرأسي لا يكاد يذكر بالمقارنة مع الاتجاهات في الطائرة في معظم الأجهزة. ومع ذلك، وتسخير هذا البعد الثالث من التدرجات مجال كهربائي ل3D DEP يسمح للأعلى عينة الإنتاجية ويزيد من براعة تصميم فصل dielectrophoretic الجديدة والمحسنة التي تدفق هو TRAVERSE إلى الميدان التدرجات 16، 17. وتشمل تصاميم محددة أخرى 3D القائم على عازل DEP 18، 3D الكربون القطب DEP 13، 19، و 3D الكهربائي DEP 10. كما يتضح من البحث في هياكل 3D، مثل هذه الأجهزة يمكن أن تعمل في وضع التدفق المستمر لتحقيق أعلى الانتاجية. ويتحقق رصد حركة الجسيمات 3D في الجهاز لدينا 3D الطبقات بوصفها وظيفة من وتيرة والموصلية المتوسطة عبر المجهر الضوئي على ارتفاعات مختلفة التنسيق.
Fatoyinbo وآخرون. ذكرت أول DEP في 3D مغلفة هيكل القطب / العزل باستخدام مكدسة بدلا من 30 ميكرون رقائق الألومنيوم و 150 ميكرومتر الايبوكسي الأفلام الراتنج 20. هوبنر آخرون. ثم تصميم أقطاب مماثلة مغلفة 3D مع 35 ميكرون الشريط النحاس و 118 ميكرومتر بوليميد لاصق 21. هذا العمل يستعير تصميم 3D جيدا 22، 23، ويستخدم فريد راحة 50 ميكرون ورقة الجرافين كما طبقات وإجراء 100 ميكرون الشريط على الوجهين كما الطبقات العازلة، التي حققت الختم والتدريع الكهربائية كافية. الجرافين رقة براعة هو ميزة واضحة عن الأجهزة بالغة الصغر القطب 3D لأن nanoplatelets الجرافين لديها القدرة على العمل في وقت واحد كما أجهزة الاستشعار، والتي أثبتت هذه المجموعة سابقا 24.
التدرجات مجال تحقيق داخل الجرافين ورقة / البوليمر مغلفة الأجهزة بالغة الصغر 3D تعتمد على الأبعاد الصغيرة بشكل جيد، ورقة الجرافين طبقات، وتطبيق الحقل الكهربائي. وتشمل أبعاد حرجة التباعد العمودي الكهربائي (إجراء والعزل سمك طبقة) وقطرها الصغير بشكل جيد وارتفاع (يحددها طبقات مكدسة). يمكن ضبطها إشارة كهربائية عبر السعة والتردد. هيكل الجهاز الحالي هو لتشغيل الدفعة، ولكن يمكن أن يكون متلائما مع جهاز التدفق المستمر. القوات المسلحة البوروندية الجهازتقنية rication الموصوفة هنا هو مناسبة لتطوير مغلفة 3D الأقطاب مع مجموعة واسعة من خصائص الجرافين nanoplatelet ببساطة عن طريق تبادل ورقة الجرافين المستخدمة. مزايا استخدام ورقة الجرافين هي براعة من الخصائص الفيزيائية والكيميائية، وخفض النفقات، ويمكن أن تتصرف بشكل متزامن nanoplatelets الجرافين كما أجهزة الاستشعار للكشف عن مجموعة واسعة من bioanalytes 24. أهداف طويلة الأجل لنظم DEP 3D إنتاجية عالية في تحديد أنواع الخلايا بسرعة 25-27، أو تحقيق خالية من التسمية، بوساطة كهربائيا الفرز خلية من الخلايا المريضة من السكان من الخلايا السليمة 28. يوضح هذه الورقة التحسين المادي وإعداد وتشغيل الجهاز تليها التوضيح وتحليل نتائج نموذجية.
Protocol
1. افتعال هيكل 3D اللاصق الكهربائي / العزل
- للطبقة 6 الجرافين،، وقطع 5 جهاز طبقة ورقة الشريط الجرافين مع مشرط أو شفرة حلاقة مماثلة والحاكم وارتفع الثابت إلى ست 0.7 سم × 1.5 سم المستطيلات واستخدام مقص لقطع الشريط الحساس للضغط على الوجهين إلى خمس 1.3 سم س ~ 5 سم المشارب.
ملاحظة: كما هو مبين في الشكل 1A، وهذا ينتج الكهربائي 3 الأرض، 3 AC إشارة الجهاز الكهربائي. 7 ملم إجراء عرض طبقة ضيقة بما يكفي لتناسب على شريحة زجاجية، ولكن واسعة بما يكفي لسهولة الحفر. طول 2 ملم لا كسر بسهولة عند الاستخدام المتكرر ولديه مساحة كافية لنعلق أسلاك النحاس. عمق الجهاز يقتصر بواسطة أعماق نهاية مطحنة. - وضع الطبقة الأولى من ورقة الجرافين على شريحة زجاجية نظيفة. تغطية ببطء واحدة من نهاية ورقة الجرافين مع شريط واحد من الشريط، وترك هامش مم ~ 2 لضمان العزل بين اثنين من الجرافين المجاورة طبقات الورق (الشكل 1B ).
- وضع الطبقة الثانية من ورقة الجرافين على الجزء العلوي من الشريط الإزاحة إلى الطبقة الأولى من ورقة الجرافين (الشكل 1A). الضغط المعتدل (اضغط بشكل موحد مع الإبهام، ~ 100 N أكثر من 0.7 سم 2 مساحة) بعد إضافة كل طبقة إجراء لضمان حسن الختم بين الطبقات.
- كرر الخطوات من 1.2 و 1.3 للطبقات المتبقية، وترك كل من أعلى وأسفل طبقات ورقة الجرافين. قطع على طول الخط المنقط هو مبين في الشكل 1B لإزالة الشريط الزائدة من حواف الجهاز وترك الصغيرة ~ 1 ملم الهامش لضمان عزل مختومة بين الجرافين طبقات الورق (الشكل 1B).
ملاحظة: لا يستخدم الشريط على الوجهين مثل أعلى وأسفل طبقات لتجنب جمع الحطام لأن هذا الهيكل مغلفة يتم حفرها، التي شنت على شريحة، ومليئة العينة. - إجراء العزل اختبار سريع مع المتعدد (وضع المقاومة). ضع تحقيقات الإيجابية والسلبية على الجانبين مختلفة من الجهاز البريد (A و B على الشكل 1C)؛ مقاومة عالية (كيلو لميجا أوم) تشير العزل الجيد بين الطبقات. إزالة بنية الطبقات من شريحة زجاجية للتحضير لجيدا الصغرى الحفر.
ملاحظة: فشل الجهاز عادة اختبار العزل عندما المتاخمة الجرافين طبقات الورق اجراء اتصالات خلال الخطوات 1.2 خلال 1.4. تجاهل مثل هذه الأجهزة.
2. حفر مايكرو جيدا في بنية مغلفة
- استخدام آلة ميكانيكية طحن الصغرى الكمبيوتر التي تسيطر عليها واختيار نهاية مطحنة مع ميكرون في القطر 700 مم طول و 2.1 من الخفض. شل بنية مغلفة على المسرح الصغير الطحن باستخدام المشابك المناسب (أرقام 2A و ب). تشغيل آلة المغزل طحن في 8،600 دورة في الدقيقة، ثم خفض مطحنة نهاية ببطء إلى وعبر مركز بنية مغلفة. تحريك طاحونة نهاية الدورية صعودا وهبوطا من خلال جيدا الدقيقة لضمان سلاسة الجدار في الداخل.
- اختيار جيد الصغرىبأقطار، التي يعيقها المتاحة مطحنة نهاية قطرها / طول نسب خفض الجانب. تأكد من أن السطح الداخلي للبئر الصغيرة كما الرأسي ونظيفة ممكن لالتدرجات الحقل الكهربائي الأمثل ومرور الضوء من خلال الصغرى أيضا.
- الحطام نظيفة من بئر صغيرة مع الهواء المضغوط. أداء اختبار العزل آخر كما هو موضح في 1.5.
3. إرفاق الشراء الكهربائية لبنية مغلفة
- شقين 3 سم طويلة 32 G الأسلاك النحاسية إلى الزاوية اليمنى في 2 سم. مزيج ~ 1.5 مل من الجزء ألف وباء من الفضة الايبوكسي موصل.
ملاحظة: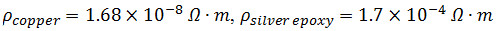
- تطبيق يدويا مختلطة الفضة الايبوكسي إلى الأعلى ونصائح من كل 3 طبقات الجرافين ورقة لضمان اتصال جيد بين طبقات على جانب ألف من بنية مغلفة (الشكل 1C)، ثم ضع 1 سم نهاية الأسلاك النحاسية في الايبوكسي وبين أي اثنين طبقات. مربع بهدوءueeze طبقات لإزالة الايبوكسي الزائدة وضمان الاتصال الكهربائية جيدة. تكرار لالجانب باء من هيكل مغلفة.
- وضع الجهاز كله في رف الفرن، لتجف بين عشية وضحاها في 70 درجة مئوية و 1 أجهزة الصراف الآلي.
4. إعداد عينة وسائل الإعلام
- إعداد وسائل الاعلام متساوي التوتر من طائفة من التوصيلات باستخدام متر الموصلية، 290 ملي حل الأسهم مانيتول والإضافات مسلسل متساوي التوتر المالحة العازلة الفوسفات (PBS).
ملاحظة: هناك علاقة خطية بين الموصلية وحجم تركيز ~ 290 الميلي أسمول / L PBS (إجراء) في الميلي أسمول ~ 290 / L مانيتول الحل (غير موصلة). ميزات الفيديو وسيلة لل0.01 S / م الموصلية. - مزج الخرز البوليسترين مع وسائل الإعلام مستعدة الموصلية أو المياه النقية ه (~ 5 × 10 -6 S / م) ل1:50 المجلد: نسبة المجلد. هذا البروتوكول هو قابل للتكيف بسهولة إلى الخلايا البيولوجية كذلك.
5. تجربة إعداد وتشغيل الأجهزة
- المشبك س الجهازn لشريحة زجاجية مع ضغط معتدل (الشكل 2D) باستخدام المشابك ورقة تعديل أو ما يعادلها. يجب أن تكون قريبة بما فيه الكفاية المواطئ إلى جيدا الجزئي لختم هيكل مغلفة إلى شريحة زجاجية منع تسرب العينة. المشبك وينبغي أن تندرج ضمن المرحلة المجهر مع الضغط الأمثل لأ) منع تشوه هيكل مغلفة، وب) ضمان عدم تسرب السائل الصغيرة أيضا. تشوه يغير الهندسة جيدا ومسار الضوء الحد استنساخ التجربة.
- باستخدام حقنة صغيرة أو ما يعادلها، وضخ ببطء ~ 1 ميكرولتر من العينة في الدقيقة جيدا وتجنب إدخال أي فقاعات. تكرار الحقن إذا لزم الأمر، واستخدام الحرص على عدم تلف الجدران الصغيرة بشكل جيد مع إبرة حادة. قليلا يفيض جيدا الجزئي والانزلاق على الفور غطاء زجاجي فوق جيدا الدقيقة لإزالة السوائل الزائدة، ومنع التبخر، وضمان كميات استنساخه لكل تجربة.
ملاحظة: هناك معلومات الماس glasscutter يعمل بشكل جيد لSCORه والكراك غطاء زجاجي لحجم. - تأمين microdevice مغلفة الانتهاء إلى مرحلة المجهر ونعلق الأسلاك الكهربائي وظيفة مولد لاثنين من النحاس يؤدي على الجهاز. في AxioVision (البرمجيات زايس)، انقر على زر لبدء تسجيل الكاميرا في طريقة اكتساب متعددة الأبعاد. بدء وظيفة مولد إشارة في فترة زمنية محددة بعد بدء تسجيل كاميرا CCD لتوثيق الاستجابات مع وبدون تطبيق الحقل الكهربائي.
ملاحظة: هنا 100 هرتز إلى 10 ميغاهيرتز مع 15 V ذروة الذروة إشارة طبقت ووحظت التجارب في 10X التكبير في 1-200 فوق سطح شريحة زجاجية لمدة 2 ثانية دون الميدانية و~ 5 دقائق مع مجال تطبيقها. تم حفظ الصور رقميا في 1-5 إطارات في الثانية (في الثانية) لمزيد من التحليل. - عند الانتهاء التجربة، إزالة الجهاز وتفكيك المشابك. تزج كل من شريحة زجاجية والجهاز في الماء والصابون، ثم يشطف جيدا. أجهزة إعادة استخدام حوالي 30 مرةو مع أداء ثابت.
6. تحليل البيانات ومعالجة الصور
- تحليل بيانات الصور مع برنامج المفضل، مثل يماغيج. حساب سرعة الجسيمات من النزوح بين الصور التوالي في خطوة وقت معين.
- حساب تجريبي القوة DEP والميدانية القائمة على القوة والسرعة لتجميع الاتجاهات ومقارنتها مع نظرية 29.
- قياس سرعة الجسيمات شعاعيا في الهندسة الدقيقة جيدا بما يتفق مع شكل التدرج الحقل الكهربائي. من الحافة الصغيرة جيدا إلى مركز، وتحديد 8 معالم مركزية تساوي الكهربية (350، 300، ... 50، 0 ميكرون)، والذي ينتج في 7 مناطق.
ملاحظة: الوقت للجسيمات لاجتياز تم استخدام مسافة 50 ميكرومتر لحساب السرعة. عندما استدعى الاختلافات هندسية ذلك، تم تعديل ملامح كهرساوي قليلا.
النتائج
وأجريت التجارب على Dielectrophoretic 6 حبات البوليستيرين ميكرومتر في 0.38 مم 3 اسطوانية صغيرة أيضا. تثبت النتائج أن 3D مغلفة الجهاز الورقية الجرافين يمكن أن توضح التوقيعات dielectrophoretic مماثلة لأجهزة احباط 3D معدنية مغلفة 20، 21، التقليدية 2D معدنية القطب 26 و 27، والأجه...
Discussion
هذه المخطوطة تفاصيل بروتوكولات لافتعال طبقة الجرافين الرواية 6 و 5 طبقة الشريط microdevice. أبعد من ذلك، ويتضح تشغيل الجهاز عن طريق السلوكيات المرصودة DEP من 6.08 ميكرومتر الخرز البوليسترين جنبا إلى جنب مع نهج تحليل الجسيمات سرعة فريدة من نوعها، ذات الصلة هندسيا. هذا النهج تن?...
Disclosures
والكتاب ليس لديهم الصراعات في الكشف عنها.
Acknowledgements
بفضل العلوم XG لالتبرعات السخية من ورقة الجرافين. بفضل الدكتور جيم فريدريش على السماح لنا بسخاء استخدام معدات الحفر الصغيرة. ويمتد شكر خاص لTayloria آدمز لسرد الفيديو.
Materials
| Name | Company | Catalog Number | Comments |
| Polystyrene Beads | Spherotech, Inc. | PP-60-10 | 6.08 μm diameter |
| Graphene paper | XG Sciences, Inc. | XG Leaf B-072 | |
| Double sided tape | 3M | N/A | 136 office tape |
| Silver conductive epoxy | MG chemicals | 8331-14G | Part A & B included |
| Mannitol | Sigma Aldrich | 091M0020V | |
| Phosphate buffer saline | OmniPur | 0381C490 | |
| Microscope (CCD Camera) | Zeiss | Axiovert 200M | |
| Function/waveform generator | Agilent | 33250A | |
| Syringe | Hamilton | 84505 | |
| Paper Clamp | ADAMS | 3300-50-3848 | |
| Oven | Fisher Scientific | 280A | |
| Multimeter | OMEGA | HHM25 | |
| Micro-milling machine | AEROTECH | ABL1500 stages/A3200 Npaq controller | |
| End mill | ULTRATOOL | 708473 | |
| AxioVision | Zeiss | Version 4.8 |
References
- Geim, A. K., Novoselov, K. S. The rise of graphene. Nature Materials. 6 (3), 183-191 (2007).
- Jafri, R. I., Rajalakshmi, N., Ramaprabhu, S. Nitrogen doped graphene nanoplatelets as catalyst support for oxygen reduction reaction in proton exchange membrane fuel cell. Journal of Materials Chemistry. 20 (34), 7114-7117 (2010).
- Kavan, L., Yum, J. H., Gratzel, M. Graphene Nanoplatelets Outperforming Platinum as the Electrocatalyst in Co-Bipyridine-Mediated Dye-Sensitized Solar Cells. Nano Letters. 11 (12), 5501-5506 (2011).
- Aravind, S. S. J., Baby, A. T. T., Arockiadoss, T., Rakhi, R. B., Ramaprabhu, S. A cholesterol biosensor based on gold nanoparticles decorated functionalized graphene nanoplatelets. Thin Solid Films. 519 (16), 5667-5672 (2011).
- Si, P., Ding, S. J., Lou, X. W., Kim, D. H. An electrochemically formed three-dimensional structure of polypyrrole/graphene nanoplatelets for high-performance supercapacitors. Rsc Advances. 1 (7), 1271-1278 (2011).
- Wang, D. -. W., et al. Fabrication of Graphene/Polyaniline Composite Paper via In Situ Anodic Electropolymerization for High-Performance Flexible Electrode. ACS Nano. 3 (7), 1745-1752 (2009).
- Lee, J. K., Smith, K. B., Hayner, C. M., Kung, H. H. Silicon nanoparticles-graphene paper composites for Li ion battery anodes. Chem Commun (Camb). 46 (12), 2025-2027 (2010).
- Kavan, L., Yum, J. H., Gratzel, M. Optically Transparent Cathode for Dye-Sensitized Solar Cells Based on Graphene Nanoplatelets. ACS Nano. 5 (1), 165-172 (2011).
- Martinez-Duarte, R. Microfabrication technologies in dielectrophoresis applications--a review. Electrophoresis. 33 (21), 3110-3132 (2012).
- Yamamoto, M., et al. Patterning with particles using three-dimensional interdigitated array electrodes with negative dielectrophoresis and its application to simple immunosensing. Electrochimica Acta. 82, 35-42 (2012).
- Doh, I., Kim, Y., Cho, Y. H. A particle trapping chip using the wide and uniform slit formed by a deformable membrane with air bubble plugs. Current Applied Physics. 13 (5), 902-906 (2013).
- Lin, S. C., Lu, J. C., Sung, Y. L., Lin, C. T., Tung, Y. C. A low sample volume particle separation device with electrokinetic pumping based on circular travelling-wave electroosmosis. Lab on a Chip. 13 (15), 3082-3089 (2013).
- Martinez-Duarte, R., Camacho-Alanis, F., Renaud, P., Ros, A. Dielectrophoresis of lambda-DNA using 3D carbon electrodes. Electrophoresis. 34 (7), 1113-1122 (2013).
- Yang, S. M., Tseng, S. Y., Chen, H. P., Hsu, L., Liu, C. H. Cell patterning via diffraction-induced optoelectronic dielectrophoresis force on an organic photoconductive chip. Lab on a Chip. 13 (19), 3893-3902 (2013).
- Srivastava, S. K., Gencoglu, A., Minerick, A. R. DC insulator dielectrophoretic applications in microdevice technology: a review. Anal Bioanal Chem. 399 (1), 301-321 (2011).
- Liao, S. H., Cheng, I. F., Chang, H. C. Precisely sized separation of multiple particles based on the dielectrophoresis gradient in the z-direction. Microfluidics and Nanofluidics. 12 (1-4), 1-4 (2012).
- Bajaj, P., Marchwiany, D., Duarte, C., Bashir, R. Patterned three-dimensional encapsulation of embryonic stem cells using dielectrophoresis and stereolithography. Adv Healthc Mater. 2 (3), 450-458 (2013).
- Braff, W. A., Pignier, A., Buie, C. R. High sensitivity three-dimensional insulator-based dielectrophoresis. Lab Chip. 12 (7), 1327-1331 (2012).
- Martinez-Duarte, R., Gorkin 3rd, R. A., Abi-Samra, K., Madou, M. J. The integration of 3D carbon-electrode dielectrophoresis on a CD-like centrifugal microfluidic platform. Lab Chip. 10 (8), 1030-1043 (2010).
- Fatoyinbo, H. O., Kamchis, D., Whattingham, R., Ogin, S. L., Hughes, M. P. A high-throughput 3-D composite dielectrophoretic separator. Ieee Transactions on Biomedical Engineering. 52 (7), 1347-1349 (2005).
- Hubner, Y., Hoettges, K. F., Kass, G. E. N., Ogin, S. L., Hughes, M. P. Parallel measurements of drug actions on Erythrocytes by dielectrophoresis, using a three-dimensional electrode design. Iee Proceedings-Nanobiotechnology. 152 (4), 150-154 (2005).
- Abdul Razak, M. A., Hoettges, K. F., Fatoyinbo, H. O., Labeed, F. H., Hughes, M. P. Efficient dielectrophoretic cell enrichment using a dielectrophoresis-well based system. Biomicrofluidics. 7 (6), (2013).
- Hughes, M. P. . O. S., Hoettges, K. F., Wattingham, R. . Device for Dielectrophoretic Manipulation of Particles. , (2005).
- Heldt, C. L., et al. Stacked graphene nanoplatelet paper sensor for protein detection. . Sensors and Actuators B-Chemica. 181, 92-98 (2013).
- Srivastava, S. K., Artemiou, A., Minerick, A. R. Direct current insulator-based dielectrophoretic characterization of erythrocytes: ABO-Rh human blood typing. Electrophoresis. 32 (18), 2530-2540 (2011).
- Leonard, K. M., Minerick, A. R. Explorations of ABO-Rh antigen expressions on erythrocyte dielectrophoresis: Changes in cross-over frequency. Electrophoresis. 32 (18), 2512-2522 (2011).
- Srivastava, S. K., Daggolu, P. R., Burgess, S. C., Minerick, A. R. Dielectrophoretic characterization of erythrocytes: Positive ABO blood types. Electrophoresis. 29 (24), 5033-5046 (2008).
- Minerick, A. R. The rapidly growing field of micro and nanotechnology to measure living cells. AIChE Journal. 54 (9), 2230-2237 (2008).
- Garza-Garcia, L. D., Perez-Gonzalez, V. H., Perez-Sanchez, O. A., Lapizco-Encinas, B. H. Electrokinetic Mobilities Characterization and Rapid Detection of Microorganisms in Glass Microchannels. Chemical Engineering & Technology. 34 (3), 371-378 (2011).
- Lopez-de la Fuente, M. S., et al. An electric stimulation system for electrokinetic particle manipulation in microfluidic devices. Rev Sci Instrum. 84 (3), (2013).
- Chen, D. F., Du, H., Li, W. H. A 3D paired microelectrode array for accumulation and separation of microparticles. Journal of Micromechanics and Microengineering. 16 (7), 1162-1169 (2006).
- Chu, H., Doh, I., Cho, Y. H. A three-dimensional (3D) particle focusing channel using the positive dielectrophoresis (pDEP) guided by a dielectric structure between two planar electrodes. Lab on a Chip. 9 (5), 686-691 (2009).
- Millet, L. J., Park, K., Watkins, N. N., Hsia, K. J., Bashir, R. Separating beads and cells in multi-channel microfluidic devices using dielectrophoresis and laminar flow. J Vis Exp. , (2011).
- Weiss, N. G., et al. Dielectrophoretic mobility determination in DC insulator-based dielectrophoresis. Electrophoresis. 32 (17), 2292-2297 (2011).
- Auerswald, J., Knapp, H. F. Quantitative assessment of dielectrophoresis as a micro fluidic retention and separation technique for beads and human blood erythrocytes. Microelectronic Engineering. 67-8, 879-886 (2003).
- Park, S., Zhang, Y., Wang, T. H., Yang, S. Continuous dielectrophoretic bacterial separation and concentration from physiological media of high conductivity. Lab on a Chip. 11 (17), 2893-2900 (2011).
- Sun, T., Holmes, D., Gawad, S., Green, N. G., Morgan, H. High speed multi-frequency impedance analysis of single particles in a microfluidic cytometer using maximum length sequences. Lab on a Chip. 7 (8), 1034-1040 (2007).
- Hughes, M. P., Morgan, H. Dielectrophoretic Characterization and Separation of Antibody-Coated Submicrometer Latex Spheres. Analytical Chemistry. 71 (16), 3441-3445 (1999).
- Liang, W. F., et al. Simultaneous separation and concentration of micro- and nano-particles by optically induced electrokinetics. Sensors and Actuators a-Physical. 193, 103-111 (2013).
- White, C. M., Holland, L. A., Famouri, P. Application of capillary electrophoresis to predict crossover frequency of polystyrene particles in dielectrophoresis. Electrophoresis. 31 (15), 2664-2671 (2010).
- Wu, J., Ben, Y. X., Battigelli, D., Chang, H. C. Long-range AC electroosmotic trapping and detection of bioparticles. Industrial & Engineering Chemistry Research. 44 (8), 2815-2822 (2005).
- Zhou, H., White, L. R., Tilton, R. D. Lateral separation of colloids or cells by dielectrophoresis augmented by AC electroosmosis. J Colloid Interface Sci. 285 (1), 179-191 (2005).
- Green, N. G., Ramos, A., Gonzalez, A., Morgan, H., Castellanos, A. Fluid flow induced by nonuniform ac electric fields in electrolytes on microelectrodes I. Experimental measurements. Phys Rev E Stat Phys Plasmas Fluids Relat Interdiscip Topics. 61 (4 Pt B), 4011-4018 (2000).
- Green, N. G., Ramos, A., Gonzalez, A., Castellanos, A., Morgan, H. Electrothermally induced fluid flow on microelectrodes. Journal of Electrostatics. 53 (2), 71-87 (2001).
- Gonzalez, A., Ramos, A., Morgan, H., Green, N. G., Castellanos, A. Electrothermal flows generated by alternating and rotating electric fields in microsystems. Journal of Fluid Mechanics. 564, 415-433 (2006).
- Park, S., Koklu, M., Beskok, A. Particle trapping in high-conductivity media with electrothermally enhanced negative dielectrophoresis. Anal Chem. 81 (6), 2303-2310 (2009).
- Sin, M. L., Gau, V., Liao, J. C., Wong, P. K. Electrothermal Fluid Manipulation of High-Conductivity Samples for Laboratory Automation Applications. JALA Charlottesv Va. 15 (6), 426-432 (2010).
- Liao, S. -. H., Cheng, I. F., Chang, H. -. C. Precisely sized separation of multiple particles based on the dielectrophoresis gradient in the z-direction. Microfluidics and Nanofluidics. 12 (1-4), 201-211 (2012).
- Gencoglu, A., Minerick, A. Chemical and morphological changes on platinum microelectrode surfaces in AC and DC fields with biological buffer solutions. Lab on a Chip. 9 (13), 1866-1873 (2009).
- Bocchi, M., et al. Dielectrophoretic trapping in microwells for manipulation of single cells and small aggregates of particles. Biosensors & Bioelectronics. 24 (5), 1177-1183 (2009).
- Li, P., Stratton, Z. S., Dao, M., Ritz, J., Huang, T. J. Probing circulating tumor cells in microfluidics. Lab on a Chip. , (2013).
- Rimmele, T., Kellum, J. A. Clinical review: Blood purification for sepsis. Critical Care. 15 (1), (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved