Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Entwicklung eines 3D-Graphen-Elektroden-Dielektrophoretische Geräte
In diesem Artikel
Zusammenfassung
Eine Mikrovorrichtung mit hoher Durchsatzpotential verwendet wird, um dreidimensionale (3D) Dielektrophorese (DEP) mit neuen Materialien zu demonstrieren. Graphen nanoplatelet Papier und doppelseitiges Klebeband wurden abwechselnd gestapelt; 700 um ein Mikro-Brunnen wurde quer zu den Schichten gebohrt. DEP Verhalten von Polystyrol-Kügelchen in der Mikro-und demonstriert.
Zusammenfassung
Das Design und die Herstellung einer neuartigen 3D-Elektrode Kleinst mit 50 um dicke Graphen-Papier und 100 um doppelseitiges Klebeband beschrieben. Das Protokoll beschreibt die Verfahren, die einen vielseitigen, wiederverwendbar, Mehrschicht-, Schicht Dielektrophorese Kammer bauen. Genauer wurden sechs Schichten von 50 um x 0,7 cm x 2 cm Graphen Papier und fünf Schichten aus doppelseitigem Klebeband abwechselnd aufeinander gestapelt, so eingespannt, um einen Objektträger. Dann wird eine 700 &mgr; m Durchmesser Mikro Vertiefung wurde durch den laminierten Struktur unter Verwendung eines computergesteuerten Mikro Bohrmaschine gebohrt. Isolationseigenschaften der Bandschicht zwischen benachbarten Graphitschichten wurden durch Widerstandstests sichergestellt. Silber leitfähige Epoxidharz verbunden abwechselnden Schichten von Graphen gebildet Papier und stabile Verbindungen zwischen dem Graphen-Papier und externe Kupferdraht-Elektroden. Dann wurde die fertige Vorrichtung eingespannt und auf einen Objektträger versiegelt. Die elektrischen Feldgradienten innerhalb t modellierter Mehrschicht-Gerät. Dielektrophoretische Verhaltensweisen von 6 um Polystyrol-Kügelchen wurden in den 1 mm tief Mikro gut, mit mittleren Leitfähigkeiten im Bereich von 0,0001 S / m auf 1,3 S / m demonstriert und angewendet Signalfrequenzen von 100 Hz bis 10 MHz. Negative dielektrophoretische Antworten wurden in drei Dimensionen über den größten Teil der Leitfähigkeit-Frequenz-Raum, und Übergangsfrequenz Werte konsistent mit zuvor berichteten Literatur Werte beobachtet. Die Vorrichtung nicht verhindern, dass AC Elektroosmose und elektroStröme, die in den niedrigen und hohen Frequenzbereichen aufgetreten sind. Die Graphen-Papier in diesem Gerät verwendet wird, ist vielseitig und kann anschließend als Biosensor funktionieren nach dielektrophoretischer Charakterisierungen vollständig sind.
Einleitung
Graphen ist ein neuartiges Material für seine qualitativ hochwertigen elektronischen Eigenschaften und mögliche chemische und Biosensor-Anwendungen 1 bekannt. Graphen-Nanoplättchen sind für Katalysatorträger 2, 3, 4 Biosensoren, Superkondensatoren 5, und Composite-Elektroden, einschließlich Graphen / Polyanilin und Silizium-Nanopartikel / Graphen-Verbundwerkstoffe 8.6 verwendet. Diese Handschrift beschreibt Ausnutzung Graphen Papier als Elektroden in einer einzigartigen dreidimensionalen (3D), mehrschichtige Mikrofluid-Vorrichtung. Graphen Papier Elektroden wurden mit isolierenden doppelseitigen Klebeband und einer Kammer gebohrt, in dem 3D-AC Dielektrophorese Polystyrolkügelchen durchgeführt wurde laminiert.
Dielektrophorese (DEP) auf die Bewegung von polarisierbaren Teilchen unter nicht-gleichförmige elektrische Felder. Positive DEP (pDEP) oder negative DEP (nDEP) tritt auf, wenn Teilchen sind mehr oder weniger polarisierbar als das umgebende Medium, resulting in Bewegung in Richtung des stärksten oder schwächsten elektrisches Feld auf. Diese nichtlineare elektro Werkzeug für die Trennung verwendet wurde, Sortieren, Trapping, und Identifizierung von biologischen Teilchen und Zellen 9-15. Dielektrophoretischen Kraft durch einen polarisierten Teilchen erfahren wird, ist eine Funktion des Gradienten des elektrischen Feldes, Partikel-Radius und Form, Partikel dielektrischen Eigenschaften, einschließlich Leitfähigkeit und Dielektrizitätskonstante als auch der Medien Leitfähigkeit und Dielektrizitätskonstante. In herkömmlichen zweidimensionalen (2D) DEP ist Partikelbewegung in der Hauptebene des elektrischen Feldgradienten typischerweise zwischen mikrogefertigten Oberflächenelektroden ausgebildet ist; Bewegung in der vertikalen Richtung ist im Vergleich zu Richtungen in der Ebene in den meisten Geräten. Jedoch die Nutzung dieses dritten Dimension von elektrischen Feldgradienten für 3D DEP ermöglicht höheren Probendurchsatz und erhöht die Flexibilität, neue und verbesserte dielektrophoretische Trennungen, in dem die Strömung trave entwerfenrse in das Feld Gradienten 16, 17. Weitere spezifische Designs gehören 3D-Isolator-basierte DEP 18, 3D-Kohlenstoff-Elektrode DEP 13, 19, und 3D-Galvanik DEP 10. Wie durch die Forschung in 3D-Strukturen belegt, können solche Vorrichtungen im Durchlaufbetrieb betrieben werden, um einen höheren Durchsatz zu erzielen. Die Beobachtung der 3D-Partikelbewegung in unserem geschichtet 3D Gerät wird als Funktion der Frequenz und mittlere Leitfähigkeit über Lichtmikroskopie bei verschiedenen Brenn Höhen erreicht.
Fatoyinbo et al. Berichtete zuerst DEP in einer 3D-laminiert Elektrode / Isolationsstruktur mit abwechselnd gestapelt 30 um Aluminiumfolie und 150 um Epoxyharzfilme 20. Hubner et al. Dann ähnliche 3D laminierten Elektroden mit 35 um Kupferband und 118 um Polyimid-Klebstoff 21 ausgelegt. Diese Arbeit leiht das 3D-Design sowie 22, 23Und eindeutig nutzt die Vorteile von 50 um Graphen Papier als die leitenden Schichten und 100 um doppelseitige Klebeband als die isolierenden Schichten, die eine Abdichtung und eine ausreichende elektrische Abschirmung erzielt. Graphen-Papier Vielseitigkeit ist ein deutlicher Vorteil für die 3D-Elektrodenmikrobauelementen, weil die Graphennanoplättchen haben die Fähigkeit, gleichzeitig als Biosensoren, die diese Gruppe zuvor gezeigt, 24 zu handeln.
Die Feldgradienten innerhalb der Graphen-Papier / Polymer erreicht laminiert 3D-Mikrobauelementen, hängt von den Mikroabmessungen, der Graphenpapierschichten und des angelegten elektrischen Feldes. Kritische Dimensionen sind die vertikalen Elektrodenabstand (leitenden und isolierenden Schichtdicken) und Mikro-sowie Durchmesser und Höhe (von Schichten gestapelt bestimmt). Das elektrische Signal kann über Amplitude und Frequenz abgestimmt werden. Die aktuelle Vorrichtungsstruktur ist für Chargenbetrieb, sondern kann auf einer kontinuierlichen Strömungsvorrichtung angepasst werden. Das Gerät fabhier beschriebenen rication Technik ist geeignet für die Entwicklung von 3D-Schichtelektroden mit einer Vielzahl von Graphen nanoplatelet Eigenschaften durch einfachen Austausch des Graphen-Papier verwendet. Vorteile der Verwendung von Graphen-Papier sind Vielseitigkeit der physikalischen und chemischen Eigenschaften, reduzierte Kosten und die Graphen-Nanoplättchen können gleichzeitig agieren als Biosensoren eine breite Palette von Bioanalyten 24 zu erkennen. Langfristige Ziele der Hochdurchsatz-3D-DEP-Systeme sind schnell zu identifizieren Zelltypen 25-27, oder erreichen markierungsfreie, elektrisch vermittelte Zellsortierung von kranken Zellen aus Populationen von gesunden Zellen 28. Dieses Papier zeigt die Materialoptimierung und Geräte Vorbereitung und Betrieb, gefolgt von Darstellung und Analyse von typischen Ergebnisse.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Fertigen Sie ein Verbund Elektrode / Isolierung 3D-Struktur
- Bei einem 6 Graphenschicht, 5-Band-Schicht-Gerät, schneiden Graphen-Papier mit einem Skalpell oder ähnliche Rasierklinge und dem Lineal in sechs 0,7 cm x 1,5 cm Rechtecke und mit einer Schere doppelseitige Haftklebeband in fünf 1,3 cm geschnitten ~ x 5 cm Streifen.
HINWEIS: Wie in 1a gezeigt, ergibt dies eine Masseelektrode 3, 3 AC-Signal Elektrodeneinrichtung. Die 7 mm Breite leitende Schicht ist schmal genug, um auf einen Objektträger, aber breit genug für ein einfaches Bohren passen. Die 2 mm Länge nicht leicht bei wiederholter Anwendung zu brechen und hat genügend Platz für die Kupferdrähte zu befestigen. Die Gerätetiefe wird durch Fräser Tiefe beschränkt. - Legen Sie die erste Schicht von Graphen Papier auf einer sauberen Glasobjektträger. Langsam decken ein Ende der Graphen-Papier mit einem Streifen Klebeband, so dass ein ca. 2 mm Rand der Isolierung zwischen den beiden benachbarten Graphenpapierschichten (Abbildung 1b versichern ).
- Platzieren der zweiten Schicht aus Graphitpapier auf der Oberseite des Bandes versetzt, um die erste Schicht des Graphen Papier (Abbildung 1a). Mäßigem Druck (drücken Sie mit dem Daumen gleichmäßig, ~ 100 N über 0,7 cm 2 Fläche) nach Zugabe von jeweils leitenden Schicht eine gute Abdichtung zwischen den Schichten zu gewährleisten.
- Wiederholen Sie die Schritte 1.2 und 1.3 für die übrigen Schichten, so dass sowohl die oberen und unteren Schichten Graphen-Papier. (1b Abbildung) entlang der in Fig. 1b gezeigt, um das überschüssige Band aus den Gerätekanten so dass eine kleine ~ 1 mm Rand versiegelt Isolierung zwischen Graphen-Schichten Papier versichern entfernen gestrichelte Linie geschnitten.
HINWEIS: Doppelseitiges Klebeband wird nicht genutzt, da die oberen und unteren Schichten zu vermeiden, sammeln Schmutz wie diese Schichtstruktur gebohrt wird, auf einem Schlitten montiert und mit der Probe gefüllt. - Führen Sie eine schnelle Isolationsprüfung mit einem Multimeter (Widerstand-Modus). Positionieren Sie die positiven und negativen Sonden auf zwei verschiedenen Seiten der the Vorrichtung (A und B in Fig. 1c); hohe Beständigkeit (Kilo-Mega-Ohm) zeigt eine gute Isolierung zwischen den Schichten. Entfernen Sie die Schichtstruktur aus dem Glasträger für Mikro Brunnenbau vorzubereiten.
HINWEIS: Ein Gerät in der Regel nicht die Isolationsprüfung, wenn benachbarte Graphen Papierschichten einen Kontakt während der Schritte 1.2 bis 1.4. Entsorgen Sie solche Geräte.
2. Drill Micro-und in der Verbundstruktur
- Einen Computer-gesteuerten mechanischen Mikro-Fräsmaschine und wählen einen Schaftfräser mit einem 700 &mgr; m im Durchmesser und 2,1 mm Länge geschnitten. Immobilisierung der laminierten Struktur auf der Mikro Mahlstufe mit geeigneten Klemmen (2a und b). Führen Sie die Spindel Fräsmaschine bei 8.600 Umdrehungen pro Minute, dann senken Sie das Ende Mühle langsam in und durch die Mitte der Schichtstruktur. Bewegen Sie den Drehfräser nach oben und unten durch die Mikro-und die Innenwand zu glätten.
- Wählen Sie Mikro-undDurchmessern, die durch Verfügung Fräser Durchmesser / Länge geschnitten Seitenverhältnisse eingeschränkt sind. Sicherzustellen, dass die innere Oberfläche der Mikro sowie vertikale und sauber wie möglich für eine optimale elektrische Feldgradienten und Lichtdurchgang durch die Mikro gut ist.
- Entfernen Sie Schmutz Mikro gut mit Druckluft. Führen Sie eine weitere Isolationsprüfung, wie in 1.5 beschrieben.
3. Befestigen elektrischen Leitungen auf die Schichtstruktur
- Klappen zwei 3 cm langen 32 G Kupferdrähten zu einem rechten Winkel bei 2 cm. Mischen ~ 1,5 ml von Teil A und B von Silber leitendes Epoxidharz.
HINWEIS: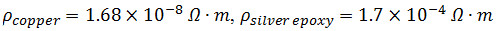
- Misch Silberepoxid manuell gelten für die Ober-und die Spitzen aller drei Graphen Papierlagen um einen guten Kontakt zwischen den Schichten auf Seite A der Schichtstruktur (Abbildung 1c) zu sichern, dann die 1 cm Kupferdraht Ende in der Epoxy-und zwischen zwei beliebigen Schichten. Softly squeeze der Schichten, um überschüssiges Epoxidharz zu entfernen und sicherzustellen, guten elektrischen Kontakt. Vorgang für die Seite B der laminierten Struktur.
- Legen Sie das ganze Gerät in Rost, über Nacht 70 ° C und 1 atm trocknen.
4. Bereiten Probe und Medien
- Bereiten isotonischen Medien ein Spektrum von Leitfähigkeiten mit dem Leitfähigkeitsmessgerät, 290 mM Mannit Stammlösung und Serien Ergänzungen isotonischer phosphatgepufferter Kochsalzlösung (PBS).
HINWEIS: Eine lineare Korrelation zwischen der Leitfähigkeit und Volumenkonzentration von ~ 290 mOsm / L PBS (Dirigieren) in ~ 290 mOsm / L Mannit-Lösung (nicht leitend). Das Video zeigt eine mittlere von 0,01 S / m Leitfähigkeit. - Mix Polystyrol-Kügelchen mit vorbereiteten Leitfähigkeit Medien oder E-reinem Wasser (ca. 5 x 10 -6 S / m) zu einer 1:50-vol: vol-Verhältnis. Dieses Protokoll ist einfach an biologischen Zellen sowie.
5. Setup-Experiment und Betreiben Geräte
- Klemmen Sie das Gerät onto einem Glasobjektträger mit mäßigem Druck (Abbildung 2d) mit modifizierten Papierklammern oder gleichwertig. Die Fundamente sollte nahe genug an dem Mikro gut, um die laminierte Struktur auf dem Glasobjektträger verhindert Probe Leckage abzudichten. Die Klammer sollte im Mikroskoptisch mit Druck, um eine optimierte) passen verhindern eine Verformung der geschichteten Struktur, und b) sicherzustellen, dass die Mikro-und Flüssigkeit nicht auslaufen. Verformung verändert die Geometrie und gut Lichtweg reduziert Experiment Reproduzierbarkeit.
- Mit einer Mikrospritze oder gleichwertig, langsam injizieren ~ 1 ul der Probe in der Mikro-gut und vermeiden Sie jegliche Einführung Blasen. Wiederholen Injektion bei Bedarf und gehen Sie vorsichtig, um die Mikro-und Wände mit der spitzen Nadel nicht beschädigt. Etwas überfüllen die Mikro-und sofort gut gleiten Deckglas über den Mikro-gut, um überschüssige Flüssigkeit zu entfernen, zu verhindern, Verdampfung und gewährleisten reproduzierbare Mengen für jedes Experiment.
HINWEIS: Ein Diamantspitze Glasschneider gut funktioniert SCORe und Riss Deckglas zur Größe. - Sichern Sie das ausgefüllte laminiert Kleinst zu dem Mikroskoptisch und befestigen Sie die Funktionsgenerator Elektrodendrähte zu den zwei Kupferleitungen auf dem Gerät. In AxioVision (Zeiss-Software), klicken Sie auf, um die Kamera-Aufzeichnung in mehrdimensionalen Erfassungsmodus starten. Funktion einleiten Generatorsignal mit einer festen Zeitperiode nach dem Start der CCD-Kamera zur Aufnahme Reaktionen mit und ohne angelegtes elektrisches Feld zu dokumentieren.
HINWEIS: Hier 100 Hz bis 10 MHz mit einer 15-V-Spitze-Spitze-Signal angewendet wurden und ohne Feldversuche wurden bei 10-facher Vergrößerung an 1 bis 200 über der Glasscheibenoberfläche 2 sec. beobachtet und ~ 5 min mit Feld angelegt. Bilder wurden digital bei 1 zu 5 Bildern pro Sekunde (fps) für die weitere Analyse gespeichert. - Nach Abschluss Experiment, entfernen Sie das Gerät demontieren und die Klammern. Tauchen Sie sowohl die Glas-Objektträger und Geräte in Seifenwasser, dann gut ausspülen. Reuse-Geräte etwa 30 Mals mit gleichbleibender Leistung.
6. Datenanalyse und Bildverarbeitung
- Analysieren Sie Bilddaten mit bevorzugten Software, wie ImageJ. Berechnen Geschwindigkeit von der Partikelverschiebung zwischen aufeinanderfolgenden Bildern in einem gegebenen Zeitschritt.
- Berechnen experimentellen DEP-Kraft und Feldstärke, basierend auf Geschwindigkeit, um Trends zu kompilieren und zu vergleichen mit 29 Theorie.
- Messen der Partikelgeschwindigkeit radial in der Mikrogeometrie auch im Einklang mit der Form des elektrischen Feldgradienten. Von der Mikro-und Rand zur Mitte, zu identifizieren 8 konzentrischen isoelektrischen Konturen (350, 300, ... 50, 0 um), die in 7 Regionen führt.
HINWEIS: Die Zeit für Partikel zu durchqueren die 50 um Abstand wurde verwendet, um die Geschwindigkeit zu berechnen. Wenn es notwendig geometrischen Variationen wurden die isoelektrischen Konturen leicht angepasst.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Dielektrophoretische Experimente auf 6 um Polystyrol-Kügelchen wurden in einem 0,38 mm 3 zylindrische Mikro gut durchgeführt. Die Ergebnisse zeigen, dass ein 3D-Graphen laminiert Papier-basierten Gerät kann ähnlich dielektrophoretischer Signaturen als 3D-Metallfolie laminiert Vorrichtungen 20, 21, traditionellen 2D-Metall-Elektrode 26, 27 2D-Isolator-Vorrichtungen 25 veranschaulichen, und. In den folgenden Versuchen wurde eine 15 V Spitze-Spitze-AC-Signal angele...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Dieses Manuskript Details Protokolle für die Herstellung eines neuartigen Graphenschicht 6 und 5 Bandschicht Kleinst. Weiterhin ist die Bedienung über Geräte beobachteten DEP Verhaltensweisen von 6,08 um Polystyrol-Kügelchen mit einem einzigartigen, geometrisch relevanten Partikelgeschwindigkeit Analyseansatz veranschaulicht. Dieses vielseitige Ansatz zur nichtlinearen elektrokinetische Geräte konstruieren, ist weniger kostspielig als Elektrode und fluidische Schicht Mikrofabrikationstechniken, während was gleiche...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben keine Konflikte offen zu legen.
Danksagungen
Dank XG Schule für großzügige Spenden von Graphen Papier. Dank Dr. C. Friedrich für die großzügige ließen uns die Mikro-Bohrgeräte. Ein besonderer Dank an Tayloria Adams erzählt das Video erweitert.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Polystyrene Beads | Spherotech, Inc. | PP-60-10 | 6.08 μm diameter |
| Graphene paper | XG Sciences, Inc. | XG Leaf B-072 | |
| Double sided tape | 3M | N/A | 136 office tape |
| Silver conductive epoxy | MG chemicals | 8331-14G | Part A & B included |
| Mannitol | Sigma Aldrich | 091M0020V | |
| Phosphate buffer saline | OmniPur | 0381C490 | |
| Microscope (CCD Camera) | Zeiss | Axiovert 200M | |
| Function/waveform generator | Agilent | 33250A | |
| Syringe | Hamilton | 84505 | |
| Paper Clamp | ADAMS | 3300-50-3848 | |
| Oven | Fisher Scientific | 280A | |
| Multimeter | OMEGA | HHM25 | |
| Micro-milling machine | AEROTECH | ABL1500 stages/A3200 Npaq controller | |
| End mill | ULTRATOOL | 708473 | |
| AxioVision | Zeiss | Version 4.8 |
Referenzen
- Geim, A. K., Novoselov, K. S. The rise of graphene. Nature Materials. 6 (3), 183-191 (2007).
- Jafri, R. I., Rajalakshmi, N., Ramaprabhu, S. Nitrogen doped graphene nanoplatelets as catalyst support for oxygen reduction reaction in proton exchange membrane fuel cell. Journal of Materials Chemistry. 20 (34), 7114-7117 (2010).
- Kavan, L., Yum, J. H., Gratzel, M. Graphene Nanoplatelets Outperforming Platinum as the Electrocatalyst in Co-Bipyridine-Mediated Dye-Sensitized Solar Cells. Nano Letters. 11 (12), 5501-5506 (2011).
- Aravind, S. S. J., Baby, A. T. T., Arockiadoss, T., Rakhi, R. B., Ramaprabhu, S. A cholesterol biosensor based on gold nanoparticles decorated functionalized graphene nanoplatelets. Thin Solid Films. 519 (16), 5667-5672 (2011).
- Si, P., Ding, S. J., Lou, X. W., Kim, D. H. An electrochemically formed three-dimensional structure of polypyrrole/graphene nanoplatelets for high-performance supercapacitors. Rsc Advances. 1 (7), 1271-1278 (2011).
- Wang, D. -W., et al. Fabrication of Graphene/Polyaniline Composite Paper via In Situ Anodic Electropolymerization for High-Performance Flexible Electrode. ACS Nano. 3 (7), 1745-1752 (2009).
- Lee, J. K., Smith, K. B., Hayner, C. M., Kung, H. H. Silicon nanoparticles-graphene paper composites for Li ion battery anodes. Chem Commun (Camb). 46 (12), 2025-2027 (2010).
- Kavan, L., Yum, J. H., Gratzel, M. Optically Transparent Cathode for Dye-Sensitized Solar Cells Based on Graphene Nanoplatelets. ACS Nano. 5 (1), 165-172 (2011).
- Martinez-Duarte, R. Microfabrication technologies in dielectrophoresis applications--a review. Electrophoresis. 33 (21), 3110-3132 (2012).
- Yamamoto, M., et al. Patterning with particles using three-dimensional interdigitated array electrodes with negative dielectrophoresis and its application to simple immunosensing. Electrochimica Acta. 82, 35-42 (2012).
- Doh, I., Kim, Y., Cho, Y. H. A particle trapping chip using the wide and uniform slit formed by a deformable membrane with air bubble plugs. Current Applied Physics. 13 (5), 902-906 (2013).
- Lin, S. C., Lu, J. C., Sung, Y. L., Lin, C. T., Tung, Y. C. A low sample volume particle separation device with electrokinetic pumping based on circular travelling-wave electroosmosis. Lab on a Chip. 13 (15), 3082-3089 (2013).
- Martinez-Duarte, R., Camacho-Alanis, F., Renaud, P., Ros, A. Dielectrophoresis of lambda-DNA using 3D carbon electrodes. Electrophoresis. 34 (7), 1113-1122 (2013).
- Yang, S. M., Tseng, S. Y., Chen, H. P., Hsu, L., Liu, C. H. Cell patterning via diffraction-induced optoelectronic dielectrophoresis force on an organic photoconductive chip. Lab on a Chip. 13 (19), 3893-3902 (2013).
- Srivastava, S. K., Gencoglu, A., Minerick, A. R. DC insulator dielectrophoretic applications in microdevice technology: a review. Anal Bioanal Chem. 399 (1), 301-321 (2011).
- Liao, S. H., Cheng, I. F., Chang, H. C. Precisely sized separation of multiple particles based on the dielectrophoresis gradient in the z-direction. Microfluidics and Nanofluidics. 12 (1-4), 1-4 (2012).
- Bajaj, P., Marchwiany, D., Duarte, C., Bashir, R. Patterned three-dimensional encapsulation of embryonic stem cells using dielectrophoresis and stereolithography. Adv Healthc Mater. 2 (3), 450-458 (2013).
- Braff, W. A., Pignier, A., Buie, C. R. High sensitivity three-dimensional insulator-based dielectrophoresis. Lab Chip. 12 (7), 1327-1331 (2012).
- Martinez-Duarte, R., Gorkin 3rd, R. A., Abi-Samra, K., Madou, M. J. The integration of 3D carbon-electrode dielectrophoresis on a CD-like centrifugal microfluidic platform. Lab Chip. 10 (8), 1030-1043 (2010).
- Fatoyinbo, H. O., Kamchis, D., Whattingham, R., Ogin, S. L., Hughes, M. P. A high-throughput 3-D composite dielectrophoretic separator. Ieee Transactions on Biomedical Engineering. 52 (7), 1347-1349 (2005).
- Hubner, Y., Hoettges, K. F., Kass, G. E. N., Ogin, S. L., Hughes, M. P. Parallel measurements of drug actions on Erythrocytes by dielectrophoresis, using a three-dimensional electrode design. Iee Proceedings-Nanobiotechnology. 152 (4), 150-154 (2005).
- Abdul Razak, M. A., Hoettges, K. F., Fatoyinbo, H. O., Labeed, F. H., Hughes, M. P. Efficient dielectrophoretic cell enrichment using a dielectrophoresis-well based system. Biomicrofluidics. 7 (6), (2013).
- Hughes, M. P. O. S., Hoettges, K. F., Wattingham, R. Device for Dielectrophoretic Manipulation of Particles. , (2005).
- Heldt, C. L., et al. Stacked graphene nanoplatelet paper sensor for protein detection. Sensors and Actuators B-Chemica. 181, 92-98 (2013).
- Srivastava, S. K., Artemiou, A., Minerick, A. R. Direct current insulator-based dielectrophoretic characterization of erythrocytes: ABO-Rh human blood typing. Electrophoresis. 32 (18), 2530-2540 (2011).
- Leonard, K. M., Minerick, A. R. Explorations of ABO-Rh antigen expressions on erythrocyte dielectrophoresis: Changes in cross-over frequency. Electrophoresis. 32 (18), 2512-2522 (2011).
- Srivastava, S. K., Daggolu, P. R., Burgess, S. C., Minerick, A. R. Dielectrophoretic characterization of erythrocytes: Positive ABO blood types. Electrophoresis. 29 (24), 5033-5046 (2008).
- Minerick, A. R. The rapidly growing field of micro and nanotechnology to measure living cells. AIChE Journal. 54 (9), 2230-2237 (2008).
- Garza-Garcia, L. D., Perez-Gonzalez, V. H., Perez-Sanchez, O. A., Lapizco-Encinas, B. H. Electrokinetic Mobilities Characterization and Rapid Detection of Microorganisms in Glass Microchannels. Chemical Engineering & Technology. 34 (3), 371-378 (2011).
- Lopez-de la Fuente, M. S., et al. An electric stimulation system for electrokinetic particle manipulation in microfluidic devices. Rev Sci Instrum. 84 (3), (2013).
- Chen, D. F., Du, H., Li, W. H. A 3D paired microelectrode array for accumulation and separation of microparticles. Journal of Micromechanics and Microengineering. 16 (7), 1162-1169 (2006).
- Chu, H., Doh, I., Cho, Y. H. A three-dimensional (3D) particle focusing channel using the positive dielectrophoresis (pDEP) guided by a dielectric structure between two planar electrodes. Lab on a Chip. 9 (5), 686-691 (2009).
- Millet, L. J., Park, K., Watkins, N. N., Hsia, K. J., Bashir, R. Separating beads and cells in multi-channel microfluidic devices using dielectrophoresis and laminar flow. J Vis Exp. , (2011).
- Weiss, N. G., et al. Dielectrophoretic mobility determination in DC insulator-based dielectrophoresis. Electrophoresis. 32 (17), 2292-2297 (2011).
- Auerswald, J., Knapp, H. F. Quantitative assessment of dielectrophoresis as a micro fluidic retention and separation technique for beads and human blood erythrocytes. Microelectronic Engineering. 67-8, 879-886 (2003).
- Park, S., Zhang, Y., Wang, T. H., Yang, S. Continuous dielectrophoretic bacterial separation and concentration from physiological media of high conductivity. Lab on a Chip. 11 (17), 2893-2900 (2011).
- Sun, T., Holmes, D., Gawad, S., Green, N. G., Morgan, H. High speed multi-frequency impedance analysis of single particles in a microfluidic cytometer using maximum length sequences. Lab on a Chip. 7 (8), 1034-1040 (2007).
- Hughes, M. P., Morgan, H. Dielectrophoretic Characterization and Separation of Antibody-Coated Submicrometer Latex Spheres. Analytical Chemistry. 71 (16), 3441-3445 (1999).
- Liang, W. F., et al. Simultaneous separation and concentration of micro- and nano-particles by optically induced electrokinetics. Sensors and Actuators a-Physical. 193, 103-111 (2013).
- White, C. M., Holland, L. A., Famouri, P. Application of capillary electrophoresis to predict crossover frequency of polystyrene particles in dielectrophoresis. Electrophoresis. 31 (15), 2664-2671 (2010).
- Wu, J., Ben, Y. X., Battigelli, D., Chang, H. C. Long-range AC electroosmotic trapping and detection of bioparticles. Industrial & Engineering Chemistry Research. 44 (8), 2815-2822 (2005).
- Zhou, H., White, L. R., Tilton, R. D. Lateral separation of colloids or cells by dielectrophoresis augmented by AC electroosmosis. J Colloid Interface Sci. 285 (1), 179-191 (2005).
- Green, N. G., Ramos, A., Gonzalez, A., Morgan, H., Castellanos, A. Fluid flow induced by nonuniform ac electric fields in electrolytes on microelectrodes I. Experimental measurements. Phys Rev E Stat Phys Plasmas Fluids Relat Interdiscip Topics. 61 (4 Pt B), 4011-4018 (2000).
- Green, N. G., Ramos, A., Gonzalez, A., Castellanos, A., Morgan, H. Electrothermally induced fluid flow on microelectrodes. Journal of Electrostatics. 53 (2), 71-87 (2001).
- Gonzalez, A., Ramos, A., Morgan, H., Green, N. G., Castellanos, A. Electrothermal flows generated by alternating and rotating electric fields in microsystems. Journal of Fluid Mechanics. 564, 415-433 (2006).
- Park, S., Koklu, M., Beskok, A. Particle trapping in high-conductivity media with electrothermally enhanced negative dielectrophoresis. Anal Chem. 81 (6), 2303-2310 (2009).
- Sin, M. L., Gau, V., Liao, J. C., Wong, P. K. Electrothermal Fluid Manipulation of High-Conductivity Samples for Laboratory Automation Applications. JALA Charlottesv Va. 15 (6), 426-432 (2010).
- Liao, S. -H., Cheng, I. F., Chang, H. -C. Precisely sized separation of multiple particles based on the dielectrophoresis gradient in the z-direction. Microfluidics and Nanofluidics. 12 (1-4), 201-211 (2012).
- Gencoglu, A., Minerick, A. Chemical and morphological changes on platinum microelectrode surfaces in AC and DC fields with biological buffer solutions. Lab on a Chip. 9 (13), 1866-1873 (2009).
- Bocchi, M., et al. Dielectrophoretic trapping in microwells for manipulation of single cells and small aggregates of particles. Biosensors & Bioelectronics. 24 (5), 1177-1183 (2009).
- Li, P., Stratton, Z. S., Dao, M., Ritz, J., Huang, T. J. Probing circulating tumor cells in microfluidics. Lab on a Chip. , (2013).
- Rimmele, T., Kellum, J. A. Clinical review: Blood purification for sepsis. Critical Care. 15 (1), (2011).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten