É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Desenvolvimento de um dispositivo 3D Grafeno Eletrodo dieletroforética
Neste Artigo
Resumo
Um microdispositivo com elevado potencial de transferência é utilizado para demonstrar tridimensional (3D) dieletroforese (DEP) com novos materiais. Papel nanoplatelet grafeno e fita dupla face foram alternadamente empilhados; um micro-poços 700 um foi perfurado transversal às camadas. DEP comportamento de esferas de poliestireno, foi demonstrada em micro-poços.
Resumo
O projeto e fabricação de um romance microdispositivo eletrodo 3D usando 50 mm de espessura e papel grafeno 100 mm fita dupla face é descrito. O protocolo detalha os procedimentos para a construção de um, reutilizável, múltiplas camadas versátil, câmara dieletroforese laminado. Especificamente, seis camadas de 50 mm x 0.7 cm x 2 cm de papel grafeno e cinco camadas de fita adesiva de face dupla foram alternadamente empilhados juntos, em seguida, fixar-se uma lâmina de vidro. Em seguida, um um de diâmetro de micro-poços 700 foi perfurado através da estrutura de laminado utilizando uma máquina de perfuração de micro controlado por computador. Propriedades de isolamento da camada de fita adesiva entre as camadas adjacentes grafene foram asseguradas por testes de resistência. Prata epóxi condutor ligado camadas alternadas de papel grafeno e formaram conexões estáveis entre o papel grafeno e os eletrodos de fio de cobre externas. O dispositivo acabado foi então fixada e selada a uma lâmina de vidro. O gradiente de campo elétrico foi modelado dentro de tele dispositivo multi-camada. Comportamentos dieletroforética de 6 mM esferas de poliestireno foram demonstrados nos 1 mm de espessura micro-Bem, com condutividades médias que variam de 0,0001 S / m para 1,3 S / m, e aplicados frequências de sinal de 100 Hz a 10 MHz. Dielectrof oréticas respostas negativas foram observadas em três dimensões sobre a maior parte do espaço condutividade freqüência e cross-over valores de frequência são consistentes com os valores da literatura anteriormente relatados. O dispositivo não impediu eletroosmose e eletrotérmica fluxos de corrente alternada, que ocorreram nas regiões de baixa e alta freqüência, respectivamente. O papel grafeno utilizado neste dispositivo é versátil e pode posteriormente funcionar como um biossensor após caracterizações dielectrof oréticas estão completas.
Introdução
O grafeno é um novo material conhecido por suas propriedades eletrônicas de alta qualidade e potenciais aplicações de produtos químicos e biossensores 1. Nanoplatelets grafeno têm sido utilizados para suporte de catalisador 2, 3, 4, biossensores super-capacitores 5 e-eletrodos compósitos incluindo grafeno / polianilina e compósitos de nanopartículas de silício / grafeno 6-8. Este manuscrito descreve a utilização de papel grafeno como eletrodos em um único tridimensional (3D), dispositivo micro camadas. Eletrodos papel de grafeno foram laminados com fita dupla face isolante e uma câmara perfurado dentro da qual AC 3D dieletroforese de esferas de poliestireno foi realizada.
Dieletroforese (DEP) refere-se ao movimento de partículas polarizáveis sob campos elétricos não uniformes. DEP positiva (PDEP) ou DEP negativo (PADS) ocorre quando as partículas são mais ou menos polarizável do que o meio, resu circundantelting em movimento na direção do campo elétrico mais forte ou mais fraco, respectivamente. Esta ferramenta electrokinetic não-linear foi utilizada para separação, classificação, prendendo, e identificação de partículas e células biológicas 9-15. A força dieletroforética experimentada por uma partícula polarizado é uma função do gradiente de campo eléctrico, o raio e a forma da partícula, partículas de propriedades dielétricas, incluindo condutividade e permissividade, bem como a meios de condutividade e permitividade. Em bidimensional (2D) DEP tradicional, o movimento das partículas é no plano principal do gradiente do campo eléctrico formado entre os eléctrodos normalmente superfície microfabricados; movimento na direção vertical é desprezível em comparação com em-plano sentidos na maioria dos dispositivos. No entanto, o aproveitamento desta terceira dimensão de gradientes do campo eléctrico para a DEP 3D permite maior rendimento da amostra e aumenta a versatilidade para conceber novas e melhoradas separações dielectrof oréticas em que o fluxo é traverse a gradientes do campo 16, 17. Outros projetos específicos incluem-base isolante 3D DEP 18, carbono-eletrodo 3D DEP 13, 19, e 3D galvanoplastia DEP 10. Como evidenciado pela investigação sobre as estruturas 3D, tais dispositivos podem ser operados no modo de fluxo contínuo para alcançar débitos mais elevados. Observação do movimento de partículas 3D no nosso dispositivo 3D em camadas é obtida como uma função de frequência e condutividade média através de microscopia de luz em diferentes alturas focais.
Fatoyinbo et al. Relatada pela primeira vez em um DEP 3D laminado estrutura eletrodo / isolamento usando alternativamente empilhados 30 mm folha de alumínio e 150 mM de resina epóxi filmes 20. Hubner et al. Então projetado eletrodos laminados 3D semelhantes com 35 mM fita de cobre e 118 mM adesiva poliimida 21. Este trabalho toma emprestado o design 3D-bem 22, 23, E utiliza exclusivamente a conveniência de 50 mM papel grafeno como as camadas condutoras e 100 mm de fita dupla face como as camadas de isolamento, que alcançou a vedação e blindagem elétrica suficiente. Grafeno papel versatilidade é uma vantagem distinta para microdevices eletrodo 3D porque os nanoplatelets grafeno tem a capacidade de agir simultaneamente como biossensores, que este grupo já demonstrou 24.
Os gradientes de campo obtidos no grafeno papel / polímero laminado microdevices 3D dependem das dimensões micro-assim, as camadas de papel de grafeno, eo campo elétrico aplicado. Dimensões críticas incluem o espaçamento vertical do eletrodo (condução e isolamento espessuras de camadas) e micro-bem diâmetro e altura (determinada por camadas empilhadas). O sinal elétrico pode ser sintonizada via amplitude e frequência. A estrutura do dispositivo actual é para a operação em lotes, mas pode ser adaptado a um dispositivo de fluxo contínuo. O fab dispositivotécnica rication aqui descrito é adequado para o desenvolvimento de 3D laminado eléctrodos com uma grande variedade de propriedades grafeno nanoplatelet simplesmente trocando o papel grafeno utilizado. Vantagens da utilização de papel grafeno são versatilidade de propriedades físicas e químicas, a despesa reduzida, e os nanoplatelets grafene pode simultaneamente actuar como biosensores para detectar uma grande variedade de bioanalytes 24. Os objetivos a longo prazo de sistemas de DEP 3D alto rendimento são identificar rapidamente os tipos de células 25-27, ou conseguir sem rótulo, separação de células eletricamente mediada de células doentes a partir de populações de células saudáveis 28. Este trabalho demonstra a otimização de materiais e preparação de dispositivos e operação seguido de ilustração e análise dos resultados típicos.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Fabricar uma estrutura 3D laminado Eletrodo / isolamento
- Para uma camada de grafeno 6, 5 dispositivo de camada de fita, corte o papel de grafeno com um bisturi ou lâmina de barbear semelhante e governante com bordas retas em seis 0,7 centímetros x 1,5 cm retângulos e usar uma tesoura para cortar a fita sensível à pressão de dupla face em cinco 1,3 centímetros x ~ 5 centímetros listras.
NOTA: Como mostrado na Figura 1a, isso gera um eletrodo de 3 chão, 3 dispositivo eletrodo sinal AC. A 7 milímetros realização largura camada é estreito o suficiente para caber em uma lâmina de vidro, mas grande o suficiente para a perfuração fácil. O comprimento de 2 mm não quebrar facilmente sobre o uso repetido e tem espaço suficiente para prender os fios de cobre. A profundidade do dispositivo é limitado pela profundidade de fresa. - Coloque a primeira camada de papel de grafeno sobre uma lâmina de vidro limpa. Lentamente cobrir uma extremidade do papel grafeno com uma tira de fita, deixando uma margem de ~ 2 mm a assegurar o isolamento entre as duas camadas de papel grafene adjacentes (Figura 1b ).
- Coloque a segunda camada de papel grafeno sobre o topo da fita de deslocamento para a primeira camada de papel grafeno (Figura 1a). Aplique pressão moderada (imprensa de maneira uniforme com o polegar, ~ 100 N sobre 0,7 centímetros 2 de área), após a adição de cada camada para garantir a realização de uma boa vedação entre as camadas.
- Repita os passos 1.2 e 1.3 para as restantes camadas, deixando ambas as camadas superior e inferior de papel grafeno. O corte ao longo da linha a tracejado mostrado na Figura 1 B para remover o excesso de fita a partir das extremidades do dispositivo, deixando uma pequena margem de ~ 1 milímetro para assegurar o isolamento entre as camadas de papel selado grafene (Figura 1b).
NOTA: Fita dupla face não é utilizado como as camadas superior e inferior para evitar a coleta de detritos como esta estrutura laminada é perfurado, montado em um slide, e preenchido com amostra. - Realize um teste de isolamento rápido com um multímetro (modo de resistência). Posicione as sondas positivos e negativos em dois lados diferentes do the dispositivo (A e B na Figura 1c); alta resistência (kilo-to mega-Ohms) indica um bom isolamento entre as camadas. Remova a estrutura em camadas da lâmina de vidro para se preparar para micro-perfuração de poços.
NOTA: Um dispositivo normalmente falha o teste de isolamento quando as camadas de papel de grafeno adjacentes fazer contato durante as etapas de 1.2 a 1.4. Descartar tais dispositivos.
2. Broca Micro-bem na estrutura laminada
- Use uma máquina de micro-moagem mecânica controlada por computador e escolher uma fresa de topo com um mM 700 de diâmetro e 2,1 mm de comprimento de corte. Imobilizar a estrutura laminada na fase de micro-moagem usando braçadeiras apropriadas (figuras 2a e b). Executar o fuso da máquina de fresagem de 8600 rpm, em seguida, baixar a fresa lentamente para dentro e através do centro da estrutura laminada. Mova a fresa girando para cima e para baixo através do micro-bem para suavizar a parede interna.
- Escolha de micro-poçosdiâmetros, que são limitados por disponível fresa de topo diâmetro / comprimento de proporções corte. Certifique-se de que a superfície interna do micro-bem é tão vertical e limpo possível para ótimas gradientes de campo elétrico e passagem de luz através do micro-bem.
- Limpo de detritos a partir de micro-poços com ar pressurizado. Execute outro teste de isolamento, conforme descrito no 1.5.
3. Fixe fios elétricos à estrutura laminada
- Dobre as duas 3 cm de comprimento 32 G fios de cobre em um ângulo direito a 2 cm. Misturar ~ 1,5 ml de partes A e B de prata epóxi condutora.
NOTA: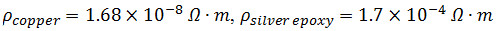
- Aplique manualmente epóxi prata misturada ao topo e as pontas de todos os 3 camadas de papel de grafeno para garantir um bom contato entre as camadas do lado A da estrutura laminada (Figura 1c), em seguida, coloque a ponta do fio de cobre de 1 cm de epóxi e entre quaisquer dois camadas. Suavemente squeeze as camadas para remover o excesso de epóxi e assegurar um bom contato elétrico. Repetir para o lado B da estrutura laminada.
- Colocar todo o dispositivo na prateleira do forno, para secar durante a noite de 70 ° C a 1 atm e.
4. Prepare Sample e Mídia
- Prepare a mídia isotónica de um espectro de condutividade utilizando o medidor de condutividade, a solução de manitol 290 mM e adições de série dos isotónica salina de tampão fosfato (PBS).
NOTA: Existe uma correlação linear entre a condutividade eo volume de concentração de ~ 290 mOsm / L PBS (condução) em ~ 290 solução mOsm / L de manitol (não condutores). O vídeo apresenta uma média de 0,01 S / m de condutividade. - Misture esferas de poliestireno com meios preparados condutividade ou e-pura água (~ 5 x 10 -6 S / m) para uma relação de 01:50 vol: vol. Este protocolo é facilmente adaptável às células biológicas bem.
5. Experiência de Instalação e Operação Dispositivo
- Prenda o dispositivo onto uma lâmina de vidro com pressão moderada (Figura 2d) usando grampos de papel modificados ou equivalente. Os fundamentos deve ser perto o suficiente para o micro-bem para selar a estrutura laminada para a lâmina de vidro impedindo o vazamento da amostra. O grampo deve caber dentro do estágio do microscópio com pressão otimizado para a) evitar a deformação da estrutura laminada, e b) garantir o fluido micro-bem não vaza. Deformação altera a geometria bem e caminho da luz reduzindo experimento reprodutibilidade.
- Usando uma seringa de micro ou equivalente, injectar lentamente ~ 1 ul da amostra num micro-poços e evitar a introdução de quaisquer bolhas. Repetir a injecção, se necessário, e utilizar o cuidado de não danificar as paredes de micro-poços, com a agulha afiada. Ligeiramente sobrecarregue o micro-bem e deslize imediatamente tampa de vidro sobre o micro-bem para remover o excesso de líquido, evitar a evaporação, e garantir volumes reprodutíveis para cada experimento.
NOTA: A ponta de diamante glasscutter funciona bem para SCORe de crack e tampa de vidro de tamanho. - Fixe o microdispositivo laminado preenchido para o estágio do microscópio e anexar os fios de eletrodo gerador de função para os dois de cobre leva no dispositivo. Em AxioVision (software Zeiss), clique no botão para iniciar a gravação da câmera em modo de aquisição multidimensional. Iniciado sinal gerador de função em um período de tempo fixo após o início da gravação da câmera CCD para documentar as respostas com e sem campo elétrico aplicado.
NOTA: Aqui 100 Hz a 10 MHz com um sinal de pico a pico de 15 V foram aplicados e os experimentos foram observados em aumento de 10x em 1 a 200 acima da superfície da lâmina de vidro por 2 segundos sem campo e ~ 5 min com o campo aplicado. As imagens foram digitalmente salvo no 1 a 5 frames por segundo (fps) para análise posterior. - Ao final do experimento, remover o dispositivo e desmontar as pinças. Mergulhe tanto a lâmina de vidro e dispositivo com água e sabão, em seguida, enxágüe bem. Reutilizar dispositivos cerca de 30 horas com um desempenho consistente.
6. Análise de Dados e Processamento de Imagem
- Analisar dados de imagem com software preferido, como o ImageJ. Calcule a velocidade do deslocamento da partícula entre imagens consecutivas em um determinado intervalo de tempo.
- Calcule a força força DEP e campo experimental com base na velocidade de compilar as tendências e comparar com a teoria 29.
- Velocidade da partícula medida radialmente no micro-geometria bem consistente com a forma do gradiente de campo eléctrico. A partir do bordo de micro-poços para o centro, identificar oito contornos concêntricos isoeléctricos (350, 300, ... 50, 0 um), o que resulta em sete regiões.
NOTA: O tempo de partículas para atravessar a distância 50 mm foi utilizada para calcular a velocidade. Quando variações geométricas exigiu ele, os contornos isoelétrico foi ligeiramente alterado.
Access restricted. Please log in or start a trial to view this content.
Resultados
Experimentos dieletroforética em 6 um esferas de poliestireno foram conduzidos em um 0,38 milímetros 3 cilíndrico micro-poços. Os resultados demonstram que um dispositivo 3D laminado à base de papel grafeno pode ilustrar assinaturas dielectrof oréticas semelhantes como dispositivos de folha de metal laminado 3D 20, 21, tradicional 2D metal eletrodo 26, 27, e dispositivos isolantes 2D 25. Nas experiências que se seguem, um sinal AC de 15 V pico a pico e foi ap...
Access restricted. Please log in or start a trial to view this content.
Discussão
Este manuscrito detalhes protocolos para fabricar uma camada de grafeno novela 6 e 5 camada de fita microdispositivo. Além disso, a operação do dispositivo é ilustrada através de comportamentos DEP observados de 6,08 mM esferas de poliestireno, juntamente com uma abordagem de análise de velocidade da partícula única, geometricamente relevante. Esta abordagem versátil para construir dispositivos eletrocinéticos não-lineares é menos onerosa do que eletrodo e técnicas de microfabricação camada fluídicos, en...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm conflitos de divulgar.
Agradecimentos
Graças ao XG Ciências de doações generosas de papel grafeno. Graças ao Dr. C. Friedrich para generosamente nos deixar usar o equipamento de micro-perfuração. Um agradecimento especial é estendido para Tayloria Adams para narrar o vídeo.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Polystyrene Beads | Spherotech, Inc. | PP-60-10 | 6.08 μm diameter |
| Graphene paper | XG Sciences, Inc. | XG Leaf B-072 | |
| Double sided tape | 3M | N/A | 136 office tape |
| Silver conductive epoxy | MG chemicals | 8331-14G | Part A & B included |
| Mannitol | Sigma Aldrich | 091M0020V | |
| Phosphate buffer saline | OmniPur | 0381C490 | |
| Microscope (CCD Camera) | Zeiss | Axiovert 200M | |
| Function/waveform generator | Agilent | 33250A | |
| Syringe | Hamilton | 84505 | |
| Paper Clamp | ADAMS | 3300-50-3848 | |
| Oven | Fisher Scientific | 280A | |
| Multimeter | OMEGA | HHM25 | |
| Micro-milling machine | AEROTECH | ABL1500 stages/A3200 Npaq controller | |
| End mill | ULTRATOOL | 708473 | |
| AxioVision | Zeiss | Version 4.8 |
Referências
- Geim, A. K., Novoselov, K. S. The rise of graphene. Nature Materials. 6 (3), 183-191 (2007).
- Jafri, R. I., Rajalakshmi, N., Ramaprabhu, S. Nitrogen doped graphene nanoplatelets as catalyst support for oxygen reduction reaction in proton exchange membrane fuel cell. Journal of Materials Chemistry. 20 (34), 7114-7117 (2010).
- Kavan, L., Yum, J. H., Gratzel, M. Graphene Nanoplatelets Outperforming Platinum as the Electrocatalyst in Co-Bipyridine-Mediated Dye-Sensitized Solar Cells. Nano Letters. 11 (12), 5501-5506 (2011).
- Aravind, S. S. J., Baby, A. T. T., Arockiadoss, T., Rakhi, R. B., Ramaprabhu, S. A cholesterol biosensor based on gold nanoparticles decorated functionalized graphene nanoplatelets. Thin Solid Films. 519 (16), 5667-5672 (2011).
- Si, P., Ding, S. J., Lou, X. W., Kim, D. H. An electrochemically formed three-dimensional structure of polypyrrole/graphene nanoplatelets for high-performance supercapacitors. Rsc Advances. 1 (7), 1271-1278 (2011).
- Wang, D. -W., et al. Fabrication of Graphene/Polyaniline Composite Paper via In Situ Anodic Electropolymerization for High-Performance Flexible Electrode. ACS Nano. 3 (7), 1745-1752 (2009).
- Lee, J. K., Smith, K. B., Hayner, C. M., Kung, H. H. Silicon nanoparticles-graphene paper composites for Li ion battery anodes. Chem Commun (Camb). 46 (12), 2025-2027 (2010).
- Kavan, L., Yum, J. H., Gratzel, M. Optically Transparent Cathode for Dye-Sensitized Solar Cells Based on Graphene Nanoplatelets. ACS Nano. 5 (1), 165-172 (2011).
- Martinez-Duarte, R. Microfabrication technologies in dielectrophoresis applications--a review. Electrophoresis. 33 (21), 3110-3132 (2012).
- Yamamoto, M., et al. Patterning with particles using three-dimensional interdigitated array electrodes with negative dielectrophoresis and its application to simple immunosensing. Electrochimica Acta. 82, 35-42 (2012).
- Doh, I., Kim, Y., Cho, Y. H. A particle trapping chip using the wide and uniform slit formed by a deformable membrane with air bubble plugs. Current Applied Physics. 13 (5), 902-906 (2013).
- Lin, S. C., Lu, J. C., Sung, Y. L., Lin, C. T., Tung, Y. C. A low sample volume particle separation device with electrokinetic pumping based on circular travelling-wave electroosmosis. Lab on a Chip. 13 (15), 3082-3089 (2013).
- Martinez-Duarte, R., Camacho-Alanis, F., Renaud, P., Ros, A. Dielectrophoresis of lambda-DNA using 3D carbon electrodes. Electrophoresis. 34 (7), 1113-1122 (2013).
- Yang, S. M., Tseng, S. Y., Chen, H. P., Hsu, L., Liu, C. H. Cell patterning via diffraction-induced optoelectronic dielectrophoresis force on an organic photoconductive chip. Lab on a Chip. 13 (19), 3893-3902 (2013).
- Srivastava, S. K., Gencoglu, A., Minerick, A. R. DC insulator dielectrophoretic applications in microdevice technology: a review. Anal Bioanal Chem. 399 (1), 301-321 (2011).
- Liao, S. H., Cheng, I. F., Chang, H. C. Precisely sized separation of multiple particles based on the dielectrophoresis gradient in the z-direction. Microfluidics and Nanofluidics. 12 (1-4), 1-4 (2012).
- Bajaj, P., Marchwiany, D., Duarte, C., Bashir, R. Patterned three-dimensional encapsulation of embryonic stem cells using dielectrophoresis and stereolithography. Adv Healthc Mater. 2 (3), 450-458 (2013).
- Braff, W. A., Pignier, A., Buie, C. R. High sensitivity three-dimensional insulator-based dielectrophoresis. Lab Chip. 12 (7), 1327-1331 (2012).
- Martinez-Duarte, R., Gorkin 3rd, R. A., Abi-Samra, K., Madou, M. J. The integration of 3D carbon-electrode dielectrophoresis on a CD-like centrifugal microfluidic platform. Lab Chip. 10 (8), 1030-1043 (2010).
- Fatoyinbo, H. O., Kamchis, D., Whattingham, R., Ogin, S. L., Hughes, M. P. A high-throughput 3-D composite dielectrophoretic separator. Ieee Transactions on Biomedical Engineering. 52 (7), 1347-1349 (2005).
- Hubner, Y., Hoettges, K. F., Kass, G. E. N., Ogin, S. L., Hughes, M. P. Parallel measurements of drug actions on Erythrocytes by dielectrophoresis, using a three-dimensional electrode design. Iee Proceedings-Nanobiotechnology. 152 (4), 150-154 (2005).
- Abdul Razak, M. A., Hoettges, K. F., Fatoyinbo, H. O., Labeed, F. H., Hughes, M. P. Efficient dielectrophoretic cell enrichment using a dielectrophoresis-well based system. Biomicrofluidics. 7 (6), (2013).
- Hughes, M. P. O. S., Hoettges, K. F., Wattingham, R. Device for Dielectrophoretic Manipulation of Particles. , (2005).
- Heldt, C. L., et al. Stacked graphene nanoplatelet paper sensor for protein detection. Sensors and Actuators B-Chemica. 181, 92-98 (2013).
- Srivastava, S. K., Artemiou, A., Minerick, A. R. Direct current insulator-based dielectrophoretic characterization of erythrocytes: ABO-Rh human blood typing. Electrophoresis. 32 (18), 2530-2540 (2011).
- Leonard, K. M., Minerick, A. R. Explorations of ABO-Rh antigen expressions on erythrocyte dielectrophoresis: Changes in cross-over frequency. Electrophoresis. 32 (18), 2512-2522 (2011).
- Srivastava, S. K., Daggolu, P. R., Burgess, S. C., Minerick, A. R. Dielectrophoretic characterization of erythrocytes: Positive ABO blood types. Electrophoresis. 29 (24), 5033-5046 (2008).
- Minerick, A. R. The rapidly growing field of micro and nanotechnology to measure living cells. AIChE Journal. 54 (9), 2230-2237 (2008).
- Garza-Garcia, L. D., Perez-Gonzalez, V. H., Perez-Sanchez, O. A., Lapizco-Encinas, B. H. Electrokinetic Mobilities Characterization and Rapid Detection of Microorganisms in Glass Microchannels. Chemical Engineering & Technology. 34 (3), 371-378 (2011).
- Lopez-de la Fuente, M. S., et al. An electric stimulation system for electrokinetic particle manipulation in microfluidic devices. Rev Sci Instrum. 84 (3), (2013).
- Chen, D. F., Du, H., Li, W. H. A 3D paired microelectrode array for accumulation and separation of microparticles. Journal of Micromechanics and Microengineering. 16 (7), 1162-1169 (2006).
- Chu, H., Doh, I., Cho, Y. H. A three-dimensional (3D) particle focusing channel using the positive dielectrophoresis (pDEP) guided by a dielectric structure between two planar electrodes. Lab on a Chip. 9 (5), 686-691 (2009).
- Millet, L. J., Park, K., Watkins, N. N., Hsia, K. J., Bashir, R. Separating beads and cells in multi-channel microfluidic devices using dielectrophoresis and laminar flow. J Vis Exp. , (2011).
- Weiss, N. G., et al. Dielectrophoretic mobility determination in DC insulator-based dielectrophoresis. Electrophoresis. 32 (17), 2292-2297 (2011).
- Auerswald, J., Knapp, H. F. Quantitative assessment of dielectrophoresis as a micro fluidic retention and separation technique for beads and human blood erythrocytes. Microelectronic Engineering. 67-8, 879-886 (2003).
- Park, S., Zhang, Y., Wang, T. H., Yang, S. Continuous dielectrophoretic bacterial separation and concentration from physiological media of high conductivity. Lab on a Chip. 11 (17), 2893-2900 (2011).
- Sun, T., Holmes, D., Gawad, S., Green, N. G., Morgan, H. High speed multi-frequency impedance analysis of single particles in a microfluidic cytometer using maximum length sequences. Lab on a Chip. 7 (8), 1034-1040 (2007).
- Hughes, M. P., Morgan, H. Dielectrophoretic Characterization and Separation of Antibody-Coated Submicrometer Latex Spheres. Analytical Chemistry. 71 (16), 3441-3445 (1999).
- Liang, W. F., et al. Simultaneous separation and concentration of micro- and nano-particles by optically induced electrokinetics. Sensors and Actuators a-Physical. 193, 103-111 (2013).
- White, C. M., Holland, L. A., Famouri, P. Application of capillary electrophoresis to predict crossover frequency of polystyrene particles in dielectrophoresis. Electrophoresis. 31 (15), 2664-2671 (2010).
- Wu, J., Ben, Y. X., Battigelli, D., Chang, H. C. Long-range AC electroosmotic trapping and detection of bioparticles. Industrial & Engineering Chemistry Research. 44 (8), 2815-2822 (2005).
- Zhou, H., White, L. R., Tilton, R. D. Lateral separation of colloids or cells by dielectrophoresis augmented by AC electroosmosis. J Colloid Interface Sci. 285 (1), 179-191 (2005).
- Green, N. G., Ramos, A., Gonzalez, A., Morgan, H., Castellanos, A. Fluid flow induced by nonuniform ac electric fields in electrolytes on microelectrodes I. Experimental measurements. Phys Rev E Stat Phys Plasmas Fluids Relat Interdiscip Topics. 61 (4 Pt B), 4011-4018 (2000).
- Green, N. G., Ramos, A., Gonzalez, A., Castellanos, A., Morgan, H. Electrothermally induced fluid flow on microelectrodes. Journal of Electrostatics. 53 (2), 71-87 (2001).
- Gonzalez, A., Ramos, A., Morgan, H., Green, N. G., Castellanos, A. Electrothermal flows generated by alternating and rotating electric fields in microsystems. Journal of Fluid Mechanics. 564, 415-433 (2006).
- Park, S., Koklu, M., Beskok, A. Particle trapping in high-conductivity media with electrothermally enhanced negative dielectrophoresis. Anal Chem. 81 (6), 2303-2310 (2009).
- Sin, M. L., Gau, V., Liao, J. C., Wong, P. K. Electrothermal Fluid Manipulation of High-Conductivity Samples for Laboratory Automation Applications. JALA Charlottesv Va. 15 (6), 426-432 (2010).
- Liao, S. -H., Cheng, I. F., Chang, H. -C. Precisely sized separation of multiple particles based on the dielectrophoresis gradient in the z-direction. Microfluidics and Nanofluidics. 12 (1-4), 201-211 (2012).
- Gencoglu, A., Minerick, A. Chemical and morphological changes on platinum microelectrode surfaces in AC and DC fields with biological buffer solutions. Lab on a Chip. 9 (13), 1866-1873 (2009).
- Bocchi, M., et al. Dielectrophoretic trapping in microwells for manipulation of single cells and small aggregates of particles. Biosensors & Bioelectronics. 24 (5), 1177-1183 (2009).
- Li, P., Stratton, Z. S., Dao, M., Ritz, J., Huang, T. J. Probing circulating tumor cells in microfluidics. Lab on a Chip. , (2013).
- Rimmele, T., Kellum, J. A. Clinical review: Blood purification for sepsis. Critical Care. 15 (1), (2011).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados