このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
3Dグラフェン電極誘電泳動デバイスの開発
要約
ハイスループット電位を有するマイクロデバイスは、新規の材料と三次元(3D)誘電泳動(DEP)を示すために使用される。グラフェンナノ小板紙や両面テープを交互に積層した。 700ミクロンのマイクロウェルは、層に対して横方向に掘削された。ポリスチレンビーズのDEP挙動は、マイクロウェルにおいて実証された。
要約
厚さ50μmのグラフェン紙と100μmの両面テープを用いた新規の3D電極マイクロデバイスの設計および製造が記載されている。プロトコルは、汎用性、再利用可能な、複数層積層誘電泳動槽を構築するための手順を詳しく説明します。具体的には、6つの50ミクロン×0.7センチメートル×2センチメートルグラフェン紙の層と、両面テープ5層が交互に積層されたが、スライドガラスにクランプ。次いで、700μmの直径のマイクロウェルは、コンピュータ制御された微細穿孔機を用いて積層構造を貫通して穿孔した。隣接するグラフェン層の間のテープ層の絶縁性、抵抗性試験によって保証された。銀の導電性エポキシは、グラフェン紙の交互の層を接続し、グラフェン紙と外部銅線電極間の安定した接続を形成した。完成した装置は、クランプされ、スライドガラスに封入した。電場勾配をt内でモデル化された彼は、多層デバイス。 6μmのポリスチレンビーズの誘電泳動挙動は、0.0001〜S / mの1.3 S / mの範囲の導電率を有する媒体ディープウェルマイクロ1mmので実証し、10メガヘルツから100 Hzの信号周波数を適用した。負の誘電泳動応答は、導電周波数空間の大部分にわたって3次元で観察され、クロスオーバー周波数の値は、以前に報告された文献値と一致していた。デバイスはそれぞれ、低周波数および高周波数領域において発生した、交流電気浸透や電熱フローを防ぐことはできませんでした。このデバイスで利用されるグラフェン紙は用途が広く、誘電泳動特性化が完了した後に、その後、バイオセンサーとして機能することができる。
概要
グラフェンは、その高品質の電子的性質および潜在的な化学的バイオセンサの用途1で知られる小説素材です。グラフェンナノプレートレットは、触媒支持体2、3、4バイオセンサー、スーパーキャパシタ5、グラフェン/ポリアニリンおよびシリコンナノ粒子/グラフェン複合材料6-8を含む複合電極のために使用されている。この原稿は、ユニークな3次元(3D)内の電極は、層状マイクロ流体デバイスとしてグラフェン紙の利用を説明しています。グラフェン紙の電極は、絶縁性両面テープとポリスチレンビーズの3D AC誘電泳動が行われたチャンバー内に穿孔して積層した。
誘電泳動(DEP)は、不均一な電場下での分極性粒子の移動を指す。粒子は、多かれ少なかれ分極周囲の媒体、RESUよりあるとき、正のDEP(PDEP)または負のDEP(NDEP)が発生それぞれ、最強または最弱電場に向けた動きにlting。この非線形の動電学的ツールは、並べ替えトラッピング、および粒子及び9-15生物細胞の同定、分離のために使用されている。偏粒子によって経験される誘電泳動力は、電場勾配、粒子径および形状、導電率及び誘電率を含む粒子の誘電特性、ならびにメディア伝導性及び誘電率の関数である。従来の2次元(2D)DEPにおいて、粒子の移動は、典型的には、微細加工された表面電極との間に形成される電場勾配の主平面にあり;垂直方向の移動は、ほとんどのデバイスの面内方向に比べて無視できる程度である。しかし、3D DEPのための電場勾配のこの3次元を活用することは、より高いサンプルスループットを可能にし、流れがラーベである新しい改良誘電泳動分離を設計するために汎用性を高めRSEフィールドに16、17を勾配。他の特定の設計は、3D絶縁体ベースのDEP 18、DEP 10を電気3Dカーボン電極DEP 13、19、および3Dが含まれています。 3D構造の研究により証明されるように、そのようなデバイスは、より高いスループットを達成するために、連続フローモードで動作させることができる。我々の3D積層装置における3次元粒子移動の観察は、異なる焦点高さで光学顕微鏡を介して周波数及び導電性媒体の関数として達成される。
Fatoyinbo らは、第交互に積層さ30μmのアルミニウム箔と150μmのエポキシ樹脂膜20を用いて電極/絶縁構造積層3DでDEPを報告した。ヒュブナーらは、その後、35ミクロンの銅テープと118ミクロンのポリイミド接着剤21と同じような3D積層電極を設計しました。この作品は3Dウェルデザイン22、23を借用、および独自に密封し、十分な電気シールドを達成し、絶縁層として、導電層と100μmの両面テープとして50μmのグラフェン紙の利便性を利用しています。グラフェンナノプレートレットが同時にこのグループに以前に24を示したバイオセンサーとして作用する能力を有するため、グラフェン紙の汎用性は、3D電極マイクロデバイスのための明確な利点である。
グラフェン紙/ポリマー内で達成磁場勾配は、3Dマイクロデバイスは、マイクロウェルの寸法は、グラフェン紙層と、印加される電界に依存して積層されている。限界寸法は、縦電極間隔(層の厚さを行い、絶縁膜)とマイクロウェルの直径と高さ(積層によって測定)が挙げられる。電気信号は振幅および周波数を介して調整することができる。現在のデバイス構造は、バッチ操作のためであるが、連続フロー装置に合わせて調整することができる。デバイスFABここで説明rication技術は、単に利用グラフェン紙を交換することにより、グラフェンナノ小板特性の多種多様な3次元積層電極を開発するために適している。グラフェン紙を利用する利点は、物理的および化学的特性の多様性、低減費用であり、バイオセンサーがbioanalytes 24の広い範囲を検出するようにグラフェンナノプレートレットが同時に作用することができる。高スループット3D DEPシステムの長期的な目標は、急速な細胞型を25〜27を特定したり、健康な細胞28の集団からの疾患細胞のラベルフリー電気媒介細胞選別を達成することである。本論文では、材料の最適化とイラストと、典型的な結果の分析に続いて、デバイスの準備と操作を示しています。
プロトコル
1。積層電極/絶縁3D構造を作製
- 6グラフェン層のために、5テープ層デバイスは、6 0.7センチメートル×1.5センチの長方形にメスまたは類似のカミソリの刃とストレートエッジの定規でグラフェン紙を切り、5 1.3センチメートルに両面粘着テープをカットするはさみを使用してX〜5cmのストライプ。
NOTE: 図1aに示すように、これは3接地電極、3 AC信号電極装置が得られる。層幅を行う7ミリメートル、簡単掘削のため、まだ十分に広い、スライドガラス上に収まるほど狭い。 2ミリメートルの長さを容易に繰り返し使用すると分解し、銅線を取り付けるための十分な余地がありません。デバイスの深さは、エンドミルの深さによって制限される。 - 清浄なガラススライド上にグラフェン紙の第1の層を敷く。ゆっくりつの隣接するグラフェン紙層( 図1b間の絶縁を確保する〜2mmの余白を残して、テープの一方のストライプでグラフェン紙の一端を覆う)。
- グラフェン紙( 図1a)の第一の層にオフセットテープの上にグ ラフェン紙の第二の層を配置します。層の間の良好なシールを確保するために、各電層を添加した後に中程度の圧力(親指で均一に押して、〜100 N 0.7以上のCM 2エリア)を適用します。
- 繰り返し上下層のグラフェン紙の両方を残して、1.2および残りの層のための1.3を繰り返します。グラフェン紙層( 図1b)との間の密封された絶縁性を確保する小〜1mmの余白を残して、デバイスの縁から過剰なテープを除去するために、図1bに示される点線に沿って切断する。
NOTE:両面テープをこの積層構造は、穿孔スライド上に取り付け、試料が充填されているようにデブリを収集避けるために頂部および底部層として利用されない。 - マルチメータ(抵抗モード)でのクイック絶縁試験を行う。目の二つの異なる側面に正と負のプローブを配置する電子デバイス( 図1c上のAおよびB);高抵抗(メガオームキロまで)は、層の間の良好な絶縁を示している。マイクロウェル掘削の準備をガラススライドから層状構造を削除します。
注:隣接グラフェン紙層がステップ1.4を通じて1.2の間に接触すると、デバイスは通常、絶縁試験を失敗した。そのようなデバイスを廃棄します。
2。積層構造にマイクロウェルドリル
- コンピュータ制御された機械式のマイクロフライス盤を使用し、直径700ミクロンカットの2.1ミリメートルの長さのエンドミルを選択します。 ( 図2aおよびb)は 、適切なクランプを使用したマイクロフライスステージ上の積層構造を固定化する。ゆっくりにして、積層構造の中心を通ってエンドミルを下げた後、8600 rpmでフライス盤の主軸を実行します。内壁を滑らかにするために、マイクロウェルを通して上下に回転するエンドミルを移動します。
- マイクロウェルを選択してくださいカットアスペクト比の利用可能なエンドミル径/長さによって制約される直径。マイクロウェルの内面はマイクロウェルを通して最適な電場勾配と光を通過させるため、可能な限り垂直、汚れていないことを確認。
- 加圧された空気とのマイクロウェルからきれいな破片。 1.5で説明したように、他の絶縁試験を行う。
3。積層構造に電気リードを取り付け
- 2センチメートルで直角に2つの3 cmの長さ32のG銅線をまとめておきます。 A部と銀導電性エポキシのBを〜1.5ミリリットルを混ぜる。
注: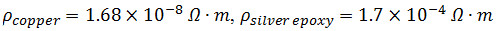
- 手動積層構造( 図1c)の側面A上に層の間の良好な接触を確実にするために上部および全グラフェン紙層の先端に混合銀エポキシを適用し、次いでエポキシ1cmの銅線の端部を配置し、任意の2つの間のレイヤー。そっと平方過剰のエポキシを除去し、良好な電気的接触を確実にするための層をueeze。積層構造のB面に対して繰り返します。
- 一晩で70℃、1気圧を乾燥させるために、オーブンラックにデバイス全体を配置します。
4。サンプルおよびメディアを準備
- 導電率計を用いて導電率のスペクトルは、290 mMのマンニトールストック溶液および等張リン酸緩衝生理食塩水(PBS)の連続添加の等張性媒体を調製する。
注:線形相関は、〜290ミリオスモル/ Lのマンニトール溶液(非導通)に(導通)〜290ミリオスモル/ LのPBSの導電率と体積濃度の間に存在する。ビデオは0.01 S / M伝導媒体を提供しています。 - 体積比:1:50 VOLに準備された導電性媒体や電子純水(〜5×10 -6 S / m)でポリスチレンビーズをミックス。このプロトコルは、同様に、生体細胞に容易に適合される。
5。セットアップ実験とデバイスを操作
- デバイスOをクランプ修正された紙のクランプまたは同等を使用して、中程度の圧力( 図2d)でガラススライドNTO。フッタは、試料の漏れを防止するガラススライドに積層構造をシールするマイクロウェルに十分に近くなければならない。クランプは、積層構造の変形を防止するように最適化圧力)で顕微鏡ステージ内に収まると、b)マイクロウェル流体が漏れないようにする必要があります。変形は、実験の再現性を低下させるだけでなく形状および光路を変化させる。
- マイクロシリンジまたは同等を使用して、ゆっくりとマイクロウェルへの試料の〜1μLを注入し、気泡を導入することは避けてください。必要に応じて注射を繰り返し、鋭い針をマイクロウェルの壁を損傷しないように注意してください。少しのマイクロウェルを入れすぎて、すぐ、余分な水分を取り除く蒸発を防ぐため、各実験のための再現可能なボリュームを確保するために、マイクロウェルの上にカバーガラスをスライドさせます。
注:SCORにうまく機能glasscutterダイヤモンドチップサイズにカバーガラスをEと割れ。 - 顕微鏡のステージに完成した積層マイクロデバイスを固定し、デバイス上の2つの銅のリードにファンクション·ジェネレータの電極ワイヤを接続します。 AxioVisionの(ツァイスソフトウェア)では、多次元取得モードでカメラの録画を開始するためのボタンをクリックします。印加による電界のない応答を記録するためにCCDカメラの記録を開始してから一定期間において関数発生器信号を開始する。
注:ここでは、15V のピーク·ピーク信号と10MHzの周波数を100Hzに適用し、実験は、フィールドなしで2秒間、ガラススライド表面上に1から200までの10倍の倍率で観察し、フィールドで〜5分が適用された。画像がデジタルでさらに分析するために毎秒1から5フレーム(fps)で保存されました。 - 実験が完了すると、デバイスを削除し、クランプを解体。石鹸水でのガラススライドとデバイスの両方を浸し、その後よくすすいでください。 30時間程度のデバイスを再利用一貫性のあるパフォーマンスでS。
6。データ解析と画像処理
- このようなImageJのような好ましいソフトウェア、画像データを分析します。与えられた時間ステップでの連続した画像間の粒子変位から速度を計算。
- トレンドをコンパイルし、理論29と比較するために、速度に基づいて、実験のDEP力と電界強度を計算します。
- 半径方向に電場勾配の形状に一致するマイクロウェルジオメトリのメジャー粒子速度。マイクロウェルのエッジから中心に、7地域で、その結果、8同心の等電輪郭(350、300、···50、0μm)を識別します。
NOTE:50μmの距離を横断する粒子のための時間は、速度を計算するために使用した。幾何学的な変動は、それを必要とする場合は、等電点電気輪郭がわずかに調整した。
結果
6ミクロンのポリスチレンビーズ上に誘電泳動実験0.38 mm 3のシリンドリカルマイクロウェル中で行った。結果は、3次元グラフェン紙ベースのデバイスは、3D金属箔積層装置20,21、従来の2Dの金属電極26、27と同様の誘電泳動署名を示し、2D絶縁装置25ができる積層していることを実証する。以下の実験では、15 V のピーク·ピーク AC信号が印加され、周波数...
ディスカッション
この原稿は、新規6グラフェン層と5テープ層のマイクロデバイスを製造するためのプロトコルの詳細について説明します。さらに、デバイスの動作は、固有の、幾何学的に関連する粒子速度分析手法と共に6.08ミクロンのポリスチレンビーズの観察されたDEP挙動を介して図示されている。同等に信頼できる結果を得ながら、非線形動電デバイスを構築するためのこの多目的なアプローチは、電?...
開示事項
著者らは、開示する競合がない。
謝辞
グラフェン紙の寛大な寄付のためのXG科学に感謝します。寛大に私たちは、マイクロ掘削装置を使用させるための博士でフリードリヒに感謝します。特別な感謝は、ビデオを語るためのTayloriaアダムスに拡張されます。
資料
| Name | Company | Catalog Number | Comments |
| Polystyrene Beads | Spherotech, Inc. | PP-60-10 | 6.08 μm diameter |
| Graphene paper | XG Sciences, Inc. | XG Leaf B-072 | |
| Double sided tape | 3M | N/A | 136 office tape |
| Silver conductive epoxy | MG chemicals | 8331-14G | Part A & B included |
| Mannitol | Sigma Aldrich | 091M0020V | |
| Phosphate buffer saline | OmniPur | 0381C490 | |
| Microscope (CCD Camera) | Zeiss | Axiovert 200M | |
| Function/waveform generator | Agilent | 33250A | |
| Syringe | Hamilton | 84505 | |
| Paper Clamp | ADAMS | 3300-50-3848 | |
| Oven | Fisher Scientific | 280A | |
| Multimeter | OMEGA | HHM25 | |
| Micro-milling machine | AEROTECH | ABL1500 stages/A3200 Npaq controller | |
| End mill | ULTRATOOL | 708473 | |
| AxioVision | Zeiss | Version 4.8 |
参考文献
- Geim, A. K., Novoselov, K. S. The rise of graphene. Nature Materials. 6 (3), 183-191 (2007).
- Jafri, R. I., Rajalakshmi, N., Ramaprabhu, S. Nitrogen doped graphene nanoplatelets as catalyst support for oxygen reduction reaction in proton exchange membrane fuel cell. Journal of Materials Chemistry. 20 (34), 7114-7117 (2010).
- Kavan, L., Yum, J. H., Gratzel, M. Graphene Nanoplatelets Outperforming Platinum as the Electrocatalyst in Co-Bipyridine-Mediated Dye-Sensitized Solar Cells. Nano Letters. 11 (12), 5501-5506 (2011).
- Aravind, S. S. J., Baby, A. T. T., Arockiadoss, T., Rakhi, R. B., Ramaprabhu, S. A cholesterol biosensor based on gold nanoparticles decorated functionalized graphene nanoplatelets. Thin Solid Films. 519 (16), 5667-5672 (2011).
- Si, P., Ding, S. J., Lou, X. W., Kim, D. H. An electrochemically formed three-dimensional structure of polypyrrole/graphene nanoplatelets for high-performance supercapacitors. Rsc Advances. 1 (7), 1271-1278 (2011).
- Wang, D. -. W., et al. Fabrication of Graphene/Polyaniline Composite Paper via In Situ Anodic Electropolymerization for High-Performance Flexible Electrode. ACS Nano. 3 (7), 1745-1752 (2009).
- Lee, J. K., Smith, K. B., Hayner, C. M., Kung, H. H. Silicon nanoparticles-graphene paper composites for Li ion battery anodes. Chem Commun (Camb). 46 (12), 2025-2027 (2010).
- Kavan, L., Yum, J. H., Gratzel, M. Optically Transparent Cathode for Dye-Sensitized Solar Cells Based on Graphene Nanoplatelets. ACS Nano. 5 (1), 165-172 (2011).
- Martinez-Duarte, R. Microfabrication technologies in dielectrophoresis applications--a review. Electrophoresis. 33 (21), 3110-3132 (2012).
- Yamamoto, M., et al. Patterning with particles using three-dimensional interdigitated array electrodes with negative dielectrophoresis and its application to simple immunosensing. Electrochimica Acta. 82, 35-42 (2012).
- Doh, I., Kim, Y., Cho, Y. H. A particle trapping chip using the wide and uniform slit formed by a deformable membrane with air bubble plugs. Current Applied Physics. 13 (5), 902-906 (2013).
- Lin, S. C., Lu, J. C., Sung, Y. L., Lin, C. T., Tung, Y. C. A low sample volume particle separation device with electrokinetic pumping based on circular travelling-wave electroosmosis. Lab on a Chip. 13 (15), 3082-3089 (2013).
- Martinez-Duarte, R., Camacho-Alanis, F., Renaud, P., Ros, A. Dielectrophoresis of lambda-DNA using 3D carbon electrodes. Electrophoresis. 34 (7), 1113-1122 (2013).
- Yang, S. M., Tseng, S. Y., Chen, H. P., Hsu, L., Liu, C. H. Cell patterning via diffraction-induced optoelectronic dielectrophoresis force on an organic photoconductive chip. Lab on a Chip. 13 (19), 3893-3902 (2013).
- Srivastava, S. K., Gencoglu, A., Minerick, A. R. DC insulator dielectrophoretic applications in microdevice technology: a review. Anal Bioanal Chem. 399 (1), 301-321 (2011).
- Liao, S. H., Cheng, I. F., Chang, H. C. Precisely sized separation of multiple particles based on the dielectrophoresis gradient in the z-direction. Microfluidics and Nanofluidics. 12 (1-4), 1-4 (2012).
- Bajaj, P., Marchwiany, D., Duarte, C., Bashir, R. Patterned three-dimensional encapsulation of embryonic stem cells using dielectrophoresis and stereolithography. Adv Healthc Mater. 2 (3), 450-458 (2013).
- Braff, W. A., Pignier, A., Buie, C. R. High sensitivity three-dimensional insulator-based dielectrophoresis. Lab Chip. 12 (7), 1327-1331 (2012).
- Martinez-Duarte, R., Gorkin 3rd, R. A., Abi-Samra, K., Madou, M. J. The integration of 3D carbon-electrode dielectrophoresis on a CD-like centrifugal microfluidic platform. Lab Chip. 10 (8), 1030-1043 (2010).
- Fatoyinbo, H. O., Kamchis, D., Whattingham, R., Ogin, S. L., Hughes, M. P. A high-throughput 3-D composite dielectrophoretic separator. Ieee Transactions on Biomedical Engineering. 52 (7), 1347-1349 (2005).
- Hubner, Y., Hoettges, K. F., Kass, G. E. N., Ogin, S. L., Hughes, M. P. Parallel measurements of drug actions on Erythrocytes by dielectrophoresis, using a three-dimensional electrode design. Iee Proceedings-Nanobiotechnology. 152 (4), 150-154 (2005).
- Abdul Razak, M. A., Hoettges, K. F., Fatoyinbo, H. O., Labeed, F. H., Hughes, M. P. Efficient dielectrophoretic cell enrichment using a dielectrophoresis-well based system. Biomicrofluidics. 7 (6), (2013).
- Hughes, M. P. . O. S., Hoettges, K. F., Wattingham, R. . Device for Dielectrophoretic Manipulation of Particles. , (2005).
- Heldt, C. L., et al. Stacked graphene nanoplatelet paper sensor for protein detection. . Sensors and Actuators B-Chemica. 181, 92-98 (2013).
- Srivastava, S. K., Artemiou, A., Minerick, A. R. Direct current insulator-based dielectrophoretic characterization of erythrocytes: ABO-Rh human blood typing. Electrophoresis. 32 (18), 2530-2540 (2011).
- Leonard, K. M., Minerick, A. R. Explorations of ABO-Rh antigen expressions on erythrocyte dielectrophoresis: Changes in cross-over frequency. Electrophoresis. 32 (18), 2512-2522 (2011).
- Srivastava, S. K., Daggolu, P. R., Burgess, S. C., Minerick, A. R. Dielectrophoretic characterization of erythrocytes: Positive ABO blood types. Electrophoresis. 29 (24), 5033-5046 (2008).
- Minerick, A. R. The rapidly growing field of micro and nanotechnology to measure living cells. AIChE Journal. 54 (9), 2230-2237 (2008).
- Garza-Garcia, L. D., Perez-Gonzalez, V. H., Perez-Sanchez, O. A., Lapizco-Encinas, B. H. Electrokinetic Mobilities Characterization and Rapid Detection of Microorganisms in Glass Microchannels. Chemical Engineering & Technology. 34 (3), 371-378 (2011).
- Lopez-de la Fuente, M. S., et al. An electric stimulation system for electrokinetic particle manipulation in microfluidic devices. Rev Sci Instrum. 84 (3), (2013).
- Chen, D. F., Du, H., Li, W. H. A 3D paired microelectrode array for accumulation and separation of microparticles. Journal of Micromechanics and Microengineering. 16 (7), 1162-1169 (2006).
- Chu, H., Doh, I., Cho, Y. H. A three-dimensional (3D) particle focusing channel using the positive dielectrophoresis (pDEP) guided by a dielectric structure between two planar electrodes. Lab on a Chip. 9 (5), 686-691 (2009).
- Millet, L. J., Park, K., Watkins, N. N., Hsia, K. J., Bashir, R. Separating beads and cells in multi-channel microfluidic devices using dielectrophoresis and laminar flow. J Vis Exp. , (2011).
- Weiss, N. G., et al. Dielectrophoretic mobility determination in DC insulator-based dielectrophoresis. Electrophoresis. 32 (17), 2292-2297 (2011).
- Auerswald, J., Knapp, H. F. Quantitative assessment of dielectrophoresis as a micro fluidic retention and separation technique for beads and human blood erythrocytes. Microelectronic Engineering. 67-8, 879-886 (2003).
- Park, S., Zhang, Y., Wang, T. H., Yang, S. Continuous dielectrophoretic bacterial separation and concentration from physiological media of high conductivity. Lab on a Chip. 11 (17), 2893-2900 (2011).
- Sun, T., Holmes, D., Gawad, S., Green, N. G., Morgan, H. High speed multi-frequency impedance analysis of single particles in a microfluidic cytometer using maximum length sequences. Lab on a Chip. 7 (8), 1034-1040 (2007).
- Hughes, M. P., Morgan, H. Dielectrophoretic Characterization and Separation of Antibody-Coated Submicrometer Latex Spheres. Analytical Chemistry. 71 (16), 3441-3445 (1999).
- Liang, W. F., et al. Simultaneous separation and concentration of micro- and nano-particles by optically induced electrokinetics. Sensors and Actuators a-Physical. 193, 103-111 (2013).
- White, C. M., Holland, L. A., Famouri, P. Application of capillary electrophoresis to predict crossover frequency of polystyrene particles in dielectrophoresis. Electrophoresis. 31 (15), 2664-2671 (2010).
- Wu, J., Ben, Y. X., Battigelli, D., Chang, H. C. Long-range AC electroosmotic trapping and detection of bioparticles. Industrial & Engineering Chemistry Research. 44 (8), 2815-2822 (2005).
- Zhou, H., White, L. R., Tilton, R. D. Lateral separation of colloids or cells by dielectrophoresis augmented by AC electroosmosis. J Colloid Interface Sci. 285 (1), 179-191 (2005).
- Green, N. G., Ramos, A., Gonzalez, A., Morgan, H., Castellanos, A. Fluid flow induced by nonuniform ac electric fields in electrolytes on microelectrodes I. Experimental measurements. Phys Rev E Stat Phys Plasmas Fluids Relat Interdiscip Topics. 61 (4 Pt B), 4011-4018 (2000).
- Green, N. G., Ramos, A., Gonzalez, A., Castellanos, A., Morgan, H. Electrothermally induced fluid flow on microelectrodes. Journal of Electrostatics. 53 (2), 71-87 (2001).
- Gonzalez, A., Ramos, A., Morgan, H., Green, N. G., Castellanos, A. Electrothermal flows generated by alternating and rotating electric fields in microsystems. Journal of Fluid Mechanics. 564, 415-433 (2006).
- Park, S., Koklu, M., Beskok, A. Particle trapping in high-conductivity media with electrothermally enhanced negative dielectrophoresis. Anal Chem. 81 (6), 2303-2310 (2009).
- Sin, M. L., Gau, V., Liao, J. C., Wong, P. K. Electrothermal Fluid Manipulation of High-Conductivity Samples for Laboratory Automation Applications. JALA Charlottesv Va. 15 (6), 426-432 (2010).
- Liao, S. -. H., Cheng, I. F., Chang, H. -. C. Precisely sized separation of multiple particles based on the dielectrophoresis gradient in the z-direction. Microfluidics and Nanofluidics. 12 (1-4), 201-211 (2012).
- Gencoglu, A., Minerick, A. Chemical and morphological changes on platinum microelectrode surfaces in AC and DC fields with biological buffer solutions. Lab on a Chip. 9 (13), 1866-1873 (2009).
- Bocchi, M., et al. Dielectrophoretic trapping in microwells for manipulation of single cells and small aggregates of particles. Biosensors & Bioelectronics. 24 (5), 1177-1183 (2009).
- Li, P., Stratton, Z. S., Dao, M., Ritz, J., Huang, T. J. Probing circulating tumor cells in microfluidics. Lab on a Chip. , (2013).
- Rimmele, T., Kellum, J. A. Clinical review: Blood purification for sepsis. Critical Care. 15 (1), (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved