Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
3D Grafen Elektrot dielektroforetik Cihazı Geliştirilmesi
Bu Makalede
Özet
Yüksek verimli bir potansiyele sahip olan yeni microdevice malzemeler ile üç boyutlu (3D) dielektroforez (DEP) göstermek için kullanılır. Grafen nanoplatelet kağıt ve çift taraflı bant dönüşümlü yığılmış; 700 ml'lik bir mikro-gözenekli tabakaların enine delinmiştir. Polistiren boncuklar DEP davranışı mikro iyi gösterilmiştir.
Özet
50 mikron kalınlığında grafen kağıdı ve 100 mikron çift taraflı bant kullanarak yeni bir 3D elektrot mikrocihazda tasarım ve imalat açıklanmıştır. Protokol çok yönlü, yeniden kullanılabilir, çoklu katman, lamine dielektroforez odasını oluşturmak için prosedürleri ayrıntıları. Özel olarak, x 0.7 cm x 2 cm graphene kağıt 50 um ve çift taraflı bant beş kat altı tabakaları dönüşümlü olarak bir araya konmuş, daha sonra, bir cam slayt kenetlenir. Daha sonra, bir 700 mikron çapında mikro zamanda bir bilgisayar kontrollü mikro delme makinesi kullanılarak tabakalı yapısı ile delinmiştir. Komşu grafen katmanları arasında bant tabakasının yalıtım özellikleri direnç testleri ile güvence verildi. Gümüş iletken epoksi grafen kağıdı alternatif katmanları bağlı ve grafen kağıdı ve dış bakır tel elektrotlar arasında istikrarlı bağlantıları kurdu. Bitmiş cihaz kilitlenir ve daha sonra, cam bir kapak ile kapatılır. Elektrik alan degrade t içinde modellenmişO çok katmanlı cihaz. 6 um polistiren boncuklar dielelektroforetik davranışları 0.0001 S / m 1.3 S / m arasında değişen orta iletkenlik derin mikro de 1 mm gösterdiği ve 10 MHz 100 Hz sinyal frekansları uygulanmıştır. Olumsuz dielelektroforetik tepkiler frekans değerleri, daha önce bildirilen literatür değerleri ile tutarlıdır iletkenlik frekans alanı ve çaprazlama en fazla üç boyutlu olarak gözlenmiştir. Cihaz AC elektroozmoz ve elektro-düşük ve yüksek frekans bölgelerinde meydana gelen akışları, sırasıyla engel olamadı. Bu cihazın kullanılan grafen kağıdı yönlüdür ve dielektroforetik karakterizasyonu tamamlandıktan sonra sonradan bir biyosensör olarak işlev olabilir.
Giriş
Grafen yüksek kaliteli elektronik özellikleri ve potansiyel kimyasal ve biyosensör uygulamalarında 1 için bilinen yeni bir malzemedir. Grafen nanoplatelets katalizör desteği 2, 3, 4 biyosensörler, süper kondansatör 5 ve grafin / polianilin ve silikon nanopartikül / graphene kompozitler 6-8 içeren kompozit elektrotlar kullanılmaktadır. Bu el yazması eşsiz bir üç boyutlu (3D) elektrotlar, katmanlı mikroakışkan cihazı olarak grafen kağıdı kullanımını açıklar. Grafen kağıt elektrotlar olarak yalıtkan, çift taraflı bant ve polistiren boncuklar 3D AC dielektroforez uygulandı, içinde delinmiş bir bölme ile lamine edilmiştir.
Dielektroforez, (DEP) eşit olmayan elektrik alanlarının altında polarize parçacıkların hareketi ifade eder. Partiküller daha fazla veya daha az polarize olabilir çevreleyen ortam, resu daha olduğunda pozitif DEP (pDEP) veya negatif DEP (NDEP) ortaya çıkarsırasıyla, güçlü ya da zayıf elektrik alanına doğru hareketi lting. Bu doğrusal olmayan elektrokinetik aracı, ayırma yakalama ve parçacıklar ve biyolojik hücre kimlik, 9-15 arasında, ayrılması için kullanılmıştır. Bir polarize parçacığın karşılaştığı dielektroforetik kuvvet elektrik alan gradyan, partikül çapı ve şekli, iletkenlik ve geçirgenlik gibi parçacık dielektrik özelliklerinin yanı sıra medya iletkenlik ve geçirgenlik bir fonksiyonudur. Geleneksel iki boyutlu (2B) DEP olarak, tipik haliyle parçacık hareket mikrofabrike yüzeye elektrotlar arasında oluşan elektrik alanının gradyanı birincil düzleminde olduğu; dikey yönde hareket en cihazlarda in-düzlem yönlerde kıyasla ihmal edilebilir düzeydedir. Ancak, 3D DEP için elektrik alan degradelerin bu üçüncü boyut koşan daha yüksek örnek sağlar ve akış trave olduğu yeni ve geliştirilmiş dielektroforetik ayrımlarını tasarım çok yönlülüğü artırıralana RSE 16, 17, gradyanlar. Diğer özel tasarımlar 3D izolatör-tabanlı DEP 18, 3D karbon-elektrot DEP 13, 19, ve DEP 10 galvanik 3D içerir. 3B yapılar halinde araştırma kanıtladığı gibi, bu cihazlar yüksek verim elde etmek için sürekli bir akış modunda çalıştırılabilir. Bizim katmanlı 3B cihazında 3D parçacık hareketinin gözlenmesi farklı odak yüksekliklerde ışık mikroskobu ile frekans ve orta iletkenliğinin bir fonksiyonu olarak elde edilmektedir.
Fatoyinbo vd. Ilk alternatif yığılmış 30 mikron alüminyum folyo ve 150 mikron epoksi reçine filmleri 20 kullanılarak elektrot / yalıtım yapıya lamine bir 3D DEP bildirdi. Hubner vd. Sonra 35 mikron bakır şerit ve 118 mikron poliimit yapıştırıcı 21 ile benzer 3D lamine elektrotları tasarlanmıştır. Bu çalışma, 3D-iyi tasarım 22, 23 ödünç, Ve eşsiz bir sızdırmazlık ve yeterli elektrik koruma elde yalıtım katmanları olarak iletken tabaka ve 100 um çift taraflı bir bant olarak 50 um grafin kağıt kolaylık kullanır. Grafen nanoplatelets anda bu grup daha önce 24 gösterildiği biyosensör olarak hareket yeteneğine sahip, çünkü Grafen kağıdı yönlülüğü 3D elektrot mikrocihazlar için ayrı bir avantajdır.
Grafen kağıdı / polimer içinde elde alan eğimleri 3D mikrovasıtalar mikro kuyu boyutları, grafen kağıt katmanları ve uygulanan elektrik alan bağlıdır lamine. Kritik boyutlar dikey elektrot boşluğu (tabaka kalınlıkları iletken ve yalıtkan) ve mikro-kuyu çapı ve yüksekliği (yığılı katmanları tarafından belirlenir) içerir. Elektrik sinyali genliği ve frekansı ile ayarlanmış olabilir. Geçerli aygıt yapısı toplu işlem için, ama sürekli bir akış cihazı için uygun olabilir. Cihaz fabBurada anlatılan teknik, rication 3D sadece kullanılan grafen kağıdı alışverişi grafin nanoplatelet özelliklerinin geniş bir yelpazede olan elektrotlar lamine geliştirmek için uygundur. Grafen kağıdı kullanan Avantajları fiziksel ve kimyasal özelliklerinin çok yönlülük, azaltılmış gider, ve biyosensörler bioanalytes 24 geniş bir tespit olarak grafen nanoplatelets aynı anda hareket edebilir. Yüksek kapasiteli 3D DEP sistemlerinin uzun vadeli hedefleri hızla hücre tipleri 25-27 tanımlamak, ya da sağlıklı hücrelerin 28 popülasyonlarında hastalıklı hücrelerin etiket ücretsiz, elektriksel aracılı hücre sıralamayı elde etmek için vardır. Bu kağıt malzeme optimizasyonu ve gösterim ve tipik sonuçların analizi, ardından cihaz hazırlık ve işlem gösterilmektedir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1.. Bir Lamine Elektrot / yalıtım 3D Yapı Üretiyor
- 6 grafen tabakası için, 5 bant katmanı cihazı, altı 0.7 cm x 1.5 cm dikdörtgenler halinde bir neşter ya da benzer bir jilet ve düz kenarlı cetvel ile grafen kağıdı kesti ve beş 1.3 cm içine çift taraflı basınca duyarlı bant kesmek için makas kullanın x ~ 5 cm çizgili.
NOT: Şekil 1a'da gösterildiği gibi, bir toprak elektrotu 3, 3 AC sinyali elektrotlu bir aygıt elde edilir. Tabaka genişliği yürüten 7 mm kolay delme için yeterince geniş, henüz bir cam slayt üzerine sığacak kadar dar olduğunu. 2 mm uzunluk kolayca tekrar tekrar kullanımı üzerine kırmak ve bakır tel takmak için yeterli oda vardır değil. Cihaz derinlik derinliklerine freze ile sınırlıdır. - Temiz bir cam slayt grafen kağıdı ilk katman yatıyordu. Yavaşça iki bitişik graphene kağıt tabakaları arasında yalıtım (Şekil 1b sağlamak için bir ~ 2 mm kenar boşluğu bırakarak şeridinin bir şerit ile grafen kağıdın bir ucunu kapsar ).
- Graphene kağıt (Şekil 1a) birinci tabaka ofset bandın üzerine grafen kağıt, ikinci kat yerleştirin. Tabakalar arasında iyi bir sızdırmazlık sağlamak için, her iletken tabakanın ilave edildikten sonra orta basınç (başparmak ile muntazam pres, ~ 100 N fazla 0,7 cm 2 alan) uygulanır.
- Tekrar üst ve alt katmanları grafen kağıdı hem bırakarak, 1.2 ve kalan katmanları için 1.3 adımları. Graphene kağıt tabakası arasında yalıtım sağlamak için, küçük bir ~ 1 mm kenar boşluğu bırakarak cihaz kenarlarından fazla bandı çıkarmak için Şekil 1b de gösterildiği gibi kesikli bir hat boyunca kesilmiş (Şekil 1b).
NOT: Çift taraflı bant, bu lamine yapı olarak enkaz toplama önlemek için alt ve üst katmanlar delinmiş gibi bir slayt üzerine monte, kullanılan ve örnek ile dolu değil. - Bir multimetre (direnç modu) ile hızlı bir izolasyon testi yapın. Th iki farklı yanları üzerinde pozitif ve negatif probları yerleştirine cihazı (Şekil 1c A ve B); yüksek direnç (mega Ohm kilo kadar) katmanlar arasında iyi bir yalıtım gösterir. Mikro kuyu sondajı için hazırlamak için cam slayt katmanlı yapısını çıkarın.
NOT: komşu grafen kağıdı tabakaları adımlarla 1,4 ile 1,2 esnasında temas yaparken bir cihaz genellikle yalıtım test başarısız olur. Bu tür cihazlar atın.
2.. Lamine Yapısı Mikro-iyi Matkap
- Bir bilgisayar kontrollü mekanik mikro-freze makinesi kullanın ve bir çapı 700 mikron ve kesim 2.1 mm uzunluğunda bir uç değirmeni seçin. Uygun kelepçeler kullanılarak mikro-freze sahnede lamine yapıyı hareketsiz (Şekil 2a ve b). 8600 rpm'de freze milini çalıştırın ve ardından uç değirmen içine yavaş yavaş ve tabakalı yapının merkezi boyunca aşağı indirin. Iç duvarını yumuşatmak için mikro-kuyunun yukarı ve aşağı dönen uç değirmen taşı.
- Mikro-iyi seçinkesim boy oranları mevcut freze çap / uzunluğuna göre kısıtlı çapları. Mikro kuyusunun iç yüzeyinin mikro-gözenekli sayesinde optimal elektrik alan gradyanları ve ışık geçişi için mümkün olduğu kadar dikey ve temiz olduğundan emin olun.
- Basınçlı hava ile mikro-kuyudan temiz enkaz. 1.5 açıklandığı gibi başka bir yalıtım testi yapın.
3.. Lamine Yapısı Elektrik İlanlar takın
- 2 cm bir dik açı ile iki 3 cm uzunluğunda 32 G bakır teller katlayın. ~ Karıştırın kısım A ve gümüş iletken epoksi B 1.5 ml.
NOT: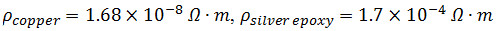
- El üstüne gümüş karışık epoksi uygulanır ve 3 grafin kağıt tabakalarının uçları tabakalı yapı (Şekil 1c) yan A tabakalar arasında iyi bir temas sağlamak için, daha sonra epoksi ve ikisi arasında 1 cm bakır tel ucunu yerleştirmek katmanları. Softly sqaşırı epoksi kaldırmak ve iyi bir elektrik teması sağlamak için katmanları ueeze. Lamine yapının yan B için tekrarlayın.
- Gece boyunca at 70 ° C ve 1 atm kuruması için, fırın rafa bütün yerleştiriniz.
4.. Numune ve Medya hazırlayın
- Bir iletkenlik ölçer kullanılarak iletkenliklerinin spektrumu, 290 mM mannitol stok çözeltisi ve izotonik fosfat tamponlu salin (PBS) içinde seri eklemeler izotonik ortam hazırlayın.
Not: A doğrusal bir ilişki ~ 290 mOsm / L mannitol çözeltisi (iletken olmayan) in (iletken) ~ 290 mOsm / L PBS iletkenliği ve hacim konsantrasyonu arasında bulunmaktadır. Video 0.01 S / m iletkenlik bir ortam sunmaktadır. - Vol oranı: 01:50 hac için hazırlanan iletkenlik medya ya da e-saf su (~ 5 x 10 -6 S / m) ile polistiren boncuklar karıştırın. Bu protokol de biyolojik hücrelere kolaylıkla uyarlanabilir.
5.. Kurulum Deney ve Aygıtı İşlet
- Cihaz o Kelepçetadil edilmiş kağıt kelepçeler veya eşdeğeri kullanılarak orta basınç (Şekil 2d) ile bir cam slayt nBu. Temeller örnek sızıntının önlenmesi cam slayt lamine yapıyı mühür mikro-kuyuya kadar yakın olmalıdır. Kelepçe katmanlı yapısının deformasyonunu önlemek için optimize edilmiş bir basınç) ile mikroskop aşamasında içinde uygun ve b) mikro-gözenekli sıvı akmaması sağlamalıdır. Deformasyon deney tekrarlanabilirlik azaltarak iyi geometri ve ışık yolunu değiştirir.
- Bir mikro şırınga veya eşdeğeri kullanılarak, yavaş yavaş mikro kuyuya numunenin ~ 1 ul enjekte edilir ve herhangi bir baloncuklarının oluşumunu ortadan kaldırmak. Gerekirse enjeksiyon tekrarlayın ve keskin iğne ile mikro kuyu duvarları zarar için dikkatli kullanın. Biraz mikro-iyi doldurmayın ve hemen, aşırı sıvı kaldırmak buharlaşmasını önlemek ve her bir deney için tekrarlanabilir miktarlar sağlamak için mikro-kuyunun üzerinde cam kapak kaydırın.
NOT: Scor için iyi çalışır glasscutter bir elmas uçboyutuna e ve çatlak cam kapak. - Mikroskop aşamasında tamamlanmış lamine mikrocihazda Güvenli ve cihaz üzerinde yol iki bakır fonksiyon jeneratörü elektrot tel takmak. Axiovision (Zeiss) yazılımı, çok boyutlu yakalama modunda kamera kaydını başlatmak için düğmesini tıklatın. Uygulanmış ve elektrik alan olmadan tepkilerini belgelemek için CCD kamera kaydı başladıktan sonra sabit bir zaman diliminde işlev üreteci sinyali başlatın.
Not: Burada, 100 Hz, 15 V tepe-tepe sinyal ile MHz frekansı 10 uygulanmıştır ve deneyler 2 saniye boyunca cam slayt, yüzey üzerinde 1-200 de 10X büyütmede gözlenmiştir alanı olmadan ve alanı ile ~ 5 dakika uygulanır. Görüntüler dijital fazla analiz için saniye (fps) başına 1 ila 5 kare kaydedildi. - Deney tamamlandıktan sonra, aygıtı kaldırmak ve kelepçeleri sökün. Sabunlu suyla cam slayt ve cihazı hem de batırmayın, sonra iyice durulayın. 30 hakkında zaman Tekrar cihazlartutarlı bir performans ile s.
6.. Veri Analizi ve Görüntü İşleme
- Gibi ImageJ olarak tercih yazılımı ile görüntü verileri analiz. Belirli bir zaman adımında ardışık görüntüler arasında parçacık deplasman hızını hesaplayın.
- Eğilimleri derlemek ve teori 29 ile karşılaştırmak hıza dayanan deneysel DEP kuvvet ve alan gücü hesaplayın.
- Radyal olarak elektrik alan gradyanı şekline uygun mikro-gözenekli geometride Ölçü parçacık hızı. Mikro kuyu kenarından merkezine, 7 bölgede sonuçlanır 8 eş izoelektrik konturları (350, 300, ... 50, 0 um), tanımlamak.
NOT: 50 mikron mesafe hız hesaplamak için kullanılan çapraz parçacıklar için zaman. Geometrik varyasyonları bunu gerektirdiği zaman, izoelektrik kontür biraz ayarlandı.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
6 um polistiren boncuklar üzerinde dielelektroforetik deneyleri, 0.38 mm 3 silindirik, mikro-gözenekli yapılmıştır. Sonuçlar, 3D grafen kağıt tabanlı bir aygıt 3D metal folyo laminat cihazları 20, 21, geleneksel 2D metal elektrot 26, 27 benzer dielelektroforetik imzalar göstermektedir, ve 2D yalıtkan cihazları 25 için lamine göstermektedir. Aşağıdaki deneylerde, 15 V bir tepe-tepe AC sinyali uygulandı ve frekansı 100 Hz MHz 30 ile 10...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu el yazması bir roman 6 grafen tabakası ve 5 bant katmanı mikrocihazda imalatı için protokoller ayrıntıları. Ayrıca, cihaz işlemi benzersiz, geometrik ilgili parçacık hız analizi yaklaşımı ile birlikte 6.08 mikron polistiren boncuklar gözlenen DEP davranışları aracılığıyla gösterilmektedir. Aynı derecede güvenilir sonuçlar veren ise doğrusal olmayan elektrokinetik cihazlar oluşturmak için bu çok yönlü yaklaşım, elektrot ve akışkan tabaka mikroimalat tekniklerden daha az maliyetlid...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar ifşa etmek hiçbir çatışmalar var.
Teşekkürler
Grafen kağıdı cömert bağış için XG Bilimleri teşekkürler. Cömertçe bize mikro-sondaj ekipmanları kullanmak için icar Dr C. Friedrich sayesinde. Özel bir teşekkür videoyu anlatan için Tayloria Adams uzatıldı.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Polystyrene Beads | Spherotech, Inc. | PP-60-10 | 6.08 μm diameter |
| Graphene paper | XG Sciences, Inc. | XG Leaf B-072 | |
| Double sided tape | 3M | N/A | 136 office tape |
| Silver conductive epoxy | MG chemicals | 8331-14G | Part A & B included |
| Mannitol | Sigma Aldrich | 091M0020V | |
| Phosphate buffer saline | OmniPur | 0381C490 | |
| Microscope (CCD Camera) | Zeiss | Axiovert 200M | |
| Function/waveform generator | Agilent | 33250A | |
| Syringe | Hamilton | 84505 | |
| Paper Clamp | ADAMS | 3300-50-3848 | |
| Oven | Fisher Scientific | 280A | |
| Multimeter | OMEGA | HHM25 | |
| Micro-milling machine | AEROTECH | ABL1500 stages/A3200 Npaq controller | |
| End mill | ULTRATOOL | 708473 | |
| AxioVision | Zeiss | Version 4.8 |
Referanslar
- Geim, A. K., Novoselov, K. S. The rise of graphene. Nature Materials. 6 (3), 183-191 (2007).
- Jafri, R. I., Rajalakshmi, N., Ramaprabhu, S. Nitrogen doped graphene nanoplatelets as catalyst support for oxygen reduction reaction in proton exchange membrane fuel cell. Journal of Materials Chemistry. 20 (34), 7114-7117 (2010).
- Kavan, L., Yum, J. H., Gratzel, M. Graphene Nanoplatelets Outperforming Platinum as the Electrocatalyst in Co-Bipyridine-Mediated Dye-Sensitized Solar Cells. Nano Letters. 11 (12), 5501-5506 (2011).
- Aravind, S. S. J., Baby, A. T. T., Arockiadoss, T., Rakhi, R. B., Ramaprabhu, S. A cholesterol biosensor based on gold nanoparticles decorated functionalized graphene nanoplatelets. Thin Solid Films. 519 (16), 5667-5672 (2011).
- Si, P., Ding, S. J., Lou, X. W., Kim, D. H. An electrochemically formed three-dimensional structure of polypyrrole/graphene nanoplatelets for high-performance supercapacitors. Rsc Advances. 1 (7), 1271-1278 (2011).
- Wang, D. -W., et al. Fabrication of Graphene/Polyaniline Composite Paper via In Situ Anodic Electropolymerization for High-Performance Flexible Electrode. ACS Nano. 3 (7), 1745-1752 (2009).
- Lee, J. K., Smith, K. B., Hayner, C. M., Kung, H. H. Silicon nanoparticles-graphene paper composites for Li ion battery anodes. Chem Commun (Camb). 46 (12), 2025-2027 (2010).
- Kavan, L., Yum, J. H., Gratzel, M. Optically Transparent Cathode for Dye-Sensitized Solar Cells Based on Graphene Nanoplatelets. ACS Nano. 5 (1), 165-172 (2011).
- Martinez-Duarte, R. Microfabrication technologies in dielectrophoresis applications--a review. Electrophoresis. 33 (21), 3110-3132 (2012).
- Yamamoto, M., et al. Patterning with particles using three-dimensional interdigitated array electrodes with negative dielectrophoresis and its application to simple immunosensing. Electrochimica Acta. 82, 35-42 (2012).
- Doh, I., Kim, Y., Cho, Y. H. A particle trapping chip using the wide and uniform slit formed by a deformable membrane with air bubble plugs. Current Applied Physics. 13 (5), 902-906 (2013).
- Lin, S. C., Lu, J. C., Sung, Y. L., Lin, C. T., Tung, Y. C. A low sample volume particle separation device with electrokinetic pumping based on circular travelling-wave electroosmosis. Lab on a Chip. 13 (15), 3082-3089 (2013).
- Martinez-Duarte, R., Camacho-Alanis, F., Renaud, P., Ros, A. Dielectrophoresis of lambda-DNA using 3D carbon electrodes. Electrophoresis. 34 (7), 1113-1122 (2013).
- Yang, S. M., Tseng, S. Y., Chen, H. P., Hsu, L., Liu, C. H. Cell patterning via diffraction-induced optoelectronic dielectrophoresis force on an organic photoconductive chip. Lab on a Chip. 13 (19), 3893-3902 (2013).
- Srivastava, S. K., Gencoglu, A., Minerick, A. R. DC insulator dielectrophoretic applications in microdevice technology: a review. Anal Bioanal Chem. 399 (1), 301-321 (2011).
- Liao, S. H., Cheng, I. F., Chang, H. C. Precisely sized separation of multiple particles based on the dielectrophoresis gradient in the z-direction. Microfluidics and Nanofluidics. 12 (1-4), 1-4 (2012).
- Bajaj, P., Marchwiany, D., Duarte, C., Bashir, R. Patterned three-dimensional encapsulation of embryonic stem cells using dielectrophoresis and stereolithography. Adv Healthc Mater. 2 (3), 450-458 (2013).
- Braff, W. A., Pignier, A., Buie, C. R. High sensitivity three-dimensional insulator-based dielectrophoresis. Lab Chip. 12 (7), 1327-1331 (2012).
- Martinez-Duarte, R., Gorkin 3rd, R. A., Abi-Samra, K., Madou, M. J. The integration of 3D carbon-electrode dielectrophoresis on a CD-like centrifugal microfluidic platform. Lab Chip. 10 (8), 1030-1043 (2010).
- Fatoyinbo, H. O., Kamchis, D., Whattingham, R., Ogin, S. L., Hughes, M. P. A high-throughput 3-D composite dielectrophoretic separator. Ieee Transactions on Biomedical Engineering. 52 (7), 1347-1349 (2005).
- Hubner, Y., Hoettges, K. F., Kass, G. E. N., Ogin, S. L., Hughes, M. P. Parallel measurements of drug actions on Erythrocytes by dielectrophoresis, using a three-dimensional electrode design. Iee Proceedings-Nanobiotechnology. 152 (4), 150-154 (2005).
- Abdul Razak, M. A., Hoettges, K. F., Fatoyinbo, H. O., Labeed, F. H., Hughes, M. P. Efficient dielectrophoretic cell enrichment using a dielectrophoresis-well based system. Biomicrofluidics. 7 (6), (2013).
- Hughes, M. P. O. S., Hoettges, K. F., Wattingham, R. Device for Dielectrophoretic Manipulation of Particles. , (2005).
- Heldt, C. L., et al. Stacked graphene nanoplatelet paper sensor for protein detection. Sensors and Actuators B-Chemica. 181, 92-98 (2013).
- Srivastava, S. K., Artemiou, A., Minerick, A. R. Direct current insulator-based dielectrophoretic characterization of erythrocytes: ABO-Rh human blood typing. Electrophoresis. 32 (18), 2530-2540 (2011).
- Leonard, K. M., Minerick, A. R. Explorations of ABO-Rh antigen expressions on erythrocyte dielectrophoresis: Changes in cross-over frequency. Electrophoresis. 32 (18), 2512-2522 (2011).
- Srivastava, S. K., Daggolu, P. R., Burgess, S. C., Minerick, A. R. Dielectrophoretic characterization of erythrocytes: Positive ABO blood types. Electrophoresis. 29 (24), 5033-5046 (2008).
- Minerick, A. R. The rapidly growing field of micro and nanotechnology to measure living cells. AIChE Journal. 54 (9), 2230-2237 (2008).
- Garza-Garcia, L. D., Perez-Gonzalez, V. H., Perez-Sanchez, O. A., Lapizco-Encinas, B. H. Electrokinetic Mobilities Characterization and Rapid Detection of Microorganisms in Glass Microchannels. Chemical Engineering & Technology. 34 (3), 371-378 (2011).
- Lopez-de la Fuente, M. S., et al. An electric stimulation system for electrokinetic particle manipulation in microfluidic devices. Rev Sci Instrum. 84 (3), (2013).
- Chen, D. F., Du, H., Li, W. H. A 3D paired microelectrode array for accumulation and separation of microparticles. Journal of Micromechanics and Microengineering. 16 (7), 1162-1169 (2006).
- Chu, H., Doh, I., Cho, Y. H. A three-dimensional (3D) particle focusing channel using the positive dielectrophoresis (pDEP) guided by a dielectric structure between two planar electrodes. Lab on a Chip. 9 (5), 686-691 (2009).
- Millet, L. J., Park, K., Watkins, N. N., Hsia, K. J., Bashir, R. Separating beads and cells in multi-channel microfluidic devices using dielectrophoresis and laminar flow. J Vis Exp. , (2011).
- Weiss, N. G., et al. Dielectrophoretic mobility determination in DC insulator-based dielectrophoresis. Electrophoresis. 32 (17), 2292-2297 (2011).
- Auerswald, J., Knapp, H. F. Quantitative assessment of dielectrophoresis as a micro fluidic retention and separation technique for beads and human blood erythrocytes. Microelectronic Engineering. 67-8, 879-886 (2003).
- Park, S., Zhang, Y., Wang, T. H., Yang, S. Continuous dielectrophoretic bacterial separation and concentration from physiological media of high conductivity. Lab on a Chip. 11 (17), 2893-2900 (2011).
- Sun, T., Holmes, D., Gawad, S., Green, N. G., Morgan, H. High speed multi-frequency impedance analysis of single particles in a microfluidic cytometer using maximum length sequences. Lab on a Chip. 7 (8), 1034-1040 (2007).
- Hughes, M. P., Morgan, H. Dielectrophoretic Characterization and Separation of Antibody-Coated Submicrometer Latex Spheres. Analytical Chemistry. 71 (16), 3441-3445 (1999).
- Liang, W. F., et al. Simultaneous separation and concentration of micro- and nano-particles by optically induced electrokinetics. Sensors and Actuators a-Physical. 193, 103-111 (2013).
- White, C. M., Holland, L. A., Famouri, P. Application of capillary electrophoresis to predict crossover frequency of polystyrene particles in dielectrophoresis. Electrophoresis. 31 (15), 2664-2671 (2010).
- Wu, J., Ben, Y. X., Battigelli, D., Chang, H. C. Long-range AC electroosmotic trapping and detection of bioparticles. Industrial & Engineering Chemistry Research. 44 (8), 2815-2822 (2005).
- Zhou, H., White, L. R., Tilton, R. D. Lateral separation of colloids or cells by dielectrophoresis augmented by AC electroosmosis. J Colloid Interface Sci. 285 (1), 179-191 (2005).
- Green, N. G., Ramos, A., Gonzalez, A., Morgan, H., Castellanos, A. Fluid flow induced by nonuniform ac electric fields in electrolytes on microelectrodes I. Experimental measurements. Phys Rev E Stat Phys Plasmas Fluids Relat Interdiscip Topics. 61 (4 Pt B), 4011-4018 (2000).
- Green, N. G., Ramos, A., Gonzalez, A., Castellanos, A., Morgan, H. Electrothermally induced fluid flow on microelectrodes. Journal of Electrostatics. 53 (2), 71-87 (2001).
- Gonzalez, A., Ramos, A., Morgan, H., Green, N. G., Castellanos, A. Electrothermal flows generated by alternating and rotating electric fields in microsystems. Journal of Fluid Mechanics. 564, 415-433 (2006).
- Park, S., Koklu, M., Beskok, A. Particle trapping in high-conductivity media with electrothermally enhanced negative dielectrophoresis. Anal Chem. 81 (6), 2303-2310 (2009).
- Sin, M. L., Gau, V., Liao, J. C., Wong, P. K. Electrothermal Fluid Manipulation of High-Conductivity Samples for Laboratory Automation Applications. JALA Charlottesv Va. 15 (6), 426-432 (2010).
- Liao, S. -H., Cheng, I. F., Chang, H. -C. Precisely sized separation of multiple particles based on the dielectrophoresis gradient in the z-direction. Microfluidics and Nanofluidics. 12 (1-4), 201-211 (2012).
- Gencoglu, A., Minerick, A. Chemical and morphological changes on platinum microelectrode surfaces in AC and DC fields with biological buffer solutions. Lab on a Chip. 9 (13), 1866-1873 (2009).
- Bocchi, M., et al. Dielectrophoretic trapping in microwells for manipulation of single cells and small aggregates of particles. Biosensors & Bioelectronics. 24 (5), 1177-1183 (2009).
- Li, P., Stratton, Z. S., Dao, M., Ritz, J., Huang, T. J. Probing circulating tumor cells in microfluidics. Lab on a Chip. , (2013).
- Rimmele, T., Kellum, J. A. Clinical review: Blood purification for sepsis. Critical Care. 15 (1), (2011).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır