Method Article
تسجيلات في وقت واحد على المدى الطويل في مرحلتين العصبية في معالجة يتصرفون نحل العسل
In This Article
Summary
أنشئت التسجيلات المدى الطويل خارج الخلية في وقت واحد من اثنين neuropiles الدماغ المختلفة أو اثنين مساحات تشريحية مختلفة في نحل العسل. تسمح هذه التسجيلات التحقيق في الجوانب الزمنية للتجهيز الخلايا العصبية في مناطق الدماغ المختلفة في الخلايا العصبية واحد، وكذلك على مستوى الفرقة في حيوان يتصرف.
Abstract
في كل من الثدييات والحشرات تتم معالجة المعلومات العصبية في المراكز العليا والدنيا أجل الدماغ المختلفة. تقترن هذه المراكز عبر متقاربة والاتصالات التشريحية متباينة بما في ذلك التغذية إلى الأمام وردود الفعل الأسلاك. وعلاوة على ذلك، يتم إرسال المعلومات من نفس المصدر جزئيا عبر مسارات موازية لمختلفة وأحيانا في مناطق الدماغ نفسه. لفهم الفوائد التطورية فضلا عن المزايا الحسابية هذه الاستراتيجيات الأسلاك وخصوصا تبعيات الزمنية على بعضها البعض، فمن الضروري أن يكون الوصول إلى الخلايا العصبية في وقت واحد واحد من مساحات مختلفة أو neuropiles في نفس الاعداد في القرار الزماني عالية. نحن هنا التركيز على نحل العسل من خلال إظهار وصول فريدة من نوعها على المدى الطويل خارج الخلية لتسجيل نشاط وحدة متعددة في اثنين neuropiles اللاحقة 1، الفص antennal (AL)، وأول مرحلة التجهيز حاسة الشم والجسم الفطر (MB)، وهو أعلى مركز أجل التكامل INVOlved في التعلم وتكوين الذاكرة، أو اثنين مساحات العصبية موازية 2 ربط AL مع MB. وقد تم اختيار هذا الأخير كمثال وسوف يمكن وصفها بشكل كامل. في الفيديو دعم ويتجلى بناء والإدراج دائمة مرنة متعددة الأقطاب والأسلاك القناة. البشرى التضخيم التفاضلية للقنوات سلك كهربائي الصغرى يقلل بشكل كبير من الضوضاء ويتحقق من أن مصدر إشارة يرتبط ارتباطا وثيقا موقف طرف القطب. المرونة الميكانيكية للأقطاب الأسلاك المستخدمة يسمح التسجيلات مستقرة على المدى الطويل الغازية على مدى عدة ساعات تصل إلى أيام، والتي هي ميزة واضحة بالمقارنة مع تقنيات التسجيل الجسم الحي وخارج الخلايا في التقليدية.
Introduction
نحل العسل وكذلك معظم الحشرات الأخرى تعتمد بشكل كبير على الشم. وغيرها التي يستخدمونها العظة حاسة الشم لتحديد اتجاهاتها، التزاوج والتواصل مع conspecifics، والبحث عن الطعام. يساهم نظام حاسة الشم وضعت بشكل جيد على ذخيرة غنية من السلوكيات التعلم المتصلة المحفزات رائحة الأزهار. هذه السلوكيات يمكن دراستها بسهولة تحت الظروف المعملية للرقابة (للمراجعة انظر 3-5). هم "العقول البسيطة" (cp. 6) مع أعدادهم صغيرة نسبيا من الخلايا العصبية يجعل نحل العسل كائن نموذج مناسب تماما لدراسة الترميز حاسة الشم والتعلم خلال رصد النشاط العصبي.
نظام حاسة الشم لدى الحشرات وكذلك في الثدييات يظهر منظمة مشابهة إلى حد كبير (للمراجعة انظر 7،8). في نحل العسل حوالي 80،000 الخلايا العصبية مستقبلات 9 يقع في sensillae على طول هوائيات 10،11 ترجمة التحفيز رائحة البيئية إلى رجل أعمالإشارة اونال. محاور عصبية من الخلايا العصبية مستقبلات الشمية يعصب الفص antennal (AL)، التي لديها تنظيم الكبيبي مماثلة لالبصلة الشمية الفقاريات. وتضم الجامعة حوالي 164 الكبيبات مترابطة مع بعضها البعض بنحو 4،000 interneurons المحلي (LN) (للمراجعة انظر 12). خاصة في نحل العسل وقد تبين مؤخرا أن LNS توفير اتصال الجانبية غير مكتمل وأن المجموعات السكانية الفرعية المختلفة تمتلك خصائص عنصري وconfigural حاسة الشم الترميز 13،14. وقد أظهرت AL إلى تقسيمها إلى الفص بطني وظهري نصفي مما أدى إلى وسطي والمسالك الجانبية الفص antennal (M-L-ALT و؛ يطلق عليه سابقا م وL-APT للالإنسي والوحشي لوب Antennal protocerebral المسالك 15-17). هنا مصطلحات المسالك الجديدة التي أدخلت من خلال بذل جهد الأخيرة لتسمية موحدة للدماغ الحشرة سيتم استخدام 18. كلا العطاءات (ل م و-ALT) الجمع بين إما 410 (ل-ALT) أو 510 (م-ALT) proje uniglomerularالخلايا العصبية كشن (PN)، على التوالي 15،16،19. وقد تم مؤخرا أظهرت السندات الإذنية كل مساحات إلى الروائح كود بالتوازي 2 (للمراجعة انظر 17،20)، وكلاهما مساحات تشكيل synaptically اتصالات مع خلايا متباينة كينيون (KC)، وهي الهيئة الفطر (MB) الخلايا العصبية الرئيسية. كل MB يحتوي على حوالي 172،000 ككس 21-23. من المعروف أن ميجا أن تشارك في التكامل التحفيز، التعلم، وتشكيل الذاكرة. التشعبات الذخائر المتروكة من ككس تشكل السويقة (الجذعية الفطر)، والذي فقد اثنين من مناطق الانتاج الرئيسية: وvertica أو ألفا الفص والأفقي أو بيتا الفص 22،24. إخراج MB يتقاطع فقط حوالي 400 خلية عصبية خارجي (EN) 24. ENS المسؤولة عن معالجة المعلومات الشمية يعصب معظمها الجانب البطني من الفص العمودي 22. في الآونة الأخيرة، وقد تبين أن ENS سجلت في هذا المجال ترميز جمعية رائحة مكافأة 25.
كما الزمانيأصبحت pects داخل منظومة حاسة الشم من الحشرات وكذلك الفقاريات جانبا هاما وكبيرا من حيث المبدأ الترميز المحتملة 26 - 29. لتكون قادرة على تسجيل في وقت واحد الخلايا العصبية متعددة من مواقع مختلفة في القرار الزماني عالية، أنشأنا مزدوجة متعددة تقنيات التسجيل باستخدام وحدة مخصصة متعددة الأقطاب والأسلاك قناة أدخلت إلى المناطق المستهدفة المختلفة في نظام حاسة الشم النحلة. هذا النهج تمكننا من تحليل ومقارنة معالجة الزمنية في نظام حاسة الشم نحل العسل على مستوى الخلايا العصبية واحد والسكان من الخلايا العصبية الشمية إما بين مسارات متوازية، المسار المزدوج 2 حاسة الشم أو بين مختلف neuropils اللاحقة 1. في الآونة الأخيرة مع المنهج التجريبي مماثلة في نظام حاسة الشم الجراد 30 باستخدام تكوين مختلف من الأقطاب الكهربائية كانوا قادرين على تحليل آلية الترميز الزمانية المكانية للخلفية ثابتة رائحة اعتراف 31. اللنا، التسجيلات المزدوجة التي أنشئت تمكين جمع المعلومات المكانية عن ملامح نشاط الخلايا العصبية في وقت واحد.
مقارنة مع أخذ العينات المكانية أوسع تم الحصول عليها من التصوير الكالسيوم هذا الأسلوب يسمح تسجيل من مركزين فقط. ومع ذلك، فإن ميزة مقارنة تقنيات التصوير الكالسيوم هو الدقة الزمنية عالية من العمل التسجيلات المحتملة، والتي لا يمكن أن تقدمها إما التقليدية التصوير CCD أو اقتناء التصوير 2 الفوتون. الأقطاب خارج الخلية وصفها هنا يتم زرعها بشكل دائم وثابت بالنسبة إلى الدماغ والرأس كبسولة تجنب الانجراف القطب. هذا هو ميزة واضحة بالمقارنة مع استخدام أقطاب كهربائية داخل الخلايا حادة. ميزة أخرى لمقارنة تسجيلات داخل الخلايا والتصوير الكالسيوم هي المرة المراقبة العصبية طويلة تتراوح بين عدة ساعات إلى أيام. هذا هو شرط مسبق هام لتحقيق يرتبط العصبية تشكيل التعلم والذاكرة. فوائد إضافية متعددةويرد مزيد من التسجيلات حدة في قسم المناقشة.
في هذه النظرة المنهجية سيظهر الإجراء تصنيع أقطاب الأسلاك العرف تصميم، وتكييفها من 32،33 وملاءمة للتسجيلات وحدة متعددة على المدى الطويل في الدماغ نحل العسل. بالإضافة إلى ذلك، على سبيل المثال كيف يتم زرع هذه الأنواع من الأقطاب الكهربائية بشكل دائم في موقعين تسجيل مختلفة داخل منظومة حاسة الشم نحل العسل لتسجيل في وقت واحد هو مبين-L وم-ALT على مدى فترات طويلة من الوقت للسماح العديد من البروتوكولات التحفيز 2. للتحقق من تسجيل مواقف وتقدم مثالا وبروتوكول لتلطيخ وتسجيل آخر التصور من مواقع التسجيل.
Protocol
1. بناء الكهربائي (الشكل 1)
- إنتاج محول الكهربائي الذي يناسب واجهة مجلس القطب من النظم التجارية مكبر للصوت متعدد القنوات 1،2،25.
- استخدام لوحة زجاجي صغير لصقها على قاعدة موصل 18 دبوس.
- ربط قاعدة مع 3 قطع قصيرة من سلك معزول إلى 3 العروات لحام منفصلة مشدود على طبق زجاجي (الشكل 1 A1-A3).
- إدراج الأخدود في لوحة زجاجي فيه الزجاج الشعرية يمكن التحرك بسهولة وستعقد في مكانها بواسطة المسمار (الشكل 1 B1).
- تمديد الزجاج الشعرية حوالي 5 ملم باستخدام دبوس minutien.
- نعلق الأسلاك الكهربائي الجزئي على طول دبوس minutien والزجاج الشعرية لضمان الاستقرار والدعم.
- متعدد القنوات انتاج الاسلاك الدقيقة (اعتمدت من Ryuichy اوكادا 32،33)
- فترة 3 أسلاك متناهية الصغر (البولي يوريثين المغلفة الأسلاك النحاسية، 15قطر ميكرون) في الطريقة التي يتم وضعها بجانب بعضها البعض (الشكل 1 B2).
- استخدام 12 فولت لحام إبرة لنشر طبقة رقيقة من الشمع الأسنان انصهار منخفضة (50 درجة مئوية) جزئيا على طول الأسلاك لالغراء لهم معا (القطب غيض) (الشكل 1 B3). ترك بضعة سنتيمترات غير إلتصق (نهاية القطب) كما سيتم استخدام هذا القسم في وقت لاحق لربط الأسلاك الصغيرة مع محول كهربائي.
- ربط متعددة الأسلاك قناة الصغير إلى محول كهربائي
- إزالة الزجاج الشعرية من حامل وإرفاقه مع دبوس minutien إلى طرف القطب. جعله مواز الموقف إلى القطب الدقيقة (Figure1 B3).
- الغراء طرف القطب إلى دبوس minutien باستخدام انصهار منخفضة شمع طب الأسنان وقطع القطب الصغير في طرف، جاحظ 2-3 سم من دبوس minutien وفي نهاية القطب (الشكل 1 الأسهم الصغيرة B3).
- زلة SL الشعريةightly العودة الى محول كهربائي. استخدام المسمار لاصلاحها (الشكل 1 B4).
- جندى المغفلة من الأسلاك الثلاثة إلى العروات لحام باستخدام بندقية لحام مع درجة حرارة حوالي 360 درجة مئوية لضمان ذوبان العزل (الشكل 1 B4). بعد لحام، وضمان وجود اتصال الكهربائية الكافية (~ 300 kOhm).
- جبل احد من الأقطاب الكهربائية (ماجستير) لمجلس واجهة كهربائي من headstage وإصلاح قناة أخرى متعددة القطب (الرقيق) على محول منفصل. ربط قنوات العبد إلى القطب الرئيسي (الشكل 1 C1). بالإضافة إلى ذلك، جندى الإشارة فضلا عن أقطاب العضلات إلى قاعدة القطب الرئيسي (الشكل 1 C2).
2. إعداد النحل (الشكل 2)
في هذه التجارب وصفت، ونحل العسل (mellifera أبيس)، وهو حيوان اللافقارياتوبالتالي لا تتطلب تصاريح أخلاقية محددة للاستخدام، ويستخدم.
- قبض علافات نحل العسل (A. mellifera) عند مدخل الخلية في الصباح كما هو موضح من قبل الآخرين 34،35.
- هدئ النحل على الثلج المجروش حتى الشلل (5-10 دقيقة) وإصلاح واحدة في حامل زجاجي القياسية أو أنبوب معدني بطريقة التي يتعرض لها رئيس (الشكل 2 أ). للتقليل من استخدام حركات الرأس المنخفضة ذوبان الشمع الأسنان (~ 50 درجة مئوية) وتحديد رأس بعناية لحامل حول أساس مجمع العينين والرقبة.
- استخدام منخفضة ذوبان الشمع ليحملق في scapi من الهوائيات على رأسه كبسولة (الشكل 2 ب) دون لمس السوط. والسوط الهوائي يحتاج إلى الإشارة إلى الأمام. تأكد من أن النحل يمكن أن تتحرك بحرية في خرطوم.
- حلق الرأس كبسولة لضمان وجهة نظر دون عائق، والوصول إلى أعلى الرأس.
- تغذية النحل بمحلول السكروز 30٪ حتى saturatiعلى تبليل لضمان ما يكفي من أنسجة المخ والجدوى الجيدة للحيوان (الشكل 2 C).
- جعل شقوق حذرا عموديا على طول الحدود من عيون المجمع وأفقيا فوق قواعد antennal وكذلك تحت التي تشبه وإزالة قطعة خففت من إهاب (الشكل 2 D).
- تعيين جانبا بعناية الغدد البلعوم السفلي وإزالة القصبة الهوائية لضمان عرض واضح الوصول إلى الدماغ قبل قطب كهربائي الإدراج (أرقام 2E، 2F).
3. الكهربائي الإدراج
في حالة المثال الموضح في الشكل 2، ويتم وضع قطب كهربائي واحد يهدف إلى L-ALT، والآخر يهدف على M-ALT 2. باستخدام معالم وجه الخصوص، المناطق المستهدفة أخرى ممكنة أيضا، على سبيل المثال مناطق الانتاج وAL MB 1.
- وضع أقطاب كهربائية باستخدام micromanipulators في المنطقة ذات الاهتمام ( الشكل 2G و 3A). لاستهداف المكان م-ALT القطب بين الجامعة وإعلامي من الفص العمودي للMB. ضمان موقع الإدراج يجري فوق نقطة التفرع من السندات الإذنية ALT الناصف الوحشي. تبرز الكهربائي في الدماغ وعلى عمق حوالي 180 (2E الشكل) ميكرون. لL-ALT PN مكان تسجيل القطب تحت protocerebrum الجانبي (وLH) في منتصف خط وهمي بين الجانب الوحشي من الفص الرأسي ومنتصف AL. إدراج القطب وعلى عمق حوالي 300 ميكرومتر (الشكل 2E)
- إدراج مرجع (سلك الفضة، وحوالي 25 ميكرون قطر) في العين مجمع المماثل من خلال قطع صغير في إهاب. إدراج الأسلاك الفضية أخرى في المنطقة الإسقاط العضلات تحت التي تشبه الجانبي. ملاحظة: إذا لزم الأمر سلوك التعلم من النحل يمكن رصدها بدقة عالية الزمنية من خلال تسجيل M17 العضلات، التي تشارك طن الاستجابة تمديد خرطوم (PER) النحل 36 كما هو موضح في 25.
- لترسيخ بقوة الأقطاب داخل الدماغ وكبسولة الرأس، وتغطي كامل المساحة فوق الدماغ مع اثنين من السيليكون المكون (الشكل 2H)، والتي سوف يمنع الدماغ من الجفاف. ملاحظة: يمكن للتسجيلات تستمر لساعات تصل إلى أيام، ويمكن على سبيل المثال أن تسجل النحل أثناء إجراء الإشراط الكلاسيكي (الشكل 2H) أو حفز مع لوحة كبيرة من الروائح المختلفة.
4. الحصول على البيانات وتجهيزها
- استخدام البرمجيات المناسبة اكتساب يلبي المتطلبات التالية: معدل 25 دقيقة كيلو هرتز أخذ العينات؛ التناظرية أو الرقمية 1،25 2 عبر التمايز بين قنوات القطب؛ الفرقة تمرير مرشح من 300 هرتز إلى 8،000 هرتز لاستخراج مسمار الأحداث.
- استخدام البرمجيات المتاحة ارتفاع الفرز لاستخراج النشاط حدة واحدة، على سبيل المثال TEMPLأكلت تقنيات مطابقة كما وردت في البرنامج Spike2 (الشكل 3).
- لمزيد من التحليل استخدام الوقت الطوابع وحدات استخراج لحساب وحدة واحدة وبلغ متوسط استجابات رائحة (الشكل 4) أو لحساب ناقلات السكان لتحليل المكون الرئيسي (PCA) (الشكل 5) باستخدام البرمجيات المتاحة تجاريا. لمزيد من تحليل وحدة واحدة واستجابة الكمون السكان من فضلك قارن المنشورات الأخيرة 1،2،25.
5. تصور النسبية الكهربائي الموقع (الشكل 4)
- تراجع نصائح الأقطاب في حل أي من 5٪ اليكسا هيدرازيد 568 أو 5٪ اليكسا هيدرازيد 488 الذي يذوب في 0.5 M محلول كلوريد البوتاسيوم قبل التجارب التسجيل.
- إزالة الأقطاب والسيليكون غطاء بعناية بعد التجارب، وشطف الدماغ مع قارع الأجراس حل النحل، وإزالة الغدد والقصبة الهوائية وتضاف بلورات صغيرة من tetramethylrhodamiن ديكستران أو إدراج الحل 5٪ حلها في 1.0 M خلات البوتاسيوم في AL لتسمية العطاءات anterogradely. نفذ الخطوات التالية في الظلام.
- تسمح الصبغة التي سيتم تناولها ونقلها بواسطة الخلايا العصبية الإسقاط على طول محور عصبي مساحات بهم (30-45 دقيقة) (الشكل 4A)، قبل غسل الدماغ مع قارع الأجراس النحل حل ثلاث مرات لمدة 30-45 دقيقة أخرى.
- هدئ النحل على الجليد حتى تجميد وإزالة بعناية الدماغ من الكبسولة الرأس. يحملق في الدماغ قبل الشطف في حل 0.1 M PBS تحتوي على 4٪ الفورمالديهايد ويبقيه بين عشية وضحاها في 4 درجات مئوية.
- الانتظار على الأقل 12 ساعة قبل غسل الدماغ مرتين في 0.1 M برنامج تلفزيوني (10 دقيقة لكل منهما).
- غسل 3X الدماغ لمدة 20 دقيقة في 0.2٪ تريتون X-100 0.1 M مخففة في برنامج تلفزيوني قبل التجفيف في سلسلة الكحول تصاعدي (30٪، 50٪، 70٪، 90٪، 95٪، 3X الإيثانول بنسبة 100٪، 20 دقيقة كل خطوة).
- تضمين الدماغ المجففة في Methylsalicylate على شريحة المجهر وقالخطوط الجوية الاثيوبية مع شريحة الغطاء.
- استخدام متحد البؤر مجهر المسح بالليزر ومسح الدماغ والمقاطع البصرية كل 2-5 ميكرون باستخدام مجمع متناسق الهدف خطة امزيغ (10X 0.4 NA الغمر). تثير الأنسجة باستخدام 568 نانومتر الطول الموجي للtetramethylrhodamin ديكستران والطول الموجي من 488 نانومتر للموقف القطب.
- إعادة بناء هياكل الدماغ الملون ومسارات الكهربائي من مداخن الصورة في 3D مع برنامج إعادة الإعمار (على سبيل المثال. AMIRA أو فيجي) (الشكل 4).
النتائج
"هذا البروتوكول يسمح التسجيلات في وقت واحد في اثنين من مراحل التجهيز المختلفة داخل نحل العسل الفردية وبالإضافة إلى ذلك يسمح لاختبار الآليات الكامنة وراء التعلم والذاكرة عن طريق على سبيل المثال.، PER تكييف داخل النحل ضبط النفس." هذا هو شرط أساسي لتحليل الجوانب الزمنية المعالجة العصبية. هذه الطريقة قابلة للتكيف بسهولة لنهج العلمية المختلفة لكشف الشبكة العصبية نظام حاسة الشم النحلة. على سبيل المثال يتم استخدام هذا الأسلوب (ط) لتحليل معالجة الزماني للالسندات الإذنية داخل المسار المزدوج حاسة الشم من نحل العسل، و-L و m-ALT السندات الإذنية (الشكل 5). في الشكل 5A يتم إعطاء مثال واحد من PN-L ALT سجلت في وقت واحد مع PN من م-ALT الى عشرة متوسط المحاكمة ويوضح قوة استجابتها والكمون فيما يتعلق خمسة تركيزات مختلفة مثل رائحة ونا مميزا الحرارة المؤامرة. في المتوسط من سبعة النحل مع 11 لتر و 13 مللي أمبيرLT السندات الإذنية (أرقام 5B، 5C) يوضح أن كلا من قوة الاستجابة وكذلك الكمون ردا على ذلك، إلى حد ما، يعكس تركيز الرائحة. وبالتالي السندات الإذنية في هذا المثال زيادة قوة الاستجابة في حين مع زيادة تركيز الرائحة الكمون استجابتها رفض (أرقام 5B، 5C). هذه النتيجة هي محدودة نوعا ما، وصالحة فقط لتحليل الرائحة، ولكن لا يزال يتفق مع النماذج الحسابية الأخيرة من AL 37. ما إذا كان الترميز في تركيز الرائحة AL النحلة وراء حسابات غير خطية أو وراء خصائص الترميز الأخرى لا يزال يتعين تحليلها في المستقبل. علاوة على ذلك، يمكن استخدام أسلوب (ب) لمقارنة الجوانب الزمنية في النشاط السكاني في مرحلتين المعالجة اللاحقة، وAL-MB-والإخراج (الشكل 6). يوضح تحليل المكون الرئيسي (PCA) أن رائحة حساب يطول وتدوم العرض رائحة بأكملها على المستوى PN في حين ENق فقط رائحة وإيقاف مجموعة ممثلة في النشاط السكاني (الشكل 6). وبذلك بلغ عدد السكان EN نشاطهم القصوى بالفعل في نقطة الوقت الذي كان فيه النشاط PN لا تزال تتطور (cp. فيلم 1).
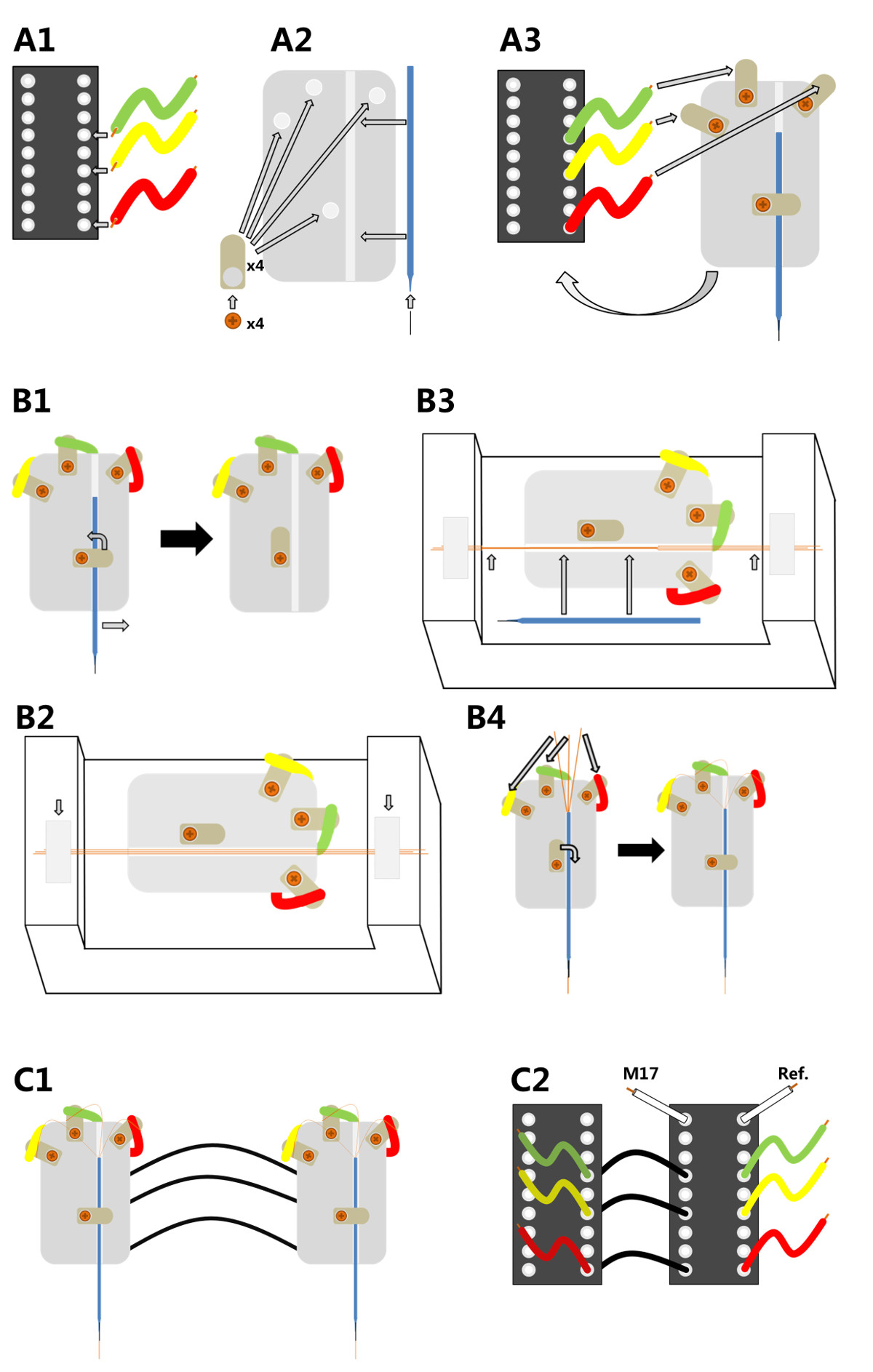
. الرقم 1 تصنيع ثلاث قنوات أقطاب الصغرى سلك A1) وملحوم والنهايات من ثلاثة أسلاك لموصل دبوس IC في المراكز 11 و 13 و 16 A2) وثمل أربعة العروات لحام على لوحة قاعدة بلاستيكية زجاجي؛ يتم إدخال دبوس minutien في غيض من الزجاج الشعرية التي يتم بعد ذلك تعلق على لوحة من البلاستيك. A3) يتم لصقها على لوحة من البلاستيك على رأس دبوس موصل IC ونهاية خالية من كل سلك ملحوم لحام واحدة من أعلى العروات. <قوية> B1) لتجهيز حامل الكهربائي مع الأسلاك النحاسية الجميلة، وشعري لا بد من اتخاذها للخروج مرة أخرى. B2) وقاعدة حامل ثم يتم إصلاحها في العرف مواءمة الجهاز. يتم محاذاة ثلاثة أسلاك النحاس الصغيرة على طول الأخدود وثابتة مع شريط لاصق في نهاية كل B3) يتم لصقها الأسلاك الدقيقة بالتوازي مع شمع طب الأسنان ويتم وضع شعري مرة أخرى في مكان (السهام طويلة)؛ ثم هي التي تعلق على أسلاك متناهية الصغر لصقها على شعري بالشمع الأسنان ويتم قطع اطرافها قبالة (السهام قصيرة). B4) وملحوم والمغفلة ثلاثة من الأسلاك النحاسية الى المراكز الثلاثة الاولى العروات لحام بالتالي تقديمهم في اتصال مع الكهربائية يمكن ان تكون مرتبطة IC دبوس موصل. C1) اثنين من أقطاب تجميعها بشكل كامل لبعضها البعض للاستخدام مع headstage واحد. C2) لهذا الغرض ترتبط دبابيس من القطب واحد (اليسار والرقيق) عن طريق أسلاك معزولة إلى القطب الآخر (يمين، ساريةإيه)، والتي يتم توصيلها إلى مرحلة الرأس؛ يمكن للheadstage توصيل الكهربائي أيضا جمع مدخلات من العضلات (M17) والقطب المرجعية (المرجع).
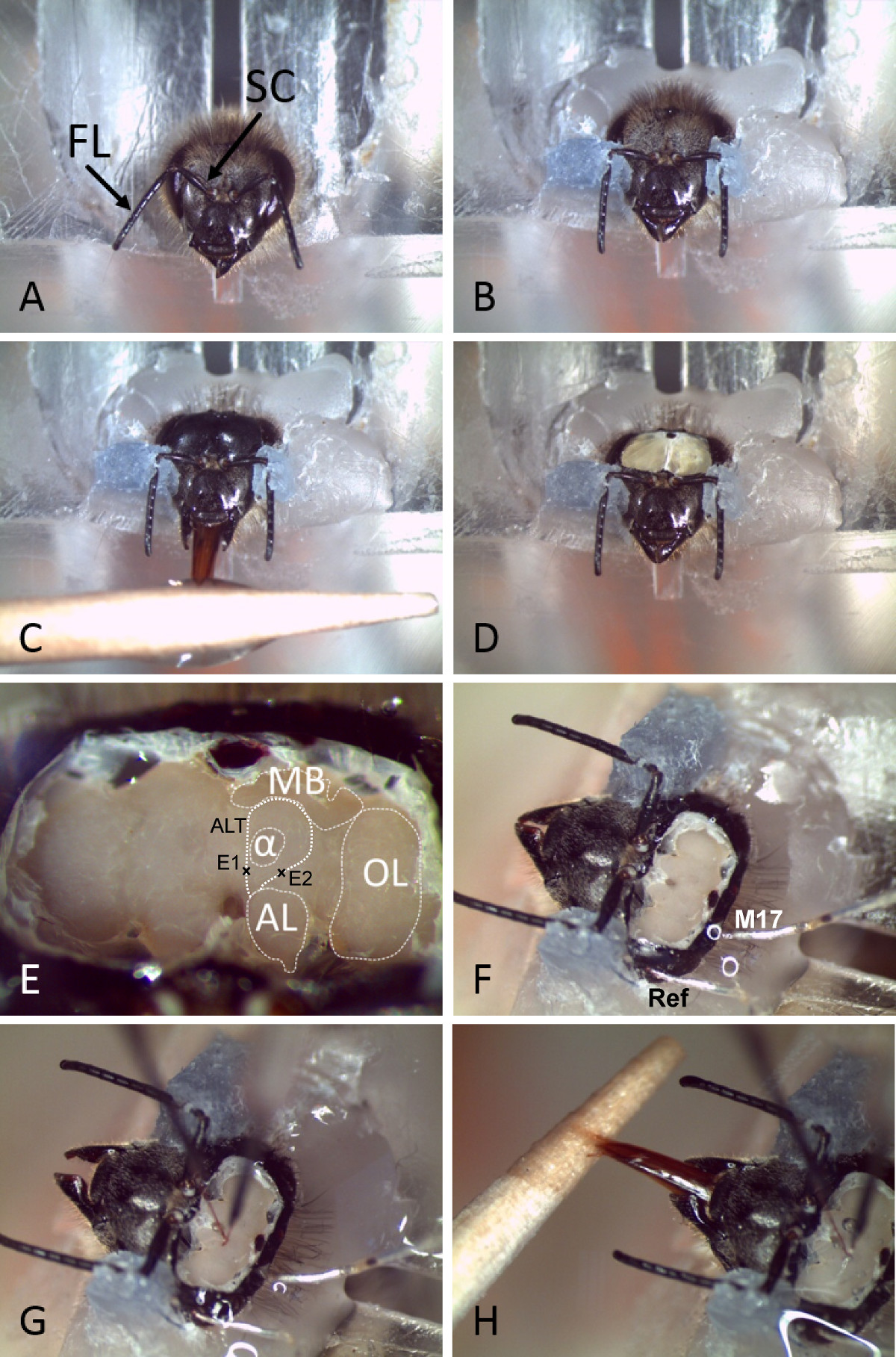
الشكل 2. إعداد والإدراج القطب دائمة في الدماغ النحل. A) يتم إدخال النحل في حامل زجاجي بعد الشلل على الجليد. يشار إلى هوائيات مع السوط (فلوريدا) وسقيبة (SC). ب) الرأس ويتم إصلاح الهوائيات باستخدام الشمع الأسنان. C) وحلق كبسولة الرأس ويتم تغذية النحل مع الماء والسكر. D) يتم فتح الكبسولة الرأس. E) بعد إزالة الغدد والقصبة الهوائية من أعلى الدماغ، ويمكن بسهولة أن تميز مختلف neuropiles والمعالم الرئيسية. يشار إلى مسارات للالعطاءات جنبا إلى جنب مععلامة حيث يتم إدراج الأقطاب. (MB: هيئة فطر، AL: الفص Antennal، OL: الفص البصري، α: ألفا الفص الفص أو الرأسي، ALT: antennal المسالك الفص، E1: الجانب القطب الإدراج للحصول على تسجيلات M-ALT، E2: الجانب القطب الإدراج لL-ALT يتم إدراج التسجيلات). F) مرجع (المرجع) والأقطاب الكهربائية في العضلات (M17) في كبسولة الرأس من خلال ثقوب صغيرة في بشرة أو العين المجمع. G) يتم إدراج الأقطاب والأسلاك في الدماغ في المواقع المناسبة. H) بعد تحديد الأقطاب في مكانها باستخدام اثنين من السيليكون المكون النحل لا يزال يظهر PER ويمكن تكييف (على سبيل المثال، باستخدام الماء والسكر).
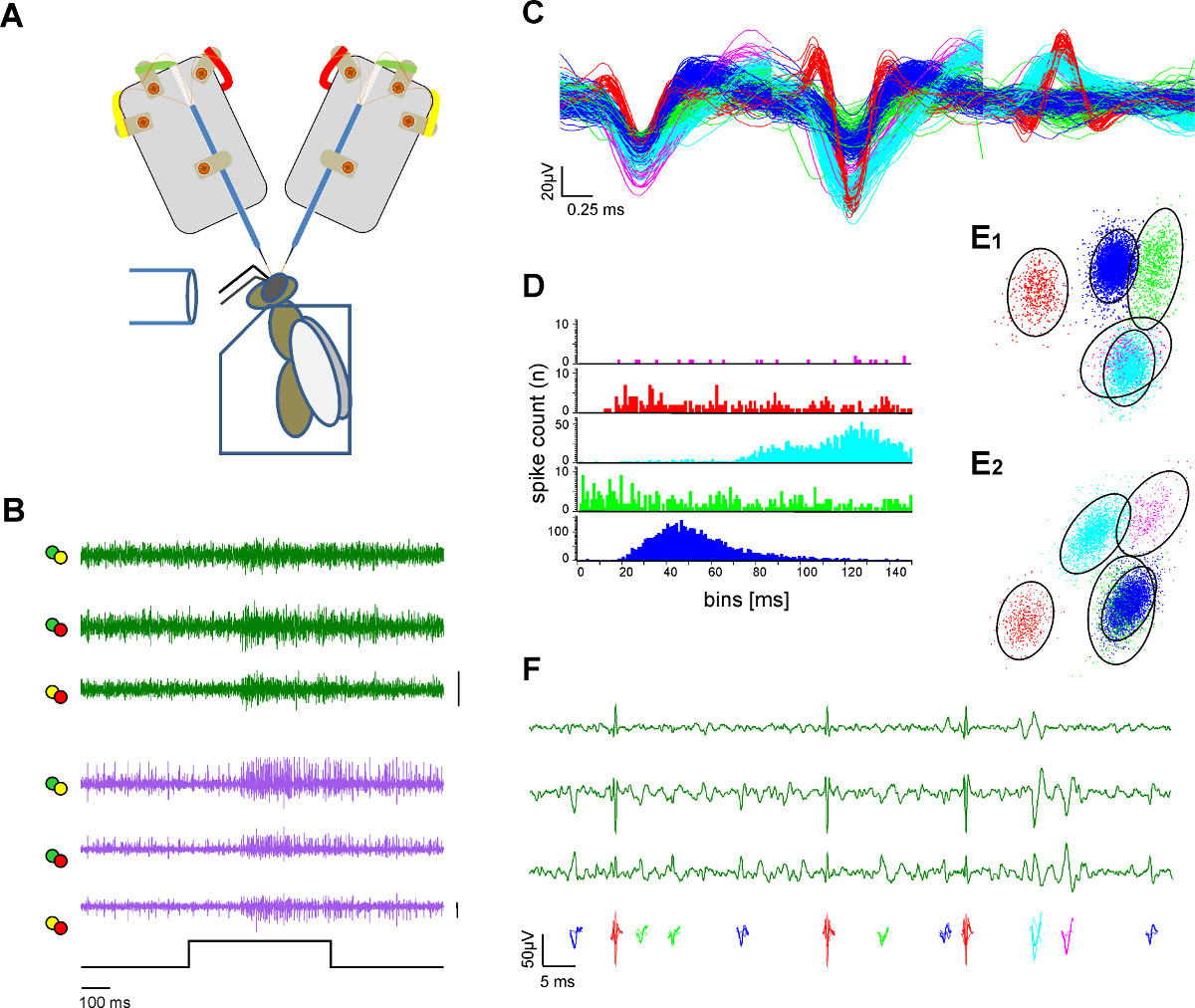
الرقم 3. خارج الخلية تسجيل في اثنين مساحات العصبية واستخراج وحدة واحدة (ارتفاع الفرز). A ) الرسم التخطيطي من الإعداد التجريبية. وتركز اهتمامها على النحل في حامل زجاجي. يتم توفير التحفيز رائحة عبر أنبوب زجاجي. اثنين من السيقان القطب تقوم بالتسجيل من الدماغ النحل المكشوفة. B) في وقت واحد التسجيلات من لتر وم-ALT السندات الإذنية (الأخضر والأرجواني آثار) تظهر الاستجابات مثير على كل مساحات إلى التحفيز 500 ميللي ثانية رائحة العسل في محلول الماء بتركيز 1:100 في 33 درجة مئوية. كل سطر يمثل تآمر القنوات متباينة كتسمية مرمزة من العروات لحام كهربائي في بار A.: 50 μV C) بعد الإجراءات ارتفاع الفرز يتم فرز إمكانات العمل واحد ولون مشفرة. تراكب من الوحدات التي تم فرزها يوضح الفصل بين الطول الموجي. D) سبايك الرسم البياني فاصل يشير إلى نوعية الفصل بين الوحدات التي تم فرزها كدليل على ارتفاع الفرز كافية. ملاحظة عدم وجود ارتفاع في الفترة صهر الوحدة. E) رأيان (E1، E2) منوتجمع 3D وحدة فرزها مع تحليل العنصر الرئيسي الذي يشير إلى مسافة الوحدات التي تم فرزها لبعضها البعض. الدوائر تدل على مسافة 2.5 أضعاف Mahalanobis التي تشبه SD في الفضاء ويشير إلى وجود تمايز كبير من المجموعات في الفضاء المكون الرئيسي F) اللون وحدات ترميز تصور إمكانات العمل مرئية في التكبير من ثلاث قنوات من تسجيل المسالك واحدة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4. التصور بعد تسجيل وإعادة الإعمار 3D-الموقف التسجيل. أ) عرض الإسقاط من أورثو-شرائح على طول ض محاور مع أقصى قدر من المواءمة كثافة من انتيرووردمها إلى الوراء من الخلايا العصبية الإسقاط إسقاط uniglomerular من AL إلى MB وLH. تم إدراج التتبع داخل الخلايا Microruby (tetramethylrhodamin ديكستران) إلى AL بعد التجارب التسجيل. الكبيبات الملون داخل AL دليل PN تلطيخ المناسبة. B) الإسقاط عرض شرائح أورثو على طول ض محاور مع أقصى قدر من المواءمة كثافة من تلطيخ من القطبين مع اليكسا هيدرازيد 488 مما يدل على وضع قطب كهربائي لم-ALT (E1، السهم ) و l-ALT (E2، السهم). التتبع اليكسا هيدرازيد 488 يهاجر إلى الأنسجة المحيطة القطب والبقع موقع الإدراج القطب. لاحظ، وتلطيخ بارز في الجامعة هو الحرفية السطحية. C) 3D إعادة بناء الخلايا المستهدفة ملطخة (السندات الإذنية) وموقع القطب الإدراج من A، B (الجانب الأيمن) جنبا إلى جنب مع لمحة التخطيطي للنظام حاسة الشم نحل العسل (يسار الجانب) مع الإشارة إلى مسارات-L و m-ALT. ملاحظة، فقط uniglomerوتظهر مساحات جزيئية PN. AN: الأعصاب antennal، AL: الفص antennal، LH: القرن الوحشي، MB: هيئة فطر، E1، E2: مواقع الإدراج الكهربائي، M-ALT: سطي لوب Antennal المسالك، L-ALT: الوحشي لوب Antennal المسالك، ج: الذيلية، ص: منقاري، م: وسطي، ل:. الوحشي الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

الشكل 5. مثال على رائحة تركيز الترميز داخل المسار المزدوج توضيح حاسة الشم. A) المؤامرات الحرارة رد واحد ل-ALT (الخضراء) و M-ALT احد PN (البنفسجية) حصلت في وقت واحد من نحل العسل الفردية ردا على الرائحة hexanal إلى زيادة تركيزات رائحة (من 1: 10 -6 إلى 1:100). كل سطر في المتوسط عشرة STIM المحاكمةulation. يظهر معدل اطلاق مثل تغير الكثافة النسبية وهو معدل اطلاق النار في ما يتعلق النشاط العفوي طرح باء) استجابة السكان الكمون من 11 لتر و 13 م ALT السندات الإذنية من 7 النحل المسجلة. في كل النحل سجلت السندات الإذنية من كل مساحات في وقت واحد. يظهر الكمون استجابة السكان الكمون تناقص مع زيادة تركيز الرائحة في السندات الإذنية من كل مساحات. تم تسجيل ظهور رائحة استجابة في الهوائيات في 99 ميللي ثانية عبر electroantennograms وتطرح من الإختفاء استجابة PN. لاحظ أنه عند أدنى تركيزات استجابات ضعيفة جدا لقياس الكمون، وبالتالي تم استبعاد استجابة. C) السكان يطلقون معدل من نفس السندات الإذنية كما في B. ومع تزايد تركيز الرائحة قوة الاستجابة آخذ في الازدياد. يبين-ALT لتر قوة استجابة أقوى. في B، C وترد المتوسط وSD.
الشكل 6. مقارنة النشاط السكاني في مرحلتين المعالجة اللاحقة على طول مسار حاسة الشم في نحل العسل و. تم تسجيل البيانات في 20 الحيوانات التي حفزت مع 1-HEXANOL و 2 octanone. A) كل سطر يمثل اللون كاذبة مشفرة متوسط معدل اطلاق النار من إسقاط واحد الخلايا العصبية (PN) المحسوبة في 10 التكرار رائحة 1-HEXANOL. يبدأ العرض في وقت ورائحة 0 واستمرت ثلاث ثوان. B) يظهر نفسه كما في A) ولكن لجسم الفطر الخلايا العصبية خارجي (EN). المصفوفة هو مبين في A) يمكن أن ينظر إليها باعتبارها ناقلات السكان PN خلال التحفيز رائحة مع 1-HEXANOL. حسبنا نفس النوع من ناقلات السكان خلال التحفيز رائحة مع 2 octanone واستخدامها على حد سواء ناقلات في تحليل المكون الرئيسي (PCA) الحفاظ على البعد الزماني. ج) ثلاثة مكونات رئيسية الأول (PC1 و 2 و 3) وتآمر ضد بعضها البعض لتوضيح فصل الرائحة في النشاط الفرقة PN في الانتاج الفص antennal. وتعد هذه المرة قبل بداية رائحة سوداء. ويظهر النشاط خلال ثلاث ثوان من التحفيز مع 1-HEXANOL باللون الأزرق. يظهر النشاط خلال التحفيز مع 2 الأوكتانول باللون الأحمر. وعلاوة على ذلك، وتبين لنا 1.5 ثانية (آخر) من النشاط بعد رائحة مجموعة من 1-HEXANOL (الضوء الأزرق) و 2 octanonen (الوردي). لاحظ أنه على مستوى الفرقة PN، سواء الروائح تستحضر مسارات واضحة للغاية تسوية في "النقطة الثابتة" التي يدوم أطول فترة التحفيز رائحة كله. إلا بعد رائحة تعويض مسارات نقل مرة أخرى إلى النشاط الأساسي دون التحفيز رائحة. D) وقد أجري التحليل نفسه على مستوى الفرقة EN تمثل النشاط في الانتاج الجسم الفطر. مقارنة مع النشاط PN الروائح تثير مسار أقل وضوحا. وعلاوة على ذلك "نقطة ثابتة" ليست واضحة. في البداية رائحة مسارات بفعل الأسواق العالمية ضغطهاrmingle مع النشاط الأساسي على الرغم من أن رائحة لا تزال موجودة. فقط رائحة تعويض أثار مسارا إضافية.
. الفيلم 1 حل وقت تقييم رائحة يسببها المسار بعد تحليل المكون الرئيسي للناقل PN-السكان (يسار) ومتجه السكان EN (اليمنى. حزب المحافظين الشكل 6) وتشمل الأجزاء العلوية المكونات الرئيسية الثلاثة الأولى (PC1، 2 و 3) تآمر ضد بعضها البعض. توضيح الألواح أقل تقييم PC1 و 2 و 3 مع مرور الوقت. يتم وضع علامة التحفيز رائحة بواسطة شريط الرمادية. وقد تزامن كل اللوحات. لاحظ أن النشاط السكاني EN يبدأ قليلا قبل النشاط السكاني PN، وهي ظاهرة يبدو أن contraintuitive ولكن يمكن تفسير ذلك الربط وخصائص الطبقات المعنية، والتي يتم مناقشتها في وقت سابق 1.
Discussion
يوضح هذا المقال إنتاج واستخدام مصمم خصيصا متعدد القنوات الصغيرة الأسلاك الكهربائية. الأقطاب وصفها هي مناسبة لتسجيل كل من وحدة واحدة والنشاط السكاني وهو أمر مفيد خاصة بالنسبة للقياسات الكمون وغيرها من الخصائص الزمانية استجابة الخلايا العصبية المختلفة وneuropils مختلفة ضمن عينة واحدة (لمزيد من التفاصيل انظر 1،2،25). بالإضافة إلى ذلك أظهرنا كيفية تنفيذ بشكل دائم الأقطاب والأسلاك الدقيقة للسماح التسجيلات مستقرة طويلة الأجل في التصرف النحل التي تستمر لساعات تصل إلى أيام.
أصبح خارج الخلية تسجيلات متعددة وحدة أداة مواتية لتحقيق القرار الزماني عالية جنبا إلى جنب مع المعلومات المكانية. في حالتنا، وهذه هي إما مساحات العصبية موازية 2 أو اثنين neuropils مختلفة 1. الخلايا العصبية متعددة يمكن تسجيلها وتحليلها على مستوى الخلايا العصبية واحد وبشكل متواز في القرار الزماني عالية. سجل وحدة متعددةطبقت بالجلسات الأولى في الثدييات 38 و في وقت لاحق أيضا في الحشرات 39-41. وقد تحقق تقدم كبير في تطوير وتحسين تقنيات التسجيل خارج الخلية متعدد القنوات 42،43. هذا، على سبيل المثال، يتضمن تطوير أقطاب جديدة 44 أو الرواية ارتفاع الفرز والتجميع خوارزميات 45. الطرق العامة من تقنيات التسجيل وحدة متعددة خارج الخلية وصفا جيدا 46-48. الأقطاب الذاتي بنيت يظهر في هذا الفيديو بالإضافة إلى ذلك يمكن تكييفها عن طريق إضافة المزيد microwires في القطب أو أسلاك متناهية الصغر يمكن الملتوية للحصول على مسافات ثابتة قابلة للقياس بين النصائح. أن كلا الإجراءين، ومع ذلك، يؤدي إلى تناقص المرونة وزيادة سمك القطب.
مقارنة مع تحقيقات السيليكون المستخدمة عادة لتسجيلات خارج الخلية في الحشرات أكبر من ذلك بكثير مثل الصقور العثة، الجراد والصراصير 40،49 - 51 وصفت الأسلاك الكهربائية الصغيرة هي أصغر ومرنة ويمكن التعامل بسهولة مع حركات الدماغ المحتملة، وبالتالي، يمكن استخدامها بشكل موثوق في الحشرات الاجتماعية الصغيرة مثل النحل والنمل التي تظهر ذخيرة السلوكية أوسع من ذلك بكثير. معظم تحقيقات السيليكون لديهم ساق حادة مثل هياكل قطع محاور عصبية والأنسجة العصبية على طول قناة الإدراج، في حين الأسلاك الدقيقة وصفها هي الجولة، مرونة وأصغر حجما وبالتالي هي أقل ضررا على الأنسجة المحيطة بها والتي هي ميزة واضحة إذا كان الهدف هو دراسة طويلة اللدونة الأجل في حيوان سليمة ويتصرف. ميزة أخرى من الأقطاب الكهربائية الأسلاك الدقيقة هو إنتاجها منخفضة التكلفة وسهولة التعامل. بدلا من التنظيف بعناية اجراء تحقيق سيليكون مكلفة الأسلاك الكهربائي وقطع طازجة قبل الإدراج في الدماغ، وبالتالي عدم وجود مشاكل الازدحام. وعلاوة على ذلك فمن الممكن استخدام أكثر من واحد سلك كهربائي الصغرى في نفس إعداد إدراجها إما في neuropiles مختلفة 1 سمساحات ص 2 كما نعرض هنا. هذا النهج هو مواتية خاصة لتحليل ومقارنة الجوانب الزمانية مثل الإختفاء الاستجابة والتفاعلات على مختلف المستويات المعالجة العصبية.
نحن على بينة من حقيقة أن الإشارات المسجلة خارج الخلية لا تعكس النشاط خلية واحدة في حد ذاتها. هو دائما مركب من النشاط الكهربائي في جميع أنحاء طرف القطب. لتحديد مصدر إشارة الفرق من قناتين الأسلاك الصغيرة المجاورة داخل القطب واحد وتحسب دائما. وبالتالي كانت مصدر لإشارات ارتفاع المستخدمة لاستخراج النشاط حدة واحدة دائما قريبة جدا من واحد أو قناة القطب الآخر مما أدى إلى ارتفاع الطول الموجي يمكن تمييزها بسهولة. إشارات من أبعد، مثل نشاط العضلات أو نشاط neuropils المجاورة، والوصول إلى كل من الأقطاب الكهربائية في نفس الوقت تستحضر الأشكال للمقارنة وسعة وسيتم تجاهل هذا الإجراء. باستخدام تقنية القالب مطابقة Spike2،نحن واثقون جدا للحصول على النشاط وحدة واحدة، والتي ليست هي نفسها، ولكن قريبة جدا من نشاط الخلايا العصبية واحدة. ومع ذلك، يمكن تجنب مسألة ارتفاع الفرز باستخدام تقنيات التسجيل داخل الخلايا.
تسجيلات خلية واحدة مع أي من أقطاب حادة أو ماصات التصحيح تسمح المعرفة بتعمق حول خصائص الفسيولوجية للخلية عصبية واحدة. ولكن نظرا لصغر حجم الخلايا العصبية الحشرات وneurites التي منها (على سبيل المثال، أقل من 1 ميكرون لنحل العسل السندات الإذنية 52) تسجيلات المدى القصير فقط يمكن التحكم فيها. وعلاوة على ذلك، والتسجيلات داخل الخلوية قد تكون غازية ويمكن أن يؤذي الخلية التي هو ربما سبب آخر لقيود زمنية. في الجسم الحي تسجيلات داخل الخلايا في الحشرات نادرا ما تدوم ساعة واحدة. A نافذة الوقت الذي كان كافيا لعمله الرائد مارتن المطرقة 53 الذي سجل داخل الخلايا من الخلايا العصبية التي تم تحديدها واحد، وبطني المفردة maxilar الخلايا العصبية رقم 1 (VUMmx1). ما في وسعه ليترالحبر نشاطها مباشرة إلى مسار المثوبة. جوليان Mauelshagen 54 مسجلة داخل الخلية النشاط لتحديد فطر الجسم خارجي الخلايا العصبية، والخلايا العصبية السويقة خارجي # 1 (PE1) خلال تكييف الكلاسيكية. وكان نفس الخلايا العصبية في تركيز منزل ومانز 55 عندما وجدوا الكمونية بعد التحفيز الكهربائي للخلايا كينيون. ومع ذلك، يمكن أن اوكادا وزملاؤه 56 استخدام نمط ارتفاعه داخل الخلية تتميز كذلك (المسامير المزدوجة والثلاثية) لتحديد PE1 خلال التسجيلات خارج الخلية. بعد كل شيء مزيج من الطريقتين، والتسجيلات داخل الخلايا من الخلايا العصبية التي تم تحديدها والتسجيلات خارج الخلية على المدى الطويل قد يكون أداة قوية للتحقيقات في المستقبل.
ومع ذلك، باستخدام الأقطاب حادة لتسجيل عدة خلايا (وحدات) في وقت واحد عند مستويات معالجة مختلفة على مدى ساعات طويلة تصل إلى أيام لتحليل علاقاتهم الاستجابة الزمنية و / أو حتى التغييرات البلاستيك طيكاد يكون من المستحيل.
مع اقتراب التصوير الكالسيوم الأولى في نحل العسل 57،58 باستخدام الأصباغ الكالسيوم الحساسة وتحليل الأنماط المكانية لاستجابات رائحة الوصول 59-62. ومع ذلك، في كثير من الحالات الأصباغ الحساسة الكالسيوم يجب أن تكون أدخلت على أنسجة المخ عن طريق التلاعب الغازية التي تحد مرة أخرى مدى الحياة والنحل والخصائص الذاتية للخلايا تحليلها. يتم التغلب على هذه المشكلة في الكائنات نموذج آخر مثل ذبابة الفاكهة باستخدام أجهزة استشعار الكالسيوم قدم وراثيا 63،64. ولكن، بشكل عام، وأجهزة الاستشعار الكالسيوم قد فرض قيود أخرى لأنها يمكن أن تكون بمثابة مخازن الكالسيوم التي تؤثر على الأرجح الخصائص الزمانية الردود الرائحة. يمكن تسجيلات داخل الخلايا في وقت واحد جنبا إلى جنب مع التصوير الكالسيوم أو النهج الحسابية تثبت القرار الزماني السليم لعمليات التصوير 65،66. ومع ذلك، فإن القرار الزمني للعملية التصوير في حد ذاته هو راذهص محدودة. نظم حيازة البصرية عادة استخدام CCD التصوير مع القرار الزماني من 5-20 هرتز 67، على الرغم من 2 فوتون التصوير قد تكون قادرة على الحصول على تسلسل أسرع 68. ومع ذلك، وزيادة معدل أخذ العينات يذهب دائما جنبا إلى جنب مع خسارة في القرار المكانية. وعلاوة على ذلك الأصباغ الكالسيوم الحساسة المستخدمة في نحل العسل الخضوع التبييض، مما يقلل أيضا اكتساب الوقت 69.
بالمقارنة مع غيرها من تقنيات التسجيل الفسيولوجية في الحشرات لدينا متعدد القنوات مرنة أقطاب الصغرى سلك ضمان وصول وقت طويل إلى وحدة واحدة والسكان نشاط الخلايا العصبية في التصرف النحل.
أثبتنا كيفية استخدام اثنين من هذه الأقطاب في مراحل المعالجة المختلفة في نفس الحيوان، مما يسهل تحليل الجوانب الترميز الزمني بين المواقع تسجيل مختلفة. تعتمد على مشكلة البحث ونموذج الحشرات الطريقة الأساسية لبناء القطب تظاهر هنا يتم تمديد بسهولةقادرة و / أو يمكن تكييفها. على سبيل المثال فإنه من الممكن تصور لاستخدام أكثر من الأسلاك الثلاثة واحد لإنتاج الأقطاب متعدد القنوات. بالإضافة إلى ذلك، عدد من المواقع يمكن تمديد تسجيل ومراقبة الجوانب الزمانية أكثر من اثنين أو مساحات neuropils هو ممكن عمليا. أملنا هو أن هذا الأسلوب سوف تلهم العديد من العلماء وسيساهم بشكل إيجابي في فهم معالجة الخلايا العصبية في أدمغة متطورة الصغيرة.
Disclosures
يعلن الكتاب أنه ليس لديهم مصالح مالية المتنافسة.
Acknowledgements
The authors would like to thank Isabelle Reus for establishment of tracing the electrode insertion side, Tobias Rosenbaum for LabView programming, Anneke Meyer for data analyzes and helpful discussions. We thank Randolf Menzel for discussion and practical help during early stage of electrode development. Furthermore we thank Brian Smith for postdoctoral association to MS-B. This work was supported by the Deutsche Forschungsgemeinschaft (DFG, SPP 1392, Ro1177/5-2) to WR.
Materials
| Name | Company | Catalog Number | Comments |
| Paraffin oil | Fluka | 76235 | |
| Odors | Sigma Aldrich | ||
| PBS | pH 7.2 | ||
| 4% Formaldehyde | ThermoScientific | 28908 | Methanol free |
| Triton X | BioChemica | A1388 | |
| Methylsalicylate | Roth | 4529.1 | |
| Tetramethylrhodamin dextran, 10,000 MW (Microruby) | Invitrogen | D7162 | keep dark |
| Alexa 488 hydrazide | Invitrogen | A-10436 | keep dark |
| Alexa 568 hydrazide | Invitrogen | A-10437 | keep dark |
| Bee Ringer Solution | see 2 | ||
| Polyurethane-coated copper wire | Elektrisola | 15µm diameter & P155 insulation | |
| Dental Wax | Densply Detrey | 64103015S1 | moderate melting point |
| Dental Wax | Flexaponal | 124-202-00 | low-melting Wax |
| KWIK SIl | WPI | 03L | |
| 18 Pin Socket | Conrad Electronic | 189634-62 | |
| Hot melting glue | Conrad Electronic | 827673 | |
| soldering needle | Conrad Electronics | 830283 | 12 V |
| Soldering terminal lug | Conrad Electronic | 531901 | |
| Glaselectrodes | WPI | 1B100F-3 | |
| Minutien Pins | Fine Science Tools | 26002-20 | V2A 0.2 x 12 mm |
| switchable headstage | Tucer Davis Technologies | SH16 | |
| Headstage connection module | NPI | INT-03M | |
| Amplifier Module | NPI | PDA-2F | |
| Data Acquisition boards | National Instruments | NI-6123, Ni-6143 | |
| Acquisition Software | National Instruments | Lab View 8.2 | custom design |
| Spike-Sorting | CED | Spike 2 v7.11 | |
| Matlab | Mathworks | R2008B | |
| Micromanipulator | Leitz | manual | |
| AG-wires | WPI | AGT05100 | |
| Confocal laser scanning microscope | Leica | TCS SP2 AOBS | |
| AMIRA | Mercury Computer Systems | 2/5/2000 |
References
- Strube-Bloss, M. F., Herrera-Valdez, M. a., Smith, B. H. Ensemble response in mushroom body output neurons of the honey bee outpaces spatiotemporal odor processing two synapses earlier in the antennal lobe. PLoS ONE. 7 (11), (2012).
- Brill, M. F., Rosenbaum, T., Reus, I., Kleineidam, C. J., Nawrot, M. P., Rössler, W. Parallel processing via a dual olfactory pathway in the honeybee. The Journal of neuroscience the official journal of the Society for Neuroscience. 33 (6), 2443-2456 (2013).
- Menzel, R. The honeybee as a model for understanding the basis of cognition. Nature Reviews Neuroscience. 13 (11), 758-768 (2012).
- Sandoz, J. Behavioral and neurophysiological study of olfactory perception and learning in honeybees. Frontiers in Systems Neuroscience. 5, (2011).
- Giurfa, M. Cognition with few neurons: higher-order learning in insects. Trends in Neurosciences. 36 (5), 1-10 (2013).
- Menzel, R., Giurfa, M. Cognitive architecture of a mini-brain: the honeybee. Trends in cognitive sciences. 5 (2), 62-71 (2001).
- Hildebrand, J. G., Shepherd, G. M. Mechanisms of olfactory discrimination: converging evidence for common principles across phyla. Annual Review of Neuroscience. 20, 595-631 (1997).
- Wilson, R. I., Mainen, Z. F. Early events in olfactory processing. Annu. Rev. Neurosci. 29, 163-201 (2006).
- Streinzer, M., Kelber, C., Pfabigan, S., Kleineidam, C. J., Spaethe, J. Sexual dimorphism in the olfactory system of a solitary and a eusocial bee species. The Journal of comparative neurology. 521 (12), (2013).
- Nishino, H., Nishikawa, M., Mizunami, M., Yokohari, F. Functional and topographic segregation of glomeruli revealed by local staining of antennal sensory neurons in the honeybee Apis mellifera. The Journal of comparative neurology. 515 (2), 161-180 (2009).
- Schneider, D. Elektrophysiologische Untersuchungen von Chemo- und Mechanorezeptoren der Antenne des Seidenspinners Bombyx mori L. Zeitschrift für Vergleichende Physiologie. 40 (1), 8-41 (1957).
- Menzel, R., Rybak, J. Antennal lobe of the honeybee. Handbook of brain microcircuits. , 427-432 (2011).
- Girardin, C. C., Kreissl, S., Galizia, C. G. Inhibitory connections in the honeybee antennal lobe are spatially patchy. Journal of neurophysiology. 109 (2), 332-343 (2013).
- Meyer, A., Galizia, C. G. Elemental and configural olfactory coding by antennal lobe neurons of the honeybee (Apis mellifera). Journal of comparative physiology. A, Neuroethology, sensory, neural, and behavioral. 198 (2), 159-171 (2012).
- Abel, R., Rybak, J., Menzel, R. Structure and response patterns of olfactory interneurons in the honeybee, Apis mellifera. The Journal of comparative neurology. 437 (3), 363-383 (2001).
- Kirschner, S., Kleineidam, C. J., Zube, C., Rybak, J., Grünewald, B., Rössler, W. Dual olfactory pathway in the honeybee, Apis mellifera. The Journal of comparative neurology. 499 (6), 933-952 (2006).
- Galizia, C. G., Rössler, W. Parallel olfactory systems in insects: anatomy and function. Annual review of entomology. 55 (August), 399-420 .
- Ito, K., Shinomiya, K., et al. A coordinated nomenclature system for the insect brain. Neuron. 81 (4), 755-765 (2014).
- Rybak, J. The digital honey bee brain atlas. Honeybee Neurobiology and Behavior. , 125-140 (2012).
- Rössler, W., Brill, M. F. Parallel processing in the honeybee olfactory pathway: structure, function, and evolution. Journal of comparative physiology. A, Neuroethology, sensory, neural, and behavioral. 199 (11), (2013).
- Mobbs, P. The brain of the honeybee Apis mellifera. I. The connections and spatial organization of the mushroom bodies. Philosophical transactions of the Royal Society of London. Series B, Biological. 298 (1091), 309-354 (1982).
- Strausfeld, N. J. Organization of the honey bee mushroom body: representation of the calyx within the vertical and gamma lobes. The Journal of comparative neurology. 450 (1), 4-33 (2002).
- Witthöft, W. Absolute Anzahl und Verteilung der Zellen im Hirn der Honigbiene. Zeitschrift für Morphologie der Tiere. 61 (1), 160-184 (1967).
- Rybak, J., Menzel, R. Anatomy of the mushroom bodies in the honey bee brain: the neuronal connections of the alpha-lobe. The Journal of Comparative Neurology. 465, 444-465 (1993).
- Strube-Bloss, M. F., Nawrot, M. P., Menzel, R. Mushroom body output neurons encode odor-reward associations. The Journal of neuroscience : the official journal of the Society for Neuroscience. (8), 3129-3140 (2011).
- Haddad, R., Lanjuin, A., Madisen, L., Zeng, H., Murthy, V. N., Uchida, N. Olfactory cortical neurons read out a relative time code in the olfactory bulb. Nature neuroscience. (May), 1-11 (2013).
- Martin, J. P., Beyerlein, A., et al. The neurobiology of insect olfaction: Sensory processing in a comparative context. Progress in neurobiology. 95 (3), 427-447 (2011).
- Nawrot, M. P. Dynamics of sensory processing in the dual olfactory pathway of the honeybee. Apidologie. 43 (3), 269-291 (2012).
- Farkhooi, F., Froese, A., Muller, E., Menzel, R., Nawrot, M. P. Cellular adaptation facilitates sparse and reliable coding in sensory pathways. PLoS computational biology. 9 (10), e1003251 (2013).
- Saha, D., Leong, K., Katta, N., Raman, B. Multi-unit recording methods to characterize neural activity in the locust (Schistocerca americana) olfactory circuits. Journal of visualized experiments JoVE. (71), (2013).
- Saha, D., Leong, K., Li, C., Peterson, S., Siegel, G., Raman, B. A spatiotemporal coding mechanism for background-invariant odor recognition. Nature neuroscience. 16 (12), 1-13 (2013).
- Mizunami, M., Okada, R., Li, Y., Strausfeld, N. J. Mushroom Bodies of the Cockroach Activity and Identities of Neurons. Journal of Comparative Neurology. 519 (July), 501-519 (1998).
- Okada, R., Ikeda, J., Mizunami, M. Sensory responses and movement-related activities in extrinsic neurons of the cockroach mushroom bodies. Journal of Comparative Physiology A: Sensory, Neural, and Behavioral Physiology. 185 (2), 115-129 (1999).
- Haehnel, M., Froese, A., Menzel, R. In vivo Ca2+ imaging of mushroom body neurons during olfactory learning in the honey bee. Journal of visualized experiments JoVE. (30), (2009).
- Felsenberg, J., Gehring, K. B., Antemann, V., Eisenhardt, D. Behavioural pharmacology in classical conditioning of the proboscis extension response in honeybees (Apis mellifera). Journal of visualized experiments JoVE. (47), (2011).
- Rehder, V. Quantification of the honeybee’s proboscis reflex by electromyographic recordings. Journal of Insect Physiology. 33 (7), 501-507 (1987).
- Serrano, E., Nowotny, T., Levi, R., Smith, B. H., Huerta, R. Gain control network conditions in early sensory coding. PLoS computational biology. 9 (7), e1003133 (2013).
- Hubel, D. H., Wiesel, T. N. Receptive fields and functional architecture of monkey striate cortex. The Journal of physiology. 195 (1), 215-243 (1968).
- Christensen, T. A., Pawlowski, V. M., Lei, H., Hildebrand, J. G. Multi-unit recordings reveal context-dependent modulation of synchrony in odor-specific neural ensembles. Nature neuroscience. 3 (9), 927-931 (2000).
- Byers, K. J. R. P., Sanders, E., Riffell, J. A. Identification of olfactory volatiles using gas chromatography-multi-unit recordings (GCMR) in the insect antennal lobe. Journal of visualized experiments JoVE. (72), e4381 (2013).
- Perez-Orive, J., Mazor, O., Turner, G. C., Cassenaer, S., Wilson, R. I., Laurent, G. Oscillations and sparsening of odor representations in the mushroom body. Science. 297 (5580), 359-365 (2002).
- Stevenson, I. H., Kording, K. P. How advances in neural recording affect data analysis. Nature. 14 (2), 139-142 (2011).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature neuroscience. 7 (5), 446-451 (2004).
- Viventi, J., Kim, D. -. H., et al. Flexible, foldable, actively multiplexed, high-density electrode array for mapping brain activity in vivo. Nature neuroscience. 14 (12), 1599-1605 (2011).
- Pouzat, C., Mazor, O., Laurent, G. Using noise signature to optimize spike-sorting and to assess neuronal classification quality. Journal of neuroscience methods. 122 (1), 43-57 (2002).
- Lewicki, M. S. A review of methods for spike sorting: the detection and classification of neural action potentials. Network. 9 (4), R53-R78 (1998).
- Quian Quiroga, R., Panzeri, S. Extracting information from neuronal populations: information theory and decoding approaches). Nature reviews. Neuroscience. 10 (3), 173-185 (2009).
- Einevoll, G. T., Franke, F., Hagen, E., Pouzat, C., Harris, K. D. Towards reliable spike-train recordings from thousands of neurons with multielectrodes. Current opinion in neurobiology. 22 (1), 11-17 (2012).
- Riffell, J. a., Lei, H., Abrell, L., Hildebrand, J. G. Neural basis of a pollinator’s buffet: olfactory specialization and learning in Manduca sexta. Science. 164 (6), 877-892 (2013).
- Bender, J. a., Pollack, A. J., Ritzmann, R. E. Neural activity in the central complex of the insect brain is linked to locomotor changes. Current biology : CB. 20 (10), 921-926 (2010).
- Perez-Orive, J., Bazhenov, M., Laurent, G. Intrinsic and circuit properties favor coincidence detection for decoding oscillatory input. The Journal of neuroscience the official journal of the Society for Neuroscience. 24 (26), 6037-6047 (2004).
- Rybak, J. . Die strukturelle Organisation der Pilzkörper und synaptische Konnektivität protocerebraler Interneuronen im Gehrin der Honigbiene, Apis mellifera.: eine licht- und elektronenmikroskopische Studie. , (1994).
- Hammer, M. An identified neuron mediates the unconditioned stimulus in associative olfactory learning in honeybees. Nature. 366, 59-63 (1993).
- Mauelshagen, J. Neural correlates of olfactory learning paradigms in an identified neuron in the honeybee brain. Journal of neurophysiology. 69, 609-625 (1993).
- Menzel, R., Manz, G. Neural plasticity of mushroom body-extrinsic neurons in the honeybee brain. The Journal of experimental biology. 208 (22), 4317-4332 (2005).
- Okada, R., Rybak, J., Manz, G., Menzel, R. Learning-related plasticity in PE1 and other mushroom body-extrinsic neurons in the honeybee brain). The Journal of neuroscience: the official journal of the Society for Neuroscience. 27 (43), 11736-11747 (2007).
- Joerges, J., Küttner, A., Galizia, C. G., Menzel, R. Representation of odours and odour mixtures visualized in the honeybee brain. Nature. 387, 285-288 (1997).
- Galizia, C. G., Joerges, J., Küttner, A., Faber, T., Menzel, R. A semi-in-vivo preparation for optical recording of the insect brain. Journal of neuroscience. 76 (1), 61-69 (1997).
- Galizia, C. G., Sachse, S., Rappert, A., Menzel, R. The glomerular code for odor representation is species specific in the honeybee Apis mellifera. Nature. 2 (5), 473-478 (1999).
- Sandoz, J. -. C. Odour-evoked responses to queen pheromone components and to plant odours using optical imaging in the antennal lobe of the honey bee drone Apis mellifera L. The Journal of experimental biology. 209 (18), 3587-3598 (2006).
- Fernandez, P. C., Locatelli, F. F., Person-Rennell, N., Deleo, G., Smith, B. H. Associative conditioning tunes transient dynamics of early olfactory processing. The Journal of neuroscience the official journal of the Society for Neuroscience. 29 (33), 10191-10202 (2009).
- Locatelli, F. F., Fernandez, P. C., et al. Nonassociative plasticity alters competitive interactions among mixture components in early olfactory processing. European Journal of Neuroscience. 37 (1), (2013).
- Silbering, A. F., Bell, R., Galizia, C. G., Benton, R. Calcium imaging of odor-evoked responses in the Drosophila antennal lobe. Journal of visualized experiments JoVE. (61), 1-7 (2012).
- Strutz, A., Völler, T., Riemensperger, T., Fiala, A., Sachse, S. Calcium imaging of neural activity in the olfactory system of Drosophila. Genetically Encoded Functional Indicators. 72, 43-70 (2012).
- Galizia, C. G., Kimmerle, B. Physiological and morphological characterization of honeybee olfactory neurons combining electrophysiology, calcium imaging and confocal microscopy. Journal of Comparative Physiology A: Neuroethology, Sensory, Neural, and Behavioral Physiology. 190 (1), 21-38 (2004).
- Helmchen, F., Waters, J. Ca2+ imaging in the mammalian brain in vivo. European journal of pharmacology. 447 (2-3), 119-129 (2002).
- Stierle, J. S., Galizia, C. G., Szyszka, P. Millisecond stimulus onset-asynchrony enhances information about components in an odor mixture. Journal of Neuroscience. 33 (14), 6060-6069 (2013).
- Haase, A., Rigosi, E., et al. In-vivo two-photon imaging of the honey bee antennal lobe. Biomedical optics express. 2 (1), 131-138 (2010).
- Becker, P. L., Fay, F. S. Photobleaching of fura-2 and its effect on determination of calcium concentrations. The American journal of physiology. 253 (4 pt 1), C613-C618 (1987).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved