Method Article
Grabaciones simultáneas a largo plazo en dos etapas de procesamiento neuronal en Behaving abejas
En este artículo
Resumen
Simultáneas grabaciones extracelulares de largo plazo a partir de dos neuropiles cerebrales diferentes o dos extensiones anatómicas diferentes se establecieron en las abejas. Estas grabaciones permiten la investigación de los aspectos temporales de procesamiento neuronal a través de diferentes áreas cerebrales en la única neurona, así como a nivel de conjunto en un animal de comportarse.
Resumen
En ambos mamíferos e insectos de información neuronal se procesa en diferentes centros de orden superior e inferior del cerebro. Estos centros están acoplados a través de convergentes y divergentes conexiones anatómicas entre ellos alimentación hacia adelante y el cableado de la retroalimentación. Además, la información del mismo origen se envía parcialmente a través de vías paralelas para diferentes ya veces en las mismas áreas del cerebro. Para entender los beneficios evolutivos, así como las ventajas computacionales de estas estrategias de cableado y especialmente sus dependencias temporales de cada otro, es necesario tener acceso simultáneo a las neuronas individuales de diferentes extensiones o neuropiles en la misma preparación a alta resolución temporal. Aquí nos concentramos en las abejas mediante la demostración de un acceso único extracelular largo plazo para registrar la actividad de múltiples unidades en dos neuropiles posteriores 1, el lóbulo antenal (AL), la primera etapa de procesamiento olfativo y el cuerpo de hongo (MB), un orden superior invo centro de integraciónlved en el aprendizaje y la formación de la memoria, o dos tractos neuronales paralelos 2 que conectan la Liga Americana con el MB. Este último fue elegido como un ejemplo y se describe en su totalidad. En el video se demuestra el apoyo a la construcción y la inserción permanente de electrodos flexibles de múltiples hilos de canal. Amplificación diferencial por pares de los canales de electrodos de alambre micro reduce drásticamente el ruido y verifica que la fuente de la señal está estrechamente relacionada con la posición de la punta del electrodo. La flexibilidad mecánica de los electrodos de alambre utilizados permite grabaciones estables invasivos de uso prolongado durante muchas horas hasta días, lo cual es una clara ventaja en comparación con técnicas adicionales e intracelulares en convencionales de grabación in vivo.
Introducción
Las abejas, así como la mayoría de otros insectos dependen en gran medida el olfato. Entre otros que utilizan señales olfativas para la orientación, el apareamiento, la comunicación con sus congéneres, y búsqueda de alimento. Su sistema olfativo bien elaborada contribuye a un rico repertorio de comportamientos de aprendizaje relacionadas con los estímulos de olor florales. Estos comportamientos se pueden estudiar fácilmente bajo condiciones controladas de laboratorio (para revisión ver 3-5). Sus cerebros "mini" (cp. 6) con su número relativamente pequeño de neuronas hace que la abeja melífera en un organismo modelo muy adecuado para el estudio de la codificación olfativo y el aprendizaje durante el monitoreo de la actividad neuronal.
El sistema olfativo en los insectos como en mamíferos muestra organización análoga en gran medida (para revisión ver 7,8). En las abejas alrededor de 80.000 neuronas receptoras 9 situadas en sensilas lo largo de las antenas 10,11 traducen el olor estímulo ambiental en un neurseñal onal. Los axones de las neuronas olfativas del receptor inervan el lóbulo antenal (AL), que tiene una organización glomerular comparable a el bulbo olfatorio de los vertebrados. El AL comprende alrededor de 164 glomérulos interconectados entre sí por unos 4.000 interneuronas locales (LN) (para una revisión ver 12). Especialmente en la abeja se ha demostrado recientemente que los LN proporcionan conectividad lateral irregular y que las diferentes subpoblaciones poseen propiedades olfativas de codificación elementales y configuracionales 13,14. El AL ha demostrado ser subdividido en un lóbulo ventral y dorsal de un hemi dando lugar a la medial y el lóbulo antenal tracto lateral (m-y l-ALT, anteriormente denominado m-y l-APT para medial y lateral protocerebral lóbulo antenal Tracto 15-17). Aquí una nueva terminología del tracto introducido por un esfuerzo reciente por una nomenclatura unificada del cerebro del insecto se utilizará 18. Ambos ALTs (l-y m-ALT) se combinan ya sea 410 (l-ALT) o 510 (m-ALT) proye uniglomerularneuronas cción (PN), respectivamente 15,16,19. PN de ambas vías han sido recientemente demostrado que los olores de código en paralelo 2 (para revisión ver 17,20), y las dos extensiones formar sinápticamente conexiones divergentes con células Kenyon (KC), el cuerpo de hongo (MB) neuronas principales. Cada MB contiene alrededor de 172.000 KC 21-23. El MBS se sabe que están implicados en la integración de estímulos, el aprendizaje y la formación de la memoria. Las dendritas axo de los KC forman el pedúnculo (tallo de la seta), que tiene dos regiones principales de salida: la vertica o alfa-lóbulo y la horizontal o beta-lóbulo 22,24. La salida de la MB converge a sólo alrededor de 400 neuronas extrínsecas (ES) 24. ENS responsable del procesamiento de la información olfativa inervan principalmente la cara ventral del lóbulo vertical 22. Recientemente, se ha demostrado que las EN grabados en esta área codifican la asociación olor recompensa 25.
Temporal comoaspectos dentro del sistema olfativo de los insectos, así como los vertebrados se han convertido en un aspecto importante y significativo como un principio potencial de codificación 26 a 29. Para ser capaz de grabar simultáneamente múltiples neuronas de diferentes sitios con alta resolución temporal, establecimos las técnicas de grabación de múltiples unidades dobles utilizando personalizadas varios electrodos de alambre canal introducidos a diferentes regiones de destino en el sistema olfativo de las abejas. Este enfoque nos permite analizar y comparar el procesamiento temporal en el sistema olfativo de abejas a nivel de las neuronas individuales y poblaciones de neuronas, ya sea entre las vías olfativas paralelas, la doble vía olfativa 2 o entre diferentes neuropils posteriores 1. Recientemente, con un enfoque experimental similar en el sistema olfativo de langostas 30 utilizando una configuración diferente de electrodos fueron capaces de analizar el mecanismo de codificación espacio-temporal de fondo-invariante olor reconocimiento 31. Thnosotros, las grabaciones duales establecidos permiten la recopilación de información espacial sobre los perfiles de actividad neuronal simultánea.
En comparación con el muestreo espacial más amplia obtenida a partir de imágenes de calcio este método permite la grabación de sólo dos puntos. Sin embargo, la ventaja en comparación con las técnicas de imagen de calcio es la alta precisión temporal del potencial de acción grabaciones, que no pueden ser provistos por cualquiera de imagen CCD convencional o de adquisición de imágenes 2-fotón. Los electrodos extracelulares que se describen aquí se implantan y se fijaron en relación con el cerebro y la cápsula de la cabeza evitando deriva de la sonda de forma permanente. Esta es una clara ventaja en comparación con el uso de electrodos intracelulares afilados. Otra de las ventajas en comparación con los registros intracelulares y de imágenes de calcio es el tiempo de observación neuronal extendida desde muchas horas hasta días. Este es un requisito previo importante para investigar correlatos neurales de aprendizaje y formación de la memoria. Los beneficios adicionales de múltiplesgrabaciones de la unidad se detallará en la sección de discusión.
En este panorama metodológico se muestra el procedimiento de fabricación de electrodos de alambre diseño personalizado, adaptado a partir de 32,33 y adecuado para las grabaciones de unidades múltiples a largo plazo en el cerebro de la abeja. Además, un ejemplo de cómo estos tipos de electrodos se implantan permanentemente en dos sitios diferentes de grabación dentro del sistema olfativo abeja para registrar simultáneamente la se muestra L-y el m-ALT durante largos períodos de tiempo para permitir que muchos protocolos de estimulación 2. Para la verificación de las posiciones de registro se proporciona un ejemplo y un protocolo para la tinción y grabación posterior visualización de los sitios de registro.
Protocolo
1. Electrodo de construcción (Figura 1)
- La producción de un adaptador de electrodos que se ajuste a la tarjeta de interfaz de múltiples electrodos 1,2,25 sistemas amplificadores de canal comercial.
- Utilice una placa de plexiglás pequeño pegado a una base del conector de 18 pines.
- Conecte la base con 3 piezas cortas de hilo aislado a 3 lengüetas de soldadura separadas atornillados a la placa de plexiglás (Figura 1 A1-A3).
- Inserte una ranura en la placa de plexiglás en el que un capilar de vidrio se puede mover fácilmente y se mantiene en su lugar mediante un tornillo (Figura 1 B1).
- Extienda el capilar de vidrio de unos 5 mm utilizando un alfiler minutien.
- Conecte los cables de micro electrodos a lo largo del pin minutien y el capilar de vidrio para garantizar la estabilización y apoyo.
- Producción de micro alambre multicanal (adoptado de Ryuichy Okada 32,33)
- Span 3 hilos micro (alambre de cobre recubierto de poliuretano, 15diámetro micras) de una manera que se colocan uno al lado del otro (Figura 1 B2).
- Utilice una aguja de soldadura 12 V para extender una fina capa de cera dental de bajo punto de fusión (50 ° C) parcialmente a lo largo de los cables para unirlos (punta del electrodo) (Figura 1 B3). Deja unos pocos centímetros unglued (final) como electrodo de esta sección se utilizará más adelante para conectar los cables de micro con el adaptador de electrodo.
- Conecte el cable de múltiples micro canal para el adaptador de electrodo
- Retire el capilar de vidrio del soporte y fijarla con el pasador minutien a la punta del electrodo. Ponerla en una posición paralela a la micro-electrodo (Figura 1 B3).
- Pegue la punta del electrodo al pin minutien con cera dental de bajo punto de fusión y corte el electrodo micro en la punta, que sobresale de 2-3 cm de la clavija minutien y al final de electrodos (pequeñas flechas Figura 1 B3).
- Deslice la sl capilarightly de nuevo en el adaptador de electrodo. Utilice el tornillo para fijarlo (Figura 1 B4).
- Soldar los extremos sueltos de los tres cables a las orejetas de soldadura utilizando una pistola de soldadura con una temperatura de alrededor de 360 ° C para asegurar la fusión del aislamiento (Figura 1 B4). Después de la soldadura, asegúrese de que hay un contacto eléctrico adecuado (~ 300 kOhm).
- Instale uno de los electrodos (maestro) a la tarjeta de interfaz de electrodo de la headstage y fijar el otro electrodo multicanal (esclavo) en un adaptador independiente. Conecte los canales del esclavo al electrodo principal (Figura 1 C1). Además, la soldadura de la referencia, así como electrodos musculares a la base del electrodo principal (Figura 1 C2).
2. Preparación Bee (Figura 2)
En estos experimentos descritos, la abeja melífera (Apis mellifera), que es un animal invertebradoy por lo tanto no requiere permisos éticos específicos para el uso, se utiliza.
- Atrapa recolectores de abejas (A. mellifera) en la entrada de la colmena de la mañana, como se muestra por otros 34,35.
- Chill las abejas en hielo picado hasta inmovilización (5 a 10 minutos) y fijar uno en un soporte de plexiglás estándar o tubo de metal de modo que la cabeza está expuesta (Figura 2 A). Para minimizar los movimientos de la cabeza usan cera dental de bajo punto de fusión (~ 50 ° C) y fijan la cabeza con cuidado en el soporte alrededor de la base de los ojos compuestos y el cuello.
- Use cera de bajo punto de fusión que se fije el SCAPI de las antenas en la cápsula de la cabeza (Figura 2 B) sin tocar el flagelo. El flagelo de la antena necesita ser apuntando hacia delante. Asegúrese de que la abeja puede moverse libremente su probóscide.
- Afeitarse la cápsula de la cabeza para asegurar una vista sin ser molestados y el acceso a la parte superior de la cabeza.
- Alimentar a la abeja con una solución de sacarosa al 30% hasta el saturatien para asegurar la humectación suficiente de tejido cerebral y buena viabilidad del animal (Figura 2 C).
- Hacer incisiones cuidadosas verticalmente a lo largo de las fronteras de los ojos compuestos y horizontalmente por encima de las bases de las antenas, así como debajo de los ocelos y retire la pieza desprendida de la cutícula (Figura 2 D).
- Con cuidado, dejar de lado las glándulas hipofaringe y retire la tráquea para asegurar una visión clara y el acceso al cerebro antes de la inserción del electrodo (Figuras 2E, 2F).
3. Electrodo de inserción
En el caso de ejemplo ilustrado en la Figura 2, un electrodo se coloca el objetivo de la L-ALT, el otro objetivo de la m-ALT 2. El uso de puntos de referencia concretos, otras regiones de destino son posibles también, para las regiones de salida AL y MB 1 ejemplo.
- Coloque los electrodos utilizando micromanipuladores en la región de interés ( Figura 2G y 3A). Para orientar el lugar m-ALT electrodo entre el AL y medial del lóbulo vertical de la MB. Asegúrese de que el sitio de inserción está por encima del punto de las PN ALT mediolaterales ramificación. Sobresalen el electrodo en el cerebro con una profundidad de aproximadamente 180 micras (Figura 2E). Para L-ALT PN lugar la grabación el electrodo por debajo de la protocerebro lateral (la LH) en el medio de una línea imaginaria entre el lado lateral del lóbulo vertical y el medio de la AL. Insertar el electrodo con una profundidad de aproximadamente 300 micras (Figura 2e)
- Inserte la referencia (hilo de plata, alrededor de 25 m de diámetro) en el ojo compuesto ipsilateral a través de un pequeño corte en la cutícula. Inserte otro alambre de plata en la región por debajo de la proyección del músculo ocelos laterales. NOTA: Si es necesario, el comportamiento de aprendizaje de la abeja se puede controlar con alta precisión temporal mediante el registro de la M17 muscular, que está implicado in la respuesta de extensión probóscide (PER) de la abeja 36, como se describe en el 25.
- Para anclar sólidamente los electrodos en el cerebro y la cápsula de la cabeza, cubrir todo el espacio por encima del cerebro con dos de silicio componente (Figura 2H), lo que evitará que el cerebro de la desecación. NOTA: las grabaciones pueden durar horas hasta días, y las abejas pueden, por ejemplo, se grabarán durante un procedimiento de condicionamiento clásico (Figura 2H) o estimulada con un gran panel de diferentes olores.
4. Adquisición de datos y preprocesamiento
- Utilice software de adquisición adecuado que cumpla con los siguientes requisitos: tasa de muestreo de 25 kHz min; analógica o digital 2 1,25 diferenciación cruzada entre las canales de electrodos; filtro pasa banda de 300 Hz a 8000 Hz para extraer eventos pico.
- Utilice software de pico de selección disponibles para extraer la actividad de una sola unidad, por ejemplo templcomió técnicas coincidentes tal como se incluye en el software de Spike2 (Figura 3).
- Para un análisis más detallado utilizar las marcas de tiempo de las unidades extraídas para calcular sola unidad un promedio de las respuestas de olor (Figura 4) o para calcular los vectores de la población para el Análisis de Componentes Principales (PCA) (Figura 5) mediante un software comercial. Para analizar más sola unidad y la respuesta de latencia población compara por favor publicaciones recientes 1,2,25.
5. Visualización de la posición relativa del electrodo (Figura 4)
- Sumergir las puntas de electrodos en una solución de 5% ya sea hidrazida Alexa 568 o 5% hidrazida Alexa 488 que se disuelve en solución 0,5 M de cloruro de potasio antes de los experimentos de grabación.
- Retire los electrodos y el silicio cubierta con cuidado después de los experimentos, enjuague el cerebro con solución de Ringer abeja, extraer las glándulas y la tráquea e inserta diminutos cristales de tetramethylrhodamin dextrano o inserte una solución al 5% disuelto en 1,0 M de acetato de potasio en la Liga Americana para etiquetar los ALTs anterogradely. Realice los siguientes pasos en la oscuridad.
- Permita que el tinte que se deben abordar y transportado por las neuronas de proyección a lo largo de sus tractos axonales (30-45 min) (Figura 4), antes de lavar el cerebro con solución de Ringer abeja tres veces para otro 30-45 min.
- Enfríe la abeja en hielo hasta que la inmovilización y retirar con cuidado el cerebro de la cápsula de la cabeza. Fijar el cerebro de un enjuague en una solución 0,1 M PBS que contenía formaldehído al 4% y mantenerlo durante la noche a 4 ° C.
- Espere por lo menos 12 horas antes de lavar el cerebro dos veces en PBS 0,1 M (10 min cada uno).
- Lavar el cerebro 3x durante 20 min en 0,2% de Triton X-100 diluido en 0,1 M de PBS antes de la deshidratación en una serie ascendente de alcohol (30%, 50%, 70%, 90%, 95%, 3x 100% de etanol, 20 min cada paso).
- Incrustar el cerebro deshidratado en Salicilato de metilo en un portaobjetos de microscopio y seal con una tapa deslizante.
- Utilice un microscopio de escaneo láser confocal y escanear el cerebro como secciones ópticas cada 2-5 micras utilizando un compuesto Armónica objetivo del Plan Apochromat (10X 0,4 NA inmersión). Excite el tejido utilizando 568 nm de longitud de onda para el dextrano tetramethylrhodamin y una longitud de onda de 488 nm para la posición del electrodo.
- Reconstruir las estructuras cerebrales teñidas y caminos de los electrodos de las pilas de imágenes en 3D con software de reconstrucción (por ejemplo. AMIRA o Fiji) (Figura 4).
Resultados
"El presente protocolo permite grabaciones simultáneas en dos etapas de procesamiento diferentes dentro de las abejas individuales y, además, permite poner a prueba los mecanismos subyacentes de la memoria y el aprendizaje a través de por ejemplo., PER acondicionado dentro de las abejas sobrios." Este es un requisito previo para el análisis de los aspectos temporales de procesamiento neuronal. El método es fácilmente adaptable para diferentes enfoques científicos a desentrañar la red neuronal del sistema olfativo de las abejas. Por ejemplo, este método se utiliza (i) analizar el procesamiento temporal de PN en la doble vía olfativa de la abeja, la l-y m-ALT PN (Figura 5). En la Figura 5A un ejemplo de un PN L-ALT registrada simultáneamente con un PN de la m-ALT se da como promedio de diez ensayo e ilustra su fuerza de la respuesta y la latencia con respecto a cinco concentraciones diferentes de olor como un código de color parcela de calor. En un promedio de siete abejas con 11 L-y 13 mALT PN (Figuras 5B, 5C) ilustra que tanto la intensidad de la respuesta, así como la latencia de respuesta, en cierta medida, refleja la concentración de odorante. De esta manera PN en este ejemplo aumentan su fuerza de la respuesta, mientras que con el aumento de la concentración de odorante su latencia de respuesta se redujo (Figuras 5B, 5C). Este resultado es bastante limitado y sólo es válida para el odorante analizado, pero sigue siendo compatible con los últimos modelos computacionales de la Liga Americana 37. Si la codificación concentración de olor en AL de la abeja subyace cálculos no lineales o subyace a otras propiedades de codificación aún debe ser analizado en el futuro. Además, el método puede ser utilizado (ii) para comparar los aspectos temporales en la actividad de la población en dos etapas de procesamiento posteriores, el Al-y MB-salida (Figura 6). Análisis de componentes principales (PCA) ilustra que el olor de cálculo se prolonga y dura más que toda la presentación de olores a nivel PN mientras que en ESs sólo el olor dentro y fuera del set estuvieron representados en la actividad de la población (Figura 6). De esta manera la población EN alcanzó su máxima actividad ya en un momento en que la actividad PN aún está en desarrollo (cf. Película 1).
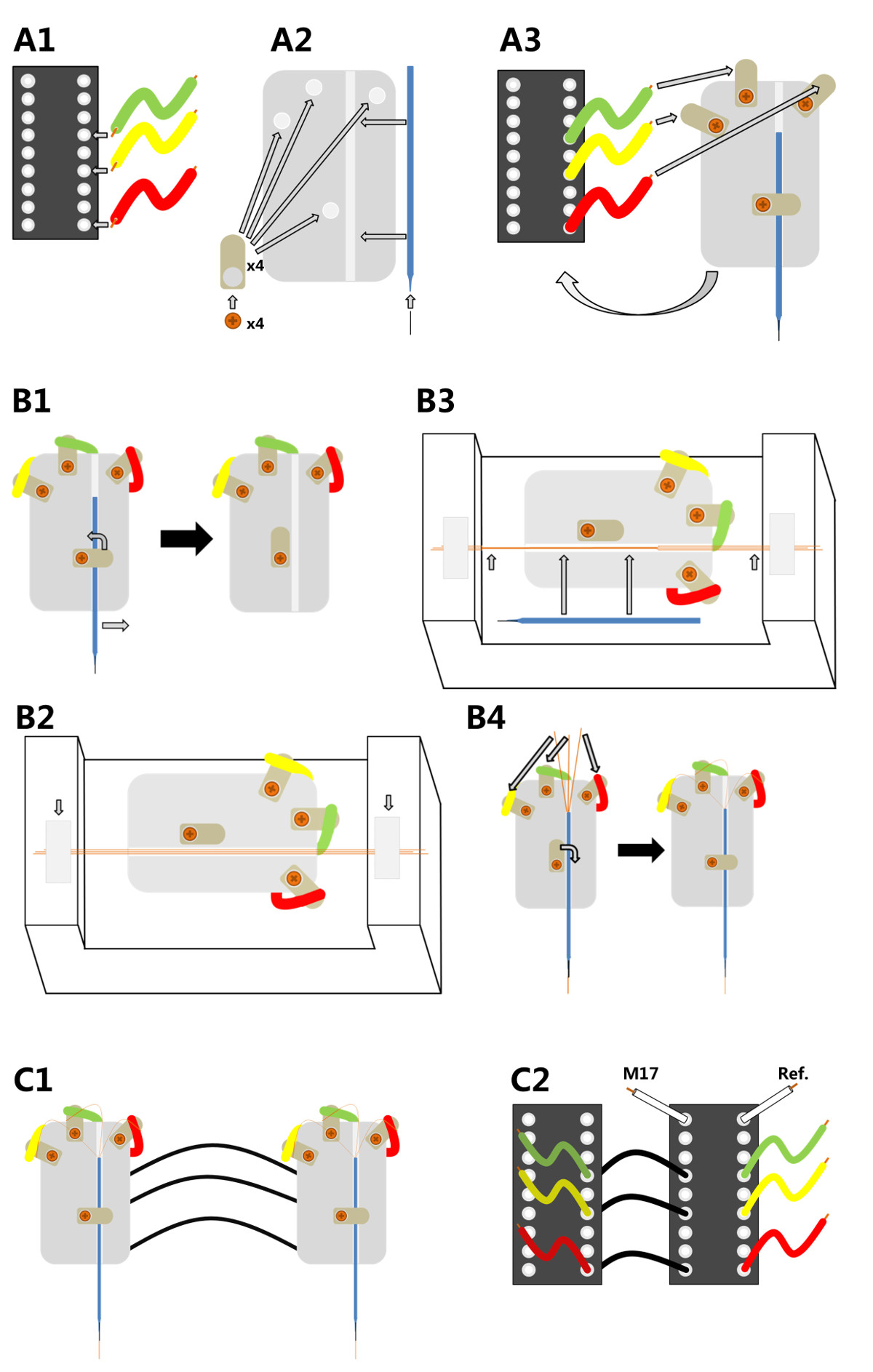
.. Figura 1 Fabricación electrodos micro-alambre de tres canales A1) Las terminaciones de tres cables están soldados a un conector pin IC en posiciones 11, 13 y 16 A2) Cuatro lengüetas de soldadura se enroscan en una placa base de plástico plexiglás.; un pasador minutien se inserta en la punta de un capilar de vidrio que luego se une a la placa de plástico. A3) La placa de plástico se pega en la parte superior de un conector de pines de circuitos integrados y el extremo libre de cada cable está soldado a uno de la parte superior de soldadura orejetas. B1) Para equipar el porta-electrodos con los cables de cobre fino, el capilar tiene que ser tomado una vez más. B2) La base del soporte se fija a continuación en un encargo dispositivo de alineación. Tres cables de cobre micro están alineados a lo largo de la ranura y se fijan con cinta adhesiva en cada extremo B3) Los cables micro paralelas están pegadas con cera dental y el capilar se vuelve a poner en su lugar (flechas largas).; los cables micro pegados se unen entonces al capilar con cera dental y sus extremos se cortan (flechas cortas). B4) Los tres extremos sueltos de los cables de cobre se sueldan a los tres primeros salientes de soldadura con lo que así en contacto eléctrico con la conector de pines de circuitos integrados. C1) Dos electrodos totalmente ensamblados se pueden conectar entre sí para su uso con una sola headstage. C2) Para este propósito los pasadores de un electrodo (izquierda, esclavo) están conectados a través de cables aislados para el otro electrodo (a la derecha, mástilER), que está conectado a la etapa de la cabeza; el electrodo headstage conectado también puede recopilar información de un músculo (M17) y el electrodo de referencia (Ref).
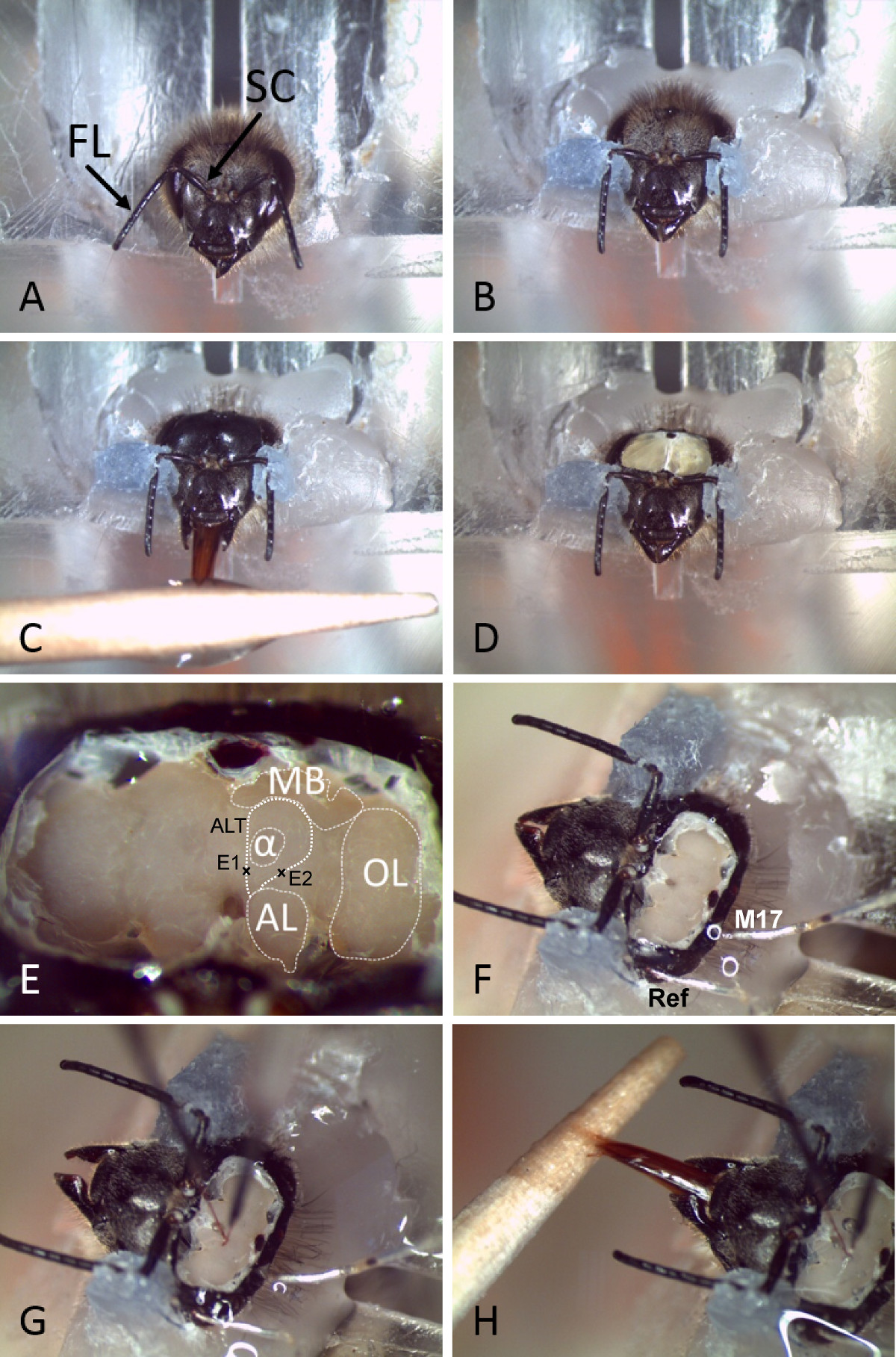
Figura 2. Preparación y inserción de electrodos permanente en el cerebro de abeja. A) Una abeja se inserta en un soporte de plexiglás después de la inmovilización en hielo. Antenas con Flagelo (FL) y scapus (SC) se indican. B) La cabeza y las antenas se fijan con cera dental. C) La cápsula de la cabeza rapada y la abeja se alimenta con agua azucarada. D) Se abre la cápsula de la cabeza. E) Después de quitar las glándulas y la tráquea desde la parte superior del cerebro, las diferentes neuropiles y los principales lugares de interés se pueden distinguir fácilmente. Las trayectorias de las OAB se indican junto conuna marca donde se insertan los electrodos. (MB: cuerpo Mushroom, AL: lóbulo antenal, OL: lóbulo óptico, α: Alfa lóbulo o lóbulos vertical, ALT: tracto lóbulo antenal, E1: lado de inserción de electrodos para las grabaciones de m-ALT, E2: lado de inserción del electrodo para l-ALT grabaciones). F) Referencia (Ref) y electrodos musculares (M17) se insertan en la cápsula de la cabeza a través de pequeños agujeros en la cutícula o el ojo compuesto. G) Los electrodos de alambre se insertan en el cerebro en los lugares apropiados. H) después de la fijación de los electrodos en su lugar con dos de silicio componente, la abeja sigue mostrando PER y puede estar condicionada (por ejemplo., usando agua con azúcar).
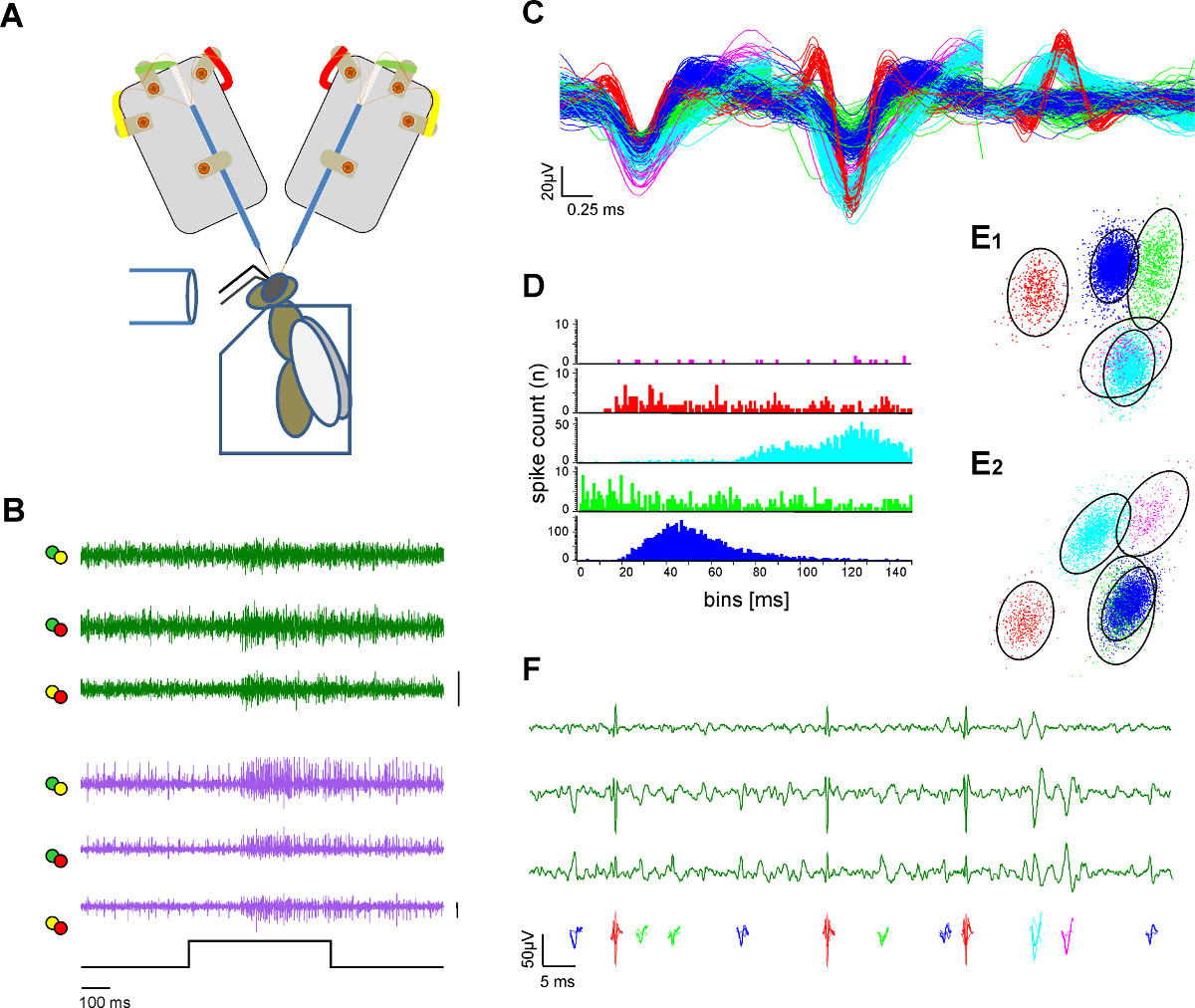
Figura 3. Extracelular grabación en dos tractos neuronales y la extracción de una sola unidad (clasificación pico). A ) Esquema del montaje experimental. La abeja es fijado en un soporte de plexiglás. Estimulación Olor se proporciona a través de un tubo de vidrio. Dos vástagos de electrodo están grabando desde el cerebro de la abeja expuesto. B) registros simultáneos de la l-y m-ALT PN (verde y rastros de color púrpura) que muestra las respuestas excitatorias en ambos tractos a una estimulación de 500 ms olor de la miel en una solución de agua con una concentración de 1:100 a 33 º C. Cada línea trazada representa los canales diferenciados como etiqueta con código de color de las orejetas de soldadura de electrodos en A. Bar:. 50 mV C) Después de los procedimientos de pico clasificar los potenciales de acción individuales se clasifican y un código de color. Superposición de las unidades clasificadas ilustra la separación de las formas de onda. D) de Spike histograma intervalo indica la calidad de la separación de las unidades clasificadas como prueba de clasificación adecuada pico. Tenga en cuenta que no hay pico dentro del período refractario de la unidad. E) Dos vistas (E1, E2) deuna agrupación 3D de la unidad ordenada con análisis de componentes principales que indica la distancia de las unidades ordenados uno al otro. Los círculos indican el 2,5 veces la distancia de Mahalanobis que se asemeja a la SD en el espacio e indica una diferenciación significativa de los grupos en el componente principal del espacio F) Color unidades codificadas representan los potenciales de acción visibles en una ampliación de tres canales de una grabación de las vías. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Visualización Post-grabación y reconstrucción 3D de la posición de grabación. A) vista Proyección de orto-rebanadas a lo largo de los ejes Z con la alineación máxima intensidad de una anteroy relleno retrógrado de las neuronas de proyección uniglomerular sobresalen de la Liga Americana a la MB y LH. El trazador intracelular Microruby (dextrano tetramethylrhodamin) se insertó en la AL después de los experimentos de grabación. Glomérulos teñidas dentro de la AL tinción PN adecuada prueba. B) Vista de proyección de las rebanadas de orto a lo largo de los ejes Z con la alineación máxima intensidad de una tinción de los dos electrodos con Alexa hidrazida 488 que indica la colocación de los electrodos para el m-ALT (E1, flecha ) y l-ALT (E2, flecha). El trazador Alexa 488 Hidrazida migra al tejido circundante del electrodo y tiñe el sitio de inserción del electrodo. Nota, la tinción prominente en la AL es un artefacto superficial. C) 3D Las reconstrucciones de las células objetivo marcadas (PNS) y el sitio de inserción de electrodos de A, B (lado derecho), junto con una vista general esquemática del sistema olfativo abeja melífera (izquierda lado) con la indicación de l-y m-ALT trayectorias. Tenga en cuenta, sólo uniglomerse muestran extensiones ular PN. AN: nervio antenal, AL: lóbulo antenal, LH: asta lateral, MB: cuerpo de setas, E1, E2: sitios de inserción de los electrodos, m-ALT: medial del tracto lóbulo antenal, l-ALT: lateral tracto lóbulo antenal, c: caudal, r: rostral, m: medial, l:. lateral Haga clic aquí para ver una versión más grande de esta figura.

Figura 5. Ejemplo de olor codificación concentración en la doble vía olfativa. A) parcelas de calor ilustran la respuesta de una sola l-ALT (verde) y solo m-ALT PN (púrpura) adquiridos de forma simultánea desde una abeja individual en la respuesta a la odorante hexanal en el aumento de las concentraciones de olor (de 1: 10 -6 a 1:100). Cada línea es una media de diez ensayos stimblación. La velocidad de disparo se muestra como cambio de intensidad relativa que es la tasa de disparos en relación con la actividad espontánea restado. B) Población respuesta de latencia de 11 L-13 y m-ALT PN de 7 abejas registrados. En cada abeja se registraron las PN de ambas vías simultáneamente. La latencia de respuesta de la población muestra una latencia disminuye a medida que aumenta la concentración de olor en el PN de las dos extensiones. El inicio de respuesta olor en las antenas a 99 mseg se registró a través de electroantenogramas y se resta de las latencias de respuesta PN. Tenga en cuenta que en las concentraciones más bajas respuestas son demasiado débiles para las mediciones de latencia y, por lo tanto, fueron excluidos respuesta. C) Población tasa de disparo de las PN mismos como en B. Con el aumento de la concentración de olor de la intensidad de la respuesta está aumentando. La l-ALT muestra una fuerza de la respuesta más fuerte. En B, C se dan la media y SD.

Figura 6. La comparación de la actividad de la población en dos etapas de procesamiento posteriores a lo largo de vía olfativa de la abeja. Se registraron datos de 20 animales que fueron estimuladas con 1-hexanol y 2-octanona. A) Cada línea representa el falso código de color tasa media de disparo de una proyección neurona (PN) calculado a través de 10 repeticiones de olor de 1-hexanol. Presentación Olor comienza en el instante 0 y duró tres segundos. B) muestra el mismo que en A), pero para el cuerpo de hongo neuronas extrínsecas (EN). La matriz que se muestra en A) puede ser visto como un vector población PN durante olor de la estimulación con 1-hexanol. Se calculó el mismo tipo de vector de la población durante la estimulación con olor 2-octanona y utilizamos los dos vectores en un análisis de componentes principales (PCA) manteniendo la dimensión temporal. C) Los tres primeros componentes principales (PC1, 2 y 3) setrazado uno contra el otro para ilustrar la separación olor en la actividad conjunto de PN en la salida del lóbulo antenal. El tiempo antes de la aparición de olores está marcado en negro. Actividad durante los tres segundos de estimulación con 1-hexanol se muestra en azul. La actividad durante la estimulación con 2-octanol se muestra en rojo. Además, se muestra 1,5 segundos (entrada) de la actividad después de olor de un conjunto de 1-hexanol (azul claro) y 2-octanonen (rosa). Tenga en cuenta que en el plano de conjunto PN, ambos olores que evocan trayectorias muy distintas se asientan en un "punto fijo", que sobrevive a todo el período de la estimulación olor. Sólo después de compensar el olor de las trayectorias se mueven de nuevo a la actividad de referencia, sin olor estimulación. D) El mismo análisis se realiza a nivel de conjunto ES representa la actividad en la salida del cuerpo de hongos. En comparación con la actividad PN olores evocan una trayectoria menos distintas. Además, un "punto fijo" no es observable. Las trayectorias inicialmente inducidos olor INTErmingle con la actividad de línea de base, aunque el olor todavía está presente. Sólo el desplazamiento olor evoca una trayectoria adicional.
. Película 1 Hora resuelve la evaluación de un olor inducida trayectoria después de un análisis de componentes principales de un vector PN-población (izquierda) y un vector de población EN. (derecha;. cp Figura 6) Las partes superiores son los tres primeros componentes principales (PC1, 2 y 3) trazan unos contra otros. Los paneles inferiores ilustran la evaluación de la PC1, 2 y 3 con el tiempo. Estimulación Olor está marcado por la barra gris. Todos los paneles fueron sincronizados. Tenga en cuenta que la actividad de la población ES comienza ligeramente antes de la actividad de la población de PN, un fenómeno que parece ser contraintuitive pero puede explicarse por la conectividad y las propiedades de las capas implicadas, que se discute anteriormente 1.
Discusión
En este artículo se demuestra la producción y el uso de micro canal de cable-electrodos múltiples de diseño personalizado. Los electrodos descritos son adecuados para la grabación tanto de una sola unidad y la población que es especialmente útil para las mediciones de latencia y otras propiedades de respuesta temporales de diferentes neuronas y diferentes neuropils dentro de un único espécimen (para más detalles véase 1,2,25). Además hemos demostrado cómo implementar de forma permanente los electrodos micro alambre para permitir grabaciones estables a largo plazo en comportarse abejas que duran horas hasta días.
Grabaciones de varias unidades extracelulares se convirtieron en una herramienta favorable para lograr alta resolución temporal se combina con la información espacial. En nuestro caso, se trata de cualquiera de los tractos neuronales paralelos 2 o dos neuropils diferentes 1. Neuronas múltiples pueden ser registrados y analizados a nivel de la neurona individual en paralelo y con una alta resolución temporal. Record Multi-unitnes se aplicaron por primera vez en 38 mamíferos y más tarde también en los insectos 39-41. Progresos sustanciales se logró con el desarrollo y mejora de las técnicas de grabación de múltiples canales extracelulares 42,43. Esto, por ejemplo, incluye el desarrollo de nuevos electrodos 44 o novedosas de clasificación y clustering algoritmos espiga 45. Métodos generales de las técnicas de grabación extracelulares de múltiples unidades están bien descritos 46 - 48. Los auto construido electrodos que se muestran en este video, además, se pueden adaptar añadiendo más microhilos por electrodos o los cables micro se pueden torcer para ganar distancias constantes medibles entre las puntas. Ambos procedimientos serían, sin embargo, conducir a la disminución de la flexibilidad y el aumento del espesor del electrodo.
En comparación con las sondas de silicona de uso general para las grabaciones extracelulares en los insectos mucho más grandes, como la polilla halcón, langostas y cucarachas 40,49 - 51 los cables-electrodos micro descritos son más pequeñas, flexibles y pueden fácilmente hacer frente a los posibles movimientos del cerebro y, por lo tanto, pueden ser utilizados de forma fiable en pequeños insectos sociales como las abejas y las hormigas que muestran un repertorio conductual más amplio. La mayoría de las sondas de silicona tienen agudo vástago como las estructuras de corte axones y tejido neural a lo largo de su canal de inserción, mientras que los cables de micro descritos son redondos, flexible y más pequeño y por lo tanto son menos perjudiciales para el tejido circundante que es una clara ventaja si el objetivo es estudiar a largo plasticidad plazo en un animal intacto y de comportarse. Otra ventaja de los electrodos micro alambre es su producción de bajo costo y fácil manejo. En lugar de limpiar cuidadosamente una sonda de silicona caro los hilos de los electrodos están recién cortados antes de la inserción del cerebro y, por lo tanto, los problemas de falta de congestión. Además es posible utilizar más de un micro electrodo de alambre en la misma preparación, ya sea insertado en diferentes neuropiles 1 Otractos r 2, como se muestra aquí. Este enfoque es especialmente favorable para analizar y comparar los aspectos temporales como las latencias de respuesta y de las interacciones de diferentes niveles de procesamiento neural.
Somos conscientes del hecho de que una señal grabada extracelular no refleja la actividad de células individuales per se. Siempre es un compuesto de la actividad de tensión alrededor de la punta del electrodo. Para identificar la fuente de la señal de la diferencia de dos canales de cable micro vecinos, dentro de un electrodo se calcula siempre. Así, la fuente de las señales de espiga se utilizan para extraer la actividad de una sola unidad era siempre muy cerca de uno u otro canal de electrodo que resulta en formas de onda de pico fácilmente distinguibles. Las señales procedentes de más lejos, al igual que la actividad muscular o la actividad de neuropils vecinos, alcanzan ambos electrodos al mismo tiempo que evoca formas y amplitudes comparables y serán descartados por este procedimiento. Utilizando la técnica de emparejamiento de plantillas de Spike2,estamos muy seguros de obtener la actividad de una sola unidad, lo que no es el mismo, pero muy cerca de la actividad neuronal única. Sin embargo, la cuestión de la clasificación pico podría evitarse mediante el uso de técnicas de grabación intracelulares.
Registros de células individuales, ya sea con electrodos afilados o pipetas de parche permiten profundo conocimiento acerca de las propiedades fisiológicas de una sola neurona. Sin embargo, debido al pequeño tamaño de las neuronas del insecto y sus neuritas (p. ej., A menos de 1 m para la abeja PN 52) grabaciones sólo a corto plazo son manejables. Además, las grabaciones intracelulares podrían ser invasiva y podría dañar a la célula que es, posiblemente, otra de las razones para las limitaciones temporales. En vivo registros intracelulares en insectos rara vez duran más de una hora. Una ventana de tiempo que fue suficiente para que el trabajo pionero de Martin Hammer 53 que grabó intracelular de una sola neurona identificado, el ventral no apareado neurona maxilar # 1 (VUMmx1). Podía ltinta su actividad directamente al circuito de recompensa. Juliane Mauelshagen 54 registrado intracelularmente la actividad de una seta cuerpo extrínseca neurona identificado, la Pedunculus neurona extrínseca # 1 (PE1) durante el condicionamiento clásico. La misma neurona estaba en el foco de Menzel y Manz 55 cuando encontraron LTP después de la estimulación eléctrica de las células de Kenyon. Sin embargo, Okada y sus colegas 56 podrían utilizar el patrón de clavar intracelularmente bien caracterizado (picos dobles y triples) para la identificación de la PE1 durante las grabaciones extracelulares. Después de todo, una combinación de ambos métodos, registros intracelulares de las neuronas identificadas y grabaciones extracelulares de largo plazo podrían ser una poderosa herramienta para las investigaciones futuras.
Sin embargo, el uso de electrodos afilados para grabar varias celdas (unidades) de manera simultánea en los diferentes niveles de procesamiento de más de varias horas hasta días para analizar sus relaciones de respuesta temporal y / o incluso cambios plásticos is casi imposible.
Con la primera imagen de calcio se acerca en la abeja 57,58 usando colorantes sensibles al calcio el análisis de los patrones espaciales de las respuestas de olor eran accesibles 59-62. Sin embargo, en muchos casos, los colorantes sensibles al calcio tienen que ser introducido en el tejido cerebral a través de manipulaciones invasivas que de nuevo limitan duración de la vida de las abejas y las propiedades intrínsecas de las células analizadas. Este problema se soluciona en otros organismos modelo como la mosca de la fruta utilizando sensores de calcio introducidas genéticamente 63,64. Sin embargo, en general, sensores de calcio pueden introducir otras limitaciones, ya que pueden actuar como tampones de calcio que probablemente influyen en las propiedades temporales de las respuestas de olor. Registros intracelulares simultáneos combinados con imágenes de calcio o enfoques computacionales pueden probar la resolución temporal adecuada de imágenes procesa 65,66. Sin embargo, la resolución temporal del proceso de formación de imágenes en sí es RatheR limitada. Sistemas de adquisición ópticos suelen utilizar CCD de imágenes con una resolución temporal de 5-20 Hz 67, aunque 2-Photon-Imaging podría ser capaz de adquirir las secuencias más rápidas 68. Sin embargo, el aumento de la frecuencia de muestreo siempre va de la mano con una pérdida de resolución espacial. Además, los colorantes sensibles al calcio utilizados en la abeja se someten a la decoloración, que también reduce el tiempo de adquisición 69.
En comparación con otras técnicas de grabación fisiológicos en los insectos nuestros multicanal electrodos micro hilos flexibles aseguran un acceso de largo plazo a la unidad y la población de la actividad neuronal en comportarse abejas.
Demostramos cómo usar dos de estos electrodos en diferentes etapas de procesamiento en el mismo animal, lo que facilita el análisis de los aspectos de codificación temporales entre los diferentes sitios de registro. Dependiendo del problema de la investigación y el modelo de insecto el método básico de construcción de electrodo demostrado aquí se extienden fácilmentepoder y / o se puede adaptar. Por ejemplo, es concebible utilizar más de los tres cables individuales para producir electrodos multicanal. Además, el número de sitios de grabación puede ser ampliado y la observación de aspectos temporales de más de dos secciones o neuropils es factible. Nuestra esperanza es que este método va a inspirar a muchos científicos y contribuirá positivamente a la comprensión del procesamiento neuronal sofisticada en pequeños cerebros.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
The authors would like to thank Isabelle Reus for establishment of tracing the electrode insertion side, Tobias Rosenbaum for LabView programming, Anneke Meyer for data analyzes and helpful discussions. We thank Randolf Menzel for discussion and practical help during early stage of electrode development. Furthermore we thank Brian Smith for postdoctoral association to MS-B. This work was supported by the Deutsche Forschungsgemeinschaft (DFG, SPP 1392, Ro1177/5-2) to WR.
Materiales
| Name | Company | Catalog Number | Comments |
| Paraffin oil | Fluka | 76235 | |
| Odors | Sigma Aldrich | ||
| PBS | pH 7.2 | ||
| 4% Formaldehyde | ThermoScientific | 28908 | Methanol free |
| Triton X | BioChemica | A1388 | |
| Methylsalicylate | Roth | 4529.1 | |
| Tetramethylrhodamin dextran, 10,000 MW (Microruby) | Invitrogen | D7162 | keep dark |
| Alexa 488 hydrazide | Invitrogen | A-10436 | keep dark |
| Alexa 568 hydrazide | Invitrogen | A-10437 | keep dark |
| Bee Ringer Solution | see 2 | ||
| Polyurethane-coated copper wire | Elektrisola | 15µm diameter & P155 insulation | |
| Dental Wax | Densply Detrey | 64103015S1 | moderate melting point |
| Dental Wax | Flexaponal | 124-202-00 | low-melting Wax |
| KWIK SIl | WPI | 03L | |
| 18 Pin Socket | Conrad Electronic | 189634-62 | |
| Hot melting glue | Conrad Electronic | 827673 | |
| soldering needle | Conrad Electronics | 830283 | 12 V |
| Soldering terminal lug | Conrad Electronic | 531901 | |
| Glaselectrodes | WPI | 1B100F-3 | |
| Minutien Pins | Fine Science Tools | 26002-20 | V2A 0.2 x 12 mm |
| switchable headstage | Tucer Davis Technologies | SH16 | |
| Headstage connection module | NPI | INT-03M | |
| Amplifier Module | NPI | PDA-2F | |
| Data Acquisition boards | National Instruments | NI-6123, Ni-6143 | |
| Acquisition Software | National Instruments | Lab View 8.2 | custom design |
| Spike-Sorting | CED | Spike 2 v7.11 | |
| Matlab | Mathworks | R2008B | |
| Micromanipulator | Leitz | manual | |
| AG-wires | WPI | AGT05100 | |
| Confocal laser scanning microscope | Leica | TCS SP2 AOBS | |
| AMIRA | Mercury Computer Systems | 2/5/2000 |
Referencias
- Strube-Bloss, M. F., Herrera-Valdez, M. a., Smith, B. H. Ensemble response in mushroom body output neurons of the honey bee outpaces spatiotemporal odor processing two synapses earlier in the antennal lobe. PLoS ONE. 7 (11), (2012).
- Brill, M. F., Rosenbaum, T., Reus, I., Kleineidam, C. J., Nawrot, M. P., Rössler, W. Parallel processing via a dual olfactory pathway in the honeybee. The Journal of neuroscience the official journal of the Society for Neuroscience. 33 (6), 2443-2456 (2013).
- Menzel, R. The honeybee as a model for understanding the basis of cognition. Nature Reviews Neuroscience. 13 (11), 758-768 (2012).
- Sandoz, J. Behavioral and neurophysiological study of olfactory perception and learning in honeybees. Frontiers in Systems Neuroscience. 5, (2011).
- Giurfa, M. Cognition with few neurons: higher-order learning in insects. Trends in Neurosciences. 36 (5), 1-10 (2013).
- Menzel, R., Giurfa, M. Cognitive architecture of a mini-brain: the honeybee. Trends in cognitive sciences. 5 (2), 62-71 (2001).
- Hildebrand, J. G., Shepherd, G. M. Mechanisms of olfactory discrimination: converging evidence for common principles across phyla. Annual Review of Neuroscience. 20, 595-631 (1997).
- Wilson, R. I., Mainen, Z. F. Early events in olfactory processing. Annu. Rev. Neurosci. 29, 163-201 (2006).
- Streinzer, M., Kelber, C., Pfabigan, S., Kleineidam, C. J., Spaethe, J. Sexual dimorphism in the olfactory system of a solitary and a eusocial bee species. The Journal of comparative neurology. 521 (12), (2013).
- Nishino, H., Nishikawa, M., Mizunami, M., Yokohari, F. Functional and topographic segregation of glomeruli revealed by local staining of antennal sensory neurons in the honeybee Apis mellifera. The Journal of comparative neurology. 515 (2), 161-180 (2009).
- Schneider, D. Elektrophysiologische Untersuchungen von Chemo- und Mechanorezeptoren der Antenne des Seidenspinners Bombyx mori L. Zeitschrift für Vergleichende Physiologie. 40 (1), 8-41 (1957).
- Menzel, R., Rybak, J. Antennal lobe of the honeybee. Handbook of brain microcircuits. , 427-432 (2011).
- Girardin, C. C., Kreissl, S., Galizia, C. G. Inhibitory connections in the honeybee antennal lobe are spatially patchy. Journal of neurophysiology. 109 (2), 332-343 (2013).
- Meyer, A., Galizia, C. G. Elemental and configural olfactory coding by antennal lobe neurons of the honeybee (Apis mellifera). Journal of comparative physiology. A, Neuroethology, sensory, neural, and behavioral. 198 (2), 159-171 (2012).
- Abel, R., Rybak, J., Menzel, R. Structure and response patterns of olfactory interneurons in the honeybee, Apis mellifera. The Journal of comparative neurology. 437 (3), 363-383 (2001).
- Kirschner, S., Kleineidam, C. J., Zube, C., Rybak, J., Grünewald, B., Rössler, W. Dual olfactory pathway in the honeybee, Apis mellifera. The Journal of comparative neurology. 499 (6), 933-952 (2006).
- Galizia, C. G., Rössler, W. Parallel olfactory systems in insects: anatomy and function. Annual review of entomology. 55 (August), 399-420 .
- Ito, K., Shinomiya, K., et al. A coordinated nomenclature system for the insect brain. Neuron. 81 (4), 755-765 (2014).
- Rybak, J. The digital honey bee brain atlas. Honeybee Neurobiology and Behavior. , 125-140 (2012).
- Rössler, W., Brill, M. F. Parallel processing in the honeybee olfactory pathway: structure, function, and evolution. Journal of comparative physiology. A, Neuroethology, sensory, neural, and behavioral. 199 (11), (2013).
- Mobbs, P. The brain of the honeybee Apis mellifera. I. The connections and spatial organization of the mushroom bodies. Philosophical transactions of the Royal Society of London. Series B, Biological. 298 (1091), 309-354 (1982).
- Strausfeld, N. J. Organization of the honey bee mushroom body: representation of the calyx within the vertical and gamma lobes. The Journal of comparative neurology. 450 (1), 4-33 (2002).
- Witthöft, W. Absolute Anzahl und Verteilung der Zellen im Hirn der Honigbiene. Zeitschrift für Morphologie der Tiere. 61 (1), 160-184 (1967).
- Rybak, J., Menzel, R. Anatomy of the mushroom bodies in the honey bee brain: the neuronal connections of the alpha-lobe. The Journal of Comparative Neurology. 465, 444-465 (1993).
- Strube-Bloss, M. F., Nawrot, M. P., Menzel, R. Mushroom body output neurons encode odor-reward associations. The Journal of neuroscience : the official journal of the Society for Neuroscience. (8), 3129-3140 (2011).
- Haddad, R., Lanjuin, A., Madisen, L., Zeng, H., Murthy, V. N., Uchida, N. Olfactory cortical neurons read out a relative time code in the olfactory bulb. Nature neuroscience. (May), 1-11 (2013).
- Martin, J. P., Beyerlein, A., et al. The neurobiology of insect olfaction: Sensory processing in a comparative context. Progress in neurobiology. 95 (3), 427-447 (2011).
- Nawrot, M. P. Dynamics of sensory processing in the dual olfactory pathway of the honeybee. Apidologie. 43 (3), 269-291 (2012).
- Farkhooi, F., Froese, A., Muller, E., Menzel, R., Nawrot, M. P. Cellular adaptation facilitates sparse and reliable coding in sensory pathways. PLoS computational biology. 9 (10), e1003251 (2013).
- Saha, D., Leong, K., Katta, N., Raman, B. Multi-unit recording methods to characterize neural activity in the locust (Schistocerca americana) olfactory circuits. Journal of visualized experiments JoVE. (71), (2013).
- Saha, D., Leong, K., Li, C., Peterson, S., Siegel, G., Raman, B. A spatiotemporal coding mechanism for background-invariant odor recognition. Nature neuroscience. 16 (12), 1-13 (2013).
- Mizunami, M., Okada, R., Li, Y., Strausfeld, N. J. Mushroom Bodies of the Cockroach Activity and Identities of Neurons. Journal of Comparative Neurology. 519 (July), 501-519 (1998).
- Okada, R., Ikeda, J., Mizunami, M. Sensory responses and movement-related activities in extrinsic neurons of the cockroach mushroom bodies. Journal of Comparative Physiology A: Sensory, Neural, and Behavioral Physiology. 185 (2), 115-129 (1999).
- Haehnel, M., Froese, A., Menzel, R. In vivo Ca2+ imaging of mushroom body neurons during olfactory learning in the honey bee. Journal of visualized experiments JoVE. (30), (2009).
- Felsenberg, J., Gehring, K. B., Antemann, V., Eisenhardt, D. Behavioural pharmacology in classical conditioning of the proboscis extension response in honeybees (Apis mellifera). Journal of visualized experiments JoVE. (47), (2011).
- Rehder, V. Quantification of the honeybee’s proboscis reflex by electromyographic recordings. Journal of Insect Physiology. 33 (7), 501-507 (1987).
- Serrano, E., Nowotny, T., Levi, R., Smith, B. H., Huerta, R. Gain control network conditions in early sensory coding. PLoS computational biology. 9 (7), e1003133 (2013).
- Hubel, D. H., Wiesel, T. N. Receptive fields and functional architecture of monkey striate cortex. The Journal of physiology. 195 (1), 215-243 (1968).
- Christensen, T. A., Pawlowski, V. M., Lei, H., Hildebrand, J. G. Multi-unit recordings reveal context-dependent modulation of synchrony in odor-specific neural ensembles. Nature neuroscience. 3 (9), 927-931 (2000).
- Byers, K. J. R. P., Sanders, E., Riffell, J. A. Identification of olfactory volatiles using gas chromatography-multi-unit recordings (GCMR) in the insect antennal lobe. Journal of visualized experiments JoVE. (72), e4381 (2013).
- Perez-Orive, J., Mazor, O., Turner, G. C., Cassenaer, S., Wilson, R. I., Laurent, G. Oscillations and sparsening of odor representations in the mushroom body. Science. 297 (5580), 359-365 (2002).
- Stevenson, I. H., Kording, K. P. How advances in neural recording affect data analysis. Nature. 14 (2), 139-142 (2011).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature neuroscience. 7 (5), 446-451 (2004).
- Viventi, J., Kim, D. -. H., et al. Flexible, foldable, actively multiplexed, high-density electrode array for mapping brain activity in vivo. Nature neuroscience. 14 (12), 1599-1605 (2011).
- Pouzat, C., Mazor, O., Laurent, G. Using noise signature to optimize spike-sorting and to assess neuronal classification quality. Journal of neuroscience methods. 122 (1), 43-57 (2002).
- Lewicki, M. S. A review of methods for spike sorting: the detection and classification of neural action potentials. Network. 9 (4), R53-R78 (1998).
- Quian Quiroga, R., Panzeri, S. Extracting information from neuronal populations: information theory and decoding approaches). Nature reviews. Neuroscience. 10 (3), 173-185 (2009).
- Einevoll, G. T., Franke, F., Hagen, E., Pouzat, C., Harris, K. D. Towards reliable spike-train recordings from thousands of neurons with multielectrodes. Current opinion in neurobiology. 22 (1), 11-17 (2012).
- Riffell, J. a., Lei, H., Abrell, L., Hildebrand, J. G. Neural basis of a pollinator’s buffet: olfactory specialization and learning in Manduca sexta. Science. 164 (6), 877-892 (2013).
- Bender, J. a., Pollack, A. J., Ritzmann, R. E. Neural activity in the central complex of the insect brain is linked to locomotor changes. Current biology : CB. 20 (10), 921-926 (2010).
- Perez-Orive, J., Bazhenov, M., Laurent, G. Intrinsic and circuit properties favor coincidence detection for decoding oscillatory input. The Journal of neuroscience the official journal of the Society for Neuroscience. 24 (26), 6037-6047 (2004).
- Rybak, J. . Die strukturelle Organisation der Pilzkörper und synaptische Konnektivität protocerebraler Interneuronen im Gehrin der Honigbiene, Apis mellifera.: eine licht- und elektronenmikroskopische Studie. , (1994).
- Hammer, M. An identified neuron mediates the unconditioned stimulus in associative olfactory learning in honeybees. Nature. 366, 59-63 (1993).
- Mauelshagen, J. Neural correlates of olfactory learning paradigms in an identified neuron in the honeybee brain. Journal of neurophysiology. 69, 609-625 (1993).
- Menzel, R., Manz, G. Neural plasticity of mushroom body-extrinsic neurons in the honeybee brain. The Journal of experimental biology. 208 (22), 4317-4332 (2005).
- Okada, R., Rybak, J., Manz, G., Menzel, R. Learning-related plasticity in PE1 and other mushroom body-extrinsic neurons in the honeybee brain). The Journal of neuroscience: the official journal of the Society for Neuroscience. 27 (43), 11736-11747 (2007).
- Joerges, J., Küttner, A., Galizia, C. G., Menzel, R. Representation of odours and odour mixtures visualized in the honeybee brain. Nature. 387, 285-288 (1997).
- Galizia, C. G., Joerges, J., Küttner, A., Faber, T., Menzel, R. A semi-in-vivo preparation for optical recording of the insect brain. Journal of neuroscience. 76 (1), 61-69 (1997).
- Galizia, C. G., Sachse, S., Rappert, A., Menzel, R. The glomerular code for odor representation is species specific in the honeybee Apis mellifera. Nature. 2 (5), 473-478 (1999).
- Sandoz, J. -. C. Odour-evoked responses to queen pheromone components and to plant odours using optical imaging in the antennal lobe of the honey bee drone Apis mellifera L. The Journal of experimental biology. 209 (18), 3587-3598 (2006).
- Fernandez, P. C., Locatelli, F. F., Person-Rennell, N., Deleo, G., Smith, B. H. Associative conditioning tunes transient dynamics of early olfactory processing. The Journal of neuroscience the official journal of the Society for Neuroscience. 29 (33), 10191-10202 (2009).
- Locatelli, F. F., Fernandez, P. C., et al. Nonassociative plasticity alters competitive interactions among mixture components in early olfactory processing. European Journal of Neuroscience. 37 (1), (2013).
- Silbering, A. F., Bell, R., Galizia, C. G., Benton, R. Calcium imaging of odor-evoked responses in the Drosophila antennal lobe. Journal of visualized experiments JoVE. (61), 1-7 (2012).
- Strutz, A., Völler, T., Riemensperger, T., Fiala, A., Sachse, S. Calcium imaging of neural activity in the olfactory system of Drosophila. Genetically Encoded Functional Indicators. 72, 43-70 (2012).
- Galizia, C. G., Kimmerle, B. Physiological and morphological characterization of honeybee olfactory neurons combining electrophysiology, calcium imaging and confocal microscopy. Journal of Comparative Physiology A: Neuroethology, Sensory, Neural, and Behavioral Physiology. 190 (1), 21-38 (2004).
- Helmchen, F., Waters, J. Ca2+ imaging in the mammalian brain in vivo. European journal of pharmacology. 447 (2-3), 119-129 (2002).
- Stierle, J. S., Galizia, C. G., Szyszka, P. Millisecond stimulus onset-asynchrony enhances information about components in an odor mixture. Journal of Neuroscience. 33 (14), 6060-6069 (2013).
- Haase, A., Rigosi, E., et al. In-vivo two-photon imaging of the honey bee antennal lobe. Biomedical optics express. 2 (1), 131-138 (2010).
- Becker, P. L., Fay, F. S. Photobleaching of fura-2 and its effect on determination of calcium concentrations. The American journal of physiology. 253 (4 pt 1), C613-C618 (1987).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados