Method Article
Registrazioni simultanee a lungo termine in due fasi neuronale Processing in Comportarsi api
In questo articolo
Riepilogo
Registrazioni simultanee extracellulari lungo termine provenienti da due diversi neuropiles cerebrali o due diversi tratti anatomici sono stati stabiliti nelle api. Queste registrazioni permettono lo studio di aspetti temporali del trattamento neuronale attraverso diverse aree cerebrali del singolo neurone, così come a livello di complesso in un animale comportarsi.
Abstract
In entrambi i mammiferi e insetti informazioni neuronale viene elaborata in diversi centri cerebrali di ordine superiore e inferiore. Questi centri sono accoppiati tramite convergenti e divergenti connessioni anatomiche tra cui avanzamento e il cablaggio feedback. Inoltre, informazioni della stessa origine è parzialmente inviato attraverso vie parallele differenti e talvolta nelle stesse aree cerebrali. Per comprendere i vantaggi evolutivi, nonché i vantaggi computazionali di queste strategie di cablaggio e soprattutto i loro dipendenze temporali di ciascun altro, è necessario avere accesso simultaneo a singoli neuroni di differenti tratti o neuropiles nella stessa preparazione ad alta risoluzione temporale. Qui ci concentriamo sulle api dimostrando un unico accesso extracellulare lungo termine per registrare l'attività a più unità in due successive neuropiles 1, il lobo antennale (AL), la prima fase di elaborazione olfattiva e il corpo del fungo (MB), un ordine superiore centro di integrazione involved nell'apprendimento e nella formazione della memoria, o due tratti neuronali parallele 2 collegano il AL con la MB. Quest'ultimo è stato scelto come esempio e verrà descritta in dettaglio. Nel video di supporto è dimostrata la costruzione e l'inserimento permanente di elettrodi a filo multicanale flessibili. Amplificazione differenziale a coppie dei microcanali filo elettrodo riduce drasticamente il rumore e verifica che la sorgente del segnale è strettamente correlata alla posizione della punta dell'elettrodo. La flessibilità meccanica degli elettrodi a filo utilizzati permette registrazioni a lungo termine invasive stabili per molte ore fino a giorni, che è un chiaro vantaggio rispetto alle tradizionali tecniche di registrazione in più e intracellulari in vivo.
Introduzione
Le api così come la maggior parte degli altri insetti pesantemente affidamento su olfatto. Tra gli altri usano stimoli olfattivi per l'orientamento, l'accoppiamento, la comunicazione con i conspecifici, e foraggiamento. Il loro sistema olfattivo ben elaborato contribuisce ad un ricco repertorio di comportamenti di apprendimento relativi agli stimoli odori floreali. Questi comportamenti possono essere facilmente studiati in condizioni controllate di laboratorio (per la recensione vedi 3-5). I loro "mini-cervelli" (cfr. 6) con il loro numero relativamente piccolo di neuroni fanno le api di un organismo modello adatto per studiare la codifica olfattiva e di apprendimento durante il monitoraggio dell'attività neurale.
Il sistema olfattivo negli insetti e nei mammiferi mostra organizzazione analogo in gran parte (per una rassegna vedi 7,8). In api circa 80.000 neuroni recettori 9 situati in sensillae lungo le antenne 10,11 tradurre lo stimolo odore ambientale in un neursegnale onal. Assoni dai neuroni recettori olfattivi innervano il lobo antennale (AL), che ha un'organizzazione glomerulare paragonabile al bulbo olfattivo vertebrato. La AL comprende circa 164 glomeruli interconnessi tra loro da circa 4.000 interneuroni locali (LN) (per una rassegna vedi 12). Soprattutto nel ape è stato dimostrato recentemente che LNs forniscono connettività laterale irregolare e che le diverse sottopopolazioni possiedono elementari e configural olfattive proprietà di codifica 13,14. L'AL ha dimostrato di essere suddiviso in un lobo ventrale e dorsale hemi dando origine al mediale e il tratto lobo antenne laterali (-M e L-ALT; precedentemente definito-M e L-APT-mediale e laterale Lobe antenne protocerebral Tract 15 - 17). Qui un nuovo tratto terminologia introdotta da una recente sforzo per una nomenclatura unificata del cervello dell'insetto verrà utilizzato 18. Entrambi ALTs (l-e m-ALT) combinano sia 410 (l-ALT) o 510 (m-ALT) proge uniglomerularneuroni ction (PN), rispettivamente 15,16,19. PN di entrambi i tratti sono stati recentemente dimostrato che gli odori di codice in parallelo 2 (per la recensione vedi 17,20), ed entrambi i tratti sinapticamente formare connessioni divergenti con celle Kenyon (KC), il corpo di funghi (MB) neuroni principali. Ogni MB contiene circa 172.000 KC 21-23. MBS sono noti per essere coinvolti nella integrazione stimolo, l'apprendimento e la formazione della memoria. I dendriti AXO del KC formano il peduncolo (gambo del fungo), che ha due regioni di uscita principali: il vertica o alfa-lobo e orizzontale o beta-lobo 22,24. L'uscita del MB converge a solo circa 400 neuroni estrinseci (EN) 24. ENS responsabile per l'elaborazione delle informazioni olfattive soprattutto innervano l'aspetto ventrale del lobo verticale 22. Recentemente, è stato dimostrato che ENs registrati in questa zona codificano l'associazione odore premio 25.
Temporaleaspetti all'interno del sistema olfattivo di insetti e vertebrati sono diventati un aspetto importante e significativo come potenziale principio codifica 26-29. Per essere in grado di registrare simultaneamente più neuroni da diversi siti ad alta risoluzione temporale, abbiamo stabilito matrimoniali tecniche multiple di registrazione dell'unità utilizzo di elettrodi su misura a filo multicanale introdotte diverse regioni bersaglio nel sistema olfattivo delle api. Questo approccio ci permette di analizzare e confrontare l'elaborazione temporale nel sistema olfattivo delle api a livello dei singoli neuroni e delle popolazioni di neuroni o tra le vie olfattive parallele, il duplice percorso olfattivo 2 o tra i diversi neuropils successivi 1. Recentemente con un approccio sperimentale simile nel sistema olfattivo locusta 30 con una diversa configurazione degli elettrodi sono stati in grado di analizzare il meccanismo di codifica spazio-temporale per sfondo-invariante riconoscimento odore 31. Thnoi, i doppi registrazioni stabiliti consentono la raccolta di informazioni spaziali sulle simultanei profili di attività neuronali.
Rispetto al campionamento spaziale più ampio ottenuto da immagini di calcio questo metodo permette di registrare da soli due punti. Tuttavia, il vantaggio rispetto alle tecniche di imaging calcio è l'elevata precisione temporale di potenziali registrazioni d'azione, che non possono essere forniti da una CCD convenzionale o acquisizione di immagini 2-fotone. Gli elettrodi extracellulari qui descritti vengono impiantati in modo permanente e fissi rispetto al cervello e testa capsula evitando elettrodo deriva. Questo è un chiaro vantaggio rispetto all'utilizzo di elettrodi intracellulari taglienti. Un altro vantaggio rispetto alle registrazioni intracellulari e immagini di calcio è il tempo di osservazione neurale estesa vanno da molte ore fino a giorni. Questo è un presupposto importante per indagare i correlati neurali di formazione di apprendimento e memoria. Ulteriori vantaggi di piùregistrazioni unità sono ulteriormente descritti nella sezione di discussione.
In questa visione metodologica verrà mostrato il processo di fabbricazione di elettrodi a filo design personalizzato, adattato da 32,33 e adatto per lungo termine le registrazioni multi-unità nel cervello delle api. Inoltre, un esempio di come questi tipi di elettrodi sono impiantati in modo permanente in due differenti siti di registrazione all'interno del sistema olfattivo api per registrare simultaneamente è indicata la-l e m-ALT per lunghi periodi di tempo per consentire a molti protocolli di stimolazione 2. Per la verifica delle posizioni di registrazione è fornito un esempio e un protocollo per la colorazione e post visualizzazione dei siti di registrazione.
Protocollo
1. Elettrodi edifici (Figura 1)
- La produzione di un adattatore elettrodo che si inserisce la scheda di interfaccia elettrodo di commercio più sistemi di amplificazione dei canali 1,2,25.
- Utilizzare una piccola piastra in plexiglas incollati alla base di un connettore 18 pin.
- Collegare la base con 3 brevi pezzi di filo isolato a 3 anse a saldare separati avvitati sulla piastra di plexiglas (Figura 1 A1-A3).
- Inserire una scanalatura nella piastra di plexiglas in cui un capillare di vetro può essere facilmente spostato ed essere trattenuto da una vite (Figura 1 B1).
- Ampliare la capillare di vetro di circa 5 mm con uno spillo minutien.
- Collegare i fili degli elettrodi micro lungo il perno minutien e la capillare di vetro per garantire la stabilizzazione e sostegno.
- Multi-canale di produzione micro filo (adottato da Ryuichy Okada 32,33)
- Span 3 micro fili (poliuretano rivestito in filo di rame, 15diametro micron) in modo che essi sono posti accanto all'altro (figura 1 B2).
- Utilizzare una saldatura ago 12 V per diffondere un sottile strato di cera dentale basso punto di fusione (50 ° C) in parte lungo i fili per incollare insieme (punta dell'elettrodo) (Figura 1 B3). Lascia pochi centimetri unglued (fine elettrodo), come questa sezione sarà utilizzato in seguito per collegare i cavi micro con l'adattatore elettrodo.
- Collegare il micro canale filo più all'adattatore elettrodo
- Rimuovere il capillare di vetro dal supporto e fissarlo con il perno minutien alla punta dell'elettrodo. Portarlo in una posizione parallela al micro-elettrodo (Figura1 B3).
- Incollare la punta dell'elettrodo al perno minutien con cera dentale basso punto di fusione e tagliare il micro elettrodo sulla punta, sporgente 2-3 cm dal perno minutien e alla fine elettrodo (frecce piccole Figura 1 B3).
- Infilare il capillare slightly indietro nel adattatore dell'elettrodo. Utilizzare la vite per risolvere il problema (Figura 1 B4).
- Saldare le estremità dei tre fili alle alette di saldatura utilizzando un saldatore con una temperatura di circa 360 ° C per assicurare fusione dell'isolante (Figura 1 B4). Dopo la saldatura, assicurarsi che ci sia un adeguato contatto elettrico (~ 300 kOhm).
- Montare uno degli elettrodi (master) per la scheda di interfaccia elettrodo del headstage e fissare l'altro elettrodo multicanale (slave) su un adattatore separato. Collegare i canali dello slave all'elettrodo master (Figura 1 C1). Inoltre, saldare il riferimento nonché elettrodi muscolari all'elettrodo di base principale (Figura 1 C2).
2. Ape Preparazione (Figura 2)
In questi esperimenti descritti, l'ape (Apis mellifera), che è un animale invertebratoe quindi non richiede specifiche autorizzazioni etiche per l'utilizzo, viene utilizzato.
- Cattura api bottinatrici (A. mellifera) presso l'ingresso dell'alveare al mattino, come mostrato da altri 34,35.
- Raffreddare le api su ghiaccio tritato fino immobilizzazione (da 5 a 10 min) e fissare una in un supporto di plexiglas standard o tubo metallico in modo che la testa è esposta (Figura 2). Per minimizzare i movimenti della testa usano cera a basso punto di fusione dentale (~ 50 ° C) e fissare la testa con attenzione al titolare intorno alla base degli occhi composti e del collo.
- Utilizzare cera basso punto di fusione per fissare la SCAPI delle antenne sulla capsula testa (Figura 2 B) senza toccare il flagello. Il flagello dell'antenna deve essere rilevato in avanti. Assicurarsi che l'ape può liberamente muovere la sua proboscide.
- Radere la capsula testa per garantire una vista indisturbata e accesso alla parte superiore della testa.
- Alimentare l'ape con una soluzione di saccarosio del 30% fino saturatia garantire una sufficiente umidificazione del tessuto cerebrale e buona vitalità dell'animale (Figura 2 C).
- Fai incisioni attenti verticalmente lungo i bordi degli occhi composti e orizzontalmente sopra le basi antennali così come sotto gli ocelli e togliere il pezzo allentato della cuticola (Figura 2 D).
- Impostare con attenzione da parte delle ghiandole ipofaringee e rimuovere la trachea per garantire una visione chiara e l'accesso al cervello prima di inserimento dell'elettrodo (figure 2E, 2F).
3. Inserimento dell'elettrodo
Nel caso dell'esempio illustrato nella figura 2, un elettrodo è posizionato scopo la l-ALT, l'altro puntando sul m-ALT 2. Utilizzando particolari punti di riferimento, in altre regioni di destinazione sono possibili anche, per esempio, le regioni uscita AL e 1 MB.
- Posizionare gli elettrodi usando micromanipolatori alla regione di interesse ( Figura 2G e 3A). Per indirizzare il posto m-ALT dell'elettrodo tra la AL e medialmente dal lobo verticale del MB. Assicurarsi che il sito di inserimento di essere al di sopra del punto di diramazione dei PN ALT mediolaterale. Sporgere l'elettrodo nel cervello con una profondità di circa 180 micron (Figura 2E). Per l-ALT PN posto l'elettrodo di registrazione sotto il protocerebro laterale (LH) nel mezzo di una linea immaginaria tra la parte laterale del lobo verticale e mezzo della AL. Inserire l'elettrodo con una profondità di circa 300 micron (figura 2E)
- Inserire il riferimento (filo d'argento, circa 25 micron di diametro) nel occhio composto omolaterale attraverso un piccolo taglio nella cuticola. Inserire un altro filo d'argento nella regione proiezione muscolo sotto gli ocelli laterali. NOTA: Se necessario, il comportamento di apprendimento delle api può essere monitorato con alta precisione temporale registrando muscolo M17, che è coinvolto in risposta estensione proboscide (PER) del ape 36 come descritto in 25.
- Per ancorare saldamente gli elettrodi nel cervello e la capsula testa, coprire l'intero spazio sopra il cervello con due silicio componente (Figura 2H), che impedirà il cervello si secchi. NOTA: le registrazioni possono durare per ore fino a giorni, e le api possono per esempio essere registrato durante una procedura di condizionamento classico (Figura 2H) o stimolate con un grande pannello di odori diversi.
4. Acquisizione e pre-elaborazione
- Utilizzare un software di acquisizione adeguata che soddisfi i seguenti requisiti: frequenza di campionamento di almeno 25 kHz; analogico o digitale 1,25 2 differenziazione incrocio tra i canali elettrodi; filtro passa banda da 300 Hz a 8000 Hz per estrarre eventi spike.
- Utilizzare disponibili spike ordinamento software per estrarre l'attività singola unità, per esempio template tecniche corrispondenti come incluso nel software Spike2 (Figura 3).
- Per ulteriori analisi utilizzare i timestamp delle unità estratte per calcolare singola unità media cattivi odori (Figura 4) o per calcolare i vettori di popolazione per Analisi delle Componenti Principali (PCA) (Figura 5) utilizzando un software disponibile in commercio. Per analizzare ulteriormente singola unità e la popolazione latenza di risposta si prega di confrontare pubblicazioni recenti 1,2,25.
5. Visualizzazione della relativa posizione degli elettrodi (Figura 4)
- Immergere le punte degli elettrodi in una soluzione di 5% o Alexa idrazide 568 o 5% Alexa IDRAZIDE 488 che viene disciolto in soluzione di cloruro di 0,5 M di potassio prima degli esperimenti di registrazione.
- Rimuovere gli elettrodi e il silicio rivestimento cura dopo gli esperimenti, lavare il cervello con la soluzione ape Ringer, rimuovere le ghiandole e trachea e inserire minuscoli cristalli di tetramethylrhodamin destrano o inserire una soluzione al 5% risolto in 1.0 M acetato di potassio in AL per etichettare i ALTs anterogradely. Effettuare le seguenti operazioni nel buio.
- Lasciare il colorante da prendere e trasportato dai neuroni di proiezione lungo i tratti assonali (30-45 min) (Figura 4A), prima di lavare il cervello con soluzione Ringer ape tre volte per altri 30-45 min.
- Raffreddare l'ape sul ghiaccio fino immobilizzazione e rimuovere con cautela il cervello dalla capsula testa. Fissare il cervello risciacquandola in una soluzione 0,1 M PBS contenente formaldeide al 4% e tenerlo notte a 4 ° C.
- Attendere almeno 12 ore prima di lavare il cervello due volte in 0.1 M PBS (10 minuti ciascuno).
- Lavare 3x cervello per 20 minuti in 0,2% Triton X-100 diluito in 0,1 M PBS prima disidratazione in una serie ascendente di alcool (30%, 50%, 70%, 90%, 95%, 3x 100% etanolo, 20 min ogni passo).
- Incorporare il cervello disidratato in Methylsalicylate su un vetrino da microscopio e seal con un coperchio scorrevole.
- Utilizzare un microscopio confocale a scansione laser e la scansione del cervello come sezioni ottiche ogni 2-5 micron utilizzando un composto Harmonic obiettivo di Piano Apochromat (10X 0.4 NA immersione). Eccitare il tessuto usando 568 nm per tetramethylrhodamin destrano e una lunghezza d'onda di 488 nm per la posizione degli elettrodi.
- Ricostruire le strutture cerebrali colorati e percorsi elettrodi delle pile di immagini in 3D con il software di ricostruzione (ad es. AMIRA o Fiji) (Figura 4).
Risultati
"L'attuale protocollo consente registrazioni simultanee in due diverse fasi di lavorazione all'interno delle singole api e inoltre permette di testare sottostanti meccanismi di apprendimento e di memoria tramite ad esempio., PER condizionata all'interno api trattenuto." Questo è un prerequisito per analizzare gli aspetti temporali del processo neuronale. Il metodo è facilmente adattabile a diversi approcci scientifici per svelare la rete neuronale del sistema olfattivo delle api. Per esempio, questo metodo viene utilizzato (i) per analizzare l'elaborazione temporale di PN all'interno del percorso olfattivo doppio delle api,-l e m-ALT PN (Figura 5). In Figura 5A un esempio di PN l-ALT simultaneamente registrato con una PN del m-ALT è data come media dieci tentativi ed illustra la loro forza di risposta e la latenza rispetto a cinque diverse concentrazioni di odori come codice colore trama calore. In una media di sette api con 11-l e 13 mALT PN (figure 5B, 5C) illustra che sia la forza di risposta e la latenza di risposta, in una certa misura, riflette concentrazione di odorizzante. In tal modo PN in questo esempio aumentare la loro forza di risposta, mentre con l'aumentare della concentrazione di odorizzante la latenza di risposta è diminuita (figure 5B, 5C). Questo risultato è piuttosto limitata e valida solo per l'odorizzante analizzato, ma è comunque in linea con i recenti modelli computazionali della AL 37. Sia codifica concentrazione di odore in AL dell'ape sottende calcoli non lineari o sottende altre proprietà di codifica deve ancora essere analizzati in futuro. Inoltre il metodo può essere utilizzato (ii) per confrontare aspetti temporali nell'attività popolazione in due fasi successive di trasformazione, la AL-e MB-uscita (Figura 6). Analisi delle componenti principali (PCA) dimostra che l'odore di calcolo è prolungata e sopravvivere alla intera presentazione odore a livello PN mentre in ENs solo l'odore e spegnimento set sono stati rappresentati nell'attività popolazione (Figura 6). In tal modo la popolazione EN raggiunto la loro massima attività già in un punto temporale in cui si sta ancora sviluppando l'attività PN (cfr. film 1).
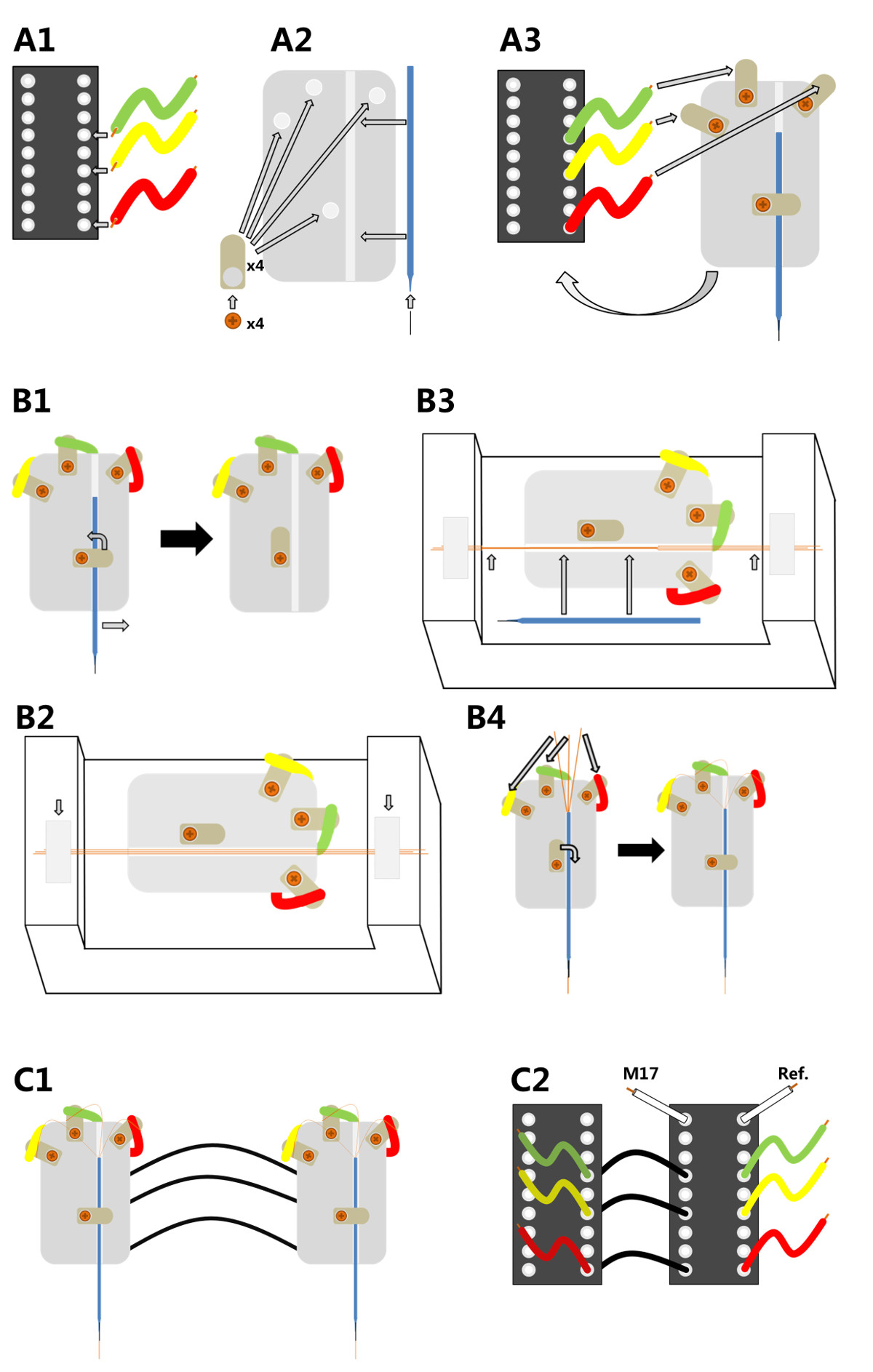
.. Figura 1 Produzione elettrodi micro-wire a tre canali A1) Le terminazioni di tre fili sono saldati ad un connettore pin IC in posizioni 11, 13 e 16 A2) Quattro alette di saldatura sono avvitati su una piastra di base in plastica plexiglas.; un perno minutien viene inserito nella punta di un capillare di vetro che viene poi attaccato alla piastra di plastica. A3) La piastra di plastica è incollato su di un pin IC e l'estremità libera di ciascun filo è saldato uno della saldatura superiore alette. B1) Per dotare il portaelettrodo con i fili sottili di rame, il capillare deve essere presa una volta di più. B2) La base del supporto viene poi fissato in una misura dispositivo di allineamento. Tre rame micro fili sono allineati lungo la scanalatura e fissati con del nastro adesivo ad ogni fine B3) I micro fili paralleli sono incollati insieme con la cera dentale e il capillare viene messo a posto (lunghe frecce).; micro fili incollati sono poi attaccati alla capillare con impronte dentarie e le sue estremità sono tagliate (frecce corte). B4) Le tre estremità dei fili di rame sono saldati alle tre alette di saldatura migliori portandoli così in contatto elettrico con la pin IC. C1) Due elettrodi completamente assemblati possono essere collegati tra loro per l'uso con un singolo headstage. C2) A tal fine i perni di un elettrodo (a sinistra, slave) sono collegati tramite conduttori isolati per l'altro elettrodo (a destra, alberoer), che è collegato alla fase testa; l'elettrodo headstage collegato può anche raccogliere input da un muscolo (M17) e l'elettrodo di riferimento (Ref).
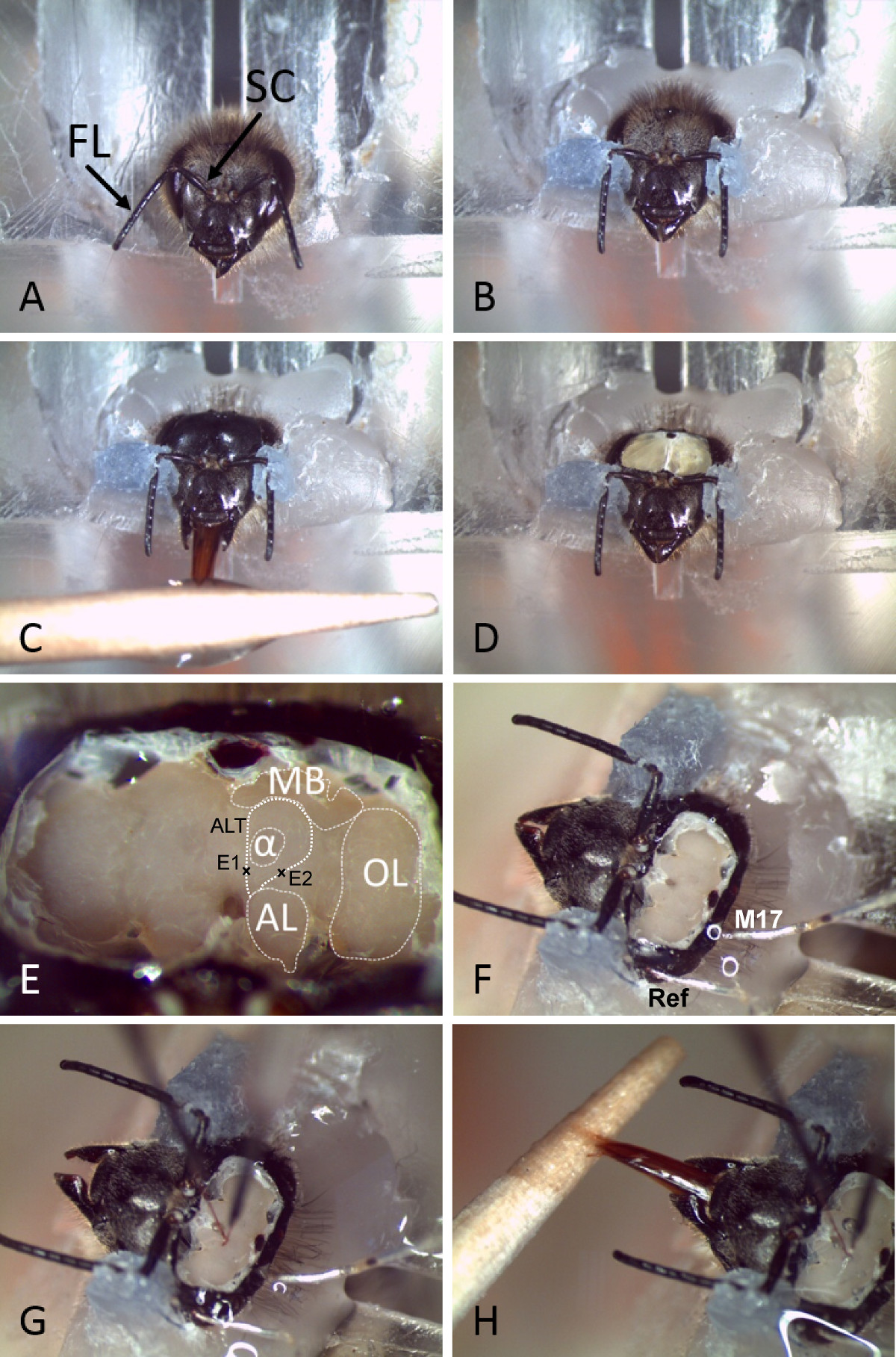
Figura 2. Preparazione e inserimento elettrodo permanente nel cervello ape. A) Un ape è inserito in un supporto di plexiglas dopo immobilizzazione su ghiaccio. Antenne con Flagello (FL) e Scapus (SC) sono indicati. B) La testa e le antenne sono fissati con cera dentale. C) La capsula testa è rasata e l'ape è alimentato con acqua e zucchero. D) La capsula testa è aperto. E) Dopo aver rimosso ghiandole e trachea dalla parte superiore del cervello, le diverse neuropiles e limiti importanti essere facilmente distinte. Le traiettorie dei ALTs sono indicati conun segno dove sono inseriti gli elettrodi. (MB: corpo del fungo, AL: lobo antenne, OL: lobo ottico, α: Alpha lobo o lobo verticale, ALT: tratto lobo antenne, E1: lato di inserimento degli elettrodi per le registrazioni m-ALT, E2: lato di inserimento dell'elettrodo per l-ALT registrazioni). F) Riferimento (Ref) ed elettrodi muscolari (M17) sono inseriti nella capsula testa attraverso piccoli fori nella cuticola o l'occhio composto. G) Gli elettrodi a filo sono inseriti nel cervello presso i siti appropriati. H) dopo che fissa gli elettrodi in atto utilizzando due componenti di silicio, l'ape mostra ancora PER e può essere condizionato (ad es., usando acqua e zucchero).
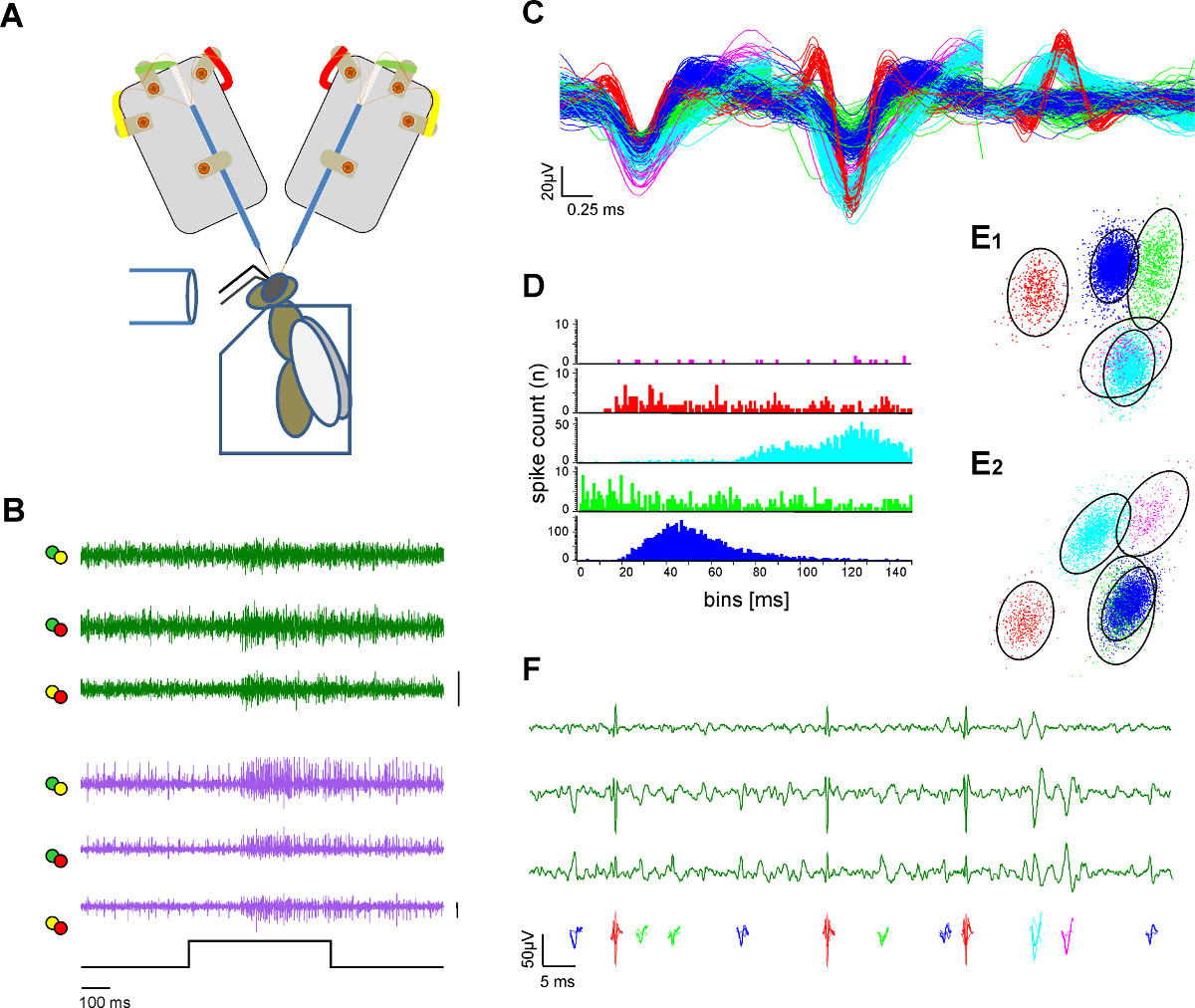
Figura 3. Extracellulare registrazione in due tratti neurali ed estrazione singola unità (spike ordinamento). A ) Schema del setup sperimentale. L'ape è fissata in un supporto di plexiglas. Stimolazione odore è fornito tramite un tubo di vetro. Due gambi elettrodi registrano dal cervello delle api esposte. B) registrazioni simultanee dal l-e m-ALT PN (verde e viola tracce) che mostra le risposte eccitatorie su entrambi i tratti di una stimolazione 500 msec odore di miele in soluzione acquosa ad una concentrazione 1:100 a 33 ° C. Ogni linea tracciata rappresenta i canali differenziati come etichetta color-coded dall'elettrodo alette di saldatura in A. Bar:. 50 mV C) Dopo le procedure di picco classificare singoli potenziali d'azione sono ordinati e colore codificati. Sovrapposizione delle unità ordinate illustra la separazione delle forme d'onda. D) Spike intervallo istogramma indica la qualità separazione delle unità ordinate come prova della sufficiente ordinamento picco. Nota: non vi è alcun picco nel periodo refrattario dell'unità. E) Due viste (E1, E2) daun raggruppamento 3D dell'unità ordinato con analisi del componente principale che indica la distanza delle unità ordinati l'uno all'altro. Cerchi indicano l'2,5 volte la distanza di Mahalanobis che ricorda l'SD nello spazio e indica una differenziazione significativa dei cluster nella principale componente spaziale F) Colore unità codificate raffigurano i potenziali d'azione visibili in un ingrandimento di tre canali da una registrazione tratto. Cliccate qui per visualizzare una versione più grande di questa figura.

Figura 4. Visualizzazione post-registrazione e 3D-ricostruzione della posizione di registrazione. A) proiezione di orto-fette lungo gli assi Z con allineamento massima intensità di un anteroe colmata retrograda dei neuroni di proiezione uniglomerular sporgenti dalla AL al MB e LH. Il tracciante intracellulare Microruby (tetramethylrhodamin destrano) è stato inserito nel AL dopo gli esperimenti di registrazione. Glomeruli all'interno del tinto AL prova adeguata colorazione PN. B) in proiezione delle fette orto lungo gli assi Z con allineamento massima intensità da una colorazione dei due elettrodi con Alexa hydrazide 488 che indica il posizionamento degli elettrodi per l'm-ALT (E1, freccia ) e l-ALT (E2, freccia). Il tracciante Alexa Hydrazide 488 migra verso il tessuto circostante elettrodo e colora il sito di inserimento dell'elettrodo. Nota, la colorazione di rilievo nel AL è un manufatto superficiale. C) ricostruzioni 3D delle cellule bersaglio colorate (PN) e il sito di inserimento dell'elettrodo da A, B (a destra) insieme a una visione schematica del sistema olfattivo delle api (di sinistra lato) con l'indicazione delle traiettorie-L e M-alt. Nota, solo uniglomersono mostrati tratti colare PN. AN: nervo antenne, AL: lobo antenne, LH: corno laterale, MB: il corpo del fungo, E1, E2: siti di inserzione di elettrodi, m-ALT: mediale tratto lobo antenne, l-ALT: laterale tratto lobo antenne, c: caudale, r: rostrale, m: mediale, l:. laterale cliccate qui per vedere una versione più grande di questa figura.

Figura 5. Esempio di odore codifica concentrazione ai duplice via olfattiva. A) Trame calore illustrano la risposta di un singolo l-ALT (verde) e singoli m-ALT PN (viola) acquistare contemporaneamente da un individuo ape in risposta al odorizzante esanale a concentrazioni crescenti di odori (da 1: 10 -6 a 1:100). Ogni linea è una media di dieci stim provamento. La frequenza di scarica è indicata come cambiamento intensità relativa, che è la frequenza di scarica in relazione all'attività spontanea sottratto. B) latenza di risposta Popolazione di 11-l e 13 m-ALT PN da 7 api registrate. In ogni ape sono state registrate contemporaneamente i PN di entrambe le vie. La latenza di risposta della popolazione mostra una latenza decrescente con l'aumentare della concentrazione di odore in PN da entrambi i tratti. L'insorgenza risposta odore Allo antenne a 99 msec è stato registrato tramite electroantennograms e viene sottratto dai latenze di risposta PN. Si noti che le concentrazioni più basse risposte sono troppo deboli per misure di latenza e, di conseguenza, sono stati esclusi risposta. C) Popolazione sparare tasso di PN stesse come in B. Con l'aumento della concentrazione di odore la forza di risposta è in aumento. Il l-ALT mostra una resistenza più forte risposta. In B, C la media e la deviazione standard sono dati.

Figura 6. Confronto attività popolazione in due successive fasi di lavorazione lungo percorso olfattivo della api. Dati sono stati registrati in 20 animali che sono stati stimolati con 1-esanolo e 2-octanone. A) Ogni linea rappresenta il colore falso codificata media frequenza di scarica di una proiezione neurone (PN) calcolata su 10 ripetizioni odore di 1-esanolo. Presentazione Odore inizia al tempo 0 ed è durato tre secondi. B) mostra lo stesso in A), ma per il corpo fungo neuroni estrinseci (EN). La matrice mostrata in A) può essere visto come un vettore PN popolazione durante la stimolazione odore con 1-esanolo. Abbiamo calcolato lo stesso tipo di popolazione vettore durante la stimolazione odore con 2-octanone e usato entrambi i vettori in una analisi delle componenti principali (PCA) mantenendo la dimensione temporale. C) Le prime tre componenti principali (PC1, 2 e 3) sono statitracciata contro l'altro per illustrare la separazione odore nell'attività complesso PN all'uscita lobo antenne. Il tempo prima odore esordio è segnato in nero. Attività durante tre secondi di stimolazione con 1-esanolo è mostrata in blu. L'attività durante la stimolazione con 2-ottanolo è mostrato in rosso. Inoltre, vi mostriamo 1,5 secondi (post) dell'attività dopo l'odore di serie di 1-esanolo (luce blu) e 2-octanonen (rosa). Si noti che, a livello corale PN, sia gli odori che evocano traiettorie molto diverse stabilirsi in un "punto fisso", che sopravvive tutto il periodo di stimolazione odore. Solo dopo aver compensato l'odore le traiettorie si spostano di nuovo l'attività di base senza stimolazione odore. D) La stessa analisi è stata fatta a livello corale IT che rappresenta l'attività in uscita corpo fungo. Rispetto all'attività PN odori evocano una traiettoria meno distinta. Inoltre, un "punto fisso" non è osservabile. Le inizialmente odore traiettorie indotte Interrmingle con l'attività basale anche se l'odore è ancora presente. Solo l'offset odore evocato una traiettoria supplementare.
. Movie 1 ora risolto valutazione di una traiettoria odore indotto dopo analisi delle componenti principali di un vettore PN popolazione (a sinistra) e un EN popolazione vettore. (destra,. cp Figura 6) Le parti superiori sono i primi tre componenti principali (PC1, 2 e 3) tracciata contro l'altro. I pannelli inferiori illustrano la valutazione di PC1, 2 e 3 nel tempo. Stimolazione odore è segnato dalla barra grigia. Tutti i pannelli sono stati sincronizzati. Si noti che la EN dell'attività popolazione inizia poco prima dell'attività popolazione PN, un fenomeno che sembra essere contraintuitive ma può essere spiegato con la connettività e le proprietà degli strati in questione, che è descritto in precedenza 1.
Discussione
Questo articolo illustra la produzione e l'utilizzo di multi micro canale filo-elettrodi progettati su misura. Gli elettrodi descritti sono adatti per la registrazione sia per singola unità e l'attività della popolazione che è particolarmente utile per le misurazioni di latenza e altre proprietà di risposta temporale di diversi neuroni e diverse neuropils all'interno di un unico esemplare (per i dettagli vedi 1,2,25). Inoltre, abbiamo mostrato come implementare in modo permanente gli elettrodi a filo micro per consentire registrazioni stabili a lungo termine comportarsi api che durano per ore fino a giorni.
Extracellulari registrazioni multi-unit è diventato uno strumento favorevole per raggiungere alta risoluzione temporale combinata con informazioni spaziali. Nel nostro caso, questi sono o tratti neuronali in parallelo 2 o due differenti neuropils 1. Diverse neuroni possono essere registrati e analizzati a livello neuronale singola parallelamente e ad alta risoluzione temporale. Multi-unit registrazioneIngs sono stati applicati prima nei mammiferi 38 e successivamente anche negli insetti 39-41. Notevoli progressi è stato raggiunto con lo sviluppo e il miglioramento delle extracellulari tecniche di registrazione multicanale 42,43. Questo, per esempio, comprende lo sviluppo di nuovi elettrodi 44 o nuove picco di ordinamento e di clustering algoritmi 45. Metodi generali di tecniche di registrazione multi-unit extracellulari sono ben descritti 46-48. Gli elettrodi auto costruita mostrati in questo video inoltre possono essere adattati aggiungendo più microfili per elettrodo o micro fili possono essere intrecciati per ottenere misurabili distanze costanti tra le punte. Entrambe le procedure sarebbero, tuttavia, portare a diminuire la flessibilità e aumento dello spessore dell'elettrodo.
Rispetto alle sonde di silicio comunemente utilizzati per le registrazioni extracellulari in insetti molto più grandi, come il falco falena, locuste e scarafaggi 40,49 - 51 micro filo-elettrodi descritte sono più piccoli, flessibili e in grado di affrontare facilmente con i potenziali movimenti del cervello e, quindi, possono essere utilizzate in modo affidabile in piccoli insetti sociali come le api e le formiche che mostrano un repertorio comportamentale molto più ampio. La maggior parte delle sonde silicone hanno gambo appuntito come strutture di taglio assoni e tessuto neurale lungo il canale d'inserimento, mentre le micro fili descritti sono rotondi, flessibile e più piccole e sono quindi meno dannosi per il tessuto circostante che è un chiaro vantaggio se l'obiettivo è quello di studiare lungo plasticità termine in un animale intatto e di comportarsi. Un altro vantaggio di elettrodi a filo micro è la produzione a basso costo e la maneggevolezza. Invece di pulire accuratamente una sonda silicone costosi i fili elettrodi sono appena tagliato prima dell'inserimento cervello e, quindi, problemi mancanza di congestione. Inoltre è possibile utilizzare più di un filo elettrodo micro nella stessa preparazione sia inserita in diversi neuropiles 1 otratti r 2 come ci mostrano qui. Questo approccio è particolarmente favorevole per analizzare e confrontare aspetti temporali come latenze di risposta e interazioni a diversi livelli di elaborazione neurale.
Siamo consapevoli del fatto che un segnale registrato extracellulare non riflette l'attività della cellula singola per sé. E 'sempre un composto di attività tensione attorno alla punta dell'elettrodo. Per individuare la sorgente del segnale differenza dei due canali fili micro limitrofi entro un elettrodo viene sempre calcolata. Così la sorgente per i segnali spike utilizzati per estrarre l'attività singola unità era sempre molto vicino a uno o l'altro canale elettrodo conseguente forme d'onda spike facilmente distinguibili. I segnali provenienti da più lontano, come attività muscolare o attività di neuropils limitrofi, raggiungono entrambi gli elettrodi allo stesso tempo evocando forme e ampiezze comparabili e vengono scartati da questa procedura. Utilizzando la tecnica del modello corrispondente di Spike2,siamo molto fiduciosi di ottenere l'attività singola unità, che non è lo stesso, ma molto vicino all'attività singolo neurone. Tuttavia, la questione del picco ordinamento potrebbe essere evitato utilizzando tecniche di registrazione intracellulare.
Registrazioni cella singola sia con elettrodi taglienti o pipette di patch consentono conoscenza approfondita sulle proprietà fisiologiche di un singolo neurone. Tuttavia, a causa delle piccole dimensioni dei neuroni degli insetti e delle loro neuriti (ad es., Meno di 1 micron per le api PN 52) le registrazioni solo a breve termine sono gestibili. Inoltre, le registrazioni intra cellulari potrebbero essere invasivi e potrebbero danneggiare la cellula che è forse un altro motivo per i limiti temporali. Nel vivo registrazioni intracellulari negli insetti raramente sopravvivono un'ora. Una finestra di tempo che è stato sufficiente per il lavoro pionieristico di Martin Hammer 53, che ha registrato intracellulare da un singolo neurone identificato, il ventrale spaiato maxilar neurone # 1 (VUMmx1). Poteva linchiostro sua attività direttamente al percorso premio. Juliane Mauelshagen 54 registrato intracellulare l'attività di un fungo identificato corpo estrinseca neurone, il peduncolo neurone estrinseca # 1 (PE1) durante il condizionamento classico. Lo stesso neurone era nel fuoco di Menzel e Manz 55 quando hanno trovato LTP dopo la stimolazione elettrica delle cellule Kenyon. Tuttavia, Okada e colleghi 56 potrebbero usare l'innalzamento della intracellulare ben caratterizzato (punte doppie e triple) per l'identificazione del PE1 durante le registrazioni extracellulari. Dopo tutto una combinazione di entrambi i metodi, registrazioni intracellulari da neuroni identificati e registrazioni extracellulari lungo termine potrebbero essere un potente strumento per le indagini future.
Tuttavia, utilizzando elettrodi appuntiti per registrare più cellule (unità) simultaneamente a diversi livelli di elaborazione oltre molte ore fino a giorni per analizzare le loro relazioni risposta temporali e / o anche i cambiamenti plasticis quasi impossibile.
Con la prima rappresentazione di calcio si avvicina nel ape 57,58 con coloranti calcio-sensibile l'analisi dei modelli spaziali di risposte odori erano accessibili 59-62. Tuttavia, in molti casi i coloranti sensibili calcio devono essere introdotti al tessuto cerebrale tramite manipolazioni invasive che limitano nuovamente vita delle api e le proprietà intrinseche delle cellule analizzate. Questo problema è stato superato in altri organismi modello come il moscerino della frutta utilizzando sensori di calcio geneticamente introdotte 63,64. Tuttavia, in generale, i sensori di calcio possono introdurre altre limitazioni in quanto possono agire come buffer di calcio che possono influenzare le proprietà temporali dei cattivi odori. Registrazioni intracellulari simultanee combinate con immagini di calcio o approcci computazionali in grado di dimostrare la risoluzione temporale corretta delle immagini processi 65,66. Tuttavia, la risoluzione temporale del processo di imaging in sé è piuttosto cr limitato. Sistemi di acquisizione ottica di solito usano CCD-imaging con una risoluzione temporale di 5-20 Hz 67, anche se 2-Photon-imaging potrebbe essere in grado di acquisire sequenze veloci 68. Tuttavia, aumentando la frequenza di campionamento va sempre con una perdita in risoluzione spaziale. Inoltre i coloranti calcio-sensibile utilizzato nelle api subiscono sbianca, che riduce anche il tempo di acquisizione 69.
Rispetto ad altre tecniche di registrazione fisiologiche negli insetti nostri elettrodi micro-filo multicanale flessibili garantiscono l'accesso a lungo tempo per singola unità e la popolazione l'attività neuronale nel comportarsi api.
Abbiamo dimostrato come utilizzare due di questi elettrodi in diverse fasi di lavorazione nello stesso animale, che facilita l'analisi degli aspetti codifica temporali tra i vari siti di registrazione. A seconda del problema di ricerca e il modello di insetti il metodo di base della costruzione dell'elettrodo dimostrato qui è facilmente estenderegrado e / o possono essere adattati. Ad esempio è concepibile utilizzare più di tre fili singoli per produrre elettrodi multicanale. Inoltre, il numero di siti di registrazione può essere estesa e osservando aspetti temporali più di due tratti o neuropils è fattibile. La nostra speranza è che questo metodo ispirerà molti scienziati e contribuirà positivamente alla comprensione di sofisticata elaborazione neuronale in piccoli cervelli.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari in competizione.
Riconoscimenti
The authors would like to thank Isabelle Reus for establishment of tracing the electrode insertion side, Tobias Rosenbaum for LabView programming, Anneke Meyer for data analyzes and helpful discussions. We thank Randolf Menzel for discussion and practical help during early stage of electrode development. Furthermore we thank Brian Smith for postdoctoral association to MS-B. This work was supported by the Deutsche Forschungsgemeinschaft (DFG, SPP 1392, Ro1177/5-2) to WR.
Materiali
| Name | Company | Catalog Number | Comments |
| Paraffin oil | Fluka | 76235 | |
| Odors | Sigma Aldrich | ||
| PBS | pH 7.2 | ||
| 4% Formaldehyde | ThermoScientific | 28908 | Methanol free |
| Triton X | BioChemica | A1388 | |
| Methylsalicylate | Roth | 4529.1 | |
| Tetramethylrhodamin dextran, 10,000 MW (Microruby) | Invitrogen | D7162 | keep dark |
| Alexa 488 hydrazide | Invitrogen | A-10436 | keep dark |
| Alexa 568 hydrazide | Invitrogen | A-10437 | keep dark |
| Bee Ringer Solution | see 2 | ||
| Polyurethane-coated copper wire | Elektrisola | 15µm diameter & P155 insulation | |
| Dental Wax | Densply Detrey | 64103015S1 | moderate melting point |
| Dental Wax | Flexaponal | 124-202-00 | low-melting Wax |
| KWIK SIl | WPI | 03L | |
| 18 Pin Socket | Conrad Electronic | 189634-62 | |
| Hot melting glue | Conrad Electronic | 827673 | |
| soldering needle | Conrad Electronics | 830283 | 12 V |
| Soldering terminal lug | Conrad Electronic | 531901 | |
| Glaselectrodes | WPI | 1B100F-3 | |
| Minutien Pins | Fine Science Tools | 26002-20 | V2A 0.2 x 12 mm |
| switchable headstage | Tucer Davis Technologies | SH16 | |
| Headstage connection module | NPI | INT-03M | |
| Amplifier Module | NPI | PDA-2F | |
| Data Acquisition boards | National Instruments | NI-6123, Ni-6143 | |
| Acquisition Software | National Instruments | Lab View 8.2 | custom design |
| Spike-Sorting | CED | Spike 2 v7.11 | |
| Matlab | Mathworks | R2008B | |
| Micromanipulator | Leitz | manual | |
| AG-wires | WPI | AGT05100 | |
| Confocal laser scanning microscope | Leica | TCS SP2 AOBS | |
| AMIRA | Mercury Computer Systems | 2/5/2000 |
Riferimenti
- Strube-Bloss, M. F., Herrera-Valdez, M. a., Smith, B. H. Ensemble response in mushroom body output neurons of the honey bee outpaces spatiotemporal odor processing two synapses earlier in the antennal lobe. PLoS ONE. 7 (11), (2012).
- Brill, M. F., Rosenbaum, T., Reus, I., Kleineidam, C. J., Nawrot, M. P., Rössler, W. Parallel processing via a dual olfactory pathway in the honeybee. The Journal of neuroscience the official journal of the Society for Neuroscience. 33 (6), 2443-2456 (2013).
- Menzel, R. The honeybee as a model for understanding the basis of cognition. Nature Reviews Neuroscience. 13 (11), 758-768 (2012).
- Sandoz, J. Behavioral and neurophysiological study of olfactory perception and learning in honeybees. Frontiers in Systems Neuroscience. 5, (2011).
- Giurfa, M. Cognition with few neurons: higher-order learning in insects. Trends in Neurosciences. 36 (5), 1-10 (2013).
- Menzel, R., Giurfa, M. Cognitive architecture of a mini-brain: the honeybee. Trends in cognitive sciences. 5 (2), 62-71 (2001).
- Hildebrand, J. G., Shepherd, G. M. Mechanisms of olfactory discrimination: converging evidence for common principles across phyla. Annual Review of Neuroscience. 20, 595-631 (1997).
- Wilson, R. I., Mainen, Z. F. Early events in olfactory processing. Annu. Rev. Neurosci. 29, 163-201 (2006).
- Streinzer, M., Kelber, C., Pfabigan, S., Kleineidam, C. J., Spaethe, J. Sexual dimorphism in the olfactory system of a solitary and a eusocial bee species. The Journal of comparative neurology. 521 (12), (2013).
- Nishino, H., Nishikawa, M., Mizunami, M., Yokohari, F. Functional and topographic segregation of glomeruli revealed by local staining of antennal sensory neurons in the honeybee Apis mellifera. The Journal of comparative neurology. 515 (2), 161-180 (2009).
- Schneider, D. Elektrophysiologische Untersuchungen von Chemo- und Mechanorezeptoren der Antenne des Seidenspinners Bombyx mori L. Zeitschrift für Vergleichende Physiologie. 40 (1), 8-41 (1957).
- Menzel, R., Rybak, J. Antennal lobe of the honeybee. Handbook of brain microcircuits. , 427-432 (2011).
- Girardin, C. C., Kreissl, S., Galizia, C. G. Inhibitory connections in the honeybee antennal lobe are spatially patchy. Journal of neurophysiology. 109 (2), 332-343 (2013).
- Meyer, A., Galizia, C. G. Elemental and configural olfactory coding by antennal lobe neurons of the honeybee (Apis mellifera). Journal of comparative physiology. A, Neuroethology, sensory, neural, and behavioral. 198 (2), 159-171 (2012).
- Abel, R., Rybak, J., Menzel, R. Structure and response patterns of olfactory interneurons in the honeybee, Apis mellifera. The Journal of comparative neurology. 437 (3), 363-383 (2001).
- Kirschner, S., Kleineidam, C. J., Zube, C., Rybak, J., Grünewald, B., Rössler, W. Dual olfactory pathway in the honeybee, Apis mellifera. The Journal of comparative neurology. 499 (6), 933-952 (2006).
- Galizia, C. G., Rössler, W. Parallel olfactory systems in insects: anatomy and function. Annual review of entomology. 55 (August), 399-420 .
- Ito, K., Shinomiya, K., et al. A coordinated nomenclature system for the insect brain. Neuron. 81 (4), 755-765 (2014).
- Rybak, J. The digital honey bee brain atlas. Honeybee Neurobiology and Behavior. , 125-140 (2012).
- Rössler, W., Brill, M. F. Parallel processing in the honeybee olfactory pathway: structure, function, and evolution. Journal of comparative physiology. A, Neuroethology, sensory, neural, and behavioral. 199 (11), (2013).
- Mobbs, P. The brain of the honeybee Apis mellifera. I. The connections and spatial organization of the mushroom bodies. Philosophical transactions of the Royal Society of London. Series B, Biological. 298 (1091), 309-354 (1982).
- Strausfeld, N. J. Organization of the honey bee mushroom body: representation of the calyx within the vertical and gamma lobes. The Journal of comparative neurology. 450 (1), 4-33 (2002).
- Witthöft, W. Absolute Anzahl und Verteilung der Zellen im Hirn der Honigbiene. Zeitschrift für Morphologie der Tiere. 61 (1), 160-184 (1967).
- Rybak, J., Menzel, R. Anatomy of the mushroom bodies in the honey bee brain: the neuronal connections of the alpha-lobe. The Journal of Comparative Neurology. 465, 444-465 (1993).
- Strube-Bloss, M. F., Nawrot, M. P., Menzel, R. Mushroom body output neurons encode odor-reward associations. The Journal of neuroscience : the official journal of the Society for Neuroscience. (8), 3129-3140 (2011).
- Haddad, R., Lanjuin, A., Madisen, L., Zeng, H., Murthy, V. N., Uchida, N. Olfactory cortical neurons read out a relative time code in the olfactory bulb. Nature neuroscience. (May), 1-11 (2013).
- Martin, J. P., Beyerlein, A., et al. The neurobiology of insect olfaction: Sensory processing in a comparative context. Progress in neurobiology. 95 (3), 427-447 (2011).
- Nawrot, M. P. Dynamics of sensory processing in the dual olfactory pathway of the honeybee. Apidologie. 43 (3), 269-291 (2012).
- Farkhooi, F., Froese, A., Muller, E., Menzel, R., Nawrot, M. P. Cellular adaptation facilitates sparse and reliable coding in sensory pathways. PLoS computational biology. 9 (10), e1003251 (2013).
- Saha, D., Leong, K., Katta, N., Raman, B. Multi-unit recording methods to characterize neural activity in the locust (Schistocerca americana) olfactory circuits. Journal of visualized experiments JoVE. (71), (2013).
- Saha, D., Leong, K., Li, C., Peterson, S., Siegel, G., Raman, B. A spatiotemporal coding mechanism for background-invariant odor recognition. Nature neuroscience. 16 (12), 1-13 (2013).
- Mizunami, M., Okada, R., Li, Y., Strausfeld, N. J. Mushroom Bodies of the Cockroach Activity and Identities of Neurons. Journal of Comparative Neurology. 519 (July), 501-519 (1998).
- Okada, R., Ikeda, J., Mizunami, M. Sensory responses and movement-related activities in extrinsic neurons of the cockroach mushroom bodies. Journal of Comparative Physiology A: Sensory, Neural, and Behavioral Physiology. 185 (2), 115-129 (1999).
- Haehnel, M., Froese, A., Menzel, R. In vivo Ca2+ imaging of mushroom body neurons during olfactory learning in the honey bee. Journal of visualized experiments JoVE. (30), (2009).
- Felsenberg, J., Gehring, K. B., Antemann, V., Eisenhardt, D. Behavioural pharmacology in classical conditioning of the proboscis extension response in honeybees (Apis mellifera). Journal of visualized experiments JoVE. (47), (2011).
- Rehder, V. Quantification of the honeybee’s proboscis reflex by electromyographic recordings. Journal of Insect Physiology. 33 (7), 501-507 (1987).
- Serrano, E., Nowotny, T., Levi, R., Smith, B. H., Huerta, R. Gain control network conditions in early sensory coding. PLoS computational biology. 9 (7), e1003133 (2013).
- Hubel, D. H., Wiesel, T. N. Receptive fields and functional architecture of monkey striate cortex. The Journal of physiology. 195 (1), 215-243 (1968).
- Christensen, T. A., Pawlowski, V. M., Lei, H., Hildebrand, J. G. Multi-unit recordings reveal context-dependent modulation of synchrony in odor-specific neural ensembles. Nature neuroscience. 3 (9), 927-931 (2000).
- Byers, K. J. R. P., Sanders, E., Riffell, J. A. Identification of olfactory volatiles using gas chromatography-multi-unit recordings (GCMR) in the insect antennal lobe. Journal of visualized experiments JoVE. (72), e4381 (2013).
- Perez-Orive, J., Mazor, O., Turner, G. C., Cassenaer, S., Wilson, R. I., Laurent, G. Oscillations and sparsening of odor representations in the mushroom body. Science. 297 (5580), 359-365 (2002).
- Stevenson, I. H., Kording, K. P. How advances in neural recording affect data analysis. Nature. 14 (2), 139-142 (2011).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature neuroscience. 7 (5), 446-451 (2004).
- Viventi, J., Kim, D. -. H., et al. Flexible, foldable, actively multiplexed, high-density electrode array for mapping brain activity in vivo. Nature neuroscience. 14 (12), 1599-1605 (2011).
- Pouzat, C., Mazor, O., Laurent, G. Using noise signature to optimize spike-sorting and to assess neuronal classification quality. Journal of neuroscience methods. 122 (1), 43-57 (2002).
- Lewicki, M. S. A review of methods for spike sorting: the detection and classification of neural action potentials. Network. 9 (4), R53-R78 (1998).
- Quian Quiroga, R., Panzeri, S. Extracting information from neuronal populations: information theory and decoding approaches). Nature reviews. Neuroscience. 10 (3), 173-185 (2009).
- Einevoll, G. T., Franke, F., Hagen, E., Pouzat, C., Harris, K. D. Towards reliable spike-train recordings from thousands of neurons with multielectrodes. Current opinion in neurobiology. 22 (1), 11-17 (2012).
- Riffell, J. a., Lei, H., Abrell, L., Hildebrand, J. G. Neural basis of a pollinator’s buffet: olfactory specialization and learning in Manduca sexta. Science. 164 (6), 877-892 (2013).
- Bender, J. a., Pollack, A. J., Ritzmann, R. E. Neural activity in the central complex of the insect brain is linked to locomotor changes. Current biology : CB. 20 (10), 921-926 (2010).
- Perez-Orive, J., Bazhenov, M., Laurent, G. Intrinsic and circuit properties favor coincidence detection for decoding oscillatory input. The Journal of neuroscience the official journal of the Society for Neuroscience. 24 (26), 6037-6047 (2004).
- Rybak, J. . Die strukturelle Organisation der Pilzkörper und synaptische Konnektivität protocerebraler Interneuronen im Gehrin der Honigbiene, Apis mellifera.: eine licht- und elektronenmikroskopische Studie. , (1994).
- Hammer, M. An identified neuron mediates the unconditioned stimulus in associative olfactory learning in honeybees. Nature. 366, 59-63 (1993).
- Mauelshagen, J. Neural correlates of olfactory learning paradigms in an identified neuron in the honeybee brain. Journal of neurophysiology. 69, 609-625 (1993).
- Menzel, R., Manz, G. Neural plasticity of mushroom body-extrinsic neurons in the honeybee brain. The Journal of experimental biology. 208 (22), 4317-4332 (2005).
- Okada, R., Rybak, J., Manz, G., Menzel, R. Learning-related plasticity in PE1 and other mushroom body-extrinsic neurons in the honeybee brain). The Journal of neuroscience: the official journal of the Society for Neuroscience. 27 (43), 11736-11747 (2007).
- Joerges, J., Küttner, A., Galizia, C. G., Menzel, R. Representation of odours and odour mixtures visualized in the honeybee brain. Nature. 387, 285-288 (1997).
- Galizia, C. G., Joerges, J., Küttner, A., Faber, T., Menzel, R. A semi-in-vivo preparation for optical recording of the insect brain. Journal of neuroscience. 76 (1), 61-69 (1997).
- Galizia, C. G., Sachse, S., Rappert, A., Menzel, R. The glomerular code for odor representation is species specific in the honeybee Apis mellifera. Nature. 2 (5), 473-478 (1999).
- Sandoz, J. -. C. Odour-evoked responses to queen pheromone components and to plant odours using optical imaging in the antennal lobe of the honey bee drone Apis mellifera L. The Journal of experimental biology. 209 (18), 3587-3598 (2006).
- Fernandez, P. C., Locatelli, F. F., Person-Rennell, N., Deleo, G., Smith, B. H. Associative conditioning tunes transient dynamics of early olfactory processing. The Journal of neuroscience the official journal of the Society for Neuroscience. 29 (33), 10191-10202 (2009).
- Locatelli, F. F., Fernandez, P. C., et al. Nonassociative plasticity alters competitive interactions among mixture components in early olfactory processing. European Journal of Neuroscience. 37 (1), (2013).
- Silbering, A. F., Bell, R., Galizia, C. G., Benton, R. Calcium imaging of odor-evoked responses in the Drosophila antennal lobe. Journal of visualized experiments JoVE. (61), 1-7 (2012).
- Strutz, A., Völler, T., Riemensperger, T., Fiala, A., Sachse, S. Calcium imaging of neural activity in the olfactory system of Drosophila. Genetically Encoded Functional Indicators. 72, 43-70 (2012).
- Galizia, C. G., Kimmerle, B. Physiological and morphological characterization of honeybee olfactory neurons combining electrophysiology, calcium imaging and confocal microscopy. Journal of Comparative Physiology A: Neuroethology, Sensory, Neural, and Behavioral Physiology. 190 (1), 21-38 (2004).
- Helmchen, F., Waters, J. Ca2+ imaging in the mammalian brain in vivo. European journal of pharmacology. 447 (2-3), 119-129 (2002).
- Stierle, J. S., Galizia, C. G., Szyszka, P. Millisecond stimulus onset-asynchrony enhances information about components in an odor mixture. Journal of Neuroscience. 33 (14), 6060-6069 (2013).
- Haase, A., Rigosi, E., et al. In-vivo two-photon imaging of the honey bee antennal lobe. Biomedical optics express. 2 (1), 131-138 (2010).
- Becker, P. L., Fay, F. S. Photobleaching of fura-2 and its effect on determination of calcium concentrations. The American journal of physiology. 253 (4 pt 1), C613-C618 (1987).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon