A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
وصفها تسلسل معين من الأحماض النووية والبروتينات مع ميثيل والعامل المساعد النظائر
In This Article
Summary
وصفت DNA والبروتينات تسلسل تحديدا مع تقارب أو مجموعات مراسل الفلورسنت باستخدام الحمض النووي أو البروتين ميثيل ونظائرها العامل المساعد الاصطناعية. اعتمادا على خصوصية العامل المساعد للأنزيمات، aziridine أو مزدوجة نظائرها العامل المساعد تنشيط يعملون لواحد أو اثنين من خطوة وصفها.
Abstract
S -Adenosyl-L-ميثيونين (AdoMet أو SAM) ميثيل معتمد على (MTase) تحفز نقل مجموعة الميثيل تفعيلها من AdoMet إلى مواقع محددة في DNA، RNA والبروتينات والجزيئات الحيوية الصغيرة. يمكن توسيع هذا رد فعل مثيلة الطبيعي لمجموعة واسعة من ردود الفعل الألكلة باستخدام نظائرها العامل المساعد الاصطناعية. استبدال مركز sulfonium رد الفعل من AdoMet مع حلقة aziridine يؤدي إلى العوامل المساعدة التي يمكن أن يقترن مع الحمض النووي DNA من قبل MTases المختلفة. يمكن تجهيز هذه العوامل المساعدة aziridine مع جماعات مراسل في مواقع مختلفة من شاردة الأدينين واستخدامها لS M equence محددة ethyltransferase- I nduced جي L هابيل من الحمض النووي (DNA يبتسم). وكمثال نموذجي نعطي بروتوكول للbiotinylation من DNA البلازميد pBR322 في التسلسل 5'-ATCG A T-3 "مع DNA MTase M.BseCI والعامل المساعد aziridine 6BAz فيخطوة واحدة. تمديد مجموعة الميثيل تفعيلها مع غير المشبعة النتائج الألكيل في فئة أخرى من نظائرها AdoMet التي تستخدم لم الموجه ethyltransferase T ransfer من A roups G ctivated (mTAG). منذ يتم تنشيط الجانب سلاسل طويلة من قبل مركز sulfonium والسندات غير المشبعة، وتسمى هذه العوامل المساعدة نظائرها AdoMet تنشيط نقرا مزدوجا. هذه نظائرها وظيفة ليس فقط باعتبارها العوامل المساعدة لMTases DNA، مثل العوامل المساعدة aziridine، ولكن أيضا لRNA والبروتين وMTases جزيء صغير. وعادة ما يتم استخدامها لتعديل الأنزيمية من ركائز MTase مع المجموعات الوظيفية الفريدة التي وصفت مع جماعات مراسل في خطوة الكيميائية الثانية. ويتمثل هذا في بروتوكول لوضع العلامات مضان من البروتين هيستون H3. يتم نقل مجموعة propargyl صغيرة من SeAdoYn العامل المساعد التناظرية إلى البروتين بواسطة يسين هيستون H3 4 (H3K4) MTase Set7 / 9 تليها بنقرة وضع العلامات للalkynylated H3 هيستون مع طمرة أزيد. وضع العلامات MTase بوساطة مع نظائرها العامل المساعد هو عبارة عن تقنية تمكن للعديد من التطبيقات المثيرة بما في ذلك تحديد ودراسة وظيفية من ركائز MTase فضلا عن التنميط الجيني DNA وكشف الحامض.
Introduction
وضع العلامات معين من الأحماض النووية والبروتينات 1،2 3،4 هو من مصلحة كبيرة للالأوصاف الوظيفية، والتشخيص الطبي و(نانو) التكنولوجيا الحيوية. هنا نقدم طريقة وضع العلامات الأنزيمي لهذه البوليمرات الحيوية التي تقوم على أساس S -adenosyl-L-ميثيونين (AdoMet أو SAM) ميثيل معتمد على (MTases). هذه الفئة من الأنزيمات (EC 2.1.1.) تستهدف مواقع أليفة النواة الفردية (النيتروجين، والأكسجين والكبريت وذرات الكربون) داخل بقايا معينة من الأحماض النووية والبروتينات وبطبيعة الحال ينقل مجموعة الميثيل تفعيلها من AdoMet العامل المساعد (الشكل 1A) 5. وبالإضافة إلى ذلك، يمكن MTases الاستفادة من نظائرها العامل المساعد الاصطناعية لوضع العلامات المحددة مع بطاقة تقارب، fluorophores أو تسميات أخرى (الشكل 1B) 6. وقد وضعت فئتين من نظائرها AdoMet: العوامل المساعدة Aziridine لS equence محددة M ethyltransferase- I nduced L هابيل جي (يبتسم) 7 ومزدوجة نظائرها AdoMet تفعيلها للم الموجه ethyltransferase T ransfer من A ctivated roups G (mTAG) 8.

الشكل 1: ردود الفعل يحفزه ميثيل (MTases) A. الميثيل نقل مجموعة من العامل المساعد الطبيعي AdoMet (SAM) إلى ركائز مختلفة بما في ذلك DNA، RNA والبروتينات والجزيئات الحيوية صغيرة B. وصفها / functionalization من الأحماض النووية والبروتينات (NNNNN =. أزواج قاعدة لDNA، RNA النيوكليوتيدات لوالأحماض الأمينية للبروتينات، XXXXX = تسلسل الاعتراف MTase مع بقايا الهدف باللون الأخضر) مع نظائرها العامل المساعد الاصطناعية. العوامل المساعدة Aziridine تحتوي على مجموعة مراسل (المجال الأزرق)تعلق على عصابة الأدينين هي تسلسل جانب تحديدا مع بقايا الهدف (يسار) ومزدوجة تنشيط نظائرها AdoMet تؤدي إلى نقل سلاسل ألكيل بمد يحمل مراسل الكيميائية Y (يمين) والتي يمكن أن توصف عن طريق النقر رد فعل bioorthogonal في الخطوة الثانية. الرجاء الضغط هنا لمشاهدة نسخة أكبر من هذا الرقم.
العوامل المساعدة Aziridine تعمل بشكل أفضل مع MTases DNA. أنها تحتوي على حلقة membered ثلاثة مع ذرة النيتروجين 9 (أو N -mustard 10،11) بدلا من مركز sulfonium مجموعة رد الفعل كما. إضافة بروتون من هذا ذرة النيتروجين ينشط حلقة aziridine لهجوم أليف النواة من قبل النوكليوتيدات الهدف الذي يؤدي إلى اقتران التساهمية من العامل المساعد كله مع DNA. عن طريق ربط مجموعات المراسل إلى حلقة الأدينين والعوامل المساعدة aziridine يمكن استخدامها في تركيبة مع MTases DNA لتسمية DNA في خطوة واحدة ( ز> الشكل 1B، يسار) 7،12. ويتجلى هذا في التفاصيل لbiotinylation من الحمض النووي مع 6BAz 13-15 (aziridine العامل المساعد مع البيوتين تعلق على موقف 6 من عصابة الأدينين) والأدينين محددة DNA MTase من عصوية دهنية أليفة الحرارة (M.BseCI) 16 (الشكل 2، انظر القسم بروتوكول 2: وضع العلامات خطوة واحدة من الحمض النووي عبر aziridine العوامل المساعدة). بالإضافة إلى M.BseCI ('تسلسل الاعتراف، وMTases DNA من مستحرة مائية (M.TaqI، 5'-TCG A -3 5'-ATCG A T-3)')، من المستدمية heamolyticus (M.HhaI، 5 "-G C GC-3 ') ومن Spiroplasma (M.SssI، وقد استخدمت 5'- C G-3') بنجاح لbiotinylate DNA مع 6BAz 17. وعلاوة على ذلك، العوامل المساعدة aziridine يمكن استخدام لخطوة واحدة وضع العلامات DNA مضان 18،19.
ontent "FO: المحافظة على together.within صفحة =" دائما ">
الشكل 2: تسلسل محدد من خطوة واحدة biotinylation من الحمض النووي مع M.BseCI و6BAz تعترف DNA MTase M.BseCI تسلسل الحمض النووي المزدوج تقطعت بهم السبل 5'-ATCG A T-3 "وبطبيعة الحال methylates المجموعة الأمينية من الأدينين الثاني بقايا (الأخضر) باستخدام AdoMet. مع العامل المساعد aziridine 6BAz يتم تغيير مسار رد الفعل وM.BseCI يؤدي إلى تسلسل الحمض النووي biotinylation معين عن طريق اقتران العامل المساعد كله بما في ذلك البيوتين (الأزرق) مع الأدينين الهدف. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
مزدوجة نظائرها AdoMet تنشيط تحتوي على تمديد السلاسل الجانبية غير المشبعة بدلا من مجموعة الميثيل في مركز sulfonium (الشكل 1B ، أليس كذلك) 20. الرابطة المزدوجة أو الثلاثية غير المشبعة في β-موقف لمركز sulfonium يعوض إلكترونيا الآثار الفراغية غير المواتية داخل الدولة الانتقالية لتحقيق الاستقرار اقترانية. نظرا لأن كلا من مركز sulfonium والسندات غير المشبعة تفعيل الجانب سلسلة لنقل الأنزيمية، تم تسمية هذه العوامل المساعدة نظائرها AdoMet تنشيط نقرا مزدوجا. عادة، يتم استخدامها لنقل سلاسل جنب مع مجموعة فريدة الكيميائية (للصحفيين) الكيميائية، مثل مجموعات الأمينية، آلكاين وأزيد، لوضع العلامات الكيماوي انتقائية في الخطوة الثانية 8،21. بشكل عام، يمكن أن تتضاعف تنشيط نظائرها AdoMet ليس فقط وظيفة العوامل المساعدة لDNA MTases 8،20،21 ولكن أيضا لRNA MTases 22،23 وMTases البروتين 24 - 28 يسمح وضع العلامات إضافية من RNA والبروتينات. ومع ذلك، فإن السلاسل الجانبية الممتدة هي sterically أكثر تطلبا من مجموعة الميثيل وتوسيع المواقع المفعلة MTase بواسطة بروتين الهندسة هو الغفور الرحيمأون المطلوبة للحصول على معدلات نقل فعالة. حل آخر لهذه المشكلة هو استخدام التناظرية AdoMet مع مجموعة صغيرة propargyl (ثلاثة الكربونات) حيث يخدم آلكاين محطة وظيفتين: 1. لتحقيق الاستقرار في الحالة الانتقالية خلال نقل الأنزيمية و2. التعامل مع رد الفعل لمتابعة التعديلات الكيميائية نحاسية المحفزة أزيد آلكاين الإضافة الحلقية (CuAAC) انقر الكيمياء. واتضح أن الناتج propargylic AdoMet التناظرية 29 غير مستقر تماما في ظل ظروف محايدة أو الأساسية قليلا وفقط من الاستخدام المحدود. هذا العيب يمكن أن تكون ثابتة عن طريق استبدال ذرة الكبريت مع السيلينيوم. مما أدى العامل المساعد 5 '- [(سي) [(3 S) -3-الأمينية-3-carboxypropyl] دعامة-2-ynylselenonio] -5'-deoxyadenosine (SeAdoYn، الشكل 3) وقبلها البرية من نوع DNA، RNA وMTases بروتين 30-32 التي تلغي الحاجة للهندسة البروتين في كثير من الحالات. وهذا يتجسد من مضان الموالية وضع العلامات البروتين مع يسين هيستون H3 4 (H3K4) MTase Set7 / 9 33 (الشكل 3، انظر القسم بروتوكول 3: خطوتين وضع العلامات البروتين عن طريق تنشيط العوامل المساعدة مزدوجة).
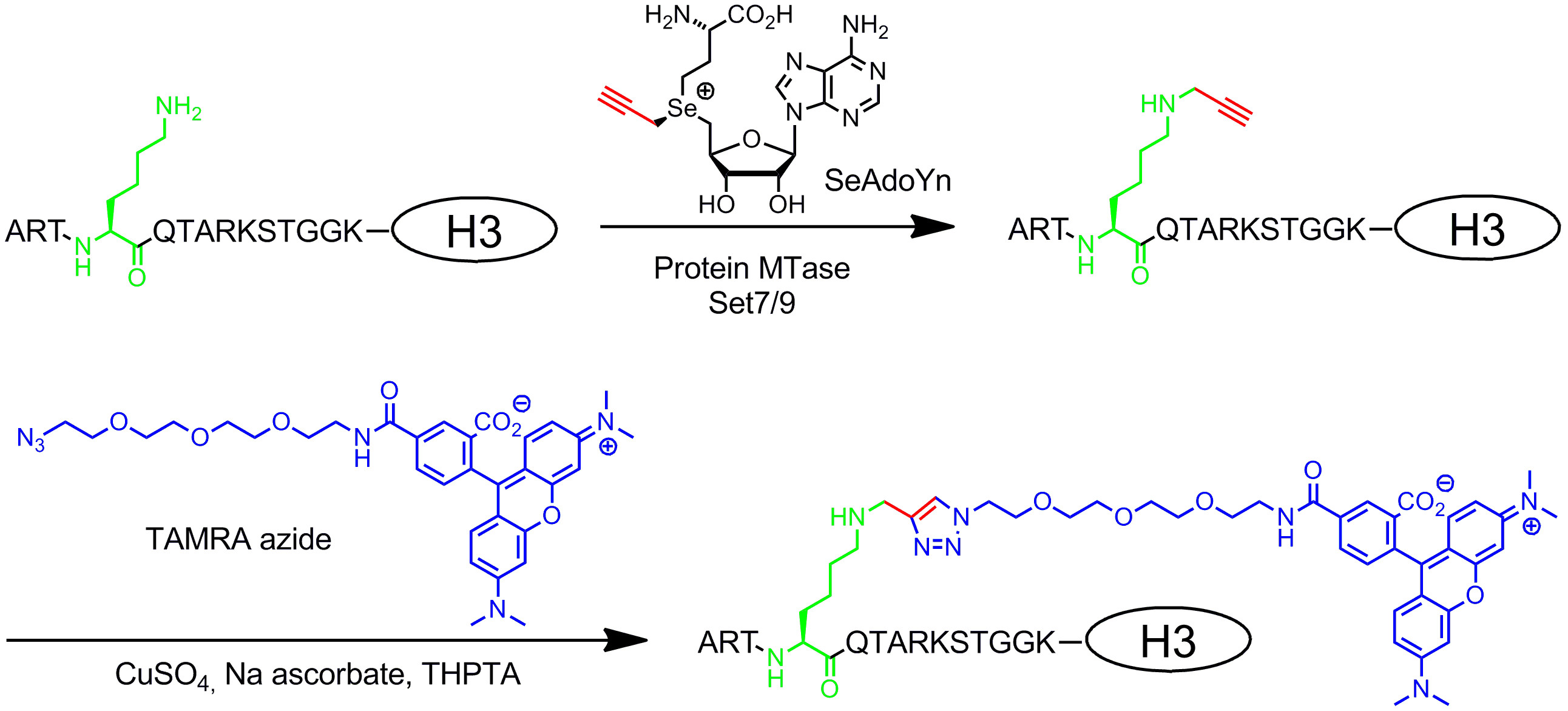
الشكل (3): من خطوتين وضع العلامات مضان تسلسل محدد من هيستون H3 مع Set7 / 9، SeAdoYn وطمرة أزيد البروتين MTase Set7 / 9 طبيعيا methylates المجموعة الأمينية يسين 4 في H3 هيستون (H3K4 والأخضر) باستخدام AdoMet. مع العامل المساعد المزدوج تنشيط SeAdoYn في MTase نقل مجموعة propargyl صغيرة (أحمر) إلى بقايا يسين. ثم يتم تعديل رابطة ثلاثية محطة تعلق بشكل انتقائي في bioorthogonal نقرة رد فعل (المحفز النحاس وأزيد آلكاين الإضافة الحلقية، CuAAC) مع أزيد derivatized طمرة (tetramethylrhodamine والأزرق) fluorophore.تحميل / 52014 / 52014fig3highres.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
Protocol
1. التعليمات العامة
- متجر aziridine العامل المساعد 6BAz (في DMSO) والبروتين MTase Set7 / 9 -80 ° C وجميع الكواشف الأخرى بما في ذلك العامل المساعد المزدوج تنشيط SeAdoYn وDNA MTase M.BseCI (في 50٪ الجلسرين) في -20 ° C.
- تحديد تركيز 6BAz وSeAdoYn عن طريق الأشعة فوق البنفسجية / فيس التحليل الطيفي باستخدام معاملات الانقراض ε 269nm (6BAz) = 16،000 سم -1 -1 M وε 260nm (SeAdoYn) = 15،400 سم -1 M -1 في الماء منزوع الأيونات. تحديد تركيز MTases بواسطة الفحص برادفورد، أو إذا كان معامل الانقراض هو متاح، عبر امتصاص المباشر في 280 نانومتر.
- في محاولة لتجنب خلق فقاعات من قبل pipetting المكثف أو vortexing للمنع فقدان نشاط انزيم. بدلا من ذلك، مزيج من قبل pipetting بلطف صعودا وهبوطا.
- عند إضافة العوامل المساعدة aziridine من الحلول الأسهم في DMSO تأكد من أن تركيز DMSO النهائية في الاختبار هو أقلمن 5٪. تشمل دائما 10 أيونات المغنيسيوم ملي في المخزن المؤقت فحص لمنع ردود الفعل غير محددة مع DNA.
- عند إضافة العوامل المساعدة تنشيط مزدوجة من الحلول الأسهم الحمضية استخدام كميات صغيرة (حلول الأوراق المالية عالية التركيز) لتجنب التغييرات الرقم الهيدروجيني، وتأكد من أن الرقم الهيدروجيني للمحلول الفحص لا تتغير بشكل ملحوظ. تجنب التجولات، على سبيل المثال، β المركابتويثانول أو dithiothreitol (DTT)، في المخزن المؤقت فحص لأنها يمكن أن تتداخل مع النقر رد فعل من جانب complexation من أيونات النحاس المطلوبة.
2. خطوة واحدة وصفها من الحمض النووي عبر Aziridine العوامل المساعدة
- تسلسل محدد الناتج عن ناقلة ميثيل تسمية جي (يبتسم) من DNA البلازميد مع M.BseCI DNA MTase وaziridine العامل المساعد 6BAz.
- ذوبان الجليد الحل العامل المساعد في 20 ° C وإعداد الخلائط رد فعل على الجليد.
- بالإضافة إلى فحص أداء عنصر تحكم "العامل المساعد"، لتصور أي تعديلات محددة غير، و& #8220؛ انزيم "السيطرة، للتأكد من أن إعداد MTase نقدمه مجانا من AdoMet العامل المساعد الطبيعي.
- لمزيج فحص 2 ميكرولتر من 10X عازلة التعديل (التي تحتوي على 100 ملي تريس، حمض الهيدروكلوريك، و 100 ملي MgCl 2، 20 ملم β المركابتويثانول، ودرجة الحموضة 7.4)، 2 ميكرولتر من pBR322 (0.5 ميكروغرام / ميكرولتر)، و 10 مكافئ. M.BseCI في تسلسل الاعتراف على الحمض النووي (تسلسل 1 الاعتراف في pBR322) والعامل المساعد aziridine 6BAz إلى تركيز النهائي من 60 ميكرومتر ضمن الحجم الكلي لل20 ميكرولتر. إضافة العامل المساعد وDNA MTase الماضي.
ملاحظة: β المركابتويثانول سامة، أكالة وضررا للبيئة. - من أجل السيطرة "العامل المساعد" إضافة الماء منزوع الأيونات بدلا من M.BseCI ول "إنزيم" السيطرة يضاف الماء منزوع الأيونات بدلا من 6BAz.
- مزيج الحلول من قبل pipetting بلطف صعودا وهبوطا.
- احتضان الأنابيب عند 55 درجة مئوية لمدة 1 ساعة.
- أجهزة الطرد المركزي لفترة وجيزة لجمع كل السائل في الجزء السفلي من الأنابيب.
- تقييد للتعديل فحص للتحقق من تعديل DNA.
- يعد حل عن طريق خلط 10 ميكرولتر 10X R.TaqI عازلة (التي تحتوي على 100 ملي تريس، حمض الهيدروكلوريك، 50 ملي MgCl 2، 1 M كلوريد الصوديوم، 1 ملغ / مل الزلال البقري مصل، ودرجة الحموضة 8.0)، و 80 ميكرولتر الماء منزوع الأيونات و 3.3 ميكرولتر من تقييد نوكلياز داخلية (REase) من مستحرة مائية (R.TaqI، 10 U / ميكرولتر). تأكد من إضافة REase في الخطوة الأخيرة.
- إلى كل أنبوب من 2.1.7 إضافة 2 ميكرولتر من 10X R. تقي العازلة و 28 ميكرولتر من الحل من فوق (2.2.1).
- مزيج الحلول من قبل pipetting بلطف صعودا وهبوطا.
- احتضان الأنابيب عند 65 درجة مئوية لمدة 30 دقيقة.
- أجهزة الطرد المركزي لفترة وجيزة لجمع كل السائل في الجزء السفلي من الأنابيب.
- التحول Electromobility فحص (EMSA) مع streptavidin للتحقق من تعديل وظيفي.
- إزالة 25 ميكرولتر من كل أنبوب (2.2.5) وإضافة 2.4 ميكرولتر من حل streptavidin (1 ملم فيما يتعلق streptavidin مonomer في المخزن streptavidin تحتوي على 100 ملي نا 2 هبو 4، 100 مم كلوريد الصوديوم، ودرجة الحموضة 7.5. 4 حكمه من إجمالي البيوتين). إضافة 2.4 ميكرولتر من العازلة streptavidin للأنابيب المتبقية.
- احتضان جميع الأنابيب عند 37 درجة مئوية لمدة 1 ساعة.
- تحليل عبر agarose هلام الكهربائي.
- إضافة 5 ميكرولتر من العازلة 6X تحميل (0.25٪ برموفينول الأزرق، و 30٪ الجلسرين) إلى كل أنبوب.
- مزيج من حلول بلطف.
- تحميل 10 ميكرولتر من كل عينة في آبار من agarose هلام (1٪ الاغاروز في المخزن 0.5X TBE تحتوي على 1X GelRed من حل 10،000x الأسهم).
- تشغيل هلام في 0.5X عازلة TBE مع 80 V تقريبا. 1 ساعة.
- تصور العصابات DNA على طاولة الأشعة فوق البنفسجية (312 نانومتر) مع كاميرا CCD مجهزة فلتر (540 ± 50 نانومتر).
ملاحظة: ضوء الأشعة فوق البنفسجية وتضر العينين والجلد.
3. اثنين من خطوة وصفها البروتين عن طريق العوامل المساعدة المنشط مزدوجة
- Methyltransfنقل المجموعات المنشط (mTAG) مع Set7 / 9 والعامل المساعد المزدوج تنشيط SeAdoYn لهيستون H3 يسين 4 وضع العلامات (خطوة التعديل) محو الموجه.
- ذوبان الجليد مكونات وتحضير مخاليط رد فعل على الجليد. ملاحظة: دائما نأخذ تبريد SeAdoYn لتجنب تدهور.
- بالإضافة إلى فحص أداء عنصر تحكم "العامل المساعد"، لتصور أي تعديلات غير محددة، و "إنزيم" السيطرة، لاستبعاد ردود فعل غير محددة لجنة التحقيق الفلورسنت.
- تحضير محلول الفحص (20 ميكرولتر) التي تحتوي على عازلة التعديل (50 ملي تريس، حمض الهيدروكلوريك، 5٪ الجلسرين، ودرجة الحموضة 8.5)، و 10 ميكرومتر هيستون H3، 10 ميكرومتر Set7 / 9 و 600 ميكرومتر SeAdoYn (خليط من كلا epimers في السيلينيوم). في الخطوات الأخيرة إضافة العامل المساعد ثم MTase.
- من أجل السيطرة "العامل المساعد" إعداد حل الفحص كما في 3.1.3 وإضافة 60 ملي AdoMet للتنافس مع العامل المساعد الاصطناعية. من أجل السيطرة "إنزيم" إضافة الماء منزوع الأيونات بدلا من SeAdoYn.
- مزيج الحلول من قبل pipetting ببطء صعودا وهبوطا. تحقق من درجة الحموضة بإضافة 1 ميكرولتر من كل حل لمجال العلوي من شريط الأس الهيدروجيني (الحموضة مجموعة من 5 - 10).
- احتضان عند 37 درجة مئوية لمدة 2 ساعة.
- في هلام وفي الوقت نفسه إعداد 12٪ SDS بولي أكريلاميد هلام (تشغيل: 357 ملم مكرر تريس درجة الحموضة 6،5-6،8، 0.1٪ (ث / ت) وكالة الأنباء الجزائرية، 0.04٪ (ت / ت) TEMED و 12٪ مادة الأكريلاميد / bisacrylamide 37.5: 1 ، هلام التحميل: 357 ملم مكرر تريس درجة الحموضة 6،5-6،8، 0.1٪ (ث / ت) وكالة الأنباء الجزائرية، 0.04٪ (ت / ت) TEMED و 5٪ الأكريلاميد / bisacrylamide 37.5: 1).
ملاحظة: الأكريلاميد / bisacrylamide هي سامة والصحة خطرة. ارتداء القفازات أثناء هذا الإجراء.
- وضع العلامات الكيميائي ليسين alkinylated 4 في هيستون H3 عبر المحفز النحاس وأزيد آلكاين الإضافة الحلقية (CuAAC) (الخطوة التوسيم).
- فقط قبل نهاية التفاعل تعديل إعداد 5X انقر مزيج تحتوي على 3 مم كبريتات النحاس 4، 3 ملي تريس (3-هيدروكسي-triazolylmethyl) أمين (THPTA)، 250 ملي أسكوربات الصوديوم و 6 ملي طمرة أزيد معالحجم الكلي لل20 ميكرولتر.
- إضافة 5 ميكرولتر من الطازجة 5X فوق المزيج إلى كل أنبوب لبدء CuAAC وإخماد رد فعل التعديل.
- المزيج بلطف pipetting صعودا وهبوطا.
- حماية جميع الأنابيب مع رقائق الألومنيوم من الضوء لتجنب الصورة تبيض من fluorophore.
- احتضان عند 20 درجة مئوية لمدة 1 ساعة.
- هطول الأمطار البروتين لإزالة الزائدة حرية طمرة fluorophore.
- لتجنب التألق من الفلورسنت المسمى هيستون H3 التي كتبها المكثف مضان في جل حرية طمرة fluorophore، وإزالة fluorophore الزائدة من قبل هطول الأمطار من البروتينات (3.3.2 - 3.3.4) 34.
- إضافة 75 ميكرولتر الميثانول، 18.8 ميكرولتر الكلوروفورم و 50 ميكرولتر منزوع الأيونات الماء إلى كل أنبوب ودوامة لفترة وجيزة بعد كل إضافة. أجهزة الطرد المركزي في 16،000 x ج لمدة 5 دقائق. إزالة المرحلة العليا من دون إزعاج طبقة اجهة، والتي تحتوي على البروتين.
- إضافة 56.3 ميكرولتر الميثانول إلى المرحلة المتبقية طن كل أنبوب، دوامة والطرد المركزي في 16،000 x ج لمدة 5 دقائق لتكوير البروتين. إزالة طاف. كرر هذه الخطوة لغسل بيليه.
- تغطية أنابيب مفتوحة بمنديل الخالي من الوبر والسماح لهم الجافة لمدة 15 - 30 دقيقة.
- تحليل عبر SDS PAGE.
- حل البروتينات عجلت من 3.3.4 في 20 ميكرولتر SDS العازلة تحميل (50 ملي تريس، حمض الهيدروكلوريك، و 2.5٪ (ث / ت) SDS، 10٪ (ت / ت) الجلسرين، 320 ملم β المركابتويثانول و 0.05٪ (وزن / ت) برموفينول الأزرق، ودرجة الحموضة 6.8). تأكد بحل تماما بيليه وذلك بدهن جدران الأنابيب مع ماصة.
- احتضان العينات عند 95 درجة مئوية لمدة 10 دقيقة والسماح لهم يبرد إلى 20 درجة مئوية.
- أجهزة الطرد المركزي لفترة وجيزة لجمع كل السائل في الجزء السفلي من الأنابيب.
- تحميل كامل المبلغ من كل عينة في آبار من هلام بولي أكريلاميد SDS (3.1.7). استخدام 50 ملي اجتماعات الأطراف، 50 ملي تريس-X (تريس قاعدة)، و 5 ملي EDTA، 0.1٪ (ث / ت) SDS كما يعمل عازلة للالكهربي.
- تشغيل هلام مع 120 V تقريبا. 90 دقيقة.
- تصور مضان في جل على طاولة الأشعة فوق البنفسجية (312 نانومتر) مع كاميرا CCD مجهزة فلتر (540 نانومتر ± 50 نانومتر).
ملاحظة: ضوء الأشعة فوق البنفسجية وتضر العينين والجلد.
النتائج
خطوة واحدة وصفها من الحمض النووي عبر Aziridine العوامل المساعدة
ويتم هذا التفاعل سبيل المثال بها مع DNA MTase M.BseCI، الذي يعدل بقايا الأدينين الثانية ضمن 5'-ATCG A T-3 "تسلسل المزدوج تقطعت بهم السبل، ولها موقع اعتراف واحد على ...
Discussion
وضع العلامات من خطوة واحدة من الحمض النووي DNA مع MTases والعوامل المساعدة aziridine (DNA يبتسم) هو وسيلة قوية ولكن ينبغي النظر في بعض الجوانب عند التخطيط للتجربة.
العامل المساعد Aziridine: وكان تركيز 6BAz لوضع العلامات DNA مع M.BseCI 60 ميكرومتر. ع?...
Disclosures
The authors disclose the following competing financial interest: E.W. is inventor on related patents.
Acknowledgements
The authors thank Kerstin Glensk for preparing the MTases M.BseCI and Set7/9 and gratefully acknowledge funding by the Excellence Initiative of the German Federal and State Governments and RWTH Aachen University. The authors are happy to provide 6BAz and SeAdoYn or other cofactor analogues for collaborative research.
Materials
| Name | Company | Catalog Number | Comments |
| 6BAz | Synthesized according to Weinhold et al., Patent number US 8,129,106, published March 6, 2012. | ||
| β-Mercaptoethanol | Serva | 28625 | |
| Acetic acid | Fisher Scientific | 10304980 | |
| Acrylamide/Bis Solution, 37.5:1 | Serva | 10688 | |
| UltraPure Agarose | Invitrogen | 16500100 | |
| Ammonium persulfate (APS) | Serva | 13375 | |
| Bis-Tris | Gerbu | 1304 | |
| Boric acid | Gerbu | 1115 | |
| Bromophenol blue Na salt | Serva | 15375 | |
| Copper(II) sulfate | Aldrich | C1297 | |
| Chloroform | Fisher Scientific | 10020090 | |
| Coomassie Brilliant Blue | Serva | 17525 | |
| EDTA disodium salt | Gerbu | 1034 | |
| Ethanol | Merck | 100983 | |
| GelRed (10,000x in water) | Biotium | 41003 | |
| Glycerol (99.5%) | Gerbu | 2006 | |
| FastRuler Low Range DNA Ladder | Thermo Scientific | SM1103 | |
| Histone H3 | Expression plasmid obtained from Dr. Philipp Voigt and Prof. Danny Reinberg; expression and isolation according to T. J. Richmond et al., J. Mol. Biol. 1997, 272, 301-311. | ||
| M.BseCI | Expression plasmid obtained from Dr. Michael Kokkinidis; expression and isolation according to Kapetaniou et al., Acta Cryst. 2006, F63, 12-14. | ||
| Methanol | Fisher Scientific | 10675112 | |
| Magnesiumchloride hexahydrate | J.T. Baker | 4003 | |
| MOPS | Gerbu | 1081 | |
| Sodium chloride | Gerbu | 1112 | |
| pH strip (Neutralit) | Merck | 1,095,330,001 | |
| pBR322 | Thermo Scientific | SD0041 | |
| R.TaqI (10 u/µl) | Thermo Scientific | ER0671 | |
| SeAdoYn | Synthesized according to Willnow et al., ChemBioChem 2012, 13, 1167-1173. | ||
| Set7/9 | Expression plasmid obtained from Prof. Danny Reinberg, expression and isolation according to D. Reinberg et al., Genes Dev.2002, 16, 479-489. | ||
| Streptavidin | Gerbu | 3058 | |
| (+)-Sodium L-ascorbate | Sigma Life Science | A7631 | |
| SDS Granular | Gerbu | 1833 | |
| di-Sodium hydrogenphosphate | Merck | 106,586 | |
| TAMRA azide | Synthesized according to reference 30: Willnow et al., ChemBioChem 2012, 13, 1167-1173. | ||
| TaqI buffer (10x) | Thermo Scientific | B28 | |
| N,N,N',N'-Tetramethylethylenediamine (TEMED) | Acros Organics | 42058 | |
| Tris-HCl | Gerbu | 1028 | |
| Tris-X (TRIS-base) | Gerbu | 1018 | |
| Tris(3-hydroxypropyltriazolyl-methyl)amine (THPTA) | Sigma-Aldrich | 762342 |
References
- Gottfried, A., Weinhold, E. Sequence-specific covalent labelling of DNA. Biochem. Soc. Trans. 39, 623-628 (2011).
- Zohar, H., Muller, S. J. Labeling DNA for single-molecule experiments: methods of labeling internal specific sequences on double-stranded DNA. Nanoscale. 3, 3027-3039 (2011).
- Hinner, M. J., Johnsson, K. How to obtain labeled proteins and what to do with them. Curr. Opin. Biotechnol. 21, 766-776 (2010).
- Wua, Y. -. W., Goody, R. S. Probing protein function by chemical modification. J. Pept. Sci. 16, 514-523 (2010).
- Struck, A. -. W., Thompson, M. L., Wong, L. S., Micklefield, J. S-Adenosyl-methionine-dependent methyltransferases: Highly versatile enzymes in biocatalysis, biosynthesis and other biotechnological applications. ChemBioChem. 13, 2642-2655 (2012).
- Klimasauskas, S., Weinhold, E. A new tool for biotechnology: AdoMet-dependent methyltransferases. Trends Biotechnol. 25, 99-104 (2007).
- Pljevaljcic, G., Schmidt, F., Weinhold, E. Sequence-specific Methyltransferase-Induced Labeling of DNA (SMILing DNA). ChemBioChem. 5, 265-269 (2004).
- Lukinavicius, G., Lapiene, V., Stasevskij, Z., Dalhoff, C., Weinhold, E., Klimasauskas, S. Targeted labeling of DNA by methyltransferase-directed Transfer of Activated Groups (mTAG). J. Am. Chem. Soc. 129, 2758-2759 (1021).
- Pignot, M., Siethoff, C., Linscheid, M., Weinhold, E. Coupling of a nucleoside with DNA by a methyltransferase. Angew. Chem. Int. Ed. 37, 2888-2891 (1998).
- Weller, R. L., Rajski, S. R. Design, synthesis, and preliminary biological evaluation of a DNA methyltransferase-directed alkylating agent. ChemBioChem. 7, 243-245 (2006).
- Du, Y., Hendrick, C. E., Frye, K. S., Comstock, L. R. Fluorescent DNA Labeling by N-Mustard Analogues of S-adenosyl-l-methionine. ChemBioChem. 13, 2225-2233 (2012).
- Pljevaljcic, G., Schmidt, F., Scheidig, A. J., Lurz, R., Weinhold, E. Quantitative labeling of long plasmid DNA with nanometer precision. ChemBioChem. 8, 1516-1519 (1002).
- Wilkinson, S., et al. Molecular scale architecture: engineered three- and four-way junctions. Bioconjugate Chem. 19, 470-475 (2008).
- Braun, G., et al. Enzyme-directed positioning of nanoparticles on large DNA templates. Bioconjugate Chem. 19, 476-479 (2008).
- Kim, S., et al. Enzymatically incorporated genomic tags for optical mapping of DNA binding proteins. Chem. Int. Ed. 51, 3578-3581 (2012).
- Rina, M., Bouriotis, V. Cloning purification and characterization of the BseCI DNA methyltransferase from Bacillus stearothermophilus. Gene. 133, 91-94 (1993).
- Weinhold, E., Meier, T., Düfel, H., Markert-Hahn, C., Schmuck, R. Sequence-specific detection of methylation in biomolecules. US Patent. , (2012).
- Pljevaljcic, G., Pignot, M., Weinhold, E. Design of a new fluorescent cofactor for DNA methyltransferases and sequence-specific labeling of DNA. J. Am. Chem. Soc. 125, 3492-3410 (2003).
- Schmidt, F. H. -. G., Hüben, M., Gider, B., Renault, F., Teulade-Fichou, M. -. P., Weinhold, E. Sequence-specific Methyltransferase-Induced Labelling (SMILing) of plasmid DNA for studying cell transfection. Bioorg. Med. Chem. 16, 40-48 (2008).
- Dalhoff, C., Lukinavicius, G., Klimasauskas, S., Weinhold, E. Direct transfer of extended groups from synthetic cofactors by DNA methyltransferases. Nat. Chem. Biol. 2, 31-32 (2006).
- Lukinavicius, G., Tomkuviene, M., Masevicius, V., Klimasauskas, S. Enhanced chemical stability of AdoMet analogues for improved methyltransferase-directed labeling of DNA. ACS Chem. Biol. 8, 1134-1139 (2013).
- Motorin, Y., et al. Expanding the chemical scope of RNA:methyltransferases to site-specific alkynylation of RNA for click labeling. Nucleic Acids Res. 39, 1943-1952 (1943).
- Schulz, D., Holstein, J. M., Rentmeister, A. A chemo-enzymatic approach for site-specific modification of the RNA cap. Angew. Chem. Int. Ed. 52, 7874-7878 (2013).
- Peters, W., et al. Enzymatic site-specific functionalization of protein methyltransferase substrates with alkynes for click labeling. Angew. Chem. Int. Ed. 49, 5170-5173 (2010).
- Islam, K., Zheng, W., Yu, H., Deng, H., Luo, M. Expanding cofactor repertoire of protein lysine methyltransferase for substrate labeling. ACS Chem. Biol. 6, 679-684 (2011).
- Wang, R., Zheng, W., Yu, H., Deng, H., Luo, M. Labeling substrates of protein arginine methyltransferase with engineered enzymes and matched S-adenosyl-l-methionine analogues. J. Am. Chem. Soc. 133, 7648-7651 (2011).
- Islam, K., et al. Bioorthogonal profiling of protein methylation using azido derivative of S-adenosyl-l-methionine. J. Am. Chem. Soc. 134, 5909-5915 (2012).
- Islam, K., et al. Defining efficient enzyme-cofactor pairs for bioorthogonal profiling of protein methylation. Proc. Natl. Acad. Sci. U.S.A. 110, 16778-16783 (2013).
- Binda, O., Boyce, M., Rush, J. S., Palaniappan, K. K., Bertozzi, C. R., Gozani, O. A chemical method for labeling lysine methyltransferase substrates. ChemBioChem. 12, 330-334 (2011).
- Willnow, S., Martin, M., Lüscher, B., Weinhold, E. A selenium-based click AdoMet analogue for versatile substrate labeling with wild-type protein methyltransferases. ChemBioChem. 13, 1167-1173 (2012).
- Bothwell, I. R., et al. Se-Adenosyl-l-selenomethionine cofactor analogue as a reporter of protein methylation. J. Am. Chem. Soc. 134, 14905-14912 (2012).
- Tomkuviene, M., Clouet-d’Orval, B., Cerniauskas, I., Weinhold, E., Klimasauskas, S. Programmable sequence-specific click-labeling of RNA using archaeal box C/D RNP methyltransferases. Nucleic Acids Res. 40, 6765-6773 (2012).
- Nishioka, K., et al. Set9, a novel histone H3 methyltransferase that facilitates transcription by precluding histone tail modifications required for heterochromatin formation. Genes Dev. 16, 479-489 (2002).
- Clark, P. M., et al. Direct in-gel fluorescence detection and cellular imaging of O-GlcNAc-modified proteins. J. Am. Chem. Soc. 130, (2008).
- Lukinavicius, G., Lapinaite, A., Urbanaviciute, G., Gerasimaite, R., Klimasauskas, S. Engineering the DNA cytosine-5 methyltransferase reaction for sequence-specific labeling of DNA. Nucleic Acids Res. 40, 11594-11602 (2012).
- Neely, R. K., Dedecker, P., Hotta, J., Urbanaviciute, G., Klimasauskas, S., Hofkens, J. DNA fluorocode: A single molecule, optical map of DNA with nanometre resolution. Chem. Sci. 1, 453-460 (2010).
- Roberts, R. J., Vincze, T., Posfai, J., Macelis, D. REBASE-a database for DNA restriction and modification: enzymes, genes and genomes. Nucleic Acids Res. 38, 234-236 (2010).
- Petrossian, T. C., Clarke, S. G. Uncovering the human methyltransferasome. Mol. Cell. Proteomics. 10, 1-12 (2011).
- Kriukiene, E., et al. DNA unmethylome profiling by covalent capture of CpG sites. Nat. Commun. 4, 2190 (2013).
- Wang, R., et al. Profiling genome-wide chromatin methylation with engineered posttranslation apparatus within living cells. J. Am. Chem. Soc. 135, 1048-1056 (2013).
- Zhang, C., Weller, R. L., Thorson, J. S., Rajski, S. R. Natural product diversification using a non-natural cofactor analogue of S-adenosyl-l-methionine. J. Am. Chem. Soc. 128, 2760-2761 (2006).
- Stecher, H., et al. Biocatalytic Fiedel-Crafts alkylation using non-natural cofactors. Angew. Chem. Int. Ed. 48, 9546-9548 (2009).
- Lee, B. W. K., Sun, H. G., Zang, T., Kim, B. J., Alfaro, J. F., Zhou, Z. S. Enzyme-catalyzed transfer of a ketone group from an S-adenosylmethionine analogue: A tool for the functional analysis of methyltransferases. J. Am. Chem. Soc. 132, 3642-3643 (2010).
- Winter, J. M., et al. Expanding the structural diversity of polyketides by exploring the cofactor tolerance of an inline methyltransferase domain. Org. Lett. 15, 3774-3777 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved