Method Article
تحسين مرفق من الوسيطة الإنسان الخلايا الجذعية على بولي (ε-caprolactone) خيوط Electrospun
In This Article
Summary
This article describes a range of set-ups for seeding human mesenchymal stem cells onto materials, in this case electrospun yarns, that do not cover the base of standard culture well plates in order to maximize and quantify the number of cells that initially attach compared to the known seeding density.
Abstract
وغالبا ما تتضمن البحث في المواد الحيوية وهندسة الأنسجة في المختبر التحقيقات القائمة على الخلية، والتي تتطلب معرفة أولية لعدد خلية البداية. في حين الباحثين تشير عادة كثافة البذر من هذا لا يشير بالضرورة العدد الفعلي للخلايا التي انضمت إلى هذه المادة في السؤال. وهذا هو الحال بالنسبة للمواد، أو السقالات، التي لا تغطي قاعدة لوحات جيدا ثقافة الخلية القياسية بشكل خاص. هذه الدراسة المرفق الأولي من الخلايا الجذعية الوسيطة الإنسان المصنفة في عدد معروفة على بولي electrospun (ε-caprolactone) الغزل بعد 4 ساعات في الثقافة. عقدت خيوط Electrospun في غضون عدة مختلفة مجموعة عمليات، بما في ذلك سفن الدورية مفاعل حيوي في 9 دورة في الدقيقة، وتدرج ثقافة الخلية المتمركزة في انخفاض لوحات جيدا ملزمة وتترافلوروإيثيلين (PTFE) أحواض توضع داخل أطباق بتري. تعرض الأخيرين إما ثابتة أو شروط وضع على لوحة شاكر (30 37 درجة مئوية، CO 2 5٪، تم تحديد موقع الخلايا المزروعة عن طريق فحص DNA الخلية. تم إزالة السقالات من الحاويات ووضعها في تحلل العازلة. تمت إزالة جزء الإعلام بالمثل وطرد - طاف تجاهل وبيليه فضت مع تحلل العازلة. وأضاف العازلة تحلل إلى كل وعاء، أو جيدا، وكشط لتحرير أي الخلايا التي قد تكون موجودة. فحص DNA الخلية تحديد النسبة المئوية للخلايا موجودة داخل سقالة والإعلام والكسور جيدا. كان مرفق الخلية منخفضة لكل مجموعة المنبثقة التجريبية، مع أكبر مرفق (30٪) للخيوط التي عقدت في إطار إدراج خلية ثقافة وتعرض للاهتزاز الحركة. هذه الدراسة تثير الوعي إلى العدد الفعلي للخلايا المرتبطة السقالات بغض النظر عن المعلنة كثافة البذر الخلية.
Introduction
وبشكل روتيني يجري تطوير السقالات وبحثت عن مادة بيولوجية والنسيج الهندسة التطبيقات. على هذا النحو، والمصنفة أنها عادة مع الخلايا وسلوكهم في المختبر تتميز عن طريق المقايسات التي تحدد تكاثر الخلايا وعدد الخلايا، على سبيل المثال. للتجارب مثل هذه، لا بد من أن عدد الخلايا الأولي هو معروف والباحثين في كثير من الأحيان يذكر تركيز البذر من حيث عدد الخلايا لكل مل أو سم 2. في حين أن هذا هو ممارسة جيدة، وخاصة لأغراض زيادة، فإنه لا تمثل العدد الفعلي للخلايا التي تلتزم سطح سقالة (والذي هو أيضا تعتمد على خصائص لاصقة من سطح مادة بيولوجية 1). وهذا ينطبق بشكل خاص على السقالات التي لا تغطي قاعدة كاملة من الخلية لوحة الثقافة كذلك خلايا يمكن أن تقع بعيدا عن بناء و، نظرا لطبيعة كثير من الأحيان ثابتة من التجربة، قد لا تأتي مرة أخرى في اتصال مع المواد من الأسواق العالمية ضغطهابقية. خيوط الألياف Electrospun هي مثال جيد على سقالة التي لا تغطي قاعدة البئر (الشكل 1A). في هذه الحالة، وانخفاض لوحات جيدا الملزمة التي لم تكن المعالجة السطحية ينبغي أن تستخدم لمنع الخلايا من الالتصاق سطح اللوحة، وبالتالي تشويه نتائج أي فحص مقرها جيدا.
وتستخدم لوحات جيدة بسهولة لبذر الخلايا على السقالات، ولكنها ليست الطريقة الوحيدة المتاحة. أنظمة زراعة الخلايا دوارة، وهو نوع من مفاعل حيوي وضعتها شعبة علوم الحياة في وكالة ناسا في أواخر عام 1980، يمكن بالمثل أن تستخدم البذور السقالات ضمن ثلاثية الأبعاد (3D) مع بيئة الجاذبية الصغرى المحاكاة. هذا النوع من مفاعل حيوي لا يزال خيارا شعبيا مع الباحثين في جميع أنحاء العالم، وقد أدرجت في الدراسات لخلية اشارة 2،3، 4،5 الخلايا وهندسة الأنسجة 6،7 الجذعية. ما الذي يجعل مفاعل حيوي دوار الأفضل لوحات جيدا هو صيانةبيئة 3D، مما يساعد على منع خلايا متباينة من dedifferentiating، كما هو الحال في كثير من الأحيان عندما مثقف ضمن شروط 2D التقليدية 8.
تبحث هذه الورقة تقنيات مختلفة لبذر الخلايا الجذعية الوسيطة الإنسان على بولي electrospun (ε-caprolactone) خيوط الألياف وملفقة في بوسورث وآخرون، 9 من أجل تحقيق أقصى قدر من العدد الأولي للخلايا ربط لهذه السقالات في غضون فترة 4 ساعات. للثقافة 2D، عقدت خيوط آمن داخل لوحات جيدا أو حسب الطلب بولي (tetrafluoroethylene) (PTFE) أحواض وأبقى تحت ظروف ثابتة، أو اهتزت في 30 دورة في الدقيقة. للثقافة 3D، عقدت خيوط وخلايا داخل الأوعية مفاعل حيوي بالتناوب في 9 دورة في الدقيقة.
Protocol
تصنيع 1.Scaffold والتعقيم
- حل PCL في 1،1،1،3،3،3-hexafluoroisopropanol لإعطاء 10٪ ث / تركيز الخامس. كما هو موضح في بوسورث وآخرون، 9 electrospin الحل البوليمر (المعلمات: 20 كيلو فولت، 1 مل / ساعة، 20 سم). وجمع ألياف الانحياز على حافة مغزل الدورية (600 دورة في الدقيقة). مع مشرط إزالة الشريط من الألياف التي تم جمعها ومن ثم تقطع إلى أطوال أقصر - 3 سم (لأحواض السفن والدوارة) و 4 سم (لزراعة الخلايا إدراج) أطوال.
- باستخدام ملقط غرامة تغرق شرائح الفردية في الماء المقطر وإزالة.
- عقد طرفي بين الإبهام والسبابة. يدويا تطور القطاع حتى أنه يشبه الموضوع.
- لفترة وجيزة غمر هذه السقالة مثل موضوع في الماء المقطر ووضع على بطاقة نظيفة وغير ليفية لتجف.
- الجاف مرة واحدة، ومكان بشكل فردي في أنابيب microcentrifuge نظيفة وإضافة 1 مل من 50٪ ت / ت الإيثانول في الماء المقطر. إغلاق الأغطية ويترك لمدة 24 ساعة.
ملاحظة: نفذ الخطوات التالية في إطار تدفق الصفحي: - وضع أنابيب microcentrifuge في مجلس الوزراء تدفق الصفحي ونضح 50٪ الحل ت / ت. استبدال مع 1 مل 70٪ ت / ت الإيثانول في الماء المقطر، والأغطية وثيقة ويترك لمدة 24 ساعة.
- كرر لمدة 90٪ و 100٪ ت / ت الإيثانول في الماء المقطر (1 مل مجلدات).
- غسل السقالات مرتين مع الفوسفات مخزنة المالحة الحل (PBS)، و 24 ساعة في غسل (2 × 1 مل).
- إزالة برنامج تلفزيوني واستبدالها مع 1 مل سائل الإعلام ثقافة الخلية. ملاحظة: السقالات جاهزة للاستخدام ساعة آخر 24 ساعة.
2. تحديد منطقة سقالة السطحية وعدد الخلايا
- باستخدام المجهر والتصوير البرامج الخفيفة، وقياس قطرها من الغزول electrospun على طوله لتحديد القيمة المتوسطة.
- تولي الغزل ليكون قضيب أسطواني وتقريب المساحة السطحية باستخدام:
- حيث A = المساحة، ص = نصف القطر وح = طول
ملاحظة: تم حساب المساحة السطحية لتكون 18902، 800 ميكرون 2. وعلاوة على ذلك، تجدر الإشارة إلى أن مساحة الفعلية ستكون أكبر من هذا الحساب كما يتكون الغزل مئات من الألياف الدقيقة، والتي سوف تزيد من مساحة السطح. ونتيجة لذلك عدد أكبر من الخلايا وينبغي أن تكون قادرة على نعلق على منصة الاعدام. ومع ذلك، هذا لا يؤثر على المقارنة المباشرة بين مجموعات اختبار تبذل. - تحديد الحد الأقصى لعدد الخلايا التي يمكن أن نعلق على سطح سقالة كشفها بواسطة:
ملاحظة: باستخدام المجهر والتصوير البرامج الخفيفة، تم تحديد قطرها الخلايا الجذعية الوسيطة الإنسان أن يكون 20 ميكرون (خلايا افتراض هي وإيابا)، وبالتالي في هذه الحالة، عدد الخلايا = 60200.
3. سقالة مجموعة المتابعة - خلية الثقافة إدراجات (الشكل 1A)
- تحت تدفق الصفحي، فتح معقمة 6 جيدا إدراج خلية ثقافة وفصل حلقات أقصر مع الأسنان من الهيئات أوسع الحلقية.
- خذ حلقة مع الأسنان مشيرا صعودا. ثنى واحدمن السقالات 4 سم على وسط الحلبة والتأكد من أنها تتداخل في كلا الجانبين. خذ الجسم الحلقية وموقف خلال حلقة أسنان والسقالة، ودفع إلى أسفل والتأكد من يبقى سقالة في موقف وتكمن من خلال مركز إدراج الثقافة الخلية.
- ضع إدراج الثقافة زنزانة مع سقالة في بئر من 6 جيدا، وانخفاض لوحة ملزمة.
- إضافة 10 مل من وسائل الإعلام ثقافة لالسقالة.
4. سقالة مجموعة المتابعة - منخفض (الشكل 1B)
- تحت تدفق الصفحي، ومكان بولي (tetrafluoroethylene) (PTFE) أحواض في أطباق بتري الفردية وإضافة 10 مل من وسائل الإعلام ثقافة إلى القاع.
- باستخدام ملقط ثنى واحدة من سم 3 السقالات في الحوض الصغير، والتأكد من طوله تقع موازية لحافة أطول الحوض الصغير و.
5. سقالة مجموعة المتابعة - تفاعلات الاحيائية سفينة (الشكل 1C)
- تحت تدفق الصفحي، الاستغناء 10 مل PBS العقيمة من خلال مفاعل حيوي السفينةالميناء الرئيسي ويترك لمدة 10 دقيقة.
- إزالة برنامج تلفزيوني واستبدالها مع 8 مل سائل الإعلام والثقافة.
- باستخدام ملقط، إدراج أحد السقالات 3 سم في الإناء عبر الميناء الرئيسي.
- إغلاق الميناء الرئيسي.
6. خلية العد
- خلايا الثقافة الإنسانية الجذعية الوسيطة (hMSC) المشتقة من نخاع العظام وفقا لبروتوكول الشركة المصنعة حتى مرور 4 قبل الحصاد.
- نضح في وسائل الإعلام من 75 سم 2 قارورة تحتوي على hMSCs المشتقة من نخاع العظام (مرور 4، 80٪ confluency).
- غسل الخلايا مع 10 مل العقيمة برنامج تلفزيوني ونضح.
- إضافة 3 مل التربسين واحتضان القارورة عند 37 درجة مئوية، و 5٪ CO 2 حتى فكها الخلايا من سطح القارورة.
- إضافة 7 مل سائل الإعلام والثقافة لإبطال نشاط انزيم ونقل هذا الحجم الكلي (10 مل) إلى أنبوب الطرد المركزي.
- و resuspend هذا التعليق الخلية بواسطة pipetting صعودا وهبوطا عدة مرات لتفريق متجانس الخلايا داخلوسائل الإعلام والكتل خلية الحد (10 مل ماصة).
- إزالة 20 ميكرولتر من تعليق خلية ونقل إلى haemocytometer.
- ضع haemocytometer تحت مجهر الضوء والصورة في الهدف X10.
- التركيز على خطوط الشبكة وحساب عدد الخلايا في 4 × 4 مربعات في كل ركن من أركان الشبكة والتي تقع داخل المربع وتلك التي تعبر عن يمين أو خط الحدود القاع. عد لكل مجموعة من 4 × 4 مربعات (4 التهم في الشبكة).
- تكرار العد وإعادة تعليق الخلية ثلاث مرات (الخطوات 6،6-6،9).
- حساب عدد خلايا متوسط وتحديد حجم وسائل الإعلام اللازمة لإعادة تعليق الخلية (تركيز خلية 60200 في 200 ميكرولتر). على سبيل المثال، تحديد متوسط عدد خلايا من haemocytometer ومن ثم تحديد متوسط العدد الإجمالي للخلايا من التهم الثلاث. اضرب هذا من 1 × 10 4 إلى إعطاء عدد من الخلايا لكل مل ثم ضرب من قبل الحجم الكلي للتعليق الخلية لإعطاء لالتل عدد من الخلايا. استخدام المعادلة التالية لتحديد حجم وسائل الإعلام اللازمة لإعادة تعليق:
- الطرد المركزي تعليق خلية في 241 x ج لمدة 5 دقائق.
البذر 7. خلية
- نضح وسائل الإعلام من أنبوب طرد ترك بيليه الخلية واستبدالها مع حجم وسائل الإعلام المحسوبة.
- resuspend الخلايا وسائل الإعلام لحتى المزيج.
- باستخدام ماصة P200 جيلسون، الاستغناء ببطء 200 ميكرولتر من تعليق الخلية على كل سقالة عن طريق تشغيل غيض من ماصة على طول سقالة وتحت سطح السائل وسائل الإعلام. ترك دون عائق لمدة 20 دقيقة.
- للسفن مفاعل حيوي، الاستغناء 200 ميكرولتر من تعليق الخلية من خلال الميناء الرئيسي. أعلى متابعة وسائل الإعلام والثقافة 2 مل المتبقية عن طريق الموانئ حقنة لإعطاء إجمالي حجم 10 مل.
8. تبدأ التجريبية
- نقل السفن مفاعل حيوي لمفاعل حيوي المراكز المناخية الإقليمية-4DQ وتعيين لتدوير في 9 دورة في الدقيقة.
- ترانSFER لوحات بشكل جيد مع إدراج خلية ثقافة وأحواض لوحة شاكر وتعيين لتدوير في 30 دورة في الدقيقة.
- نقل لوحات بشكل جيد مع إدراج خلية ثقافة وهبوطا إلى الرف من حاضنة خلية وضعت في 37 ° C، 5٪ CO 2 (ثقافة ثابتة).
9. DNA الفحص
- إعداد حلول - تحلل العازلة، 1X TE العازلة، معايير DNA وحل العاملة DNA الخلية - وفقا لتعليمات الشركة المصنعة.
- بعد 4 ساعات، وإزالة عينات من الحاضنة ومكان تحت تدفق الصفحي.
- إزالة الكسور وسائل الاعلام من جميع العينات ووضع في أنابيب الطرد المركزي وصفت بشكل منفصل. الطرد المركزي أنابيب 241 x ج. إزالة طاف وإضافة 3 مل العازلة تحلل. Resuspend وحل لتفكك بيليه الخلية.
- باستخدام ملقط إزالة السقالات ومكان في أنابيب الطرد المركزي التي تحتوي على 3 مل العازلة تحلل (لالسقالات داخل الأوعية مفاعل حيوي، وإزالة سقالة قبل الشفط ليديا). للالسقالات التي عقدت في إطار إدراج ثقافة الخلية، أولا تحرير سقالة عن طريق قطع سقالة قريبة من حافة إدراج باستخدام مشرط.
- إضافة 3 مل من تحلل العازلة على كل وعاء سقالة وكشط سطح (تستنهض الهمم بقوة للسفن مفاعل حيوي). إزالة العازلة تحلل وضعها في أنابيب الطرد المركزي وصفت بشكل منفصل.
- دوامة كل أنبوب الطرد المركزي لحوالي 1 دقيقة لضمان التحريض كاف من الخلايا والعازلة وتشجيع تحلل من غشاء الخلية.
- في السوداء 96 لوحة جيدا، إضافة 100 ميكرولتر من تحلل العازلة لكل عينة جزء - السقالة، وسائل الإعلام وكذلك (مكررة).
- في الظلام، وإضافة 100 ميكرولتر من محلول الحمض النووي الخلوي لجميع الآبار التي تحتوي على العازلة تحلل وتخلط بلطف.
- وتشمل الآبار مع العازلة تحلل لا تحتوي على محلول الحمض النووي والحمض النووي خلية لتوفير المراقبة السلبية والإيجابية لوحة جيدا.
- باستخدام لوحة مضان القارئ، وقياس الامتصاصية من البئرS باستخدام 485 نانومتر الإثارة و 520 نانومتر الانبعاثات.
- مقارنة البيانات مع منحنى معيار المتولدة من المعايير DNA وفقا لتعليمات الشركة المصنعة.
10. الضوئي المجهر الإلكتروني (SEM) التثبيت
- نفذ الخطوات التالية في إطار تدفق الصفحي: بعد 4 ساعات، وإزالة جميع السقالات من أوعية ومكان داخل جديدة لوحة 6 جيدا (الآبار منفصلة).
- غسل السقالات مرتين مع برنامج تلفزيوني.
- نفذ الخطوات التالية على مقاعد البدلاء مفتوحة: إلى كل بئر، إضافة 2 مل من 1.5٪ ت / ت غلوتارالدهيد في برنامج تلفزيوني لضمان تغطية كاملة للسقالة.
- ترك لوحة لمدة 30 دقيقة في الحد الأدنى 4 ° C لتثبيت الخلية.
- إزالة الحل تثبيتي، وغسل السقالات مرتين مع برنامج تلفزيوني.
- يذوى السقالات مع زيادة تركيزات الإيثانول في الماء المقطر بدءا من 50٪ ت / ت، تليها 70٪ ت / ت و 90٪ ت / ت. لكل تركيز، submerse تماما السقالات في محلولن (2 مل) ويترك لمدة 3 دقائق. تجاهل الحل وتكرار.
- يذوى في الإيثانول بنسبة 100٪ عن طريق الغمر في السائل تماما السقالات في حل (2 مل)، وترك لمدة 5 دقائق. تجاهل الحل وتكرار.
- كيميائيا تجف السقالات باستخدام hexamethyldisilazane (HMDS) داخل خزانة الدخان. تزج السقالات في HMDS (2 مل) ويترك لمدة 5 دقائق. إزالة HMDS وتكرار.
- إزالة HMDS والسماح للالسقالات لتجف. تركيب السقالات في المتاحة تجاريا بذرة SEM (في هذه الحالة بذرة الفولاذ المقاوم للصدأ مع علامات التبويب الكربون لاصقة).
- لتخفيف عرض ضمن SEM، ومعطف العينات باستخدام المغطي الذهب تفل لمدة 2 دقيقة لضمان تغطية رقيقة وحتى.
- مكان عينات داخل SEM وتصور السقالات خلايا المصنف باستخدام شعاع الالكترون 5 كيلو.
النتائج
النتائج تسلط الضوء على موقع الخلايا التالية 4 ساعات بعد البذر لكل التجريبية مجموعة المتابعة التحقيق فيها. ويوضح الشكل 2A النسبة المئوية للخلايا التي تعلق على السطح سقالة خلال هذا الوقت. تم استخدام عامل تحويل 8.5 جزء من الغرام / خلية لتحويل محتوى DNA قياس في عدد الخلايا وبالتالي تحديد النسبة المئوية للخلايا 10. لجميع البذر مجموعة عمليات التحقيق، والنسبة المئوية للمرفق الخلية منخفضة نسبيا، مع التزام أكبر خلية (30٪) للالسقالات التي عقدت في إطار إدراج خلية ثقافة واهتزت في 30 دورة في الدقيقة (إدراج شاكر). كان أدنى الالتزام (15٪) للالسقالات التي عقدت في إطار إدراج خلية ثقافة وأبقى تحت ظروف ثابتة (إدراج ثابت).
وكان عدد كبير من الخلايا موجودة في وسائل الاعلام جزء (الشكل 2B)، وعلى الأخص لإدراج ثقافة الخلية التي عقدت في إطار لوحات منخفضة ملزمة (إدراج ثابت) والسفن الدوارة يجري 50٪ و 51٪على التوالي. تظاهر السقالات التي عقدت في إطار أحواض عدد رفعت من خلايا موجودة داخل حامل نفسه - 48٪ من الخلايا للمنخفض شاكر و 50٪ للمنخفض ثابت.
المجهر الإلكتروني يسمح بتقييم البصري من السقالات خلية المصنفة (الشكل 3). أبرزت صور تمثيلية وجود محدود للخلايا على سطح ليفي، بغض النظر عن البذر انشاء. ومع ذلك، فإن عددا أكبر من الخلايا والكتل خلية موجودة على السقالات التي عقدت في إطار إدراج خلية ثقافة واهتزت في 30 دورة في الدقيقة (إدراج شاكر).
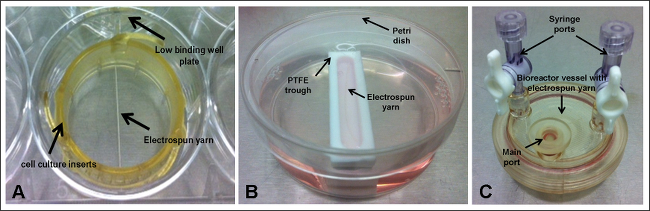
الشكل 1. التجريبية مجموعة عمليات، حيث يقام Electrospun غزل الداخل؛ (A) إدراج خلية ثقافة وانخفاض لوحة جيدا ملزمة؛ (ب) بولي (tetrafluoroethylene) (PTFE) الحوض الصغير وطبق بتري. و(C) سفينة مفاعل حيوي. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
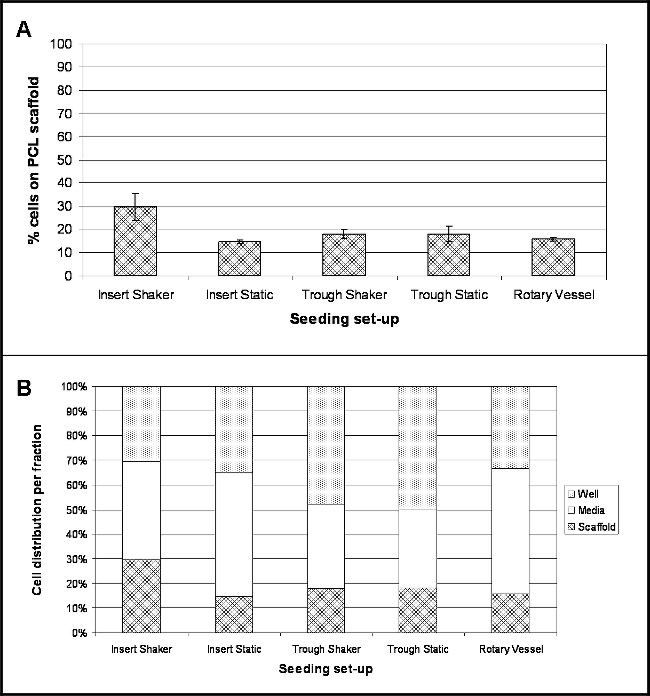
الشكل 2. الموقع من الخلايا 4 ساعات ما بعد البذر على PCL Electrospun خيوط مختلفة باستخدام البذر تعيين المنبثقة. (A) يدل على النسبة المئوية للخلايا التي تعلق على سقالة PCL (يعني ± الانحراف المعياري)؛ (B) يسلط الضوء على انتشار نسبة موقع خلية داخل الكسور ثلاثة - وسائل الإعلام، وأيضا وسقالة (ن = 4، والبيانات المقدمة كما يعني القيم). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
الشكل 3. الممثل الضوئي الكترون الميكروسكوب لPCL خيوط Electrospun مع الوسيطة الإنسان الخلايا الجذعية، 4 ساعة بعد البذر الأولي تستخدم مختلفة التجريبية مجموعة المنبثقة. (جميع الصور في 1،000X التكبير، شريط النطاق = 130 ميكرومتر.) الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
وتستخدم المصفوفات الألياف Electrospun ملفقة من البوليمرات الحيوية بصورة منتظمة لدعم مرفق الخلية والانتشار لتطبيقات بيولوجية و / أو هندسة الأنسجة 11،12. في هذه الحالات، والمصفوفات وغالبا ما تكون صفائح رقيقة من الألياف التي تغطي بسهولة قاعدة كاملة من لوحة جيدا ثقافة الخلية، وبالتالي هم على اتصال كامل مع خلايا المصنف مما يحسن مرفق الخلية. ومع ذلك، إذا سقالة بيولوجية لا تغطي كامل قاعدة لوحة جيدا، هناك فرصة كبيرة أن نسبة كبيرة من الخلايا المصنفة لن تبقى على اتصال مع سقالة، وفي نهاية المطاف لن تكون قادرة على تولي. التحقيق في هذه الدراسة عدة أساليب مختلفة لبذر الخلايا على السقالات التي لا تغطي قاعدة من لوحة جيدا، من أجل تحديد أسلوب الأمثل التي يمكن أن يوصى بها لتجارب خلية القاعدة في المستقبل.
وقد تم التحقيق خمسة مختلفة مجموعة عمليات (الشكل 1): scaffoعقدت LDS (electrospun الغزل) باستخدام إدراج ثقافة خلية داخل منخفضة وحات جيدا ملزمة وإما تبقى في ظل ظروف ثابتة أو اهتزت في 30 دورة في الدقيقة. السقالات وضعت داخل أحواض PTFE الضيقة وعقد ثابت أو اهتزت في 30 دورة في الدقيقة. والسقالات يضم داخل مفاعل حيوي سفن الدورية في 9 دورة في الدقيقة. تحديد عدد الخلايا التي قد انضمت إلى خيوط electrospun بواسطة فحص الحمض النووي أظهرت نسبة منخفضة من المرفقات للجميع البذر مجموعة عمليات (الشكل 2)؛ وهذا ما أكد كذلك من مسح الميكروسكوب الإلكتروني (SEM) (الشكل 3). أكبر مرفق الخلية - 30٪ أو ~ 18،060 خلايا -was احظ لخيوط التي جرت ضمن إدراج خلية ثقافة وتعرض لحركة مستمرة. ومن المثير للاهتمام، وقد تحقق أدنى مرفق الخلية (15٪) للخيوط التي عقدها إدراج ثقافة خلية لكنها أبقت في ظل ظروف ثابتة، وهو ما يشير إلى أن إدراج الحركة شعاعي له تأثير إيجابي على حفظ الخلايا في اتصال مع السقالة. ومع ذلك،تجدر الإشارة إلى أن الدوران المستمر لتدفق وسائل الإعلام قد تكون مسؤولة عن تكتلات من خلية لاحظ من الصور SEM. تم تعيين لوحة شاكر على وضع أدنى مستوياته - 30 دورة في الدقيقة - التي يمكن أن تكون على سبيل الحصر، هذه مجموعة المتابعة. باستخدام حركة شعاعي أبطأ قد يساعد على منع أو الحد من التكتل الخلية ويمكن أيضا تحسين مرفق الخلية كخلايا سوف تشهد أقل قوة. ينبغي أن تركز التجارب المستقبلية على تحسين سرعة شاكر مثالية لتحسين مرفق الخلية. دمج الحركة للخيوط التي عقدت في إطار أحواض لم تسفر عن وجود اتجاه مماثل، مع كل السيناريوهات تدر 18٪ مرفق (~ 10836 خلايا)؛ رغم أن هذا قد يكون راجعا إلى التعويم الجزئي للالسقالات داخل أحواض (لاحظ لأحواض توضع على لوحة شاكر) لأنها لم تستند إلى قاعدة. العائمة جزئي للسقالة سيمنع أي الخلايا التي غرقت في قاع الحوض من ملامسة المواد والتمسك. لرله معين مجموعة المتابعة، ويضم الحوض الصغير في طبق بتري وإجمالي حجم 10 مل من وسائل الإعلام وأضاف. أبعاد صغيرة من الحوض الصغير يعني أن غالبية وسائل الإعلام موجودة داخل طبق بتري وإذا كان هناك أي تحرك، قد خلايا الانجراف بعيدا عن الحوض الصغير في طبق بتري وتبقى تماما بعيدا عن متناول السقالة. للتغلب على هذه القيود، ينبغي أن تشمل المزيد من التجارب خطوة إضافية في البروتوكول، حيث يتم يعلق ينتهي من السقالات لقاعدة أحواض باستخدام معقم غرامة الإبر، وهذا يجب منع الطرح وحركة (ولا سيما بالنسبة للالسقالات تتعرض ل الحركة شعاعي)، والتي ينبغي أن تؤدي في النهاية إلى زيادة عدد خلايا المترتبة على سقالة. وكان 16٪ من خلايا تعلق على خيوط الحالية داخل الأوعية الدوارة. على الرغم من كونه تقنية راسخة للثقافة 3D، لم تنشأ مشاكل مع إزالة السقالات من الميناء الرئيسي للسفن، والتي قد أسفرت عن اتاك فضفاضةخلايا هيد الضياع. السفن التي يمكن فتحها بالكامل من شأنه القضاء على هذه المشكلة؛ هذه هي متاحة للشراء، ولكن هي إلى حد كبير أكثر تكلفة من السفن المتاح المستخدمة في هذه الدراسة.
وتوضح هذه الدراسة القضايا الراهنة مع بذر السقالات التي لا تغطي قاعدة كاملة من لوحات جيدا ثقافة الخلية القياسية. بذر عدد الخلايا المعروفة أدى في أقل من إرفاق الثالث إلى سقالة، على الرغم من مساحة سطح السقالة والسماح لجميع الخلايا على الالتزام. وهذا يمكن أن يكون لها عواقب ضارة في غيرها من المقايسات خلية القاعدة التي قد تقييم السلوك توافق مع الحياة والخلية مادة / خلية خلية والتفاعل مع السقالة كجهاز طبي المحتملة في المستقبل. ويمكن أن تشمل القيود مزيد من الدراسة 4 ساعة الوقت نقطة - على الرغم من كونها طويلة بما فيه الكفاية لضمان البذر الخلية الأولي (وقد ثبت الخلايا لنعلق بحزم إلى ركائز في غضون ثلاثين دقيقة 13،14،15)، فإنه قد يكون من المعقول فيvestigate في وقت لاحق نقاط الوقت توفر الخلايا لا تتكاثر خلال إطار زمني أطول لأن ذلك من شأنه أن تحرف وإلا فإن عدد الخلايا تبدأ. تخفيض حجم وسائل الإعلام، في هذه الحالة 10 مل، ويمكن أيضا تحسين الاتصال بين الخلايا وسقالة، وفي نهاية المطاف زيادة مرفق الخلية. يجب أن تنظر أيضا في الدراسات المستقبلية بقاء الخلية بأنها عملية البذر الخلية يمكن أن تسبب تلف الخلايا و / أو موت الخلية 16. فحوصات DNA الخلية لا تفرق بين خلايا قابلة للحياة وغير قابلة للحياة، ومثل هذا / الفحص ميت يعيش، على سبيل المثال، فإن تسليط الضوء على مستوى قدرتها على البقاء.
هذا التحقيق يثير الوعي إلى العدد الفعلي للخلايا أن نعلق على منصة الاعدام على الرغم من البذر كمية معروفة. للدراسات التي تعتمد على عدد انطلاق من الخلايا، فمن المهم جدا أن الباحثين يعرفون بالضبط كم من هذا الرقم تفعل في الواقع والتمسك الركيزة المصالح.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
فإن الكتاب أود أن أشكر والاعتراف مجلس البحوث الطبية لتمويل هذا البحث - MRC-DPFS كود منحة G1000788-98812.
Materials
| Name | Company | Catalog Number | Comments |
| Distilled water | in-house supply | n/a | |
| Ethanol | Merck | 1117271000 | |
| Phosphate Buffered Saline solution | Life Technologies | 70013016 | |
| Human mesenchymal stem cells | PromoCell GmbH | C-12974 | |
| MSC culture media | PromoCell GmbH | C-28010B | Warmed to 37 oC before use |
| Supplement mix | PromoCell GmbH | C-39810 | Add to culture media |
| Antibiotic/antimyotic mix | Sigma-Aldrich | A5955 | Add to culture media |
| Trypsin (0.05%) EDTA (0.02%) | Sigma-Aldrich | 59417C | Warmed to 37 °C before use |
| Cell culture flasks (T75) | Becton Dickinson Ltd | 353110 | |
| Low binding 6-well plates | Costar Corning | 3471 | |
| 6-well CellCrowns | Scaffdex | C00003S | |
| Petri-dish 50 ml deep | Sterilin | 124 | |
| PTFE troughs | in-house production | n/a | |
| Disposable RCCS vessels 10 ml | Synthecon | D-410 | |
| 4 Vessel Rotary Cell Culture System bioreactor | Synthecon | RCCS-4DQ | |
| Shaker plate | Stuart | SSM1 | Mini Orbital Shaker |
| Haemocytometer | Digital Bio | DHC-F01 | Disposable C-Chip |
| Centrifuge tube | Deltalab | 352096, 429901 | 15 ml and 50 ml |
| Centrifuge | Hettich | Rotafix 32 A | |
| Syringe 3 ml | Shield Medicare Ltd | 3039820 | |
| Pipettes | Sterilin | 40305, 47310, 40125 | 5, 10 and 25 ml |
| Gilson pipettes | SLS | F144801, F144802, F123600, F123601, F123602 | P2 - P1000 |
| Pipette tips | SLS | PIP7852, PIP7834, PIP7840 | |
| Micro test tube 1.5 ml | Eppendorf | 30125.15 | |
| Triton X-100 | Sigma | 9002-93-1 | |
| PicoGreen Assay | Invitrogen | P7589 | Assay set-up in the dark |
| Black 96-well plate | Greiner Bio One | 655086 | |
| Fluorescent plate-reader | BGM Labtech | FLUOstar Optima | |
| Glutaraldehyde 25% | TAAB Laboratories | G002 | Made to a concentration of 1.5% v/v in PBS |
| Hexamethyldisilazane (HMDS) | Sigma | 999-97-3 | |
| Aluminium stubs (SEM) | Agar Scientific | G301 | |
| Carbon tabs (SEM) | Agar Scientific | G3347N | |
| Gold sputter coater | Edwards | S150B | |
| Scanning Electron Microscope (SEM) | Phenom World | Phenom Pro |
References
- Jauregui, H. O. Cell adhesion to biomaterials. The role of several extracellular matrix components in the attachment of non-transformed fibroblasts and parenchymal cells. ASAIO transactions/American Society for Artificial Internal Organs. 33 (2), 66-74 (1986).
- Puca, A., Russo, G., Giordano, A. Properties of Mechano-Transduction via Simulated Microgravity and its Effects on Intracellular Trafficking of VEGFR's. Oncotarget. 3 (4), 426 (2012).
- Vincent, L., Avancena, P., Cheng, J., Rafii, S., Rabbany, S. Y. Simulated microgravity impairs leukemic cell survival through altering VEGFR-2/VEGF-A signaling pathway. Annals of biomedical engineering. 33 (10), 1405-1410 (2005).
- Rungarunlert, S., Klincumhom, N., Tharasanit, T., Techakumphu, M., Pirity, M. K., Dinnyes, A. Slow Turning Lateral Vessel Bioreactor Improves Embryoid Body Formation and Cardiogenic Differentiation of Mouse Embryonic Stem Cells. Cellular Reprogramming. 15 (5), 443-458 (2013).
- Wu, X., Li, S. H., Lou, L. M., Chen, Z. R. The Effect of the Microgravity Rotating Culture System on the Chondrogenic Differentiation of Bone Marrow Mesenchymal Stem Cells. Molecular biotechnology. 54 (2), 331-336 (2013).
- Wang, Y., et al. Rotating Microgravity-Bioreactor Cultivation Enhances the Hepatic Differentiation of Mouse Embryonic Stem Cells on Biodegradable Polymer Scaffolds. Tissue Engineering Part A. 18 (21-22), 2376-2385 (2012).
- Lv, Q., Deng, M., Ulery, B. D., Nair, L. S., Laurencin, C. T. Nano-ceramic Composite Scaffolds for Bioreactor-based Bone Engineering. Clinical Orthopaedics and Related Research. 471 (8), 2422-2433 (2013).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. American Journal of Physiology-Renal Physiology. 281 (1), F12-F25 (2001).
- Bosworth, L. A., Alam, N., Wong, J. K., Downes, S. Investigation of 2D and 3D electrospun scaffolds intended for tendon repair. Journal of Materials Science: Materials in Medicine. 24 (6), 1605-1614 (2011).
- Dormer, N. H., Qiu, Y., Lydick, A. M., Allen, N. D., Mohan, N., Berkland, C. J., Detamore, M. S. Osteogenic differentiation of human bone marrow stromal cells in hydroxyapatite-loaded microsphere-based scaffolds.. Tissue Engineering Part A. 18 (7-8), 757-767 (2011).
- Rayatpisheh, S., Heath, D. E., Shakouri, A., Rujitanaroj, P. O., Chew, S. Y., Chan-Park, M. B. Combining cell sheet technology and electrospun scaffolding for engineered tubular, aligned, and contractile blood vessels. Biomaterials. 35 (9), 2713-2719 (2014).
- Wismer, N., Grad, S., Fortunato, G., Ferguson, S. J., Alini, M., Eglin, D. Biodegradable electrospun scaffolds for annulus fibrosus tissue engineering: effect of scaffold structure and composition on annulus fibrosus cells in vitro. Tissue Engineering Part A. (3-4), 672-682 (2014).
- Yavin, E., Yavin, Z. Attachment and culture of dissociated cells from rat embryo cerebral hemispheres on polylysine-coated surface. The Journal of cell biology. 62 (2), 540-546 (1974).
- Chen, H. Guan, of focal adhesion kinase with its potential substrate phosphatidylinositol 3-kinase. Proceedings of the National Academy of Sciences. 91 (21), 10148-10152 (1994).
- Grant, D. S., Tashiro, K. -. I., Segui-Real, B., Yamada, Y., Martin, G. R., Kleinman, H. K. Two different laminin domains mediate the differentiation of human endothelial cells into capillary-like structures in vitro. Cell. 58 (5), 933-943 (1989).
- Carrier, R. L., Papadaki, M., Rupnick, M., Schoen, F. J., Bursac, N., Langer, R., Freed, L. E., Vunkaj-Novakovic, G. Cardiac tissue engineering: cell seeding, cultivation parameters, and tissue construct characterization. Biotechnology and bioengineering. 64 (5), 580-589 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved