Method Article
폴리 (ε 카프로 락톤) 전기 방사 원사에 인간 중간 엽 줄기 세포의 첨부 파일을 최적화
요약
This article describes a range of set-ups for seeding human mesenchymal stem cells onto materials, in this case electrospun yarns, that do not cover the base of standard culture well plates in order to maximize and quantify the number of cells that initially attach compared to the known seeding density.
초록
생체 재료 및 조직 공학에 대한 연구는 종종 시작 셀 번호의 초기 지식을 필요 셀 기반 시험 관내 연구를 포함한다. 연구진은 일반적으로 자신의 파종 밀도를 참조하는 동안이 반드시 문제의 자료에 부착 한 세포의 실제 수를 표시하지 않습니다. 특히 표준 세포 배양 웰 플레이트의베이스를 커버하지 않는 재료 또는 비계 대한 경우이다. 이 연구는 문화에 4 시간 후 전기 방사 폴리 (ε 카프로 락톤) 사 상에 알려진 번호로 시드 인간 중간 엽 줄기 세포의 초기 부착을 조사합니다. 전기 방사 얀 9 rpm으로 배양 접시 내에 배치 낮은 결합 웰 플레이트 및 테트라 플루오로 에틸렌 (PTFE) 최저점에 위치하는 세포 배양 용 바이오 리액터를 삽입 회전 용기를 포함한 여러 다른 셋업 내에 유지 하였다. 후자의 두 가지를 흔드는 판에 정적 조건 중 하나를 사용하거나 배치했다 ((30) ℃로 4 시간 배양, 5 % CO 2 후에, 세포 접종 위치는 세포 DNA 분석으로 측정 하였다. 지지체는 용기에서 제거하고, 용해 완충액에 넣었다. 미디어 분획 마찬가지로 제거하고, 원심 분리 - 상등액을 버리고 펠렛을 용해 완충액으로 망가. 용해 버퍼는 각 소켓에 추가하거나, 잘, 그리고 존재할 수있는 임의의 셀을 무료로 긁어했다. 세포 DNA 분석은 세포 골격 내에 존재하는, 미디어 및 웰 분획의 비율을 결정 하였다. 세포 부착 원사 세포 배양 삽입 이내에 개최 및 모션을 흔들어 실시에 대한 큰 첨부 파일 (30 %)으로, 모든 실험 셋업에 대한 낮았다. 이 연구는 관계없이 정해진 셀 시드 밀도의 골격에 부착 세포의 실제 수에 대한 인식을 제기한다.
서문
공사장 공중 발판은 일상적으로 개발하고 생체 재료 및 조직 공학 응용 프로그램에 대한 연구되고있다. 이와 같이, 그것들은 일반적으로 예를 들면, 세포 증식 및 세포 수를 결정하는 것을 특징으로 세포 분석을 통해 시험 관내 및 행동 시딩 하였다. 이와 같은 실험의 경우, 초기 셀 수가 알려진 것이 필수적이며, 연구자들은 종종 또는 ml의 cm 당이 세포의 수로 시드 농도를 명시. 이 특히 스케일 업을 위해 좋은 방법이 있지만, 그것은 (또한 생체 재료 표면 1의 접착 특성에 따라 다릅니다), 골격 표면에 부착 세포의 실제 수를 고려하지 않습니다. 세포 구조에서 멀리 떨어질 수 있고, 때문에 실험 종종 정적 특성으로 INTE의 물질과 접촉에 다시 오지 않을 수 있으므로이 세포 배양 웰 플레이트의 전체베이스를 커버하지 않는 발판 특히 그렇습니다나머지. 전기 방사 섬유 원사가 잘 (그림 1A)의베이스를 커버하지 않는 발판의 좋은 예이다. 이 경우, 표면 처리되지 않은 낮은 결합 웰 플레이트는 플레이트의 표면에 부착하기 때문에 임의의 잘 - 기반 분석의 결과로부터 세포 왜곡을 방지하기 위해 사용되어야한다.
음 판은 쉽게 발판에 셀 시드에 사용되는, 그러나 그들은 사용할 수있는 유일한 방법은 아니다. 로타리 세포 배양 시스템, 1980 년대 후반 NASA에서 생명 과학에 의해 개발 부문 생물 반응기의 유형은 유사하게 시뮬레이션 미세 중력과 3 차원 (3D) 환경 내에서 골격을 배정 할 수있다. 생물 반응기의 이러한 유형의 연구는 전 세계적으로 인기있는 선택 및 유지, 세포 5 및 조직 공학 -6,7- 줄기 세포 2,3의 시그널링을위한 연구에 포함되었다. 무엇을 잘 접시에 바람직 회전 생물 반응기를 만드는 것은 유지 보수입니다자주의 경우와 같이, dedifferentiating에서 분화 세포를 방지하는 데 도움이 3D 환경의 경우 기존의 2D 조건 (8) 내에서 배양 하였다.
본 논문은 4 시간 기간 내에 이러한 지지체에 부착 세포의 초기 수를 최대화하기 위해 보즈 워스 등., 9 제작으로 전기 방사 된 폴리 (ε 카프로 락톤) 섬유 원사에 인간 중간 엽 줄기 세포를 파종에 대해 서로 다른 기술을 조사합니다. 2D 문화, 원사 안전하게 잘 접시 또는 사용자 정의 만든 폴리 (테트라 플루오로 에틸렌) (PTFE) 골짜기에서 개최 된 정적 조건에서 보관, 30 rpm으로 흔들어. 3D 문화, 원사 및 세포는 9 rpm으로 회전 생물 반응기 혈관 내에서 개최되었다.
프로토콜
1.Scaffold 제조 및 살균
- 10 % w / V 농도를 제공하기 위해 1,1,1,3,3,3- 헥사 플루오로 이소프로판올에 PCL을 녹여. . 중합 용액 (파라미터 : 20 kV로, 1 ㎖ / hr이고, 20cm) electrospin 보즈 등의 문헌 9에 기재된 바와 같이 회전 맨드릴 (600 RPM)의 가장자리에 정렬 된 섬유를 수집한다. (골짜기와 회전 선박에 대한) 3cm과 길이 (세포 배양 인서트) 4cm를 - 메스 짧은 길이로 절단 한 후 수집 된 섬유의 리본을 제거하고.
- 미세 집게 증류수의 개별 스트립 잠수함 및 제거를 사용.
- 엄지 손가락과 집게 손가락 사이의 양쪽 끝을 잡고; 이 스레드를 닮을 때까지 수동으로 스트립을 비틀.
- 간단히 증류수이 스레드 같은 발판 잠수함 건조 깨끗한, 비 섬유 카드에 배치합니다.
- 일단 건조, 개별적으로 깨끗한 마이크로 원심 튜브를 취하게하고 증류수에 50 % v / V를 에탄올 1 ㎖를 추가합니다. 뚜껑을 닫고 2 떠나4 시간.
참고 : 층류에서 다음 단계를 수행하십시오 : - 층류 캐비닛에 마이크로 원심 튜브를 삽입하고 50 % V / V 솔루션을 대기음. 증류수, 가까운 뚜껑에 1 ml의 70 % v / V를 에탄올로 교체하고 24 시간 동안 둡니다.
- 90 % 증류수 (1 ml의 볼륨)에서 100 % V / V 에탄올을 반복합니다.
- 워시 인산염 완충 생리 식염수 (PBS), 세척 당 24 시간 (2 × 1 ml)로 두 번 발판.
- PBS를 제거하고 1 ml의 세포 배양 용지로 교체합니다. 참고 : 공사장 공중 발판은 사용 후 24 시간 동안 준비가되어 있습니다.
2. 비계 표면적과 세포의 수 결정
- 광학 현미경 및 이미징 소프트웨어를 사용하여, 평균값을 결정하기 위해 그 길이를 따라 전기 방사 원사의 직경을 측정한다.
- 환봉을 사용하고 표면적 근사 얀을 가정 :
- 여기서 A = 표면적, R = 반경과 시간 = 길이
주 : 표면적이 18,902 인 것으로 계산되었다800 μm의 2. 또한, 얀 표면적을 증가 미세 섬유, 수백로 구성되어 실제 표면적이 계산보다 크다는 것을 주목해야한다. 따라서 세포의 수가 많을수록 골격에 부착 할 수 있어야한다. 그러나, 이것은 테스트 그룹 간의 직접적인 비교가 이루어지고 영향을주지 않는다. - 에 의해 노출 된 지지체 표면에 부착 할 수 세포의 최대 수를 결정합니다 :
주 : 광학 현미경 및 이미징 소프트웨어를 사용하여, 인간 중간 엽 줄기 세포의 직경이 측정되었다 20 μm의 (가정 세포는 원형), 따라서이 경우에, 셀의 수 = 60,200.
3. 비계 셋업 - 세포 배양 삽입 (그림 1A)
- 층류에서 멸균 6- 웰 세포 배양 삽입물을 열고 넓은 고리의 몸에서 치아 짧은 고리를 분리.
- 치아가 위쪽으로 가리키는 반지를 가져 가라. 하나를 올려 놓만드는 고리의 중심을 통해 4cm 비계의 확인이 양쪽에 겹칩니다. 톱니 링과 비계를 통해 고리 몸과 위치를 가지고 발판이 위치에 유지하고, 세포 배양 삽입의 중심을 거짓말을 확인하고 아래쪽으로 밀어 넣습니다.
- 6 자, 낮은 결합 판의 우물에 지지체와 세포 배양 삽입을 놓습니다.
- 발판에 문화 매체의 10 ML을 추가합니다.
4. 비계 셋업 - 쓰루 (그림 1B)
- 층류에서 장소 폴리 (테트라 플루오로 에틸렌) (PTFE)는 각각의 배양 접시에 쓰루과 구유에 배지 10 ㎖를 추가합니다.
- 반드시 길이를 만들고, 집게가 저점에 3cm의 비계의 한 드레이프 사용하면 통의 긴 가장자리에 평행하게 놓여있다.
5. 비계 셋업 - 생물 반응기 용기 (그림 1C)
- 층류에서 생물 반응기를 통해 용기의 멸균 PBS 10 ㎖를 분배주요 항구와 10 분 동안 둡니다.
- PBS를 제거하고 8 ml의 문화 용지로 교체합니다.
- 집게를 사용하여 주 포트를 통해 용기에 3cm의 발판 중 하나를 삽입합니다.
- 주요 포트를 닫습니다.
6. 셀 카운팅
- 최대 수확 이전에 통과 4 제조 업체 프로토콜에 따라 골수에서 파생 된 문화 인간 중간 엽 줄기 세포 (hMSC).
- 75cm에서 골수 (통로 (4), 80 % 컨 플루)에서 파생 된 중배엽 줄기 세포를 포함하는 2 플라스크 미디어를 대기음.
- 10 ml의 멸균 PBS와 대기음으로 세포를 씻으십시오.
- 3 ㎖ 트립신을 추가하고 세포를 플라스크 표면에서 빠질 때까지 37 ° C, 5 % CO 2의 플라스크를 품어.
- 효소를 불 활성화 및 원심 분리 관이 총 부피 (10 ml)에 전송하는 7 ml의 배지를 추가합니다.
- 균일 내에서 세포를 분산하도록 피펫 팅에 의해 여러 번 다운이 세포 현탁액을 재현 탁미디어 및 한계 세포 응집체 (10㎖ 피펫).
- 혈구에 세포 현탁액 및 전송의 20 μl를 제거합니다.
- X10 목적에서 광학 현미경 이미지에서 혈구를 놓습니다.
- 눈금 선 초점과 그리드의 각 모서리에있는 4 × 4 사각형 세포의 수를 계산하고있는이 광장 내에 오른손 또는 하단 경계 선을 넘어 것들. 4 × 4 사각형 (그리드 당 4 카운트)의 각 세트에 대한 계산합니다.
- 부유 세포 수를 세 번 (6.6-6.9 단계) 반복합니다.
- 평균 세포 수를 계산하고 재 부유 셀 (200 μL의 세포 농도 60,200)에 필요한 미디어의 볼륨을 결정한다. 예를 들어, 혈구 세포의 평균 수를 결정하고, 그 다음 세 개의 분리 된 세포의 카운트에서 전체 평균 수를 결정한다. 에주는 세포 현탁액의 전체 볼륨을 곱 후 1 ㎖ 당 세포의 수와를 제공하기 위해 1 × 4를 곱하면세포의 탈 번호. 재 부상에 필요한 용지의 양을 결정하기 위해 다음 식을 사용하여
- 5 분 동안 241 XG에 세포 현탁액을 원심 분리기.
7. 셀 시드
- 세포 펠렛을 떠나 원심 분리 관에서 미디어를 대기음 계산 된 미디어 볼륨으로 교체합니다.
- 심지어 혼합의 세포와 미디어를 재현 탁.
- P200 길슨 피펫을 사용하여 천천히 골격 길이를 따라 그리고 매체 액면 아래 피펫 팁을 실행하여 각 지지체에 세포 현탁액 200 μl를 분배. 20 분 동안 방해받지 둡니다.
- 생물 반응기 용기의 경우, 주 포트를 통해 세포 현탁액 200 μl를 분배. 주사기 포트를 통해 상위로해서 나머지 2 ml의 배양 배지는 10 ㎖의 총량을 얻었다.
8. 실험 시작
- RCCS - 4DQ 생물 반응기에 생물 반응기 혈관을 전송하고 9 rpm으로 회전하도록 설정합니다.
- 트란셰이 판에 세포 배양 삽입과 최저점과 웰 플레이트를 sfer 30 rpm으로 회전하도록 설정합니다.
- 37 ° C, 5 % CO 2 (정적 문화)로 설정 세포 배양기의 선반에 세포 배양 삽입과 최저점과 웰 플레이트를 전송합니다.
9. DNA 분석
- 용해 버퍼, 1X TE 버퍼, DNA 표준 및 세포 DNA의 작업 솔루션 - - 제조사의 지시에 따라 솔루션을 준비합니다.
- 4 시간 후, 인큐베이터에서 샘플을 제거하고 층류 아래에 배치합니다.
- 모든 샘플에서 미디어 분수를 제거하고 별도 표시 원심 분리기 튜브에 배치합니다. 튜브 241 XG를 원심 분리기. 상층 액을 제거하고 3 ㎖ 용해 버퍼를 추가합니다. 해체 할 수있는 세포 펠렛을 솔루션을 재현 탁.
- 집게는 생물 반응기 용기 내에서 비계를위한 3 ㎖ 용해 버퍼를 (포함하는 원심 분리기 튜브의 발판과 장소를 제거하여, 이전에 저를 흡입에 발판을 제거DIA). 세포 배양 삽입 내에서 개최 비계를 들어, 먼저 메스를 사용하여 삽입의 가장자리에 발판을 절단하여 발판을 확보.
- 각 발판 콘센트에 용해 버퍼의 3 ㎖를 추가하고 표면을 긁어 (적극적으로 생물 반응기 선박 선동). 용해 버퍼를 제거하고 별도 표시 원심 분리기 튜브에 배치합니다.
- 소용돌이 대략 1 분 동안 원심 분리 관 각각은 셀들의 충분한 교반을 보장하고 버퍼와 세포막의 용해를 촉진한다.
- 비계, 미디어 및 잘 (중복) - 검은 96 웰 플레이트에서 각 샘플 일부분에 대한 용해 버퍼 100 μl를 추가합니다.
- 어둠 속에서, 용해 버퍼를 포함하는 모든 우물에 세포의 DNA 용액 100 μl를 추가하고 부드럽게 섞는다.
- 잘 판에 대한 부정과 긍정적 인 제어를 제공하기 위해 더 DNA와 세포의 DNA 솔루션을 포함하지 않는 용해 버퍼와 우물을 포함합니다.
- 형광 플레이트 판독기를 사용하여, 웰의 흡광도를 측정485 nm의 여기 및 520 nm의 발광을 사용이야.
- 제조사의 지시에 따라 DNA 표준에서 생성 된 표준 곡선과 데이터를 비교한다.
(10) 주사 전자 현미경 (SEM) 고정
- 층류에서 다음 단계를 수행 : 4 시간 후, 새로운 6 웰 플레이트 (별도의 우물) 내에서 소켓과 장소에서 모든 비계를 제거합니다.
- PBS로 두 번 발판을 씻으십시오.
- 오픈 벤치에서 다음 단계를 수행하여 각 웰, 발판의 완전한 범위를 보장하기 위해 PBS에 1.5 % V / V의 글 루타 알데하이드 (glutaraldehyde) 2 ㎖를 추가합니다.
- 셀 고정 4 ℃에서 최소 30 분 동안 접시를 남겨주세요.
- 정착액 솔루션을 제거하고 PBS로 두 번 발판을 씻는다.
- 70 % V / V 및 V 90 %,이어서 50 % V / V를 증류수로 시작하고, 에탄올 농도가 증가함에 따라 발판 탈수 / V. 각각의 농도를 들어, 완전히 solutio의 발판을 물속에 가라 앉히다N (2 ml)을 3 분 동안 둡니다. 솔루션을 취소하고 반복합니다.
- 완전 용액의 비계 (2ml)에 5 분간 담근 떠나 100 % 에탄올 탈수. 솔루션을 취소하고 반복합니다.
- 화학적 흄 후드 내에서 헥사 메틸 디 실라 잔을 사용하여 비계 (HMDS)을 건조. HMDS의 비계 (2 ml)에 담그고 5 분 동안 둡니다. HMDS를 제거하고 반복합니다.
- HMDS를 제거하고 비계 건조 할 수 있습니다. (이 경우 접착제 탄소 탭 스테인레스 스틸 스텁)에서 상업적으로 이용 가능한 SEM 스텁에 비계를 탑재합니다.
- SEM에서 볼 완화하기 위해, 2 분 동안 금 스퍼터 코터를 사용하여 코팅 된 샘플은 심지어 얇은 커버리지를 보장한다.
- 및 SEM 내의 플레이스 샘플 5 KeV의 전자 빔을 이용하여 셀 시드 발판을 시각화.
결과
결과는 조사 각 실험 장치에 대한 4 시간의 후 파종을 다음 세포의 위치를 강조 표시합니다. 그림 2A는이 시간 동안 지지체의 표면에 부착 한 세포의 비율을 보여줍니다. 8.5 PG / 셀의 변환율은 셀 개수의 측정 DNA 콘텐츠를 변환하고, 따라서 셀 (10)의 백분율을 측정 하였다. 모든 시드 셋업 조사 들어, 세포 부착의 백분율은 세포 배양 인서트 내에 유지 30rpm의 (삽입 쉐이커) 진탕 발판 대 큰 셀 순응도 (30 %)와, 상대적으로 낮다. 최저 순응도 (15 %)을 세포 배양 용 지지체 인서트 내에 유지했다 위해 정적 상태 (삽입 정적)하에 유지.
세포의 많은 수의 미디어 부분 (그림 2B) 내에 존재, 특히 50 %와 51 % 인 낮은 바인딩 플레이트 (삽입 정적) 및 회전 용기 내에서 개최 세포 배양 인서트각각. 트로프 셰이커에 대한 세포의 48 %와 트로프 정적 50 % - 골짜기에서 개최 발판 홀더 자체 내에 존재하는 세포의 발생 수를 보여 주었다.
주사 전자 현미경은 셀 시드 비계의 시각적 평가를 (도 3)을 허용했다. 대표적인 이미지는 관계없이 설정 시딩, 섬유 표면에 세포의 존재를 제한 강조. 그러나, 세포 및 세포 응집체는 더 많은 수의 세포 배양 인서트 내에 유지 30rpm의 (삽입 쉐이커) 진탕 지지체 상에 존재 하였다.
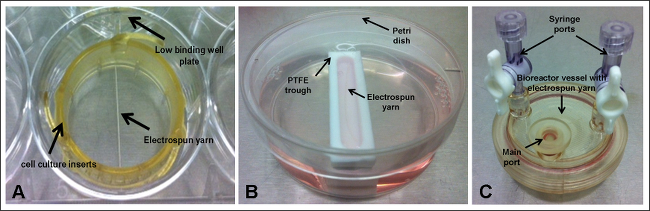
전기 방사 원사가 내에서 개최되는 그림 1. 실험 셋업; (A) 세포 배양 삽입물과 낮은 바인딩 웰 플레이트 (B) 폴리 (테트라 플루오로 에틸렌) (PTFE) 및 트로프 페트리 접시; 및 (C) 생물 반응기 용기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
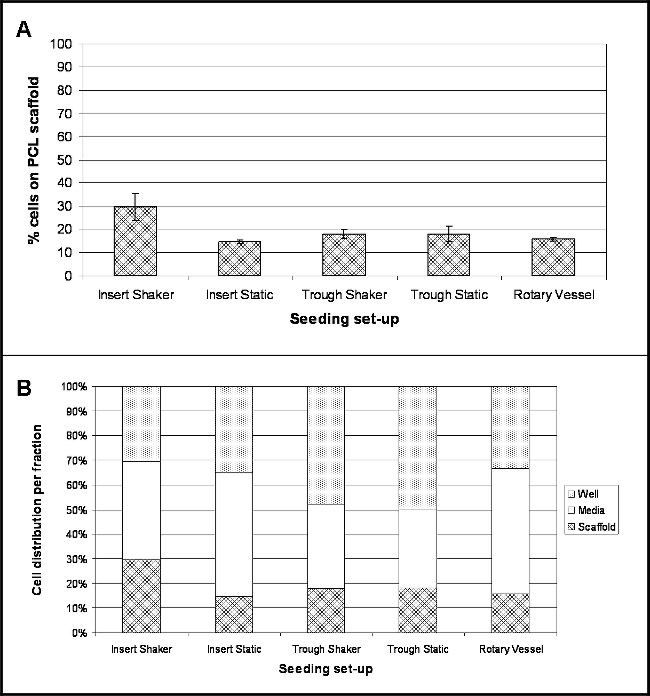
다른 시드 셋업을 사용하여 PCL 전기 방사 원사 상 세포 4 시간 후 파종 그림 2. 위치. 미디어 (웰 지지체 N = 4 데이터로 표현 - (B) 세 분획 내의 셀 위치의 백분율 확산 강조; (A)는 (평균 ± 표준 편차) PCL 지지체에 부착 한 세포의 백분율을 보여 ) 값을 의미한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3. 대표 주사 전자 현미경 사진 인간 중간 엽 줄기 세포와 PCL 전기 방사 원사, 4 초기 시드가 다른 실험 셋업 사용 후 시간. 대한 (배, 1000 배 배율의 모든 이미지, 스케일 바 = 130 μm의.) 를 보려면 여기를 클릭하십시오 이 그림의 더 큰 버전.
토론
생체 고분자로부터 제조 전기 방사 섬유 매트릭스 정기적 생체 재료 및 / 또는 조직 공학을위한 응용 11,12 세포 부착과 증식을 지원하는데 사용된다. 이러한 경우, 행렬은 쉽게 세포 배양 웰 플레이트의베이스 전체를 커버하고, 따라서 세포 부착을 향상 시드 세포 완전한 접촉하는 섬유의 얇은 시트가 많다. 그러나, 생체 지지체 완전히 웰 플레이트의베이스를 커버하지 않는 경우, 시딩 된 세포의 큰 비율이 지지체와 접촉 유지되지 궁극적 첨부 할 수 없다는 것을 높은 확률이있다. 본 연구는 미래 세포 기반 실험을 추천 할 수있는 최적화 된 방법을 결정하기 위해, 웰 플레이트의베이스를 커버하지 않는 세포를 지지체 상에 시드를위한 여러 가지 방법을 연구 하였다.
다섯 다른 셋업 (그림 1)을 조사 하였다 : scaffo을LDS (전기 방사 얀) 낮은 결합 웰 플레이트 내에서 세포 배양을 이용하여 인서트 개최 정적 조건하에 유지 또는 30 rpm으로 진탕; 30 rpm에서 좁은 PTFE 골짜기 내에 배치 및 정적 개최 또는 동요 비계; 와 비계 9 rpm으로 회전 생물 반응기 용기 안에 보관. 모든 시드 셋업 (그림 2)에 대한 첨부 파일의 낮은 비율은 DNA 분석하여 전기 방사 원사에 부착 한 세포의 수를 보여 결정하는 단계; 이는 상기 전자 현미경 (SEM) (도 3) 검색에서 확인되었다. 최대 세포 부착 - 30 % ~ 18,060 세포 세포 배양 인서트 내에 유지하고 지속적인 운동을 실시 얀 관찰 하던가. 흥미롭게도, 낮은 세포 부착 (15 %)는 방사상 모션의 포함은 지지체와 접촉 세포 유지에 긍정적 인 효과를 제안했다 세포 배양 삽입물에 유지하지만, 정적 조건하에 유지 얀, 달성 하였다. 그러나,이것은 미디어의 흐름이 연속적으로 선회 SEM 이미지에서 관찰 된 세포 응집체 책임 수 있다는 것에주의해야 할 것이다. 셰이 판은 가장 낮은 설정에 설정 한 - 30 RPM -이 세트 업에 제한이 될 수 있습니다. 느린 방사형 모션을 사용하면 방지하거나 세포 덩어리를 줄이는 데 도움이 될 수있는 세포가 적은 힘을 경험하게 될 것입니다으로도 세포 부착을 향상시킬 수 있습니다. 미래의 실험은 개선 된 세포 부착을위한 이상적인 흔드는 속도를 최적화에 초점을 맞추어야한다. 두 경우 모두 18 %의 첨부 파일 (~ 10,836 세포)를 산출하여, 유사한 경향을 초래하지 않은 골짜기에서 개최 원사 운동을 통합; 이 골짜기 내에서 비계의 일부 부상으로 인해있을 수 있지만 그들이베이스에 고정되지 않은로 (통 판에 배치 골 관찰). 재료 및 접착과 접촉 통의 바닥에 침몰 한 모든 세포를 방지 할 수 비계의 일부 부동. t에 대한자신의 특정 세트 업, 저점은 페트리 접시 내에 수용하고 미디어의 총 10 ml의 볼륨 덧붙였다. 구유의 작은 크기는 미디어의 대부분은 페트리 접시 내에 존재와 움직임이있는 경우, 세포가 배양 접시에 떨어져 저점에서 드리프트와 비계의 손이 닿지 않는 곳에 완전히 남아있을 수 있다는 것을 의미한다. 이 노출 비계 그들의 부유 특히 이동 (방지한다 이러한 한계를 극복하기 위해 추가적인 실험이 비계의 단부 멸균 미세 바늘을 이용하여 골의베이스에 고정되어있다 프로토콜에 추가 단계를 포함한다 궁극적으로 발판에 부착 세포 수의 증가로 연결되어야 반경 모션). 세포의 16 %가 회전 혈관 내에 존재하는 실에 부착했다. 3D 문화 확립 된 기술 임에도 불구하고, 문제가 느슨하게 ATTAC 이어질 수있는 선박의 주요 포트에서 비계의 제거, 발생할 않았다을 Hed 세포가 손실된다. 완벽하게이 문제를 제거 할 열 수있는 선박; 이러한 구매 가능하지만 상당히 본 연구에 사용 된 일회용 용기보다 더 비싸다.
이 연구는 표준 세포 배양 웰 플레이트의 전체베이스를 커버하지 않는 발판을 시드와 현재의 문제를 보여줍니다. 알려진 세포 수를 심는 것은 준수하는 모든 셀을 허용 비계의 면적에도 불구하고, 발판에 세 번째 부착 이하의 결과. 이것은 잠재적 인 미래의 의료 기기와 비계와 생체 적합성 및 세포 물질 / 세포 - 세포 행동과 상호 작용을 평가할 수있는 다른 세포 기반 분석에 해로운 결과를 초래할 수 있습니다. 이 연구의 또 다른 한계는 4 시간의 시간을 소수점 포함 할 수있다 - 초기 셀 시딩을 보장하기 위해 충분한 시간 임에도 불구하고을 (세포가 단단히 삼십분 13,14,15 내에서 기판에 부착하는 것으로 나타났다), 그것은에서 합리적으로 할 수있다나중에 포인트이 그렇지 않으면 시작 세포 수를 왜곡하는 것처럼 세포가 더 긴 시간 프레임 동안 증식하지 않습니다 제공 vestigate. 이 경우에, 10 mL의 매체의 용적을 감소 또한 세포와 지지체 사이의 접촉을 향상시키고, 궁극적으로 세포 부착을 증가시킬 수있다. 미래의 연구는 세포 손상 및 / 또는 세포 사멸 (16)을 일으킬 수 세포 파종의 과정으로 세포 생존 능력을 고려해야한다. 그러한 라이브 / 죽은 분석법, 예를 들면 생존 레벨을 강조하는 것처럼 세포 DNA 분석이 가능한 비 생존 세포를 구별하지 않는다.
이 조사는 알려진 양을 뿌리기에도 불구하고 발판에 부착 세포의 실제 수에 대한 인식을 제기한다. 세포의 시작 번호에 의존하는 연구의 경우, 연구자들은 그 그림의 대부분은 사실 관심의 기판에 부착에 똑같이 방법을 알고 매우 중요합니다.
공개
The authors declare that they have no competing financial interests.
감사의 말
MRC-DPFS 보조금 코드 G1000788-98812을 - 저자는이 연구에 자금을 지원하기위한 의료 연구위원회를 감사하고 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Distilled water | in-house supply | n/a | |
| Ethanol | Merck | 1117271000 | |
| Phosphate Buffered Saline solution | Life Technologies | 70013016 | |
| Human mesenchymal stem cells | PromoCell GmbH | C-12974 | |
| MSC culture media | PromoCell GmbH | C-28010B | Warmed to 37 oC before use |
| Supplement mix | PromoCell GmbH | C-39810 | Add to culture media |
| Antibiotic/antimyotic mix | Sigma-Aldrich | A5955 | Add to culture media |
| Trypsin (0.05%) EDTA (0.02%) | Sigma-Aldrich | 59417C | Warmed to 37 °C before use |
| Cell culture flasks (T75) | Becton Dickinson Ltd | 353110 | |
| Low binding 6-well plates | Costar Corning | 3471 | |
| 6-well CellCrowns | Scaffdex | C00003S | |
| Petri-dish 50 ml deep | Sterilin | 124 | |
| PTFE troughs | in-house production | n/a | |
| Disposable RCCS vessels 10 ml | Synthecon | D-410 | |
| 4 Vessel Rotary Cell Culture System bioreactor | Synthecon | RCCS-4DQ | |
| Shaker plate | Stuart | SSM1 | Mini Orbital Shaker |
| Haemocytometer | Digital Bio | DHC-F01 | Disposable C-Chip |
| Centrifuge tube | Deltalab | 352096, 429901 | 15 ml and 50 ml |
| Centrifuge | Hettich | Rotafix 32 A | |
| Syringe 3 ml | Shield Medicare Ltd | 3039820 | |
| Pipettes | Sterilin | 40305, 47310, 40125 | 5, 10 and 25 ml |
| Gilson pipettes | SLS | F144801, F144802, F123600, F123601, F123602 | P2 - P1000 |
| Pipette tips | SLS | PIP7852, PIP7834, PIP7840 | |
| Micro test tube 1.5 ml | Eppendorf | 30125.15 | |
| Triton X-100 | Sigma | 9002-93-1 | |
| PicoGreen Assay | Invitrogen | P7589 | Assay set-up in the dark |
| Black 96-well plate | Greiner Bio One | 655086 | |
| Fluorescent plate-reader | BGM Labtech | FLUOstar Optima | |
| Glutaraldehyde 25% | TAAB Laboratories | G002 | Made to a concentration of 1.5% v/v in PBS |
| Hexamethyldisilazane (HMDS) | Sigma | 999-97-3 | |
| Aluminium stubs (SEM) | Agar Scientific | G301 | |
| Carbon tabs (SEM) | Agar Scientific | G3347N | |
| Gold sputter coater | Edwards | S150B | |
| Scanning Electron Microscope (SEM) | Phenom World | Phenom Pro |
참고문헌
- Jauregui, H. O. Cell adhesion to biomaterials. The role of several extracellular matrix components in the attachment of non-transformed fibroblasts and parenchymal cells. ASAIO transactions/American Society for Artificial Internal Organs. 33 (2), 66-74 (1986).
- Puca, A., Russo, G., Giordano, A. Properties of Mechano-Transduction via Simulated Microgravity and its Effects on Intracellular Trafficking of VEGFR's. Oncotarget. 3 (4), 426 (2012).
- Vincent, L., Avancena, P., Cheng, J., Rafii, S., Rabbany, S. Y. Simulated microgravity impairs leukemic cell survival through altering VEGFR-2/VEGF-A signaling pathway. Annals of biomedical engineering. 33 (10), 1405-1410 (2005).
- Rungarunlert, S., Klincumhom, N., Tharasanit, T., Techakumphu, M., Pirity, M. K., Dinnyes, A. Slow Turning Lateral Vessel Bioreactor Improves Embryoid Body Formation and Cardiogenic Differentiation of Mouse Embryonic Stem Cells. Cellular Reprogramming. 15 (5), 443-458 (2013).
- Wu, X., Li, S. H., Lou, L. M., Chen, Z. R. The Effect of the Microgravity Rotating Culture System on the Chondrogenic Differentiation of Bone Marrow Mesenchymal Stem Cells. Molecular biotechnology. 54 (2), 331-336 (2013).
- Wang, Y., et al. Rotating Microgravity-Bioreactor Cultivation Enhances the Hepatic Differentiation of Mouse Embryonic Stem Cells on Biodegradable Polymer Scaffolds. Tissue Engineering Part A. 18 (21-22), 2376-2385 (2012).
- Lv, Q., Deng, M., Ulery, B. D., Nair, L. S., Laurencin, C. T. Nano-ceramic Composite Scaffolds for Bioreactor-based Bone Engineering. Clinical Orthopaedics and Related Research. 471 (8), 2422-2433 (2013).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. American Journal of Physiology-Renal Physiology. 281 (1), F12-F25 (2001).
- Bosworth, L. A., Alam, N., Wong, J. K., Downes, S. Investigation of 2D and 3D electrospun scaffolds intended for tendon repair. Journal of Materials Science: Materials in Medicine. 24 (6), 1605-1614 (2011).
- Dormer, N. H., Qiu, Y., Lydick, A. M., Allen, N. D., Mohan, N., Berkland, C. J., Detamore, M. S. Osteogenic differentiation of human bone marrow stromal cells in hydroxyapatite-loaded microsphere-based scaffolds.. Tissue Engineering Part A. 18 (7-8), 757-767 (2011).
- Rayatpisheh, S., Heath, D. E., Shakouri, A., Rujitanaroj, P. O., Chew, S. Y., Chan-Park, M. B. Combining cell sheet technology and electrospun scaffolding for engineered tubular, aligned, and contractile blood vessels. Biomaterials. 35 (9), 2713-2719 (2014).
- Wismer, N., Grad, S., Fortunato, G., Ferguson, S. J., Alini, M., Eglin, D. Biodegradable electrospun scaffolds for annulus fibrosus tissue engineering: effect of scaffold structure and composition on annulus fibrosus cells in vitro. Tissue Engineering Part A. (3-4), 672-682 (2014).
- Yavin, E., Yavin, Z. Attachment and culture of dissociated cells from rat embryo cerebral hemispheres on polylysine-coated surface. The Journal of cell biology. 62 (2), 540-546 (1974).
- Chen, H. Guan, of focal adhesion kinase with its potential substrate phosphatidylinositol 3-kinase. Proceedings of the National Academy of Sciences. 91 (21), 10148-10152 (1994).
- Grant, D. S., Tashiro, K. -. I., Segui-Real, B., Yamada, Y., Martin, G. R., Kleinman, H. K. Two different laminin domains mediate the differentiation of human endothelial cells into capillary-like structures in vitro. Cell. 58 (5), 933-943 (1989).
- Carrier, R. L., Papadaki, M., Rupnick, M., Schoen, F. J., Bursac, N., Langer, R., Freed, L. E., Vunkaj-Novakovic, G. Cardiac tissue engineering: cell seeding, cultivation parameters, and tissue construct characterization. Biotechnology and bioengineering. 64 (5), 580-589 (1999).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유