Method Article
Otimizando Penhora de mesenquimais humanas Células-Tronco em Poly (ε-caprolactona) electrospun Yarns
Neste Artigo
Resumo
This article describes a range of set-ups for seeding human mesenchymal stem cells onto materials, in this case electrospun yarns, that do not cover the base of standard culture well plates in order to maximize and quantify the number of cells that initially attach compared to the known seeding density.
Resumo
A investigação sobre biomateriais e engenharia de tecidos, muitas vezes inclui investigações in vitro baseados em células, que exigem conhecimento inicial do número de células de partida. Enquanto os pesquisadores comumente referenciar a sua densidade de semeadura isso não indica necessariamente o número real de células que aderiram ao material em questão. Este é particularmente o caso dos materiais, ou andaimes, que não cobrem a base de placas de cultura de células padrão. Este estudo investiga a ligação inicial de células-tronco mesenquimais humanas semeados em um número conhecido em poli electrospun (ε-caprolactona) de fios após 4 horas em cultura. Fios electrospun foram realizadas dentro de vários set-ups diferentes, incluindo os navios de biorreatores rotativas às 9 rpm, inserções de cultura de células posicionadas em baixas poços de ligação e de politetrafluoretileno (PTFE) calhas colocadas dentro de caixas de Petri. Os dois últimos foram submetidos a condições tanto estáticas ou posicionado num agitador de placas (30 ° C, 5% de CO 2, o local de células semeadas foram determinados pelo ensaio de ADN da célula. Os andaimes foram removidos dos respectivos recipientes e colocados em tampão de lise. A fracção meio foi removido e centrifugado de forma semelhante - o sobrenadante descartado e o sedimento dividida com tampão de lise. O tampão de lise foi adicionada a cada recipiente, ou bem, e raspadas para libertar quaisquer células que possam estar presentes. O ensaio de DNA de células determinada a percentagem de células presentes no andaime, mídia e frações bem. A adesão celular foi baixa para todos os arranjos experimentais, com maior apego (30%) para os fios realizadas na inserções de cultura de células e sujeitas a agitação movimento. Este estudo levanta a consciência para o número real de células inerentes aos andaimes, independentemente da densidade de semeadura de células indicada.
Introdução
Os andaimes são rotineiramente sendo desenvolvidos e pesquisados para aplicações de biomateriais e engenharia de tecidos. Como tal, eles são vulgarmente semeadas com células e o seu comportamento in vitro, caracterizadas através de ensaios que determinam a proliferação celular e o número de células, por exemplo. Para experiências como essas, é imperativo que o número de células inicial é conhecida e pesquisadores freqüentemente a máxima concentração de semeadura, em termos de número de células por ml ou cm 2. Enquanto isto é uma boa prática, especialmente para fins de aumento de escala, que não tem em conta o número real de células que aderem à superfície de andaime (que também é dependente das propriedades adesivas da superfície do biomaterial 1). Isto é especialmente verdadeiro para os andaimes que não cobrem toda a base da célula de cultura bem como placa de células poderiam cair fora da construção e, devido à natureza muitas vezes estática do experimento, pode nunca mais voltar em contacto com o material de interesto. Fios de fibra electrospun são um bom exemplo de um andaime que não cobre a base da cavidade (Figura 1A). Neste caso, os baixos placas de poços de ligação que não foram tratados à superfície deve ser usada para evitar que as células de se ligarem à superfície da placa e, consequentemente, distorcem os resultados de qualquer ensaio bem fundamentada.
Poços são facilmente utilizados para semeadura de células para andaimes, mas eles não são o único método disponível. Sistemas de cultura de células do Rotary, um tipo de biorreator desenvolvido pela Divisão de Ciências da Vida da NASA no final de 1980, da mesma forma pode ser usado para semear andaimes dentro de um ambiente tridimensional (3D) com microgravidade simulada. Este tipo de biorreator continua a ser uma escolha popular entre os pesquisadores em todo o mundo e tem sido incorporada nos estudos para a sinalização celular 2,3, as células estaminais e engenharia de tecidos de 4,5 6,7. O que faz com que o bioreactor rotativo preferível placas de poços é a manutençãode um ambiente 3D, o que ajuda a evitar que as células diferenciadas de dedifferentiating, como é frequentemente o caso quando cultivadas dentro de condições 2D convencionais 8.
Este artigo investiga técnicas diferentes para sementeira de células estaminais mesenquimais humanas em electrospun poli (ε-caprolactona) como fios de fibra fabricada em Bosworth et al., 9, a fim de maximizar o número inicial de células ligadas a estes esqueletos dentro de um período de 4 h. Para a cultura 2D, os fios foram solidamente mantidos dentro de poços ou feitos sob medida de poli (tetrafluoroetileno) (PTFE) calhas e mantidos em condições estáticas, ou agitado em 30 rpm. Para a cultura 3D, fios e células foram realizadas dentro dos vasos de biorreatores rotativas às 9 rpm.
Protocolo
Fabrication 1.Scaffold e Esterilização
- Dissolve-PCL em 1,1,1,3,3,3-hexafluoroisopropanol para dar um 10% w concentração / v. Tal como descrito em Bosworth et al, 9 electrospin solução polimérica (parâmetros: 20 kV, 1 ml / h, 20 cm). E recolher fibras alinhadas na extremidade de um mandril rotativo (600 rpm). Com um bisturi remover a fita de fibra recolhido e, em seguida, cortado em comprimentos mais curtos - 3 cm (para calhas e vasos rotativos) e 4 cm (para inserções de cultura de células) comprimentos.
- Usando fórceps finos submergir tiras individuais em água destilada e remover.
- Segurando as duas extremidades entre o polegar eo indicador; torcer manualmente a banda até que se assemelha a discussão.
- Resumidamente submergir este andaime do tipo fio em água destilada e colocar no cartão limpo, não fibrosas para secar.
- Depois de seco, realiza individualmente em tubos de microcentrífuga limpo e adicionar 1 ml de 50% v / v de etanol em água destilada. Fechar as tampas e deixe por 24 hr.
Nota: Execute as seguintes etapas em fluxo laminar: - Colocar em tubos de microcentrífuga de uma câmara de fluxo laminar e aspirar a solução de v / v de 50%. Substituir com 1 ml de 70% v / v de etanol em água destilada, tampas de fechar e deixar durante 24 horas.
- Repetir para 90% e 100% v / v de etanol em água destilada (1 ml de volume).
- Lavar andaimes duas vezes com solução salina tamponada com fosfato (PBS), 24 h por lavagem (2 x 1 ml).
- Remover PBS e substitua com 1 ml de meio de cultura de células. Nota: Os andaimes estão prontos para uso pós-24 hr.
2. Determinar Area Andaime superfície e número de células
- Usando um microscópio de luz e o software de imagem, medir o diâmetro do fio electrospun ao longo do seu comprimento para determinar um valor significativo.
- Assuma que o fio de ser uma haste cilíndrica e aproximar a área de superfície utilizando:
- Onde A = área de superfície, r = raio e h = comprimento
Nota: A área de superfície foi calculada como sendo de 18.902, 800 mm 2. Além disso, deve notar-se que a área de superfície real será superior a este cálculo, o fio é composto por centenas de fibras finas, o que irá aumentar a área de superfície. Consequentemente, um número maior de células deve ser capaz de anexar ao cadafalso. No entanto, isto não afecta a uma comparação directa entre os grupos de teste a ser feito. - Determine o número máximo de células que poderia anexar à superfície andaime expostos por:
Nota: Usando um microscópio de luz e o software de imagem, o diâmetro de células estaminais mesenquimais humanas foi determinada como sendo de 20 um (assumindo que as células são redondas), portanto, neste caso, o número de células = 60.200.
3. Andaime Set-up - Cultura Celular inserções (Figura 1A)
- Sob fluxo laminar, aberto estéreis as inserções de 6 poços de cultura de células e separar os anéis com dentes mais curtos a partir dos corpos em anel mais largo.
- Pegue o anel com dentes apontando para cima. Armar umados quatro centímetros andaimes sobre o centro do anel de ter certeza que ele se sobrepõe em ambos os lados. Tirar o corpo e a posição dos anéis sobre o anel dentado e andaime e empurrar para baixo para garantir que o andaime fica em posição e encontra-se através do centro da inserção de cultura de célula.
- Coloque a inserção de cultura de células com o andaime no poço de um de 6 poços, baixo placa de ligação.
- Adicionar 10 ml de meio de cultura para o andaime.
4. Andaime Set-up - Trough (Figura 1B)
- Sob fluxo laminar, local de poli (tetrafluoroetileno) (PTFE) calhas individuais em placas de petri e adicionam-se 10 ml de meio de cultura para a calha.
- Usando fórceps armar um dos três centímetros andaimes para a calha, assegurando-se o seu comprimento situa-se paralelamente ao longo da calha de borda.
5. Andaime Set-up - Bioreactor Vessel (Figura 1C)
- Sob fluxo laminar, dispensar 10 ml de PBS estéril através do bioreactor de navioprincipal porto e deixe por 10 min.
- Retire a PBS e substituir com 8 ml meios de cultura.
- Usando pinças, inserir um dos suportes 3 centímetros para dentro do recipiente através da porta principal.
- Fechar a porta principal.
Contando 6. celular
- As células estaminais mesenquimais humanas de cultura (hMSC) derivadas de medula óssea de acordo com o protocolo do fabricante até 4 passagens, antes da colheita.
- Aspirar a mídia a partir de um 75 centímetros 2 frasco contendo hMSCs derivadas da medula óssea (passagem 4, 80% de confluência).
- Lavam-se as células com 10 ml de PBS estéril e aspirado.
- Adicionar 3 ml de tripsina e incubar o balão a 37 ° C, 5% de CO2 até as células terem desalojado da superfície do frasco.
- Adicionar 7 ml de meio de cultura para inactivar a enzima e transferir esse volume total (10 ml) para um tubo de centrífuga.
- Ressuspender desta suspensão de células por pipetagem para cima e para baixo várias vezes para dispersar de forma homogénea no interior da célulasmeios de comunicação e aglomerados celulares limite (10 ml de pipeta).
- Remover 20 pi de suspensão de células e transferir para um hemocitómetro.
- Coloque o hemocit�etro sob um microscópio e imagem luz no objetivo x10.
- Concentre-se as linhas de grade e contar o número de células nos 4 x 4 quadrados em cada canto da rede e que se inserem no quadrado e aqueles que atravessam a mão direita ou linha de limite inferior. Contagem para cada conjunto de 4 x 4 quadrados (quatro contagens por grade).
- Repita a ressuspensão e celular contagem três vezes (passos 6,6-6,9).
- Calcula-se a média da contagem de células e determinação do volume de material necessário para a ressuspensão de células (concentração de células 60.200 em 200 ul). Por exemplo, determinar a contagem média de células do hemacitómetro e depois determinar o número médio total de células a partir dos três contagens separadas. Multiplicar este por 1 x 10 4 para indicar o número de células por ml e, em seguida, multiplica-se por o volume total de suspensão de células para dar anúmero tal de células. Utilize a seguinte equação para determinar o volume de mídia necessária para a ressuspensão:
- Centrifuga-se a suspensão de células a 241 xg durante 5 min.
Sementeira 7. celular
- Aspirar a mídia do tubo centrifugado deixando o pellet celular e substituir com o volume de mídia calculado.
- Ressuspender as células e os media para uma misturar mesmo.
- Usando uma pipeta Gilson P200, dispensar lentamente 200 ul de suspensão celular em cada andaime rodando a ponta da pipeta ao longo do comprimento do andaime e abaixo da superfície do líquido de suporte. Deixe em repouso por 20 min.
- Para as embarcações de biorreatores, dispensar 200 mL de suspensão de células através da porta principal. Parte-se do meio de cultura de 2 ml remanescente através das portas de seringa para dar um volume total de 10 ml.
8. Experimental Iniciar
- Transfira os vasos de biorreatores para o biorreator RCCS-4DQ e definir a rodar a 9 rpm.
- TransFer as placas bem com inserções de cultura de células e os cavados para o agitador de placas, e por rodar a 30 rpm.
- Transferem-se as placas bem com inserções de cultura de células e as calhas para a prateleira de uma célula incubadora fixada em 37 ° C, 5% de CO 2 (cultura estática).
9. DNA Assay
- Preparar soluções - tampão de lise, 1x tampão TE, padrões de ADN e de solução de trabalho DNA celular - conforme as instruções do fabricante.
- Após 4 horas, remover as amostras da incubadora e colocar sob fluxo laminar.
- Retire as frações de mídia de todas as amostras e coloque em tubos de centrífuga marcados separadamente. Centrifugar os tubos 241 xg. Remover o sobrenadante e adicionar 3 ml de tampão de lise. Ressuspender a solução para quebrar-se o sedimento de células.
- Utilizando uma pinça remover os andaimes e coloque em tubos de centrífuga contendo 3 ml de tampão de lise (para os andaimes no interior dos vasos de biorreatores, remova o andaime antes de aspirar o media). Para andaimes realizadas na inserções de cultura de células, em primeiro lugar libertar o andaime cortando o andaime perto da borda da inserção usando um bisturi.
- Adicionar 3 ml de tampão de lise a cada recipiente de andaime e raspe a superfície (vigorosamente para agitar os recipientes reactores biológicos). Remover o tampão de lise e colocar em tubos de centrífuga rotulado separadamente.
- Vortex de cada tubo de centrifugação durante cerca de 1 min para assegurar a agitação suficiente das células e o tampão e para estimular a lise da membrana celular.
- Em um preto placa de 96 poços, adicione 100 ml de tampão de lise para cada fração amostral - andaime, mídia e bem (duplicar).
- No escuro, adicionar 100 uL de solução de ADN celular de todos os poços contendo tampão de lise, e misturar suavemente.
- Incluem os poços com tampão de lise contendo nenhuma solução de ADN e ADN de células para proporcionar um controlo negativa e positiva para o poço de placa.
- Utilizando um leitor de placas de fluorescência, mede-se a absorvância do poços usando excitação a 485 nm e 520 nm de emissão.
- Comparar os dados com a curva padrão gerada a partir dos padrões de ADN conforme as instruções do fabricante.
10. Microscópio Eletrônico de Varredura (MEV) Fixação
- Execute as seguintes etapas sob fluxo laminar: Após 4 horas, remover todos os scaffolds de seus recipientes e lugar dentro de uma nova placa de 6 poços (poços separados).
- Lavar os andaimes duas vezes com PBS.
- Execute as seguintes etapas no banco aberto: Para cada poço, adicione 2 ml de 1,5% v / v em PBS para garantir a cobertura completa do andaime.
- Deixar a placa para um mínimo de 30 min a 4 ° C durante a fixação das células.
- Remover a solução fixadora e lavam os andaimes duas vezes com PBS.
- Desidratar os andaimes com concentrações crescentes de etanol em água destilada começando com 50% v / v, seguido por 70% v / v e 90% v / v. Para cada concentração, mergulhe totalmente os andaimes em solution (2 ml) e deixar durante 3 min. Descartar a solução e repita.
- Desidratar em etanol a 100% por submergir completamente os suportes na solução (2 ml) e deixando durante 5 min. Descartar a solução e repita.
- Quimicamente secar os scaffolds usando hexametildisilazano (HMDS) dentro de um exaustor. Mergulhe os andaimes em HMDS (2 ml) e deixe por 5 min. Retire os HMDS e repita.
- Remover os HMDS e permitir que os andaimes para secar. Monte os andaimes sobre tocos SEM comercialmente disponíveis (neste caso topos de aço inoxidável com abas adesivas de carbono).
- Para facilitar a visualização dentro do SEM, revestem-se as amostras usando um aplicador de ouro por borrifamento de 2 min para garantir uma cobertura fina e uniforme.
- Colocar as amostras dentro do SEM e visualizar os scaffolds de células-semeado usando um feixe de elétrons 5 KeV.
Resultados
Estes resultados indicam a localização das células seguintes quatro horas após a sementeira para cada conjunto experimental investigado. A Figura 2A demonstra a percentagem de células que têm ligado à superfície do andaime durante este tempo. Um factor de conversão de 8,5 pg / célula foi usada para converter o teor de ADN medido em número de células e, assim, determinar a percentagem de células 10. Para todos os semeadura set-ups investigado, o percentual de fixação das células é relativamente baixa, com maior aderência celular (30%) para andaimes realizadas na inserções de cultura de células e agitando a 30 rpm (Insert Shaker). Mais baixa aderência (15%) foi realizada por andaimes dentro das inserções de cultura de células e mantidos sob condições estáticas (Inserir estáticas).
Um grande número de células estavam presentes dentro da fracção de media (Figura 2B), mais notavelmente para inserções de cultura de células mantidas dentro de placas de ligação (baixos) Inserir estáticas e vasos rotativos sendo 50% e 51%respectivamente. Andaimes realizada nos cochos demonstraram um elevado número de células presentes no interior do próprio titular - 48% das células para Trough Shaker e 50% para Trough estático.
Microscopia eletrônica de varredura permitiram uma avaliação visual dos scaffolds de células-semeado (Figura 3). Imagens representativas em destaque uma presença limitada de células na superfície fibroso, independentemente de semear set-up. No entanto, um maior número de células e aglomerados celulares estavam presentes nos andaimes mantidos dentro das inserções de cultura de células e agitados a 30 rpm (Inserir Shaker).
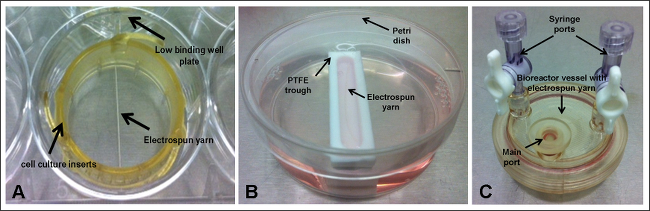
Figura 1. arranjos experimentais, onde electrospun Yarn é realizada dentro; (A) inserções de cultura de células e baixo bem placa de ligação; (B) poli (tetrafluoroetileno) (PTFE) cocho e placa de Petri; e (C) navio biorreator. Por favor, clique aqui para ver uma versão maior desta figura.
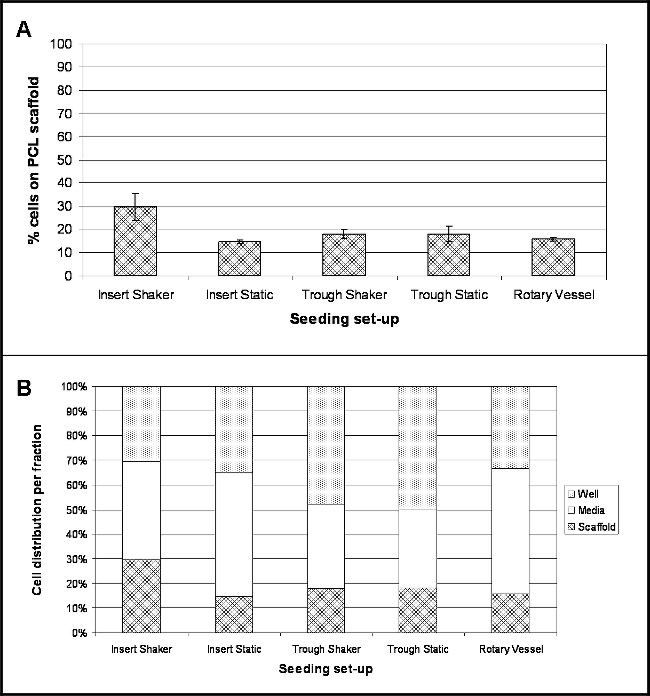
Figura 2. localização das células 4 horas pós-semeadura Onto PCL electrospun Yarns utilizando diferentes Sementeira set-ups. (A) Demonstra a percentagem de células que se ligaram ao andaime PCL (média ± desvio padrão); (B) evidencia a percentagem de propagação de célula local nas três fracções - meios de comunicação, e assim andaime (n = 4, apresentado como dados Os valores médios). Por favor, clique aqui para ver uma versão maior desta figura.

Figura 3. O representante Eletrônica de Varredura micrografias para PCL electrospun Yarns com mesenquimais humanas células-tronco, 4 horas após a semeadura inicial utilizando diferentes arranjos experimentais. (Todas as imagens na ampliação 1000X, barra de escala = 130 m.) Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
Matrizes de fibra electrospun fabricados a partir de biopolímeros são regularmente utilizados para apoiar a fixação das células e proliferação de biomateriais e / ou aplicações de engenharia de tecidos 11,12. Nestes casos, as matrizes são muitas vezes folhas finas de fibras que facilmente cobrir toda a base de uma placa de cultura de células e, assim, estão em contacto total com células semeadas que melhora a fixação das células. No entanto, se o cadafalso biomaterial não cobrir totalmente a base da placa bem, há uma grande chance de que uma grande proporção das células semeadas não vai ficar em contato com o cadafalso e, finalmente, não será capaz de anexar. Este estudo investigou vários métodos diferentes para a sementeira de células para andaimes que não cobrem a base da placa com cavidades, a fim de determinar uma técnica optimizada que pode ser recomendado para experiências futuras baseados em células.
Cinco diferentes set-ups foram investigados (Figura 1): ScaffoLDS (fio electrospun), realizada utilizando inserções de cultura de células dentro de placas de baixo bem ligação e ou mantidos sob condições estáticas ou agitado em 30 rpm; andaimes colocados dentro calhas PTFE estreitas e detidos estática ou abaladas em 30 rpm; e andaimes alojado dentro de vasos de biorreatores rotativas às 9 rpm. Determinar o número de células que tinham aderido aos fios electrospun por ensaio DNA demonstrou um baixo percentual de fixação para todos os semeando set-ups (Figura 2); e isto foi confirmado a partir de micrografias de varredura por electrões (SEM) (Figura 3). Fixação das células maior - 30% ou ~ 18.060 células -foi observado para os fios que foram realizadas dentro de inserções de cultura de células e sujeitos a movimento contínuo. Curiosamente, menor a fixação das células (15%) foi obtida para os fios mantidos por inserções de cultura de células, mas mantidos sob condições estáticas, o que sugere que a inclusão de movimento radial tem um efeito positivo sobre a manter as células em contacto com o andaime. No entanto,deve notar-se que circulando contínua de fluxo dos meios de comunicação pode ser responsável por aglomerados de células observadas a partir das imagens de SEM. O agitador de placas foi definido em sua configuração mais baixa - 30 rpm - o que poderia ser uma limitação para este set-up. Usando um movimento radial mais lenta pode ajudar a prevenir ou reduzir a aglomeração de células e também pode melhorar a fixação das células como células experimentará menos força. Experimentos futuros devem se concentrar em otimizar a velocidade do agitador ideal para uma melhor fixação das células. Incorporando movimento para fios realizadas dentro das calhas não resultou em uma tendência semelhante, com ambos os cenários produzindo 18% de fixação (~ 10.836 células); embora isto possa ser devido à flutuação parcial dos andaimes no interior das calhas (observada durante calhas colocadas no agitador de placas) por não terem sido ancoradas à base. Flutuante parcial do andaime vai impedir quaisquer células que se afundaram para o fundo da calha a partir de terem entrado em contacto com o material e aderente. Para tseu especial set-up, o cocho foi alojado dentro de um prato de petri e um volume total de 10 ml de media acrescentou. As pequenas dimensões da calha significa que a maior parte dos meios de comunicação está presente no interior da placa de petri e se houver qualquer movimento, as células podem afastar-se a partir da calha para a placa de petri e permanecer completamente fora do alcance do andaime. Para superar estas limitações, as experiências devem incluir um passo extra no protocolo, através do qual as extremidades dos andaimes são fixadas à base das calhas utilizando agulhas estéreis-finas, como este deve evitar a sua flutuação e movimento (particularmente para andaimes expostos a movimento radial), o que, em última análise deve levar a um aumento do número de células inerentes ao cadafalso. 16% de células tinham ligado aos fios presentes no interior dos vasos rotativos. Apesar de ser uma técnica bem estabelecida para a cultura 3D, os problemas que surgem com a remoção de andaimes do porto principal dos vasos, o que pode ter resultado em ATTAC vagamentecélulas HED sendo perdida. Os navios que pode ser totalmente aberto eliminaria este problema; estes estão disponíveis para aquisição, mas são consideravelmente mais caros do que os recipientes descartáveis utilizados neste estudo.
Este estudo demonstra os problemas atuais com a semeadura andaimes que não cobrem toda a base de placas de cultura de células normais. Semeando um número de celular conhecido resultou em menos de um terço de fixação para o cadafalso, apesar de a área de superfície do andaime permitindo a todas as células para aderir. Isto pode ter consequências prejudiciais em outros ensaios baseados em células, que pode avaliar o comportamento biocompatibilidade e célula-célula-célula de material / e interacções com a escora, tal como um potencial futuro dispositivo médico. As limitações do estudo podem incluir o ponto de momento de 4 h - apesar de ser suficientemente longo para garantir a sementeira inicial de células (células foram mostrados para prender firmemente a substratos dentro de trinta minutos 13,14,15), pode ser razoável emterrogam posteriores pontos temporais fornecimento de células não proliferam durante um espaço de tempo mais longo como este, de outra forma distorcer o número de células de partida. A redução do volume do meio, neste caso, 10 ml, poderiam também melhorar o contacto entre as células e andaime e, finalmente, aumentar a aderência celular. Futuros estudos devem considerar também a viabilidade celular como o processo de semeadura de células pode causar danos às células e / ou morte celular 16. Ensaios de ADN celular não diferenciar entre células viáveis e não viáveis, como a / ensaio mortos tal ao vivo, por exemplo, gostaria de destacar o nível de viabilidade.
Esta investigação aumenta a consciência para o número real de células que se ligam ao cadafalso apesar semeando uma quantidade conhecida. Para os estudos que se baseiam no número inicial de células, é muito importante que os pesquisadores sabem exatamente quantas daquela figura de fato aderir ao substrato de interesse.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
Os autores gostariam de agradecer e reconhecer o Conselho de Pesquisa Médica para o financiamento desta pesquisa - MRC-FAP código concessão G1000788-98812.
Materiais
| Name | Company | Catalog Number | Comments |
| Distilled water | in-house supply | n/a | |
| Ethanol | Merck | 1117271000 | |
| Phosphate Buffered Saline solution | Life Technologies | 70013016 | |
| Human mesenchymal stem cells | PromoCell GmbH | C-12974 | |
| MSC culture media | PromoCell GmbH | C-28010B | Warmed to 37 oC before use |
| Supplement mix | PromoCell GmbH | C-39810 | Add to culture media |
| Antibiotic/antimyotic mix | Sigma-Aldrich | A5955 | Add to culture media |
| Trypsin (0.05%) EDTA (0.02%) | Sigma-Aldrich | 59417C | Warmed to 37 °C before use |
| Cell culture flasks (T75) | Becton Dickinson Ltd | 353110 | |
| Low binding 6-well plates | Costar Corning | 3471 | |
| 6-well CellCrowns | Scaffdex | C00003S | |
| Petri-dish 50 ml deep | Sterilin | 124 | |
| PTFE troughs | in-house production | n/a | |
| Disposable RCCS vessels 10 ml | Synthecon | D-410 | |
| 4 Vessel Rotary Cell Culture System bioreactor | Synthecon | RCCS-4DQ | |
| Shaker plate | Stuart | SSM1 | Mini Orbital Shaker |
| Haemocytometer | Digital Bio | DHC-F01 | Disposable C-Chip |
| Centrifuge tube | Deltalab | 352096, 429901 | 15 ml and 50 ml |
| Centrifuge | Hettich | Rotafix 32 A | |
| Syringe 3 ml | Shield Medicare Ltd | 3039820 | |
| Pipettes | Sterilin | 40305, 47310, 40125 | 5, 10 and 25 ml |
| Gilson pipettes | SLS | F144801, F144802, F123600, F123601, F123602 | P2 - P1000 |
| Pipette tips | SLS | PIP7852, PIP7834, PIP7840 | |
| Micro test tube 1.5 ml | Eppendorf | 30125.15 | |
| Triton X-100 | Sigma | 9002-93-1 | |
| PicoGreen Assay | Invitrogen | P7589 | Assay set-up in the dark |
| Black 96-well plate | Greiner Bio One | 655086 | |
| Fluorescent plate-reader | BGM Labtech | FLUOstar Optima | |
| Glutaraldehyde 25% | TAAB Laboratories | G002 | Made to a concentration of 1.5% v/v in PBS |
| Hexamethyldisilazane (HMDS) | Sigma | 999-97-3 | |
| Aluminium stubs (SEM) | Agar Scientific | G301 | |
| Carbon tabs (SEM) | Agar Scientific | G3347N | |
| Gold sputter coater | Edwards | S150B | |
| Scanning Electron Microscope (SEM) | Phenom World | Phenom Pro |
Referências
- Jauregui, H. O. Cell adhesion to biomaterials. The role of several extracellular matrix components in the attachment of non-transformed fibroblasts and parenchymal cells. ASAIO transactions/American Society for Artificial Internal Organs. 33 (2), 66-74 (1986).
- Puca, A., Russo, G., Giordano, A. Properties of Mechano-Transduction via Simulated Microgravity and its Effects on Intracellular Trafficking of VEGFR's. Oncotarget. 3 (4), 426(2012).
- Vincent, L., Avancena, P., Cheng, J., Rafii, S., Rabbany, S. Y. Simulated microgravity impairs leukemic cell survival through altering VEGFR-2/VEGF-A signaling pathway. Annals of biomedical engineering. 33 (10), 1405-1410 (2005).
- Rungarunlert, S., Klincumhom, N., Tharasanit, T., Techakumphu, M., Pirity, M. K., Dinnyes, A. Slow Turning Lateral Vessel Bioreactor Improves Embryoid Body Formation and Cardiogenic Differentiation of Mouse Embryonic Stem Cells. Cellular Reprogramming. 15 (5), 443-458 (2013).
- Wu, X., Li, S. H., Lou, L. M., Chen, Z. R. The Effect of the Microgravity Rotating Culture System on the Chondrogenic Differentiation of Bone Marrow Mesenchymal Stem Cells. Molecular biotechnology. 54 (2), 331-336 (2013).
- Wang, Y., et al. Rotating Microgravity-Bioreactor Cultivation Enhances the Hepatic Differentiation of Mouse Embryonic Stem Cells on Biodegradable Polymer Scaffolds. Tissue Engineering Part A. 18 (21-22), 2376-2385 (2012).
- Lv, Q., Deng, M., Ulery, B. D., Nair, L. S., Laurencin, C. T. Nano-ceramic Composite Scaffolds for Bioreactor-based Bone Engineering. Clinical Orthopaedics and Related Research. 471 (8), 2422-2433 (2013).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. American Journal of Physiology-Renal Physiology. 281 (1), F12-F25 (2001).
- Bosworth, L. A., Alam, N., Wong, J. K., Downes, S. Investigation of 2D and 3D electrospun scaffolds intended for tendon repair. Journal of Materials Science: Materials in Medicine. 24 (6), 1605-1614 (2011).
- Dormer, N. H., Qiu, Y., Lydick, A. M., Allen, N. D., Mohan, N., Berkland, C. J., Detamore, M. S. Osteogenic differentiation of human bone marrow stromal cells in hydroxyapatite-loaded microsphere-based scaffolds. Tissue Engineering Part A. 18 (7-8), 757-767 (2011).
- Rayatpisheh, S., Heath, D. E., Shakouri, A., Rujitanaroj, P. O., Chew, S. Y., Chan-Park, M. B. Combining cell sheet technology and electrospun scaffolding for engineered tubular, aligned, and contractile blood vessels. Biomaterials. 35 (9), 2713-2719 (2014).
- Wismer, N., Grad, S., Fortunato, G., Ferguson, S. J., Alini, M., Eglin, D. Biodegradable electrospun scaffolds for annulus fibrosus tissue engineering: effect of scaffold structure and composition on annulus fibrosus cells in vitro. Tissue Engineering Part A. (3-4), 672-682 (2014).
- Yavin, E., Yavin, Z. Attachment and culture of dissociated cells from rat embryo cerebral hemispheres on polylysine-coated surface. The Journal of cell biology. 62 (2), 540-546 (1974).
- Chen, H. Guan, of focal adhesion kinase with its potential substrate phosphatidylinositol 3-kinase. Proceedings of the National Academy of Sciences. 91 (21), 10148-10152 (1994).
- Grant, D. S., Tashiro, K. -I., Segui-Real, B., Yamada, Y., Martin, G. R., Kleinman, H. K. Two different laminin domains mediate the differentiation of human endothelial cells into capillary-like structures in vitro. Cell. 58 (5), 933-943 (1989).
- Carrier, R. L., Papadaki, M., Rupnick, M., Schoen, F. J., Bursac, N., Langer, R., Freed, L. E., Vunkaj-Novakovic, G. Cardiac tissue engineering: cell seeding, cultivation parameters, and tissue construct characterization. Biotechnology and bioengineering. 64 (5), 580-589 (1999).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados