Method Article
Optimización de unión de las células madre mesenquimales humanas en poli (ε-caprolactona) electrohiladas Hilos
En este artículo
Resumen
This article describes a range of set-ups for seeding human mesenchymal stem cells onto materials, in this case electrospun yarns, that do not cover the base of standard culture well plates in order to maximize and quantify the number of cells that initially attach compared to the known seeding density.
Resumen
La investigación en biomateriales y la ingeniería de tejidos a menudo incluye las investigaciones basadas en células in vitro, que requieren conocimiento inicial del número de células de partida. Mientras que los investigadores comúnmente Referencia su densidad de siembra esto no indica necesariamente el número real de células que se han adherido al material en cuestión. Este es particularmente el caso de los materiales, o andamios, que no cubren la base de las placas de cultivo celular estándar bien. Este estudio investiga la fijación inicial de las células madre mesenquimales humanas sembradas a un número conocido en poli electrohiladas (ε-caprolactona) de hilo después de 4 horas en la cultura. Hilados electrohiladas se celebraron en varias configuraciones distintas, incluidos los buques de biorreactor que giran a 9 rpm, insertos de cultivo celular colocados en placas de pocillos vinculantes bajos y politetrafluoroetileno (PTFE) comederos colocados dentro de cajas de Petri. Los dos últimos fueron sometidos a cualquiera de las condiciones estáticas o colocados en un agitador de placas (30 37 ° C, 5% de CO 2, la ubicación de las células sembradas se determinó mediante el ensayo de ADN de la célula. Los andamios fueron retirados de sus envases y se colocan en tampón de lisis. La fracción de los medios de comunicación se retiró y se centrifugó de manera similar - se desechó el sobrenadante y pellet disuelta con tampón de lisis. El tampón de lisis se añadió a cada receptáculo, o bien, y raspado para liberar a las células que pueden estar presentes. El ensayo de ADN de la célula determinó el porcentaje de células presentes en el andamio, medios de comunicación y las fracciones así. La unión celular fue baja para todos los montajes experimentales, con mayor apego (30%) para los hilos celebradas en insertos de cultivo celular y sometidos a agitación movimiento. Este estudio plantea conciencia para el número real de células correspondientes a los andamios con independencia de la densidad de la siembra de células indicado.
Introducción
Andamios rutinariamente se están desarrollando e investigando para aplicaciones de biomateriales y la ingeniería tisular. Como tales, son comúnmente sembrados con células y su comportamiento in vitro caracterizadas a través de ensayos que determinan la proliferación celular y número de células, por ejemplo. Para los experimentos de este tipo, es imperativo que se conoce el número inicial de células y los investigadores a menudo indicar la concentración de siembra en términos de número de células por ml o 2 cm. Si bien esta es una buena práctica, especialmente con fines escala-up, que no tiene en cuenta el número real de células que se adhieren a la superficie de andamio (que también depende de las propiedades adhesivas de la superficie de biomaterial 1). Esto es especialmente cierto para andamios que no cubren la totalidad de la base de la placa de cultivo de células como células podrían caer fuera de la construcción y, debido a la naturaleza a menudo estática del experimento, nunca pueden venir de nuevo en contacto con el material de inteel descanso. Hilos de fibra Electrospun son un buen ejemplo de un andamio que no cubre la base del pozo (Figura 1). En este caso, y placas de unión bajas que no han sido tratados en la superficie se deben utilizar para evitar que las células se adhieran a la superficie de la placa y por lo tanto la distorsión de los resultados de cualquier ensayo bien fundamentada.
Y placas se utilizan fácilmente para la siembra de células en los andamios, pero no son el único método disponible. Sistemas de cultivos celulares de Rotary, un tipo de biorreactor desarrollado por la División de Ciencias de la Vida de la NASA en la década de 1980, de manera similar se pueden utilizar para sembrar andamios dentro de un entorno de tres dimensiones (3D) con la microgravedad simulada. Este tipo de biorreactor sigue siendo una opción popular entre los investigadores de todo el mundo y se ha incorporado en los estudios para la señalización celular 2,3, las células madre e ingeniería de tejidos 4,5 6,7. Lo que hace que el bioreactor rotativo preferible placas así es el mantenimientode un entorno 3D, que ayuda a evitar que las células diferenciadas a partir de dedifferentiating, como es a menudo el caso cuando se cultivan en condiciones convencionales 2D 8.
Este artículo investiga las diferentes técnicas para la siembra de células madre mesenquimales humanas en poli electrospun (ε-caprolactona) como hilos de fibra fabricada en Bosworth et al., 9 con el fin de maximizar el número inicial de células correspondientes a estos andamios dentro de un período de 4 h. Para el cultivo 2D, los hilos se llevaron a cabo de forma segura dentro y placas o (PTFE) comederos poli hechos a medida (tetrafluoroetileno) y se mantuvieron en condiciones estáticas, o agitaron a 30 rpm. Para la cultura 3D, se celebraron los hilos y las células dentro de los vasos de biorreactor que giran a 9 rpm.
Protocolo
Fabricación 1.Scaffold y Esterilización
- Disolver PCL en 1,1,1,3,3,3-hexafluoroisopropanol para dar un 10% w / v de concentración. Como se describe en Bosworth et al, 9 electrospin las solución polimérica (parámetros: 20 kV, 1 ml / hr, 20 cm). Y recoger fibras alineadas en el borde de un mandril giratorio (600 rpm). Con un bisturí quitar la cinta de fibra de recogida y luego se corta en tramos más cortos - 3 cm (para canales y vasos rotativos) y 4 cm (para cultivo celular insertos) longitudes.
- Con unas pinzas finas tiras individuales sumergen en agua destilada y se eliminan.
- La celebración de los dos extremos entre el pulgar y el dedo índice; gire manualmente la tira hasta que se asemeja hilo.
- Brevemente sumergir este andamiaje de hilo en agua destilada y colocar en limpio de la tarjeta, no fibrosa que se seque.
- Una vez seco, el lugar individualmente en tubos de microcentrífuga limpios y añadir 1 ml de 50% v / v de etanol en agua destilada. Cierre las tapas y dejar actuar durante 24 hr.
Nota: Realice los siguientes pasos bajo flujo laminar: - Colocar tubos de microcentrífuga en una cabina de flujo laminar y aspirar la solución 50% v / v. Reemplazar con 1 ml de 70% v / v de etanol en agua destilada, cerrar los párpados y dejar actuar durante 24 hr.
- Repita para 90% y 100% v / v de etanol en agua destilada (1 ml volúmenes).
- Wash andamios dos veces con solución salina tamponada con fosfato (PBS), 24 hr por lavado (2 x 1 ml).
- Retire PBS y reemplazar con 1 ml de medio de cultivo celular. Nota: Los andamios están listos para su uso posterior a las 24 horas.
2. La determinación de la zona Andamios superficie y número de células
- Utilizando un microscopio de luz y las imágenes de software, medir el diámetro del hilo electrospun largo de su longitud para determinar un valor medio.
- Suponga que el hilo a ser una varilla cilíndrica y aproximar el área de la superficie usando:
- Donde A = área de superficie, r = radio y h = longitud
Nota: El área de superficie se calculó que era 18.902, 800 m 2. Además, debe tenerse en cuenta que el área de superficie real será mayor que este cálculo como el hilo se compone de cientos de fibras finas, lo que aumentará el área de superficie. En consecuencia, un mayor número de células debe ser capaz de conectar al cadalso. Sin embargo, esto no afecta a una comparación directa entre los grupos de prueba que se hizo. - Determinar el número máximo de células que podrían unirse a la superficie del andamio expuesta por:
Nota: El uso de un microscopio y software de imágenes de la luz, el diámetro de las células madre mesenquimatosas humanas se determinó que era 20 micras (suponiendo que las células son redondas), por lo tanto, en este caso, el número de células = 60.200.
3. Andamios Set-up - Cultivo Celular Inserción (Figura 1 A)
- Bajo flujo laminar, abra los 6 pocillos insertos de cultivo de células estériles y separar los anillos más cortos con los dientes de los cuerpos más amplia anilladas.
- Tome el anillo con los dientes apuntando hacia arriba. Coloque unode los andamios 4 cm sobre el centro del anillo asegurándose de que se superpone en ambos lados. Tome el cuerpo anillado y la posición sobre el anillo dentado y andamio y empuje hacia abajo asegurándose de que el andamio se mantiene en posición y se encuentra a través del centro del inserto de cultivo celular.
- Coloque el inserto de cultivo celular con el andamio en el pozo de un pozo 6, la placa de unión de baja.
- Añadir 10 ml de medios de cultivo para el cadalso.
4. Andamios Set-up - Trough (Figura 1B)
- Bajo flujo laminar, el lugar de poli (tetrafluoroetileno) (PTFE) artesas en placas de Petri individuales y añadir 10 ml de medios de cultivo para el comedero.
- El uso de pinzas cubren uno de los 3 cm andamios en la pila, asegurándose de que su longitud se encuentra paralelo al borde más largo de la artesa.
5. Andamios Set-up - biorreactor de buques (Figura 1C)
- Bajo flujo laminar, dispense 10 ml de PBS estéril a través del biorreactor buque depuerto principal y dejar durante 10 minutos.
- Retire el PBS y reemplazar con 8 ml de medios de cultivo.
- El uso de pinzas, insertar uno de los andamios 3 cm en el recipiente a través del puerto principal.
- Cerrar el puerto principal.
Conteo 6. celular
- Células de cultivo madre mesenquimales humanas (hMSC) derivadas de médula ósea de acuerdo con el protocolo del fabricante hasta el paso 4 antes de la recolección.
- Aspirar los medios de comunicación a partir de un 75 cm 2 matraz que contiene hMSC derivadas de médula ósea (paso 4, 80% de confluencia).
- Se lavan las células con 10 ml de PBS estéril y aspirar.
- Añadir 3 ml de tripsina y se incuba el matraz a 37 ° C, 5% de CO 2 hasta que las células han desplazado de la superficie del matraz.
- Añadir 7 ml de medio de cultivo para inactivar la enzima y transferir este volumen total (10 ml) a un tubo de centrífuga.
- Resuspender esta suspensión celular pipeteando arriba y abajo varias veces para dispersar homogéneamente células dentro de lamedios de comunicación y aglomerados de células límite (10 ml pipeta).
- Retire 20 l de suspensión celular y la transferencia a un hemocitómetro.
- Coloque el hemocitómetro bajo un microscopio de luz y la imagen objetivo en x10.
- Centrarse las líneas de división y contar el número de células en los 4 x 4 plazas en cada rincón de la red y que están incluidas en la plaza y los que cruzan la mano derecha o la línea límite inferior. Contar para cada conjunto de 4 x 4 plazas (4 cuentas por la red).
- Repita la resuspensión y recuento de células tres veces (pasos 6.6 a 6.9).
- Calcular el promedio de recuento de células y determinar el volumen de los medios necesarios para la resuspensión de células (concentración de células 60.200 en 200 l). Por ejemplo, determinar el recuento de células promedio desde el hemocitómetro y luego determinar el número promedio total de las células de los tres cargos separados. Multiplique esto por 1 x 10 4 para dar el número de células por ml y luego se multiplica por el volumen total de la suspensión celular para dar anúmero tal de células. Utilice la siguiente ecuación para determinar el volumen de los medios necesarios para la resuspensión:
- Centrifugar la suspensión celular a 241 xg durante 5 min.
Siembra 7. celular
- Aspirar los medios de comunicación desde el tubo de centrifugado dejando el sedimento celular y reemplazar con el volumen de medio calculado.
- Resuspender las células y los medios de comunicación para una incluso mezclar.
- Utilizando una pipeta Gilson P200, dispensar lentamente 200 l de suspensión celular en cada andamio mediante la ejecución de la punta de la pipeta a lo largo de la longitud del andamio y por debajo de la superficie del líquido medios de comunicación. Dejar reposar durante 20 minutos.
- Para los buques de biorreactores, dispense 200 l de suspensión celular a través del puerto principal. Top-up el medio de cultivo 2 ml restantes a través de los puertos de jeringa para dar un volumen total de 10 ml.
8. Experimental Inicio
- La transferencia de los vasos de biorreactores para el biorreactor RCCS-4DQ y se puso a girar a 9 rpm.
- TranSfer los pocillos con insertos de cultivo celular y mínimos para el agitador de placas y se puso a girar a 30 rpm.
- Transferir las placas de pocillos con insertos de cultivo celular y valles a la plataforma de un incubador de células fijado en 37 ° C, 5% de CO 2 (cultivo estático).
9. Ensayo de ADN
- Preparar soluciones - tampón de lisis, tampón 1x TE, patrones de ADN y la solución de trabajo del ADN celular - como por las instrucciones del fabricante.
- Después de 4 horas, retire las muestras de la incubadora y colocar bajo flujo laminar.
- Retire las fracciones de los medios de todas las muestras y colocar en tubos de centrífuga etiquetados por separado. Centrifugar los tubos 241 xg. Eliminar el sobrenadante y añadir tampón de lisis 3 ml. Resuspender la solución a romper la sedimento celular.
- Con unas pinzas eliminar los andamios y lugar en tubos de centrífuga que contienen 3 ml de tampón de lisis (para los andamios dentro de los vasos de biorreactores, quitar el andamio antes de aspirar el media). Para andamios celebradas en insertos de cultivo celular, primero liberar el andamio cortando el andamio cerca de la orilla del inserto utilizando un bisturí.
- Añadir 3 ml de tampón de lisis a cada receptáculo de andamio y raspar la superficie (agitar vigorosamente durante los vasos de biorreactor). Retire el tampón de lisis y colocar en tubos de centrífuga etiquetados por separado.
- Vortex cada tubo de centrífuga durante aproximadamente 1 min para asegurar la agitación suficiente de las células y el tampón y para fomentar la lisis de la membrana celular.
- En un plato negro de 96 pocillos, añadir 100 l de tampón de lisis para cada fracción de la muestra - andamios, medios de comunicación y también (duplicar).
- En la oscuridad, añadir 100 l de solución de ADN de la célula a todos los pocillos que contienen tampón de lisis y mezclar suavemente.
- Incluir los pocillos con tampón de lisis que no contenía solución de ADN y ADN de la célula para proporcionar un control negativo y positivo para la placa de pocillos.
- Usando una fluorescencia lector de placas, medir la absorbancia del pocillos utilizando 485 nm de excitación y 520 nm de emisión.
- Comparar los datos con la curva estándar generada a partir de los patrones de ADN como por las instrucciones del fabricante.
10. microscopio electrónico de barrido (SEM) Fijación
- Realice los siguientes pasos bajo flujo laminar: Después de 4 horas, retire todos los andamios de sus receptáculos y lugar dentro de una nueva placa de 6 pocillos (pocillos separados).
- Lave los andamios dos veces con PBS.
- Realice los pasos siguientes en el banco abierto: Para cada bien, añadir 2 ml de 1,5% v / v glutaraldehído en PBS para asegurar una cobertura completa del andamio.
- Deje la placa por un mínimo de 30 minutos a 4 ° C para la fijación celular.
- Eliminar la solución de fijador y lavar los andamios dos veces con PBS.
- Deshidratar los andamios con concentraciones crecientes de etanol en agua destilada a partir de 50% v / v, seguido de 70% v / v y 90% v / v. Para cada concentración, sumerja completamente los andamios en SOLUTIOn (2 ml) y se deja durante 3 min. Deseche la solución y repita.
- Deshidratar en etanol al 100% en sumergir totalmente los andamios en solución (2 ml) y dejar durante 5 min. Deseche la solución y repita.
- Químicamente secar los andamios utilizando hexametildisilazano (HMDS) dentro de una campana de humos. Sumerja los andamios en HMDS (2 ml) y se deja durante 5 min. Retire los HMDS y repetir.
- Retire los HMDS y permitir que los andamios se sequen. Montar los andamios sobre los talones de SEM disponibles en el mercado (en este caso los trozos de acero inoxidable con lengüetas adhesivas de carbono).
- Para facilitar la visualización dentro del SEM, recubrir las muestras usando una máquina de recubrimiento de oro de deposición durante 2 minutos para asegurar una cobertura fina y uniforme.
- Colocar las muestras dentro de la SEM y visualizar los andamios sembrado de células utilizando un haz de electrones 5 KeV.
Resultados
Los resultados ponen de manifiesto la ubicación de las células siguientes 4 horas después de la siembra para cada experimental investigado. Figura 2A muestra el porcentaje de células que se han unido a la superficie del andamio durante este tiempo. Un factor de conversión de 8,5 pg / célula se usó para convertir el contenido de ADN medido en el número de células y por lo tanto determinar el porcentaje de células 10. Para todos los montajes de siembra investigados, el porcentaje de unión celular es relativamente baja, con mayor adherencia de las células (30%) para andamios celebradas en insertos de cultivo celular y se agitó a 30 rpm (Insertar Shaker). Adherencia más bajo (15%) fue para andamios celebradas dentro de los insertos de cultivo celular y se mantiene bajo condiciones estáticas (Insertar estáticas).
Un gran número de las células estaban presentes dentro de la fracción papel (Figura 2B), sobre todo para las inserciones de cultivo de células mantenidas en placas bajas vinculantes (Insertar estáticas) y buques rotativos son 50% y 51%respectivamente. Andamios celebradas dentro de los canales demostraron un número elevado de células presentes en el propio titular - 48% de las células de Trough Shaker y el 50% para Trough estático.
Microscopía electrónica de barrido permitió una evaluación visual de los andamios sembrado de células (Figura 3). Imágenes representativas destacan una presencia limitada de las células en la superficie fibrosa, con independencia de la siembra de puesta a punto. Sin embargo, un mayor número de células y aglomerados de células estaban presentes en los andamios mantenidos dentro de los insertos de cultivo celular y se agitó a 30 rpm (Insertar Shaker).
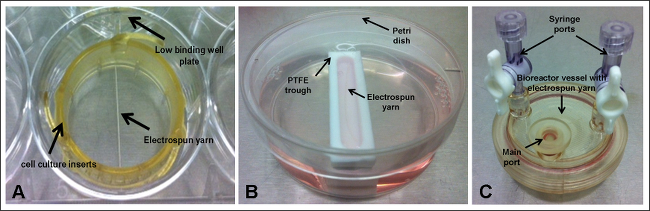
Figura 1. montajes experimentales, donde Electrospun hilado se mantiene dentro; (A) insertos de cultivo celular y la placa de unión bien bajo; (B) poli (tetrafluoroetileno) (PTFE) artesa y placa de Petri; y (C) recipiente biorreactor. Haga clic aquí para ver una versión más grande de esta figura.
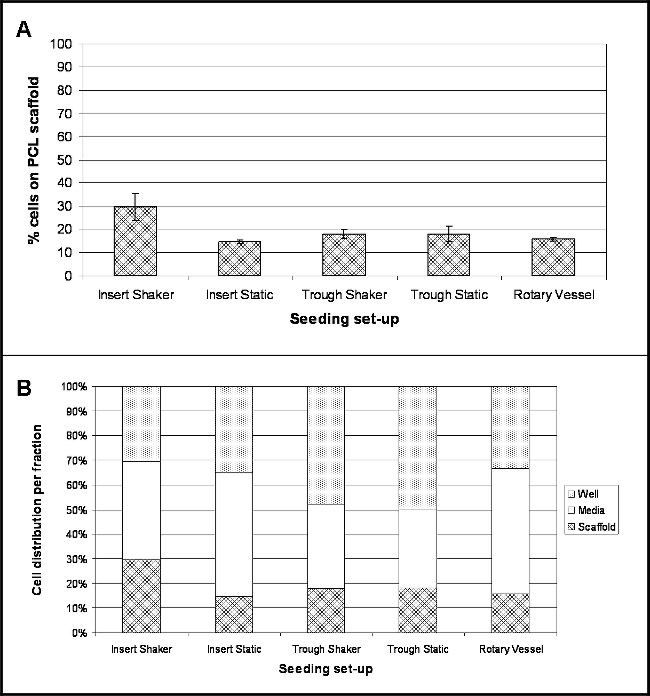
Figura 2. Ubicación de las células 4 horas después de la siembra Onto PCL Electrospun Hilos utilizando diferentes Siembra Set-ups. (A) demuestra el porcentaje de células que se han adherido al cadalso PCL (media ± desviación estándar), (B) destaca la propagación porcentaje de ubicación de la celda dentro de las tres fracciones - los medios de comunicación, bien y andamio (n = 4, los datos presentados como los valores medios). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Representante Scanning Electron micrografías para PCL electrohiladas Los hilos con células madre mesenquimales humanas, 4 horas después de la siembra inicial utilizando diferentes montajes experimentales. (Todas las imágenes con una ampliación 1.000X, barra de escala = 130 micras.) Haga clic aquí para ver una versión más grande de esta cifra.
Discusión
Matrices de fibra electrospun fabricados a partir de biopolímeros se utilizan regularmente para apoyar la unión de células y la proliferación para aplicaciones de biomateriales y / o de ingeniería de tejidos 11,12. En estos casos, las matrices son a menudo finas láminas de fibras que cubren fácilmente toda la base de una placa de cultivo celular y por lo tanto están en contacto completo con las células sembradas que mejora la unión celular. Sin embargo, si el andamio biomaterial no cubre completamente la base de la placa así, hay una alta probabilidad de que una gran proporción de las células sembradas no se quedará en contacto con el andamio y en última instancia, no podrá adjuntar. Este estudio investigó varios métodos diferentes para la siembra de células sobre andamios que no cubren la base de la placa, así, con el fin de determinar una técnica optimizada que podrían recomendarse para futuros experimentos basados en células.
Cinco diferentes montajes fueron investigados (Figura 1): Scaffolds (hilo electrospun) realizó utilizando insertos de cultivo celular en placas bajas así vinculante y sea mantenido bajo condiciones estáticas o sacudido a 30 rpm; andamios colocados dentro de depresiones PTFE estrechas y celebradas estática o sacudido a 30 rpm; y andamios alojados dentro de los vasos de biorreactor que giran a 9 rpm. Determinación del número de células que se habían adherido a los hilos electrospun por ensayo de ADN demostró un bajo porcentaje de unión para todos los montajes de siembra (Figura 2); y esto fue confirmado más lejos de micrografías electrónicas de exploración (SEM) (Figura 3). Greatest unión de las células - 30% o ~ 18.060 células -era observaron para los hilos que se celebraron en insertos de cultivo celular y sometidos a un movimiento continuo. Curiosamente, la unión de células más bajo (15%) se logró para hilos en poder de los insertos de cultivo celular, pero mantenido en condiciones estáticas, lo que sugeriría que la inclusión del movimiento radial tiene un efecto positivo en mantener las células en contacto con el andamio. No Obstante,cabe señalar que en circuito continuo de flujo de los medios podría ser responsable de los aglomerados de células observadas de las imágenes de SEM. El agitador de placas se encuentra en su posición más baja - 30 rpm - lo que podría ser una limitación a esta configuración. Con un movimiento radial más lenta puede ayudar a prevenir o reducir la aglomeración de células y también podría mejorar la unión celular como células experimentarán menos fuerza. Experimentos futuros deberían centrarse en la optimización de la velocidad de vibración ideal para mejorar la fijación de las células. La incorporación de movimiento para hilos celebradas dentro de los canales no dio lugar a una tendencia similar, con ambos escenarios rendimiento 18% apego (~ 10.836 células); aunque esto puede ser debido a la flotación parcial de los andamios dentro de las artesas (observado para artesas colocados en el agitador de placas) ya que no estaban ancladas a la base. Flotante parcial del andamio evitará cualquier células que han hundido hasta el fondo de la cubeta entre en contacto con el material y adherente. Para tsu especial configuración, la artesa se encuentra dentro de una placa de Petri y un volumen total de 10 ml de medio añadió. Las pequeñas dimensiones de la cuba significa que la mayoría de los medios de comunicación está presente dentro de la placa de Petri y si hay cualquier movimiento, las células se puede alejar de la cubeta en el plato petri y permanecer completamente fuera del alcance del andamio. Para superar estas limitaciones, experimentos adicionales deben incluir un paso adicional en el protocolo, por lo que los extremos de los andamios se fijan a la base de las cubetas utilizando finas agujas estériles, ya que esto debería evitar su flotación y movimiento (en particular para los andamios expuestos a movimiento radial), que en última instancia deberían conducir a un mayor número de células que unen al cadalso. 16% de las células se había unido a los hilos presentes dentro de los vasos rotativos. A pesar de ser una técnica bien establecida para la cultura en 3D, los problemas surgieron con la retirada de los andamios del principal puerto de los buques, lo que puede haber dado lugar a ATTAC vagamentecélulas hed están perdiendo. Los buques que se pueden abrir totalmente eliminaría este problema; estos están disponibles para la compra, pero son considerablemente más caros que los vasos desechables utilizados en este estudio.
Este estudio demuestra los problemas actuales con la siembra de los andamios que no cubren toda la base de placas estándar y de cultivo celular. Siembra un número de células conocida resultó en menos de un tercio de fijación al cadalso, a pesar de la superficie del andamio que permite que todas las células se adhieran. Esto podría tener consecuencias perjudiciales en otros ensayos basados en células que pueden evaluar la biocompatibilidad y célula-material de / célula-célula comportamiento y las interacciones con el andamio como un futuro dispositivo médico potencial. Otras limitaciones del estudio pueden incluir el punto de tiempo de 4 h - a pesar de ser lo suficientemente largo para garantizar la siembra de células inicial (células se ha demostrado que adherirse firmemente a sustratos en treinta minutos 13,14,15), puede ser razonable envestigate puntos de tiempo posteriores proporcionar células no proliferan durante un plazo de tiempo más largo, ya que de lo contrario sesgar el número de células de partida. Reducir el volumen de los medios de comunicación, en este caso 10 ml, podría también mejorar el contacto entre las células y andamio y en última instancia, aumentar la unión celular. Los estudios futuros también deben considerar la viabilidad celular como el proceso de la siembra de células puede causar daño celular y / o muerte celular 16. Análisis de ADN de la célula no diferencian entre células viables y no viables, como un ensayo en vivo / muerto como, por ejemplo, pondría de relieve el nivel de viabilidad.
Esta investigación plantea la conciencia con el número real de las células que se adhieren al cadalso a pesar de sembrar una cantidad conocida. Para los estudios que se basan en el número de partida de las células, es muy importante que los investigadores saben exactamente cuántos de esa cifra, de hecho, adherirse al sustrato de interés.
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
Los autores desean agradecer y reconocer el Consejo de Investigación Médica para la financiación de esta investigación - MRC-FAP código concesión G1000788-98812.
Materiales
| Name | Company | Catalog Number | Comments |
| Distilled water | in-house supply | n/a | |
| Ethanol | Merck | 1117271000 | |
| Phosphate Buffered Saline solution | Life Technologies | 70013016 | |
| Human mesenchymal stem cells | PromoCell GmbH | C-12974 | |
| MSC culture media | PromoCell GmbH | C-28010B | Warmed to 37 oC before use |
| Supplement mix | PromoCell GmbH | C-39810 | Add to culture media |
| Antibiotic/antimyotic mix | Sigma-Aldrich | A5955 | Add to culture media |
| Trypsin (0.05%) EDTA (0.02%) | Sigma-Aldrich | 59417C | Warmed to 37 °C before use |
| Cell culture flasks (T75) | Becton Dickinson Ltd | 353110 | |
| Low binding 6-well plates | Costar Corning | 3471 | |
| 6-well CellCrowns | Scaffdex | C00003S | |
| Petri-dish 50 ml deep | Sterilin | 124 | |
| PTFE troughs | in-house production | n/a | |
| Disposable RCCS vessels 10 ml | Synthecon | D-410 | |
| 4 Vessel Rotary Cell Culture System bioreactor | Synthecon | RCCS-4DQ | |
| Shaker plate | Stuart | SSM1 | Mini Orbital Shaker |
| Haemocytometer | Digital Bio | DHC-F01 | Disposable C-Chip |
| Centrifuge tube | Deltalab | 352096, 429901 | 15 ml and 50 ml |
| Centrifuge | Hettich | Rotafix 32 A | |
| Syringe 3 ml | Shield Medicare Ltd | 3039820 | |
| Pipettes | Sterilin | 40305, 47310, 40125 | 5, 10 and 25 ml |
| Gilson pipettes | SLS | F144801, F144802, F123600, F123601, F123602 | P2 - P1000 |
| Pipette tips | SLS | PIP7852, PIP7834, PIP7840 | |
| Micro test tube 1.5 ml | Eppendorf | 30125.15 | |
| Triton X-100 | Sigma | 9002-93-1 | |
| PicoGreen Assay | Invitrogen | P7589 | Assay set-up in the dark |
| Black 96-well plate | Greiner Bio One | 655086 | |
| Fluorescent plate-reader | BGM Labtech | FLUOstar Optima | |
| Glutaraldehyde 25% | TAAB Laboratories | G002 | Made to a concentration of 1.5% v/v in PBS |
| Hexamethyldisilazane (HMDS) | Sigma | 999-97-3 | |
| Aluminium stubs (SEM) | Agar Scientific | G301 | |
| Carbon tabs (SEM) | Agar Scientific | G3347N | |
| Gold sputter coater | Edwards | S150B | |
| Scanning Electron Microscope (SEM) | Phenom World | Phenom Pro |
Referencias
- Jauregui, H. O. Cell adhesion to biomaterials. The role of several extracellular matrix components in the attachment of non-transformed fibroblasts and parenchymal cells. ASAIO transactions/American Society for Artificial Internal Organs. 33 (2), 66-74 (1986).
- Puca, A., Russo, G., Giordano, A. Properties of Mechano-Transduction via Simulated Microgravity and its Effects on Intracellular Trafficking of VEGFR's. Oncotarget. 3 (4), 426 (2012).
- Vincent, L., Avancena, P., Cheng, J., Rafii, S., Rabbany, S. Y. Simulated microgravity impairs leukemic cell survival through altering VEGFR-2/VEGF-A signaling pathway. Annals of biomedical engineering. 33 (10), 1405-1410 (2005).
- Rungarunlert, S., Klincumhom, N., Tharasanit, T., Techakumphu, M., Pirity, M. K., Dinnyes, A. Slow Turning Lateral Vessel Bioreactor Improves Embryoid Body Formation and Cardiogenic Differentiation of Mouse Embryonic Stem Cells. Cellular Reprogramming. 15 (5), 443-458 (2013).
- Wu, X., Li, S. H., Lou, L. M., Chen, Z. R. The Effect of the Microgravity Rotating Culture System on the Chondrogenic Differentiation of Bone Marrow Mesenchymal Stem Cells. Molecular biotechnology. 54 (2), 331-336 (2013).
- Wang, Y., et al. Rotating Microgravity-Bioreactor Cultivation Enhances the Hepatic Differentiation of Mouse Embryonic Stem Cells on Biodegradable Polymer Scaffolds. Tissue Engineering Part A. 18 (21-22), 2376-2385 (2012).
- Lv, Q., Deng, M., Ulery, B. D., Nair, L. S., Laurencin, C. T. Nano-ceramic Composite Scaffolds for Bioreactor-based Bone Engineering. Clinical Orthopaedics and Related Research. 471 (8), 2422-2433 (2013).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. American Journal of Physiology-Renal Physiology. 281 (1), F12-F25 (2001).
- Bosworth, L. A., Alam, N., Wong, J. K., Downes, S. Investigation of 2D and 3D electrospun scaffolds intended for tendon repair. Journal of Materials Science: Materials in Medicine. 24 (6), 1605-1614 (2011).
- Dormer, N. H., Qiu, Y., Lydick, A. M., Allen, N. D., Mohan, N., Berkland, C. J., Detamore, M. S. Osteogenic differentiation of human bone marrow stromal cells in hydroxyapatite-loaded microsphere-based scaffolds.. Tissue Engineering Part A. 18 (7-8), 757-767 (2011).
- Rayatpisheh, S., Heath, D. E., Shakouri, A., Rujitanaroj, P. O., Chew, S. Y., Chan-Park, M. B. Combining cell sheet technology and electrospun scaffolding for engineered tubular, aligned, and contractile blood vessels. Biomaterials. 35 (9), 2713-2719 (2014).
- Wismer, N., Grad, S., Fortunato, G., Ferguson, S. J., Alini, M., Eglin, D. Biodegradable electrospun scaffolds for annulus fibrosus tissue engineering: effect of scaffold structure and composition on annulus fibrosus cells in vitro. Tissue Engineering Part A. (3-4), 672-682 (2014).
- Yavin, E., Yavin, Z. Attachment and culture of dissociated cells from rat embryo cerebral hemispheres on polylysine-coated surface. The Journal of cell biology. 62 (2), 540-546 (1974).
- Chen, H. Guan, of focal adhesion kinase with its potential substrate phosphatidylinositol 3-kinase. Proceedings of the National Academy of Sciences. 91 (21), 10148-10152 (1994).
- Grant, D. S., Tashiro, K. -. I., Segui-Real, B., Yamada, Y., Martin, G. R., Kleinman, H. K. Two different laminin domains mediate the differentiation of human endothelial cells into capillary-like structures in vitro. Cell. 58 (5), 933-943 (1989).
- Carrier, R. L., Papadaki, M., Rupnick, M., Schoen, F. J., Bursac, N., Langer, R., Freed, L. E., Vunkaj-Novakovic, G. Cardiac tissue engineering: cell seeding, cultivation parameters, and tissue construct characterization. Biotechnology and bioengineering. 64 (5), 580-589 (1999).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados