Method Article
الجينوم على نطاق فحص التفاعلات بين البروتينات التي كتبها البروتين جزء التكملة الفحص (PCA) في الخلايا الحية
In This Article
Summary
Proteins interact with each other and these interactions determine in a large part their functions. Protein interaction partners can be identified at high-throughput in vivo using a yeast fitness assay based on the dihydrofolate reductase protein-fragment complementation assay (DHFR-PCA).
Abstract
Proteins are the building blocks, effectors and signal mediators of cellular processes. A protein’s function, regulation and localization often depend on its interactions with other proteins. Here, we describe a protocol for the yeast protein-fragment complementation assay (PCA), a powerful method to detect direct and proximal associations between proteins in living cells. The interaction between two proteins, each fused to a dihydrofolate reductase (DHFR) protein fragment, translates into growth of yeast strains in presence of the drug methotrexate (MTX). Differential fitness, resulting from different amounts of reconstituted DHFR enzyme, can be quantified on high-density colony arrays, allowing to differentiate interacting from non-interacting bait-prey pairs. The high-throughput protocol presented here is performed using a robotic platform that parallelizes mating of bait and prey strains carrying complementary DHFR-fragment fusion proteins and the survival assay on MTX. This protocol allows to systematically test for thousands of protein-protein interactions (PPIs) involving bait proteins of interest and offers several advantages over other PPI detection assays, including the study of proteins expressed from their endogenous promoters without the need for modifying protein localization and for the assembly of complex reporter constructs.
Introduction
شبكات التفاعل البروتين (دبابيس) تقدم قرارا خريطة منخفضة من كيفية تنظيم البروتينات وظيفيا في الخلية 1. كل اتصال فعلي بين اثنين من البروتينات، أو تفاعل البروتين البروتين (PPI)، قد تمثل الجمعية التي هي مستقرة في الوقت المناسب، مثل تلك التي وجدت داخل المجمعات البروتين والتي تساهم في التنظيم الهيكلي للخلية. قد تمثل هذه الاتصالات أيضا الجمعيات عابرة التي تنظم النشاط والاستقرار والتوطين والتفاعلات بين الشريكين. تحديد الشركاء التفاعل المادي للبروتين معين بالتالي يوفر المعلومات الغنية على وظيفة والتنظيم لهذا البروتين 2،3. لهذه الأسباب، وقد وضعت جهود كبيرة نحو رسم الخرائط من الدبابيس في الكائنات النموذج، بما في ذلك كولاي 4-6 ونبات الأرابيدوبسيس thaliana 7، خميرة الخباز 8-12، ذبابة الفاكهة البطن </ م> 13، انواع معينة ايليجانس 14 والانسان العاقل 15. وقد وفرت هذه الدراسات معلومات هامة عن كيفية تنظيم البروتينات في الخلية وبالتالي المعلومات الأساسية على البروتينات مع وظائف لم تكن معروفة سابقا.
وقد وضعت عدة استراتيجيات على مر السنين لدراسة الدبابيس. هذه التقنيات يمكن تصنيفها على نطاق واسع في ثلاث فئات على أساس هذا النوع من المعلومات التي يقدمونها على مثبطات مضخة البروتون (استعراضها في 16-18). ويستند أول واحد على الخميرة اثنين الهجين ومشتقاته 19. توفر هذه التقنيات من المعلومات عن ارتباط مباشر بين أزواج من البروتينات، التي تسمح ببناء شبكات الثنائية. ويستند الأسرة الثانية على تنقية تقارب من البروتينات الطعم وتحديد الشركاء المرتبطة بها، مثل تنقية تقارب تليها قياس الطيف الكتلي 20. هذه النهج تحديد مجموعات من البروتينات التي هي مباشرةأو المرتبطة بشكل غير مباشر، عموما بطريقة مستقرة، وتكون قوية للغاية لتحديد المجمعات البروتين. ويستند هذا النهج الثالث على المقايسات تكامل البروتين شظية (PCAs) 11،21. ويوفر هذا النهج على المستوى المتوسط من قرار بين النهجين السابقة، لأنها تتيح الكشف عن جمعيات مباشرة والداني بين البروتينات. كل تقنية لها قوتها الخاصة والضعف، كما استعرضت مؤخرا 18.
وPIN حقيقية النواة أفضل وصف هو إلى حد بعيد واحدة من الخميرة في مهدها خميرة الخباز، ويرجع ذلك جزئيا بروتيوم منه هو نسبيا أقل تعقيدا من تلك التي حقيقيات النوى نموذج الأخرى، ولأن المقايسات الإنتاجية العالية للكشف عن وأول مرة يتم يعاير مثبطات مضخة البروتون وأكثر كفاءة تنفيذها في هذا النموذج الحي 9-12. وهناك طريقة قوية بشكل خاص لنظام الخميرة هو اختزال ثنائي هيدروالفولات البروتين شظية تكامل فحص (DHFR-PCA)، مقايسة التي كانتيستخدم في سياقات مختلفة لدراسة PIN الخميرة في الظروف القياسية ومضطرب 11،22-26. ويعتمد هذا الأسلوب على فحص البقاء على قيد الحياة التي تمكن من الكشف عن مثبطات مضخة البروتون المباشرة وشبه المباشرة لبروتين الطعم يعطى في كل من مستويات التعبير الذاتية وتعريب التحت خلوية الأصلية للشركاء التفاعل 11،21 بطريقة كمية 27. إشارة تم الحصول عليها باستخدام هذا الاختبار (أي حجم مستعمرة على صفائف مستعمرة عالية الكثافة) وبالتالي يعكس كمية البروتين المجمعات التي تشكلت بين الطعم والفريسة في بيئة الخلوية يعادل تقريبا إلى واحدة من الخلايا من النوع البري. ويستند هذا الفحص على إعادة تشكيل انزيم مراسل تشارك في عملية الأيض حمض الفوليك، واختزال ثنائي هيدروالفولات (DHFR)، حيث يتم جلب اثنين من شظايا التكميلية للDHFR التي تنصهر فيها لاثنين من البروتينات ذات الاهتمام إلى القرب عندما تتفاعل البروتينات اللتين بدوره يؤدي إلى إعادة عكسها من نشاط انزيم 11 ونمو السلالة على المتوسط تحتوي على الميثوتريكسيت (MTX، الشكل 1). هذا المركب يثبط انزيم DHFR الذاتية، ولكن ليست واحدة تحور المستخدمة في فحص 28. مجموعتين من سلالات PCA، واحدة تحتوي على ~ 4،300 ماتا سلالات مع تنصهر ORF إلى DHFR F [1،2] شظية واحدة تحتوي على ~ 4،800 MAT α سلالات مع تنصهر ORF إلى DHFR [3] جزء، ويمكن شراؤها ل تنفيذ DHFR-PCA على نطاق صغير أو كبير في أي مختبر. هنا، نحن تصف بروتوكول عام ولكن مفصلا إلى الشاشة لمثبطات مضخة البروتون بين واحد من البروتين الطعم و~ 4،800 البروتينات فريسة باستخدام هذا الاختبار.
Protocol
1. البناء / التحقق من بيت سلالات
- إذا كانت سلالة الطعم ذات الاهتمام متوفر في ماتا DHFR F [1،2] جمع واسترجاعها من مجموعة كما هو موضح في الخطوة 1.1.1، وبناء وإلا فإن سلالة كما هو موضح في الخطوة 1.1.2.
ملاحظة: بروتوكول الموصوفة هنا يستخدم DHFR F [1،2] سلالة كطعم وDHFR F [3] جمع ويفترس، كما تحتوي هذه المجموعة على المزيد من سلالات من DHFR F [1،2] جمع. ومع ذلك، فمن الممكن أن تؤدي الشاشة على العكس من ذلك إذا كانت سلالة الطعم متاح فقط في DHFR F [3] جمع أو في كل الاتجاهات إذا كان أحد يتطلب تغطية أعلى من interactome.- ذوبان الجليد لوحة الأسهم الجلسرين الذي يحتوي على سلالة الطعم على الجليد لمدة ساعة واحدة. تعقيم رقائق الألومنيوم التي تغطي لوحة باستخدام الايثانول 95٪. بيرس احباط مع طرف عقيمة، ماصة صعودا وهبوطا لresuspend الخلايا ومسحة 2-3 ميكرولتر من الأسهم الجلسرين على انتقائية خلاصة الخميرة ببتونسكر العنب (YPD) + 100 ميكروغرام / مل Nourseothricin (نات) من أجل عزل المستعمرات واحد. احتضان لمدة يومين في 30 ° C.
- بناء سلالة الطعم PCA (ماتا DHFR F [1،2]).
- باستخدام البلمرة عالية الدقة وبروتوكول PCR القياسية، وتضخيم DHFR F [1،2] الكاسيت من البلازميد pAG25-رابط-DHFR F [1،2] -ADHterm باستخدام أليغنوكليوتيد] مع يخيم ينتهي مثلي إلى 40 سنة مضت الأخير من عام ORF 3'نهاية باستثناء كودون وقف (التمهيدي إلى الأمام) وإلى BP 40 أول من الجين 3'-UTR (التمهيدي عكسي) (الشكل 1A).
- تحويل المنتج PCR إلى خلايا الخميرة المختصة (عادة في سلالة BY4741) باستخدام معيار LiOAc / PEG بروتوكول تحول الخميرة كما في 29 (الشكل 1A).
- لوحة على YPD انتقائي + نات المتوسطة لعزل transformants إيجابية.
- إجراء PCR مستعمرة التشخيص على مستعمرات معزولة لتأكيد السليم DHFR F [1،2] الانصهار. استخدام العلاقات العامةimers والصلب 1) في الجين تسلسل الترميز (بنسبة ضئيلة إلى الأمام) حوالي 100 سنة مضت المنبع من الانصهار DHFR و 2) في فاصل ADH من الكاسيت (عكس بنسبة ضئيلة) (الشكل 1B).
- تسلسل المنتج PCR من قبل سانجر تسلسل لتأكيد الانصهار الجين السليم.
- أرشفة سلالة الطعم أكد في 25٪ الجلسرين في -80 ° C.
ملاحظة: يمكن إيقافها مؤقتا البروتوكول في هذه الخطوة.
2. دبوس أداة التعقيم والطباعة إجراءات
تم تحسين الإجراء التعقيم هو موضح أدناه لأدوات دبوس التلاعب بها من قبل BM3-BC (S & P الروبوتات) منصة روبوتية، ولكن يمكن تكييفها لمنصات أخرى أيضا: ملاحظة. يصف هذا القسم إجراءات التعقيم والطباعة دبوس الأداة التي تستخدم لنقل الخلايا من وسط إلى آخر لبقية البروتوكول. ويمكن الحصول على منزل في البرامج النصية استخدامها لتنفيذ هذه الإجراءات بناء على طلبها. ملاحظة ثار جميع الخطوات التي يمكن أن يؤديها من دون الحاجة إلى منصة روبوتية باستخدام اليدوية دبوس أداة 30.
- تركيب دبوس أداة مناسبة على منصة الروبوتية.
- إعداد التنظيف ومحطات الرطب على النحو التالي:
- إضافة 500 مل من الماء المعقم في محطة حمام الماء.
- إضافة 320 مل من الماء المعقم في محطة الفرشاة.
- إضافة 380 مل من الايثانول 70٪ في sonicator عند تكرار من لوحة أجار (86 × 128 ملم omnitray، التي تحتوي على 35 مل من المتوسط طدت) لوحة أجار، أو 400 مل عند تكرار من وحة microtiter تحتوي على الثقافات السائلة إلى لوحة آغار.
- إضافة 35 مل من الماء المعقم في محطة الرطبة (تتألف من omnitray فارغة عقيمة).
- في بداية كل يوم تتطلب منصة الروبوتية، تعقيم دبوس الأدوات خمس مرات لدقيقة واحدة في sonicator باث. وفي الوقت نفسه، تشغيل مصباح الأشعة فوق البنفسجية لمدة خمس دقائق لتعقيم العلبة الروبوت.
ملاحظة: لا يلزم هذا إذا كان تسلبيقع بعد التمديد تحت غطاء العقيمة. - بين كل تكرار الجولة دبوس أداة، تعقيم دبوس أداة على النحو التالي:
- نقع دبوس أداة خمس مرات لمدة 10 ثانية في محطة حمام الماء لإزالة كتل الخلية.
- نقع دبوس أداة مرتين ذهابا وإيابا في محطة الفرشاة.
ملاحظة: سوف الفرشاة الدورية إزالة الخلايا المتبقية. - نقع دبوس أداة مرتين لمدة 20 ثانية في محطة sonicator.
ملاحظة: باقي الخلايا على المسامير سوف يتم التوقف عن صوتنة أو قتل بواسطة الايثانول. - تأكد من أن عمق غمس من المسامير يزيد في كل حمام على التوالي لضمان التعقيم السليم.
- تجفيف دبوس أداة في محطة مجفف الهواء لمدة 25 ثانية.
- قبل أخذ الخلايا على لوحات مصدر، والرطب دبابيس في محطة الرطبة، والذي يحتوي على 35 مل من الماء المعقم في omnitray.
- تراجع دبابيس مرتين في المستعمرات من لوحة المصدر.
- الطباعة على لوحة جهة سكب حديثا عن طريق لمس AGسطح AR مرتين (المشار إليه فيما بعد عمل "الطباعة" مجموعة).
3. التكثيف من DHFR F [3] مجموعة في 1،536 صفائف باستخدام الروبوتية منصة الآلي
- ذوبان الجليد على الجليد في DHFR F [3] جمع (لوحات 60 96-جيدا) وإضافية لوحة 96-جيدا مليئة DHFR L-F [3] سيطرة سلالة (الشكل 1C)، الذي يحتوي على DHFR F [3] شظية وأعرب عن رابط المنبع وحدها كوسيلة لمراقبة سلبية.
ملاحظة: من حيث المبدأ، وهذا جزء لا ينبغي أن تتفاعل مع أي DHFR تفتيت البروتين الانصهار (انظر المناقشة لمزيد من التفاصيل). - لوحات أجهزة الطرد المركزي (تدور سريع) قبل إزالة رقائق الألومنيوم لتجنب مخاطر التلوث المتبادل بين الآبار.
- تتكثف جمع على 16 صفائف من 384 سلالات (الشكل 2A). للقيام بذلك، لكل 384 مجموعة، والطباعة أربع لوحات الجلسرين على الأرباع الأربعة من YPD انتقائي + 250 ميكروغرام / مل هيغروميسين B (HygB) omnitray باستخدام عشره 96 دبوس أداة (هنا، وهو 384 مجموعة ويمكن تقسيم في أربعة أجزاء interspaced على قدم المساواة، يتألف كل منها من 96 مناصب في تخطيط مصفوفة 2 × 2). إدراج أربع لوحات 96-جيدا تحتوي على [3] السيطرة L-DHFR F سلبية في ما بين 60 لوحات أخرى من أجل الحصول على مجموعة نهائية من 64 لوحات التي تملأ بالضبط أربعة 1،536 المصفوفات. تعقيم دبوس أداة بين كل دورة النسخ المتماثل كما هو موضح في الخطوة 2.
ملاحظة: أدخل L-DHFR F [3] لوحات من أجل الحصول على واحدة من هذه لوحة على كل من أربعة 1،536 صفائف النهائية. - احتضان لوحات لمدة يومين في 30 ° C. ملاحظة: في هذه المرحلة، يمكن تخزين جمع DHFR في شكل 384 في 4 مئوية لمدة شهر واحد على لوحات أجار.
- تتكثف جمع إلى أربعة صفوف من 1،536 سلالات (الشكل 2A). للقيام بذلك، لكل 1،536 مجموعة، طباعة أربعة صفوف من 384 سلالات على الأرباع الأربعة من لوحة من نفس المتوسط كما في الخطوة 3.2 باستخدام 384 دبوس أداة (هنا، وهو 1،536 مجموعة ويمكن تقسيم في أربعة هinterspaced qually الأرباع يتألف كل منها من 384 مواقع في تخطيط مصفوفة 2 × 2).
- احتضان لوحات لمدة يومين في 30 ° C. ملاحظة: في هذه المرحلة، يمكن تخزين جمع DHFR في شكل 1،536 في 4 مئوية لمدة شهر واحد على لوحات أجار.
- تكرار صفائف أربعة في نفس المتوسطة لتوحيد حجم مستعمرة باستخدام 1،536 دبوس الأداة.
- احتضان لوحات لمدة يومين في 30 مئوية.
4. عالية الإنتاجية الإجراءات DHFR-PCA
- تطعيم ثقافة سلالة الطعم (DHFR F [1،2] الانصهار) التي تم الحصول عليها من الخطوة 1.1.1 أو 1.1.2 في 20 مل من السائل YPD + نات في أنبوب 50 مل (الشكل 2B).
- احتضان لمدة يومين في 30 ° C مع اهتزاز عند 250 دورة في الدقيقة للسماح للثقافة للوصول إلى الإشباع.
- بعد يومين من الحضانة، لوحة 5 مل من ثقافة على YPD + نات omnitray. السماح خلايا كثف على السطح لمدة 5-10 دقيقة وإزالة السائل الزائد (الشكل 2B). كرر رأورده لجعل ثلاثة مكررات.
- احتضان لمدة يومين في 30 ° C.
- طباعة سلالة الطعم من الخطوات 4.3 و 4.4 على 12 لوحات YPD (يكفي أن التزاوج أربعة لوحات من DHFR F [3] جمع × ثلاثة مكررات) مع 1،536 دبوس أداة باستخدام كل خلية في الحديقة لا أكثر من أربع مرات.
- طباعة مجموعة مناسبة من DHFR F [3] جمع على أعلى من خلايا الطعم باستخدام 1،536 دبوس أداة (الشكل 2C).
- السماح للسلالات تتزاوج التي يحتضنها لمدة يومين في 30 ° C.
- حدد الخلايا مضاعفا عن طريق طباعة المستعمرات على omnitrays تحتوي على YPD + HygB + نات (الشكل 2C).
- احتضان لمدة يومين في 30 ° C.
- اختيار مضاعفا كرر كما هو موضح في الخطوات 4.8 و 4.9 (الشكل 2B).
- إعداد لوحات مع وسائل الإعلام التي تحتوي على MTX (MTX المتوسطة) يوميا قبل الاستخدام باتباع الخطوات التالية 21 (تنبيه: كن حذرا عند التعامل مع MTX كما هو مركب سام ارتداء القفازات دائما، المتواجدنظارات ction ومعطف المختبر عند التعامل مع ذلك) (الشكل 2C):
- إعداد -lys 10X / التقى / ADE الأحماض الأمينية التسرب في الماء منزوع الأيونات. فلتر تعقيم التسرب في زجاجة معقمة باستخدام 0.2 ميكرومتر معقم مرشح حقنة أو، إذا لزم الأمر بكميات كبيرة، 0.2 ميكرومتر زجاجة كبار قمع الترشيح (الجدول 1).
- إعداد 10 ملغ / مل MTX حل الأسهم في سلفوكسيد ثنائي ميثيل (DMSO). استخدامها على الفور بعد إعداد الحل وتجميد ما تبقى في -20 ° C. حمايته من الضوء كما هو حساس. لا تجمد MTX مرة أخرى بعد ذوبان ذلك.
- إعداد وسائل الإعلام على النحو التالي (المكونات المتوسطة وكميات هي نفس تلك المستخدمة في تاراسوف وآخرون 11):
- ليتر واحد من المتوسطة، وخلط في اثنين من قوارير منفصلة: 1) 6.69 غرام من الخميرة قاعدة النيتروجين دون الأحماض الأمينية ودون كبريتات الامونيوم و 330 مل من الماء منزوع الأيونات. 2) 25 غرام من مل النبيلة أجار و 500 من الماء منزوع الأيونات.
- قوارير الأوتوكلاف على 121 درجة مئوية لمدة 20 دقيقة.
- تتوازن درجة الحرارة في حمام مائي عند 55 درجة مئوية لمدة ساعة واحدة على الأقل.
- مزيج من قوارير اثنين معا، وإضافة 50 مل من معقم الجلوكوز 40٪، و 100 مل من 10X العقيمة التسرب، و 20 مل من MTX 10 ملغ / مل.
- صب 35 مل (انظر الملاحظة أدناه) من المتوسط في omnitrays. السماح لترسيخ ما لا يقل عن ساعة ونصف. لوحات درع من الضوء.
ملاحظة: هنا، وسكب 35 مل من المتوسط في omnitray أمر بالغ الأهمية لضمان المساواة في سمك لوحة، وهو أمر مهم لجميع الخطوات اللاحقة.
- لوحات صورة من الجولة الثانية من اختيار مضاعفا مع منصة روبوتية أو مع الكاميرا الرقمية العادية مع موحدة لوحة الإضاءة. استخدام هذه الصور لتحديد مواقع فارغة على صفائف عند إجراء تحليل المصب. تأكد من أن المعلمات من الكاميرا هي ذاتها على الدوام، وأنه يتم تشغيل ضوء الروبوت على.
- طباعة الخلايا مضاعفا على MTX وسائل الإعلام باليودنانوغرام 1،536 دبوس الأداة.
- احتضان لمدة أربعة أيام في 30 درجة مئوية في أكياس بلاستيكية لمنع جفاف.
- إعداد الدفعة الثانية من omnitrays تحتوي على MTX المتوسطة كما هو موضح في الخطوة 4.11.
- بعد أربعة أيام من الحضانة، لوحات صورة باستخدام منصة روبوتية أو الكاميرا الرقمية العادية. تأكد من أن المعلمات من الكاميرا هي ذاتها على الدوام، وأنه يتم تشغيل ضوء الروبوت على.
- إجراء الجولة الثانية من MTX اختيار من تكرار الخلايا على الدفعة الثانية من MTX سائل الإعلام.
ملاحظة: هذا سيقلل من النمو خلفية سلالات PCA وزيادة دقة الكمي. - احتضان لمدة أربعة أيام في 30 درجة مئوية في أكياس بلاستيكية لمنع جفاف.
- لوحات صورة كما هو موضح في الخطوة 4.16.
5. تحليل صورة
- تحليل الصور من صفائف مستعمرة مع يماغيج العرف 31 البرامج النصية أو باستخدام البرمجيات التي نشرت مثل المستعمر، حزب التحرير شبكة مستعمرة محلل، التعريف خلية، مستعمرة صورةص، ScreenMill، YeastXtract ومشبكة (المترجمة في 32). يجب إخراج واحد أو عدة جداول البيانات التي تحتوي على أحجام مستعمرة لكل موقف كل مجموعة، واستخدام تحليل الصور هذه الأحجام مستعمرة لجميع التحليلات المصب.
ملاحظة: في هذه الدراسة، كنا السيناريو يماغيج العرف وصفها في Leducq وآخرون 33 (انظر القسم مناقشة لمزيد من التفاصيل).
6. تحليل البيانات
ملاحظة: النتائج من تحليل الصور يمكن معالجتها في الجدوال مثل Excel أو باستخدام لغة البرمجة مثل R 34. تصف الخطوات التالية الإجراء باستخدام مخصص يماغيج 31 النصي.
- باستخدام برنامج نصي العرف، سلسلة ملفات الإخراج من تحليل الصور وتعليم كل صف مع لوحة وتجهد المعلومات كما في الجدول التكميلي 1.
- تسجيل 2 تحويل القيم حجم مستعمرة (الكثافة المتكاملة أو منطقة مستعمرة، وهنا، العمود "IntDenBackSub & #8221؛ من الجدول التكميلي 1 تم استخدامها).
ملاحظة: سوف توزيع القيمة تبدو كما في الشكل 3A. - تطبيع هذه القيم من خلال طرح قيمة وسيطة من كل لوحة.
ملاحظة: هذه الضوابط خطوة لوحة التحيز التي قد تنجم عن كمية وسائل الإعلام غير متكافئة أو التباين في الحصول على الصور التلقائي، ويقلل من التباين بين تكرار (الشكل 3B). - تحقق من أن مكررات ترتبط مع بعضها البعض (الشكل 3C) لتقييم استنساخ التجارب.
- التفريق التفاعل من أزواج غير التفاعل الطعم والفرائس، وضع عتبة عالية الثقة الموافق المئين عشر 95 من توزيع L-DHFR F [3] الضوابط.
ملاحظة: في هذه التجربة، وهذا يتوافق مع 3.39 (الشكل 3D). بدلا من ذلك، يمكن استخدام عتبة تستند إلى التداخل مع interactors الفيزيائية المعروفة مثل تلك التي ذكرت في BioGRID 35.انظر المناقشة لمزيد من التفاصيل. - لأي الطعم، ويفترس مرشح تحديدها على أنها تشارك في التفاعلات إيجابية كاذبة في شاشات DHFR-PCA (انظر المناقشة لمزيد من التفاصيل) والمدرجة في الجدول التكميلي 2 (التي تعرف بأنها "1" في عمود "تصفيتها").
- متوسط Log2 أحجام مستعمرة تطبيع من مكررات ثلاثة من كل تفاعل (العمود "انهيار" في الجدول التكميلي 2).
7. التحقق من Interactors البدنية عن طريق التجارب على نطاق صغير
ملاحظة: أي PPI ذات أهمية خاصة وجود درجة أعلى أو على مقربة من عتبة تطبيقها يمكن التحقق من صحة باستخدام الفحص DHFR-PCA في التصميم التجريبي على نطاق صغير باستخدام فحص النمو على صلبة أو سائلة المتوسطة MTX. تظهر الخطوات التالية الإجراء لبناء سلالات PCA مضاعفا يدويا وإجراء فحوصات بقعة على MTX المتوسطة. المجرب أن تؤدي هذه الخطوات كافة لزم الامرضوابط ص (بيت-DHFR F [1،2] X L-DHFR F [3]، سحاب-رابط-DHFR سلالات مضاعفا ورابط-DHFR سلالة مضاعفا).
- لوحة 2-3 ميكرولتر من الأسهم الجلسرين من سلالة الطعم ولدت في 1.1.2.6)، وL-DHFR F [3] سلالة السيطرة، وزيبر-رابط-DHFR ورابط-DHFR سلالات مضاعفا على YPD + نات، YPD + HygB ومرتين YPD + نات + HygB وسائل الإعلام، على التوالي.
- استرداد فريسة المصالح في DHFR F [3] جمع واتبع الإرشادات في الخطوة 1.1.1، ولكن خط الضغط على YPD + HygB المتوسطة بدلا من YPD + نات المتوسطة.
- إجراء PCR التشخيص كما هو الحال في 1.1.2.4 لتأكيد DHFR F [3] الانصهار في موضع الفريسة وتسلسل المنتج.
- تطعيم 1 مل من المتوسط YPD السائل مع سلالات فرداني للتزاوج (بيت س بري، بيت خ L-DHFR F [3] السيطرة) وتنمو يومين على الأقل في 30 ° C للسماح للdiploids لتشكيل.
- حدد diploids التي كتبها تسليط الضوء 4-5 ميكرولتر من الثقافة في 7.4 في صلب المتوسطة YPD + HygB + نات. تنمو يومين في 30 ° C.
- SELECر مستعمرة معزولة واحد وتنمو بين عشية وضحاها في الثقافة السائلة (1 مل) لأداء الفحص النمو.
- إعداد MTX وDMSO (نفس المكونات كما MTX المتوسطة، ولكن من دون MTX) لوحات يوميا قبل الاستخدام. راجع الخطوة 4.11 لمزيد من التفاصيل.
- أداء فحص النمو من خلال اكتشاف التخفيفات المسلسل الى ثقافات مختلفة على جهاز التحكم (DMSO) وألواح التحديد (MTX).
- تمييع precultures إلى OD = 1.
- أداء التخفيفات خمسة أضعاف (إلى عامل التخفيف من 625) في العقيمة لوحة 96-جيدا.
- بقعة 4 ميكرولتر من كل تخفيف على وسائل الإعلام PCA (DMSO وMTX).
- احتضان عند 30 درجة مئوية في أكياس بلاستيكية لمنع جفاف.
- لوحات صورة من أيام 1 إلى 7 من الحضانة باستخدام منصة روبوتية أو كاميرا رقمية عادية.
النتائج
هو الجدول التكميلي 2 مثال على نتائج ممثلة تم الحصول عليها باستخدام بروتين الخميرة تنصهر Nup82 إلى DHFR F [1،2] جزء كطعم. العتبة المحددة مع L-DHFR F [3] يمكن استخدام الضوابط باعتباره عتبة التجريبية لتحديد يضرب ثقة عالية (أرقام 3D و3E). بدلا من ذلك، ترتيب النتيجة يمكن استخدامها لإجراء التخصيب الجيني علم الوجود أو غيرها ظيفية يحلل 36 على أساس معايير الذهب 37. وinteractors الفيزيائية المعروفة من الطعم يمكن استرجاعها من قواعد البيانات مثل BioGRID 35 و مضافين على البيانات (أرقام 3E و 3F). في هذا المثال، تم الإبلاغ عن خمسة من أصل ثمانية ثقة عالية يضرب سابقا interactors Nup82 وهما جزء من subcomplex Nup82، Nup116 وNup159 (الشكل 3F & 3G). عضو آخر من المجمع، Nsp1، لا تظهر أي ينتراكنشوئها في تجربتنا. وكان اثنان يفترس، Ade17 وTef2 (لا يظهر في الشكل 3F)، وعشرات فوق عتبة الصعبة تطبيقها، ولكن هذه من المحتمل أن تكون ايجابيات كاذبة لأنها تتفاعل مع ما يقرب من أي بروتين الطعم في شاشات PCA وقد أجرينا (نتائج غير منشورة). من ناحية أخرى، قد Pex30 تمثل interactor لالبدني رواية Nup82 وكنا قادرين على تأكيد هذا التفاعل باستخدام DHFR-PCA في منخفضة الإنتاجية (الشكل 3G). Pex30 هو بروتين الغشاء peroxisomal وتم الإبلاغ عن عدد قليل من التفاعل المباشر بين مجمع المسام النووي (NPC) وهذه العضية. حددت شاشة يومين هجين اثنين البروتين مجلس الشعب الآخر، Nup53 وAsm4 (Nup59)، وinteractors المادية للPex30 38، وقد تم الإبلاغ عن التفاعل الجيني بين Pex30 وNup170 39. شريكين آخرين التفاعل الكشف، Nup120 وNup85 (الشكل 3F & 3G)، ليست جزءا من Nup82 شبه معقدة، مما يدل على قدرةمن DHFR-PCA للكشف عن التفاعلات داخل وبين subcomplexes في المجمعات الكبيرة 11.
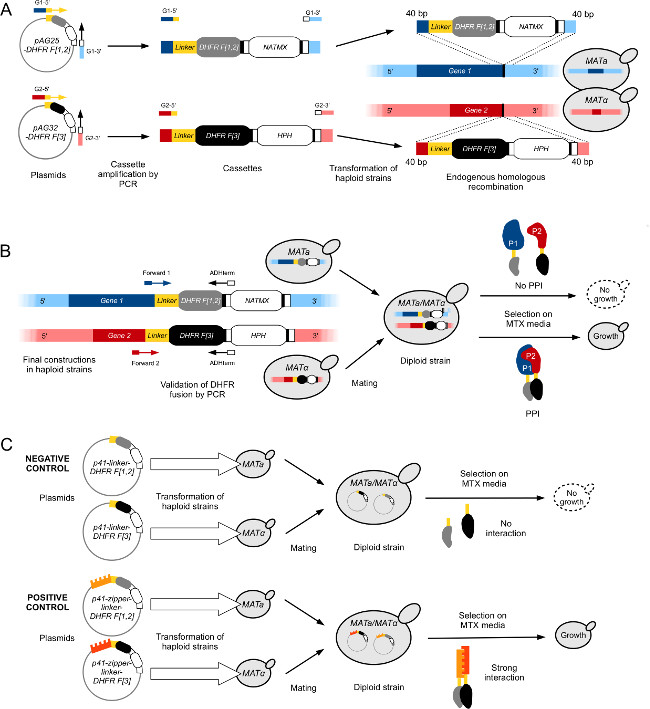
الشكل 1: سلالات الخميرة الهندسة العالى الإنتاجية DHFR-PCA (. الرقم مقتبس من Leducq وآخرون 2012 33) (A) بناء فرداني ماتا وMAT α سلالات لتلتحم Gene1 (G1) وGene2 (G2) مع DHFR F [1،2] -NatMX وDHFR F [3] -HPH الكاسيت، على التوالي. وتتضخم أشرطة من البلازميدات pAG25-DHFR F [1،2] وpAG32-DHFR F [3] مع الاشعال إلى الأمام G1-5 "و G2-5، وعكس الاشعال G1-3" و G2-3 "، ومن ثم إدراج في الجينوم في نهاية 3 'من الجينات المستهدفة من خلال إعادة التركيب مثلي. البروتينات الناتجة عن ذلك، P1 و P2، وتنصهر على التوالي إلى DHFR F [1،2] جزء (ماتا) وDHFR F [3] جزء (MATα) عن طريق رابط مرونة. (ب) التحقق من البناء في (A) يتم تنفيذها بواسطة تسلسل تقاطعات بين لGene1 وORFS Gene2 و الأشرطة DHFR. ثم يتم تزاوج سلالات PCA شيدت من معارضة أنواع التزاوج لتشكيل مضاعفا. سلالات مضاعفا تنمو على MTX المتوسطة إذا تم جلب اثنين من شظايا DHFR التكميلية إلى القرب من التفاعل بين P1 و P2، التي reconstitutes نشاط الإنزيم DHFR. (C) بناء تحكم مضاعفا PCA سلالات للشاشات DHFR-PCA. هي التي شيدت الضوابط السلبية (L-DHFR) عن طريق تحويل ماتا وMATα سلالات فرداني بشكل منفصل مع البلازميدات P41-رابط-DHFR F [1،2] وP41-رابط-DHFR F [3] (11)، على التوالي. وتزاوج سلالتين مما أدى إلى سيطرة سلبية سلالة مضاعفا التي شظايا DHFR غير قادرةليكمل كل منهما الآخر (أعلى). هي التي شيدت الضوابط الإيجابية باستخدام نفس النهج لعناصر سلبية، ولكن البلازميدات تحول في سلالات فرداني (P41 سستة-رابط-DHFR F [1،2] (P41-ZL-DHFR F [1،2]) وP41 -zipper-رابط-DHFR F [3] (P41-ZL-DHFR F [3])) تحتوي على اثنين GCN4 يسين مواز شظايا سحاب تنصهر إلى شظايا DHFR التكميلية، الأمر الذي يؤدي إلى التفاعل القوي والتأسيسي أن reconstitutes النشاط DHFR (القاع ). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
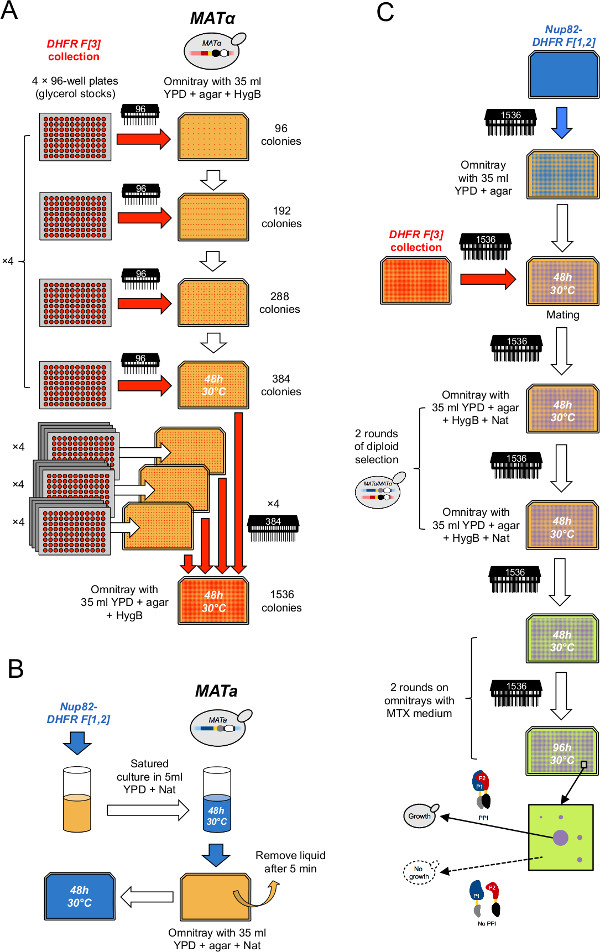
الشكل 2: الإنتاجية العالية الإجراء DHFR-PCA (الرقم مقتبس من Leducq وآخرون 33.) (A) وMAT α DHFR F [3] جمع. ويتم تكثيف في شكل 1536 من خلال جولتين متتاليتين من التكثيف. أولا، يتم الجمع بين لوحات الأسهم الجلسرين من قبل مجموعات من أربعة على انتقائية المتوسطة YPD + HygB في شكل 384 باستخدام 96 دبوس الأداة. ثانيا، يتم الجمع بين 384 صفائف من قبل مجموعات من أربعة على انتقائية المتوسطة YPD + HygB في شكل 1536 باستخدام 384 دبوس الأداة. يتم إعداد (B) المروج خلية من سلالة الطعم ماتا PCA التي تنمو ثقافة مشبعة من سلالة الطعم في وتستخدم YPD انتقائي + نات المتوسطة والطلاء الثقافة على YPD + نات omnitray. (C) هذه المروج للتزاوج سلالة الطعم مع DHFR F [3] جمع على YPD المتوسطة. يتم نقل الخلايا على التوالي مرتين على YPD + HygB + نات المتوسطة لتحديد لdiploids ومرتين على MTX المتوسطة لأداء PCA. سيتم فقط لوحظ نمو على MTX المتوسطة إذا شظايا DHFR يكمل كل منهما الآخر بعد التفاعل بين الطعم والبروتينات فريسة.e.jpg من "الهدف =" _ فارغة "> الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
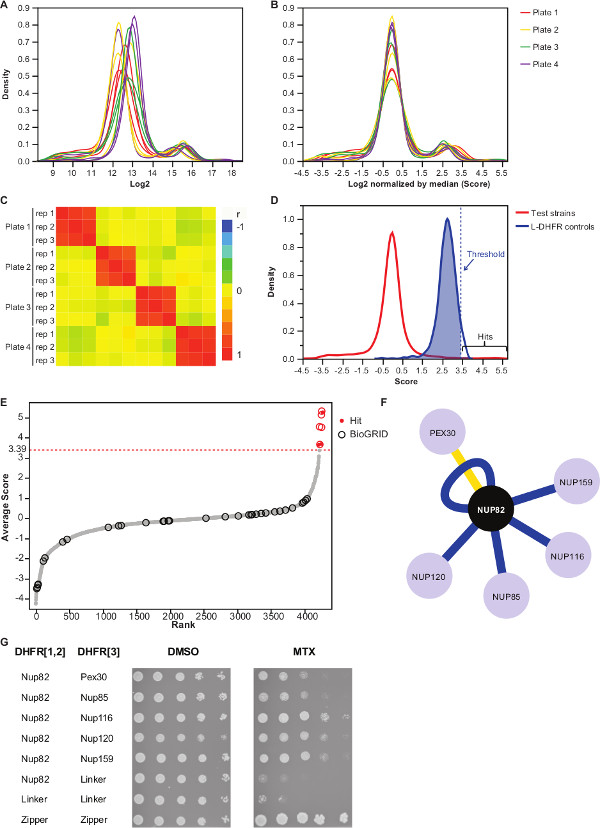
الشكل (3):.. ويحلل البيانات من خلال خطوات التطبيع، وتحديد عتبة أهمية وتحديد التفاعلات الإيجابية (A) توزيع كثافة حجم مستعمرة على كل لوحة (تسجيل 2) (ب) التطبيع من قبل الوسيط من كل صورة على تصحيح التحيز ل يرتبط مع لوحة إلى لوحة الآثار. (C) Heatmap تظهر معامل الارتباط سبيرمان بين لوحات، مؤكدا على استنساخ الإجراء. (D) توزيع الدرجات لمثبطات مضخة البروتون اختبارها و[3] ضوابط L-DHFR F. يمكن تعيين عتبة رقية إلى المئين عشر 95 من L-DHFR F [3] توزيع لتحديد مثبطات مضخة البروتون عالية الثقة (يمثله منقط الرأسيتوزيع الخط). (E) من اجل رتبة متوسط درجة من كل فريسة. ويتم تحديد المبلغ عنها سابقا شركاء التفاعل المادي للNup82p في BioGRID 35 من الدوائر وتلك التي ذكرت في هذه الدراسة يتم تحديدها من قبل النقط الحمراء. ويظهر العتبة المحددة في (D) كخط منقط. (F) شبكة تبين مثبطات مضخة البروتون عالية الثقة التي تم تحديدها في هذه الدراسة. حواف زرقاء تظهر ذكرت سابقا interactors المادية (BioGRID 35) وحواف صفراء تظهر التفاعل غير المبلغ عنه سابقا مع Pex30. (G) بقعة-فحص تخفيف من PCA سلالات مضاعفا تنطوي Nup82-DHFR F [1،2] وفريسة-DHFR F [3 ] أزواج حددت كما interactors المادية للNup82p في هذه الدراسة. تم إجراء فحص النمو في DMSO المتوسطة (MTX المذيبات، اللوحة اليسرى) وMTX المتوسطة (اللوحة اليمنى). ضوابط السلبية التي تتكون من Nup82-DHFR F [1،2] - رابط-DHFR F [3] ورابط-DHFR F [1،2] - رابط-DHFR F [3] وتحكم إيجابية تتكون من ركان التفاعل القوي بين اثنين من الأنصاف يسين سحاب (سحاب-DHFR F [1،2] - سحاب-DHFR F [3]) كانوا المدرجة. ينبغي أن تفسر نمو الخلايا متفوقة على ضوابط السلبية في MTX المتوسطة باعتبارها التفاعل الجسدي. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
| الأحماض الأمينية | الكمية (ز) |
| الأدينين كبريتات * | 0.2 |
| L-التربتوفان | 0.4 |
| L-التيروسين | 0.3 |
| L-الفنيل الانين | 0.5 |
| حمض الغلوتاميك-L (أحادية الصوديوم والملح) | 1.0 |
| L-الهليونين | 1.0 |
| L-فالين | 1.5 |
| L-ثريونين | 2.0 |
| L-سيرين | 3.75 |
| Uracile | 0.2 |
| L-الحامض الأميني حمض الهيدروكلوريك | 0.2 |
| L-ارجينين حمض الهيدروكلوريك | 0.2 |
| L-ميثيونين * | 0.2 |
| L-ليسين * | 0.2 |
| L-وسين | 0.6 |
| * المسحوبة عند تنفيذ معيار PCA (كما هو الحال في هذا البروتوكول)، ولكن يمكن أن تضاف لأغراض أخرى. | |
الجدول 1: تكوين 10X -lys / التقى / ADE التسرب في الوسط MTX الكميات هي ليتر واحد من 10X التسرب. النجمة للدلالة على المركبات التي يجب سحبها لMTX المتوسطة القياسية، ولكن يمكن أن تضاف لأغراض أخرى.
. يحتوي على البيانات المجمعة من لوحات 12 اختبار الجدول 1 دا متسلسلة: الجدول التكميلي 1تا من التحليل يماغيج تنفيذها باستخدام برنامج نصي يماغيج مخصصة مع كل صف المقابلة لموقف واحد على كل 1،536 صفيف. وبالإضافة إلى ذلك، تم المشروح كل صف مع معلومات حول ملف صورة، DHFR لوحة جمع وتكرار، ORF واسم البروتين.
الجدول التكميلي 2: متوسط نمو تطبيع لكل سلالة ويتضمن الجدول 2 متوسط سجل 2 نمو تطبيع لكل سلالة من جمع جنبا إلى جنب مع الانحراف المعياري. ويتم تحديد يفترس تصفيتها، ويضرب وinteractors الفيزيائية المعروفة في أعمدة منفصلة.
Discussion
نحن تصف البروتوكول على أساس فحص DHFR-PCA تمكين تحديد منهجي لinteractors المادية لأي بروتين الطعم يعطى في الإنتاجية العالية. هذا البروتوكول يمكن تكييفها عن طريق فحص لمزيد من الطعم، وهذا على أي مستوى المطلوب من النسخ المتماثل. ونحن لشرح موثوقية هذا البروتوكول من قبل تحديد الشركاء التفاعل الجسدي لبروتين الطعم المشاركة في مجمع المسام النووية: Nup82. تحليلنا تمكين للعثور على خمسة interactors عنها سابقا واحد غير المبلغ عنها سابقا interactor ل(أرقام 3F & 3G)، وتسليط الضوء على قدرة طريقة لدراسة interactome بروتين الخميرة.
بروتوكول الموصوفة هنا يتضمن العديد من الخطوات الهامة التي المجرب وينبغي الالتفات. ونحن نوصي ل1) تأكد من أن DHFR الطعم F [1،2] الانصهار هو الصحيح (الشكل 1B)؛ هذا يمكن تحقيقه من خلال تسلسل البناء وقياس آثافةجي تعبير البروتين الصحيح باستخدام مضاد للDHFR F [1،2] أو مكافحة DHFR F [3] الأجسام المضادة. 2) قبل بداية الشاشة، فمن المستحسن للتحقق إن وجدت الطعم من مصلحة المعارض التفاعلات منحل في شاشات PCA. ويمكن القيام بذلك عن طريق أداء شاشات التحكم مع الطعوم عبرت مع سيطرة L-DHFR المناسبة أو عن طريق التزاوج يدويا الطعم مع سيطرة L-DHFR المناسبة وإجراء فحص النمو في MTX المتوسطة. 3) ينبغي صب لوحات اليوم قبل استخدامها بحيث الرطوبة المثلى لتمسك الخلايا على سطح أجار أثناء عملية الطباعة. 4) لوحات المصدر لا ينبغي أن تستخدم أكثر من أربع مرات لنقل ما يكفي من الخلايا على لوحة الوجهة. زيادة عدد النسخ من لوحة جهة يمكن أن تقوم به خطوات متتالية من التوسع (على سبيل المثال 4 نسخ -> 16 نسخ -> 64 نسخة). بدلا من ذلك، والخلايا يمكن التقاطها في مواقع مختلفة على مروج أو في المستعمرة بين جولات مختلفة من تكرارها. 5) إذا كان عدة صositions مفقودة بعد اختيار مضاعفا (ق)، وتأكد من أن لوحات مصدر لم تستخدم في كثير من الأحيان في الخطوة التزاوج (الخطوات 4،5-4،7)؛ 6) التأكد من أن متوسط MTX يحتوي على جميع المكونات الأساسية في تركيزات الصحيحة. في الواقع، إذا لوحظ أي نمو على الإطلاق على المدى المتوسط MTX، يمكن أن يكون إما لأنه لا يوجد التفاعل هو للكشف عن طريق PCA للبروتينات في المصالح أو لأنه لم يتم إعداد المتوسطة MTX بشكل صحيح. للتأكد من أن يسمح المتوسطة نمو سلالات تظهر DHFR شظايا تكامل، ويمكن إضافة التفاعل التأسيسي في مواقع فارغة من جمع واستخدام مثل مراقبة إيجابية مثل DHFR-شظايا تنصهر ليسين الأنصاف سحاب 33 (الشكل 1C). سوف الاختبارات المتوازية باستخدام شظايا رابط-DHFR أو شظايا سحاب-رابط-DHFR تسمح للتمييز بين الشروط التي تسمح لجميع الخلايا لتنمو (تركيز منخفض MTX أو البروتين الطعم التي تميل إلى جعل تفاعلات إيجابية كاذبة، كما أن described أدناه)، والظروف التي تحول دون نمو جميع سلالات (المكون تركيز MTX عالية جدا أو أساسي مفقود في المتوسط)؛ 7) ونظرا إلى أن PCA يتم تنفيذ من خلال جولات متعاقبة من مكررات من وسط إلى آخر، قد يحدث التلوث العرضي بين سلالات بين لوحات مختلفة إذا، على سبيل المثال، لا يتم تعقيمها دبوس أداة بشكل صحيح بين جولات تكرار و / أو الماء الماضي حمام (محطة أي الرطب) في إجراء التعقيم ملوثة من قبل مستعمرات جولات النسخ السابقة. عدة مناصب على صفائف فارغة وبالتالي يمكن استخدامها كمواقع السيطرة حيث ينبغي مراعاة أي نمو للكشف عن التلوث عبر.
لا يمكن أن يؤديها تحليل الصور باستخدام عدة برامج نشرت (انظر القسم 5 من البروتوكول) أو أي برنامج نصي مخصص. في هذه الدراسة، وسيناريو مخصص ينفذ الخطوات التالية: 1) السيناريو يطرح القيم بكسل لوحة فارغة إلى بكسل القيم من كل لوحة من أجل أن تشاركrrect عن التحيزات الإضاءة. 2) البرنامج النصي بتحويل كل صورة لتصحيح الخلفية لثنائي باستخدام عتبة قيمة بكسل 10. 3) لكل 1،536 مواقف كل لوحة، والتي تحددها تتراكب مستطيل على المستعمرات الحافة، والنصي يعمل يماغيج "تحليل الجزيئات ... "وظيفة في مجموعة دائرية. يتم تعيين اختيار دائرية نصف قطرها يساوي الفترة الفاصلة بين موقعين ناقص 10 بكسل. 4) السيناريو يختار أقرب الجسيمات من مركز التحديد ويؤكد على أنها مستعمرة إذا موقعها ليست أكثر من نصف الفترة الزمنية الفاصلة بين مستعمرتين بعيدا عن مركز التحديد. 5) ويقيس النصي القيم بكسل من الجسيمات المختارة على الصورة لتصحيح الخلفية. 6) لمزيد من تصحيح أي المتبقية التحيزات الإضاءة الخلفية، والسيناريو يطرح قيمة متوسط من كل بكسل من الاختيار الدائرية التي لم تكن جزءا من الجسيمات إلى القيم بكسل للمستعمرة. مجموع هذه القيمة بكسل تصحيحالصورة، المخزنة في العمود "IntDenBackSub" من الجدول التكميلي 1، وتستخدم كمقياس لحجم مستعمرة.
والخطوة الحاسمة في الجزء التحليل هو الخيار عتبة أهمية. هنا، اخترنا عتبة على أساس توزيع السلبي L-DHFR F [3] ضوابط، ولكن اعتمادا على الهدف من الشاشة، قد تكون هذه العتبة صارمة للغاية. في الواقع، L-DHFR F [3] overexpressed الضوابط (المروج TEF قوي) بحيث شظايا التكميلية قد عفويا يكمل كل منهما الآخر، وهذه هي بالتالي لا تمثل التعبير عن معظم البروتينات. ويبرز هذا من حقيقة أن توزيع L-DHFR F [3] ضوابط أعلى من متوسط النمو الخلفية (الشكل 3D). وهكذا، وبعض التفاعلات وجود عشرات أدناه هذه العتبة صارمة ولكن هذا بشكل واضح خارج لتوزيع النمو الخلفية يمكن اعتبار الزيارات المفترضة التي قد تمثل، على سبيل المثال، بين عابرة أو ضعيفةالإجراءات. ويمكن مزيد من الدراسة والتحقق من صحتها عبر إذا، على سبيل المثال، لا يتم أعرب عن البروتينات اثنين على المستويات التي يمكن أن تسمح للتكامل عفوية من شظايا DHFR مثل الضوابط L-DHFR. وكبديل لذلك، يمكن للمرء أن وضع عتبة أهمية على أساس نسبة من التداخل مع interactors المادية التي أعلن عنها في قواعد البيانات مثل BioGRID 35 من أجل تعظيم نسبة الإيجابيات الحقيقية على ايجابيات كاذبة. ومع ذلك، خلافا للاستخدام توزيع L-DHFR، هذا البديل قد لا يكون دائما مجديا إذا، على سبيل المثال، فإن عدد interactors المادية المعروفة ليست عالية بما فيه الكفاية. وعلاوة على ذلك، فإن اختيار عتبة أهمية له تأثير على نسبة كاذبة ايجابيات وسلبيات كاذبة في مجموعة البيانات النهائي. في الواقع، مثل أي دولة أخرى فحص الكشف عن مؤشر أسعار المنتجين، ويمكن ايجابيات كاذبة تنجم عن تفاعل غير محدد من البروتين مع البروتين DHFR الانصهار إذا، على سبيل المثال، والبروتين وفيرة للغاية كما ذكر في وقت سابق. هذاويتضح من حقيقة أن بعض يفترس تتفاعل بشكل منتظم مع جميع البروتينات الطعم في شاشات PCA، وبالتالي تحتاج إلى إزالتها من تحليل 11 (على سبيل المثال Tef2 وAde17 والجدول التكميلي 2). للتحايل على هذه المشكلة، وشاشة تحكم PCA من المجموعتين ضد السيطرة L-DHFR المناسبة (F [1،2] أو F [3]) لتحديد الطعم ويفترس واظهار عفوية DHFR شظايا تكامل لا يمكن أن يؤديها في شروط محددة كل شاشة. وعلاوة على ذلك، إجراء تحليل لتخصيب جين علم الوجود يمكن أن تزيد من الثقة في البيانات إذا كان من المعروف وظيفة الطعم معين. من ناحية أخرى، يمكن أن DHFR-PCA تؤدي إلى السلبيات كاذبة لعدة أسباب: 1) ليس كل البروتينات يمكن أن تنصهر إلى شظايا DHFR لأن هذه قد زعزعة الاستقرار في البروتينات أو تعديل التعريب في حال، على سبيل المثال، والانصهار DHFR ل C-محطة يتداخل مع إشارة توطين. 2) إعادة DHFR في بعض الأجزاء الخلوية Mالمنعم يوسف لا تنتج حمض الفوليك إذا، على سبيل المثال، شرطا ضروريا لتخليق حمض الفوليك غير متوفر؛ 3) C مصطلحات حاجة إلى أن يكون على مسافة من 8 نانومتر لDHFR تكامل تحدث 11. وبالتالي، قد لا يتم الكشف عن تفاعل المعروفة إذا بهم C-مصطلحات ليست قريبة بما فيه الكفاية في الفضاء. ويتمثل هذا هنا من حقيقة أن جزءا كبيرا من التفاعلات الفيزيائية Nup82 التي أعلن عنها في قواعد البيانات، ومعظمها غير مباشرة، لم تكتشف في فحص لدينا. وبالمثل، فإن التفاعلات بين البروتينات الغشاء من أجلها C-مصطلحات هي في غير المشبعة نسبة إلى الغشاء لا يؤدي إلى DHFR شظايا تكامل ولن يتم الكشف عن 11. القيود 1) و 3) يمكن التحايل ببساطة نسبيا عن طريق دمج جزء DHFR إلى N-مصطلحات من البروتين. القيام بذلك قد يمنع التدخل في إشارة توطين بالقرب من C-مصطلحات وقد تسمح للكشف عن وجود تفاعل بين البروتينات الغشاء الذي N و C-محطة هي في قريب رابطة الدول المستقلةلغشاء.
لا تزال العديد من التحديات في دراسة الصنوبر (استعراضها في 2،3). إلى حد كبير وصفت الخرائط من الدبابيس أنتجت حتى الآن في حالة تجريبية واحدة لكل نوع وبالتالي توفر لقطة واحدة من كيفية تنظيم شبكات البروتين. ولذا فإن هناك حاجة لاستكشاف ظروف تجريبية أخرى لنرى كيف يمكن إعادة تنظيم المسامير في استجابة للتغيرات البيئية، منبهات محددة، عبر تطوير أو الطفرات التالية. سيتم التغلب على هذه التحديات من خلال تطوير تقنيات جديدة لاستجواب مثبطات مضخة البروتون في الوقت الحقيقي، في الخلايا الحية والتكيف مع التقنيات الحالية بحيث يمكن استخدامها من قبل مجتمع أكبر من المختبرات. كأسلوب الكمية التي يمكن الكشف عن التغييرات في كمية DHFR تكامل المجمعات 27، DHFR-PCA يمكن تكييفها للتغلب على هذه التحديات واستخدمت لدراسة كيفية تأثر مثبطات مضخة البروتون من قبل DNA الإضرار الوكيل 22 ، العوامل الكيميائية 25، الحذف الجين 23،26 أو في أنواع الخميرة الأخرى والهجينة من 33. سوف استكشاف هذه الأبعاد الجديدة تصبح أكثر وأكثر أهمية للكشف عن ديناميكية PIN.
Disclosures
تم دفع جزء من رسوم النشر مفتوحة الوصول لهذا المقال من قبل S & P الروبوتات.
Acknowledgements
وأيد هذا العمل من قبل المعهد الكندي للبحوث الصحية (CIHR) المنح 191597، 299432 و324265، والعلوم الطبيعية والهندسة مجلس البحوث منحة كندا ديسكفري ومنحة برنامج العلوم الحدودي الإنسان إلى CRL. CRL غير محقق CIHR الجديد. ويدعم غيوم ديس من قبل زمالة PROTEO. ويدعم صموئيل روشيت التي كتبها NSERC وFRQNT المنح الدراسية.
Materials
| Name | Company | Catalog Number | Comments |
| BioMatrix Robot, Bench-top Configuration | S&P Robotics Inc. | BM5-BC | |
| 96-format Pin-tool | S&P Robotics Inc. | PH-96-10 | Standard 96-format Pin-tool with 96 high-precision floating pins |
| 384-format Pin-tool | S&P Robotics Inc. | PH-384-10 | Standard 384-format Pin-tool with 384 high-precision floating pins |
| 1536-format Pin-tool | S&P Robotics Inc. | PH-1536-05 | Custom 1536-format Pin-tool with 0.5mm high-precision floating pins |
| Automated imaging module | S&P Robotics Inc. | IMG-02 | |
| Methotrexate | Bioshop Canada Inc. | MTX440 | CAUTION: toxic compound |
| Hygromycin B | Bioshop Canada Inc. | HYG003 | |
| Nourseothricin dihydrogen sulfate | Werner BioAgents | 5010000 | |
| Yeast-Interactome Collection | Thermo Scientific | YSC5849 | |
| Omni Tray w/lid sterile | Thermo Scientific | 242811 | |
| Anti-DHFR F[1,2] antibody | Sigma-Aldrich | D1067 | |
| Anti-DHFR F[3] antibody | Sigma-Aldrich | D0942 |
References
- Alberts, B. The cell as a collection of protein machines: preparing the next generation of molecular biologists. Cell. 92, 291-294 (1998).
- Diss, G., et al. Integrative avenues for exploring the dynamics and evolution of protein interaction networks. Curr Opin Biotechnol. 24, 775-783 (2013).
- Vidal, M., Cusick, M. E., Barabasi, A. L. Interactome networks and human disease. Cell. 144, 986-998 (2011).
- Hu, P., et al. Global functional atlas of Escherichia coli encompassing previously uncharacterized proteins. PLoS biology. 7, e96 (2009).
- Arifuzzaman, M., et al. Large-scale identification of protein-protein interaction of Escherichia coli K-12. Genome Res. 16, 686-691 (2006).
- Rajagopala, S. V., et al. The binary protein-protein interaction landscape of Escherichia coli. Nature biotechnology. 32, 285-290 (2014).
- Arabidopsis-Interactome-Mapping-Consortium. Evidence for network evolution in an Arabidopsis interactome map. Science. 333, 601-607 (2011).
- Babu, M., et al. Interaction landscape of membrane-protein complexes in Saccharomyces cerevisiae. Nature. 489, 585-589 (2012).
- Krogan, N. J., et al. Global landscape of protein complexes in the yeast Saccharomyces cerevisiae. Nature. 440, 637-643 (2006).
- Gavin, A. C., et al. Functional organization of the yeast proteome by systematic analysis of protein complexes. Nature. 415, 141-147 (2002).
- Tarassov, K., et al. An in vivo map of the yeast protein interactome. Science. 320, 1465-1470 (2008).
- Uetz, P., et al. A comprehensive analysis of protein-protein interactions in Saccharomyces cerevisiae. Nature. 403, 623-627 (2000).
- Guruharsha, K. G., et al. A protein complex network of Drosophila melanogaster. Cell. 147, 690-703 (2011).
- Li, S., et al. A map of the interactome network of the metazoan C. elegans. Science. 303, 540-543 (2004).
- Rual, J. F., et al. Towards a proteome-scale map of the human protein-protein interaction network. Nature. 437, 1173-1178 (2005).
- Landry, C. R., Levy, E. D., Abd Rabbo, D., Tarassov, K., Michnick, S. W. Extracting insight from noisy cellular networks. Cell. 155, 983-989 (2013).
- Berggard, T., Linse, S., James, P. Methods for the detection and analysis of protein-protein interactions. Proteomics. 7, 2833-2842 (2007).
- Wodak, S. J., Vlasblom, J., Turinsky, A. L., Pu, S. Protein-protein interaction networks: the puzzling riches. Current opinion in structural biology. 23, 941-953 (2013).
- Fields, S., Song, O. A novel genetic system to detect protein-protein interactions. Nature. 340, 245-246 (1989).
- Dunham, W. H., Mullin, M., Gingras, A. C. Affinity-purification coupled to mass spectrometry: basic principles and strategies. Proteomics. 12, 1576-1590 (2012).
- Michnick, S. W., Ear, P. H., Landry, C., Malleshaiah, M. K., Messier, V. A toolkit of protein-fragment complementation assays for studying and dissecting large-scale and dynamic protein-protein interactions in living cells. Methods Enzymol. 470, 335-368 (2010).
- Rochette, S., Gagnon-Arsenault, I., Diss, G., Landry, C. R. Modulation of the yeast protein interactome in response to DNA damage. Journal of proteomics. 100, 25-36 (2014).
- Diss, G., Dube, A. K., Boutin, J., Gagnon-Arsenault, I., Landry, C. R. A systematic approach for the genetic dissection of protein complexes in living cells. Cell Rep. 3, 2155-2167 (2013).
- Gagnon-Arsenault, I., et al. Transcriptional divergence plays a role in the rewiring of protein interaction networks after gene duplication. Journal of proteomics. 81, 112-125 (2013).
- Schlecht, U., Miranda, M., Suresh, S., Davis, R. W., St Onge, R. P. Multiplex assay for condition-dependent changes in protein-protein interactions. Proceedings of the National Academy of Sciences of the United States of America. 109, 9213-9218 (2012).
- Lev, I., et al. Reverse PCA, a systematic approach for identifying genes important for the physical interaction between protein pairs. PLoS Genet. 9, e1003838 (2013).
- Freschi, L., Torres-Quiroz, F., Dube, A. K., Landry, C. R. qPCA: a scalable assay to measure the perturbation of protein-protein interactions in living cells. Mol Biosyst. 9, 36-43 (2013).
- Pelletier, J. N., Campbell-Valois, F. X., Michnick, S. W. Oligomerization domain-directed reassembly of active dihydrofolate reductase from rationally designed fragments. Proceedings of the National Academy of Sciences of the United States of America. 95, 12141-12146 (1998).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods Enzymol. 350, 87-96 (2002).
- Schuldiner, M., Collins, S. R., Weissman, J. S., Krogan, N. J. Quantitative genetic analysis in Saccharomyces cerevisiae using epistatic miniarray profiles (E-MAPs) and its application to chromatin functions. Methods. 40, 344-352 (2006).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature methods. 9, 671-675 (2012).
- Wagih, O., Parts, L. gitter: A Robust and Accurate Method for Quantification of Colony Sizes From Plate Images. G3 (Bethesda). 4 (3), 547-552 (2014).
- Leducq, J. B., et al. Evidence for the robustness of protein complexes to inter-species hybridization. PLoS Genet. 8, e1003161 (2012).
- . . Development Core Team: A language and environment for statistical computing. , (2008).
- Stark, C., et al. BioGRID: a general repository for interaction datasets. Nucleic Acids Res. 34, D535-D539 (2006).
- Vinayagam, A., et al. Protein complex-based analysis framework for high-throughput data sets. Science signaling. 6, rs5 (2013).
- Jansen, R., Gerstein, M. Analyzing protein function on a genomic scale: the importance of gold-standard positives and negatives for network prediction. Current opinion in microbiology. 7, 535-545 (2004).
- Ito, T., et al. A comprehensive two-hybrid analysis to explore the yeast protein interactome. Proceedings of the National Academy of Sciences of the United States of America. 98, 4569-4574 (2001).
- Costanzo, M., et al. The genetic landscape of a cell. Science. 327, 425-431 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved