Method Article
הקרנת הגנום כל חלבונים אינטראקציה ידי חלבון-בר השלמה Assay (PCA) בתאים חיים
In This Article
Summary
Proteins interact with each other and these interactions determine in a large part their functions. Protein interaction partners can be identified at high-throughput in vivo using a yeast fitness assay based on the dihydrofolate reductase protein-fragment complementation assay (DHFR-PCA).
Abstract
Proteins are the building blocks, effectors and signal mediators of cellular processes. A protein’s function, regulation and localization often depend on its interactions with other proteins. Here, we describe a protocol for the yeast protein-fragment complementation assay (PCA), a powerful method to detect direct and proximal associations between proteins in living cells. The interaction between two proteins, each fused to a dihydrofolate reductase (DHFR) protein fragment, translates into growth of yeast strains in presence of the drug methotrexate (MTX). Differential fitness, resulting from different amounts of reconstituted DHFR enzyme, can be quantified on high-density colony arrays, allowing to differentiate interacting from non-interacting bait-prey pairs. The high-throughput protocol presented here is performed using a robotic platform that parallelizes mating of bait and prey strains carrying complementary DHFR-fragment fusion proteins and the survival assay on MTX. This protocol allows to systematically test for thousands of protein-protein interactions (PPIs) involving bait proteins of interest and offers several advantages over other PPI detection assays, including the study of proteins expressed from their endogenous promoters without the need for modifying protein localization and for the assembly of complex reporter constructs.
Introduction
רשתות אינטראקציה חלבון (PIN) מציעות מפה ברזולוציה נמוכה של כמה חלבונים מאורגנים מבחינה תפקודית בתא 1. כל חיבור פיזי בין שני חלבונים, או אינטראקציה בין חלבונים (PPI), עשוי לייצג עמותה כי הוא יציב בזמן, כמו אלה שנמצאו בתוך קומפלקסי חלבונים ושתורם לארגון המבני של התא. קשרים אלה עשויים גם לייצג עמותות חולפות המסדירות את הפעילות, יציבות, הלוקליזציה ואינטראקציות של שני השותפים. זיהוי שותפי אינטראקציה הפיזי של חלבון נתון לכן מספק מידע עשיר על התפקוד והרגולציה של החלבון ש2,3. מסיבות אלה, כבר לשים מאמצים גדולים למיפוי של סיכות באורגניזמים מודל, כולל Escherichia coli 4-6, thaliana ארבידופסיס 7, Saccharomyces cerevisiae 8-12, דרוזופילה melanogaster </ Em> 13, Caenorhabditis elegans 14 וההומו ספיינס 15. מחקרים אלה סיפקו תובנות חשובות כיצד חלבונים מאורגנים בתא ומידע ובכך מפתח בחלבונים עם פונקציות ידועות קודם לכן.
כמה אסטרטגיות שפותחו במשך השנים ללמוד מספרי זיהוי אישיים. טכנולוגיות אלה יכולות להיות מקובצים באופן כללי בשלוש קטגוריות המבוססות על הסוג של מידע שהם מספקים ב- PPI (שנסקר ב16-18). הראשון מבוסס על שמרי שתי-היברידי ונגזרותיו 19. טכנולוגיות אלו מספקות מידע על העמותה הישירה בין הזוגות של חלבונים, המאפשר בניית רשתות בינארי. המשפחה השנייה מבוססת על טיהור הזיקה של חלבוני פיתיון וזיהוי של השותפים הקשורים בם, כגון טיהור זיקה ואחריו ספקטרומטריית מסת 20. גישות אלה לזהות קבוצות של חלבונים אשר מתייחסות ישירותאו קשור באופן עקיף, בדרך כלל באופן יציב, והם חזקים מאוד לזהות קומפלקסי חלבונים. הגישה השלישית מתבססת על מבחני חלבון-בר שלמה (PCAs) 11,21. גישה זו מספקת רמה בינונית של החלטה בין שתי הגישות הקודמות, שכן היא מאפשרת איתור עמותות ישירות והפרוקסימלי בין חלבונים. לכל אחד יש טכניקה עוצמות משלה וחולשות, כפי שנסקר 18 לאחרונה.
PIN אוקריוטים ביותר שתואר הוא ללא ספק אחד משמרי ניצני Saccharomyces cerevisiae, בין שאר משום שproteome היא יחסית פחות מורכבת מאלה של אאוקריוטים מודל אחרים וכי מבחני תפוקה גבוהה כדי לזהות PPIs ראשון כבר assayed ויעילות רב יותר מיושם באורגניזם מודל זה 9-12. שיטה חזקה במיוחד למערכת השמרים היא assay דיהידרופולאט רדוקטאז שלמת חלבון-בר (DHFR-PCA), assay כי כברמשמש בהקשרים שונים כדי ללמוד את PIN השמרים בתנאים סטנדרטיים ומוטרדים 11,22-26. שיטה זו מסתמכת על assay הישרדות המאפשר זיהוי של PPI ישיר וכמעט ישיר לחלבון פיתיון ניתנו בשתי רמות ביטוי אנדוגני והמגוירים subcellular יליד שותפי האינטראקציה 11,21 באופן כמותי 27. האות שהושגה באמצעות assay זה (גודל מושבה כלומר על מערכי מושבה בצפיפות גבוהה) ובכך משקפת את הסכום של קומפלקסי חלבונים שנוצרו בין הפיתיון והטרף בסביבה סלולרית כמעט שווה ערך לאחד מתאי wild-type. Assay מבוסס על הכינון מחדש של אנזים כתב המעורב במטבוליזם של חומצה פולית, דיהידרופולאט רדוקטאז (DHFR), לפיה שני שברים משלימים של DHFR שהתמזגו שני חלבונים של עניין הם הביאו לקרבה כאשר שני חלבוני האינטראקציה, ש בתורו מוביל לכינון מחדש הפיך של פעילות אנזים 1גידול של 1 ושל העומס על methotrexate בינוני מכיל (MTX; איור 1). מתחם זה מעכב את אנזים אנדוגני DHFR, אבל לא אחד שעבר מוטציה בשימוש assay 28. שני אוספים של זני PCA, אחד המכיל ~ 4,300 מאטה זנים עם ORF התמזג DHFR F [1,2] ובר אחד המכיל ~ 4,800 MAT α זנים עם ORF התמזג DHFR [3] שבר, ניתן לרכוש ל ליישם DHFR-PCA בקנה מידה קטנה או גדול בכל מעבדה. כאן, אנו מתארים פרוטוקול כללי אבל מפורט למסך ל- PPI בין חלבון פיתיון אחד ו~ 4,800 חלבוני טרף באמצעות assay זה.
Protocol
1. בנייה / אימות של זני Bait
- אם מתח הפיתיון של עניין זמין ב[ 1,2] אוסף מאטה DHFR F, לשלוף אותו מהאוסף כמתואר בשלב 1.1.1, אחרת לבנות את המתח כמתואר בשלב 1.1.2.
הערה: הפרוטוקול המתואר כאן משתמש DHFR F [1,2] זן כפיתיון וDHFR F [3] אוסף כפושט, כאוסף זה מכיל יותר מ זני DHFR F [1,2] האוסף. עם זאת, ניתן לבצע את המסך להיפך אם מתח הפיתיון זמין רק בDHFR F [3] האוסף או בשני הכיוונים, אם אחד מהם דורש כיסוי גבוה יותר של interactome.- להפשיר את צלחת מניית גליצרול המכילה את זן הפיתיון על קרח למשך שעה אחת. לעקר את רדיד האלומיניום מכסה את הצלחת באמצעות אתנול 95%. פירס נייר עם טיפ סטרילי, פיפטה מעלה ומטה כדי resuspend התאים וμl 2-3 הפס של מניית גליצרול על peptone תמצית שמרים סלקטיביתדקסטרוז (YPD) + 100 מיקרוגרם / מיליליטר Nourseothricin (נט) כדי לבודד מושבות אחת. דגירה במשך יומיים ב 30 מעלות צלזיוס.
- בנייה של מתח PCA פיתיון (מאטה DHFR F [1,2]).
- [1,2] קלטת באמצעות פולימראז באיכות גבוהה ופרוטוקול PCR סטנדרטי, להגביר את DHFR F מפלסמיד pAG25-מקשר DHFR F [1,2] -ADHterm באמצעות oligonucleotides עם תלויה מסתיימת הומולוגית ל -40 נ"ב האחרון של ORF של 3'-end לא כולל קודון העצירה (פריימר Forward) ועד 40 נקודות בסיס הראשונות שלו של הגן 3'-UTR (איור 1 א) (פריימר ההפוך).
- להפוך את מוצר ה- PCR לתאי שמרים מוסמכים (בדרך כלל במתח BY4741) תוך שימוש בפרוטוקול שמרי שינוי סטנדרטי LiOAc / PEG כב 29 (איור 1 א).
- צלחת על YPD סלקטיבית + בינוני נט לבודד transformants החיובי.
- לבצע PCR מושבה אבחון במושבות מבודדות כדי לאשר את DHFR F הנכון [1,2] ההיתוך. השתמש ביחסי ציבורimers חישול 1) ברצף קוד הגנטי של (אוליגו קדימה) כ -100 נ"ב במעלה הזרם של היתוך DHFR ו -2) בשליחות קטלנית ADH של הקלטת (בכיוון ההפוך אוליגו) (איור 1).
- רצף מוצר ה- PCR על ידי סנגר רצף כדי לאשר היתוך גן תקין.
- ארכיון מתח הפיתיון אישר בגליצרול 25% ב -80 מעלות צלזיוס.
הערה: הפרוטוקול יכול להיות מושהה בשלב זה.
2. נהלי עיקור והדפסת Pin-כלי
הערה: הליך העיקור המתואר להלן הייתה מותאם לפין-הכלים שהופעלו על ידי BM3-BC (רובוטיקה S & P) פלטפורמה רובוטית, אבל יכולה להיות מותאמת לפלטפורמות אחרות גם כן. סעיף זה מתאר את הליכי עיקור והדפסת Pin-כלי המשמשים להעברת תאים ממדיום אחד למשנהו לשארית של הפרוטוקול. ניתן להשיג תסריטים בבית המשמשים לביצוע שגרה אלה על פי בקשה. tha הערהt ניתן לבצע את כל הפעולות ללא הצורך בפלטפורמה רובוטית באמצעות סיכה-כלי 30 ידני.
- הר פיני הכלי המתאים על הפלטפורמה רובוטית.
- הכן ניקוי ותחנות רטובות כדלקמן:
- הוסף 500 מיליליטר של מים סטריליים בתחנת אמבט מים.
- להוסיף 320 מיליליטר של מים סטריליים בתחנת המברשת.
- להוסיף 380 מיליליטר של אתנול 70% בsonicator כאשר משכפלים מצלחת אגר (omnitray 86 x 128 מ"מ, המכיל 35 מיליליטר של מדיום מוצק) לצלחת אגר, או 400 מיליליטר כאשר משכפלים מצלחת microtiter המכילה תרבויות נוזלי לצלחת אגר.
- להוסיף 35 מיליליטר של מים סטריליים בתחנה הרטובה (בהיקף של omnitray הריק סטרילי).
- בתחילתו של כל יום שדורש פלטפורמה רובוטית, לעקר את פיני הכלים חמש פעמים דקות אחד באמבטיה sonicator. בינתיים, להדליק את מנורת UV במשך חמש דקות כדי לעקר את מתחם הרובוט.
הערה: זו אינה נדרשת אם לשדודot שוכן מתחת למכסת מנוע סטרילית. - בין כל סיבוב שכפול פיני כלי, לעקר את פיני כלי כדלקמן:
- משרים את פיני הכלי חמש פעמים במשך 10 שניות בתחנת אמבט מים כדי להסיר גושי תא.
- משרים את פיני כלי פעמיים הלוך ושוב בתחנת המברשת.
הערה: המברשת המסתובבת תסיר תאי שיורי. - משרים את פיני כלי פעמיים במשך 20 שניות בתחנת sonicator.
הערה: נותרה תאים על הפינים יוסרו על ידי sonication או נהרגה על ידי אתנול. - ודא שעומק הטבילה של הסיכות מגדיל בכל אמבטיה רצופה כדי להבטיח עיקור נכון.
- ייבש את פיני הכלי בתחנת אוויר מייבש במשך 25 שניות.
- לפני נטילת תאים בצלחות המקור, להרטיב את הסיכות בתחנה הרטובה, המכילה 35 מיליליטר של מים סטריליים בomnitray.
- טובלים את הסיכות פעמיים במושבות מצלחת המקור.
- הדפסה על צלחת יעד טרי שפכו על ידי הנגיעה בagמשטח ar פעמיים (המכונה הפעולה של "הדפסה" מערך להלן).
3. עיבוי של DHFR F [3] האוסף ב1,536 מערכי שימוש אוטומטי לכיסוח פלטפורמה
- הפשרה על קרח DHFR F [3] האוסף (צלחות 60 96-היטב) ו96-גם צלחת נוספת מלאות בDHFR L-F [3] מתח ביקורת (איור 1 ג), אשר מכיל את DHFR F [3] שבר והמקשר במעלה הזרם הביע לבד כביקורת שלילית.
הערה: באופן עקרוני, בר זה לא צריך אינטראקציה עם כל חלבון DHFR-הבר פיוז'ן (ראה דיון לפרטים נוספים). - צלחות צנטריפוגה (סיבוב מהיר) לפני הסרת נייר האלומיניום כדי למנוע סיכונים של זיהום צולב בין בארות.
- לתמצת את האוסף על 16 מערכים של 384 זנים (איור 2 א). כדי לעשות זאת, עבור כל מערך 384, הדפסת ארבע צלחות גליצרול בארבעת הרביעים של YPD סלקטיבית + 250 מיקרוגרם / מיליליטר hygromycin B (HygB) omnitray באמצעות הדואר 96 פיני כלי (כאן, מערך 384 ניתן לחלק בארבעה רביעים interspaced באותה מידה, כל אחת בהיקף של 96 משרות בפריסת מטריצה 2 x 2). הכנס ארבעה 96-גם צלחות המכילות [3] הביקורת השלילית L-DHFR F בין 60 הצלחות אחרות על מנת להיות קבוצה סופית של 64 צלחות שבדיוק למלא ארבעה 1,536 מערכים. לעקר את פיני הכלי בין כל מחזור שכפול כמתואר בשלב 2.
הערה: הכנס את L-DHFR F [3] צלחות כדי שתהיה לי צלחת אחת כזו בכל אחד מארבעת 1,536 המערכים הסופיים. - דגירה צלחות במשך יומיים ב 30 מעלות צלזיוס. הערה: בשלב זה, אוסף DHFR יכול להיות מאוחסן בפורמט 384 ב 4 C עד חודש אחד על צלחות אגר.
- לתמצת את האוסף לארבעה מערכים של 1,536 זנים (איור 2 א). כדי לעשות זאת, עבור כל מערך 1,536, להדפיס ארבעה מערכים של 384 זנים בארבעה הרביעים של צלחת שלו המדיום כמו בשלב 3.2 באמצעות 384 פיני הכלי (כאן, מערך 1,536 ניתן לחלק בארבעה דוארqually interspaced רביעים כל אחת מהן 384 משרות בפריסת מטריצה 2 x 2).
- דגירה צלחות במשך יומיים ב 30 מעלות צלזיוס. הערה: בשלב זה, אוסף DHFR יכול להיות מאוחסן בפורמט 1,536 ב 4 C עד חודש אחד על צלחות אגר.
- לשכפל את ארבעת מערכים באותו המדיום לתקן גודל מושבה באמצעות 1,536 פיני כלי.
- דגירה צלחות במשך יומיים בכ- 30 מעלות צלסיוס.
4. נוהל DHFR-PCA תפוקה גבוהה
- לחסן תרבות של זן הפיתיון (היתוך DHFR F [1,2]) המתקבל מצעד 1.1.1 או 1.1.2 ב 20 מיליליטר של נוזל YPD + נט בשפופרת 50 מיליליטר (איור 2).
- דגירה במשך יומיים ב 30 מעלות צלזיוס עם הרועד ב 250 סל"ד כדי לאפשר התרבות כדי להגיע לרוויה.
- לאחר יומיים של דגירה, צלחת 5 מיליליטר של התרבות על YPD + נט omnitray. בואו תאים לספוג על פני השטח למשך 5-10 דקות ולהסיר את הנוזל העודף (איור 2). t חזורwice לעשות שלוש חזרות.
- דגירה במשך יומיים ב 30 מעלות צלזיוס.
- הדפס את מתח הפיתיון מצעדים 4.3 ו -4.4 ב -12 בצלחות YPD (מספיק להזדווגות ארבע צלחות של DHFR F × שלוש משכפל [3] אוסף) עם 1,536 פיני כלי שימוש בכל תא דשא לא יותר מארבע פעמים.
- הדפס את המערך המתאים של DHFR F [3] האוסף על גבי תאי הפיתיון באמצעות פיני הכלי 1,536 (איור 2 ג).
- בואו זני הזדווג ידי דוגרים במשך יומיים ב 30 מעלות צלזיוס.
- בחר תאי דיפלואידי ידי הדפסת מושבות על omnitrays מכיל YPD + HygB + נט (איור 2 ג).
- דגירה במשך יומיים ב 30 מעלות צלזיוס.
- בחירת דיפלואידי חזור כמתואר בשלבי 4.8 ו -4.9 (איור 2).
- להכין צלחות עם תקשורת המכילה MTX (בינוני MTX) יום לפני השימוש בהתאם להוראות באות 21 (זהירות:. להיות זהירים בעת העבודה עם MTX כפי שהיא תרכובת רעילה תמיד ללבוש כפפות, הגנה של מחזורמשקפיים ction וחלוק מעבדה בעת טיפול זה) (איור 2 ג):
- הכן את 10x -lys / פגש / נשירת חומצת אמינו ade במים ללא יונים. מסנן לעקר נשירה בבקבוק סטרילי באמצעות מסנן מזרק סטרילי 0.2 מיקרומטר או, במידת צורך בכמויות גדולות, משפך 0.2 מיקרומטר בקבוק עליון סינון (טבלת 1).
- הכן 10 מ"ג / מיליליטר פתרון מניות MTX בsulfoxide דימתיל (DMSO). השתמש מייד לאחר הכנת הפתרון ולהקפיא את השאר ב -20 ° C. להגן עליו מפני אור כפי שהוא רגיש לאור. אין להקפיא MTX שוב לאחר הפשרתו.
- הכן את התקשורת באופן הבא (מרכיבים וכמויות בינוניים זהים לאלה המשמשים בTarassov et al 11.):
- לליטר אחד של מדיום, לערבב בשתי צלוחיות נפרדות: 1) 6.69 גרם של שמרי בסיס חנקן ללא חומצות אמינו וללא אמוניום סולפט ו -330 מיליליטר של מים ללא יונים; 2) 25 גרם של מיליליטר אצילי אגר ו -500 של מים ללא יונים.
- צלוחיות החיטוי ב 121 מעלות צלזיוס במשך 20 דקות.
- לאזן טמפרטורה באמבט מים ב 55 מעלות צלזיוס במשך שעה אחת לפחות.
- מערבבים את שתי צלוחיות יחד ולהוסיף 50 מיליליטר של גלוקוז 40% סטרילי, של 10x נשירת סטרילי 100 מיליליטר, 20 מיליליטר של 10 MTX מ"ג / מיליליטר.
- יוצקים 35 מיליליטר (ראה הערה בהמשך) של מדיום בomnitrays. בואו לחזק לפחות שעה וחצי. לוחות מגן מפני אור.
הערה: כאן, לשפוך 35 מיליליטר של מדיום לomnitray הוא קריטי כדי להבטיח עובי צלחת שווה, וזה חשוב עבור כל הצעדים במורד הזרם.
- צלחות תמונה מהסיבוב השני של בחירת דיפלואידי עם הפלטפורמה רובוטית או עם מצלמה דיגיטלית רגילה עם תאורת צלחת אחידה. השתמש בתמונות אלה כדי לזהות עמדות ריקות על המערכים בעת ביצוע הניתוח במורד הזרם. ודא שהפרמטרים של המצלמה הם תמיד אותו הדבר ושאור הרובוט מופעל.
- להדפיס תאי דיפלואידי על USI תקשורת MTXng 1,536 פיני הכלי.
- דגירה במשך ארבעה ימים על 30 מעלות צלזיוס בשקיות פלסטיק כדי למנוע התייבשות.
- הכן מנה שנייה של omnitrays מכיל בינוני MTX כמתואר בשלב 4.11.
- לאחר ארבעה ימים של דגירה, צלחות תמונה באמצעות הפלטפורמה רובוטית או מצלמה דיגיטלית רגילה. ודא שהפרמטרים של המצלמה הם תמיד אותו הדבר ושאור הרובוט מופעל.
- לבצע סיבוב של בחירת MTX שני על ידי שכפול התאים במנה השנייה של תקשורת MTX.
הערה: זה יקטין את צמיחת הרקע של זני PCA ולהגדיל את הרזולוציה כמותי. - דגירה במשך ארבעה ימים על 30 מעלות צלזיוס בשקיות פלסטיק כדי למנוע התייבשות.
- צלחות תמונה כמתואר בשלב 4.16.
ניתוח 5. תמונה
- ניתוח תמונות של מערכי מושבה עם ImageJ המותאם אישית 31 סקריפטים או שימוש בתוכנות שפורסמו כגון קולוניאלי, מנתח רשת המושבה Ht, מאבחן Cell, תמונת המושבהr, ScreenMill, YeastXtract וגיטר (מלוקט ב -32). ניתוח תמונה צריך פלט אחד או כמה גיליונות אלקטרוניים המכילים גדלי מושבה לכל תפקיד של כל מערך, השתמשו בגדלים המושבה הללו לכל הניתוחים במורד הזרם.
הערה: במחקר זה, השתמשנו תסריט ImageJ המותאם אישית שתואר בLeducq et al 33 (ראו סעיף דיון לפרטים נוספים)..
ניתוח 6. נתונים
הערה: תוצאות מניתוח תמונה יכולות להיות מעובד בטַבלָר כגון Excel או באמצעות שפת סקריפטים כגון R 34. השלבים הבאים מתארים את ההליך באמצעות תסריט ImageJ 31 מותאם אישית.
- שימוש בסקריפט מותאם אישית, לשרשר קבצי פלט מניתוח תמונה ויסמנו כל שורה עם הצלחת ולהתאמץ מידע בטבלה משלים 1.
- התחבר 2 להפוך את ערכי גודל מושבה (צפיפות משולבת או באזור מושבה; כאן, טור "IntDenBackSub & #8221; מטבלת משלים 1 היה בשימוש).
הערה: חלוקת ערך תיראה כמו באיור 3 א. - לנרמל את הערכים הללו על ידי הפחתת הערך החציוני של כל צלחת.
הערה: פקדי שלב זה להטית צלחת שעשויה להיגרם כתוצאה מכמות שווה תקשורת או וריאציה ברכישת תמונה אוטומטית, ומפחית את השונות בין-לשכפל (איור 3). - ודא שמשכפל לתאם אחד עם השני (איור 3 ג) כדי להעריך את שחזור של הניסויים.
- כדי לבדל את האינטראקציה מזוגות פיתיון-טרף אינטראקציה-עישון, להגדיר סף ברמת ודאות גבוהה המתאים לאחוזון ה -95 של חלוקת L-DHFR F [3] הבקרות.
הערה: בניסוי זה, זה מתאים ל3.39 (3D איור). לחלופין, ניתן להשתמש בסף מבוסס על החפיפה עם interactors הפיזי ידוע כגון אלו שדווחו בBioGRID 35.ראה דיון לפרטים נוספים. - לכל פיתיון, מסנן הפושט זוהה כמעורבים באינטראקציות חיוביות כוזבות במסכי DHFR-PCA (ראה דיון לפרטים נוספים) ומופיע בטבלה משלימה 2 (המזוהה "1" בטור "מסונן").
- ממוצע גדלי מושבה מנורמלת log2 של שלושה משכפל של כל אינטראקציה (עמודה "ציון ממוצע" בטבלה משלימה 2).
7. אישור של הגופני interactors באמצעות ניסויים בקנה מידה קטנה
הערה: כל PPI עניין מיוחד שיש לו ציון מעל או קרוב לסף להחיל יכול להיות מאומת באמצעות assay DHFR-PCA בתכנון ניסוי בקנה מידה קטנה באמצעות assay צמיחה במדיום MTX מוצק או נוזלי. השלבים הבאים יציגו את ההליך לבנות באופן ידני זני PCA דיפלואידי ולבצע מבחני נקודה על מדיום MTX. הנסיין צריך לבצע את הפעולות הבאות עבור כל necessarבקרות y (Bait-DHFR F [1,2] L-DHFR x F [3], ציפר-מקשר DHFR זני דיפלואידי ומתח דיפלואידי מקשר DHFR).
- μl צלחת 2-3 ממניות גליצרול של זן הפיתיון שנוצר ב1.1.2.6), L-DHFR F [3] מתח שליטה, זני דיפלואידי ציפר-מקשר DHFR והמקשר DHFR על YPD + נט, YPD + תקשורת HygB ופעמים YPD + נט + HygB, בהתאמה.
- אחזר את הטרף של העניין בDHFR F [3] האיסוף ולעקוב אחר הוראות בשלב 1.1.1, אבל פס העומס על מדיום YPD + HygB במקום בינוני YPD + נט.
- לבצע PCR לאבחון כמו ב1.1.2.4 כדי לאשר את DHFR F [3] היתוך במוקד הטרף ורצף המוצר.
- לחסן 1 מיליליטר של מדיום YPD הנוזלי עם הזנים הפלואידים להזדווג (Bait x טרף, L-DHFR x Bait F [3] שליטה) ולגדול לפחות יומיים ב 30 מעלות צלזיוס, כדי לאפשר diploids ליצירת.
- בחר diploids על ידי פסי 4-5 μl של התרבות ב7.4 על מדיום YPD + HygB + נט מוצק. לגדול שני ימים ב 30 מעלות צלזיוס.
- אין תמיכה בבחירהt מושבה אחת מבודדת ולגדול בין לילה בתרבות נוזלית (1 מיליליטר) כדי לבצע את assay הצמיחה.
- הכן צלחות MTX וDMSO (אותו מרכיבים כבינוניים MTX, אך ללא MTX) יום לפני השימוש. ראה שלב 4.11 לפרטים נוספים.
- בצע assay צמיחה על ידי איתור דילולים סדרתי של התרבויות השונות על השליטה (DMSO) וצלחות בחירה (MTX).
- לדלל precultures לOD = 1.
- לבצע דילולים פי חמישה (עד גורם לדילול של 625) בצלחת 96-היטב סטרילי.
- מקום 4 μl של כל דילול על תקשורת PCA (DMSO וMTX).
- לדגור על 30 מעלות צלזיוס בשקיות פלסטיק כדי למנוע התייבשות.
- צלחות תמונה מימים 1 עד 7 מתוך דגירה באמצעות הפלטפורמה רובוטית או מצלמה דיגיטלית רגילה.
תוצאות
לוח משלים 2 הוא דוגמא לתוצאות שהושגה באמצעות נציג שמרי החלבון Nup82 התמזג DHFR F [1,2] הבר כפיתיון. הסף שנקבע עם L-DHFR F [3] בקרות יכולים לשמש כסף אמפירי כדי לקבוע להיטי ביטחון גבוהים (איורים 3D & 3E). לחלופין, דירוג הציון ניתן להשתמש כדי לבצע מוספים לג'ין אונטולוגיה או אחרים תפקודי מנתח 36 המבוסס על סטנדרטים זהב 37. Interactors הפיזי הידוע של הפיתיון יכול להאסף ממאגרי מידע כמו 35 BioGRID ומעולף על נתונים (הנתונים 3E & 3F). בדוגמא זו, חמש מתוך שמונה להיטי ביטחון גבוה כבר דווחו בעבר כinteractors Nup82 ושני הם חלק מsubcomplex Nup82, Nup116 וNup159 (איור 3F & 3G). חבר האחר של המתחם, Nsp1, לא מראה שום Interaction בניסוי שלנו. שני פושט, Ade17 וTef2 (לא מוצג באיור 3F), קבל ציונים מעל הסף הקשה ליישם, אבל אלה עשויים להיות חיוביים שגויים כפי שהם אינטראקציה עם כמעט כל חלבון פיתיון במסכי PCA שבוצענו (תוצאות לא פורסמו). מצד השני, Pex30 עשוי לייצג interactor פיזי רומן של Nup82 והיינו יכול לאשר אינטראקציה זו באמצעות DHFR-PCA בתפוקה נמוכה (איור 3G). Pex30 הוא חלבון קרום peroxisomal וכמה אינטראקציות ישירות דווחו בין מורכב הנקבובית הגרעיני (NPC) ואברון זה. מסך דו-היברידי זיהה שני חלבוני NPC אחרים, Nup53 וAsm4 (Nup59), כinteractors הפיזי של Pex30 38, ואינטראקציה גנטית בין Pex30 וNup170 דווחה 39. שני שותפים אחרים אינטראקציה זוהה, Nup120 וNup85 (איור 3F & 3G), אינם חלקים מהמשנה המורכבת Nup82, הממחישים את היכולתשל DHFR-PCA כדי לזהות אינטראקציות בתוך ובין subcomplexes במתחמים גדולים יותר 11.
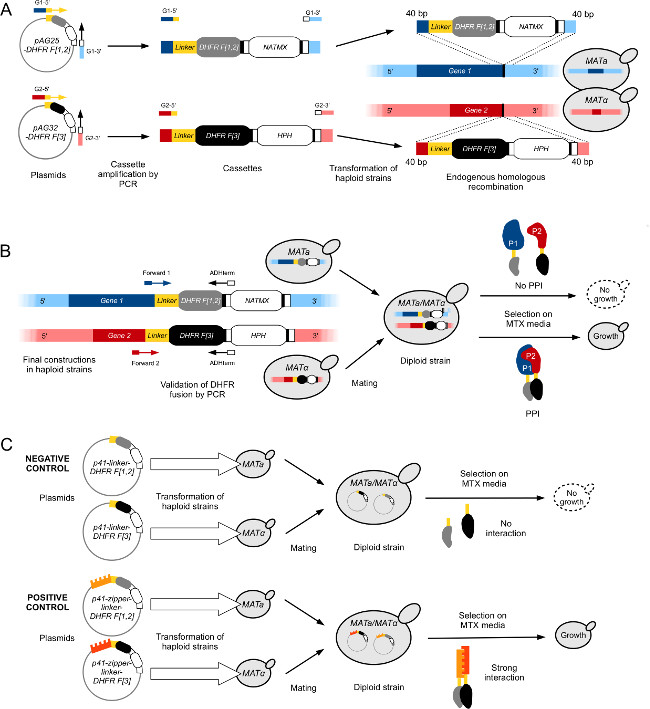
איור 1:. זני שמרי הנדסה לתפוקה גבוהה DHFR-PCA (. הדמות המותאמת מLeducq et al 2,012 33) בנייה (א) לזני מאטה וα MAT הפלואידים למזג Gene1 (G1) וGene2 (G2) עם DHFR F [1,2] -NatMX וDHFR F [3] -HPH קלטות, בהתאמה. קלטות הן מוגברות מפלסמידים pAG25-DHFR F [1,2] וpAG32-DHFR F [3] עם G1-5 פריימרים קדימה 'וG2-5', ולהפוך פריימרים G1-3 'וG2-3', ולאחר מכן הוכנס בגנום בסוף '3 של גן המטרה על ידי רקומבינציה ההומולוגית. החלבונים וכתוצאה מכך, P1 ו- P2, הם בהתאמה התמזגו DHFR F [1,2] בר (מאטה) וDHFR F [3] שבר (MATα) באמצעות מקשר גמיש. (ב) אימות של הבנייה ב() מתבצע על ידי רצף צמתים בין Gene1 של וORFs של Gene2 ו קלטות DHFR. זני PCA בנויים מנוגדים סוגי הזדווגות מכן הזדווגו כדי ליצור דיפלואידי. זני דיפלואידי לגדול במדיום MTX אם שני שברי DHFR משלימים הם הביאו לקרבה על ידי אינטראקציה בין P1 ו- P2, שreconstitutes הפעילות של אנזים DHFR. בנייה (C) של שליטת PCA דיפלואידי זנים למסכי DHFR-PCA. הבקרות השליליות (L-DHFR) בנויות על ידי הפיכת זני מאטה וMATα בנפרד הפלואידים עם פלסמידים P41-מקשר DHFR F [1,2] וP41-מקשר DHFR F [3] 11, בהתאמה. שני זנים הם הזדווגו וכתוצאה מכך מתח דיפלואידי ביקורת שלילית שבו שברי DHFR אינם מסוגליםלמשלים אחד את השני (למעלה). בקרות חיוביות נבנות תוך שימוש באותה הגישה כמו לבקרה השלילית, אבל פלסמידים הפכו בזנים הפלואידים (P41-רוכסן-מקשר DHFR F [1,2] (P41-ZL-DHFR F [1,2]) וP41 -zipper-מקשר DHFR F [3] (P41-ZL-DHFR F [3])) מכיל שברי שני GCN4 אוצין המקביל רוכסן התמזגו ברי DHFR המשלימים, מה שמוביל לאינטראקציה חזקה ומכוננת שreconstitutes פעילות DHFR (תחתון ). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
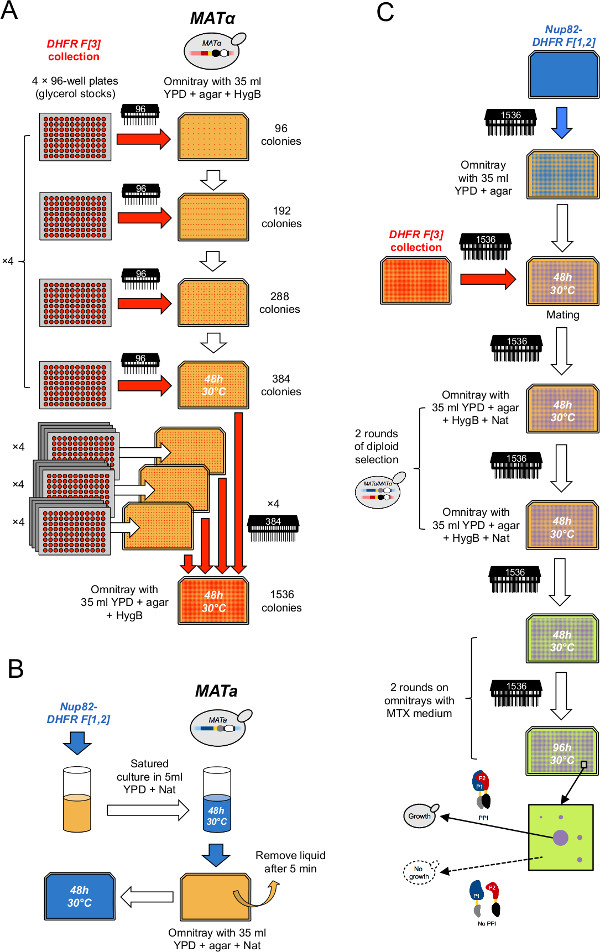
איור 2: הליך DHFR-PCA תפוקה גבוהה (דמות שהותאמה מet al Leducq 33.) () MAT α DHFR F [3] האוסף. הוא מרוכז בפורמט 1,536 באמצעות שני סיבובים רצופים של עיבוי. ראשית, צלחות מניית גליצרול משולבות בקבוצות של ארבעה על מדיום YPD + HygB סלקטיבית בפורמט 384 באמצעות 96 פיני הכלי. שנית, 384 מערכים משולבים על ידי קבוצות של ארבעה על מדיום YPD + HygB סלקטיבית בפורמט 1,536 באמצעות 384 פיני הכלי. מדשאות תא (B) של זן פיתיון מאטה PCA ערוכות על ידי גידול תרבות רוויה של זן הפיתיון ב YPD סלקטיבית + בינוני נט וציפוי התרבות בנט YPD + omnitray. (C) מדשאות אלה משמשים להזדווג מתח הפיתיון עם DHFR F [3] האוסף על מדיום YPD. תאים ברציפות מועברים פעמיים על מדיום YPD + HygB + נט כדי לבחור עבור diploids ופעמים במדיום MTX לבצע PCA. צמיחה יקויימו רק על מדיום MTX אם שברי DHFR משלימים אחד את השני הבא אינטראקציה בין הפיתיון וחלבוני הטרף."Target =" e.jpg _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
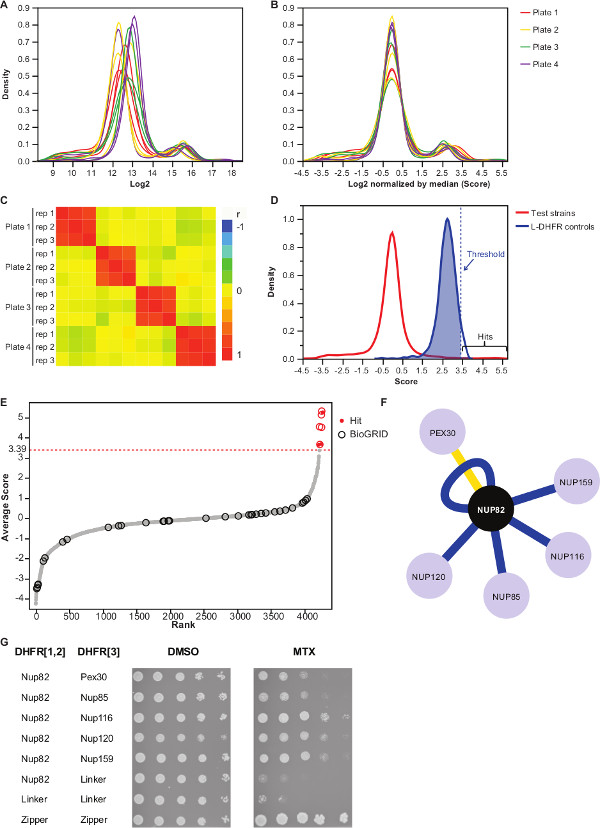
איור 3:.. נורמליזציה נתונים הניתוח באמצעות צעדי נורמליזציה, קביעת סף משמעות וזיהוי של אינטראקציות חיוביות () הפצת צפיפות של גודל מושבה על כל צלחת (יומן 2) (ב) על ידי החציון של כל תמונה מתקנת להטיות קשור בתופעות צלחת לצלחת. Heatmap (C) המציגה את מקדם מתאם ספירמן בין הצלחות, המאשר את שחזור של ההליך. הפצה (D) של ציונים לPPIs נבדק וL-DHFR F [3] בקרות. סף קשיח יכול להיות מוגדר 95 אחוזון ה של L-DHFR F [3] הפצה לזהות PPIs ברמה ודאות גבוהה (המיוצג על ידי מקווקו אנכיהפצה) כדי דרגה. (E) שורה של הציון הממוצע של כל טרף. שותפים שדווחו בעבר פיזי אינטראקציה של Nup82p בBioGRID 35 מזוהים על ידי חוגים ואלו שדווחו במחקר זה מזוהים על ידי נקודות אדומות. הסף שנקבע ב( D) מוצג כקו מקווקו. (F) רשת מציגה את PPIs ברמה ודאות הגבוהה שזוהה במחקר זה. interactors קצוות כחולים מראים שדווחו בעבר הפיזי (35 BioGRID) וקצוות צהובים להראות אינטראקציה שלא דווחה בעבר עם Pex30. assay ספוט-הדילול של זני דיפלואידי PCA מעורבים Nup82-DHFR F [1,2] והטרף-DHFR F [3 (G) ] זוגות זוהו כinteractors הפיזי של Nup82p במחקר הנוכחי. assay הצמיחה בוצע במדיום DMSO (ממס MTX, פנל משמאל) ובינוני MTX (פנל מימין). בקרות שליליות בהיקף של Nup82-DHFR F [1,2] - לינקר-DHFR F [3] ולינקר-DHFR F [1,2] - לינקר-DHFR F [3] ושליטה חיובית בהיקף של tהוא אינטראקציה חזקה בין שתי moieties הרוכסן לאוצין (רוכסן-DHFR F [1,2] - הרוכסן-DHFR F [3]) היו כלולים. תא צמיחה מעולה לבקרה השלילית במדיום MTX יש לפרש כאינטראקציה פיזית. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| חומצת אמינו | כמות (ז) |
| סולפט אדנין * | 0.2 |
| L-Tryptophane | 0.4 |
| L-טירוזין | 0.3 |
| ל-פנילאלנין | 0.5 |
| חומצה גלוטמית L-(מלח מונוסודיום) | 1.0 |
| L-asparagine | 1.0 |
| L-Valine | 1.5 |
| L-תראונין | 2.0 |
| L-Serine | 3.75 |
| Uracile | 0.2 |
| L-היסטידין HCl | 0.2 |
| L- ארגינין HCl | 0.2 |
| L-מתיונין * | 0.2 |
| L ליזין * | 0.2 |
| L-לאוצין | 0.6 |
| * הסתגרות בעת ביצוע PCA סטנדרטית (כמו בפרוטוקול זה) אך ניתן להוסיף למטרות אחרות. | |
טבלת 1:. כמויות הרכב 10X -lys / הנשירה / ADE נפגשה במדיום MTX הן לליטר אחד של 10x נשירה. כוכביות לציין את התרכובות שיש משיכה למדיום MTX הסטנדרטי, אבל שניתן להוסיף למטרות אחרות.
לוח משלים 1:. נתונים משולבים מצלחות מבחן 12 טבלה 1 מכילה את דה בשרשורta מניתוח ImageJ בוצע באמצעות תסריט ImageJ מותאם אישית עם כל שורה המתאימה לעמדה אחת על כל מערך 1,536. בנוסף, כל שורה כבר מבוארת עם המידע על קובץ התמונה, צלחת אוסף DHFR, לשכפל, ORF ושם חלבון.
לוח משלים 2:. צמיחה מנורמלת ממוצעת למתח טבלה 2 מכילה את הצמיחה מנורמלת יומן 2 הממוצעת עבור כל זן של האוסף יחד עם סטיית התקן. פושט מסונן, להיטים וinteractors הפיזי הידוע מזוהים בעמודות נפרדות.
Discussion
אנו מתארים פרוטוקול המבוסס על assay DHFR-PCA מאפשר זיהוי השיטתי של interactors הפיזי לכל חלבון פיתיון ניתנו בתפוקה גבוהה. פרוטוקול זה יכול להיות מותאם על ידי בדיקות סקר ליותר פיתיונות, וזה בכל רמה רצויה של שכפול. אנחנו מדגימים את האמינות של פרוטוקול זה על ידי זיהוי של שותפי אינטראקציה פיזיים לחלבון פיתיון המעורב במתחם הגרעיני נקבובי: Nup82. הניתוח שלנו אפשר למצוא חמישה interactors שדווח בעבר ואחד interactor (איורים 3F & 3G) לא פורסם בעבר, המדגיש את היכולת של השיטה ללמוד interactome שמרי החלבון.
הפרוטוקול המתואר כאן כולל מספר שלבים קריטיים שהנסיין צריך לשים לב. אנו ממליצים ל1) ודאו שDHFR הפיתיון F [1,2] היתוך נכון (איור 1); זו יכולה להיות מושגת על ידי רצף הבנייה וmeasuring ביטוי חלבון נכון באמצעות אנטי-DHFR F [1,2] או אנטי DHFR-F [3] נוגדן; 2) לפני תחילת המסך, מומלץ לבדוק אם כל פיתיון של עניין מציג אינטראקציות מופקרות במסכי PCA. ניתן לעשות זאת על ידי ביצוע מסכי שליטה עם פיתיונות חצו עם הבקרה הנאותה L-DHFR או על ידי הזדווגות ידנית את הפיתיון עם הבקרה הנאותה L-DHFR וביצוע assay צמיחה במדיום MTX. 3) צלחות צריכה להיות שפכו היום לפני שהם נמצאים בשימוש, כך שהלחות היא אופטימלית לדבקות תא על פני השטח אגר במהלך תהליך ההדפסה; 4) אין להשתמש בצלחות מקור יותר מארבע פעמים להעביר מספיק תאים בצלחת היעד. הגדלת מספר העותקים של צלחת היעד יכול להיעשות על ידי צעדים רצופים של התרחבות (למשל 4 עותקים -> 16 עותקים -> 64 עותקים). לחלופין, ניתן לאסוף תאים בעמדות שונות על המדשאות או במושבה בין סבבים השונים של שכפול; 5) אם מספר positions חסרים לאחר בחירת דיפלואידי (s), לוודא כי צלחות המקור לא היו בשימוש פעמים רבות מדי בשלב החיזור (שלבים 4.5-4.7); 6) ודא שמדיום MTX מכיל את כל המרכיבים החיוניים בריכוזים הנכונים. ואכן, אם אין צמיחה בכלל הוא ציין על מדיום MTX, זה יכול להיות גם משום שאין אינטראקציה ניתן לזהות על ידי PCA לחלבונים של עניין, או משום בינוני MTX לא היה מוכן כראוי. כדי להבטיח שהמדיום מאפשר צמיחה של זנים מראים DHFR ברי שלמה, ניתן להוסיף אינטראקציה מכוננת בעמדות ריקות של האיסוף ושימשה כביקורת חיובית כגון DHFR-ברים התמזגו moieties הרוכסן לאוצין 33 (איור 1 ג). בדיקות מקבילות באמצעות שברי המקשר DHFR או שברי הרוכסן-מקשר DHFR יאפשרו להבחין בין תנאים שיאפשר לכל התאים לגדול (ריכוז MTX נמוך או חלבון פיתיון שנוטים לעשות אינטראקציות חיוביות כוזבות, כdescribed להלן) ותנאים המונעים צמיחה של כל הזנים (מרכיב ריכוז MTX גבוה או חיוני מדי חסר במדיום); 7) בהתחשב בכך שPCA מתבצעת באמצעות סיבובים רצופים של משוכפלים ממדיום אחד למשנהו, זיהום צולב בין זנים בין לוחות שונים עלול להתרחש אם, למשל, פיני הכלי אינו מעוקר כראוי בין סיבובי שכפול ו / או המים שעבר אמבטיה (תחנה כלומר רטובה) בהליך העיקור מזוהם על ידי מושבות של סיבובי שכפול קודמים. מספר התפקידים במערכים ריקים ולכן יכולים לשמש כעמדות שליטה שבו אין צמיחה, יש לשים לב לגילוי זיהומים צולבים.
ניתוח תמונה יכול להתבצע באמצעות כמה תוכנות שפורסמו (ראה סעיף 5 לפרוטוקול) או כל תסריט מותאם אישית. במחקר זה, את התסריט המותאם אישית מבצע את השלבים הבאים: 1) התסריט גורע ערכי פיקסל של צלחת ריקה לפיקסל ערכים של כל צלחת כדי לשתףrrect להטיות תאורה. 2) התסריט ממיר כל תמונה מתוקנת רקע בינארית באמצעות סף ערך פיקסל של 10. 3) לכל 1,536 עמדות של כל צלחת, שנקבעו על ידי שכיסה מלבן במושבות הקצה, התסריט פועל ImageJ "לנתח חלקיקים ... "פונקציה בבחירה חוזר. הבחירה החוזר מוגדרת ברדיוס שווה לרווח בין שתי עמדות מינוס 10 פיקסלים. 4) התסריט בוחר את החלקיקים הקרובים ביותר ממרכז הבחירה ומאשר את זה כמושבה אם המיקום שלה הוא לא יותר ממחצית המרווח בין שתי מושבות מהמרכז של הבחירה. 5) התסריט מודד ערכי פיקסל של החלקיקים שנבחרו על התמונה מתוקנת רקע. 6) כדי לתקן עוד כל הטיות תאורת רקע שנותרו, את התסריט מחסיר את הערך הממוצע של כל הפיקסלים מהבחירה בחוזר, כי לא היו חלק מחלקיקים לערכי פיקסל של המושבה. הסכום של ערך פיקסל תיקן אלהים, מאוחסן בטור "IntDenBackSub" לוח משלים 1, משמש כמדד לגודל מושבה.
שלב קריטי בחלק הניתוח הוא הבחירה של סף המשמעות. כאן, בחרנו סף המבוסס על חלוקת L-DHFR F השלילי [3] הבקרה, אך בהתאם למטרה של המסך, סף כזה עשוי להיות מחמיר מדי. ואכן, L-DHFR F [3] פקדי ביטוי יתר (אמרגן TEF חזק) באופן שהברים המשלימים עשויים באופן ספונטני משלימים אחד את השני ואלה ובכך אינם מייצגים את הביטוי של רוב החלבונים. זה מודגש על ידי העובדה שההפצה של L-DHFR F [3] הבקרות היא גבוהה מהממוצע של צמיחת הרקע (איור 3D). לכן, כמה אינטראקציות שיש ציונים מתחת לסף מחמיר זה אבל זה בבירור מחוץ להפצת צמיחת רקע יכול להיחשב כלהיטים משוערים שעשויות לייצג, למשל היתר, חולף או חלשפעולות. ניתן ללמוד אלה נוספים ומאומתים צולבים אם, למשל, שני החלבונים אינם באים לידי ביטוי ברמות שיכולות להרשות לשלמה הספונטנית של שברי DHFR כמו פקדי L-DHFR. כחלופה, אפשר להגדיר סף משמעות בהתאם לחלק היחסי של חפיפה עם interactors הפיזי דווח במסדי נתונים כמו 35 BioGRID על מנת למקסם את חלקם של תוצאות חיוביות האמיתיות על תוצאות חיוביות שגויות. עם זאת, בניגוד לשימוש בהפצת L-DHFR, חלופה זו עשויה שלא להיות תמיד אפשרית אם, למשל, מספר interactors הפיזי הידוע הוא לא גבוה מספיק. יתר על כן, הבחירה של סף המשמעות יש השפעה על השיעור של תוצאות חיוביות שגויות וגם שליליים שווא בערכת הנתונים הסופי. ואכן, כמו כל assay זיהוי PPI אחר, חיוביים שגוי יכול להיגרם כתוצאה מאינטראקציה נוקבת של חלבון עם חלבון DHFR-ההיתוך אם, למשל, החלבון הוא נרחב ביותר כאמור. זהמודגם על ידי העובדה שחלק פושט שיטתי אינטראקציה עם כל חלבוני הפיתיון במסכי PCA, ולכן, יש צורך להסיר מהניתוח 11 (לדוגמא Tef2 וAde17 ולוח משלים 2). כדי לעקוף בעיה זו, מסך PCA שליטה של שני אוספים נגד הבקרה הנאותה L-DHFR (F [1,2] או F [3]) כדי לזהות פיתיונות ופושט מציגים ספונטני DHFR ברי שלמה יכולה להתבצע בתנאים מסוימים של כל מסך. יתר על כן, ביצוע ניתוח העשרת Gene אונטולוגיה יכול להגדיל את האמון בנתונים אם הפונקציה של פיתיון נתון ידועה. מצד השני, DHFR-PCA יכולה להצמיח שליליים שגוי מכמה סיבות: 1) לא ניתן התמזגו כל החלבונים לברי DHFR כמו אלה עלולים לערער את היציבות בחלבונים או לשנות את הלוקליזציה שלהם, אם, למשל, היתוך DHFR ל C-הסופי מפריע לאות לוקליזציה; 2) הכינון מחדש DHFR בכמה תאים סלולריים מ 'איי לא לייצר חומצה פולית אם, למשל, מבשר חיוני לסינתזה של חומצה פולית אינו זמין; 3) C-Termini צורך להיות במרחק של 8 ננומטר לשלמת DHFR להתרחש 11. לפיכך, אינטראקציה ידועה לא תזוהה אם C-Termini שלהם לא קרוב מספיק בחלל. זה בא לידי ביטוי כאן בעובדה שחלק גדול מאינטראקציות פיזיות Nup82 דווחו במאגרי מידע, אשר רובם עקיפים, לא התגלה assay שלנו. בדומה לכך, אינטראקציות בין חלבוני קרום שC-טרמיני נמצאים בטרנס ביחס לקרום לא יובילו לDHFR ברי שלמה ולא יזוהה 11. מגבלות 1) ו -3) ניתן לעקוף יחסית פשוט על ידי איחוי שבר DHFR לN-Termini של החלבון. פעולה זו עלולה למנוע להפריע לאות לוקליזציה ליד C-Termini ועשוי לאפשר לגילוי אינטראקציה בין החלבונים בממברנה שN ו- C-הסופי נמצא ביחסי cisהקרום.
כמה אתגרים להישאר במחקר של מספרי זיהוי אישיים (שנסקר ב2,3). המפות של סיכות הופקו עד כה במידה רבה תוארו בתנאי ניסוי יחידים עבור כל מין ובכך להציע תמונת מצב אחת לאופן שעשויות להיות מאורגנים רשתות חלבון. אין אפוא צורך בבדיקה של תנאי ניסוי אחרים כדי לראות איך מספרי זיהוי אישיים עשויים להיות מחדש בתגובה לשינויים סביבתיים, גירויים מסוימים, על פני פיתוח או המוטציות הבאות. אתגרים אלה יהיו להתגבר על ידי פיתוח הטכנולוגיות חדשות לחקירת PPIs בזמן אמת, בתאים חיים ועל ידי התאמת טכניקות הנוכחיות, כך שהם יכולים להיות בשימוש על ידי קהילה גדולה יותר של מעבדות. כטכניקה כמותית שיכול לזהות שינויים בכמות של שלמת DHFR קומפלקסי 27, ניתן להתאים DHFR-PCA להתגבר על אתגרים אלה ונעשה שימוש כדי ללמוד איך PPIs מושפע DNA נזק סוכן 22 , חומרים כימיים 25, מחיקות גן 23,26 או במינים שמרים אחרים והכלאיים שלהם 33. היכרות עם הממדים החדשים אלה תהפוך ליותר ויותר חשובים לחשוף את הדינמיקה של PIN.
Disclosures
חלק מדמי פרסום גישה הפתוחים לכתבה זו שולם על ידי רובוטיקה S & P.
Acknowledgements
עבודה זו נתמכה על ידי מכון הקנדי לחקר בריאות (CIHR) מעניק 191,597, 299,432 324,265 ו, מדעי טבע והנדסת מועצת מחקר של מענק Discovery קנדה ומענק Frontier אדם תכנית המדע לCRL. CRL הוא חוקר CIHR חדש. גיום Diss נתמך על ידי מענק PROTEO. סמואל Rochette נתמך על ידי מלגות NSERC וFRQNT.
Materials
| Name | Company | Catalog Number | Comments |
| BioMatrix Robot, Bench-top Configuration | S&P Robotics Inc. | BM5-BC | |
| 96-format Pin-tool | S&P Robotics Inc. | PH-96-10 | Standard 96-format Pin-tool with 96 high-precision floating pins |
| 384-format Pin-tool | S&P Robotics Inc. | PH-384-10 | Standard 384-format Pin-tool with 384 high-precision floating pins |
| 1536-format Pin-tool | S&P Robotics Inc. | PH-1536-05 | Custom 1536-format Pin-tool with 0.5mm high-precision floating pins |
| Automated imaging module | S&P Robotics Inc. | IMG-02 | |
| Methotrexate | Bioshop Canada Inc. | MTX440 | CAUTION: toxic compound |
| Hygromycin B | Bioshop Canada Inc. | HYG003 | |
| Nourseothricin dihydrogen sulfate | Werner BioAgents | 5010000 | |
| Yeast-Interactome Collection | Thermo Scientific | YSC5849 | |
| Omni Tray w/lid sterile | Thermo Scientific | 242811 | |
| Anti-DHFR F[1,2] antibody | Sigma-Aldrich | D1067 | |
| Anti-DHFR F[3] antibody | Sigma-Aldrich | D0942 |
References
- Alberts, B. The cell as a collection of protein machines: preparing the next generation of molecular biologists. Cell. 92, 291-294 (1998).
- Diss, G., et al. Integrative avenues for exploring the dynamics and evolution of protein interaction networks. Curr Opin Biotechnol. 24, 775-783 (2013).
- Vidal, M., Cusick, M. E., Barabasi, A. L. Interactome networks and human disease. Cell. 144, 986-998 (2011).
- Hu, P., et al. Global functional atlas of Escherichia coli encompassing previously uncharacterized proteins. PLoS biology. 7, e96 (2009).
- Arifuzzaman, M., et al. Large-scale identification of protein-protein interaction of Escherichia coli K-12. Genome Res. 16, 686-691 (2006).
- Rajagopala, S. V., et al. The binary protein-protein interaction landscape of Escherichia coli. Nature biotechnology. 32, 285-290 (2014).
- Arabidopsis-Interactome-Mapping-Consortium. Evidence for network evolution in an Arabidopsis interactome map. Science. 333, 601-607 (2011).
- Babu, M., et al. Interaction landscape of membrane-protein complexes in Saccharomyces cerevisiae. Nature. 489, 585-589 (2012).
- Krogan, N. J., et al. Global landscape of protein complexes in the yeast Saccharomyces cerevisiae. Nature. 440, 637-643 (2006).
- Gavin, A. C., et al. Functional organization of the yeast proteome by systematic analysis of protein complexes. Nature. 415, 141-147 (2002).
- Tarassov, K., et al. An in vivo map of the yeast protein interactome. Science. 320, 1465-1470 (2008).
- Uetz, P., et al. A comprehensive analysis of protein-protein interactions in Saccharomyces cerevisiae. Nature. 403, 623-627 (2000).
- Guruharsha, K. G., et al. A protein complex network of Drosophila melanogaster. Cell. 147, 690-703 (2011).
- Li, S., et al. A map of the interactome network of the metazoan C. elegans. Science. 303, 540-543 (2004).
- Rual, J. F., et al. Towards a proteome-scale map of the human protein-protein interaction network. Nature. 437, 1173-1178 (2005).
- Landry, C. R., Levy, E. D., Abd Rabbo, D., Tarassov, K., Michnick, S. W. Extracting insight from noisy cellular networks. Cell. 155, 983-989 (2013).
- Berggard, T., Linse, S., James, P. Methods for the detection and analysis of protein-protein interactions. Proteomics. 7, 2833-2842 (2007).
- Wodak, S. J., Vlasblom, J., Turinsky, A. L., Pu, S. Protein-protein interaction networks: the puzzling riches. Current opinion in structural biology. 23, 941-953 (2013).
- Fields, S., Song, O. A novel genetic system to detect protein-protein interactions. Nature. 340, 245-246 (1989).
- Dunham, W. H., Mullin, M., Gingras, A. C. Affinity-purification coupled to mass spectrometry: basic principles and strategies. Proteomics. 12, 1576-1590 (2012).
- Michnick, S. W., Ear, P. H., Landry, C., Malleshaiah, M. K., Messier, V. A toolkit of protein-fragment complementation assays for studying and dissecting large-scale and dynamic protein-protein interactions in living cells. Methods Enzymol. 470, 335-368 (2010).
- Rochette, S., Gagnon-Arsenault, I., Diss, G., Landry, C. R. Modulation of the yeast protein interactome in response to DNA damage. Journal of proteomics. 100, 25-36 (2014).
- Diss, G., Dube, A. K., Boutin, J., Gagnon-Arsenault, I., Landry, C. R. A systematic approach for the genetic dissection of protein complexes in living cells. Cell Rep. 3, 2155-2167 (2013).
- Gagnon-Arsenault, I., et al. Transcriptional divergence plays a role in the rewiring of protein interaction networks after gene duplication. Journal of proteomics. 81, 112-125 (2013).
- Schlecht, U., Miranda, M., Suresh, S., Davis, R. W., St Onge, R. P. Multiplex assay for condition-dependent changes in protein-protein interactions. Proceedings of the National Academy of Sciences of the United States of America. 109, 9213-9218 (2012).
- Lev, I., et al. Reverse PCA, a systematic approach for identifying genes important for the physical interaction between protein pairs. PLoS Genet. 9, e1003838 (2013).
- Freschi, L., Torres-Quiroz, F., Dube, A. K., Landry, C. R. qPCA: a scalable assay to measure the perturbation of protein-protein interactions in living cells. Mol Biosyst. 9, 36-43 (2013).
- Pelletier, J. N., Campbell-Valois, F. X., Michnick, S. W. Oligomerization domain-directed reassembly of active dihydrofolate reductase from rationally designed fragments. Proceedings of the National Academy of Sciences of the United States of America. 95, 12141-12146 (1998).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods Enzymol. 350, 87-96 (2002).
- Schuldiner, M., Collins, S. R., Weissman, J. S., Krogan, N. J. Quantitative genetic analysis in Saccharomyces cerevisiae using epistatic miniarray profiles (E-MAPs) and its application to chromatin functions. Methods. 40, 344-352 (2006).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature methods. 9, 671-675 (2012).
- Wagih, O., Parts, L. gitter: A Robust and Accurate Method for Quantification of Colony Sizes From Plate Images. G3 (Bethesda). 4 (3), 547-552 (2014).
- Leducq, J. B., et al. Evidence for the robustness of protein complexes to inter-species hybridization. PLoS Genet. 8, e1003161 (2012).
- . . Development Core Team: A language and environment for statistical computing. , (2008).
- Stark, C., et al. BioGRID: a general repository for interaction datasets. Nucleic Acids Res. 34, D535-D539 (2006).
- Vinayagam, A., et al. Protein complex-based analysis framework for high-throughput data sets. Science signaling. 6, rs5 (2013).
- Jansen, R., Gerstein, M. Analyzing protein function on a genomic scale: the importance of gold-standard positives and negatives for network prediction. Current opinion in microbiology. 7, 535-545 (2004).
- Ito, T., et al. A comprehensive two-hybrid analysis to explore the yeast protein interactome. Proceedings of the National Academy of Sciences of the United States of America. 98, 4569-4574 (2001).
- Costanzo, M., et al. The genetic landscape of a cell. Science. 327, 425-431 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved