Method Article
全基因组蛋白质相互作用通过蛋白质片段互补法(PCA)的活细胞筛选
摘要
Proteins interact with each other and these interactions determine in a large part their functions. Protein interaction partners can be identified at high-throughput in vivo using a yeast fitness assay based on the dihydrofolate reductase protein-fragment complementation assay (DHFR-PCA).
摘要
Proteins are the building blocks, effectors and signal mediators of cellular processes. A protein’s function, regulation and localization often depend on its interactions with other proteins. Here, we describe a protocol for the yeast protein-fragment complementation assay (PCA), a powerful method to detect direct and proximal associations between proteins in living cells. The interaction between two proteins, each fused to a dihydrofolate reductase (DHFR) protein fragment, translates into growth of yeast strains in presence of the drug methotrexate (MTX). Differential fitness, resulting from different amounts of reconstituted DHFR enzyme, can be quantified on high-density colony arrays, allowing to differentiate interacting from non-interacting bait-prey pairs. The high-throughput protocol presented here is performed using a robotic platform that parallelizes mating of bait and prey strains carrying complementary DHFR-fragment fusion proteins and the survival assay on MTX. This protocol allows to systematically test for thousands of protein-protein interactions (PPIs) involving bait proteins of interest and offers several advantages over other PPI detection assays, including the study of proteins expressed from their endogenous promoters without the need for modifying protein localization and for the assembly of complex reporter constructs.
引言
蛋白相互作用网络(PIN码)提供的蛋白质如何在功能上组织在小区1低分辨率图谱 。两种蛋白质之间的每个物理连接,或蛋白质 - 蛋白质相互作用(PPI),可以表示的关联是稳定的时间,例如那些蛋白质复合物中发现的,并有助于该单元的结构组织。这些连接也可能代表调节的活性,稳定性,本地化和两个合作伙伴的交互瞬态协会。识别一个给定的蛋白质的物理相互作用配偶因此提供了关于该蛋白质2,3的功能和调节的丰富信息。由于这些原因,大量的努力已投入朝向在模式生物,包括大肠杆菌 4-6, 拟南芥7,酿酒酵母8-12,果蝇码的映射/ EM> 13,秀丽隐杆线虫 14和智人 15。这些研究提供了重要的见解蛋白质是如何组织与以前未知的功能蛋白的细胞,因此关键信息。
几个战略已经发展了很多年学习的PIN。这些技术可大致分为基于他们提供关于质子泵抑制剂的种类信息(在16-18综述)三类。第一种是基于酵母双杂交及其衍生物19。这些技术提供对蛋白质之间的直接关联,允许建设的二进制网络的信息。第二系列基于诱饵蛋白的亲和纯化和它们相关的伙伴,例如亲和纯化,随后通过质谱法20的识别。这些方法鉴定的蛋白质可直接组或间接相关的,通常以稳定的方式,而且是十分强大,以确定蛋白质复合物。第三种方法是基于蛋白质片段互补测定(PCA的)11,21。这种方法提供了两个前方法之间的分辨率的中间水平,因为它允许检测蛋白质之间的直接和近端关联。每一种技术都有自己的长处和短处,最近检讨18。
最好所述的真核细胞的PIN是由芽殖酵母酿酒酵母的远的1,部分原因是它的蛋白质组相对比其它模型真核生物和由于高通量测定法不太复杂的,以检测质子泵抑制剂已先被检测,并且更有效地在这种模式生物9-12实施。一种特别有效的方法为酵母体系是二氢叶酸还原酶蛋白质片段互补测定(DHFR-PCA),即一直一个测定用在不同的上下文来研究标准和扰动条件11,22-26酵母PIN。此方法依赖于一个存活测定法,使直接和近直接质子泵抑制剂的检测为在两个内源表达水平与所述相互作用配偶11,21以定量方式27本机的亚细胞定位的给定诱饵蛋白。使用这种测定法(上高密度集落阵列即菌落大小)中获得的信号从而反映了诱饵和猎物在蜂窝环境中,几乎等同于野生型细胞中的一个之间形成的蛋白质复合物的量。该测定法是基于参与叶酸代谢记者酶的重构,二氢叶酸还原酶(DHFR),由此DHFR的被融合到两种蛋白的兴趣两个互补片段使得接近时的两个蛋白相互作用,这又导致了酶的活性1的可逆重构1和生长的菌株在含培养基甲氨蝶呤(MTX; 图1)。此化合物抑制内源性DHFR酶,但不是突变1在测定28使用。两个集合的PCA菌株,一种含〜4300 的MATa菌株与ORF融合到DHFR F [1,2]片段和一种含〜4800 MATα菌株与ORF融合到DHFR [3]片段,可以购买到实施DHFR-PCA在或大或小规模的在任何实验室。在这里,我们描述了一种普遍但详细的协议,以屏幕为1诱饵蛋白,并使用该测定〜4800猎物蛋白质之间质子泵抑制剂。
研究方案
1.建筑/验证诱饵株
- 如果感兴趣的诱饵菌株中提供的MATa DHFR F [1,2]的收集,从收集,如步骤1.1.1中所述检索它,如在步骤1.1.2说明的情况下构建的菌株。
注:这里所描述的协议使用DHFR F [1,2]菌株作为诱饵和DHFR F [3]集合作为猎物,因为这个集合包含比DHFR F [1,2]收集更多的菌株。但是,它是可能的周围执行屏幕的另一种方式,如果诱饵菌株仅在DHFR F [3]的集合或在两个方向,如果一个需要更高覆盖相互作用组。- 解冻的甘油储备板,其中包含在冰上的诱饵应变一小时。消毒铝箔覆盖用95%的乙醇的板。皮尔斯用无菌尖端的箔,吸管上下重悬甘油的细胞和条纹2-3微升在选择性的酵母提取物蛋白胨葡萄糖(YPD)+100μg/ ml的诺尔丝菌素(NAT),以分离单个菌落。孵育两天在30℃。
- 诱饵PCA株的构建(DHFR 的MATa F [1,2])。
- 采用高保真聚合酶和标准PCR方法,扩增DHFR F [1,2]从质粒pAG25连接体DHFR˚F纸盒[1,2] -ADHterm用寡核苷酸与悬垂结束同源近40基点的ORF的3'-末端不包括终止密码子(正向引物),并于第一40 bp的基因的3'-UTR(反 向引物)( 图1A)的。
- 使用标准LiOAc / PEG酵母转化方案如29( 图1A)变换PCR产物到感受酵母细胞(通常在BY4741株)。
- 板选择性YPD + NAT中分离出阳性转化。
- 执行上孤立的殖民地诊断菌落PCR确认正确的DHFR F [1,2]的融合。使用PRimers退火1)的基因中的编码序列(正向低聚)大约100bp的DHFR融合的上游,并且2)在盒(逆向低聚)( 图1B)的ADH终止子。
- 序列的PCR产物通过Sanger测序,以确认正确的基因融合。
- 档案25%甘油证实诱饵菌株在-80℃。
注:该协议可以在这一步骤被暂停。
2.引脚工具消毒和印刷程序
注意:下面描述的灭菌过程由BM3-BC(普机器人技术)机器人平台操纵销工具进行了优化,但也可以适用于其他平台以及。本节介绍了用于从一种介质转移细胞到另一个协议的其余部分销工具消毒和打印程序。内部脚本用来执行这些程序可根据要求获得。注塔t的没有一个机器人平台的使用手动针工具30需要进行的所有步骤。
- 安装在机器人平台上相应的引脚的工具。
- 准备清洗和湿站如下:
- 加入500毫升无菌水在水浴站。
- 加入320毫升无菌水在刷站。
- 添加380毫升的70%乙醇中的超声波仪从琼脂平板复制(86 X128毫米omnitray,含35毫升固化介质),以琼脂平板上,或400毫升从含有液体培养于琼脂板上的微量滴定板进行复制时的时候。
- 加的35ml无菌水在湿站(包括无菌空omnitray)。
- 在每一天,需要机器人平台的开始,消毒销工具五次在超声波仪浴1分钟。与此同时,打开紫外线灯进行5分钟,以消毒机器人外壳。
注意:这是不是如果需要抢OT被安置在一个无菌罩。 - 之间的每个销工具复制轮,灭菌销工具如下:
- 浸泡销工具5次,每次10秒,在水浴站以除去细胞团块。
- 浸泡销工具两次来回刷站。
注:旋转刷将去除残留的细胞。 - 浸泡针工具两次20秒的超声仪站。
注:引脚剩余的细胞会被超声或删除乙醇杀害。 - 确保销的浸渍深度增加在每个连续的浴中以确保适当的消毒。
- 干燥该销工具在空气干燥器站为25秒。
- 之前,在源板服用细胞,湿引脚在潮湿站,其中包含一个omnitray35毫升无菌水。
- 在从源板的菌落蘸销两次。
- 打印在刚浇目标板通过触摸股份公司芳面两次(以下简称为"打印"的阵列的动作)。
3.凝结的DHFR F [3]收集的1536阵列使用一个自动机器人平台
- 解冻在冰上的DHFR F [3]集合(60 96孔板)和一个附加的96孔板填充有L型DHFR F [3]对照菌株( 图1C),其中包含的DHFR F [3]片段和单独的上游接头表达为阴性对照。
注:原则上,该片段不应与任何DHFR-片段融合蛋白(详见讨论)交互。 - 离心机板(快速旋转)除去铝箔,以避免井之间的交叉污染的风险之前。
- 冷凝收集到的384株( 图2A)16阵列。要做到这一点,每个384阵列,在四个象限选择性YPD + 250微克/毫升潮霉素B(HygB)打印4甘油片omnitray使用日ê96针工具(这里为384阵列可以细分为四个相等间隔开的象限,每批96的位置在一个2×2矩阵的布局)。插入包含在其他60板之间的L-DHFR F [3]阴性对照4 96孔板,以便有一个最后一组64片这恰好填入4 1536阵列。如在步骤2中所述消毒每个复制周期之间的销工具。
注:插入L-DHFR F [3]板,以便有一个这样的盘上的四个最后1536阵列。 - 孵育板两天在30℃。注:在此阶段,所述DHFR集合可以存储在一个384格式在4℃最多一个月在琼脂平板上。
- 凝结成收集四个阵列的1536株( 图2A)。要做到这一点,每个1536阵列,打印四组384株上的四个象限相同介质的板在使用384针的工具(此步3.2,一个1536阵列可以在四个Ë细分qually间隔开象限每批384的位置在一个2×2矩阵的布局)。
- 孵育板两天在30℃。注:在此阶段,所述DHFR集合可以存储在一个1536格式在4℃最多一个月在琼脂平板上。
- 复制相同的介质上的四个阵列使用1536销工具标准化菌落大小。
- 孵育板两天在30℃。
4.高通量DHFR-PCA程序
- 接种来自步骤1.1.1或1.1.2在20毫升液体YPD + NAT在50ml管( 图2B)中获得的诱饵应变(DHFR F [1,2]的融合)的培养。
- 孵育两天,在30℃下250rpm摇动,以允许培养达到饱和。
- 经过两天的潜伏期,板5毫升培养在YPD + NAT omnitray。让细胞吸附在表面上5-10分钟,并除去过量的液体( 图2B)。重复吨WICE做三次重复。
- 孵育两天在30℃。
- 打印的步骤4.3和4.4的12 YPD板诱饵株(足以交配四大板块的DHFR F [3]收集×3次重复),与1536引脚工具使用每个单元的草坪不超过4倍以上。
- 打印DHFR F [3]集合的适当阵列上使用1536销工具( 图2C)的诱饵细胞的顶部。
- 让该菌株交配并在30℃温育两天。
- 通过印刷在含有YPD + HygB + NAT( 图2C)omnitrays菌落选择二倍体细胞。
- 孵育两天在30℃。
- 重复二倍体选择如在步骤4.8和4.9( 图2B)说明。
- 准备板的下面使用前含MTX(MTX介质),每天的媒体,这些步骤21(注意:用MTX工作时,因为它是一种有毒的化合物,小心务必戴上手套,protection眼镜和白大褂处理时)( 图2C):
- 准备10倍 - 赖/ MET / ADE氨基酸辍学去离子水。使用0.2微米的无菌注射器过滤器过滤,消毒辍学在无菌瓶或,如果需要大批量,0.2微米瓶顶过滤漏斗( 表1)。
- 制备10毫克/毫升甲氨蝶呤的库存溶液在二甲基亚砜(DMSO)中。制备溶液后立即使用并冷冻,其余在-20℃。由轻保护它,因为它是感光。不要解冻后MTX再次冻结。
- 准备介质如下(介质成分和数量中的相同塔拉索夫等人 11使用的那些。):
- 一升培养基,混合在两个单独的烧瓶:1)6.69克的酵母氮基无氨基酸和无硫酸铵和330毫升去离子水; 2)25克贵金属琼脂和500毫升去离子水。
- 高压釜的烧瓶在121℃下进行20分钟。
- 平衡温度的水浴中在55℃进行至少一小时。
- 混合两种烧瓶在一起并加50毫升无菌的40%葡萄糖,100毫升10×无菌落出,和20毫升的MTX 10毫克/毫升。
- 倒入35毫升(见下面的注释)介质的omnitrays。让我们巩固了至少一个半小时。屏蔽板的光。
注:在这里,每浇omnitray35毫升介质的关键是要确保平等板的厚度,这是所有下游步骤非常重要。
- 从第二轮二倍体选择与机器人平台或一个普通的数码相机,平板均匀照度图像板。使用这些图片进行下游分析时标识的阵列空位置。确保该摄像机的参数总是相同,并且在机器人光被接通。
- 打印二倍体细胞对MTX媒体USI纳克的1536针的工具。
- 孵育四天在30℃下在塑料袋,以防止干燥。
- 如步骤4.11介绍准备第二批含MTX媒体omnitrays的。
- 四天后培养,利用图像板的机器人平台或普通数码相机。确保该摄像机的参数总是相同,并且在机器人光被接通。
- 通过在第二批的MTX媒体的复制单元进行的第二轮的MTX选择。
注意:这将减少PCA菌株的背景生长,增加定量的分辨率。 - 孵育四天在30℃下在塑料袋,以防止干燥。
- 图像板如在步骤4.16中描述。
5.图像分析
- 定制ImageJ的分析菌落阵列图像31脚本或使用软件出版等殖民者,高程殖民地电网分析仪,细胞探查,菌落图像R,ScreenMill,YeastXtract和小胶质(32编译)。图像分析应该输出一个或含菌落尺寸为每个阵列的每个位置的几个电子表格,用这些菌落的大小为所有下游分析。
注:在本研究中,我们使用了Leducq 等人的自定义脚本ImageJ的33(见讨论部分获取更多详情)。
6.数据分析
注:从结果图像分析可以在制表处理,如Excel或使用脚本语言,如R 34。以下步骤描述了使用定制的ImageJ 31脚本的程序。
- 使用自定义脚本,从图像分析串联输出文件和注释的每一行与板和应变信息作为附加表1。
- 登录2变换殖民地大小的值(集成密度或殖民地区;这里,列"IntDenBackSub”从附加表1中使用)。
注:值分布将如下图3A。 - 减去每块板的中值标准化这些值。
注意:此步骤控制对板偏压,可能导致从自动图像获取中不等媒体数量或变化的是,并减少了间复制方差( 图3B)。 - 验证重复互相关联的( 图3C)来评估实验的可重复性。
- 区分非交互诱饵捕食对互动,设置相应的L-DHFR F [3]控制分布的95 个百分点的高置信度阈值。
注意:在这个实验中,这对应于3.39( 图3D)。可替代地,可以使用基于与已知的物理交互件如那些报道的BioGRID 35重叠的阈值。有关详细信息,请参见讨论。 - 对于任何诱饵,滤波器捕食鉴定为参与在DHFR-PCA屏幕假阳性相互作用(见更多细节的讨论),并在补充表2(在列确定为"1","过滤")列出。
- (补充表2列"平均成绩")平均每次交互的三个重复的LOG2归殖民地的大小。
物理交互件7.验证使用小规模的实验
注:具有得分高于或接近所施加的阈值可使用固体或液体培养基中的MTX一个生长测定使用的DHFR-PCA测定在小规模的实验设计进行验证特别感兴趣的任何的PPI。下面的步骤演示程序手动构建二倍体PCA株和MTX中进行现场检测。实验者应该为所有necessar执行这些步骤ÿ对照(诱饵-DHFR F [1,2]×L型DHFR F [3],拉链连接体DHFR二倍体菌株和接头-DHFR二倍体菌株)。
- 板2-3微升在1.1.2.6所产生的诱饵菌株的甘油贮存的)中,L-DHFR F [3]对照株中,拉链连接体-DHFR和接头-DHFR在YPD + NAT,YPD二倍体菌株+ HygB两次YPD + NAT + HygB媒体分别。
- 检索在DHFR F [3]收集感兴趣的猎物,并按照步骤1.1.1指令,但连胜的YPD + HygB介质,而不是YPD + NAT中的压力。
- 执行诊断PCR在1.1.2.4确认DHFR F [3]融合的猎物位点和序列产品。
- 接种1毫升液体YPD培养基与单倍体菌株交配(诱饵X食饵,诱饵X L-DHFR F [3]对照)和长至少两天,在30℃以使二倍体形成。
- 通过在固体YPD + HygB + NAT中裸奔4-5微升的文化在7.4选择二倍体。生长两天30℃。
- 塞莱茨吨一种分离菌落并在液体培养物(1ml)中生长过夜以进行生长测定。
- 每天使用前准备MTX和DMSO(成分相同的MTX中,但没有MTX)板。更多细节见一步4.11。
- 通过发现不同文化的连续稀释控制(DMSO)和选择板(MTX)进行生长试验。
- 稀释预培养至OD = 1。
- 执行5倍稀释液(高达625的稀释因子)在一个无菌的96孔板中。
- 现货4微升每个稀释度的PCA媒体(DMSO和MTX)的。
- 在塑料袋孵育在30℃,以防止干燥。
- 从使用机器人平台或一个常规数字照相机天1至孵化7映像板。
结果
补充表2是代表性的结果利用酵母蛋白Nup82融合到DHFR F [1,2]片段作为诱饵得到的一个例子。用L-DHFR˚F定义的阈值[3]的控制可以作为一个经验阈值,以确定高可信度命中( 图3D和3E)。可替代地,得分排名可用于执行基因本体论的富集或基于金标准37的其它功能分析36。饵的已知的物理交互件可以从像BioGRID 35的数据库进行检索,并覆盖在数据( 图3E和3F)。在这个例子中,5出八高可信度命中先前已经报告为Nup82交互件和两个是Nup82 subcomplex,Nup116和Nup159( 图3F和3G)的一部分。复杂,NSP1的其他构件,并没有显示任何INTERAC化在我们的实验。两个猎物,Ade17和Tef2(在图3F中未示出),具有分数以上施加的硬的阈值,但这些都可能是假阳性,因为它们与在我们已经完成(未发表的结果)的PCA屏幕几乎任何诱饵蛋白相互作用。另一方面,Pex30可以表示Nup82的一个新的物理交互件,我们能够证实使用DHFR-PCA在低通量( 图3G)这种相互作用。 Pex30是过氧化物酶体膜蛋白和一些直接的相互作用已经报道核孔复合物(NPC)和此细胞器之间。两杂交筛选确定了另外两名NPC蛋白质,Nup53和Asm4(Nup59),作为Pex30 38物理干扰作用,并Pex30和Nup170之间的遗传相互作用已报告39。另外两个合作伙伴的互动检测,Nup120和Nup85( 图3F和3G),是不是Nup82子群的一部分,说明的能力的DHFR-PCA的检测范围内,并在更大的复合物11 subcomplexes之间的相互作用。
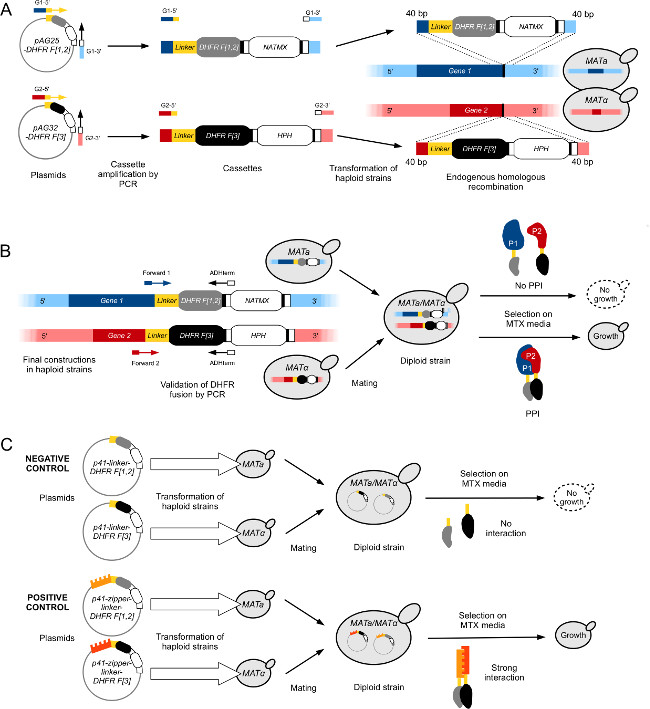
图1:单倍体马塔和MATα株工程酵母菌株的高通量DHFR-PCA( 图改编自Leducq 等 2012 33)(A)建筑融合基因1(G1)和基因2(G2)的DHFR F [1,2] -NatMX和DHFR F [3] -HPH盒,分别。盒从质粒扩增pAG25-DHFR F [1,2]和pAG32-DHFR F [3]与正向引物G1-5'和G2-5'和反向引物G1-3'和G2-3',然后插入在通过同源重组靶基因的3'末端的基因组中。将所得的蛋白质中,P1和P2,分别融合到DHFR F [1,2]片段( 的MATa)和DHFR F [3]片段(MATα)经由柔性连接体。(B)中的结构的验证中(A)是通过测序之间基因1的与基因2的的ORF和路口进行该DHFR盒中。相对的交配型的构造的PCA菌株然后配合以形成一个二倍体。二倍体菌株生长在MTX介质,如果两个互补的DHFR片段通过P1和P2之间的相互作用,其中所述重新构成的DHFR酶的活性使得接近。(C)的施工控制的二倍体菌株的PCA对DHFR-PCA屏幕。阴性对照(L-DHFR)由转化分别单倍体的MATa和MATα菌株质粒P41 -接头-DHFR F [1,2]和P41-接头-DHFR F [3] 如图11所示 ,分别构成。两种菌株交配导致的阴性对照二倍体菌株,其中DHFR片段不能相得益彰(顶部)。阳性对照使用了相同的方法,作为阴性对照构建,但质粒转化的单倍体株(P41-拉链连接子DHFR F [1,2](P41-ZL-DHFR F [1,2])和P41 -zipper -接头-DHFR F [3](P41-ZL-DHFR F [3]))包含稠合到互补的DHFR片段2 GCN4平行亮氨酸拉链的片段,从而导致该重新构成的DHFR活性的强的和组成相互作用(底)。 请点击此处查看该图的放大版本。
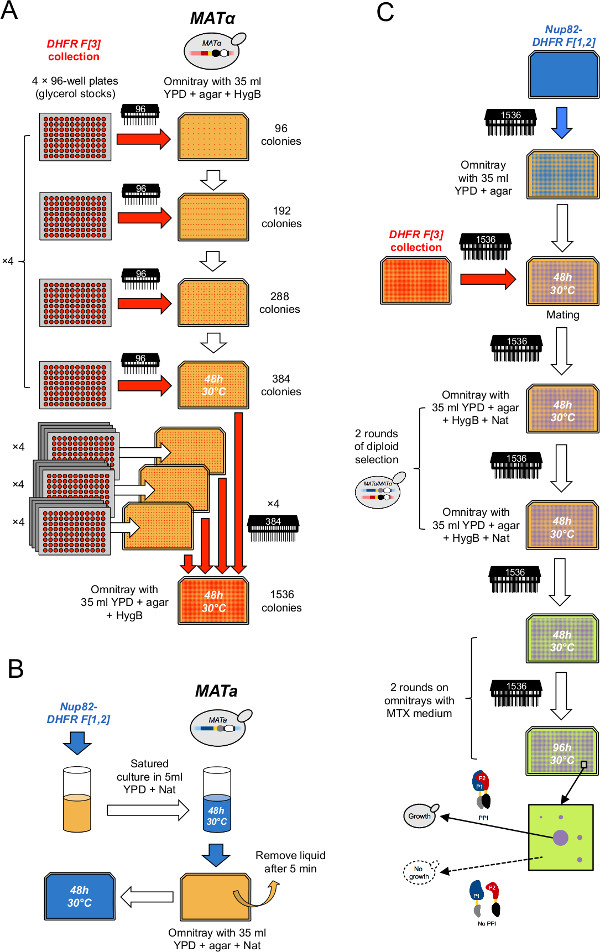
图2:高通量DHFR-PCA的过程(图改编自Leducq 等33)(A)αDHFR F [3]收集的MAT。通过连续两轮冷凝浓缩在1536格式。首先,甘油板通过四个选择性YPD + HygB介质在384格式使用96针工具组相结合。其次,384阵列是由四个在使用384针的工具1536格式的选择性YPD + HygB媒体集团合并。(B)细胞马塔 PCA诱饵应变草坪是由不断增长的诱饵应变的饱和培养物制备选择性的YPD + NAT介质上的YPD + NAT omnitray。(C)的这些草坪电镀培养用于配合的诱饵应变与DHFR F [3]收集在YPD培养基。细胞依次转移两次YPD + HygB + NAT中选择二倍体和两次MTX中进行PCA。增长只会对MTX中可以观察到,如果DHFR片段相得益彰以下的诱饵和猎物的蛋白质之间的相互作用。e.jpg"目标="_空白">点击此处查看该图的放大版本。
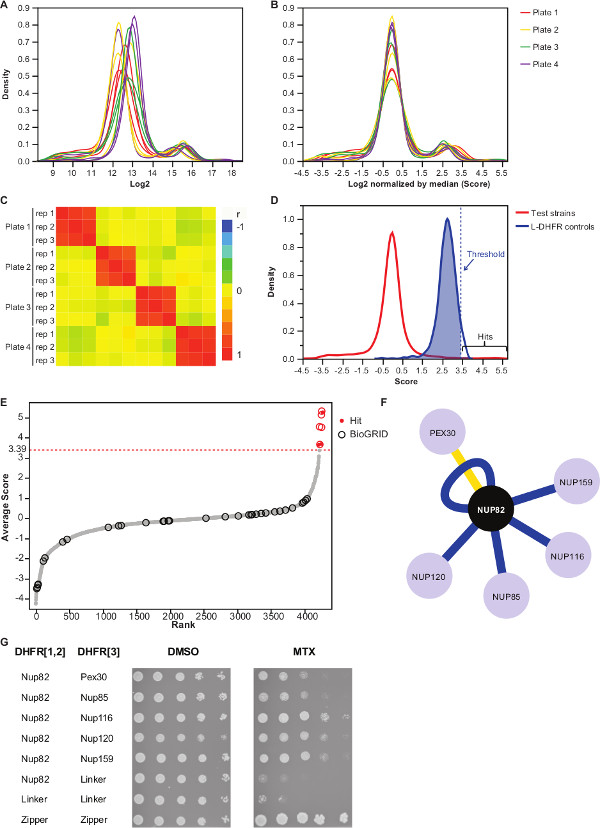
图3:数据分析通过步骤正常化,确定的意义阈值和识别的阳性相互作用的(A)的密度集落大小的分布在每个平板(日志2)(B)的各图像的中值标准化校正偏差与板直接制版效应有关。(C)的热图显示板之间的Spearman相关系数,确认该过程的可重复性。(D)的分布分数为所测试的质子泵抑制剂与L-DHFR F [3]的控制。硬阈值可被设置为95 个百分位数的L DHFR F [3]分配,以确定高可信度的质子泵抑制剂(由虚线表示的垂直平均分数每个猎物的线)。(E)排名顺序分配。 Nup82p在BioGRID 35先前报道的物理相互作用的合作伙伴用圆圈标识以及那些在本研究报告由红点标识。在(D)中所定义的阈值被示出为虚线。(F)的网络示出了本研究中所确定的高可信度的质子泵抑制剂。蓝边此前报道显示物理交互器(BioGRID 35)和黄色边缘显示出与Pex30以前未报告的互动。(G)的PCA二倍体株涉及Nup82-DHFR F [1,2]和猎物-DHFR F [3点稀释法]对确定为Nup82p在本研究中的物理交互件。在DMSO介质(MTX溶剂,左图)和MTX的培养基中(右图)进行生长测定。阴性对照由Nup82-DHFR的F [1,2] - 连接器-DHFR F [3]和链接器-DHFR F [1,2] - 连接器-DHFR F [3]和阳性对照包括吨的2亮氨酸拉链部分之间他强相互作用(拉链-DHFR F [1,2] - 拉链-DHFR F [3])均包括在内。在MTX中细胞生长优于阴性对照应该被解释为物理相互作用。 请点击此处查看该图的放大版本。
| 氨基酸 | 量(G) |
| 腺嘌呤硫酸盐* | 0.2 |
| L-色氨酸 | 0.4 |
| L-酪氨酸 | 0.3 |
| L-苯丙氨酸 | 0.5 |
| L-谷氨酸(一钠盐) | 1.0 |
| L-天冬酰胺 | 1.0 |
| L-缬氨酸 | 1.5 |
| L-苏氨酸 | 2.0 |
| L-丝氨酸 | 3.75 |
| 尿嘧啶 | 0.2 |
| L-组氨酸盐酸 | 0.2 |
| L-精氨酸盐酸 | 0.2 |
| L-蛋氨酸* | 0.2 |
| L-赖氨酸* | 0.2 |
| L-亮氨酸 | 0.6 |
| *当执行标准的PCA(如在此协议),但是可以为其他目的而被添加撤回。 | |
表1:的10X -赖/ MET / ADE辍学的MTX培养基成分数量是一升10倍辍学。星号表示应撤回对标准MTX介质的化合物,但可以为其他目的而加入。
补充表1:从12试验板组合的数据 。表1包含了级联哒た从ImageJ的分析来执行使用与每个行对应于每1536阵列上的单一位置定制ImageJ的脚本。此外,各行已被标注了有关图像文件,DHFR收集板中的信息,复制,ORF和蛋白质名称。
补充表2:每株平均归一化的生长表2包含对于集合连同标准偏差每种菌株的平均日志2归一化的增长。过滤猎物,命中和已知的物理相互作用物被确定在单独的列。
讨论
我们描述的基础上DHFR-PCA法使物理干扰作用的系统识别,在高通量任何诱饵蛋白的协议。这个协议可以通过筛选更多诱饵适于,这在复制中的任何期望的水平。我们证明该协议的可靠性物理相互作用伙伴的标识所涉及的核孔复合诱饵蛋白:Nup82。我们的分析使能找到5以前报道交互件和一个先前未报告的交互件( 图3F和3G),突出的方法来研究的酵母蛋白质相互作用组的能力。
这里所描述的协议包括几个关键步骤,以使实验者更应注意。我们建议:1)确保诱饵DHFR F [1,2]的融合是正确的( 图1B);这可以通过测序的结构和测量电来实现荷兰国际集团使用抗DHFR F [1,2]或抗DHFR F [3]抗体正确蛋白表达; 2)在此之前开始屏幕,建议以验证是否任何感兴趣的诱饵显示在屏幕的PCA混杂相互作用。这可通过用毒饵越过与合适的L-胸苷控制或通过手动配合与适当的L-胸苷控制诱饵和执行在介质MTX一个生长测定进行控制的屏幕来完成。 3)将板应在每天浇之前它们被用来使水分是最适合于在印刷过程中的琼脂表面细胞粘附; 4)源板不应该使用多于4倍,以在目标板传送足够的细胞。增大目标板的拷贝数可以通过连续步骤膨胀( - > 16份- > 64份如 4份)来完成。此外,细胞可以在草坪上或在不同的回合复制之间的群体不同位置被拾起; 5)如果几个Positions丢失二倍体选择(S),确保在源板未在配合工序中使用过许多次之后(步骤4.5至4.7); 6)确保MTX中包含了正确的浓度的所有基本要素。的确,如果在所有不生长的MTX培养基上观察到,它可以是,因为没有相互作用是可检测由PCA针对感兴趣的蛋白质或因为MTX介质未正确制备。以确保该介质允许菌株表示DHFR片段互补的生长,组成型相互作用可以在收集的空位置被加入,并用作阳性对照诸如DHFR片段融合至亮氨酸拉链结构部分33( 图1C)。使用链接器DHFR片段或拉链连接-DHFR片段并行测试将允许,这往往使假阳性相互作用的条件,让所有的细胞生长(低浓度MTX或诱饵蛋白区分为DESCRIBED以下),防止所有菌株的生长(MTX浓度过高或必要成分丢失在培养基中)的条件; 7)由于PCA是通过连续多轮次重复的从一个介质执行到另一个,如果,例如,所述销工具没有被正确复制轮和/或最后的水之间消毒,可能会出现不同的板之间的菌株间的交叉污染浴( 即湿站)消毒过程中由以前的复制轮殖民地污染。上的阵列的几个位置是空的,因此可以用来作为对照位置处没有生长应观察到检测交叉污染。
图像分析可以使用多种软件公布(见协议第5条),或任何自定义脚本来执行。在这项研究中,自定义脚本执行以下步骤:1)的脚本中减去空盘,以便共同像素各自板的值的像素值rrect照明偏见。 2)该脚本将每个背景修正图像使用10 3的像素值阈值),对于每一个1536位的各板块,通过覆盖上的优势菌落矩形确定为二进制,脚本运行ImageJ的"分析颗粒... "功能在一个圆形的选择。圆状的选择被设置具有半径等于两个位置减去10个像素之间的间隔。 4)脚本选择从选择的中心最近的粒子,并确认它作为一个群体,如果它的位置是不超过半两菌落之间的间隔距离的选择的中心。 5)脚本测量的背景校正的图像所选择的粒子的像素值。 6)为了进一步校正任何剩余的背景照明的偏见,该脚本中减去从圆状的选择所有象素所没有的一个微粒的群体的像素值的部分的平均值。这些校正后的像素值的总和S,存储在附加表1的列"IntDenBackSub",被用作集落大小的量度。
在分析部分中的一个关键步骤是的意义的阈值的选择。这里,我们选择一个阈值的基础上的负的L-胸苷F [3]的控制的分布,但根据不同的画面的目标,这样的阈值可以是过于严格。实际上,L-DHFR F [3]对照过表达(强TEF启动子),使得所述互补片段可以自发地相互补充,这些都是因此不能代表大多数蛋白质的表达。这是由以下事实的L DHFR F表示分布[3]对照比背景生长(图3D)的平均水平突出。因此,一些具有相互作用分值低于此严格阈值,但是显然的背景生长分布的外侧可被视为推定命中可以表示,例如,瞬时或弱除动作。这些可以进一步被研究和交叉验证,如果,例如,两种蛋白质不表达的水平,可以使DHFR片段似L形的DHFR控制的自发互补。作为替代方案,人们可以以最大限度真阳性超过误报的比例基础上设定的重叠与像BioGRID 35数据库报告的物理交互件的比例的显着性阈值。然而,与使用了L-DHFR分布,这种替代可能不总是可行的话,例如,公知的物理交互件的数量是不够高。此外,该阈值的意义的选择对的假阳性和假阴性的最后数据组的比例的影响。事实上,像任何其他的PPI检测分析,误报可导致从与DHFR融合蛋白的蛋白质的非特异性相互作用,如果,例如,该蛋白质是高度丰富如前面提到的。此由以下事实,一些猎物系统与所有诱饵蛋白质相互作用中的PCA屏幕和,从而例举,需要从分析11( 例如 Tef2和Ade17和补充表2)除去。为了解决这个问题,这两个集合针对相应的L-胸苷控制的控制屏幕的PCA(F [1,2]或F [3]),以确定诱饵和猎物呈现自发的DHFR片段互补可以在特定的条件下进行每个屏幕。此外,在执行一个基因本体论的富集分析可以增加信心数据如果一个给定的诱饵的功能是已知的。另一方面,DHFR-PCA可以产生假阴性有以下几个原因:1)不是所有的蛋白可以融合到DHFR片段,因为这些可能破坏该蛋白质或如果修改他们的定位,例如,在DHFR融合到C-末端干扰定位信号; 2)DHFR重组在某些细胞车厢米AY不会产生叶酸如果,例如,对于叶酸合成的重要前体是不可用; 3)C末端需要是8个纳米的距离内进行的DHFR互补发生11。因此,公知的相互作用可能无法检测到,如果他们的C端没有足够接近空间。这是通过该报告在数据库中,其中大部分是间接Nup82物理相互作用的大部分,并没有在我们的测定法检测到的事实,在这里举例说明。类似地,对于其中C-末端是在反相对于膜的膜蛋白之间的相互作用不会导致DHFR片段互补,不会被检测到11。局限性1)和3)可通过熔合DHFR片段的N-末端的蛋白质的相对简单地规避。这样做可能防止干扰附近的C-末端定位信号,并且可以允许以检测膜蛋白,其N和C末端之间的相互作用是在顺式相对到膜上。
一些挑战仍然PIN码的研究(在2,3审查)。到目前为止产生的引脚映射已经基本上在一个单一的实验条件下每个物种被描述,从而提供了如何蛋白质网络可能会被安排一个快照。因此,有必要对其它实验条件的探索,看看如何销可响应于环境的变化,具体的刺激,在开发或下列突变重组。这些挑战将由用于询问质子泵抑制剂在实时,在活细胞中的新技术的发展和通过适应当前的技术,使它们可用于通过实验室的一个更大的社区来克服。作为定量的技术,可以检测出在DHFR互补的量变化络合物27,DHFR-PCA可适于克服这些挑战,并已经被用于研究如何质子泵抑制剂受DNA损伤剂22 化学制剂25,基因缺失或23,26在其他酵母品种及其杂交种33。探索这些新尺寸将变得越来越重要,以揭示PIN的动态。
披露声明
对于这篇文章的开放获取出版费用一部分是由S&P机器人支付。
致谢
这项工作得到了健康研究加拿大学院(CIHR)授予191597,299432和324265,支持的自然科学和加拿大发现金工程研究理事会和人类前沿科学计划赠款CRL。 CRL是一种新CIHR调查。纪尧姆迪斯由PROTEO奖学金支持。塞缪尔·罗切特是由NSERC和FRQNT奖学金支持。
材料
| Name | Company | Catalog Number | Comments |
| BioMatrix Robot, Bench-top Configuration | S&P Robotics Inc. | BM5-BC | |
| 96-format Pin-tool | S&P Robotics Inc. | PH-96-10 | Standard 96-format Pin-tool with 96 high-precision floating pins |
| 384-format Pin-tool | S&P Robotics Inc. | PH-384-10 | Standard 384-format Pin-tool with 384 high-precision floating pins |
| 1536-format Pin-tool | S&P Robotics Inc. | PH-1536-05 | Custom 1536-format Pin-tool with 0.5mm high-precision floating pins |
| Automated imaging module | S&P Robotics Inc. | IMG-02 | |
| Methotrexate | Bioshop Canada Inc. | MTX440 | CAUTION: toxic compound |
| Hygromycin B | Bioshop Canada Inc. | HYG003 | |
| Nourseothricin dihydrogen sulfate | Werner BioAgents | 5010000 | |
| Yeast-Interactome Collection | Thermo Scientific | YSC5849 | |
| Omni Tray w/lid sterile | Thermo Scientific | 242811 | |
| Anti-DHFR F[1,2] antibody | Sigma-Aldrich | D1067 | |
| Anti-DHFR F[3] antibody | Sigma-Aldrich | D0942 |
参考文献
- Alberts, B. The cell as a collection of protein machines: preparing the next generation of molecular biologists. Cell. 92, 291-294 (1998).
- Diss, G., et al. Integrative avenues for exploring the dynamics and evolution of protein interaction networks. Curr Opin Biotechnol. 24, 775-783 (2013).
- Vidal, M., Cusick, M. E., Barabasi, A. L. Interactome networks and human disease. Cell. 144, 986-998 (2011).
- Hu, P., et al. Global functional atlas of Escherichia coli encompassing previously uncharacterized proteins. PLoS biology. 7, e96 (2009).
- Arifuzzaman, M., et al. Large-scale identification of protein-protein interaction of Escherichia coli K-12. Genome Res. 16, 686-691 (2006).
- Rajagopala, S. V., et al. The binary protein-protein interaction landscape of Escherichia coli. Nature biotechnology. 32, 285-290 (2014).
- Arabidopsis-Interactome-Mapping-Consortium. Evidence for network evolution in an Arabidopsis interactome map. Science. 333, 601-607 (2011).
- Babu, M., et al. Interaction landscape of membrane-protein complexes in Saccharomyces cerevisiae. Nature. 489, 585-589 (2012).
- Krogan, N. J., et al. Global landscape of protein complexes in the yeast Saccharomyces cerevisiae. Nature. 440, 637-643 (2006).
- Gavin, A. C., et al. Functional organization of the yeast proteome by systematic analysis of protein complexes. Nature. 415, 141-147 (2002).
- Tarassov, K., et al. An in vivo map of the yeast protein interactome. Science. 320, 1465-1470 (2008).
- Uetz, P., et al. A comprehensive analysis of protein-protein interactions in Saccharomyces cerevisiae. Nature. 403, 623-627 (2000).
- Guruharsha, K. G., et al. A protein complex network of Drosophila melanogaster. Cell. 147, 690-703 (2011).
- Li, S., et al. A map of the interactome network of the metazoan C. elegans. Science. 303, 540-543 (2004).
- Rual, J. F., et al. Towards a proteome-scale map of the human protein-protein interaction network. Nature. 437, 1173-1178 (2005).
- Landry, C. R., Levy, E. D., Abd Rabbo, D., Tarassov, K., Michnick, S. W. Extracting insight from noisy cellular networks. Cell. 155, 983-989 (2013).
- Berggard, T., Linse, S., James, P. Methods for the detection and analysis of protein-protein interactions. Proteomics. 7, 2833-2842 (2007).
- Wodak, S. J., Vlasblom, J., Turinsky, A. L., Pu, S. Protein-protein interaction networks: the puzzling riches. Current opinion in structural biology. 23, 941-953 (2013).
- Fields, S., Song, O. A novel genetic system to detect protein-protein interactions. Nature. 340, 245-246 (1989).
- Dunham, W. H., Mullin, M., Gingras, A. C. Affinity-purification coupled to mass spectrometry: basic principles and strategies. Proteomics. 12, 1576-1590 (2012).
- Michnick, S. W., Ear, P. H., Landry, C., Malleshaiah, M. K., Messier, V. A toolkit of protein-fragment complementation assays for studying and dissecting large-scale and dynamic protein-protein interactions in living cells. Methods Enzymol. 470, 335-368 (2010).
- Rochette, S., Gagnon-Arsenault, I., Diss, G., Landry, C. R. Modulation of the yeast protein interactome in response to DNA damage. Journal of proteomics. 100, 25-36 (2014).
- Diss, G., Dube, A. K., Boutin, J., Gagnon-Arsenault, I., Landry, C. R. A systematic approach for the genetic dissection of protein complexes in living cells. Cell Rep. 3, 2155-2167 (2013).
- Gagnon-Arsenault, I., et al. Transcriptional divergence plays a role in the rewiring of protein interaction networks after gene duplication. Journal of proteomics. 81, 112-125 (2013).
- Schlecht, U., Miranda, M., Suresh, S., Davis, R. W., St Onge, R. P. Multiplex assay for condition-dependent changes in protein-protein interactions. Proceedings of the National Academy of Sciences of the United States of America. 109, 9213-9218 (2012).
- Lev, I., et al. Reverse PCA, a systematic approach for identifying genes important for the physical interaction between protein pairs. PLoS Genet. 9, e1003838 (2013).
- Freschi, L., Torres-Quiroz, F., Dube, A. K., Landry, C. R. qPCA: a scalable assay to measure the perturbation of protein-protein interactions in living cells. Mol Biosyst. 9, 36-43 (2013).
- Pelletier, J. N., Campbell-Valois, F. X., Michnick, S. W. Oligomerization domain-directed reassembly of active dihydrofolate reductase from rationally designed fragments. Proceedings of the National Academy of Sciences of the United States of America. 95, 12141-12146 (1998).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods Enzymol. 350, 87-96 (2002).
- Schuldiner, M., Collins, S. R., Weissman, J. S., Krogan, N. J. Quantitative genetic analysis in Saccharomyces cerevisiae using epistatic miniarray profiles (E-MAPs) and its application to chromatin functions. Methods. 40, 344-352 (2006).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature methods. 9, 671-675 (2012).
- Wagih, O., Parts, L. gitter: A Robust and Accurate Method for Quantification of Colony Sizes From Plate Images. G3 (Bethesda). 4 (3), 547-552 (2014).
- Leducq, J. B., et al. Evidence for the robustness of protein complexes to inter-species hybridization. PLoS Genet. 8, e1003161 (2012).
- . . Development Core Team: A language and environment for statistical computing. , (2008).
- Stark, C., et al. BioGRID: a general repository for interaction datasets. Nucleic Acids Res. 34, D535-D539 (2006).
- Vinayagam, A., et al. Protein complex-based analysis framework for high-throughput data sets. Science signaling. 6, rs5 (2013).
- Jansen, R., Gerstein, M. Analyzing protein function on a genomic scale: the importance of gold-standard positives and negatives for network prediction. Current opinion in microbiology. 7, 535-545 (2004).
- Ito, T., et al. A comprehensive two-hybrid analysis to explore the yeast protein interactome. Proceedings of the National Academy of Sciences of the United States of America. 98, 4569-4574 (2001).
- Costanzo, M., et al. The genetic landscape of a cell. Science. 327, 425-431 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。