Method Article
وضع العلامات المزدوجة من خلايا كريست العصبية والأوعية الدموية داخل أجنة الدجاج باستخدام الفرخGFP تطعيم الأنبوب العصبي وكاروتشيانين صبغ DiI حقن
In This Article
Summary
هنا نحن تقرير وضع العلامات المزدوجة من الخلايا قمة العصبية والأوعية الدموية باستخدام الفرخGFP أنبوب العصبية تطعيم داخل الأنواع جنبا إلى جنب مع حقن DiI داخل الأوعية الدموية. هذه التقنية التجريبية تسمح لنا في وقت واحد تصور ودراسة تطوير الجهاز العصبي (المعوي) المستمدة من NCC والجهاز الوعائي، أثناء تكوين الجهاز العضوي.
Abstract
جميع الأعضاء النامية تحتاج إلى أن تكون متصلة بكل من الجهاز العصبي (للتحكم الحسي والحركي) وكذلك نظام الأوعية الدموية (لتبادل الغاز والسوائل وإمدادات المواد الغذائية). وبالتالي ، فإن كلا من الجهاز العصبي والأوعية الدموية يتطوران جنبا إلى جنب ويشتركان في أوجه التشابه المذهلة في هندستهما المعمارية المتفرعة. هنا نبلغ عن التلاعب الجنيني الذي يسمح لنا بدراسة التطور المتزامن للأنسجة العصبية المشتقة من القمة العصبية (في هذه الحالة الجهاز العصبي المعوي) ، ونظام الأوعية الدموية. ويتحقق ذلك عن طريق توليد الكيميرا الدجاج عن طريق زرع أجزاء منفصلة من الأنبوب العصبي، والقمة العصبية المرتبطة بها، جنبا إلى جنب مع حقن DiI الأوعية الدموية في نفس الجنين. تستخدم طريقتنا أجنةGFP المعدلة وراثيا للتطعيم داخل الأنواع ، مما يجعل تقنية الزراعة أقوى من بروتوكول تطعيم السمان - الفرخ الكلاسيكي المستخدم بتأثير كبير منذ السبعينيات. الفرخGFP-chick تطعيم داخل الأنواع يسهل تصوير الخلايا المزروعة وتوقعاتها في الأنسجة سليمة، ويقضي على أي تحيز محتمل في تطوير الخلايا المرتبطة الاختلافات الأنواع. تستفيد هذه الطريقة استفادة كاملة من سهولة وصول جنين الطيور (مقارنة بالأجنة الفقارية الأخرى) لدراسة التطور المشترك للجهاز العصبي المعوي والجهاز الوعائي.
Introduction
جنين الدجاج هو كائن حي نموذج لا يقدر بثمن في بيولوجيا النمو الفقارية، وليس أقلها لأن تطوره في أوفو يسمح التلاعب التجريبية التي من المستحيل على خلاف ذلك لأداء في الفقاريات التي تتطور في الرحم. وقد أدت هذه إمكانية الوصول وسهولة التلاعب إلى أن يلعب جنين الفرخ أدوارا رئيسية في العديد من الاكتشافات المنوية في مجال البيولوجيا التنموية. وكان من بين أقوى التقنيات استخدام أجنة السمان فرخ chimeric لدراسة مصير الخلية، وهي طريقة رائدة من قبل البروفيسور نيكول لو دوارين في 19701-3. على وجه الخصوص ، كانت الكيميرا السمان فرخ مفيدة بشكل خاص لوضع علامة وراثيا ومتابعة السكان الخلايا قمة العصبية المهاجرة للغاية (NCC) خلال التنمية المبكرة. NCC هي مجموعة متعددة القدرات من الخلايا المهاجرة ، تنشأ في ectoderm الظهرية على هامش الأنبوب العصبي ، التي تؤدي إلى مجموعة واسعة من أنواع الخلايا في جميع أنحاء الجنين الفقاري. وتشمل هذه الهياكل القحفية (الغضروف والعظام والعضلات) والخلايا العصبية وغليا (في الجهاز العصبي الحسي والعالذاتي) ، والخلايا الصباغية ، واكتظاظ خلايا نظام الغدد الصماء2،4،5. أحد أهم العوامل التي تؤثر على مصير NCC هو موقعها الأولي على طول المحور الأمامي الخلفي للأنبوب العصبي. على سبيل المثال ، ينشأ NCC المعوي ، الذي يؤدي إلى الخلايا العصبية والغليا في الجهاز العصبي المعوي (ENS) ، من مجموعتين فرعيتين منفصلتين: الأولى تقع في منطقة ال vagal (caudal hindbrain) ، والثانية في المنطقة العجزية للأنبوب العصبي6-13. وقد تم تطعيم بين أو داخل الأنواع من المناطق المقابلة من الأنبوب العصبي التقنيات المفضلة لتسمية هذه الخلايا بشكل دائم والسماح في وقت لاحق تتبع, من ولادتهم على هامش الأنبوب العصبي, إلى وجهاتهم النهائية داخل الجهاز الهضمي6,7,10.
تلاعب جنيني آخر أسهل في الأداء في الفرخ ، مقارنة بالنماذج الحيوانية الأخرى ، هو وضع العلامات الحيوية لنظام الأوعية الدموية. في الواقع ، مع تطور جنين الفرخ ، فإنه يضع على رأس شبكة الأوعية الدموية خارج الجنين التي تعمم الأكسجين والمواد المغذية من الصفار. يمكن استخدام هذه الشبكة الوعائية التي يمكن الوصول إليها ، الموجودة على سطح الصفار ، كبوابة لتسمية نظام الأوعية الدموية النامي للجنين أثناء تكوين الأعضاءالعضوية 12،14-17. الحقن داخل الأوعية الدموية من الأصباغ المختلفة، مثل صبغة الدهون DiI، يجعل من الممكن تحديد / وصمة عار جميع الأوعية مضيئة من شبكة الأوعية الدموية الوليدة.
لأن تطوير الأجهزة تحتاج إلى أن تكون متصلة بكل من الجهاز العصبي (للتحكم الحسي والحركي) وكذلك نظام الأوعية الدموية (لتبادل الغاز والسوائل وإمدادات المواد الغذائية)، والشبكتين تطوير جنبا إلى جنب مع بعضها البعض وتبادل أوجه التشابه ملفتة للنظر في هندستها المعمارية المتفرعة18-20. هنا نبلغ عن التلاعب الجنيني الذي يسمح لنا بدراسة التطور المتزامن ل ENS المشتقة من NCC ، جنبا إلى جنب مع نظام الأوعية الدموية ، أثناء تكوين الأعضاء. ويتحقق ذلك عن طريق توليد الكيميرا الدجاج عن طريق زرع أجزاء منفصلة من الأنبوب العصبي، بما في ذلك قمة العصبية، جنبا إلى جنب مع حقن ديي الأوعية الدموية. كتأسف من الكيميرا الدجاج السمان، طريقتنا يستخدم الأجنة الفرخ GFP المعدلة وراثيا لتطعيم الأنواع الداخلية، مما يجعل تقنية زرع أكثر قوة، من حيث خلايا التصوير وتوقعاتها، والقضاء على أي تحيز محتمل مرتبط باختلافات الأنواع.
Protocol
1. إعداد مشرط الصغرى لالاجتثاث الأنبوب العصبي
- شكل مشرط صغير من إبرة الخياطة الصلب المتاحة تجاريا.
- أولا تسطيح الإبرة على كلا الجانبين باستخدام عجلة طحن محمولة على طاحونة مقاعد البدلاء بالطاقة.
- ابدأ في تشكيل المشرط ، أولا على حجر أركنساس الخشن باستخدام حركة دائرية خاضعة للرقابة ، في اتجاهات بديلة ، على جانبي الإبرة.
- الاستمرار في نفس الحركات شحذ على درجة إضافية غرامة حجر أركنساس لتشكيل مشرط الدقيقة فائقة الدقة، مع حافة القطع محددة جيدا(الشكل 1A، B).
ملاحظة: يمكن أن تكون بدائل المشرط الصغير إبرا مشحذة كهربائيا أو إبر التنغستن المتاحة تجاريا أو إبر زجاجية منسدلة.
2. احتضان نوع البرية والبيض GFP إلى المرحلة المطلوبة
- تخزين بيض الدجاج المخصب وبيض الدجاج المعدلة وراثيا GFP في حاضنة تبريد في 14 -15 درجة مئوية قبل الحضانة كما يتم وقف التنمية في هذه درجة الحرارة. تخزين البيض لبضعة أيام، تصل إلى أسبوع واحد.
- لبدء التطوير، ضع بيض النوع البري وGFP على صينية أفقيا واحتضانه في وقت واحد في مرطب (58-60٪) حاضنة عند 37.5 درجة مئوية، بحيث تكون الأجنة في مراحل مطابقة لترقيع الأنبوب العصبي.
- الحصول على أجنة في مرحلة 10-12 سومايت من التطور لتنفيذ تطعيم الأنبوب العصبي المبهم، واحتضان البويضات لمدة 1.5 يوما (33-38 ساعة) ومرحلة الأجنة وفقا لجداول التنمية من هامبورغر وهاملتون21.
3. إعداد البيض لالنوافذ والتطعيم
- نقل بيضة واحدة في وقت واحد إلى حامل البيض حسب الطلب للنافذة. جعل ثقب صغير في قشرة البيض عن طريق التنصت مرارا وتكرارا، مع مقص مستقيم، على السطح العلوي من نهاية مدببة من البيض.
- إزالة 2 - 3 مل من الألبومين من البيض مع إبرة تحت الجلد 181/2 G ومحقنة 5 مل. إزالة الألبومين يخفض صفار داخل البيض ويسهل النوافذ اللاحقة دون التسبب في أي ضرر للجنين.
- تجاهل الألبوم. ختم الحفرة مع شريط صغير من الشريط واضحة قطع لحجم مع مقص غرامة.
- باستخدام مقص منحني، اضغط على ثقب آخر في السطح العلوي من قشرة البيض. إدراج غيض من مقص في حفرة و, الحفاظ على مقص موازية لمقاعد البدلاء, العمل في حركة دائرية لقطع نافذة قطرها ~ 2 سم على رأس قذيفة.
- إبقاء مقص في موقف ثابت وتدوير البيض. تجاهل القرص إزالة قشرة البيض. في E1.5 ، يمكن التعرف على الجنين كقرص أصفر أغمق فوق الصفار.
- إزالة أي حطام قذيفة التي سقطت داخل البيض باستخدام ملاقط. تجاهل أي بيض غير المخصبة (التي حددتها بقعة بيضاء صغيرة على رأس صفار أصفر خفيف خلاف ذلك).
4. إعداد الجنين المضيف لتلقي الأنسجة المطعمة
- ضبط مجهر ستيريو إلى مستوى العين وتحسين اتجاه مصدر الضوء gooseneck لإلقاء الضوء على نحو كاف الجنين دون التسبب في انعكاسات.
- لتصور الجنين السليم، وحقن كمية صغيرة من الحبر الهندي تحت مركز القرص الأصفر الداكن ، وذلك باستخدام أنبوب الفم والزجاج سحب مايكرو ماصة (الشكل 1C ، ياالثاني).
- إعداد الحبر 50:50 مع برنامج تلفزيوني يحتوي على البنسلين / ستريبتومايسين في التركيز النهائي 100 ميكروغرام / مل. إدراج ماصة صغيرة من خلال غشاء صفار خارج محيط blastoderm ثم زاوية بعناية طرفه مباشرة تحت الجنين.
- تسليم الحبر تحت الجنين عن طريق تهب على أنبوب الفم. إذا لم يسمح بذلك، استخدم حقنة 1 مل بدلا من ذلك. يجب الحرص على عدم إدخال أي فقاعات الهواء تحت الجنين، والتي يمكن أن تؤدي إلى التلوث، ثم إزالة بعناية زجاج ماصة صغيرة. هذه خطوة حساسة يمكن أن تؤدي إلى موت الجنين إذا لم يتم ذلك بدقة.
- مرحلة الجنين بالإشارة إلى هامبورغر وهاملتون21 وتسجيل المرحلة في كتاب المختبر.
- باستخدام مشرط صغير مصنوع خصيصا (أو إبرة التنغستن الدقيقة) المثبتة على حامل إبرة ، قم بعمل جرح صغير جدا في الغشاء الهوتيلي ، بجوار المنطقة التي سيتم فيها إجراء الجراحة الدقيقة.
- تطبيق بعناية 2 -3 قطرات من برنامج تلفزيوني على المسيل للدموع الغشاء (باستخدام زجاج ماصة صغيرة وأنبوب الفم) لخلق مساحة بين الجنين والغشاء. قطع نافذة أكبر في الغشاء لفضح المنطقة بأكملها حيث ستجري الجراحة الدقيقة.
- إزالة منطقة الأنبوب العصبي ذات الاهتمام باستخدام مشرط صغير ، بدءا من الشقوق العرضية الوردية والكودية عبر الأنبوب العصبي الظهري بأكمله (على مستوى somite 1 إلى 7 في الفيديو).
- قطع ثنائيا بين الأنبوب العصبي والسخام لفصل الأنبوب العصبي من الأنسجة المحيطة بها، دون الإضرار السخامات.
- فصل بلطف جدا الأنبوب العصبي من notochord الكامنة، والتي ينبغي أن تبقى سليمة. لاحظ أن استئصال الأنبوب العصبي الناجح سيترك جميع الأنسجة المحيطة سليمة تماما(الشكل 2).
- إزالة الأنبوب العصبي المقتطع عن طريق التجسس عليه في زجاج ماصة صغيرة، ثم تجاهل.
- سجل مستوى استئصال الأنبوب العصبي في كتاب المختبر. الجنين المضيف جاهز الآن لاستقبال الأنبوب العصبي المانح.
5. إعداد أنسجة الكسب غير المشروع المانحة
- حدد جنين GFP ذو نوافذ ومطابق للمرحلة من خلال العرض تحت مجهر ستيريو فلوري مع فلتر FITC. الفلورية GFP يجعل من السهل جدا تصور السخامات ومرحلة الجنين.
- بمجرد تحديد جنين مطابق للمرحلة ، قم بإزالة الجنين من البويضة عن طريق إجراء 4 شقوق ، مع مقص ربيع Pascheff-Wolff(الشكل 1C ، l)في شكل مستطيل حول الجنين ثم التقطه بلطف بملعقة جنين.
- ضع الجنين في زجاج ساعة مربع مع قاعدة بوليمر سيلغارد. هز الجنين برفق مع ملاقط #5 دومون لإزالة أي صفار المرفقة. إزالة الغشاء vitelline ودبوس الجنين على قاعدة البوليمر باستخدام دبابيس minutien المقاوم للصدأ (الشكل 1C).
- باستخدام مقص الربيع، قم بعمل 4 شقوق في شكل مستطيل حول الأنبوب العصبي والسخام المحيط به، في نفس المنطقة التي تمت إزالتها من الجنين المضيف.
- باستخدام ماصة نقل البلاستيك، ونقل الأنبوب العصبي والأنسجة سوميت من الجنين GFP المانحة في كوب ووتش تحتوي على 0.2٪ البنكرياس في القلم / ستريب PBS.
- السماح للهضم الأنزيمي للمضي قدما لمدة 10 دقيقة في RT للمساعدة في فصل الأنسجة. بعد الحضانة في الإنزيم، استخدم دبابيس minutien غير القابل للصدأ المثبتة على مقبض لفصل الأنبوب العصبي يدويا عن جميع الأنسجة المجاورة.
- باستخدام زجاج ماصة صغيرة، نقل الأنبوب العصبي فصل إلى آخر زجاج ساعة تحتوي على DMEM + 10٪ مصل(على سبيل المثال،الماعز والحصان أو العجل الجنين) على الجليد، لشطف البنكرياس الزائد ووقف الهضم الأنزيمي. بعد 5 دقائق، الأنبوب العصبي تشريح جاهزة ليتم تطعيم orthotopically في المضيف فرخ(الشكل 2 و S1).
6. الكسب غير المشروع الأنسجة
- باستخدام زجاج ماصة صغيرة، نقل بعناية الأنبوب العصبي تشريح من الزجاج ووتش إلى الجنين المضيف. ضع الأنبوب العصبي في الاتجاه الأمامي الخلفي الصحيح وادفع بلطف إلى الإكسبلانت المجاور للمنطقة المقتطعة من مضيف الفرخ باستخدام المشرط الصغير. اترك جزءا صغيرا من ectoderm متصلا بالسطح الظهري أو بقطعه صغيرا لتحديد اتجاه الأنبوب العصبي.
- إذا لزم الأمر، استخدم المشرط الصغير لتقليم explant إلى الحجم الدقيق للمنطقة المقتطعة.
- توجيه بلطف الأنبوب العصبي في المنطقة اجتثاث ووضعها بحيث يتم توجيه الجانب الظهري بشكل صحيح. استخدام زجاج مايكرو ماصة، شنت على أنبوب الفم، لإزالة برنامج تلفزيوني و / أو السوائل المحيطة الكسب غير المشروع. وهذا يساعد الأنسجة المانحة والمضيفة على الالتزام والكسب غير المشروع لتصبح راسخة.
- ختم النافذة بأكملها مع شريط واضح 24 ملم لمنع الجفاف والتلوث.
- قم بتسمية الجنين الشيمي عن طريق وضع علامة بقلم رصاص على قشر البيض وتسجيل رقمه في دفتر المختبر. أعد البيضة إلى الحاضنة لمزيد من التطوير.
7. حقن DiI في الأوعية الدموية للجنين المضيف
- عند النقطة الزمنية التجريبية المرغوبة (هنا ، بعد 3 - 10 أيام) ، استرجع الجنين الشيمي من الحاضنة وأزل الشريط الواضح باستخدام مقص مستقيم للوصول إلى الجنين داخل البويضة.
- إذا لزم الأمر، قم بتكبير النافذة في القشرة باستخدام المقص. يجب الحرص على عدم تلف الغشاء chorioallantoic إذا تعلق على قذيفة، مما سيؤدي إلى نزيف وتعريض وضع العلامات الأوعية الدموية للخطر.
- اختر وريدا يمكن الوصول إليه على الصفار للتأكد من توجيه تدفق الدم نحو الجنين. اختر نقطة متفرعة لأحد الأوردة الواهية(الشكل 3B، C).
ملاحظة: في E6.5 - E7.5، قد يحتاج الغشاء chorioallantoic إلى أن يتم نقله بلطف جانبا مع ملاقط للوصول إلى عروق الصفار. بعد E8.5 ، الخيار الوحيد هو الحقن في أحد عروق الغشاء المشيمي منذ ذلك الحين ، في هذه المرحلة ، يغطي الغشاء المشيمي الجنين بالكامل. - إزالة الغشاء الهوتيلي فوق نقطة الحقن المختارة باستخدام اثنين من ملاقط #5 دومون عن طريق تمزيق في اتجاهين متعاكسين.
- كسر إبرة زجاجية سحبت باستخدام #5 دومون وضبط قطرها إلى الحجم التقريبي للوريد قبل التحميل مع CellTracker CM-DiI. جعل حل الأسهم DiI في 40 ميكروغرام / ميكرولتر في DMSO وتخزينها في -20 درجة مئوية. إعداد حل العمل في 0.3 M السكروز / برنامج تلفزيوني بتركيز 4 ميكروغرام / ميكرولتر.
- اسبيرات بين 5 - 10 ميكرولتر من DiI في 0.3 M السكروز / برنامج تلفزيوني في الإبرة باستخدام شفط مع أنبوب الفم. قد تتطلب الأجنة القديمة ما يصل إلى 25 ميكرولتر أو أكثر. من E8.5 ، تحتوي الأجنة على عروق أكبر وأكثر عضلية ، والتي قد تحتاج إلى الاحتفاظ بها في موقفها مع #5 Dumont قبل الطعن بالإبرة الزجاجية المحملة ب DiI.
- أدخل الإبرة بسرعة في الوريد وانفتاحا بثبات مع أنبوب الفم للسماح للديي بالانضمام إلى تدفق الدم ببطء دون تشكيل جلطة. بدلا من ذلك، استخدم حاقن الضغط لتسليم DiI.
8. حصاد الأجنة للقسم أو فحص التلال الكاملة
- للاحتفاظ بقدر DiI داخل الجنين قدر الإمكان ، حصاد الجنين مباشرة بعد الحقن عن طريق مغرفة على ملعقة مثقبة وقطع الأوعية الدموية والأنسجة الضامة مع زوج من مقص مستقيم ، لتحرير الجنين من الصفار.
- إزالة أي أغشية فضفاضة وتشريح من الأجهزة ذات الأهمية(أي،والرئتين والجهاز الهضمي في هذا البرنامج التعليمي)، مع الحرص الشديد على عدم ضغط الأنسجة، مما يخلق انتشار DII. قم بإصلاح الأنسجة على الفور عن طريق الغمر في 4٪ PFA لمدة 1 -2 ساعة في RT.
- شطف الأنسجة لمدة 5 دقائق في برنامج تلفزيوني، ثم 15 دقيقة في برنامج تلفزيوني يحتوي على 5 ميكروغرام / مل DAPI. قم بتركيب العينات على شريحة مجهر جسرية لفحص التركيب بأكمله أو تضمينها لقسم التبريد.
النتائج
ويبين الشكل 1 الأدوات النموذجية اللازمة لتنفيذ العزل المجهري وزرع الأنبوب العصبي. يظهر الشكل 2 إجراء عملية الزرع. بعد زرع الأجنة يتم فحص لنجاح عملية زرع. وهذا ينطوي على فحص الجنين تحت مجهر مضان ستيريو، وعادة في صباح اليوم التالي لجراحة دقيقة، لوجود NCC المستمدة من الكسب غير المشروع (GFP+). إذا كانت عملية الزرع ناجحة ، فيمكن ملاحظة GFP + NCC بالقرب من الأنبوب العصبي وفي مسارات الهجرة المبكرة المؤدية إلى الصدارة. إذا لم يكن الإجراء ناجحا ، فلن تتم ملاحظة GFP + NCC خارج الأنبوب العصبي ، أو إذا كانت موجودة في المضيف ، فقد تكون بأعداد أقل. يتم التخلص من هذه الأجنة غير الناجحة. عادة، يتم إجراء 5-8 عمليات زرع الأنبوب العصبي في يوم واحد، ومن هذه 80٪ ناجحة. أسباب زرع الأنبوب العصبي غير ناجحة تشمل وفاة الجنين بسبب تلف الأنسجة التي تكبدتها أثناء الجراحة المجهرية، أو فشل الأنبوب العصبي لدمج في الجنين المضيف. يمكن أن ينتج هذا الأخير عن ضعف وضع الأنبوب العصبي داخل المضيف أو من أنبوب عصبي ضعيف الجودة بسبب تقنية تشريح سيئة أو من التعرض المفرط لأنزيم الانفصال. خطوة الفحص الأولية ، فضلا عن الفحوصات اللاحقة المماثلة لخلايا GFP + ، مفيدة لأنها تعني أن الوقت والموارد لا تضيع من خلال إجراء تجارب على الأجنة التي ليس لديها NCC المسمى GFP داخل الأمعاء.
الشكل 3 يبين الإجراء لحقن DiI من الأوعية الدموية. تعتمد كفاءة / نجاح تقنية حقن DiI على: أولا ، قطع إبرة الحقن إلى القطر الأمثل للوريد المستهدف ، والثاني لفتة دقيقة عند إدخال الإبرة في الوريد (حتى لا تخترق الجانب الآخر) ، وثالثا تجنب الإبرة التي يتم توصيلها أثناء الحقن عن طريق النفخ بمعدل ثابت. إذا تم إجراء أي من هذه المعلمات الثلاثة بشكل غير صحيح ، فإن الجنين سوف ينزف أو سيحتاج إلى عدة ساعات للتعافي قبل إجراء محاولة ثانية لأن النزيف يجعل من المستحيل تقريبا إعادة الحقن على الفور. يجب اختيار الأجنة الناجحة على الفور عن طريق المشاهدة تحت مجهر ستيريوفلورسينس ويجب تشريحها بسرعة. في الأجنة الناجحة، ديي المسمى الأوعية الدموية موجودة في جميع أنحاء الجنين (الشكل 3C، D) بما في ذلك الأسرة الشعرية (الشكل 3D).
عند حصاد الأجنة وفحص أقسام الأنسجة أو المسالك الهضمية الكاملة ، تكشف النتائج النموذجية GFP + NCC داخل ENS البدائية والهيكل الدقيق لشبكات الأوعية الدموية للأمعاء المسماة DiI(الشكل 4)يمكن فحص تحضيرات Wholemount باستخدام المجهر البؤري حيث تنتج أكوام الصور عمليات إعادة بناء ثلاثية الأبعاد (ثلاثية الأبعاد) تظهر العلاقات المتبادلة بين التوقعات الدقيقة لخلايا GFP + ENS ونظام الأوعية الدموية الملطخ DiI (الشكل 4 A-C؛ G-I; الفيديو 1 و 2).

الشكل 1 - الأرقام 1- الأرقام 1 أدوات الجراحة المجهرية الموصى بها. (أ) مشرط صغير على شكل إبرة خياطة. (ب) حجر أركنساس الدقيق لتشكيل مشرط صغير. (ج) أ) مقص مستقيم، ب) مقص منحني، ج) 5 مل حقنة مع إبرة تحت الجلد 181/2 G، د) ماصة بلاستيكية، ه) حامل البيض المصنوعة خصيصا، و) الحبر الأسود، ز) زجاج الساعة المربعة، ح) مربع ساعة الزجاج مع قاعدة sylgard السوداء، ط) مشرط صغير على حامل إبرة، ي) دبابيس minutien، ك) minutien أو إبرة التنغستن على حامل إبرة، ل) مقص الربيع باشيف وولف، م) دومون #5 ملاقط، ن) ملعقة مثقبة، أوي) قصيرة إبرة نقل النار سحبت، oii) طويلة إبرة التحبير النار سحبت، ف) أنبوب الفم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
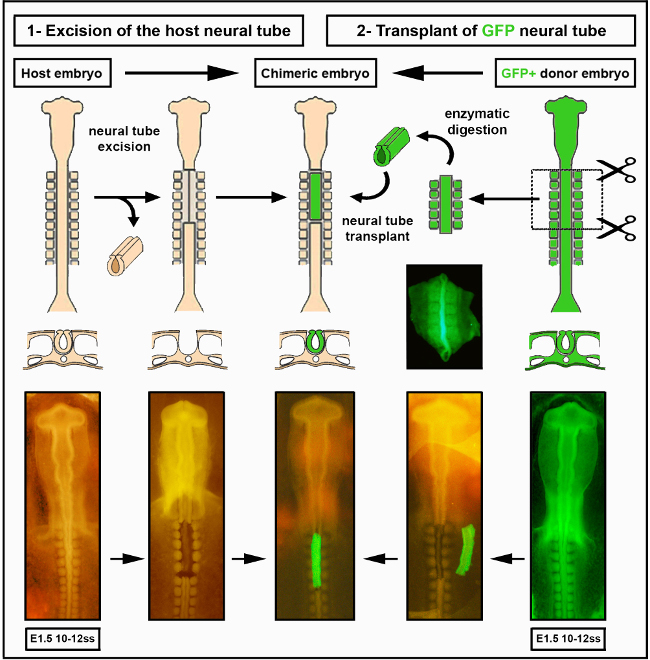
الشكل 2 - الأرقام 2- الأرقام التي تم زرع الأنبوب العصبي داخل الأنواع. وقد تم تعديل الجنين فرخ / GFP صور الأنبوب العصبي من ديلالاند وآخرون. 12.الأوعية الدموية ليست ضرورية لاستعمار الأمعاء عن طريق الخلايا المعوية قمة العصبية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
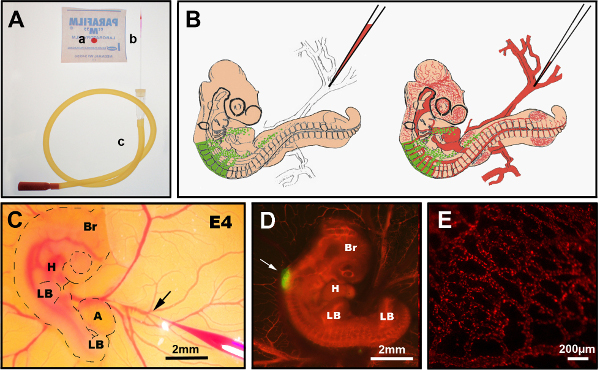
الشكل 3 - الأرقام 3- الأرقام التي يمكن أن حقن ديي الوريدي. (أ) الصكوك الموصى بها: أ) CellTracker CM-DiI قطرة على parafilm، ب) سحبت إبرة حقن الزجاج، ج) أنبوب الفم. (ب) مخطط تخطيطي لحقن DiI الوريدي في جنين فرخ E4 chimeric. (ج) في حقن أوفو ديي الوريدي تظهر إبرة زجاجية دقيقة تحتوي على DiI إدراجها في الوريد (السهم). (D) E4 الجنين الشيمي آخر حقن DiI (أحمر) مع GFP + الأنبوب العصبي (السهم). (ه) DiI ملطخة شبكة الأوعية الدموية الدقيقة في الجنين الحي، 24 ساعة بعد الحقن. Br: الدماغ; H: القلب; LB: برعم الطرف; A: الانتوا. تم تعديل الصور في (C) و (D) من ديلالاند وآخرون. 12 الأوعية الدموية ليست ضرورية لاستعمار الأمعاء عن طريق خلايا القمم العصبية المعوية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
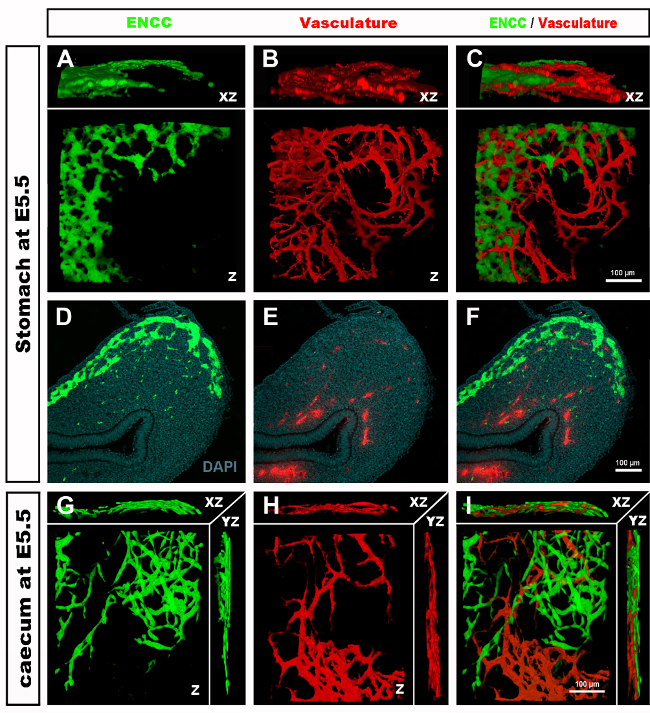
الشكل 4: النتائج التمثيلية في المعدة وcaecum من جنين فرخ E5.5. (A-C) 3 الأبعاد (3D) إعادة بناء كومة صورة confocal في منطقة المعدة تظهر (D) GFP + الخلايا المعوية قمة العصبية (ENCC) (E) نظام الأوعية الدموية الملطخة DiI و (F) صورة مدمجة لكلا المقاطع الهسولوجية D-F الشبكات على مستوى المعدة تظهر (G) وGFP + ENCC (H) نظام الأوعية الدموية الملطخة DiI و (I) صورة مدمجة لكلا الشبكتين. النوى ملطخة DAPI (سماوي). (G-H) إعادة بناء ثلاثي الأبعاد لكومة صور كونفوكال في منطقة كايكوم تظهر (A) جبهة ترحيل GFP+ ENCC باللون الأخضر، (B) نظام الأوعية الدموية الملون DiI باللون الأحمر، و (C) صورة مدمجة لكلا الشبكتين. تم تعديل الصور (A-F) من ديلالاند وآخرون. 12 الأوعية الدموية ليست ضرورية لاستعمار الأمعاء عن طريق خلايا القمم العصبية المعوية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
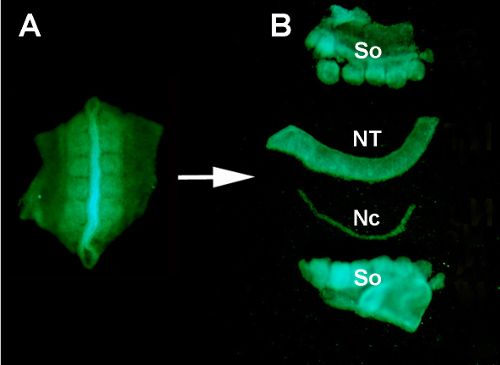
الشكل S1- الأرقام 1- الأرقام 1 عزل أنبوب GFP + العصبي المانح عن الأنسجة المحيطة عن طريق الهضم الأنزيمي والتشريح الدقيق. (أ) الأنبوب العصبي GFP+ والسخامات المجاورة التي تم تشريحها من الجنين المتبرع. (ب) أنبوب عصبي معزول بعد هضم البنكرياس وتشريح الدقيقة باستخدام دبابيس minutien المقاوم للصدأ. لذا: السخامات؛ NT: الأنبوب العصبي; ن. ن.
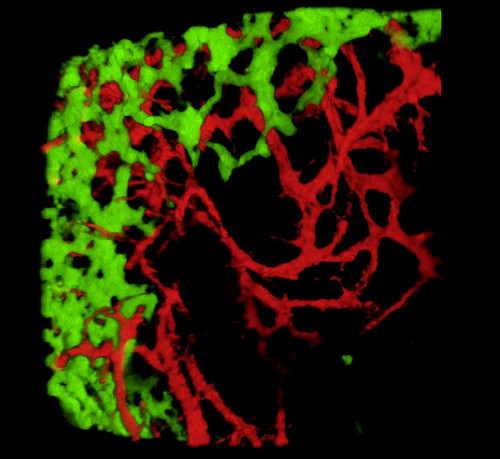
فيديو 1. دوران 3 الأبعاد 360 درجة من الصورة في الشكل 4C، والتي تبين نظام الأوعية الدموية وENCC في المعدة في E5.5 (HH27-28). الرجاء الضغط هنا لعرض هذا الفيديو.
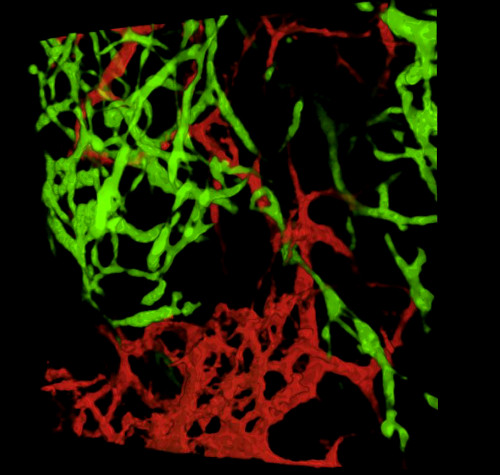
فيديو 2. دوران 3 الأبعاد 360 درجة للصورة في الشكل 4I، والتي تبين نظام الأوعية الدموية والجبهة الهجرة ENCC في منطقة caecum في E5.5 (HH27-28). الرجاء الضغط هنا لعرض هذا الفيديو.
Discussion
طريقة تطعيم الأنبوب العصبي داخل الأنواع ، جنبا إلى جنب مع وضع العلامات على الأوعية الدموية الموصوفة هنا ، تستفيد استفادة كاملة من سهولة وصول جنين الطيور داخل البويضة (مقارنة بالأجنة الفقارية الأخرى) لدراسة التطوير المشترك لعنصر من عناصر الجهاز العصبي اللاإرادي (ENS) والجهاز الوعائي.
لتسمية مشتقات NCC ، فإن طريقة تطعيم الفرخGFP-chick intraspecies التي نصفها لديها عدد من المزايا على طريقة السمان - الفرخ الكلاسيكية التي تم إنشاؤها منذ أكثر من 40 عاما1-3. أولا، تحت ضوء FITC، GFP مضان مشرق للغاية، لدرجة أن خلايا GFP + يمكن تمييزها بسهولة في الأجنة الشميرية الحية. وهذا يسمح لنجاح الكسب غير المشروع ليتم فحصها في أوفو، في حين أن تطعيم السمان فرخ يتطلب الجنين أن يقتل ، ومعالجتها والملطخة بالمناعة باستخدام QCPN ، قبل نجاح الكسب غير المشروع يمكن التأكد2. ثانيا، التعبير GFP فيGFP الفرخ المعدلة وراثيا هو السيتوبلازمية، وبالتالي فإنه ليس فقط تسميات أجسام الخلايا، ولكن أيضا يسمح لإسقاطات الخلايا المزروعة أن تصور22. وهذا يسمح الشبكات العصبية المعقدة أن يلاحظ في قرار عالية (لاحظ أن أفضل تصور التوقعات الدقيقة عندما تكون العينة مناعة ملطخة الأجسام المضادة لGFP). كما يقتصر وضع العلامات QCPN لنواة خلية السمان، لا يتم الكشف عن مثل هذه الشبكات باستخدام السمان فرخ الوهم. ثالثا، التطعيم داخل الأنواع يزيل أي اختلافات محتملة بين الأنواع بين الخلايا داخل الجنين الشيمي. منذ أجنة السمان لديها فترة حضانة أقصر من الفرخ (19 يوما مقابل 21 يوما) وقد اقترح أن خلايا السمان لديها معدل انتشار أعلى من خلايا الفرخ، والتي يمكن أن تؤثر على تطوير الأنسجة الشميرية23. ومن المثير للاهتمام أيضا، وقد ثبت في النباتات أن تطعيم بين الأنواع يمكن أن تنتج تعديلات واسعة النطاق في أنماط ميثيل الحمض النووي في المضيف 24. رابعا، الفرخGFP يسهل تجارب زرع الظهر لمعالجة مواضيع مثل مصير NCC والتزام الخلية25. خامسا ، الفرخ المعدل وراثياGFP مفيد أيضا للعديد من التقنيات الأخرى بما في ذلك فرز FACS من الخلايا الفرعية GFP + ، والثقافة العضوية للأعضاء التي تحتوي على خلايا GFP + ، والتلاعب الجيني للأنسجة GFP + المطعمة عن طريق الكهرومporation من البلازميدات التعبير26، وغيرها من تقنيات التصوير مثل التصوير المقطعي الإسقاط البصري27.
يمكن تعديل نهج زرع الأنبوب العصبي عن طريق استبدال كميات أقصر من الأنبوب العصبي جراحيا. باستخدام أجزاء أصغر من الأنبوب العصبي الجراحة المجهرية يحتمل أن تكون أقل ضررا على الجنين ويمكن تحسين البقاء على قيد الحياة. ومع ذلك ، فإن الجانب السلبي لزرع أنبوب عصبي أقل هو أن أعداد GFP + NCC في المضيف سيتم تخفيضها. يمكن للمستخدمين محاولة تحقيق توازن بين كمية الأنبوب العصبي المزروعة لإعطاء البقاء الأمثل للأجنة، وأعداد GFP + NCC داخل الأمعاء المضيفة كافية لإعطاء نتائج مفيدة.
بالنسبة لطلاء السفن ، تتمتع DiI بميزة أن مضانها مشرق وقوي للغاية. أيضا، لديها القدرة على الانتشار أثناء التثبيت ضمان تلطيخ أرقى الشعيرات الدموية المفتوحة. نظرا لأنه صبغة حيوية ، يمكن للأجنة البقاء على قيد الحياة في إجراء الحقن والاستمرار في التطور مع نظام الأوعية الدموية الملطخة (حتى 24 ساعة في أيدينا ، على الرغم من أن التلطيخ يصبح أكثر وضوحا بمرور الوقت ، انظر الشكل 3E). وبالتالي فإن الجمع بين تطعيمالفرخ GFP مع لوحة الأوعية الدموية DiI متوافق مع التصوير الحي. وإلى جانب كل هذه المزايا، من المهم أن نلاحظ أن حقن الأوعية الدموية تسميات الأوعية مضيئة فقط، وبالتالي لا يحدد الشعيرات الدموية غير مفتوحة، وخلايا تلميح البطانية أو الخلايا البطانية المعزولة. ومع ذلك، يمكن أن يوفر المزيد من التقدم في تكوين الطيور طرقا جديدة للتحايل على مثل هذه القضايا، كما يتضح من التجارب باستخدام أجنة السمان Tg (tie1:H2B-eYFP) لدراسة مورفوجينيسيس الأوعية الدموية28. وثمة قيد آخر لهذه التقنية هو أنه من أجل وضع علامات فعالة على الأوعية في الأجنة في E7.5 وما بعدها، يجب حقن كميات أكبر من الصبغة، مما قد يجعل التجارب مكلفة. ومع ذلك، يمكن أن يتضمن تعديل هذه التقنية منخفضة التكلفة الأوعية الدموية وضع العلامات على الحبر قلم تمييز14،على الرغم من أن هذا النهج لم يجرب في أيدينا.
وتشمل الخطوات الحاسمة للإجراءات عملية تصور الجنين عن طريق حقن الحبر تحت blastodisc. إذا تمزق الغشاء الذي يغطي صفار بواسطة إبرة مملوءة بالحبر في هذه المرحلة ثم بقاء الجنين للخطر الشديد. أيضا، من المهم، عند إعداد الأنبوب العصبي المانحة، أن لا تترك الأنسجة لفترة طويلة بشكل مفرط في البنكرياس (النظر في ما يقرب من 10 دقيقة كحد أقصى). التعرض لفترات طويلة لتلف البنكرياس الأنسجة وأنبوب العصبي ثم من الصعب التعامل معها، وأنها لن تدرج بشكل جيد في المضيف. اكتساب الخبرة في تقنية حقن DiI على الأجنة البرية من النوع ضروري قبل حقن الأجنة الشميرية ، حيث أن محاولة واحدة فقط للحقن ممكنة بشكل عام لكل جنين. حجم DiI وقطر الإبرة هي المعلمات الحاسمة لكل جنين، وينبغي تقييمها على نوع البرية، والضوابط المرحلة المتطابقة.
في الختام، يمكن استخدام طريقة وضع العلامات المزدوجة الخاصة بنا لزرع الأنبوب العصبي ورسم وعاء DiI في أجنة الفرخ الحية للتحقيق في العلاقات بين NCC وشبكات الأوعية الدموية أثناء تكوين الأعضاء. وبالنظر إلى أن الآليات المسؤولة عن تحديد التدين المستهدف الصحيح والأوعية الدموية أثناء تطور الأعضاء لا تزال غير معروفة إلى حد كبير، فإن هذه المنهجية تحمل إمكانات الاكتشافات المستقبلية في هذا المجال.
Disclosures
ويعلن أصحاب البلاغ أنه ليس لديهم مصالح مالية متنافسة.
Acknowledgements
تم توفير بيض الدجاج المخصب GFP من قبل البروفيسور هيلين سانغ، معهد روزلين، وجامعة أدنبرة، المملكة المتحدة. يتم تمويل مرفق روزلين للدجاج المعدل وراثيا من قبل صندوق ويلكوم ومجلس أبحاث التكنولوجيا الحيوية والعلوم البيولوجية (BBSRC). تم تمويل العمل جزئيا، ودعم NT، من قبل جمعية مستشفى غريت أورموند ستريت الخيرية للأطفال، لندن، المملكة المتحدة. يشكر المؤلفون بن جيفانس، معهد UCL لصحة الطفل، للمساعدة في إعداد الأجنة ل التطعيم.
Materials
| Name | Company | Catalog Number | Comments |
| Name of the Material/Equipment | Company | Catalog Number | |
| Fertilised chick eggs | Henry Stewart and Co, Louth, UK | ||
| Fertilised GFP chick eggs | The Transgenic Chicken Facility, The Roslin Institute, The University of Edinburgh | ||
| Egg incubator (Profi-H Hatcher) | Lyon Technologies, CA, USA | 910-033 | |
| 14C Incubator | Precision Cooled Incubator, Leec Ltd., Nottingham, UK | Model LT2 | |
| Stereo-microscope | LEICA | Model MZ 12.5 | |
| Digital Camera | LEICA | DC500 | |
| Image acquisition software | LEICA | IM50 | |
| Goose neck halogen cold light source | Advanced Imaging Concepts, Inc | KL 1500 LCD | |
| 181⁄2 G hypodermic needle | SIGMA - ALDRICH | HSWNH181 | |
| Pancreatin | SIGMA - ALDRICH | P3292 | |
| DMEM | SIGMA - ALDRICH | D5030 | |
| Goat serum | SIGMA - ALDRICH | G6767 | |
| 5ml syringe | SIGMA - ALDRICH | Z248010 | |
| Mouth tube | SIGMA - ALDRICH | A5177 | |
| Sigma Pasteur pipettes non-plugged, L 5 3/4 in. | SIGMA - ALDRICH | S6018 | |
| Transfer pipettes, polyethylene | SIGMA - ALDRICH | Z350796 | |
| Borosillicate glass capillaries, thin wall without filament | Harvard apparatus | PY8 30-0035 | |
| Iris Scissors - ToughCut | Fine Science Tools | 14058-09 | |
| Curved Iris Scissors - ToughCut | Fine Science Tools | 14059-09 | |
| Needle holders (Nickel-plated pin holder) | Fine Science Tools | 26018-17 | |
| Pascheff-Wolff Spring Scissors | Fine Science Tools | 15371-92 | |
| Dumont #5 forceps | Fine Science Tools | 11251-30 | |
| Minutien pins | Fine Science Tools | 26002-15 | |
| Dumont AA forceps, Inox Epoxy- coated | Fine Science Tools | 11210-10 | |
| Perforated spoon | Fine Science Tools | 10370-18 | |
| Tungsten needles (0.125mm diameter) | Fine Science Tools | 10130-05 | |
| Sellotape (clear, 24mm width) | Any Supplier | ||
| Pen/Strep (Penicillin, Streptomycin) Solution | VWR international | 101447-068 | |
| Sylgard 184 silicone elastomer kit | Dow Corning | S09 512 516 | |
| Pelikan black ink | Pelikan | 211-169 | |
| CellTracker CM-DiI | Molecular Probes | C-7001 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Molecular Probes | D1306 | |
| Settings for glass needle puller | Sutter Instruments | Flaming/Brown micropipette puller model P-86 | |
| Heat 950; Pull 150; Velocity 100; Time 200; Pressure 500 |
References
- Le Douarin, N. A biological cell labeling technique and its use in expermental embryology. Developmental Biology. 30, 217-222 (1973).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods in Molecular Biology. 461, 337-350 (2008).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods in Molecular Biology. 97, 305-318 (1999).
- Garcia-Castro, M., Bronner-Fraser, M. Induction and differentiation of the neural crest. Current Opinion In. Cell Biology. 11, 695-698 (1999).
- Bhatt, S., Diaz, R., Trainor, P. A. Signals and switches in Mammalian neural crest cell differentiation. Cold Spring Harbor Perspectives In Biology. 5, (2013).
- Burns, A. J., Douarin, N. M. The sacral neural crest contributes neurons and glia to the post-umbilical gut: spatiotemporal analysis of the development of the enteric nervous system. Development. 125, 4335-4347 (1998).
- Burns, A. J., Le Douarin, N. M. Enteric nervous system development: analysis of the selective developmental potentialities of vagal and sacral neural crest cells using quail-chick chimeras. The Anatomical Record. 262, 16-28 (2001).
- Burns, A. J., Delalande, J. M., Le Douarin, N. M. In ovo transplantation of enteric nervous system precursors from vagal to sacral neural crest results in extensive hindgut colonisation. Development. 129, 2785-2796 (2002).
- Burns, A. J., Champeval, D., Le Douarin, N. M. Sacral neural crest cells colonise aganglionic hindgut in vivo but fail to compensate for lack of enteric ganglia. Developmental Biology. 219, 30-43 (1006).
- Wang, X., Chan, A. K., Sham, M. H., Burns, A. J., Chan, W. Y. Analysis of the sacral neural crest cell contribution to the hindgut enteric nervous system in the mouse embryo. Gastroenterology. 141, 992-1002 (2011).
- Goldstein, A. M., Hofstra, R. M., Burns, A. J. Building a brain in the gut: development of the enteric nervous system. Clinical Genetics. 83, 307-316 (1111).
- Delalande, J. M., et al. Vascularisation is not necessary for gut colonisation by enteric neural crest cells. Developmental Biology. 385, 220-229 (2014).
- Anderson, R. B., Stewart, A. L., Young, H. M. Phenotypes of neural-crest-derived cells in vagal and sacral pathways. Cell And Tissue Research. 323, 11-25 (2006).
- Takase, Y., Tadokoro, R., Takahashi, Y. Low cost labeling with highlighter ink efficiently visualizes developing blood vessels in avian and mouse embryos. Development, Growth & Differentiation. 55, 792-801 (2013).
- Bates, D., Taylor, G. I., Newgreen, D. F. The pattern of neurovascular development in the forelimb of the quail embryo. Developmental Biology. 249, 300-320 (2002).
- Mayes, P., Dicker, D., Liu, Y., El-Deiry, W. Noninvasive vascular imaging in fluorescent tumors using multispectral unmixing. BioTechniques. 45, 459-460 (2008).
- Li, Y., et al. Direct labeling and visualization of blood vessels with lipophilic carbocyanine dye DiI. Nature Protocols. 3, 1703-1708 (2008).
- Eichmann, A., Thomas, J. L. Molecular parallels between neural and vascular development. Cold Spring Harbor Perspectives In Medicine. 3, a006551 (2013).
- Weinstein, B. M. Vessels and nerves: marching to the same tune. Cell. 120, 299-302 (2005).
- Carmeliet, P., Tessier-Lavigne, M. Common mechanisms of nerve and blood vessel wiring. Nature. 436, 193-200 (2005).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88, 49-92 (1951).
- Barraud, P., et al. Neural crest origin of olfactory ensheathing glia. Proceedings of the National Academy of Sciences of the United States of America. 107, 21040-21045 (2010).
- Senut, M. C., Alvarado-Mallart, R. M. Cytodifferentiation of quail tectal primordium transplanted homotopically into the chick embryo. Brain Research. 429, 187-205 (1987).
- Wu, R., et al. Inter-species grafting caused extensive and heritable alterations of DNA methylation in Solanaceae plants. PLoS One. 8, e61995 (2013).
- Freem, L. J., Delalande, J. M., Campbell, A. M., Thapar, N., Burns, A. J. Lack of organ specific commitment of vagal neural crest cell derivatives as shown by back-transplantation of GFP chicken tissues. The International Journal Of Developmental Biology. 56, 245-254 (2012).
- Delalande, J. M., et al. The receptor tyrosine kinase RET regulates hindgut colonization by sacral neural crest cells. Developmental Biology. 313, 279-292 (2008).
- Freem, L. J., et al. The intrinsic innervation of the lung is derived from neural crest cells as shown by optical projection tomography in Wnt1-Cre;YFP reporter mice. Journal of Anatomy. 217, 651-664 (2010).
- Sato, Y., et al. Dynamic analysis of vascular morphogenesis using transgenic quail embryos. PloS One. 5, e12674 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved