Method Article
תיוג כפול של תאי ציצה עצבית וכלי דם בתוך עוברי עוף באמצעות שתל צינור עצביGFP אפרוח והזרקת צבע DiI Carbocyanine
In This Article
Summary
כאן אנו מדווחים על תיוג כפול של תאי ציצה עצביים וכלי דם באמצעות השתלת צינור עצביGFP אפרוחים בשילוב עם הזרקת DiI תוך וסקולרית. טכניקה ניסיונית זו מאפשרת לנו לדמיין וללמוד בו זמנית את ההתפתחות של מערכת העצבים (האנטרית) הנגזרת מ- NCC ומערכת כלי הדם, במהלך אורגנוגנזה.
Abstract
כל האיברים המתפתחים צריכים להיות מחוברים הן למערכת העצבים (לשליטה חושית ומוטורית) והן למערכת כלי הדם (להחלפת גזים, אספקת נוזלים וחומרים מזינים). כתוצאה מכך, הן מערכות העצבים והן מערכות כלי הדם מתפתחות זו לצד זו וחולקות קווי דמיון בולטים בארכיטקטורת ההסתעפות שלהן. כאן אנו מדווחים על מניפולציות עובריות המאפשרות לנו לחקור את ההתפתחות הסימולטנית של רקמת עצבים שמקורה בסמל עצבי (במקרה זה מערכת העצבים האנטרית), ואת מערכת כלי הדם. זה מושגת על ידי יצירת כימרות עוף באמצעות השתלת קטעים נפרדים של הצינור העצבי, ואת הסמל העצבי הקשורים, בשילוב עם הזרקת DiI כלי דם באותו עובר. השיטה שלנו משתמשת בעוברים מהונדסיםשל אפרוחים GFP להשתלה תוך-מינית, מה שהופך את טכניקת ההשתלה לחזקה יותר מפרוטוקול השתלת אפרוחי השליו הקלאסי המשמש בהשפעה רבה מאז שנות השבעים. השתלת אפרוחיםGFP-אפרוחים intraspecies מאפשרת הדמיה של תאים מושתלים ואת התחזיות שלהם ברקמות שלמות, ומבטלת כל הטיה פוטנציאלית בהתפתחות התאים הקשורה להבדלים בין מינים. שיטה זו מנצלת במלואה את קלות הגישה של עובר העופות (בהשוואה לעוברים אחרים של בעלי חוליות) כדי לחקור את ההתפתחות המשותפת של מערכת העצבים האנטרית ומערכת כלי הדם.
Introduction
עובר העוף הוא אורגניזם מודל שלא יסולא בפז בביולוגיה התפתחותית של בעלי חוליות, לא פחות משום שהתפתחותו באובו מאפשרת מניפולציות ניסיוניות שאחרת בלתי אפשריות לביצוע בחולייתנים המתפתחים ברחם. נגישות זו וקלות המניפולציות הובילו לכך שעובר הגוזל ממלא תפקידי מפתח בתגליות מהותיות רבות בתחום הביולוגיה ההתפתחותית. בין הטכניקות החזקות ביותר היה השימוש בעוברים כימריים אפרוחי שליו כדי לחקור את גורל התא, שיטה חלוצית על ידי פרופסור ניקול לה Douarin בשנות ה-70 1-3. בפרט, כימרות שליו-חומוס היו שימושיים במיוחד כדי לסמן גנטית ולעקוב אחר אוכלוסיות גבוהות של תאי ציצה עצביים נודדים (NCC) במהלך ההתפתחות המוקדמת. NCC הם אוכלוסייה רב-תכליתית של תאים נודדים, הנובעת באקטודרם הגבי בשולי הצינור העצבי, המולידה מגוון רחב של סוגי תאים ברחבי העובר החולייתני. אלה כוללים מבנים craniofacial (סחוס, עצם, שרירים), נוירונים גליה (במערכת העצבים החושית והאוטונומית), מלנוציטים, ותת-אוכלוסין של תאים של המערכת האנדוקרינית2,4,5. אחד הגורמים החשובים ביותר המשפיעים על גורל NCC הוא מיקומם הראשוני לאורך הציר האחורי-ראשי של הצינור העצבי. לדוגמה, NCC אנטרי, אשר מעוררים את הנוירונים ואת גליה של מערכת העצבים האנטרית (ENS), נובעים משתי תת אוכלוסיות נפרדות: הראשון ממוקם באזור vagal (caudal hindbrain), והשני באזור sacral של הצינור העצבי6-13. השתלה בין-מינים או פנים-מינים של האזורים המתאימים של הצינור העצבי היו הטכניקות המועדפות לתייג תאים אלה לצמיתות ולאחר מכן לאפשר מעקב, מלידתם בשולי הצינור העצבי, ליעדם הסופי בתוך מערכת העיכול6,7,10.
מניפולציה עוברית נוספת שקל יותר לבצע בחומוס, בהשוואה למודלים אחרים של בעלי חיים, היא תיוג חיוני של מערכת כלי הדם. ואכן, ככל שעובר הגוזל מתפתח, הוא מונח על גבי רשת כלי דם חוץ-עוברית המסתובבת חמצן וחומרים מזינים מהחלמון. רשת כלי דם נגישה זו, הממוקמת על פני השטח של החלמון, יכולה לשמש כשער לתיוג מערכת כלי הדם המתפתחת של העובר במהלך organogenesis12,14-17. הזרקה תוך-וסקולרית של צבעים שונים, כגון צבע ליפופילי DiI, מאפשרת לציין /להכתים את כל כלי הדם הזוהרים של רשת כלי הדם המתהווה.
מכיוון שאיברים מתפתחים צריכים להיות מחוברים הן למערכת העצבים (לשליטה חושית ומוטורית) והן למערכת כלי הדם (להחלפת גזים, אספקת נוזלים וחומרים מזינים), שתי הרשתות מתפתחות זו לצד זו וחולקות קווי דמיון בולטים בארכיטקטורת ההסתעפות שלהן18-20. כאן אנו מדווחים על מניפולציות עובריות המאפשרות לנו לחקור את ההתפתחות הסימולטנית של ENS שמקורו ב- NCC, יחד עם מערכת כלי הדם, במהלך organogenesis. זה מושגת על ידי יצירת כימרות עוף באמצעות השתלת קטעים נפרדים של הצינור העצבי, כולל הסמל העצבי, בשילוב עם הזרקת DiI כלי דם. כהתקדמות מכומרות עוף שליו, השיטה שלנו משתמשת בעוברים מהונדסים של אפרוחי GFP להשתלה תוך-מין, מה שהופך את טכניקת ההשתלה לחזקה יותר, במונחים של תאי הדמיה והתחזיות שלהם, ומבטל כל הטיה פוטנציאלית הקשורה להבדלים בין מינים.
Protocol
1. הכנת מיקרו אזמל עבור אבלציות צינור עצבי
- לעצב מיקרו אזמל ממחט תפירה פלדה זמין מסחרית.
- ראשית לשטח את המחט משני הצדדים באמצעות גלגל שחיקה רכוב על מטחנת ספסל מופעל.
- התחל לעצב את האזמל, תחילה על אבן ארקנסו בדרגה גסה באמצעות תנועה מעגלית מבוקרת, בכיוונים חלופיים, משני צידי המחט.
- המשיכו באותן תנועות חידוד על אבן ארקנסו משובחת במיוחד כדי לעצב מיקרו-אזמל עדין במיוחד, עם חוד החנית המוגדר היטב(איור 1A, B).
הערה: חלופות לאאזמל מיקרו יכול להיות מחטים חידוד אלקטרוליטי, מחטי טונגסטן זמין מסחרית, או משך מחטי זכוכית.
2. דגירה סוג בר וביצים GFP לשלב הרצוי
- לאחסן ביצי עוף מופרות וביצי עוף GFP מהונדסות באינקובטור מקורר ב 14 - 15 מעלות צלזיוס לפני הדגירה כמו הפיתוח נעצר בטמפרטורה זו. לאחסן ביצים במשך כמה ימים, עד שבוע.
- כדי להתחיל בפיתוח, מניחים סוג פראי וביצים GFP על מגש אופקית דגירה בו זמנית לח (58 - 60%) אינקובטור ב 37.5 מעלות צלזיוס, כך העוברים נמצאים בשלבים תואמים עבור השתלת צינור עצבי.
- כדי להשיג עוברים בשלב 10 - 12 סומיט של פיתוח לביצוע השתלת צינור עצבי vagal, ביצי דגירה במשך 1.5 ימים (33 - 38 שעות) ועוברי שלב על פי שולחנות הפיתוח של המבורגר המילטון21.
3. הכנת ביצים לחלון והשתלה
- מעבירים ביצה אחת בכל פעם למחזיק ביצים בהתאמה אישית לחלון. לעשות חור קטן בקליפת הביצה על ידי הקשה חוזרת ונשנית, עם מספריים ישרים, על המשטח העליון של הקצה המחודד של הביצה.
- הסר 2 - 3 מ"ל של אלבומין מהביצה עם מחט 181/2 G hypodermic ו 5 מזרק מיליליטר. הסרת האלבומין מורידה את החלמון בתוך הביצה ומאפשרת חלון לאחר מכן מבלי לגרום נזק לעובר.
- השלך את האלבום. לאטום את החור עם רצועה קטנה של סרט שקוף לחתוך לגודל עם מספריים בסדר.
- באמצעות מספריים מעוגלות, הקש על חור נוסף במשטח העליון של קליפת הביצה. הכנס את קצה המספריים לתוך החור, ולשמור את המספריים במקביל לספסל, לעבוד בתנועה מעגלית לחתוך חלון בקוטר ~ 2 ס"מ על גבי הקליפה.
- שמור את המספריים במצב נייח ולסובב את הביצה. השלך את הדיסק שהוסר של קליפת ביצה. ב E1.5, העובר מזוהה כדיסק צהוב כהה יותר על גבי החלמון.
- הסר את כל פסולת פגז שנפל בתוך הביצה באמצעות פינצטה. השלך את כל הביצים לא מופרות (מזוהה על ידי נקודה לבנה קטנה על גבי חלמון צהוב בהיר אחרת).
4. הכינו את העובר המארח לקבלת רקמה מושתלת
- כוונן את הסטריאו-מיקרוסקופ לגובה העיניים ומטב את הכיוון של מקור אור אווז כדי להאיר כראוי את העובר מבלי לגרום להשתקפויות.
- כדי לדמיין את העובר הנכון, להזריק כמות קטנה של דיו הודי מתחת למרכז הדיסק הצהוב כהה, באמצעות צינור הפה מיקרו פיפטה זכוכית משך(איור 1C, Oii).
- הכן את הדיו 50:50 עם PBS המכיל פניצילין / סטרפטומיצין ב 100 מיקרוגרם / מיליליטר ריכוז סופי. הכנס את המיקרו-פיפטה דרך קרום החלמון מחוץ להיקף של blastoderm ואז בזהירות זווית הקצה שלה ישירות מתחת לעובר.
- לספק דיו מתחת לעובר על ידי נושבת על צינור הפה. אם צינור הפה אינו מותר, השתמש במזרק 1 מ"ל במקום. היזהר לא להציג כל בועות אוויר מתחת לעובר, אשר יכול להוביל לזיהום, ואז להסיר בזהירות את מיקרו פיפטה זכוכית. זהו צעד עדין שיכול להוביל למותו של העובר אם לא נעשה בדייקנות.
- מביים את העובר בהתייחסו להמבורגר והמילטון21 ומתעד את הבמה בספר מעבדה.
- באמצעות מיקרו אזמל בהתאמה אישית (או מחט טונגסטן בסדר) רכוב על מחזיק מחט, לעשות חתך קטן מאוד בקרום vitelline, ליד האזור שבו המיקרו ניתוח יבוצע.
- בזהירות להחיל 2 - 3 טיפות של PBS על קרע הממברנה (באמצעות מיקרו פיפטה זכוכית צינור הפה) כדי ליצור רווח בין העובר לבין הממברנה. חותכים חלון גדול יותר בקרום כדי לחשוף את האזור כולו שבו המיקרו-ניתוח יתקיים.
- הסר את אזור הצינור העצבי של עניין באמצעות אזמל מיקרו, החל חתכים רוחביים rostral ו caudal על פני הצינור העצבי הגבי כולו (ברמה של סומיט 1 עד 7 בסרטון).
- חותכים דו-צדדית בין הצינור העצבי לבין הסומיטים כדי להפריד את הצינור העצבי מהרקמות שמסביב, מבלי לפגוע בסומיטים.
- בעדינות רבה להפריד את הצינור העצבי מן notochord הבסיסית, אשר צריך להישאר שלם. שימו לב כי כריתה מוצלחת של צינור עצבי תשאיר את כל הרקמות שמסביב שלמות לחלוטין (איור 2).
- הסר את הצינור העצבי שנכרת על ידי שאיפתו לתוך מיקרו פיפטה זכוכית, ולאחר מכן להשליך.
- רשום את רמת אבלציה של צינור עצבי בספר מעבדה. העובר המארח מוכן כעת לקבל את הצינור העצבי התורם.
5. הכינו את רקמת השתל התורמת
- בחר עובר GFP עם חלונות התואמים לבמה על-ידי הצגה תחת מיקרוסקופ סטריאו-מיקרוסקופ פלואורסצנטי עם מסנן FITC. פלואורסצנטיות GFP מקלה מאוד לדמיין את הסומיטים ולביים את העובר.
- לאחר שזוהה עובר תואם שלב, הסר את העובר מהביצה על-ידי ביצוע 4 חתכים, עם מספריים אביביים של Pascheff-Wolff (איור 1C, l)בצורת מלבן סביב העובר ולאחר מכן הרים אותו בעדינות עם כף עובר.
- מניחים את העובר בזכוכית שעון מרובעת עם בסיס פולימר sylgard. בעדינות לנער את העובר עם דומונט #5 פינצטה כדי להסיר כל חלמון מצורף. הסר את קרום הויטליין והצמד את העובר לבסיס הפולימר באמצעות סיכות מינוטין אל-חלד(איור 1C).
- באמצעות מספריים האביב, לעשות 4 חתכים בצורה מלבנית סביב הצינור העצבי ואת הסומיטים שמסביב, באותו אזור שהוסר מן העובר המארח.
- באמצעות פיפטה העברת פלסטיק, להעביר את הצינור העצבי ורקמות סומייט מעובר GFP התורם לתוך שעון המכיל 0.2% לבלב בעט / סטרפטוקוקוס PBS.
- אפשר עיכול אנזימטי להמשיך במשך 10 דקות ב RT כדי לעזור להפריד את הרקמות. לאחר הדגירה באנזים, השתמש סיכות מינוטין אל חלד רכוב על ידית כדי להפריד באופן ידני את הצינור העצבי מכל הרקמות הסמוכות.
- באמצעות מיקרו פיפטה זכוכית, להעביר את הצינור העצבי מנותק לזכוכית שעון אחרת המכילה DMEM + 10% סרום(למשל,עז, סוס או עגל עוברי) על קרח, כדי לשטוף את הלבלב עודף ולהפסיק עיכול אנזימטי. לאחר 5 דקות, הצינור העצבי המנותח מוכן להשתלה אורתוטופית למארח הגוזל(איור 2 ו-S1).
6. השתלת הרקמה
- באמצעות מיקרו-פיפטה מזכוכית, העבר בזהירות את הצינור העצבי המנותח מזכוכית השעון לעובר המארח. מקם את הצינור העצבי בכיוון האחורי-אחורי הנכון ולדחוף בעדינות את explant סמוך לאזור מגורש של מארח הגוזל באמצעות המיקרו אזמל. השאירו שבר קטן של אקטודרם מחובר, או על ידי חיתוך חתך קטן פנימה, משטח הגב כדי לזהות את הכיוון של הצינור העצבי.
- במידת הצורך, השתמש במיקרו-אזמל כדי לחתוך את ההסבר לגודל המדויק של האזור שנכרת.
- להנחות בעדינות את הצינור העצבי לתוך האזור ablated ולמקם אותו כך הצד הגבי הוא מוכוון כראוי. השתמש מיקרו פיפטה זכוכית, רכוב על צינור הפה, כדי להסיר PBS ו / או נוזל המקיף את השתל. זה עוזר לתורם ולרקמות המארחות לדבוק והשתל להתבסס.
- לאטום את החלון כולו עם סרט 24 מ"מ רחב ברור כדי למנוע התייבשות וזיהום.
- תייג את העובר הכימרי על ידי סימון בעיפרון על קליפת הביצה ותקליט את מספרו בספר המעבדה. החזירו את הביצה לאינקובטור להמשך פיתוח.
7. להזריק DiI לתוך כלי הדם של עובר מארח
- בנקודת הזמן הניסיונית הרצויה (כאן, 3 - 10 ימים מאוחר יותר), לאחזר את העובר הכימרי מן האינקובטור ולהסיר את הסרט הצלול באמצעות מספריים ישר כדי לקבל גישה לעובר בתוך הביצה.
- במידת הצורך, הגדל את החלון במעטפת באמצעות המספריים. היזהר לא לפגוע בקרום chorioallantoic אם הוא מחובר הקליפה, אשר יגרום לדימום ולסכן את תיוג כלי הדם.
- בחר וריד נגיש על החלמון מוודא שזרימת הדם מופנית כלפי העובר. בחרו נקודת הסתעפות של אחד הורידים הויטליניים (איור 3B, C).
הערה: ב E6.5 - E7.5, קרום chorioallantoic ייתכן שיהיה צורך להזיז בעדינות הצידה עם פינצטה כדי לגשת לוורידים חלמון. לאחר E8.5, האפשרות היחידה היא להזריק לתוך אחד ורידים קרום chorioallantoic מאז, בשלב זה, קרום chorioallantoic מכסה באופן מלא את העובר. - הסר את קרום ויטלין מעל נקודת ההזרקה שנבחרה באמצעות שני פינצטה דומונט #5 על ידי קרע בכיוונים מנוגדים.
- לשבור מחט זכוכית משוך באמצעות דומונט #5 ולהתאים את קוטרו לגודל המשוער של הווריד לפני טעינה עם CellTracker CM-DiI. הפוך את פתרון מלאי DiI ב 40 מיקרוגרם / μl ב DMSO ולאחסן ב -20 מעלות צלזיוס. הכן את פתרון העבודה ב 0.3 M סוכרוז / PBS בריכוז של 4 מיקרוגרם / μl.
- לשאוף בין 5 - 10 μl של DiI ב 0.3 M סוכרוז / PBS לתוך המחט באמצעות יניקה עם צינור הפה. עוברים מבוגרים יותר עשויים לדרוש עד 25 μl או יותר. מ- E8.5, לעוברים יש ורידים גדולים ושריריים יותר, אשר ייתכן שיהיה צורך להחזיק בעמדה עם דומונט #5 לפני דקירה עם מחט זכוכית טעון DiI.
- במהירות להכניס את המחט לתוך הווריד ולפוצץ בהתמדה עם צינור הפה כדי לאפשר DiI להצטרף לזרימת הדם לאט מבלי ליצור קריש. לחלופין, השתמש במזרק לחץ למסירת DiI.
8. קציר עוברים עבור סעיף או בדיקה Wholemount
- כדי לשמור על כמה שיותר DiI בתוך העובר ככל האפשר, לקצור את העובר מיד לאחר ההזרקה על ידי גורף אותו על כף מחוררת חיתוך כלי הדם ורקמות חיבור עם זוג מספריים ישרים, כדי לשחרר את העובר מן החלמון.
- הסר את כל הקרומים רופפים לנתח את האיברים של עניין(כלומר,הריאות ואת מערכת העיכול במדריך זה), מקפיד מאוד לא לדחוס את הרקמה, אשר יוצר דיפוזיה של DiI. מיד לתקן את הרקמות על ידי טבילה 4% PFA עבור 1 - 2 שעות ב RT.
- לשטוף את הרקמה במשך 5 דקות PBS, ולאחר מכן 15 דקות PBS המכיל 5 מיקרוגרם / מיליליטר DAPI. הר את הדגימות על שקופית מיקרוסקופ גישור לבדיקה הר כולו או להטביע אותם עבור קריו-חתך.
תוצאות
איור 1 מראה מכשירים אופייניים הדרושים לביצוע בידוד מיקרו-כירורגי והשתלה של הצינור העצבי. איור 2 מציג את הליך ההשתלה. לאחר ההשתלה עוברים נבדקים להצלחת ההשתלה. זה כרוך בבדיקת העובר תחת מיקרוסקופ פלואורסצנטי סטריאו, בדרך כלל בבוקר שלאחר מיקרוכירורגיה, לנוכחות של שתל נגזר (GFP +) NCC. אם ההשתלה הייתה הצלחה, אז GFP + NCC ניתן לראות בקרבת הצינור העצבי ובמסלולי הגירה מוקדמת המובילים לכיוון המזלג. אם ההליך לא הצליח, GFP + NCC לא יצוין מחוץ לצינור העצבי, או אם הם נמצאים במחשב המארח הם עשויים להיות במספרים קטנים יותר. העוברים הלא מוצלחים האלה מושלכים. בדרך כלל, 5-8 השתלות צינור עצבי מבוצעות ביום אחד, ומתוכם 80% מוצלחים. הסיבות להשתלת צינור עצבי לא מוצלח כוללות מוות של העובר עקב נזק לרקמות שנגרמו במהלך מיקרו-כירורגיה, או כישלון של הצינור העצבי להשתלב בעובר המארח. זה האחרון יכול לנבוע מיקום לקוי של הצינור העצבי בתוך המארח או מצינור עצבי באיכות ירודה עקב טכניקת ניתוח לקויה או מחשיפה מוגזמת לאנזים דיסוציאציה. שלב ההקרנה הראשוני, כמו גם בדיקות מאוחרות דומות עבור תאי GFP + , שימושי כפי שהוא אומר כי זמן ומשאבים אינם מבוזבזים על ידי ביצוע ניסויים על עוברים שאין להם GFP שכותרתו NCC בתוך המעיים.
איור 3 מראה את ההליך להזרקת DiI של כלי הדם. היעילות/ ההצלחה של טכניקת הזרקת DiI תלויה: ראשית, חיתוך מחט ההזרקה לקוטר האופטימלי עבור הווריד הממוקד, השני מחווה מדויקת בעת החדרת המחט לווריד (כך שלא לנקב דרך הצד השני), ושלישית הימנעות המחט מקבל פקוק במהלך ההזרקה על ידי נושבת בקצב קבוע. אם אחד משלושת הפרמטרים האלה נעשה באופן שגוי, העובר ידמם למוות או יצטרך כמה שעות כדי להתאושש לפני ניסיון שני נעשה כמו הדימום עושה את זה כמעט בלתי אפשרי להזריק מחדש מיד. עוברים מוצלחים צריכים להיבחר באופן מיידי על ידי צפייה תחת מיקרוסקופ stereofluorescence ויש לנתח במהירות. בעוברים מוצלחים, כלי דם המסומנים ב-DiI נמצאים בכל העובר (איור 3C,D)כולל מיטות נימי(איור 3D).
עם קצירת עוברים ובדיקת מקטעי רקמות או מערכת העיכול כולה, תוצאות אופייניות חושפות את GFP+ NCC בתוך ה- ENS הפרימיטיבי ואת המבנה העדין של רשתות כלי הדם במעיים המסומנים ב- DiI (איור 4) ניתן לבחון תכשירים שלמים באמצעות מיקרוסקופיה קונפוקלית לפיה ערימות תמונה מייצרות שחזורים תלת מימדיים (3D) המראים את יחסי הגומלין בין התחזיות העדינות של תאי GFP + ENS לבין מערכת כלי הדם המוכתמת ב- DiI (איור 4 A-C; ג'י-איי. סרטונים 1 ו-2.

איור 1. מכשירי מיקרוכירורגיה מומלצים. (א) מיקרו אזמל בצורת מחט תפירה. (B) אבן ארקנסו משובחת לעיצוב אזמל מיקרו. (C) a) מספריים ישרים, ב) מספריים מעוגלות, ג) 5 מזרק מיליליטר עם 181/2 G מחט hypodermic, ד) פיפטה פלסטיק, ה) מחזיק ביצה בהתאמה אישית, ו) דיו שחור, ז) זכוכית שעון מרובע, ח) זכוכית שעון מרובע עם בסיס sylgard שחור, i) מיקרו אזמל על מחזיק מחט, j) סיכות minutien, k) minutien או מחט טונגסטן על מחזיק מחט, l) Pascheff-וולף מספריים האביב, m) Dumont #5 פינצטה, n) כפית מחוררת, אוי) קצר אש משך מחט העברה, oii) ארוך אש משך מחט בדיו, p) לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
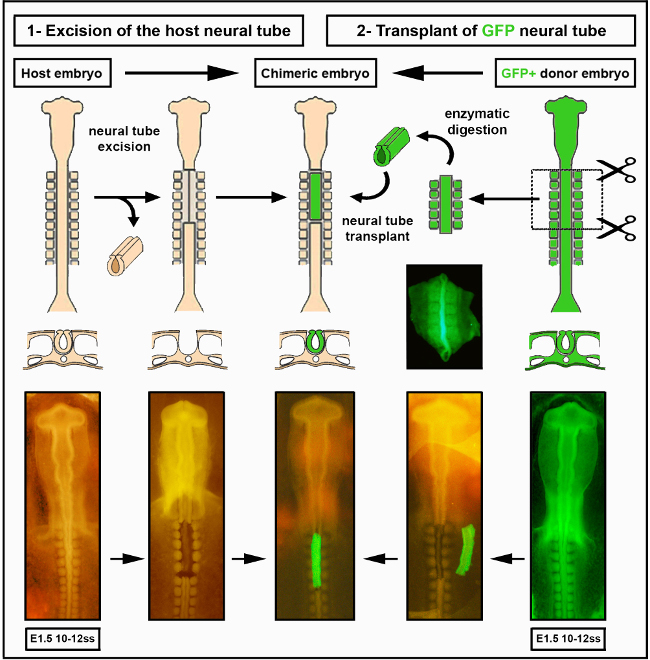
איור 2. השתלת צינור עצבי תוך-מיני. תמונות הצינור העצבי של צ'יק עובר /GFP שונו מדללנד ואח '. 12. כלי דם אינו הכרחי עבור קולוניזציה במעיים על ידי תאי ציצה עצבית אנטרית. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
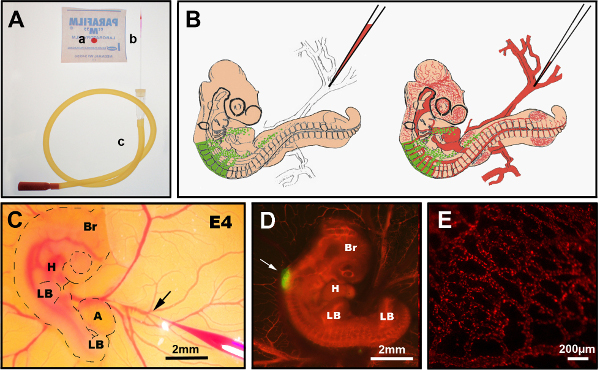
איור 3. הזרקת DiI תוך ורידי. (א) מכשירים מומלצים: א) CellTracker CM-DiI טיפה על parafilm, ב) משך מחט הזרקת זכוכית, ג) צינור הפה. (B) דיאגרמה סכמטית של הזרקת DiI תוך ורידי לעובר אפרוח כימרי E4. (ג) בהזרקה תוך ורידית ovo DiI מראה מחט זכוכית עדינה המכילה DiI מוכנס לתוך הווריד (חץ). (ד) E4 עובר כימרי פוסט הזרקת DiI (אדום) עם צינור עצבי GFP + (חץ). (ה) רשת כלי דם עדינה מוכתמת DiI בעובר חי, 24 שעות לאחר ההזרקה. Br: מוח; H: לב; LB: ניצן גפיים; ת: אלנטויס. תמונות ב- (C) ו- (D) שונו מ- Delalande et al. 12 ,12 כלי דם אינו הכרחי עבור קולוניזציה במעיים על ידי תאי ציצה עצבית אנטרית. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
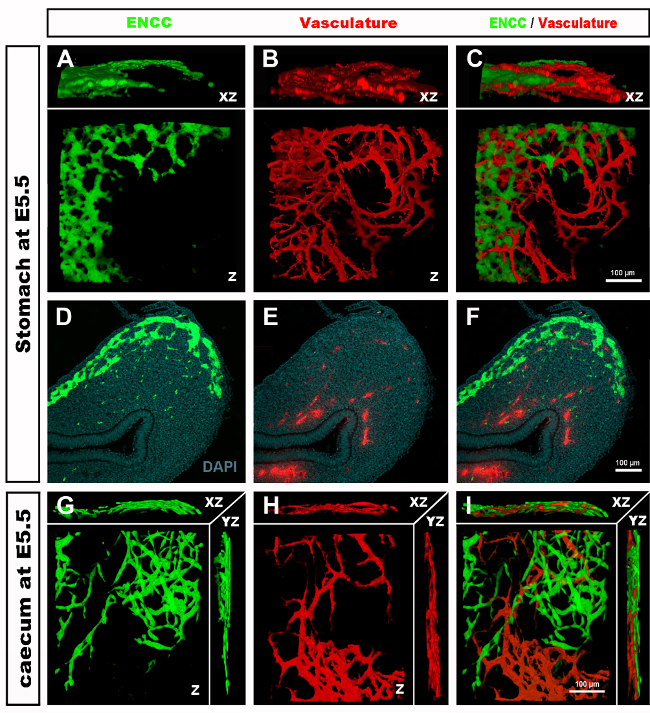
איור 4: תוצאות מייצגות בקיבה ובקיבה של עובר אפרוח E5.5. (A-C) אני לא יכול לעשות את זה. שחזור תלת מימדי (3D) של מחסנית תמונה קונפוקלית באזור הקיבה המציגה (D) את תאי הסמל העצבי האנקטי GFP + (ENCC) (E) מערכת כלי הדם המוכתמת ב- DiI ו- (F) תמונה ממוזגת של שתי הרשתות מקטעים היסטולוגיים D-F ברמת הבטן מראה (G) GFP + ENCC (H) מערכת כלי הדם מוכתם DiI ו (I) תמונה ממוזגת של שתי הרשתות. גרעינים מוכתמים ב- DAPI (ציאן). (G-H) שחזור תלת-ממדי של מחסנית תמונות קונפוקלית באזור caecum המציג (A) את חזית ההעברה GFP+ ENCC בירוק, (B) את מערכת כלי הדם המוכתמת ב- DiI באדום, ו- (C) תמונה ממוזגת של שתי הרשתות. תמונות (A-F) שונו מ Delalande ואח '. 12 ,12 כלי דם אינו הכרחי עבור קולוניזציה במעיים על ידי תאי ציצה עצבית אנטרית. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
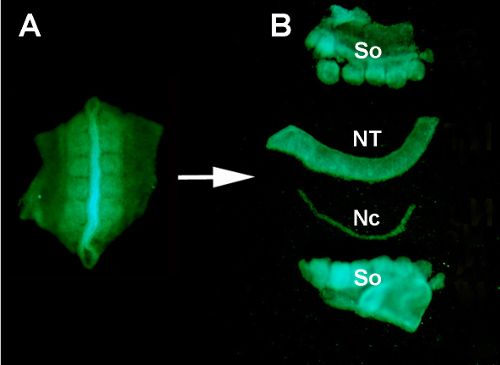
איור S1. בידוד של צינור עצבי GFP+ תורם מהרקמות שמסביב על ידי עיכול אנזימטי ומיקרו-ניתוח. (א) צינור עצבי GFP+ וסומיטים סמוכים נותחו מהעובר התורם. (ב) צינור עצבי מבודד לאחר עיכול הלבלב ומיקרו-ניתוח באמצעות סיכות מינוטין אל-חלד. אז: סומיטי; NT: צינור עצבי; נ.נ: נוטוקורד.
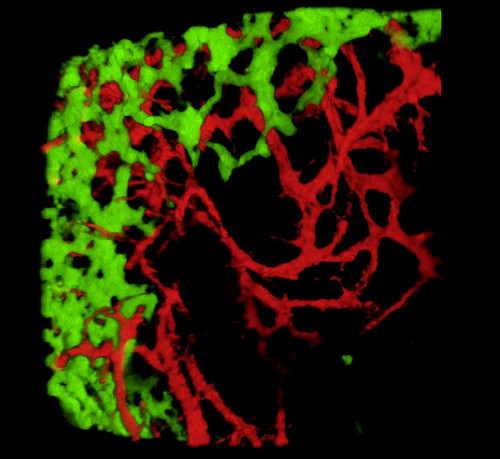
סיבוב תלת מימדי 1. 360° של התמונה באיור 4C, המציג את מערכת כלי הדם ואת ENCC בבטן ב- E5.5 (HH27-28). אנא לחץ כאן כדי לצפות בסרטון וידאו זה.
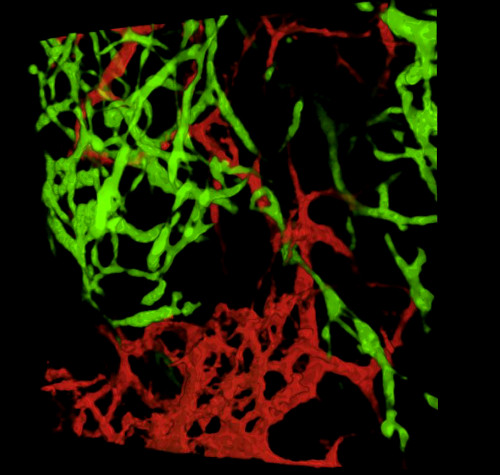
סיבוב תלת מימדי 360° של התמונה באיור 4I, המציג את מערכת כלי הדם ואת חזית ההעברה של ENCC באזור ה- caecum ב- E5.5 (HH27-28). אנא לחץ כאן כדי לצפות בסרטון וידאו זה.
Discussion
השיטה של השתלת צינור עצבי intraspecies, בשילוב עם תיוג כלי דם המתוארים כאן, מנצלת במלואה את קלות הגישה של עובר העופות בתוך הביצית (בהשוואה לעוברים אחרים של בעלי חוליות) כדי לחקור את ההתפתחות המשותפת של אלמנט של מערכת העצבים האוטונומית (ENS) ומערכת כלי הדם.
עבור תיוג נגזרות NCC, שיטת השתלת אפרוחיםGFP-אפרוחים פנים-מין שאנו מתארים יש מספר יתרונות על פני שיטת כימרה קלאסית שליו אפרוח שהוקם לפני למעלה מ -40 שנה1-3. ראשית, תחת אור FITC, פלואורסצנטיות GFP היא בהירה ביותר, במידה שתאי GFP+ ניתנים להבחנה בקלות בעוברים כימריים חיים. זה מאפשר את ההצלחה של השתל להיבדק ovo, ואילו השתלת אפרוחי שליו דורש העובר להיהרג, מעובד immunostained באמצעות QCPN, לפני ההצלחה של השתל ניתן לברר2. שנית, ביטוי GFPב- GFP אפרוח מהונדס הוא ציטופלסמי, ולכן זה לא רק מתייג גופי תאים, אלא גם מאפשר את ההקרנות של התאים המושתלים להיות דמיינו22. זה מאפשר רשתות עצביות מורכבות להיות שנצפו ברזולוציה גבוהה (שים לב כי תחזיות עדינות הם דמיינו בצורה הטובה ביותר כאשר המדגם הוא immunostained עם נוגדן נגד GFP). כמו תיוג QCPN מוגבל גרעין התא שליו, רשתות כאלה אינם נחשפים באמצעות כימרות שליו-חומוס. שלישית, השתלת intraspecies מבטלת את כל ההבדלים המינים הפוטנציאליים בין תאים בתוך העובר הכימרי. מאז עוברי שליו יש תקופת דגירה קצרה יותר מאשר אפרוח (19 ימים לעומת 21 ימים) הוצע כי תאים שליו יש שיעור התפשטות גבוה יותר מאשר תאי אפרוח, אשר עלול להשפיע על התפתחות הרקמות הכימריות23. מעניין גם, הוכח בצמחים כי השתלת interspecies יכול לייצר שינויים נרחבים בדפוסי מתילציה DNA המארח 24. רביעית,אפרוח GFP מקל על ניסויים השתלת גב כדי לטפל בנושאים כגון גורל NCC ומחויבות התא25. החמישית,GFP אפרוח מהונדס שימושי גם עבור טכניקות רבות אחרות, כולל מיון FACS של תת-אוכלוסייה של תא GFP + , תרבות organotypic של איברים המכילים GFP + תאים, מניפולציה גנטית של GFP + רקמה מושתלת באמצעות electroporation של פלסמידים ביטוי26, וטכנולוגיות הדמיה אחרות כגון טומוגרפיה הקרנהאופטית 27.
ניתן לשנות את גישת השתלת הצינור העצבי על ידי החלפה מיקרוכירורגית של כמויות קצרות יותר של צינור עצבי. על ידי שימוש במקטעים קטנים יותר של צינור עצבי המיקרוכירורגיה עלולה להיות פחות מזיקה לעובר וניתן לשפר את ההישרדות. עם זאת, החיסרון של השתלת צינור עצבי פחות הוא כי המספרים של GFP + NCC במארח יופחת. משתמשים יכולים לנסות ולהשיג איזון בין כמות הצינור העצבי מושתל לתת הישרדות אופטימלית של עוברים, ואת המספרים של GFP + NCC בתוך המעי המארח מספיק כדי לתת תוצאות אינפורמטיביות.
עבור ציור כלי שיט, ל- DiI יש את היתרון שהפלואורסצנטיות שלו בהירה וחזקה מאוד. כמו כן, יש לו את היכולת להתפזר במהלך קיבעון הבטחת כתמים של נימים פתוחים הטובים ביותר. מכיוון שמדובר בצבע חיוני, עוברים יכולים לשרוד את הליך ההזרקה ולהמשיך להתפתח עם מערכת כלי דם מוכתמת (עד 24 שעות בידיים שלנו, אם כי הכתם הופך להיות יותר נוקב לאורך זמן, ראה איור 3E). השילוב של השתלתGFP אפרוח עם ציור כלי דם DiI ולכן תואם הדמיה חיה. מלבד כל היתרונות הללו, חשוב לציין כי הזרקת כלי דם רק מתייגת כלי זוהר ולכן אינה מזהה נימים שלא נפתחו, תאי קצה אנדותל או תאי אנדותל מבודדים. עם זאת, התקדמות נוספת transgenesis העופות יכול לספק דרכים חדשות לעקוף נושאים כאלה, כפי שמדגים ניסויים באמצעות Tg(עניבה1:H2B-eYFP) שליו עוברים ללמוד מורפוגנזה כלידם 28. מגבלה נוספת של טכניקה זו היא, עבור תיוג כלי יעיל בעוברים ב E7.5 ומעבר, כמויות גדולות יותר של צבע צריך להיות מוזרק, אשר יכול להפוך ניסויים יקרים. עם זאת, שינוי של הטכניקה יכול לכלול עלות נמוכה כלי דם תיוג סימון דיו14, אם כי גישה זו לא נוסתה בידיים שלנו.
שלבים קריטיים של ההליכים כוללים את תהליך הדמיית העובר על ידי הזרקת דיו מתחת לבצק. אם הממברנה המכסה את החלמון נקרעת על ידי המחט המלאה בדיו בשלב זה אז הישרדות העובר נפגעת קשות. כמו כן, חשוב, בעת הכנת צינור עצבי תורם, כי הרקמה לא נשאר במשך זמן רב מדי בלבלב (לשקול כ 10 דקות כמקסימום). חשיפה ממושכת ללבלב פוגעת ברקמה והצינור העצבי קשה לאחר מכן לטפל בו והוא לא ישלב היטב במארח. צובר ניסיון של טכניקת הזרקת DiI על עוברים מסוג בר הוא חיוני לפני הזרקת עוברים כימריים, כמו רק ניסיון אחד בהזרקה אפשרי בדרך כלל עבור כל עובר. נפח DII וקוטר מחט הם פרמטרים קריטיים עבור כל עובר ויש להעריך על סוג פראי, פקדים תואמי שלב.
לסיכום, שיטת התיוג הכפולה שלנו של השתלת צינור עצבי וציור כלי DiI בעוברים של אפרוחים חיים יכולה לשמש כדי לחקור את היחסים ההדדיים בין רשתות NCC וכלי דם במהלך organogenesis. בהתחשב במנגנונים האחראים על ביסוס היעד הנכון innervation ו vascularization במהלך פיתוח איברים עדיין ידועים במידה רבה, מתודולוגיה זו מחזיקה פוטנציאל תגליות עתידיות בתחום זה.
Disclosures
המחברים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
ביצי עוף מופרות של GFP סופקו על ידי פרופ' הלן סאנג, מכון רוזלין ואוניברסיטת אדינבורו, בריטניה. מתקן העוף הטרנסגני רוזלין ממומן על ידי קרן Wellcome ועל ידי המועצה לחקר הביוטכנולוגיה והמדעים הביולוגיים (BBSRC). העבודה מומנה בחלקה, ו- NT נתמך על ידי בית החולים גרייט אורמונד סטריט צדקה לילדים, לונדון, בריטניה. המחברים מודים לבן יוונס, מכון UCL לבריאות הילד, על העזרה בהכנת עוברים להשתלה.
Materials
| Name | Company | Catalog Number | Comments |
| Fertilised chick eggs | Henry Stewart and Co, Louth, UK | ||
| Fertilised GFP chick eggs | The Transgenic Chicken Facility, The Roslin Institute, The University of Edinburgh | ||
| Egg incubator (Profi-H Hatcher) | Lyon Technologies, CA, USA | 910-033 | |
| 14C Incubator | Precision Cooled Incubator, Leec Ltd., Nottingham, UK | Model LT2 | |
| Stereo-microscope | LEICA | Model MZ 12.5 | |
| Digital Camera | LEICA | DC500 | |
| Image acquisition software | LEICA | IM50 | |
| Goose neck halogen cold light source | Advanced Imaging Concepts, Inc | KL 1500 LCD | |
| 181⁄2 G hypodermic needle | SIGMA - ALDRICH | HSWNH181 | |
| Pancreatin | SIGMA - ALDRICH | P3292 | |
| DMEM | SIGMA - ALDRICH | D5030 | |
| Goat serum | SIGMA - ALDRICH | G6767 | |
| 5 ml syringe | SIGMA - ALDRICH | Z248010 | |
| Mouth tube | SIGMA - ALDRICH | A5177 | |
| Sigma Pasteur pipettes non-plugged, L 5 3/4 in. | SIGMA - ALDRICH | S6018 | |
| Transfer pipettes, polyethylene | SIGMA - ALDRICH | Z350796 | |
| Borosillicate glass capillaries, thin wall without filament | Harvard apparatus | PY8 30-0035 | |
| Iris Scissors - ToughCut | Fine Science Tools | 14058-09 | |
| Curved Iris Scissors - ToughCut | Fine Science Tools | 14059-09 | |
| Needle holders (Nickel-plated pin holder) | Fine Science Tools | 26018-17 | |
| Pascheff-Wolff Spring Scissors | Fine Science Tools | 15371-92 | |
| Dumont #5 forceps | Fine Science Tools | 11251-30 | |
| Minutien pins | Fine Science Tools | 26002-15 | |
| Dumont AA forceps, Inox Epoxy- coated | Fine Science Tools | 11210-10 | |
| Perforated spoon | Fine Science Tools | 10370-18 | |
| Tungsten needles (0.125mm diameter) | Fine Science Tools | 10130-05 | |
| Sellotape (clear, 24 mm width) | Any Supplier | ||
| Pen/Strep (Penicillin, Streptomycin) Solution | VWR international | 101447-068 | |
| Sylgard 184 silicone elastomer kit | Dow Corning | S09 512 516 | |
| Pelikan black ink | Pelikan | 211-169 | |
| CellTracker CM-DiI | Molecular Probes | C-7001 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Molecular Probes | D1306 | |
| Settings for glass needle puller | Sutter Instruments | Flaming/Brown micropipette puller model P-86 | |
| Heat 950; Pull 150; Velocity 100; Time 200; Pressure 500 |
References
- Le Douarin, N. A biological cell labeling technique and its use in expermental embryology. Developmental Biology. 30, 217-222 (1973).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods in Molecular Biology. 461, 337-350 (2008).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods in Molecular Biology. 97, 305-318 (1999).
- Garcia-Castro, M., Bronner-Fraser, M. Induction and differentiation of the neural crest. Current Opinion In. Cell Biology. 11, 695-698 (1999).
- Bhatt, S., Diaz, R., Trainor, P. A. Signals and switches in Mammalian neural crest cell differentiation. Cold Spring Harbor Perspectives In Biology. 5, (2013).
- Burns, A. J., Douarin, N. M. The sacral neural crest contributes neurons and glia to the post-umbilical gut: spatiotemporal analysis of the development of the enteric nervous system. Development. 125, 4335-4347 (1998).
- Burns, A. J., Le Douarin, N. M. Enteric nervous system development: analysis of the selective developmental potentialities of vagal and sacral neural crest cells using quail-chick chimeras. The Anatomical Record. 262, 16-28 (2001).
- Burns, A. J., Delalande, J. M., Le Douarin, N. M. In ovo transplantation of enteric nervous system precursors from vagal to sacral neural crest results in extensive hindgut colonisation. Development. 129, 2785-2796 (2002).
- Burns, A. J., Champeval, D., Le Douarin, N. M. Sacral neural crest cells colonise aganglionic hindgut in vivo but fail to compensate for lack of enteric ganglia. Developmental Biology. 219, 30-43 (1006).
- Wang, X., Chan, A. K., Sham, M. H., Burns, A. J., Chan, W. Y. Analysis of the sacral neural crest cell contribution to the hindgut enteric nervous system in the mouse embryo. Gastroenterology. 141, 992-1002 (2011).
- Goldstein, A. M., Hofstra, R. M., Burns, A. J. Building a brain in the gut: development of the enteric nervous system. Clinical Genetics. 83, 307-316 (1111).
- Delalande, J. M., et al. Vascularisation is not necessary for gut colonisation by enteric neural crest cells. Developmental Biology. 385, 220-229 (2014).
- Anderson, R. B., Stewart, A. L., Young, H. M. Phenotypes of neural-crest-derived cells in vagal and sacral pathways. Cell And Tissue Research. 323, 11-25 (2006).
- Takase, Y., Tadokoro, R., Takahashi, Y. Low cost labeling with highlighter ink efficiently visualizes developing blood vessels in avian and mouse embryos. Development, Growth & Differentiation. 55, 792-801 (2013).
- Bates, D., Taylor, G. I., Newgreen, D. F. The pattern of neurovascular development in the forelimb of the quail embryo. Developmental Biology. 249, 300-320 (2002).
- Mayes, P., Dicker, D., Liu, Y., El-Deiry, W. Noninvasive vascular imaging in fluorescent tumors using multispectral unmixing. BioTechniques. 45, 459-460 (2008).
- Li, Y., et al. Direct labeling and visualization of blood vessels with lipophilic carbocyanine dye DiI. Nature Protocols. 3, 1703-1708 (2008).
- Eichmann, A., Thomas, J. L. Molecular parallels between neural and vascular development. Cold Spring Harbor Perspectives In Medicine. 3, a006551 (2013).
- Weinstein, B. M. Vessels and nerves: marching to the same tune. Cell. 120, 299-302 (2005).
- Carmeliet, P., Tessier-Lavigne, M. Common mechanisms of nerve and blood vessel wiring. Nature. 436, 193-200 (2005).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88, 49-92 (1951).
- Barraud, P., et al. Neural crest origin of olfactory ensheathing glia. Proceedings of the National Academy of Sciences of the United States of America. 107, 21040-21045 (2010).
- Senut, M. C., Alvarado-Mallart, R. M. Cytodifferentiation of quail tectal primordium transplanted homotopically into the chick embryo. Brain Research. 429, 187-205 (1987).
- Wu, R., et al. Inter-species grafting caused extensive and heritable alterations of DNA methylation in Solanaceae plants. PLoS One. 8, e61995 (2013).
- Freem, L. J., Delalande, J. M., Campbell, A. M., Thapar, N., Burns, A. J. Lack of organ specific commitment of vagal neural crest cell derivatives as shown by back-transplantation of GFP chicken tissues. The International Journal Of Developmental Biology. 56, 245-254 (2012).
- Delalande, J. M., et al. The receptor tyrosine kinase RET regulates hindgut colonization by sacral neural crest cells. Developmental Biology. 313, 279-292 (2008).
- Freem, L. J., et al. The intrinsic innervation of the lung is derived from neural crest cells as shown by optical projection tomography in Wnt1-Cre;YFP reporter mice. Journal of Anatomy. 217, 651-664 (2010).
- Sato, Y., et al. Dynamic analysis of vascular morphogenesis using transgenic quail embryos. PloS One. 5, e12674 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved