Method Article
使用小鸡GFP 神经管移植和碳水化合物染料 DiI 注射,在鸡胚胎内对神经囊细胞和血管进行双重标记
摘要
在这里,我们报告神经波峰细胞和血管的双重标签使用小鸡GFP 神经管内部嫁接结合血管内DII注射。这种实验技术使我们能够同时在器官发生期间可视化和研究NCC衍生(肠)神经系统和血管系统的发展。
摘要
所有发育中的器官都需要连接到神经系统(用于感觉和运动控制)以及血管系统(用于气体交换、液体和营养供应)。因此,神经系统和血管系统相互发展,并在其分支结构中有着惊人的相似性。在这里,我们报告胚胎操作,使我们能够研究神经波峰衍生神经组织(在这种情况下,肠神经系统)和血管系统的同时发展。这是 通过 移植神经管的离散部分和相关的神经峰,结合血管DII注射在同一胚胎实现的。我们的方法使用转基因小鸡GFP 胚胎进行物种内部移植,使移植技术比自20世纪70年代以来使用的经典小鸡间移植协议更加强大。小鸡GFP- 鸡种内嫁接有助于移植细胞的成像及其在完整组织中的投影,并消除与物种差异相关的细胞发育中的任何潜在偏差。该方法充分利用鸟类胚胎(与其他脊椎动物胚胎相比)的易于获取,研究肠道神经系统和血管系统的共同发展。
引言
鸡胚胎是脊椎动物发育生物学中一种宝贵的模型生物体,尤其是因为它 在卵母体内 的发育允许实验操作,否则在 子宫内发育的脊椎动物中是不可能执行的。这种可访问性和易于操作性导致小鸡胚胎在发育生物学领域的许多开创性发现中扮演关键角色。其中最强大的技术是利用小鸡的奇美胚胎来研究细胞命运,这是妮可·勒杜阿林教授在20世纪70年代的1-3年开创的方法。特别是,在早期发育期间,小鸡奇美拉在基因标记和跟随高度迁移神经峰细胞(NCC)种群方面特别有用。NCC是一种多能的迁移细胞群,生长在神经管边缘的后部细胞群中,在整个脊椎动物胚胎中产生多种细胞类型。这些结构包括颅面结构(软骨、骨骼、肌肉)、神经元和胶质(在感官和自主神经系统中)、黑色素细胞,以及内分泌系统2,4,5细胞的亚群。影响NCC命运的最重要因素之一是它们沿着神经管前后轴的初始位置。例如,产生肠神经系统(ENS)神经元和胶质的肠道NCC来自两个离散的亚种群:第一个位于虚无(caudal后脑)区域,第二个位于神经管6-13的囊性区域。神经管相应区域的物种间嫁接是永久标记这些细胞并随后允许跟踪这些细胞的技术,从它们诞生于神经管的边缘,到消化道6,7,10内的最终目的地。
与其他动物模型相比,另一种胚胎操作更容易在小鸡体内进行,是血管系统的重要标签。事实上,随着小鸡胚胎的发育,它位于一个胚胎外血管网络之上,该血管网络从蛋黄中循环氧气和营养物质。这个无障碍血管网络,位于蛋黄表面,可以用作在器官发生12,14-17期间标记胚胎发育血管系统的网关。各种染料(如嗜脂染料 DiI)的血管内注射,使描述/染色新生血管网络的所有发光血管成为可能。
由于发育器官需要连接到神经系统(用于感觉和运动控制)以及血管系统(用于气体交换、液体和营养供应),因此两个网络相互发展,并在其分支结构18-20中具有惊人的相似性。在这里,我们报告胚胎操作,使我们能够研究同时开发NCC衍生的ENS,以及血管系统,在器官形成期间。这是通过移植神经管的离散部分(包括神经峰)以及血管DiI注射来产生鸡幻想。作为从鹅鸡奇美拉的进展,我们的方法使用转基因GFP小鸡胚胎进行物种内部移植,使移植技术在成像细胞及其投影方面更加强大,并消除与物种差异相关的任何潜在偏差。
研究方案
1. 神经管消融的微刀制备
- 用市售的钢缝纫针塑造微型刀具。
- 首先使用安装在电动台式磨床上的研磨轮将针头两侧夷为平地。
- 开始塑造手术刀,首先在粗级阿肯色州石头上使用控制的圆形运动,在针的两侧,在交替的方向。
- 在额外的精细级阿肯色州石头上进行相同的锐化运动,以塑造一个超精细的微型刀片,具有明确定义的尖端(图1A,B)。
注:微型刀片的替代品可以是电镀金针、市售钨针或拉玻璃针。
2. 将野生类型和 GFP 鸡蛋孵化到所需的阶段
- 在孵化前,在冷却的孵化器中储存受精鸡蛋和转基因 GFP 鸡蛋,因为在此温度下发育已停止。储存鸡蛋几天,最多一周。
- 要开始开发,将野生类型和 GFP 鸡蛋水平放置在托盘上,同时在潮湿的(58 - 60%) 中孵化孵化器在37.5°C,使胚胎处于匹配阶段的神经管移植。
- 为了在10-12个卵子发育阶段获得胚胎进行阴道神经管移植,孵卵1.5天(33-38小时),并根据汉堡和汉密尔顿21的发展表阶段胚胎。
3. 准备鸡蛋用于窗口和移植
- 一次移动一个鸡蛋到定制鸡蛋架上进行窗口。用直剪刀反复敲击蛋壳上的一个小孔,在蛋尖端的上表面。
- 用181~2克皮下针和5毫升注射器从鸡蛋中取出2-3毫升白蛋白。去除白蛋白可降低卵子内的蛋黄,并有助于随后的窗口,而不会对胚胎造成任何损害。
- 丢弃白蛋白。用一小条透明胶带密封孔,用细剪刀切成大小。
- 使用弯曲的剪刀,在蛋壳的上表面再挖一个洞。将剪刀尖插入孔中,使剪刀与长凳平行,以圆形运动将直径约 2 厘米的窗户切入外壳顶部。
- 将剪刀保持静止位置,旋转鸡蛋。丢弃被移除的蛋壳盘。在E1.5,胚胎可以识别为蛋黄顶部的深黄色圆盘。
- 使用钳子清除掉在鸡蛋内的任何贝壳碎片。丢弃任何未受精的卵子(由浅黄色蛋黄顶部的一个小白点识别)。
4. 准备主机胚胎接受移植组织
- 将立体显微镜调整到眼睛水平,优化牙周光源的方向,在不引起反射的情况下充分照亮胚胎。
- 为了使胚胎 正常可视化,使用口管和拉玻璃微管(图1C,Oii)在较深的黄色圆盘中心下注入少量印度墨水。
- 准备墨水 50:50 与 PBS 含有青霉素/链霉素在 100 μg/ml 最终浓度。将微移液通过蛋黄膜插入胚胎外围,然后小心地将其尖端直接角在胚胎下面。
- 通过吹在口腔管上,在胚胎下面输送墨水。如果不允许口腔管管,请改为使用 1 毫升注射器。小心不要在胚胎下面引入任何可能导致污染的气泡,然后小心地取出玻璃微管。这是一个微妙的步骤,如果不精确完成,可能导致胚胎死亡。
- 参照汉堡和汉密尔顿21 来分阶段胚胎,并在实验室书籍中记录该阶段。
- 使用安装在针架上的定制微型刀片(或细钨针),在进行微手术的区域旁边的维特尔线膜中制作一个非常小的气喘。
- 小心地将2 -3滴PBS涂在膜撕裂上(使用玻璃微移液器和口腔管),在胚胎和膜之间创造空间。在膜中切下一个更大的窗口,以暴露将进行微手术的整个区域。
- 使用微型脚轮去除感兴趣的神经管区域,从整个后部神经管的横穿孔和剖面切口开始(在视频中为 somite 1 到 7 的水平)。
- 在神经管和索米之间进行双边切割,将神经管与周围组织分离,而不会损坏索米特。
- 非常轻轻地将神经管与底层的神经管分开,后者应保持完好无损。请注意,成功的神经管切除将保持所有周围的组织完好无损(图2)。
- 将切除的神经管吸进玻璃微管中,然后丢弃。
- 在实验室书中记录神经管消融水平。宿主胚胎现在准备接受供体神经管。
5. 准备捐赠移植组织
- 通过使用 FITC 滤镜在荧光立体显微镜下观看,选择经过窗口的舞台匹配的 GFP 胚胎。GFP荧光使得它很容易想象烟体和阶段的胚胎。
- 一旦确定了一个相匹配的胚胎,通过做4个切口从卵子中取出胚胎,用帕舍夫-沃尔夫弹簧剪刀(图1C,l)在胚胎周围的矩形形状,然后用胚胎勺轻轻拾起它。
- 将胚胎放在带硅藻聚合物底座的方形表玻璃中。用杜蒙#5钳子轻轻摇动胚胎,去除任何附着的蛋黄。取出维他林膜,用不锈钢细针(图1C)将胚胎固定在聚合物底座上。
- 使用弹簧剪刀,在神经管和周围索米特周围以矩形形状切开4个切口,位于从宿主胚胎中取出的相同区域。
- 使用塑料转移移液器,将神经管和松虫组织从供体GFP胚胎转移到含有0.2%胰腺素的手表玻璃中。
- 允许酶消化在RT进行10分钟,以帮助分离组织。在酶中孵育后,使用安装在手柄上的不锈钢小针手动将神经管与所有相邻组织分离。
- 使用玻璃微管,将分离的神经管转移到另一个手表玻璃中,其中含有10%的血清(如山羊、马或胎儿小腿),以冲洗多余的胰腺素并停止酶消化。5分钟后,解剖的神经管准备移植到小鸡主机(图2和S1)。
6. 移植组织
- 使用玻璃微管,小心地将解剖的神经管从表玻璃转移到主机胚胎。将神经管置于正确的前后方向,并使用微型刀块轻轻推送与小鸡宿主切除区域相邻的外植。将一小块等体附着在后部表面,或切入一个小刻痕,以识别神经管的方向。
- 如有必要,使用微型刀刀将去除的植物修剪到被切除区域的确切大小。
- 轻轻地引导神经管进入消融区域,并定位它,使后侧正确定向。使用安装在口腔管上的玻璃微移液器去除移植物周围的 PBS 和/或液体。这有助于捐赠者和宿主组织坚持和移植成为建立。
- 用24毫米宽的透明胶带密封整个窗户,以防止脱水和污染。
- 用铅笔在蛋壳上标记,并在实验室书上记录其数量,从而给幻想胚胎贴上标签。将鸡蛋返回孵化器以进一步发展。
7. 将DiI注射到宿主胚胎的血管中
- 在所需的实验时间点(这里,3 - 10天后),从孵化器中取出幻想胚胎,然后用直剪刀取出透明胶带,以进入卵子内的胚胎。
- 如有必要,使用剪刀放大外壳中的窗口。小心不要损坏胆囊膜,如果它连接到壳,这将导致出血和危及血管标签。
- 在蛋黄上选择一个可访问的静脉,确保血液流向胚胎。选择其中一个脉脉的分支点(图3B,C)。
注:在 E6.5 - E7.5 时,可能需要用钳子轻轻将胆囊膜移到一边才能进入蛋黄静脉。E8.5之后,唯一的选择是注射到胆囊膜静脉之一,因为,在这个阶段,胆囊膜完全覆盖胚胎。 - 使用两个杜蒙#5钳子在选定的注射点上方取出维特尔线膜,向相反的方向撕裂。
- 使用 Dumont #5打破拉玻璃针,并在加载 CellTracker CM-DiI 之前将其直径调整到静脉的大致大小。在 DMSO 中以 40μg/μl 的速度制作 DiI 库存解决方案,并存储在 -20 °C。 以浓度为 4μg/μl 的 0.3 M 蔗糖/PBS 准备工作解决方案。
- 使用口管吸吸,在 0.3 M 蔗糖/PBS 中吸入 5 - 10 μl 的 DiI。较老的胚胎可能需要高达25微升或更多。从E8.5开始,胚胎有更大、更肌肉的静脉,可能需要用杜蒙#5保持位置,然后用装有DiI的玻璃针刺住。
- 迅速将针头插入静脉,用口管稳定地吹,使 DiI 能够缓慢地加入血液流动,而不会形成血块。或者,使用压力喷油器进行 DiI 交付。
8. 分段或全山检查的收获胚胎
- 为了在胚胎内保留尽可能多的DiI,注射后立即收获胚胎,将其铲入穿孔的勺子上,用一把直剪刀切割血管和结缔组织,将胚胎从蛋黄中解放出来。
- 取出任何松散的膜,解剖出感兴趣的器官(即本教程中的肺和消化道),非常小心不要压缩组织,这会产生DiI的扩散。立即修复组织浸入4%PFA 1-2小时在RT。
- 在 PBS 中冲洗组织 5 分钟,然后在含有 5μg/ml DAPI 的 PBS 中冲洗 15 分钟。将样品安装在桥接显微镜滑梯上进行整个安装检查或嵌入样本进行低温剖面。
结果
图1 显示了进行神经管显微外科隔离和移植所需的典型仪器。 图2 显示移植过程。移植胚胎移植后,将进行筛查,以获得移植成功。这涉及到在立体荧光显微镜下检查胚胎,通常是在显微外科后的第二天早上,是否存在移植衍生的 NCC。如果移植成功,那么GFP®NCC可以在神经管附近和通往前体的早期迁移路径中观察到。如果手术没有成功,GFP®NCC将不会在神经管外观察到,或者如果它们存在于主机中,它们的数量可能较小。这些不成功的胚胎被丢弃。通常,5-8个神经管移植在一天内进行,其中80%是成功的。神经管移植失败的原因包括胚胎在显微外科期间因组织损伤而死亡,或神经管无法融入宿主胚胎。后者可能是由于神经管在宿主体内的放置不良或由于解剖技术差或过度接触分离酶而导致的神经管质量差。最初的筛选步骤,以及GFP®细胞的类似后期检查,是有用的,因为它意味着时间和资源不会浪费通过对没有GFP标签的NCC在肠道内的胚胎进行实验。
图3显示血管DII注射的程序。DiI 注射技术的效率/成功取决于:首先,将注射针切到目标静脉的最佳直径,第二,在静脉中插入针头时做出精确的手势(以免穿透另一侧),第三,通过以恒定速度吹制针头,避免针头在注射过程中被堵塞。如果这三个参数中的任何一个做错了,胚胎将出血或需要几个小时才能恢复,然后再进行第二次尝试,因为出血使得几乎不可能立即重新注射。成功的胚胎应立即通过立体荧光显微镜下观察来选择,并且必须快速解剖。在成功的胚胎中,在整个胚胎(图3C,D)中都存在DiI标记的血管,包括毛细血管(图3D)。
在采集胚胎和检查组织部分或全山胃肠道后, 典型结果表明,GFP®NCC在原始ENS内,以及DiI标记肠道血管网络的精细结构(图4)全山制剂,可使用共聚焦显微镜进行检查,图像堆栈产生三维(3D)重建,显示GFP+ENS细胞精细投影与DiI染色血管系统(图4 A-C) 之间的相互关系:G-I;视频1和2)。

图1。推荐的显微外科仪器。 (A) 缝纫针形状的微型刀具。 (B) 精细阿肯色州石头塑造微型刀片。 (C) a) 直剪刀, b) 弯曲剪刀, c) 5 毫升注射器与 181×2 G 皮下针, d) 塑料移液器, e) 定制鸡蛋支架, f) 黑色墨水, g) 方形表杯, h) 方形手表玻璃与黑色银质基础, i) 微型刀片在针架上, j) 米努蒂安针, k) 迷你或钨针在针架上, l) 帕舍夫沃尔夫弹簧剪刀, m) 杜蒙#5钳子, n) 穿孔勺子, oi) 短火拉转移针, oii) 长火拉墨针, p) 口管。 请单击此处查看此图的较大版本。
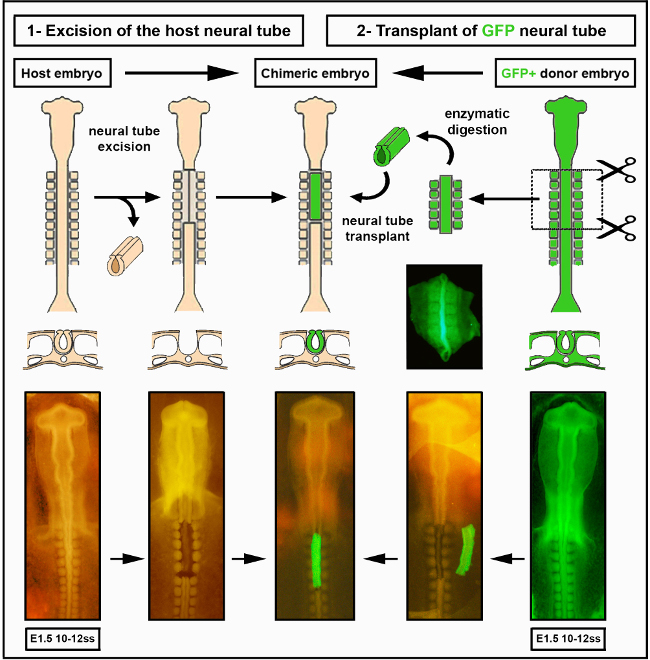
图2。物种内部神经管移植。 小鸡胚胎/GFP神经管图像已经从德拉兰德 等人修改。12. 血管化是肠道神经峰细胞殖民化所必需的。 请单击此处查看此图的较大版本。
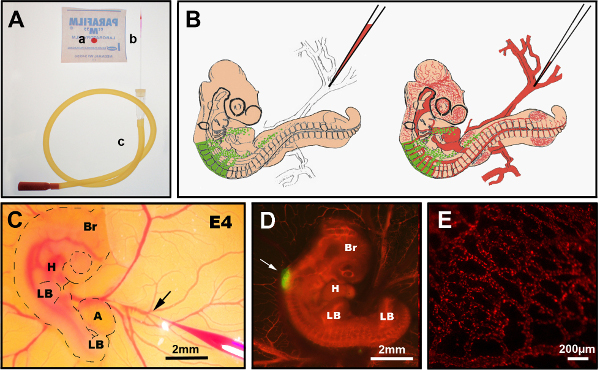
图3。静脉注射。(A)推荐仪器:a) 细胞跟踪器 CM-DiI 滴在胶片上,b) 拉玻璃注射针,c) 口管。(B)静脉注射到E4奇美小鸡胚胎的切图图。 (C) 在 ovo DiI 静脉注射中显示含有 DiI 插入静脉(箭头)的精细玻璃针。 (D) E4 芯片胚胎后 DiI 注射 (红色) 与 GFP® 神经管 (箭头).(E) DiI在活胚胎中染色细血管网络,注射后24小时。布尔:大脑:H:心脏:LB:肢体芽:答:阿兰托瓦。 (C) 和 (D) 中的图像已从德拉兰德 等人处修改。12 血管化不是肠道殖民化的必要,由肠道神经波峰细胞。 请单击此处查看此图的较大版本。
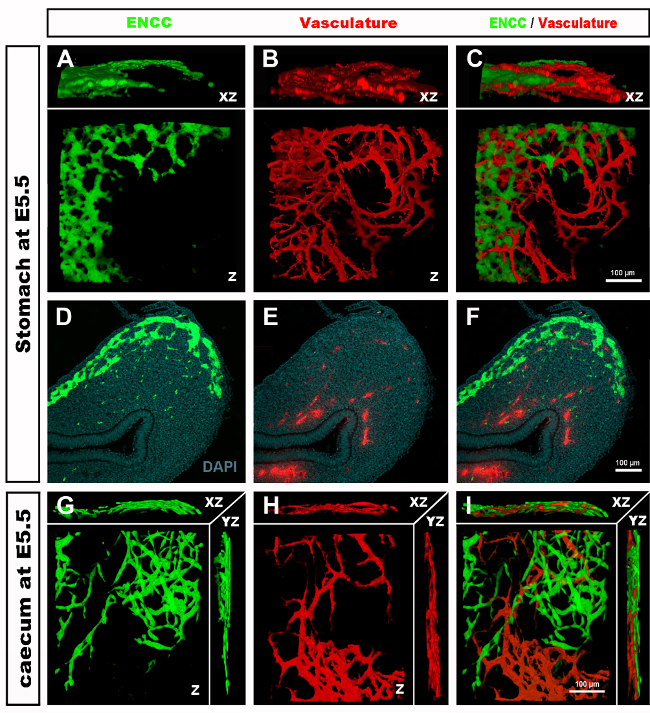
图4:代表结果在E5.5小鸡胚胎的胃和腹。(A-C)胃部区域的共焦图像堆栈的三维 (3D) 重建显示 (D) GFP® 肠神经波峰细胞 (ENCC) (E) DiI 染色血管系统和(F) )两个网络D-F组织学部分在胃的水平合并图像显示(G)GFP+ENCC(H)DiI染色血管系统和(I)两个网络的合并图像。 核上沾满了DAPI(青色)。(G-H)在 Caecum 区域对共焦图像堆栈进行 3D 重建,显示(A) GFP® ENCC 迁移前部为绿色,(B) DiI 彩色血管系统为红色,(C)两个网络的合并图像。图像(A-F)已经从德拉兰德等人修改。12血管化不是肠道殖民化的必要,由肠道神经波峰细胞。请单击此处查看此图的较大版本。
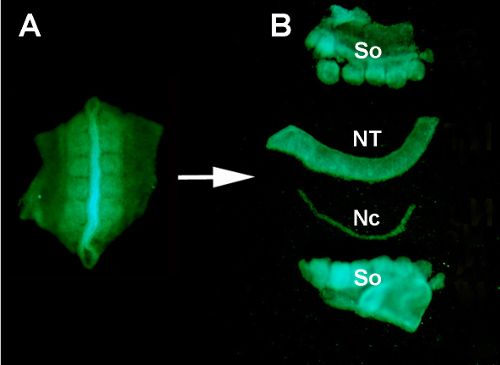
图 S1。通过酶消化和微切除将供体GFP®神经管与周围组织隔离 。(A)从供体胚胎解剖的GFP®神经管和相邻的索米特。 (B) 胰腺素消化后隔离神经管,使用不锈钢小针进行微切除。所以:索米特斯:NT:神经管:诺托乔德。
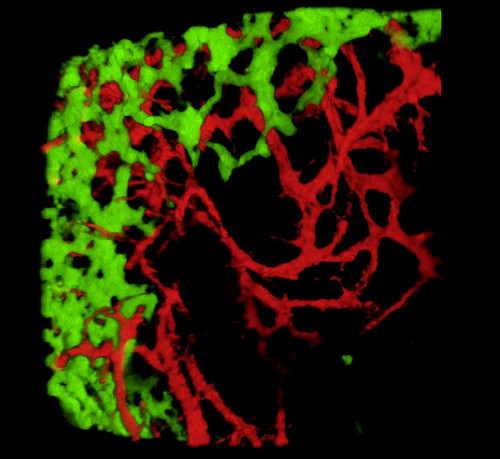
图 4C 中图像的 1. 3 维 360° 旋转视频,显示 E5.5 (HH27-28) 的血管系统和胃中的 ENCC。请单击此处查看此视频。
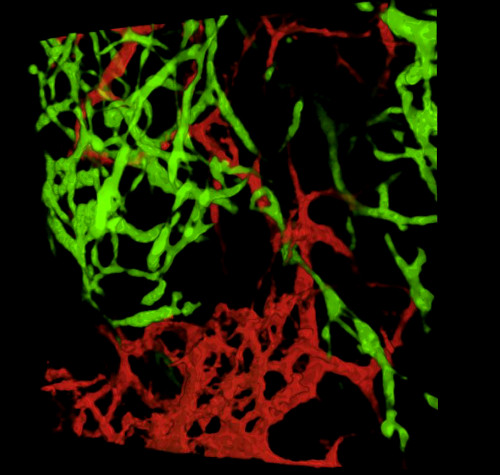
图4I中图像的三维360°旋转视频,显示E5.5(HH27-28)在Caecum区域的血管系统和ENCC迁移前。请单击此处查看此视频。
讨论
物种内部神经管移植方法,结合此处描述的血管标记,充分利用卵子内鸟类胚胎(与其他脊椎动物胚胎相比)的易于获取,研究自主神经系统(ENS)和血管系统元素的共同开发。
对于NCC衍生物的标记,我们描述的小鸡GFP-鸡种内嫁接方法比40多年前1-3年建立的经典鹅鸡奇美拉方法具有许多优点。首先,在 FITC 光下,GFP 荧光非常明亮,以至于 GFP® 细胞在活体幻想胚胎中很容易识别。这使得移植的成功在奥沃检查,而鹅鸡移植需要使用QCPN杀死,加工和免疫,然后才能确定移植的成功2。其次,转基因小鸡GFP中的GFP表达是细胞质的,因此它不仅给细胞体贴上标签,而且使移植细胞的投影可视化22。这允许以高分辨率观察复杂的神经元网络(请注意,当样品中沾有抗GFP抗体时,精细投影最好可视化)。由于 QCPN 标签仅限于夸尔细胞核,因此不会使用夸尔-奇美拉显示此类网络。第三,物种内部移植消除了奇美胚胎细胞之间的任何潜在物种差异。由于小鹰胚胎的潜伏期比小鸡短(19天对21天),因此有人建议,小鹰细胞的增殖率高于小鸡细胞,这可能影响到23个奇美组织的发展。有趣的是,在植物中也表明,物种间嫁接可以产生广泛的DNA甲基化模式在宿主24的变化。第四,小鸡GFP促进背部移植实验,以解决诸如NCC命运和细胞承诺25等话题。第五,转基因小鸡GFP对许多其他技术也很有用,包括GFP®细胞亚群的FACS排序、含有GFP®细胞的器官的器官培养、通过表达质粒26的电波对GFP®移植组织的基因操作,以及其他成像技术,如光学投影断层扫描27。
神经管移植方法可以通过微手术取代较短的神经管来修改。通过使用较小的神经管段,显微外科对胚胎的损害可能较小,存活率可以提高。然而,移植较少神经管的缺点是,在宿主中GFP+NCC的数量将减少。用户可以尝试在移植神经管以提供胚胎最佳存活率的神经管数量和主肠道内 GFP® NCC 的数量之间取得平衡,以提供翔实的结果。
对于血管绘画,DiI 的优势在于其荧光非常明亮和坚固。此外,它有能力在固定期间扩散,确保最好的开放毛细细丝染色。由于胚胎是一种重要的染料,因此可以在注射过程中存活下来,并使用染色血管系统继续发育(我们手中长达24小时,虽然随着时间的推移,染色变得更加刺穿,见 图3E)。因此,小鸡GFP 嫁接与DiI血管绘画的结合与活影像相容。除了所有这些优点,重要的是要注意,血管注射只标记发光血管,因此不识别未开封的毛细血管,内皮尖端细胞或孤立的内皮细胞。然而,在鸟类转基因的进一步进展可以提供新的方法来规避这些问题,例如实验使用Tg(tie1:H2B-eYFP)的鹅胚胎来研究血管形态形成28。这项技术的另一个局限性是,对于E7.5及以后胚胎的有效血管标签,需要注射更多的染料,这会使实验变得昂贵。然而,这项技术的修改可能包括低成本的血管标签使用荧光笔墨水14,虽然这种方法还没有尝试在我们的手中。
程序的关键步骤包括通过在爆炸盘下注入墨水来可视化胚胎的过程。如果覆盖蛋黄的膜在这个阶段被充满墨水的针头撕裂,那么胚胎存活率就会受到严重损害。此外,在准备供体神经管时,组织不会在胰腺素中留下过长的时间(考虑最多大约 10 分钟)。长期暴露在胰腺素损害组织和神经管然后很难处理,它不会很好地融入主机。在注射奇美胚胎之前,获得野生类型胚胎的DiI注射技术经验至关重要,因为每个胚胎通常只能尝试注射一次。DiI体积和针直径是每个胚胎的关键参数,应在野生类型、阶段匹配控制上进行评估。
总之,我们在活小鸡胚胎中采用神经管移植和DiI血管绘图的双重标记方法,可用于研究器官形成过程中NCC与血管网络之间的相互关系。考虑到在器官发育过程中建立正确目标内向和血管化的机制仍鲜为人知,这种方法为该领域的未来发现具有潜力。
披露声明
作者宣称他们没有相互竞争的经济利益。
致谢
受精的GFP鸡蛋由英国罗斯林研究所和爱丁堡大学的海伦·桑教授提供。罗斯林转基因鸡工厂由威康信托基金和生物技术和生物科学研究理事会(BBSRC)资助。这项工作的部分资金,和NT支持,由大奥蒙德街医院儿童慈善,伦敦,英国。作者感谢UCL儿童健康研究所的本·杰万斯帮助准备胚胎移植。
材料
| Name | Company | Catalog Number | Comments |
| Name of the Material/Equipment | Company | Catalog Number | |
| Fertilised chick eggs | Henry Stewart and Co, Louth, UK | ||
| Fertilised GFP chick eggs | The Transgenic Chicken Facility, The Roslin Institute, The University of Edinburgh | ||
| Egg incubator (Profi-H Hatcher) | Lyon Technologies, CA, USA | 910-033 | |
| 14C Incubator | Precision Cooled Incubator, Leec Ltd., Nottingham, UK | Model LT2 | |
| Stereo-microscope | LEICA | Model MZ 12.5 | |
| Digital Camera | LEICA | DC500 | |
| Image acquisition software | LEICA | IM50 | |
| Goose neck halogen cold light source | Advanced Imaging Concepts, Inc | KL 1500 LCD | |
| 181⁄2 G hypodermic needle | SIGMA - ALDRICH | HSWNH181 | |
| Pancreatin | SIGMA - ALDRICH | P3292 | |
| DMEM | SIGMA - ALDRICH | D5030 | |
| Goat serum | SIGMA - ALDRICH | G6767 | |
| 5ml syringe | SIGMA - ALDRICH | Z248010 | |
| Mouth tube | SIGMA - ALDRICH | A5177 | |
| Sigma Pasteur pipettes non-plugged, L 5 3/4 in. | SIGMA - ALDRICH | S6018 | |
| Transfer pipettes, polyethylene | SIGMA - ALDRICH | Z350796 | |
| Borosillicate glass capillaries, thin wall without filament | Harvard apparatus | PY8 30-0035 | |
| Iris Scissors - ToughCut | Fine Science Tools | 14058-09 | |
| Curved Iris Scissors - ToughCut | Fine Science Tools | 14059-09 | |
| Needle holders (Nickel-plated pin holder) | Fine Science Tools | 26018-17 | |
| Pascheff-Wolff Spring Scissors | Fine Science Tools | 15371-92 | |
| Dumont #5 forceps | Fine Science Tools | 11251-30 | |
| Minutien pins | Fine Science Tools | 26002-15 | |
| Dumont AA forceps, Inox Epoxy- coated | Fine Science Tools | 11210-10 | |
| Perforated spoon | Fine Science Tools | 10370-18 | |
| Tungsten needles (0.125mm diameter) | Fine Science Tools | 10130-05 | |
| Sellotape (clear, 24mm width) | Any Supplier | ||
| Pen/Strep (Penicillin, Streptomycin) Solution | VWR international | 101447-068 | |
| Sylgard 184 silicone elastomer kit | Dow Corning | S09 512 516 | |
| Pelikan black ink | Pelikan | 211-169 | |
| CellTracker CM-DiI | Molecular Probes | C-7001 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Molecular Probes | D1306 | |
| Settings for glass needle puller | Sutter Instruments | Flaming/Brown micropipette puller model P-86 | |
| Heat 950; Pull 150; Velocity 100; Time 200; Pressure 500 |
参考文献
- Le Douarin, N. A biological cell labeling technique and its use in expermental embryology. Developmental Biology. 30, 217-222 (1973).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods in Molecular Biology. 461, 337-350 (2008).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods in Molecular Biology. 97, 305-318 (1999).
- Garcia-Castro, M., Bronner-Fraser, M. Induction and differentiation of the neural crest. Current Opinion In. Cell Biology. 11, 695-698 (1999).
- Bhatt, S., Diaz, R., Trainor, P. A. Signals and switches in Mammalian neural crest cell differentiation. Cold Spring Harbor Perspectives In Biology. 5, (2013).
- Burns, A. J., Douarin, N. M. The sacral neural crest contributes neurons and glia to the post-umbilical gut: spatiotemporal analysis of the development of the enteric nervous system. Development. 125, 4335-4347 (1998).
- Burns, A. J., Le Douarin, N. M. Enteric nervous system development: analysis of the selective developmental potentialities of vagal and sacral neural crest cells using quail-chick chimeras. The Anatomical Record. 262, 16-28 (2001).
- Burns, A. J., Delalande, J. M., Le Douarin, N. M. In ovo transplantation of enteric nervous system precursors from vagal to sacral neural crest results in extensive hindgut colonisation. Development. 129, 2785-2796 (2002).
- Burns, A. J., Champeval, D., Le Douarin, N. M. Sacral neural crest cells colonise aganglionic hindgut in vivo but fail to compensate for lack of enteric ganglia. Developmental Biology. 219, 30-43 (1006).
- Wang, X., Chan, A. K., Sham, M. H., Burns, A. J., Chan, W. Y. Analysis of the sacral neural crest cell contribution to the hindgut enteric nervous system in the mouse embryo. Gastroenterology. 141, 992-1002 (2011).
- Goldstein, A. M., Hofstra, R. M., Burns, A. J. Building a brain in the gut: development of the enteric nervous system. Clinical Genetics. 83, 307-316 (1111).
- Delalande, J. M., et al. Vascularisation is not necessary for gut colonisation by enteric neural crest cells. Developmental Biology. 385, 220-229 (2014).
- Anderson, R. B., Stewart, A. L., Young, H. M. Phenotypes of neural-crest-derived cells in vagal and sacral pathways. Cell And Tissue Research. 323, 11-25 (2006).
- Takase, Y., Tadokoro, R., Takahashi, Y. Low cost labeling with highlighter ink efficiently visualizes developing blood vessels in avian and mouse embryos. Development, Growth & Differentiation. 55, 792-801 (2013).
- Bates, D., Taylor, G. I., Newgreen, D. F. The pattern of neurovascular development in the forelimb of the quail embryo. Developmental Biology. 249, 300-320 (2002).
- Mayes, P., Dicker, D., Liu, Y., El-Deiry, W. Noninvasive vascular imaging in fluorescent tumors using multispectral unmixing. BioTechniques. 45, 459-460 (2008).
- Li, Y., et al. Direct labeling and visualization of blood vessels with lipophilic carbocyanine dye DiI. Nature Protocols. 3, 1703-1708 (2008).
- Eichmann, A., Thomas, J. L. Molecular parallels between neural and vascular development. Cold Spring Harbor Perspectives In Medicine. 3, a006551 (2013).
- Weinstein, B. M. Vessels and nerves: marching to the same tune. Cell. 120, 299-302 (2005).
- Carmeliet, P., Tessier-Lavigne, M. Common mechanisms of nerve and blood vessel wiring. Nature. 436, 193-200 (2005).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88, 49-92 (1951).
- Barraud, P., et al. Neural crest origin of olfactory ensheathing glia. Proceedings of the National Academy of Sciences of the United States of America. 107, 21040-21045 (2010).
- Senut, M. C., Alvarado-Mallart, R. M. Cytodifferentiation of quail tectal primordium transplanted homotopically into the chick embryo. Brain Research. 429, 187-205 (1987).
- Wu, R., et al. Inter-species grafting caused extensive and heritable alterations of DNA methylation in Solanaceae plants. PLoS One. 8, e61995 (2013).
- Freem, L. J., Delalande, J. M., Campbell, A. M., Thapar, N., Burns, A. J. Lack of organ specific commitment of vagal neural crest cell derivatives as shown by back-transplantation of GFP chicken tissues. The International Journal Of Developmental Biology. 56, 245-254 (2012).
- Delalande, J. M., et al. The receptor tyrosine kinase RET regulates hindgut colonization by sacral neural crest cells. Developmental Biology. 313, 279-292 (2008).
- Freem, L. J., et al. The intrinsic innervation of the lung is derived from neural crest cells as shown by optical projection tomography in Wnt1-Cre;YFP reporter mice. Journal of Anatomy. 217, 651-664 (2010).
- Sato, Y., et al. Dynamic analysis of vascular morphogenesis using transgenic quail embryos. PloS One. 5, e12674 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。