Method Article
ChickGFP Nöral Tüp Greftleme ve Karbosiyanine Boya DiI Enjeksiyonu Kullanılarak Tavuk Embriyoları İçinde Nöral Kret Hücrelerinin ve Kan Damarlarının Çift Etiketlenimi
Bu Makalede
Özet
Burada damar içi DiI enjeksiyonu ile birlikte civcivGFP nöral tüp intraspsi greftleme kullanılarak nöral kret hücrelerinin ve kan damarlarının çift etiketlendiğini bildiriyoruz. Bu deneysel teknik, organogenez sırasında NCC türevi (enterik) sinir sisteminin ve vasküler sistemin gelişimini aynı anda görselleştirmemizi ve incelememizi sağlar.
Özet
Gelişmekte olan tüm organların hem sinir sistemine (duyusal ve motor kontrol için) hem de vasküler sisteme (gaz değişimi, sıvı ve besin temini için) bağlanması gerekir. Sonuç olarak, hem sinir hem de damar sistemleri yan yana gelişir ve dallanma mimarilerinde çarpıcı benzerlikler paylaşır. Burada, nöral kret türevi sinir dokusunun (bu durumda enterik sinir sistemi) ve vasküler sistemin eşzamanlı gelişimini incelememize izin veren embriyonik manipülasyonları rapor ediyoruz. Bu, nöral tüpün ayrık segmentlerinin ve ilişkili nöral kretin nakliyle tavuk chimeras'larının aynı embriyoda vasküler DiI enjeksiyonu ile birleştirilmesiyle elde edilir. Yöntemimiz, tür içi aşılama için transgenik civcivGFP embriyoları kullanır ve nakil tekniğini 1970'lerden beri büyük etkiyle kullanılan klasik bıldırcın-civciv türler arası aşılama protokolünden daha güçlü hale getirir. CivcivGFP-civciv intraspsi greftleme, nakledilen hücrelerin ve bunların sağlam dokulardaki projeksiyonlarının görüntülenmesini kolaylaştırır ve tür farklılıklarıyla bağlantılı hücre gelişimindeki potansiyel önyargıları ortadan kaldırır. Bu yöntem, enterik sinir sisteminin ve vasküler sistemin birlikte gelişimini incelemek için kuş embriyosunun (diğer omurgalı embriyolarla karşılaştırıldığında) erişim kolaylığından tam olarak yararlanır.
Giriş
Tavuk embriyosu omurgalı gelişim biyolojisinde paha biçilmez bir model organizmadır, çünkü ovo'daki gelişimi, rahimdegelişen omurgalılarda yapılması imkansız olan deneysel manipülasyonlara izin verdiğinden. Bu erişilebilirlik ve manipülasyon kolaylığı, civciv embriyosunun gelişim biyolojisi alanındaki birçok ufuk açıcı keşifte kilit roller oynamasına yol açmıştır. En güçlü teknikler arasında, 1970'lerde Profesör Nicole Le Douarin'in öncülük ettiği bir yöntem olan hücre kaderini incelemek için bıldırcın-civciv kimerik embriyoların kullanılmasıolmuştur. Özellikle, bıldırcın civciv chimeras, erken gelişim sırasında son derece göçmen sinirsel tepe hücresi (NCC) popülasyonlarını genetik olarak işaretlemek ve takip etmek için özellikle yararlı olmuştur. NCC, sinir tüpünün kenarlarındaki dorsal ektodermde ortaya çıkan ve omurgalı embriyo boyunca çok çeşitli hücre tiplerine yol açan çok güçlü bir göçmen hücre popülasyonudur. Bunlar kraniyofasiyal yapılar (kıkırdak, kemik, kaslar), nöronlar ve glia (duyusal ve otonom sinir sistemlerinde), melanositler ve endokrin sistemin hücrelerinin bir alt nüfus2,4,5. NCC kaderini etkileyen en önemli faktörlerden biri, sinir tüpünün ön-arka ekseni boyunca ilk konumlarıdır. Örneğin, enterik sinir sisteminin (ENS) nöronlarına ve glialarına yol açan enterik NCC, iki ayrı alt popülasyondan kaynaklanır: birincisi vagal (kaudal hindbrain) bölgesinde ve ikincisi nöral tüpün sakral bölgesinde6-13. Sinir tüpünün ilgili bölgelerinin inter veya tür içi aşılaması, bu hücreleri kalıcı olarak etiketlemek ve daha sonra nöral tüpün kenarlarındaki doğumlarından sindirim sistemi içindeki son varış yerlerine kadar izlemeye izin vermek için tercih edilen teknikler olmuştur6,7,10.
Civcivde diğer hayvan modellerine kıyasla daha kolay gerçekleştirilen bir başka embriyonik manipülasyon, damar sisteminin hayati etiketlemesidir. Gerçekten de, civciv embriyosu geliştikçe, yumurta sarısından oksijen ve besinleri dolaşan ekstra embriyonik bir vasküler ağın üzerine uzanır. Yumurta sarısının yüzeyinde bulunan bu erişilebilir vasküler ağ, organogenez12,14-17sırasında embriyonun gelişen damar sistemini etiketlemek için bir geçit olarak kullanılabilir. Lipofilik boya DiI gibi çeşitli boyaların intravasküler enjeksiyonu, nascent vasküler ağın tüm ışıklı damarlarının tanımlamasını / lekelenmesini mümkün kılar.
Gelişmekte olan organların hem sinir sistemine (duyusal ve motor kontrol için) hem de vasküler sisteme (gaz değişimi, sıvı ve besin kaynağı için) bağlanması gerektiğinden, iki ağ yan yana gelişir ve dallanma mimarilerinde çarpıcı benzerlikler paylaşır18-20. Burada, organogenez sırasında NCC türevi ENS'in damar sistemi ile birlikte eşzamanlı gelişimini incelememizi sağlayan embriyonik manipülasyonları rapor ediyoruz. Bu, nöral kret de dahil olmak üzere sinir tüpünün ayrı bölümlerinin vasküler DiI enjeksiyonu ile birlikte nakli ile tavuk chimeras üretilerek elde edilir. Bıldırcın-tavuk chimeras'tan bir ilerleme olarak, yöntemimiz transgenik GFP civciv embriyolarını tür içi aşılama için kullanır, nakil tekniğini görüntüleme hücreleri ve projeksiyonları açısından daha güçlü hale getirir ve tür farklılıklarıyla bağlantılı potansiyel önyargıları ortadan kaldırır.
Protokol
1. Nöral Tüp Ablasyonları için Mikro neşter hazırlanması
- Piyasada bulunan çelik dikiş iğnesinden mikro neşteri şekillendirin.
- İlk önce, güçlendirilmiş bir tezgah taşlama makinesine monte edilmiş bir taşlama tekerleği kullanarak iğneyi her iki tarafta düzleştirin.
- Neşteri şekillendirmeye başlayın, ilk olarak kaba sınıf bir Arkansas taşında, kontrollü dairesel bir hareket kullanarak, alternatif yönlerde, iğnenin her iki tarafında.
- Ultra ince bir mikro neşteri şekillendirmek için ekstra ince dereceli Arkansas taşında aynı keskinleştirme hareketlerini iyi tanımlanmış bir kesme kenarı ile sürdürin(Şekil 1A, B).
NOT: Mikro neştere alternatifler elektrolitik olarak keskinleştirilmiş iğneler, piyasada bulunan tungsten iğneleri veya çekilmiş cam iğneler olabilir.
2. Yabani Tip ve GFP Yumurtalarını İstenilen Aşamaya Kuluçkaya İndirin
- Döllenmiş tavuk yumurtalarını ve transgenik GFP tavuk yumurtalarını, bu sıcaklıkta gelişim durdurulduğu için inkübasyondan önce 14 - 15 ° C'de soğutulmuş bir inkübatörde saklayın. Yumurtaları birkaç gün, bir haftaya kadar saklayın.
- Gelişmeye başlamak için, vahşi tip ve GFP yumurtalarını yatay olarak bir tepsiye yerleştirin ve aynı anda nemlendirilmiş bir şekilde kuluçkaya yatırarak (%58 - 60) 37.5 ºC'de inkübatör, böylece embriyolar nöral tüp greftleme için eşleşen aşamalardadır.
- Vagal nöral tüp greftlemenin gerçekleştirilmesi için gelişimin 10 - 12 somit aşamasında embriyo elde etmek, hamburger ve Hamilton21'ingelişim tablolarına göre yumurtaları 1,5 gün (33 - 38 saat) kuluçkaya yatırmak ve embriyoları evrelamak.
3. Pencereleme ve Aşılama için Yumurta Hazırlayın
- Pencereleme için her seferinde bir yumurtayı özel yapım bir yumurta tutucuya taşıyın. Yumurtanın sivri ucunun üst yüzeyine düz makasla tekrar tekrar dokunarak yumurta kabuğunda küçük bir delik açın.
- 181/2 G hipodermik iğne ve 5 ml şırınga ile yumurtadan 2 - 3 ml albümin çıkarın. Albümin çıkarılması yumurtanın içindeki sarıyı indirir ve embriyoya herhangi bir zarar vermeden sonraki pencereyi kolaylaştırır.
- Albümin'i atın. Deliği ince makasla kesilmiş küçük bir şeffaf bant şeridi ile kapatın.
- Kavisli makas kullanarak, yumurta kabuğunun üst yüzeyindeki başka bir deliğe dokunun. Makasın ucunu deliğe yerleştirin ve makası tezgaha paralel tutarak, kabuğun üzerine ~2 cm çapında bir pencere kesmek için dairesel bir hareketle çalışın.
- Makası sabit bir konumda tutun ve yumurtayı döndürün. Yumurta kabuğunun çıkarılan diskini atın. E1.5'te embriyo, sarının üstünde daha koyu sarı bir disk olarak tanınabilir.
- Cımbız kullanarak yumurtanın içine düşen kabuk kalıntılarını çıkarın. Döllenmemiş yumurtaları atın (aksi takdirde açık sarı sarısının üstündeki küçük beyaz bir nokta ile tanımlanır).
4. Konak Embriyoyu Aşılanmış Doku Alacak Şekilde Hazırlayın
- Stereo mikroskobu göz seviyesine ayarlayın ve yansımalara neden olmadan embriyoyu yeterince aydınlatmak için kaz tüyü ışık kaynağının yönünü optimize edin.
- Embriyoyu uygunşekilde görselleştirmek için, bir ağız tüpü ve çekilmiş bir cam mikro pipet kullanarak koyu sarı diskin merkezinin altına az miktarda Hint mürekkebi enjekte edin (Şekil 1C, Oii).
- 100 μg/ml son konsantrasyonda Penisilin/Streptomisicin içeren PBS ile 50:50 mürekkep hazırlayın. Mikro pipeti blastoderm çevresinin dışındaki yumurta sarısı zarına yerleştirin, ardından ucunu embriyonun hemen altına dikkatlice açılın.
- Ağız tüpüne üfleyerek embriyonun altına mürekkep teslim edin. Ağız pipetleme izin verilmiyorsa, bunun yerine 1 ml şırıngar kullanın. Embriyonun altına kontaminasyona yol açabilecek herhangi bir hava kabarcığı sokmamaya dikkat edin, ardından cam mikro pipeti dikkatlice çıkarın. Bu, hassas bir şekilde yapılmadığı takdirde embriyonun ölümüne yol açabilecek hassas bir adımdır.
- Hamburger ve Hamilton21'e atıfta bulunarak embriyoyu sahnele ve sahneyi bir laboratuvar kitabına kaydet.
- Bir iğne tutucuya monte edilmiş özel yapılmış bir mikro neşter (veya ince bir tungsten iğnesi) kullanarak, mikro cerrahinin yapılacağı alanın yanında, vitelline zarında çok küçük bir yara yapın.
- Embriyo ile zar arasında boşluk oluşturmak için membran yırtığına (cam mikro pipet ve ağız tüpü kullanarak) 2 - 3 damla PBS dikkatlice uygulayın. Mikro cerrahinin gerçekleşeceği tüm bölgeyi ortaya çıkarmak için membranda daha büyük bir pencere kesin.
- Tüm dorsal nöral tüp boyunca rostral ve kaudal enine kesilerden başlayarak mikro neşteri kullanarak ilgi çekici sinir tüpü bölgesini çıkarın (videoda somite 1 ila 7 seviyesinde).
- Sinir tüpüne zarar vermeden, sinir tüpünü çevre dokulardan ayırmak için sinir tüpü ile somitler arasında iki taraflı kesin.
- Sinir tüpünü alttaki notochord'dan çok nazikçe ayırın, bu da bozulmadan kalmalıdır. Başarılı nöral tüp eksizyonun tüm çevre dokuları mükemmel bir şekilde sağlam bırakacağını unutmayın (Şekil 2).
- Çıkarılan sinir tüpünü cam bir mikro pipete emiş ederek çıkarın, sonra atın.
- Sinir tüpü ablasyon seviyesini bir laboratuvar kitabına kaydedin. Konak embriyo artık donör sinir tüpünü almaya hazır.
5. Donör Greft Dokusunu Hazırlayın
- FITC filtreli floresan stereo mikroskop altında görüntüleyerek pencereli, sahneyle eşleşen bir GFP embriyosu seçin. GFP floresan, somitleri görselleştirmeyi ve embriyoyu sahnelemeyi çok kolaylaştırır.
- Aşama uyumlu bir embriyo belirlendikten sonra, embriyonun etrafındaki dikdörtgen şeklinde Pascheff-Wolff yay makası (Şekil 1C, l) ile 4 kesi yaparak embriyoyu yumurtadan çıkarın ve ardından bir embriyo kaşığı ile hafifçe alın.
- Embriyoyu sylgard polimer bazlı kare bir saat camına yerleştirin. Bağlı yumurta sarısını çıkarmak için embriyoyu Dumont #5 cımbızla hafifçe sallayın. Vitelline zarını çıkarın ve embriyoyu paslanmaz minutien pimler kullanarak polimer tabanına sabitleyin (Şekil 1C).
- Yay makasını kullanarak, konak embriyodan çıkarılan aynı bölgede, sinir tüpü ve çevresindeki somitler etrafında dikdörtgen şeklinde 4 kesi yapın.
- Plastik transfer pipeti kullanarak, donör GFP embriyosundan gelen nöral tüpü ve somit dokuları Pen/Strep PBS'de% 0,2 pankreatin içeren bir saat camına aktarın.
- Dokuları ayırmaya yardımcı olmak için ENZYMATIC sindirimin RT'de 10 dakika boyunca devam etmesine izin verin. Enzimde inkübasyondan sonra, sinir tüpünü tüm bitişik dokulardan manuel olarak ayırmak için bir tutamağa monte edilmiş paslanmaz minutien pimleri kullanın.
- Bir cam mikro pipet kullanarak, fazla pankreası durulamak ve enzimatik sindirimi durdurmak için, ayrışmış sinir tüpünü buz üzerinde DMEM +% 10 serum(örneğin,keçi, at veya fetal baldır) içeren başka bir saat camına aktarın. 5 dakika sonra, parçalanmış sinir tüpü civciv konağına ortopedik olarak aşılamaya hazırdır(Şekil 2 ve S1).
6. Dokuyu Aşıla
- Bir cam mikro pipet kullanarak, parçalanmış sinir tüpünü saat camından konak embriyoya dikkatlice aktarın. Sinir tüpünü doğru ön-arka yönde konumlandırın ve mikro neşteri kullanarak civciv konağının eksize bölgesine bitişik eksplantı hafifçe itin. Sinir tüpünün yönünü belirlemek için sırt yüzeyine küçük bir çentik takmış veya küçük bir çentik keserek küçük bir ektoderm parçası bırakın.
- Gerekirse, eksplantı eksizyon bölgesinin tam boyutuna kırpmak için mikro neşteri kullanın.
- Sinir tüpünü ablated bölgeye hafifçe yönlendirin ve sırt tarafının doğru yönlendirilmesini yapacak şekilde konumlandırın. Grefti çevreleyen PBS ve/veya sıvıyı çıkarmak için ağız tüpüne monte edilmiş bir cam mikro pipet kullanın. Bu, donör ve konak dokuların yapışmasını ve greftin kurulmasını sağlar.
- Dehidrasyon ve kirlenmeyi önlemek için tüm pencereyi 24 mm genişliğinde şeffaf bantla kapatın.
- Yumurta kabuğuna kalemle işaretleyerek kimerik embriyoyu etiketleyin ve numarasını laboratuvar kitabına kaydedin. Daha fazla gelişme için yumurtayı inkübatöre geri verin.
7. Konak Embriyonun Kan Damarlarına DiI Enjekte Edin
- İstenilen deneysel zaman noktasında (burada, 3 - 10 gün sonra), chimeric embriyosunu inkübatörden alın ve yumurta içindeki embriyoya erişmek için düz makas kullanarak şeffaf bandı çıkarın.
- Gerekirse, makası kullanarak pencereyi kabukta büyütün. Kabuğa tutturulmuşsa, kanamaya neden olacak ve kan damarı etiketlemesini tehlikeye atacak olan koryallantoik zara zarar vermemeye dikkat edin.
- Kan akışının embriyoya doğru yönlendirildiğinden emin olmak için yumurta sarısı üzerinde erişilebilir bir damar seçin. Vitelline damarlarından birinin dallanma noktasını seçin (Şekil 3B, C).
NOT: E6.5 - E7.5'te, yumurta sarısı damarlarına erişmek için koryallantoik zarın cımbızla hafifçe kenara taşınması gerekebilir. E8.5'ten sonra, tek seçenek koryallantoik membran damarlarından birine enjekte etmektir, çünkü bu aşamada, koryallantoik membran embriyoyu tamamen kapsar. - Seçilen enjeksiyon noktasının üzerindeki vitelline zarını, zıt yönlerde yırtarak iki Dumont #5 cımbız kullanarak çıkarın.
- Dumont #5 kullanarak çekilmiş bir cam iğneyi kırın ve CellTracker CM-DiI ile yüklemeden önce çapını damarın yaklaşık boyutuna ayarlayın. DiI stok çözümünü DMSO'da 40 μg/μl'de yapın ve -20 °C'de saklayın. Çalışma solüsyonunun 4 μg/μl konsantrasyonda 0,3 M sakkaroz/PBS olarak hazırlanması.
- Ağız tüpü ile emme kullanarak iğneye 0,3 M sakkaroz / PBS'de 5 - 10 μl Arasında DiI epire edin. Daha eski embriyolar 25 μl veya daha fazla gerekebilir. E8.5'ten itibaren embriyolar, DiI yüklü cam iğne ile bıçaklamadan önce bir Dumont #5 ile pozisyonda tutulması gerekebilecek daha büyük, daha kaslı damarlara sahiptir.
- İğneyi damara hızlı bir şekilde sokun ve dii'nin pıhtı oluşturmadan kan akışını yavaşça birleştirmesini sağlamak için ağız tüpüyle sürekli üfleyin. Alternatif olarak, DiI teslimatı için bir basınç enjektörü kullanın.
8. Kesitleme veya Kepenk Muayenesi için Embriyoları Hasat Edin
- Embriyo içinde mümkün olduğunca fazla DiI tutmak için, embriyoyu yumurta sarısından kurtarmak için, delikli bir kaşık üzerine kepçeyle atarak ve kan damarlarını ve bağ dokularını bir çift düz makasla keserek enjeksiyondan hemen sonra hasat edin.
- Gevşek zarları çıkarın ve ilgi organlarını(yani,bu öğreticideki akciğerleri ve sindirim sistemini) parçalara ayırın, dokuyu sıkıştırmamaya büyük özen göstererek, dii'nin difüzyonunu oluşturur. RT'de 1 - 2 saat boyunca% 4 PFA'ya daldırarak dokuları hemen sabitle.
- Dokuyu PBS'de 5 dakika, daha sonra 5 μg/ml DAPI içeren PBS'de 15 dakika durulayın. Numuneleri tüm montaj incelemesi için köprülü bir mikroskop kaydırağından monte edin veya kriyo kesitleme için gömün.
Sonuçlar
Şekil 1, sinir tüpünün mikrocerrahi izolasyonu ve naklini gerçekleştirmek için gereken tipik aletleri göstermektedir. Şekil 2 nakil prosedürünü göstermektedir. Transplantasyon sonrası embriyolar nakil başarısı için taranır. Bu, embriyonun stereo floresan mikroskop altında, tipik olarak mikrocerrahiden sonraki sabah, greft türevi (GFP+) NCC varlığı için incelenmesini içerir. Transplantasyon başarılı olmuşsa, GFP+ NCC sinir tüpünün çevresinde ve önseziye giden erken göç yollarında gözlenebilir. prosedür başarılı olmadıysa, GFP + NCC sinir tüpünün dışında gözlenmez veya konakta bulunurlarsa daha küçük sayılarda olabilirler. Bu başarısız embriyolar atılır. Tipik olarak, bir günde 5-8 nöral tüp nakli yapılır ve bu% 80'i başarılıdır. Başarısız nöral tüp naklinin nedenleri arasında, mikrocerrahi sırasında oluşan doku hasarı nedeniyle embriyonun ölümü veya sinir tüpünün konak embriyoya entegre edilememesi sayılmaz. İkincisi, sinir tüpünün konakçı içinde kötü yerleştirilmesinden veya kötü diseksiyon tekniği nedeniyle düşük kaliteli bir nöral tüpten veya dissosiye enzime aşırı maruz kalmadan kaynaklanabilir. İlk tarama adımı ve GFP+ hücreleri için benzer daha sonraki incelemeler, bağırsak içinde GFP etiketli NCC olmayan embriyolar üzerinde deneyler yaparak zaman ve kaynakların boşa harcanmaması anlamına geldiği için yararlıdır.
Şekil 3 kan damarlarının DiI enjeksiyonu prosedürünü göstermektedir. DiI enjeksiyon tekniğinin verimliliği / başarısı bağlıdır: birincisi, enjeksiyon iğnesini hedeflenen damar için optimum çapa kesmek, ikincisi iğneyi damara sokarken hassas bir hareket (diğer tarafı delmemek için) ve üçüncüsü sabit bir hızda üfleyerek enjeksiyon sırasında iğnenin takılmasını önlemek. Bu üç parametreden herhangi biri yanlış yapılırsa, kanama hemen tekrar enjekte etmeyi neredeyse imkansız hale getirdiğinden, embriyonun kanaması olacak veya ikinci bir deneme yapılmadan önce iyileşmesi için birkaç saate ihtiyacı olacaktır. Başarılı embriyolar stereofluoresans mikroskobu altında görüntüleyerek hemen seçilmeli ve hızla parçalanmalıdır. Başarılı embriyolarda, dii etiketli kan damarları embriyo boyunca bulunur (Şekil 3C,D) kılcal yataklar dahil (Şekil 3D).
Embriyoların toplanması ve doku bölümlerinin veya kepenk gastrointestinal yolların incelenmesi üzerine, tipik sonuçlar, GFP+ NCC'nin ilkel ENS içindeki ince yapısını ve DiI etiketli bağırsak kan damarı ağlarının ince yapısını ortaya koymaktadır (Şekil 4) Wholemount preparatları konfokal mikroskopi kullanılarak incelenebilir, böylece görüntü yığınları GFP + ENS hücrelerinin ince projeksiyonları ile DiI lekeli vasküler sistem arasındaki ilişkileri gösteren üç boyutlu (3D) rekonstrüksiyonlar üretir (Şekil 4 A-C; G-I; Videolar 1 ve 2).

Şekil 1. Önerilen mikrocerrahi aletleri. (A) dikiş iğnesinden şekillendirilmiş mikro neşter. (B) bir mikro neşteri şekillendirmek için ince Arkansas taşı. (C) a) düz makas, b) kavisli makas, c) 181/2 G hipodermik iğneli 5 ml şırınga, d) plastik pipet, e) özel yapım yumurta tutucu, f) siyah mürekkep, g) kare saat camı, h) siyah sylgard tabanlı kare saat camı, i) iğne tutucu üzerinde mikro neşter, j) minutien pimler, k) iğne tutucu üzerinde minutien veya tungsten iğne, l) Pascheff-Wolff yay makası, m) Dumont #5 cımbız, n) delikli kaşık, oi) kısa ateşle çekilmiş transfer iğnesi, oii) uzun ateşle çekilmiş mürekkep iğnesi, p) ağız tüpü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
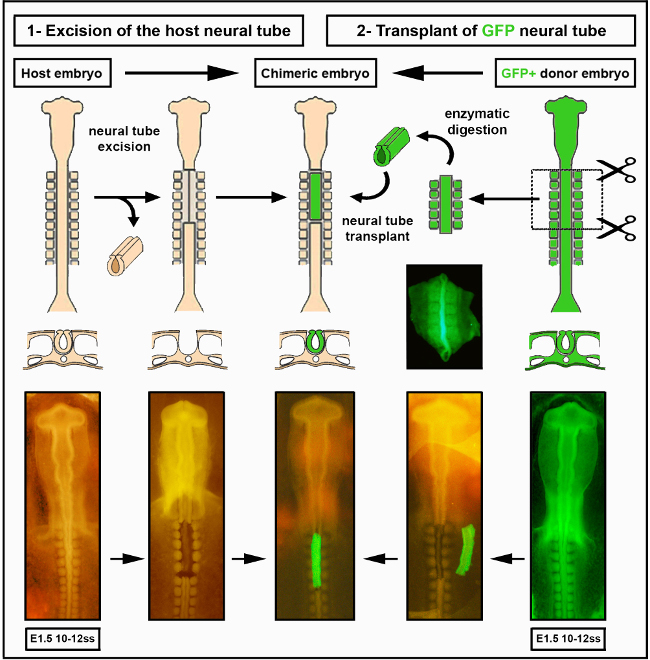
Şekil 2. İntraspes nöral tüp nakli. Civciv embriyosu/GFP nöral tüp görüntüleri Delalande ve ark. 12. İndüklenme, enterik nöral kret hücreleri tarafından bağırsak kolonizasyonu için gerekli değildir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
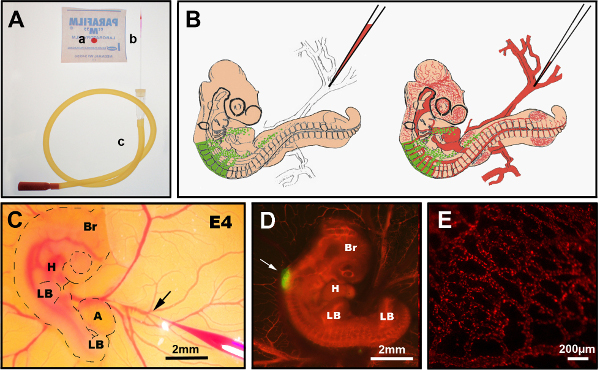
Şekil 3. İntravenöz DiI enjeksiyonu. (A) Önerilen aletler: a) CellTracker CM-DiI parafilm üzerine damla, b) çekilmiş cam enjeksiyon iğnesi, c) ağız tüpü. (B) E4 kimerik civciv embriyosuna intravenöz DiI enjeksiyonunun şematik şeması. (C) ovo DiI intravenöz enjeksiyonda, damara (ok) yerleştirilmiş DiI içeren ince cam iğne gösterir. (D) E4 chimeric embriyo sonrası DiI enjeksiyonu (kırmızı) GFP + nöral tüp (ok). (E) Canlı embriyoda DiI lekeli ince kan damarı ağı, enjeksiyon sonrası 24 saat. Br: beyin; H: kalp; LB: uzuv tomurcuk; A: allantois. (C) ve (D) öğelerindeki görüntüler Delalande ve ark. 12 İntrofik nöral kret hücreleri ile bağırsak kolonizasyonu için damarlanma gerekli değildir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
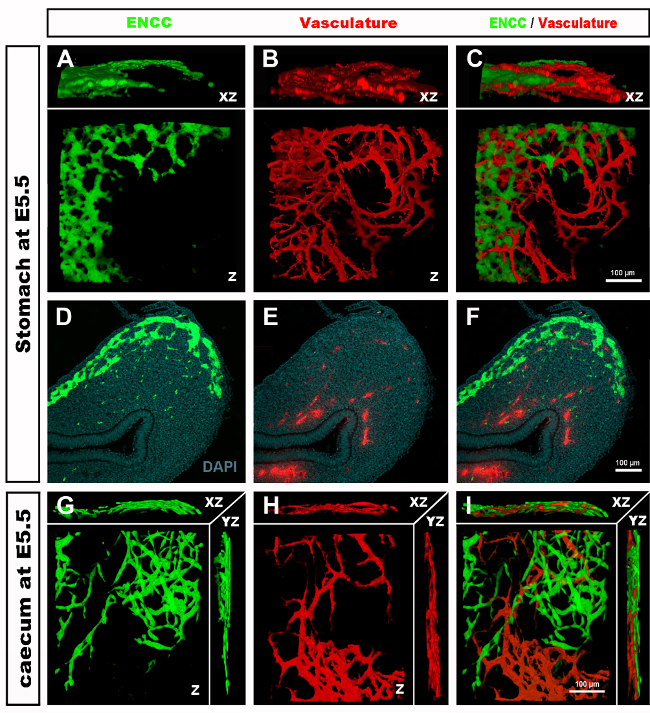
Şekil 4: Temsili bir E5.5 civciv embriyosunun mide ve caecum ile sonuçlanır. (A-C) Mide bölgesinde (D) GFP+ enterik nöral kret hücrelerini (ENCC) (E) Gösteren Bir Konfokal görüntü yığınının 3 boyutlu (3D) yeniden yapılandırılması DiI lekeli vasküler sistem ve (F ) her iki ağın birleştirilmiş görüntüsü D-F Histolojik bölümleri mide düzeyinde (G) GFP + ENCC (H) DiI lekeli vasküler sistemi ve (I) her iki ağın birleştirilmiş bir görüntüsünü gösterir. Çekirdekler DAPI (siyan) ile boyanmıştır. (G-H) (A) GFP+ ENCC geçiş cephesini yeşil, (B) DiI lekeli vasküler sistemi kırmızı ve (C) her iki ağın birleştirilmiş görüntüsünü gösteren bir konfokal görüntü yığınının 3B yeniden yapılandırılması. Resimler (A-F) Delalande ve ark. 12 İntrofik nöral kret hücreleri ile bağırsak kolonizasyonu için damarlanma gerekli değildir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
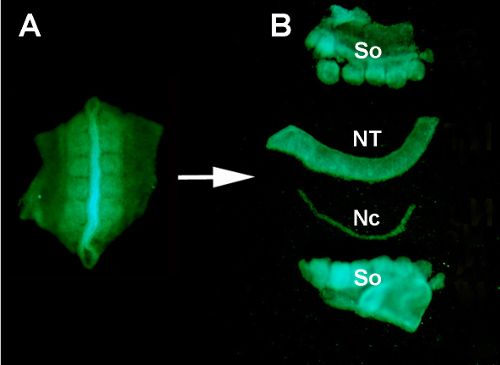
Şekil S1. Donör GFP+ nöral tüpün enzimatik sindirim ve mikro diseksiyon ile çevre dokulardan izolasyonu. (A) Donör embriyodan GFP+ nöral tüp ve bitişik somitler kesilerek. (B) Paslanmaz minutien pimler kullanılarak pankreas sindirimi ve mikro diseksiyondan sonra izole edilmiş nöral tüp. Yani: somites; NT: sinir tüpü; Nc: Notochord.
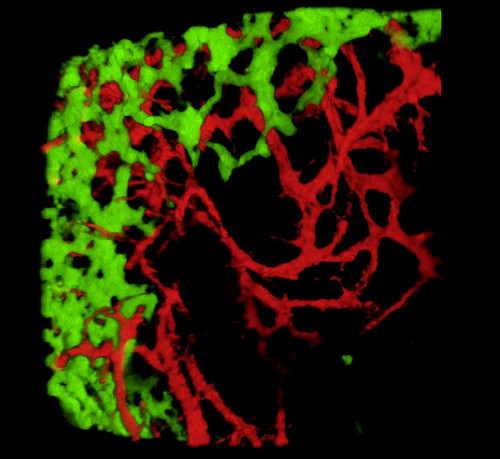
Video 1. Şekil 4C'deki görüntünün 3 boyutlu 360° dönüşü, midedeki damar sistemini ve ENCC'yi E5.5'te (HH27-28) gösterir. Bu videoyu görüntülemek için lütfen tıklayınız.
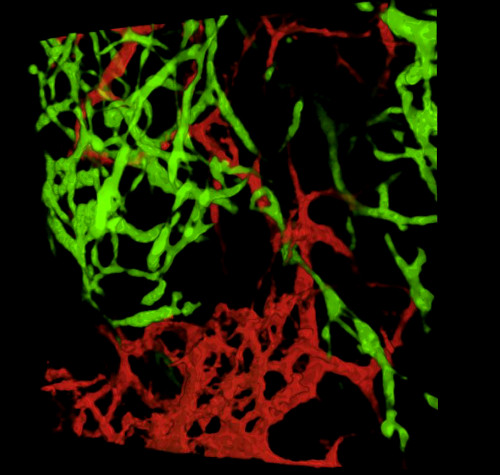
Video 2. Şekil 4I'deki görüntünün 3 boyutlu 360° dönüşü, E5.5 (HH27-28) adresindeki kaekum bölgesindeki damar sistemini ve ENCC göç cephesini gösterir. Bu videoyu görüntülemek için lütfen tıklayınız.
Tartışmalar
İntraspiller nöral tüp greftleme yöntemi, burada açıklanan kan damarı etiketlemesi ile birlikte, otonom sinir sistemi (ENS) ve vasküler sistemin bir elemanının birlikte gelişimini incelemek için yumurta içindeki kuş embriyosunun (diğer omurgalı embriyolarla karşılaştırıldığında) erişim kolaylığından tam olarak yararlanır.
NCC türevlerini etiketlemek için, tarif ettiğimiz civcivGFP-civciv intraspes greftleme yönteminin, 40 yıl önce1-3yıl önce kurulan klasik bıldırcın-civciv kimera yöntemine göre bir dizi avantajı vardır. İlk olarak, FITC ışığı altında, GFP floresan, GFP+ hücrelerinin canlı kimerik embriyolarda kolayca ayırt edilebilen ölçüde son derece parlaktır. Bu, greftin başarısının ovo'dakontrol edilmesini sağlarken, bıldırcın-civciv aşılaması embriyonun QCPN kullanılarak öldürülmesini, işlenmesini ve bağışıklık sisteminin kullanılmasını gerektirir, greftin başarısı tespit edilemeden önce2. İkincisi, transgenik civcivGFP'deki GFP ifadesi sitoplazmiktir, bu nedenle sadece hücre gövdelerini etiketlemekle kalmaz, aynı zamanda nakledilen hücrelerin projeksiyonlarının görselleştirilmesine izin verir22. Bu, karmaşık nöronal ağların yüksek çözünürlükte gözlemlenmesine izin sağlar (numune anti-GFP antikoru ile immünostain edildiğinde ince projeksiyonların en iyi şekilde görselleştirildiğini unutmayın). QCPN etiketlemesi bıldırcın hücresi çekirdeği ile sınırlı olduğundan, bu tür ağlar bıldırcın-civciv chimeras kullanılarak ortaya çıkmaz. Üçüncü olarak, tür içi aşılama, kimerik embriyodaki hücreler arasındaki potansiyel tür farklılıklarını ortadan kaldırır. Bıldırcın embriyoları civcivden daha kısa bir kuluçka süresine sahip olduğundan (19 güne karşı 21 gün) bıldırcın hücrelerinin civciv hücrelerinden daha yüksek bir çoğalma oranına sahip olduğu ve bunun kimerik dokuların gelişimini potansiyel olarak etkileyebileceği öne sürlenmiştir23. İlginçtir ki, bitkilerde türler arası aşılamanın konak 24'tekiDNA metilasyon desenlerinde kapsamlı değişiklikler üretebileceği gösterilmiştir. Dördüncüsü, civcivGFP, NCC kaderi ve hücre taahhüdü25gibi konuları ele almak için geri nakil deneylerini kolaylaştırır. Beşinci olarak, transgenik civcivGFP, GFP + hücre alt popülasyonlarının FACS tasnifleri, GFP + hücreleri içeren organların organotipik kültürü, GFP + aşılı dokunun ifade plazmidlerinin elektroporasyon yoluyla genetik manipülasyonu26ve optik projeksiyon tomografisi27gibi diğer görüntüleme teknolojileri gibi diğer birçok teknik için de yararlıdır.
Nöral tüp transplantasyon yaklaşımı, mikrocerrahi olarak daha kısa miktarlarda nöral tüp değiştirilerek değiştirilebilir. Daha küçük sinir tüpü segmentleri kullanılarak mikrocerrahi embriyoya potansiyel olarak daha az zarar verir ve sağkalım geliştirilebilir. Bununla birlikte, daha az sinir tüpü naklinin dezavantajı, konaktaki GFP + NCC sayısının azaltılacak olmasıdır. Kullanıcılar, embriyoların optimum hayatta kalmasını sağlamak için nakledilen nöral tüp miktarı ile konak bağırsak içindeki GFP + NCC sayıları arasında bilgilendirici sonuçlar vermek için yeterli bir denge kurmaya çalışabilir.
Gemi boyama için DiI, floresanlarının çok parlak ve sağlam olması avantajına sahiptir. Ayrıca, en iyi açılan kılcal damarların lekelenmesi için fiksasyon sırasında dağıtma kapasitesine sahiptir. Hayati bir boya olduğundan, embriyolar enjeksiyon prosedüründen sağ çıkabilir ve lekeli bir vasküler sistemle gelişmeye devam edebilir (lekelenme zamanla daha dakik hale gelse de, elimizde 24 saate kadar, bkz. Şekil 3E). Bu nedenle civcivGFP greftlemenin DiI vasküler boyama ile kombinasyonu canlı görüntüleme ile uyumludur. Tüm bu avantajların yanı sıra, vasküler enjeksiyonun sadece ışıklı damarları etiketlediğini ve bu nedenle açılmamış kılcal damarları, endotel uç hücrelerini veya izole endotel hücrelerini tanımlamadığını belirtmek önemlidir. Bununla birlikte, kuş transgenezinde daha fazla ilerleme, vasküler morfogenez28'iincelemek için Tg (tie1:H2B-eYFP) bıldırcın embriyolarını kullanan deneylerle örneklenen bu tür sorunları atlatmak için yeni yollar sağlayabilir. Bu tekniğin bir başka sınırlaması, E7.5 ve ötesindeki embriyolarda etkili damar etiketlemesi için, deneyleri pahalı hale getirebilecek daha büyük miktarlarda boya enjekte edilmesi gerektiğidir. Bununla birlikte, tekniğin bir modifikasyonu düşük maliyetli kan damarı etiketleme vurgulayıcı mürekkede14, bu yaklaşım elimizde denenmemiş olsa da.
Prosedürlerin kritik adımları, blastodisc'in altına mürekkep enjekte ederek embriyoyu görselleştirme işlemini içerir. Sarısını kaplayan zar bu aşamada mürekkep dolu iğne ile yırtılırsa embriyo sağkalımı ciddi şekilde tehlikeye girer. Ayrıca, bir donör sinir tüpü hazırlarken, dokunun pankreasta aşırı uzun süre bırakılmaması önemlidir (maksimum olarak yaklaşık 10 dakikayı düşünün). Pankreasa uzun süre maruz kalmak dokuya zarar verir ve sinir tüpünün kullanımı daha sonra zordur ve konak haline iyi dahil olmaz. DiI enjeksiyon tekniğinin vahşi tip embriyolar üzerinde deneyim kazanması, kimerik embriyoları enjekte etmeden önce gereklidir, çünkü her embriyo için genellikle sadece bir enjekte etme girişimi mümkündür. DiI hacmi ve iğne çapı her embriyo için kritik parametrelerdir ve vahşi tip, evre ile eşleştirilen kontroller üzerinde değerlendirilmelidir.
Sonuç olarak, canlı civciv embriyolarında nöral tüp nakli ve DiI damar boyama ikili etiketleme yöntemimiz organogenez sırasında NCC ve kan damarı ağları arasındaki ilişkileri araştırmak için kullanılabilir. Organ gelişimi sırasında doğru hedef innervasyonu ve vaskülerizasyonun kurulmasından sorumlu mekanizmaların hala büyük ölçüde bilinmediği göz önüne alındığında, bu metodoloji bu alanda gelecekteki keşifler için potansiyel barındırmaktadır.
Açıklamalar
Yazarlar rakip finansal çıkarları olmadığını beyan ederler.
Teşekkürler
Döllenmiş GFP tavuk yumurtaları Prof. Helen Sang, Roslin Enstitüsü ve İngiltere Edinburgh Üniversitesi tarafından sağlandı. Roslin Transgenik Tavuk Tesisi Wellcome Trust ve Biyoteknoloji ve Biyolojik Bilimler Araştırma Konseyi (BBSRC) tarafından finanse edilir. Çalışma kısmen finanse edildi ve NT, Great Ormond Street Hospital Children's Charity, Londra, İngiltere tarafından desteklendi. Yazarlar, embriyoların aşı için hazırlanmasına yardımcı olan UCL Çocuk Sağlığı Enstitüsü Ben Jevans'a teşekkür ediyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Fertilised chick eggs | Henry Stewart and Co, Louth, UK | ||
| Fertilised GFP chick eggs | The Transgenic Chicken Facility, The Roslin Institute, The University of Edinburgh | ||
| Egg incubator (Profi-H Hatcher) | Lyon Technologies, CA, USA | 910-033 | |
| 14C Incubator | Precision Cooled Incubator, Leec Ltd., Nottingham, UK | Model LT2 | |
| Stereo-microscope | LEICA | Model MZ 12.5 | |
| Digital Camera | LEICA | DC500 | |
| Image acquisition software | LEICA | IM50 | |
| Goose neck halogen cold light source | Advanced Imaging Concepts, Inc | KL 1500 LCD | |
| 181⁄2 G hypodermic needle | SIGMA - ALDRICH | HSWNH181 | |
| Pancreatin | SIGMA - ALDRICH | P3292 | |
| DMEM | SIGMA - ALDRICH | D5030 | |
| Goat serum | SIGMA - ALDRICH | G6767 | |
| 5 ml syringe | SIGMA - ALDRICH | Z248010 | |
| Mouth tube | SIGMA - ALDRICH | A5177 | |
| Sigma Pasteur pipettes non-plugged, L 5 3/4 in. | SIGMA - ALDRICH | S6018 | |
| Transfer pipettes, polyethylene | SIGMA - ALDRICH | Z350796 | |
| Borosillicate glass capillaries, thin wall without filament | Harvard apparatus | PY8 30-0035 | |
| Iris Scissors - ToughCut | Fine Science Tools | 14058-09 | |
| Curved Iris Scissors - ToughCut | Fine Science Tools | 14059-09 | |
| Needle holders (Nickel-plated pin holder) | Fine Science Tools | 26018-17 | |
| Pascheff-Wolff Spring Scissors | Fine Science Tools | 15371-92 | |
| Dumont #5 forceps | Fine Science Tools | 11251-30 | |
| Minutien pins | Fine Science Tools | 26002-15 | |
| Dumont AA forceps, Inox Epoxy- coated | Fine Science Tools | 11210-10 | |
| Perforated spoon | Fine Science Tools | 10370-18 | |
| Tungsten needles (0.125mm diameter) | Fine Science Tools | 10130-05 | |
| Sellotape (clear, 24 mm width) | Any Supplier | ||
| Pen/Strep (Penicillin, Streptomycin) Solution | VWR international | 101447-068 | |
| Sylgard 184 silicone elastomer kit | Dow Corning | S09 512 516 | |
| Pelikan black ink | Pelikan | 211-169 | |
| CellTracker CM-DiI | Molecular Probes | C-7001 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Molecular Probes | D1306 | |
| Settings for glass needle puller | Sutter Instruments | Flaming/Brown micropipette puller model P-86 | |
| Heat 950; Pull 150; Velocity 100; Time 200; Pressure 500 |
Referanslar
- Le Douarin, N. A biological cell labeling technique and its use in expermental embryology. Developmental Biology. 30, 217-222 (1973).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods in Molecular Biology. 461, 337-350 (2008).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods in Molecular Biology. 97, 305-318 (1999).
- Garcia-Castro, M., Bronner-Fraser, M. Induction and differentiation of the neural crest. Current Opinion In. Cell Biology. 11, 695-698 (1999).
- Bhatt, S., Diaz, R., Trainor, P. A. Signals and switches in Mammalian neural crest cell differentiation. Cold Spring Harbor Perspectives In Biology. 5, (2013).
- Burns, A. J., Douarin, N. M. The sacral neural crest contributes neurons and glia to the post-umbilical gut: spatiotemporal analysis of the development of the enteric nervous system. Development. 125, 4335-4347 (1998).
- Burns, A. J., Le Douarin, N. M. Enteric nervous system development: analysis of the selective developmental potentialities of vagal and sacral neural crest cells using quail-chick chimeras. The Anatomical Record. 262, 16-28 (2001).
- Burns, A. J., Delalande, J. M., Le Douarin, N. M. In ovo transplantation of enteric nervous system precursors from vagal to sacral neural crest results in extensive hindgut colonisation. Development. 129, 2785-2796 (2002).
- Burns, A. J., Champeval, D., Le Douarin, N. M. Sacral neural crest cells colonise aganglionic hindgut in vivo but fail to compensate for lack of enteric ganglia. Developmental Biology. 219, 30-43 (1006).
- Wang, X., Chan, A. K., Sham, M. H., Burns, A. J., Chan, W. Y. Analysis of the sacral neural crest cell contribution to the hindgut enteric nervous system in the mouse embryo. Gastroenterology. 141, 992-1002 (2011).
- Goldstein, A. M., Hofstra, R. M., Burns, A. J. Building a brain in the gut: development of the enteric nervous system. Clinical Genetics. 83, 307-316 (1111).
- Delalande, J. M., et al. Vascularisation is not necessary for gut colonisation by enteric neural crest cells. Developmental Biology. 385, 220-229 (2014).
- Anderson, R. B., Stewart, A. L., Young, H. M. Phenotypes of neural-crest-derived cells in vagal and sacral pathways. Cell And Tissue Research. 323, 11-25 (2006).
- Takase, Y., Tadokoro, R., Takahashi, Y. Low cost labeling with highlighter ink efficiently visualizes developing blood vessels in avian and mouse embryos. Development, Growth & Differentiation. 55, 792-801 (2013).
- Bates, D., Taylor, G. I., Newgreen, D. F. The pattern of neurovascular development in the forelimb of the quail embryo. Developmental Biology. 249, 300-320 (2002).
- Mayes, P., Dicker, D., Liu, Y., El-Deiry, W. Noninvasive vascular imaging in fluorescent tumors using multispectral unmixing. BioTechniques. 45, 459-460 (2008).
- Li, Y., et al. Direct labeling and visualization of blood vessels with lipophilic carbocyanine dye DiI. Nature Protocols. 3, 1703-1708 (2008).
- Eichmann, A., Thomas, J. L. Molecular parallels between neural and vascular development. Cold Spring Harbor Perspectives In Medicine. 3, a006551 (2013).
- Weinstein, B. M. Vessels and nerves: marching to the same tune. Cell. 120, 299-302 (2005).
- Carmeliet, P., Tessier-Lavigne, M. Common mechanisms of nerve and blood vessel wiring. Nature. 436, 193-200 (2005).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88, 49-92 (1951).
- Barraud, P., et al. Neural crest origin of olfactory ensheathing glia. Proceedings of the National Academy of Sciences of the United States of America. 107, 21040-21045 (2010).
- Senut, M. C., Alvarado-Mallart, R. M. Cytodifferentiation of quail tectal primordium transplanted homotopically into the chick embryo. Brain Research. 429, 187-205 (1987).
- Wu, R., et al. Inter-species grafting caused extensive and heritable alterations of DNA methylation in Solanaceae plants. PLoS One. 8, e61995 (2013).
- Freem, L. J., Delalande, J. M., Campbell, A. M., Thapar, N., Burns, A. J. Lack of organ specific commitment of vagal neural crest cell derivatives as shown by back-transplantation of GFP chicken tissues. The International Journal Of Developmental Biology. 56, 245-254 (2012).
- Delalande, J. M., et al. The receptor tyrosine kinase RET regulates hindgut colonization by sacral neural crest cells. Developmental Biology. 313, 279-292 (2008).
- Freem, L. J., et al. The intrinsic innervation of the lung is derived from neural crest cells as shown by optical projection tomography in Wnt1-Cre;YFP reporter mice. Journal of Anatomy. 217, 651-664 (2010).
- Sato, Y., et al. Dynamic analysis of vascular morphogenesis using transgenic quail embryos. PloS One. 5, e12674 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır