Method Article
Etiquetado Dual De Las Células De La Cresta Neural Y Los Vasos Sanguíneos Dentro De Los Embriones De Pollo Usando ChickGFP Injerto De Tubo Neural Y Carbocianina Tinte DiI Inyección
En este artículo
Resumen
Aquí divulgamos el etiquetado dual de las células de los nervios de la cresta y de los vasos sanguíneos usando el injerto intraespecies del tubo de los nervios del pollueloGFP combinado con la inyección intra-vascular de DiI. Esta técnica experimental nos permite visualizar y estudiar simultáneamente el desarrollo del sistema nervioso derivado de NCC (entérico) y del sistema vascular, durante la organogénesis.
Resumen
Todos los órganos en desarrollo necesitan estar conectados tanto al sistema nervioso (para el control sensorial y motor) como al sistema vascular (para el intercambio de gases, el suministro de líquidos y nutrientes). En consecuencia, tanto el sistema nervioso como el vascular se desarrollan uno junto al otro y comparten sorprendentes similitudes en su arquitectura de ramificación. Aquí divulgamos las manipulaciones embrionarias que nos permiten estudiar el desarrollo simultáneo del tejido nervioso cresta-derivado de los nervios (en este caso el sistema nervioso entérico), y del sistema vascular. Esto se logra mediante la generación de quimeras de pollo a través del trasplante de segmentos discretos del tubo neural, y la cresta neural asociada, combinado con la inyección vascular de DiI en el mismo embrión. Nuestro método utiliza embriones transgénicosde GFP de pollitos para el injerto intraespecífero, lo que hace que la técnica de trasplante sea más poderosa que el protocolo clásico de injerto interespecies codorniz-pollito utilizado con gran efecto desde la década de 1970. El injerto intraespecípeto depolluelos GFPfacilita la obtención de imágenes de células trasplantadas y sus proyecciones en tejidos intactos, y elimina cualquier sesgo potencial en el desarrollo celular vinculado a las diferencias de especies. Este método aprovecha al máximo la facilidad de acceso del embrión aviar (en comparación con otros embriones de vertebrados) para estudiar el desarrollo co-desarrollo del sistema nervioso entérico y el sistema vascular.
Introducción
El embrión de pollo es un organismo modelo invaluable en la biología del desarrollo de vertebrados, sobre todo porque su desarrollo en ovo permite manipulaciones experimentales que de otra manera son imposibles de realizar en vertebrados que se desarrollan en el útero. Esta accesibilidad y facilidad de manipulación ha llevado al embrión de polluelo a desempeñar un papel clave en muchos descubrimientos seminales en el campo de la biología del desarrollo. Entre las técnicas más poderosas ha estado el uso de embriones de quiméricos de codorniz-polluelo para estudiar el destino celular, un método iniciado por la profesora Nicole Le Douarin en la década de 19701-3. En particular, las quimeras de polluelos de codorniz han sido especialmente útiles para marcar genéticamente y seguir las poblaciones altamente migratorias de células de la cresta neural (NCC) durante el desarrollo temprano. Los NCC son una población multipotente de células migratorias, que surgen en el ectodermo dorsal en los márgenes del tubo neural, que dan lugar a una amplia gama de tipos celulares en todo el embrión de vertebrados. Estos incluyen estructuras craneofaciales (cartílago, hueso, músculos), neuronas y glía (en los sistemas nerviosos sensorial y autónomo), melanocitos y una subpoblación de células del sistema endocrino2,4,5. Uno de los factores más importantes que influyen en el destino del NCC es su ubicación inicial a lo largo del eje anterior-posterior del tubo neural. Por ejemplo, los NCC entéricos, que dan lugar a las neuronas y la glía del sistema nervioso entérico (ENS), surgen de dos subpominarias discretas: la primera localizada en la región vagal (cerebro posterior caudal), y la segunda en la región sacra del tubo neural6-13. El injerto inter o intraespecímil de las regiones correspondientes del tubo neural han sido las técnicas de elección para etiquetar permanentemente estas células y posteriormente permitir el seguimiento, desde su nacimiento en los márgenes del tubo neural, hasta sus destinos finales dentro del tracto digestivo6,7,10.
Otra manipulación embrionaria más fácil de realizar en pollitos, en comparación con otros modelos animales, es el etiquetado vital del sistema vascular. De hecho, a medida que el embrión de polluelo se desarrolla, se pone en la parte superior de una red vascular extra-embrionaria que hace circular el oxígeno y los nutrientes de la yema. Esta red vascular accesible, situada en la superficie de la yema, puede ser utilizada como puerta de entrada para etiquetar el sistema vascular en desarrollo del embrión durante la organogénesis12,14-17. La inyección intravascular de varios tintes, como el tinte lipofílico DiI, permite delinear/teñir todos los vasos luminizados de la naciente red vascular.
Debido a que los órganos en desarrollo necesitan estar conectados tanto al sistema nervioso (para el control sensorial y motor) como al sistema vascular (para el intercambio de gases, el suministro de líquidos y nutrientes), las dos redes se desarrollan una junto a la otra y comparten sorprendentes similitudes en su arquitectura de ramificación18-20. Aquí divulgamos las manipulaciones embrionarias que nos permiten estudiar el desarrollo simultáneo del ENS NCC-derivado, junto con el sistema vascular, durante organogénesis. Esto se logra mediante la generación de quimeras de pollo a través del trasplante de segmentos discretos del tubo neural, incluida la cresta neural, combinado con la inyección vascular de DiI. Como un avance de las quimeras de codorniz-pollo, nuestro método utiliza embriones transgénicos de pollitos GFP para el injerto intraespecípeto, haciendo que la técnica de trasplante sea más potente, en términos de células de imagen y sus proyecciones, y eliminando cualquier sesgo potencial vinculado a las diferencias de especies.
Protocolo
1. Preparación de micro-bisturí para ablaciones de tubo neural
- Dé forma a un micro-bisturí de una aguja de coser de acero disponible en el comercio.
- Primero aplane la aguja en ambos lados usando una muela montada en una amoladora de banco motorada.
- Comience a dar forma al bisturí, primero en una piedra de Arkansas de grado grueso usando un movimiento circular controlado, en direcciones alternativas, a ambos lados de la aguja.
- Continúe con los mismos movimientos de afilado en una piedra de Arkansas de grado extra fino para dar forma a un micro-bisturí ultra fino, con un borde de corte bien definido (Figura 1A, B).
NOTA: Las alternativas al micro-bisturí podrían ser agujas afiladas electrolímicamente, agujas de tungsteno disponibles en el mercado o agujas de vidrio tiradas.
2. Incubar huevos de tipo salvaje y GFP a la etapa deseada
- Almacene los huevos de gallina fertilizados y los huevos de gallina transgénicos de GFP en una incubadora enfriada a 14 - 15 ° C antes de la incubación, ya que el desarrollo se detiene a esta temperatura. Guarde los huevos durante unos días, hasta una semana.
- Para comenzar el desarrollo, coloque los huevos de tipo salvaje y GFP en una bandeja horizontalmente e incube simultáneamente en un humidificado (58 - 60%) incubadora a 37,5 ºC, de modo que los embriones se encuentran en etapas coincidentes para el injerto de tubo neural.
- Para obtener embriones en la etapa de desarrollo de 10 - 12 somitas para llevar a cabo injertos de tubo neural vagal, incubar óvulos durante 1,5 días (33 - 38 hrs) y en etapa embriones de acuerdo con las tablas de desarrollo de Hamburger y Hamilton21.
3. Preparar huevos para ventanas e injertos
- Mueva un huevo a la vez a un soporte de huevo hecho a medida para las ventanas. Haga un pequeño agujero en la cáscara del huevo tocando repetidamente, con tijeras rectas, en la superficie superior del extremo puntiagudo del huevo.
- Retire 2 - 3 ml de albúmina del huevo con una aguja hipodérmica de 181/2 G y una jeringa de 5 ml. La eliminación de la albúmina baja la yema dentro del huevo y facilita las ventanas posteriores sin causar ningún daño al embrión.
- Deseche la albúmina. Selle el agujero con una pequeña tira de cinta transparente cortada a su tamaño con tijeras finas.
- Usando tijeras curvas, toque otro agujero en la superficie superior de la cáscara del huevo. Inserte la punta de las tijeras en el agujero y, manteniendo las tijeras paralelas al banco, trabaje en un movimiento circular para cortar una ventana de ~ 2 cm de diámetro en la parte superior de la cáscara.
- Mantenga las tijeras en una posición estacionaria y gire el huevo. Deseche el disco eliminado de la cáscara del huevo. En E1.5, el embrión es reconocible como un disco amarillo más oscuro en la parte superior de la yema.
- Retire cualquier residuo de cáscara que haya caído dentro del huevo usando pinzas. Deseche cualquier huevo no fertilizado (identificado por una pequeña mancha blanca en la parte superior de la yema de color amarillo claro).
4. Preparar el embrión huésped para recibir tejido injertado
- Ajuste el microscopio estéreo al nivel de los ojos y optimice la orientación de la fuente de luz de cuello de cisne para iluminar adecuadamente el embrión sin causar reflejos.
- Para visualizar el embrión propiamente dicho,inyecte una pequeña cantidad de tinta india bajo el centro del disco amarillo más oscuro, utilizando un tubo bucal y una micro-pipeta de vidrio tirado(Figura 1C, Oii).
- Preparar la tinta 50:50 con PBS que contenga Penicilina/Estreptomicina a 100 μg/ml de concentración final. Inserte la micro-pipeta a través de la membrana de la yema fuera del perímetro del blastodermo y luego ángulo cuidadosamente su punta directamente debajo del embrión.
- Entregue tinta debajo del embrión soplando en el tubo de la boca. Si no se permite el pipeteo bucal, use una jeringa de 1 ml en su lugar. Tenga cuidado de no introducir burbujas de aire debajo del embrión, lo que puede conducir a la contaminación, luego retire cuidadosamente la micro-pipeta de vidrio. Este es un paso delicado que puede conducir a la muerte del embrión si no se hace con precisión.
- Escenificar el embrión por referencia a Hamburger y Hamilton21 y registrar el escenario en un libro de laboratorio.
- Usando un micro-bisturí hecho a medida (o una aguja de tungsteno fina) montado en un soporte de aguja, haga un jadeo muy pequeño en la membrana vitelina, junto al área donde se realizará la microcirugía.
- Aplique cuidadosamente de 2 a 3 gotas de PBS sobre el desgarro de la membrana (usando una micro-pipeta de vidrio y el tubo bucal) para crear espacio entre el embrión y la membrana. Corte una ventana más grande en la membrana para exponer toda la región donde se llevará a cabo la microcirugía.
- Retire la región del tubo neural de interés usando el micro-bisturí, comenzando con incisiones transversales rostrales y caudales en todo el tubo neural dorsal (a nivel de somita 1 a 7 en el video).
- Corte bilateralmente entre el tubo neural y los somitas para separar el tubo neural de los tejidos circundantes, sin dañar los somitas.
- Separe muy suavemente el tubo neural de la notocorda subyacente, que debe permanecer intacta. Tenga en cuenta que la escisión exitosa del tubo neural dejará todos los tejidos circundantes perfectamente intactos (Figura 2).
- Retire el tubo neural extirpado aspirando en una micro-pipeta de vidrio y, a continuación, deséchelo.
- Registre el nivel de ablación del tubo neural en un libro de laboratorio. El embrión huésped ya está listo para recibir el tubo neural del donante.
5. Preparar el tejido de injerto del donante
- Seleccione un embrión GFP con ventanas y adaptado al escenario visualizando bajo un microscopio estéreo fluorescente con filtro FITC. La fluorescencia GFP hace que sea muy fácil visualizar los somitas y estadificar el embrión.
- Una vez que se ha identificado un embrión emparejado con la etapa, retire el embrión del óvulo haciendo 4 incisiones, con tijeras de resorte Pascheff-Wolff(Figura 1C, l)en forma de rectángulo alrededor del embrión y luego recogerlo suavemente con una cuchara de embrión.
- Coloque el embrión en un vidrio de reloj cuadrado con una base de polímero de sigard. Agite suavemente el embrión con dumont #5 pinzas para eliminar cualquier yema adherida. Retire la membrana de vitelina y fije el embrión sobre la base del polímero utilizando pasadores de minucias inoxidables (Figura 1C).
- Usando las tijeras de resorte, haga 4 incisiones en forma rectangular alrededor del tubo neural y los somitas circundantes, en la misma región que se ha eliminado del embrión huésped.
- Usando una pipeta de transferencia de plástico, transfiera el tubo neural y los tejidos de somita del embrión de GFP donante a un vidrio de reloj que contenga pancreatina al 0,2% en PBS de pluma /estreptococo.
- Permita que la digestión enzimática proceda durante 10 minutos en RT para ayudar a separar los tejidos. Después de la incubación en enzima, use pasadores de minucias inoxidables montados en un mango para separar manualmente el tubo neural de todos los tejidos adyacentes.
- Usando una micro-pipeta de vidrio, transfiera el tubo neural disociado a otro vidrio de reloj que contenga DMEM + 10% de suero(por ejemplo,cabra, caballo o ternero fetal) sobre hielo, para enjuagar el exceso de pancreatina y detener la digestión enzimática. Después de 5 min, el tubo neural diseccionado está listo para ser injertado ortotópicamente en el huésped del polluelo(Figura 2 y S1).
6. Injertar el tejido
- Usando una micro-pipeta de vidrio, transfiera cuidadosamente el tubo neural diseccionado desde el vidrio del reloj al embrión huésped. Coloque el tubo neural en la orientación anterior-posterior correcta y empuje suavemente el explant adyacente a la región extirpada del huésped del polluelo usando el micro-bisturí. Deje un pequeño fragmento de ectodermo unido a, o cortando un pequeño nick en, la superficie dorsal para identificar la orientación del tubo neural.
- Si es necesario, use el micro-bisturí para recortar el explant al tamaño exacto de la región extirpada.
- Guíe suavemente el tubo neural hacia la región ablacional y colóquelo de tal manera que el lado dorsal esté correctamente orientado. Use una micro-pipeta de vidrio, montada en un tubo bucal, para eliminar el PBS y/o el líquido que rodea el injerto. Esto ayuda a que los tejidos del donante y del huésped se adhieran y que el injerto se establezca.
- Selle toda la ventana con cinta transparente de 24 mm de ancho para evitar la deshidratación y la contaminación.
- Etiquete el embrión quimérico marcando con un lápiz en la cáscara de huevo y registre su número en el libro de laboratorio. Devuelva el huevo a la incubadora para su posterior desarrollo.
7. Inyectar DiI en los vasos sanguíneos del embrión huésped
- En el punto de tiempo experimental deseado (aquí, 3 - 10 días después), recupere el embrión quimérico de la incubadora y retire la cinta transparente usando tijeras rectas para obtener acceso al embrión dentro del huevo.
- Si es necesario, amplíe la ventana en la cáscara usando las tijeras. Tenga cuidado de no dañar la membrana corioalantólica si está unida a la cáscara, lo que resultaría en hemorragia y pondría en peligro el etiquetado de los vasos sanguíneos.
- Elija una vena accesible en la yema asegurándose de que el flujo sanguíneo se dirija hacia el embrión. Elija un punto de ramificación de una de las venas vitelinas (Figura 3B, C).
NOTA: En E6.5 - E7.5, la membrana corioalantólica puede necesitar ser movida suavemente a un lado con pinzas para acceder a las venas de la yema. Después de E8.5, la única opción es inyectar en una de las venas de la membrana coriorantoica ya que, en esta etapa, la membrana corioalantórica cubre completamente el embrión. - Retire la membrana vitelina por encima del punto de inyección elegido con dos pinzas Dumont #5 desgarrando en direcciones opuestas.
- Rompa una aguja de vidrio tirada usando un #5 Dumont y ajuste su diámetro al tamaño aproximado de la vena antes de cargar con CellTracker CM-DiI. Hacer la solución de diI a 40 μg/μl en DMSO y almacenar a -20 °C. Preparar la solución de trabajo en sacarosa/PBS a 0,3 M a una concentración de 4 μg/μl.
- Aspirar entre 5 - 10 μl de DiI en sacarosa/PBS de 0,3 M en la aguja usando la succión con un tubo bucal. Los embriones más antiguos pueden requerir hasta 25 μl o más. A partir de E8.5, los embriones tienen venas más grandes y musculosas, que pueden necesitar mantenerse en posición con un #5 De Dumont antes de apuñalar con la aguja de vidrio cargada de DiI.
- Inserte rápidamente la aguja en la vena y sople constantemente con el tubo bucal para permitir que el DiI se una al flujo sanguíneo lentamente sin formar un coágulo. Alternativamente, utilice un inyector de presión para la administración de DiI.
8. Cosecha de embriones para seccionamiento o examen de montaje completo
- Para retener tanto DiI dentro del embrión como sea posible, coseche el embrión inmediatamente después de la inyección sacándolo en una cuchara perforada y cortando los vasos sanguíneos y los tejidos conectivos con un par de tijeras rectas, para liberar el embrión de la yema.
- Retire las membranas sueltas y diseccionar los órganos de interés(es decir,los pulmones y el tracto digestivo en este tutorial), teniendo mucho cuidado de no comprimir el tejido, lo que crea difusión del DiI. Fijar inmediatamente los tejidos por inmersión en 4% PFA durante 1 - 2 horas en RT.
- Enjuague el tejido durante 5 min en PBS, luego 15 min en PBS que contenga 5 μg/ml dapi. Monte las muestras en un portaobjetos de microscopio puenteado para el examen de montaje completo o incruste para la criosección.
Resultados
La Figura 1 muestra los instrumentos típicos necesarios para llevar a cabo el aislamiento microquirúrgico y el trasplante del tubo neural. La Figura 2 muestra el procedimiento de trasplante. Después del trasplante, los embriones se examinan para detectar el éxito del trasplante. Esto implica examinar el embrión bajo un microscopio de fluorescencia estéreo, típicamente la mañana después de la microcirugía, para detectar la presencia de NCC derivado del injerto (GFP +). Si el trasplante ha sido un éxito, entonces GFP + NCC se puede observar en las proximidades del tubo neural y en las vías de migración temprana que conducen hacia el foregut. Si el procedimiento no ha sido exitoso, GFP + NCC no se observará fuera del tubo neural, o si están presentes en el huésped pueden estar en números más pequeños. Estos embriones fracasados se desechan. Típicamente, 5-8 trasplantes de tubo neural se realizan en un día, y de estos el 80% son exitosos. Las razones para el trasplante fracasado del tubo de los nervios incluyen la muerte del embrión debido al daño tisular incurrido durante microcirugía, o la falta del tubo de los nervios para integrar en el embrión del anfitrión. Este último puede resultar de la colocación pobre del tubo de los nervios dentro del anfitrión o de un tubo de los nervios de mala calidad debido a la técnica pobre de la disección o de la exposición excesiva a la enzima de la disociación. El paso inicial de la investigación, así como los exámenes posteriores similares para las células de GFP+, es útil pues significa que el tiempo y los recursos no se desperdician realizando experimentos en los embriones que no tienen GFP-etiquetado NCC dentro de la tripa.
La Figura 3 muestra el procedimiento para la inyección de DiI de los vasos sanguíneos. La eficiencia /éxito de la técnica de inyección de DiI depende de: primero, cortar la aguja de inyección al diámetro óptimo para la vena objetivo, segundo un gesto preciso al insertar la aguja en la vena (para no perforar a través del otro lado), y tercero evitar que la aguja se taponice durante la inyección soplando a una velocidad constante. Si alguno de estos tres parámetros se realiza incorrectamente, el embrión sangrará o necesitará varias horas para recuperarse antes de que se haga un segundo intento, ya que la hemorragia hace que sea casi imposible volver a inyectarse inmediatamente. Los embriones exitosos deben seleccionarse inmediatamente mediante visualización bajo un microscopio de estereofluorescencia y deben ser diseccionados rápidamente. En los embriones exitosos, los vasos sanguíneos marcados con DiI están presentes en todo el embrión (Figura 3C,D) incluyendo lechos capilares (Figura 3D).
Tras la recolección de embriones y el examen de secciones de tejidos o tractos gastrointestinales de montaje completo, los resultados típicos revelan GFP + NCC dentro de la ENS primitiva y la estructura fina de las redes de vasos sanguíneos intestinales marcados con DiI (Figura 4) Las preparaciones de montaje completo se pueden examinar utilizando microscopía confocal mediante la cual las pilas de imágenes producen reconstrucciones tridimensionales (3D) que muestran las interrelaciones entre las proyecciones finas de las células GFP + ENS y el sistema vascular teñido de DiI (Figura 4 A-C; G-I; Videos 1 y 2).

Figura 1. Instrumentos de microcirugía recomendados. (A) micro-bisturí en forma de una aguja de coser. (B) piedra fina de Arkansas para dar forma a un micro-bisturí. (C) a) tijeras rectas, b) tijeras curvas, c) jeringa de 5 ml con aguja hipodérmica 181/2 G, d) pipeta de plástico, e) porta huevos a medida, f) tinta negra, g) vidrio de reloj cuadrado, h) vidrio de reloj cuadrado con base de sigard negro, i) micro-bisturí en el soporte de la aguja, j) pasadores minutien, k) aguja de minutien o tungsteno en el soporte de la aguja, l) tijeras de resorte Pascheff-Wolff, m) Dumont #5 pinzas, n) cuchara perforada, oi) aguja de transferencia corta tirada por el fuego, oii) aguja de entintado larga tirada por el fuego, p) tubo de boca. Haga clic aquí para ver una versión más amplia de esta figura.
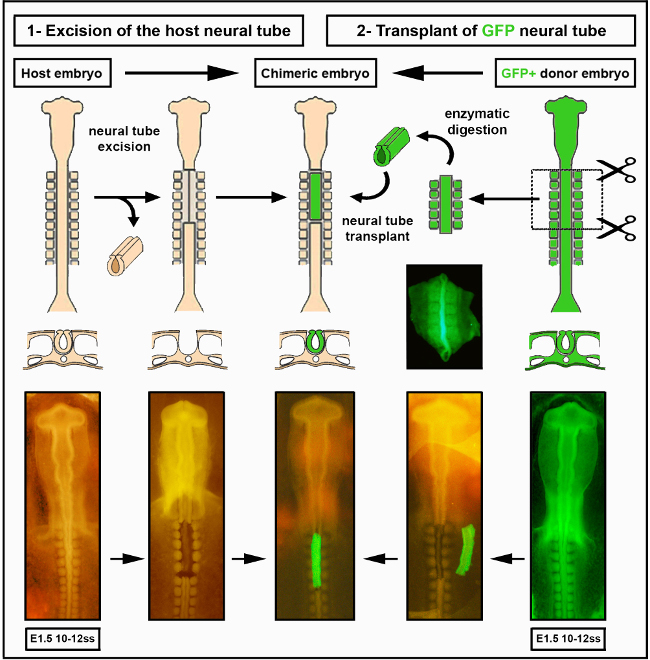
Figura 2. Trasplante de tubo neural intraespecies. Las imágenes del tubo neural del embrión de pollito/GFP se han modificado de Delalande et al. 12. La vascularización no es necesaria para la colonización intestinal por células de cresta neural entérica. Haga clic aquí para ver una versión más amplia de esta figura.
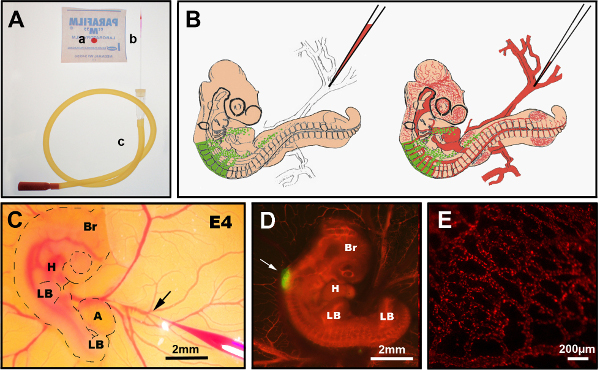
Figura 3. Inyección intravenosa de diI. (A) Instrumentos recomendados: a) CellTracker CM-DiI gota en parafilm, b) aguja de inyección de vidrio tirado, c) tubo de boca. (B) Diagrama esquemático de la inyección intravenosa de DiI en el embrión quimérico E4 del pollito. (C) en la inyección intravenosa de ovo DiI que muestra una aguja de vidrio fino que contiene DiI insertada en la vena (flecha). (D) Embrión quimérico E4 post inyección de DiI (rojo) con tubo neural GFP+ (flecha). (E) DiI manchó la red fina del vaso sanguíneo en un embrión vivo, poste-inyección de 24 horas. Br: cerebro; H: corazón; LB: brote de la extremidad; R: allantois. Las imágenes en (C) y (D) han sido modificadas de Delalande et al. 12. Vascularization no es necesario para la colonización de la tripa por las células de los nervios entéricas de la cresta. Haga clic aquí para ver una versión más amplia de esta figura.
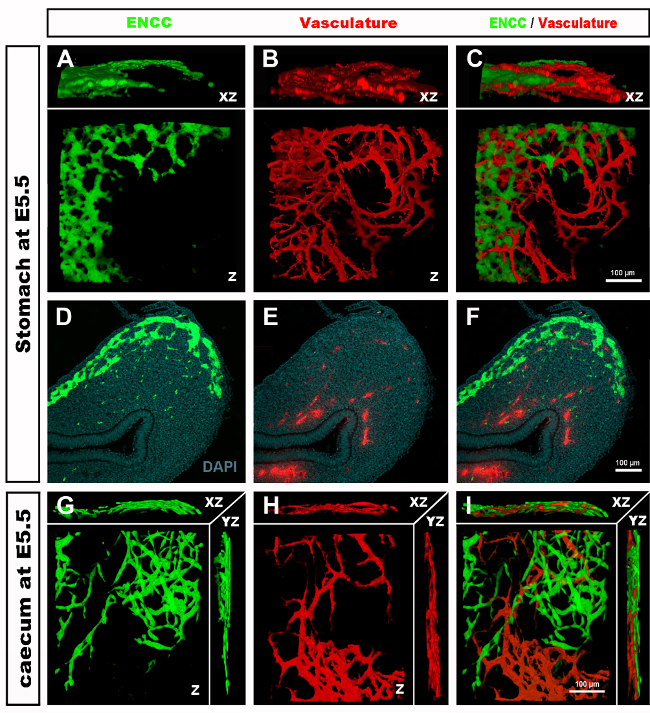
Figura 4: Resultados representativos en el estómago y el ciego de un embrión de pollito E5.5. (A-C) Reconstrucción de 3 dimensiones (3D) de una pila confocal de la imagen en la región del estómago que demuestra (d) las células de los nervios entéricas de la cresta de GFP+ (ENCC) (e) el sistema vascular manchado DiI y (f) una imagen combinada de ambas redes D-F secciones histológicas en el nivel del estómago que demuestra (G) el GFP+ ENCC (h) el diI manchó el sistema vascular y (i) una imagen combinada de ambas redes. Los núcleos se tiñen con DAPI (cian). (G-H) Reconstrucción 3D de una pila de imágenes confocales en la región del ciego que muestra (A) el frente de migración GFP + ENCC en verde, (B) el sistema vascular teñido de DiI en rojo, y (C) una imagen combinada de ambas redes. Las imágenes (A-F) han sido modificadas de Delalande et al. 12. Vascularization no es necesario para la colonización de la tripa por las células de los nervios entéricas de la cresta. Haga clic aquí para ver una versión más amplia de esta figura.
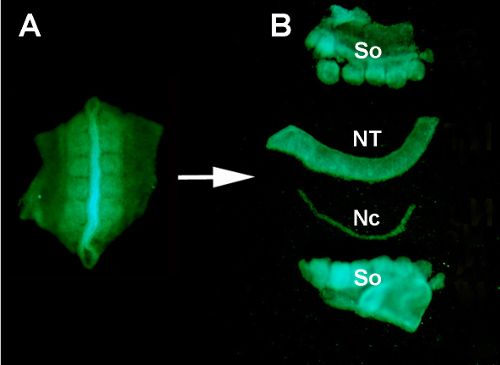
Figura S1. Aislamiento de un tubo de los nervios dispensador de aceite de GFP+ de los tejidos circundantes por la digestión enzimática y la micro-disección. (A) Tubo neural GFP+ y somitas adyacentes disecadas del embrión donante. (B) Tubo neural aislado después de la digestión de la pancreatina y la micro-disección usando los pernos inoxidables de minutien. Así: somitas; NT: tubo neural; Nc: Notocordio.
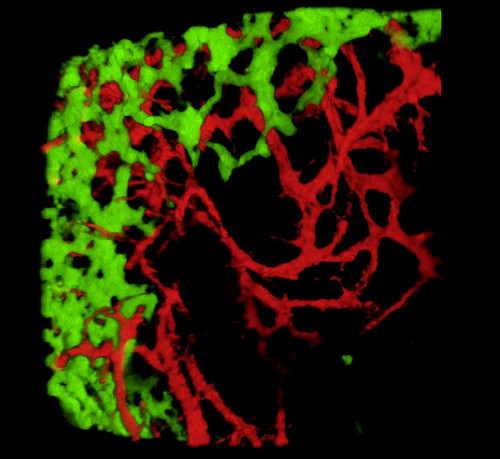
Vídeo 1. Rotación 3-dimensional de 360° de la imagen en la Figura 4C, mostrando el sistema vascular y el ENCC en el estómago en E5.5 (HH27-28). Haga clic aquí para ver este video.
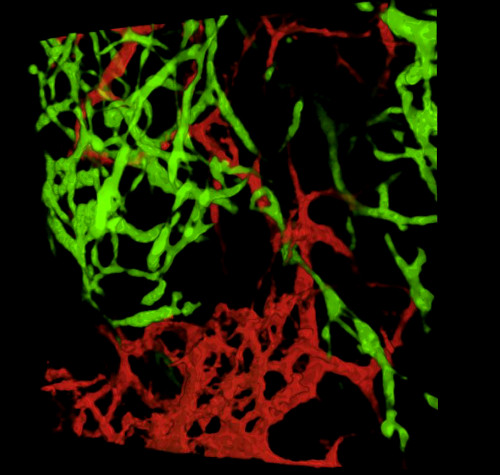
Vídeo 2. Rotación 3-dimensional 360° de la imagen en la Figura 4I, mostrando el sistema vascular y el frente de migración en la región del ciego en E5.5 (HH27-28). Haga clic aquí para ver este video.
Discusión
El método de injerto de tubo neural intraespecies, combinado con el etiquetado de vasos sanguíneos descrito aquí, aprovecha al máximo la facilidad de acceso del embrión aviar dentro del huevo (en comparación con otros embriones de vertebrados) para estudiar el desarrollo conjunto de un elemento del sistema nervioso autónomo (el ENS) y el sistema vascular.
Para el etiquetado de derivados de NCC, el método de injerto de chickGFP-chick intraspecies que describimos tiene una serie de ventajas sobre el método clásico de quimera de codorniz-pollito que se estableció hace más de 40 años1-3. En primer lugar, bajo la luz FITC, la fluorescencia de GFP es extremadamente brillante, en la medida en que las células de GFP + son fácilmente discernibles en embriones quiméricos vivos. Esto permite comprobar el éxito del injerto en ovo,mientras que el injerto de codorniz-pollito requiere que el embrión sea matado, procesado e inmunotenido utilizando QCPN, antes de que se pueda comprobar el éxito del injerto2. En segundo lugar, la expresión de GFP en el pollito transgénicoGFP es citoplasmática, por lo que no sólo etiqueta los cuerpos celulares, sino que también permite visualizar las proyecciones de las células trasplantadas22. Esto permite observar intrincadas redes neuronales a alta resolución (tenga en cuenta que las proyecciones finas se visualizan mejor cuando la muestra está inmunostained con anticuerpos anti-GFP). Como el etiquetado QCPN está restringido al núcleo de la célula de codorniz, tales redes no se revelan utilizando quimeras de codorniz-pollito. En tercer lugar, el injerto intraespecíptico elimina cualquier diferencia potencial de especies entre las células dentro del embrión quimérico. Dado que los embriones de codorniz tienen un período de incubación más corto que el polluelo (19 días frente a 21 días) se ha sugerido que las células de codorniz tienen una tasa de proliferación más alta que las células de polluelo, lo que podría afectar potencialmente el desarrollo de los tejidos quiméricos23. Curiosamente también, se ha demostrado en plantas que el injerto interespecies podría producir alteraciones extensas en los patrones de metilación del ADN en el huésped 24. En cuarto lugar, laGFP de polluelos facilita los experimentos de retroplante para abordar temas como el destino del NCC y el compromiso celular25. En quinto lugar, el pollito transgénicoGFP también es útil para muchas otras técnicas, incluyendo la clasificación FACS de subpoblaciones celulares GFP+, el cultivo organotípico de órganos que contienen células GFP+, la manipulación genética del tejido injertado GFP+ a través de la electroporación de plásmidos de expresión26,y otras tecnologías de imagen como la tomografía de proyección óptica27.
El acercamiento del trasplante del tubo de los nervios se puede modificar microsurgically substituyendo cantidades más cortas de tubo de los nervios. Mediante el uso de segmentos más pequeños del tubo neural, la microcirugía es potencialmente menos perjudicial para el embrión y la supervivencia puede mejorarse. Sin embargo, la desventaja de trasplantar menos tubo neural es que el número de GFP + NCC en el huésped se reducirá. Los usuarios podrían tratar de lograr un equilibrio entre la cantidad de tubo neural trasplantado para dar una supervivencia óptima de los embriones, y el número de GFP + NCC dentro del intestino huésped suficiente para dar resultados informativos.
Para la pintura de vasos, DiI tiene la ventaja de que su fluorescencia es muy brillante y robusta. Además, tiene la capacidad de difundir durante la fijación asegurando la tinción de los capilares abiertos más finos. Al tratarse de un colorante vital, los embriones pueden sobrevivir al procedimiento de inyección y seguir desarrollándose con un sistema vascular teñido (hasta 24 horas en nuestras manos, aunque la tinción se vuelve más punteada con el tiempo, ver Figura 3E). La combinación de injerto deGFP del polluelo con la pintura vascular de DiI es por lo tanto compatible con proyección de imagen viva. Además de todas estas ventajas, es importante tener en cuenta que la inyección vascular solo etiqueta los vasos luminizados y, por lo tanto, no identifica capilares sin abrir, células de punta endotelial o células endoteliales aisladas. Sin embargo, un mayor progreso en la transgénesis aviar podría proporcionar nuevas formas de eludir tales problemas, como lo ejemplifican los experimentos con embriones de codorniz Tg(tie1:H2B-eYFP) para estudiar la morfogénesis vascular28. Otra limitación de esta técnica es que, para un etiquetado eficaz de los vasos en embriones en E7.5 y más allá, es necesario inyectar mayores cantidades de tinte, lo que puede encarecer los experimentos. Sin embargo, una modificación de la técnica podría incluir el etiquetado de vasos sanguíneos de bajo costoutilando tinta deresaltador 14,aunque este enfoque no se ha probado en nuestras manos.
Los pasos críticos de los procedimientos incluyen el proceso de visualización del embrión inyectando tinta debajo del blastodisc. Si la membrana que cubre la yema es rasgada por la aguja llena de tinta en esta etapa, entonces la supervivencia del embrión se ve gravemente comprometida. Además, es importante, al preparar un tubo neural donante, que el tejido no se deje durante un tiempo excesivamente largo en pancreatina (considere aproximadamente 10 min como máximo). La exposición prolongada a la pancreatina daña el tejido y el tubo neural es entonces difícil de manejar y no se incorporará bien en el huésped. Adquirir experiencia en la técnica de inyección de DiI en embriones de tipo salvaje es esencial antes de inyectar embriones quiméricos, ya que generalmente solo es posible un intento de inyección para cada embrión. El volumen de DiI y el diámetro de la aguja son parámetros críticos para cada embrión y deben evaluarse en controles de tipo salvaje y estadios.
En conclusión, nuestro método de etiquetado dual de trasplante de tubo neural y pintura de vasos DiI en embriones de pollitos vivos se puede utilizar para investigar las interrelaciones entre el NCC y las redes de vasos sanguíneos durante la organogénesis. Teniendo en cuenta que los mecanismos responsables de establecer la inervación diana correcta y la vascularización durante el desarrollo de órganos son todavía en gran parte desconocidos, esta metodología tiene potencial para futuros descubrimientos en este campo.
Divulgaciones
Los autores declaran que no tienen intereses financieros contrapuestos.
Agradecimientos
Los huevos de gallina GFP fertilizados fueron suministrados por la Prof. Helen Sang, del Instituto Roslin, y la Universidad de Edimburgo, Reino Unido. La Roslin Transgenic Chicken Facility está financiada por el Wellcome Trust y por el Biotechnology and Biological Sciences Research Council (BBSRC). El trabajo fue financiado en parte, y NT apoyado, por Great Ormond Street Hospital Children's Charity, Londres, Reino Unido. Los autores agradecen a Ben Jevans, del Instituto de Salud Infantil de la UCL, por su ayuda en la preparación de embriones para injertos.
Materiales
| Name | Company | Catalog Number | Comments |
| Fertilised chick eggs | Henry Stewart and Co, Louth, UK | ||
| Fertilised GFP chick eggs | The Transgenic Chicken Facility, The Roslin Institute, The University of Edinburgh | ||
| Egg incubator (Profi-H Hatcher) | Lyon Technologies, CA, USA | 910-033 | |
| 14C Incubator | Precision Cooled Incubator, Leec Ltd., Nottingham, UK | Model LT2 | |
| Stereo-microscope | LEICA | Model MZ 12.5 | |
| Digital Camera | LEICA | DC500 | |
| Image acquisition software | LEICA | IM50 | |
| Goose neck halogen cold light source | Advanced Imaging Concepts, Inc | KL 1500 LCD | |
| 181⁄2 G hypodermic needle | SIGMA - ALDRICH | HSWNH181 | |
| Pancreatin | SIGMA - ALDRICH | P3292 | |
| DMEM | SIGMA - ALDRICH | D5030 | |
| Goat serum | SIGMA - ALDRICH | G6767 | |
| 5 ml syringe | SIGMA - ALDRICH | Z248010 | |
| Mouth tube | SIGMA - ALDRICH | A5177 | |
| Sigma Pasteur pipettes non-plugged, L 5 3/4 in. | SIGMA - ALDRICH | S6018 | |
| Transfer pipettes, polyethylene | SIGMA - ALDRICH | Z350796 | |
| Borosillicate glass capillaries, thin wall without filament | Harvard apparatus | PY8 30-0035 | |
| Iris Scissors - ToughCut | Fine Science Tools | 14058-09 | |
| Curved Iris Scissors - ToughCut | Fine Science Tools | 14059-09 | |
| Needle holders (Nickel-plated pin holder) | Fine Science Tools | 26018-17 | |
| Pascheff-Wolff Spring Scissors | Fine Science Tools | 15371-92 | |
| Dumont #5 forceps | Fine Science Tools | 11251-30 | |
| Minutien pins | Fine Science Tools | 26002-15 | |
| Dumont AA forceps, Inox Epoxy- coated | Fine Science Tools | 11210-10 | |
| Perforated spoon | Fine Science Tools | 10370-18 | |
| Tungsten needles (0.125mm diameter) | Fine Science Tools | 10130-05 | |
| Sellotape (clear, 24 mm width) | Any Supplier | ||
| Pen/Strep (Penicillin, Streptomycin) Solution | VWR international | 101447-068 | |
| Sylgard 184 silicone elastomer kit | Dow Corning | S09 512 516 | |
| Pelikan black ink | Pelikan | 211-169 | |
| CellTracker CM-DiI | Molecular Probes | C-7001 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Molecular Probes | D1306 | |
| Settings for glass needle puller | Sutter Instruments | Flaming/Brown micropipette puller model P-86 | |
| Heat 950; Pull 150; Velocity 100; Time 200; Pressure 500 |
Referencias
- Le Douarin, N. A biological cell labeling technique and its use in expermental embryology. Developmental Biology. 30, 217-222 (1973).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods in Molecular Biology. 461, 337-350 (2008).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods in Molecular Biology. 97, 305-318 (1999).
- Garcia-Castro, M., Bronner-Fraser, M. Induction and differentiation of the neural crest. Current Opinion In. Cell Biology. 11, 695-698 (1999).
- Bhatt, S., Diaz, R., Trainor, P. A. Signals and switches in Mammalian neural crest cell differentiation. Cold Spring Harbor Perspectives In Biology. 5, (2013).
- Burns, A. J., Douarin, N. M. The sacral neural crest contributes neurons and glia to the post-umbilical gut: spatiotemporal analysis of the development of the enteric nervous system. Development. 125, 4335-4347 (1998).
- Burns, A. J., Le Douarin, N. M. Enteric nervous system development: analysis of the selective developmental potentialities of vagal and sacral neural crest cells using quail-chick chimeras. The Anatomical Record. 262, 16-28 (2001).
- Burns, A. J., Delalande, J. M., Le Douarin, N. M. In ovo transplantation of enteric nervous system precursors from vagal to sacral neural crest results in extensive hindgut colonisation. Development. 129, 2785-2796 (2002).
- Burns, A. J., Champeval, D., Le Douarin, N. M. Sacral neural crest cells colonise aganglionic hindgut in vivo but fail to compensate for lack of enteric ganglia. Developmental Biology. 219, 30-43 (1006).
- Wang, X., Chan, A. K., Sham, M. H., Burns, A. J., Chan, W. Y. Analysis of the sacral neural crest cell contribution to the hindgut enteric nervous system in the mouse embryo. Gastroenterology. 141, 992-1002 (2011).
- Goldstein, A. M., Hofstra, R. M., Burns, A. J. Building a brain in the gut: development of the enteric nervous system. Clinical Genetics. 83, 307-316 (1111).
- Delalande, J. M., et al. Vascularisation is not necessary for gut colonisation by enteric neural crest cells. Developmental Biology. 385, 220-229 (2014).
- Anderson, R. B., Stewart, A. L., Young, H. M. Phenotypes of neural-crest-derived cells in vagal and sacral pathways. Cell And Tissue Research. 323, 11-25 (2006).
- Takase, Y., Tadokoro, R., Takahashi, Y. Low cost labeling with highlighter ink efficiently visualizes developing blood vessels in avian and mouse embryos. Development, Growth & Differentiation. 55, 792-801 (2013).
- Bates, D., Taylor, G. I., Newgreen, D. F. The pattern of neurovascular development in the forelimb of the quail embryo. Developmental Biology. 249, 300-320 (2002).
- Mayes, P., Dicker, D., Liu, Y., El-Deiry, W. Noninvasive vascular imaging in fluorescent tumors using multispectral unmixing. BioTechniques. 45, 459-460 (2008).
- Li, Y., et al. Direct labeling and visualization of blood vessels with lipophilic carbocyanine dye DiI. Nature Protocols. 3, 1703-1708 (2008).
- Eichmann, A., Thomas, J. L. Molecular parallels between neural and vascular development. Cold Spring Harbor Perspectives In Medicine. 3, a006551 (2013).
- Weinstein, B. M. Vessels and nerves: marching to the same tune. Cell. 120, 299-302 (2005).
- Carmeliet, P., Tessier-Lavigne, M. Common mechanisms of nerve and blood vessel wiring. Nature. 436, 193-200 (2005).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88, 49-92 (1951).
- Barraud, P., et al. Neural crest origin of olfactory ensheathing glia. Proceedings of the National Academy of Sciences of the United States of America. 107, 21040-21045 (2010).
- Senut, M. C., Alvarado-Mallart, R. M. Cytodifferentiation of quail tectal primordium transplanted homotopically into the chick embryo. Brain Research. 429, 187-205 (1987).
- Wu, R., et al. Inter-species grafting caused extensive and heritable alterations of DNA methylation in Solanaceae plants. PLoS One. 8, e61995 (2013).
- Freem, L. J., Delalande, J. M., Campbell, A. M., Thapar, N., Burns, A. J. Lack of organ specific commitment of vagal neural crest cell derivatives as shown by back-transplantation of GFP chicken tissues. The International Journal Of Developmental Biology. 56, 245-254 (2012).
- Delalande, J. M., et al. The receptor tyrosine kinase RET regulates hindgut colonization by sacral neural crest cells. Developmental Biology. 313, 279-292 (2008).
- Freem, L. J., et al. The intrinsic innervation of the lung is derived from neural crest cells as shown by optical projection tomography in Wnt1-Cre;YFP reporter mice. Journal of Anatomy. 217, 651-664 (2010).
- Sato, Y., et al. Dynamic analysis of vascular morphogenesis using transgenic quail embryos. PloS One. 5, e12674 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados