Method Article
إثراء خارج الخلية مصفوفة البروتينات من الأنسجة والهضم في الببتيدات لتحليل الطيف الكتلي
In This Article
Summary
This protocol describes a procedure for enriching ECM proteins from tissues or tumors and deglycosylating and digesting the ECM-enriched preparations into peptides to analyze their protein composition by mass spectrometry.
Abstract
المصفوفة خارج الخلية (ECM) هي شبكه معقدة من البروتينات عبر ربط تقدم العظة الفيزيائية الحيوية والكيميائية الحيوية التي هي المنظمين الرئيسية لتكاثر الخلايا، البقاء على قيد الحياة، والهجرة، وما إلى ذلك ECM يلعب دورا هاما في التنمية والأمراض المتنوعة بما في ذلك أمراض القلب والأوعية الدموية والأمراض العضلي والهيكل العظمي، والتليف والسرطان. وهكذا، واصفا تكوين موبينيل من الأنسجة الطبيعية والمريضة يمكن أن تؤدي إلى التعرف على المؤشرات الحيوية النذير والتشخيص جديدة وأهداف علاجية جديدة محتملة. ومع ذلك، جعلت طبيعة البروتينات ECM (كبيرة الحجم، عبر ربط والمربوطة تساهمي، الغليكوزيلاتي بشكل كبير) التحاليل البيوكيميائية من موبينيل تحديا. للتغلب على هذا التحدي، قمنا بتطوير طريقة لإثراء موبينيل من الأنسجة والأورام الطازجة أو المجمدة التي تستفيد من الذوبان من البروتينات ECM. وصفنا هنا في التفاصيل الإجراء decellularization التي تتكون من أنا متسلسلncubations في مخازن درجة الحموضة المختلفة وتركيز الملح والمنظفات وتكون نتيجتها 1) استخراج داخل الخلايا (عصاري خلوي والطاقة النووية، وغشاء هيكل الخلية) البروتينات و2) إثراء البروتينات ECM. نحن ثم تصف كيفية deglycosylate وهضم البروتين الاستعدادات التخصيب ECM في الببتيدات لتحليلها لاحقا من قبل مطياف الكتلة.
Introduction
المصفوفة خارج الخلية (ECM) هي شبكه معقدة من البروتينات عبر ربط والغليكوزيلاتي الذي يوفر الدعم المعماري ومرسى للخلايا ويعرف، في جزء منه، خصائص الأنسجة "النشاط الحيوي 1،2. إشارة البروتينات ECM أيضا على الخلايا إما مباشرة من خلال مستقبلاتها (على سبيل المثال، integrins، syndecans، الخ) أو عن طريق تحوير عامل النمو يشير 3. وبالتالي يوفر ECM العظة الفيزيائية الحيوية والكيميائية الحيوية التي هي المنظمين الرئيسية للعمليات الخلوية مثل انتشار والبقاء، والاستقطاب، والتمايز، والهجرة، الخ
وECM يلعب دورا رئيسيا في علم وظائف الأعضاء والتنمية والشيخوخة 4. وعلاوة على ذلك، وتسبب العديد من الأمراض، مثل أمراض القلب والأوعية الدموية، والتليف، وأمراض العضلي والهيكل العظمي، وأمراض السرطان، من قبل، أو يؤدي إلى والتعديلات ECM. وعلاوة على ذلك، يساهم ECM في الحفاظ على محاريب الخلايا الجذعية وتحديد جزيئات ECM الرئيسية عشرفي دعم stemness سيكون التطبيق المباشر في هندسة الأنسجة والطب التجديدي 5. ومع ذلك، على الرغم من أهميتها، ظلت ECM، حتى وقت قريب، اكتشافها بعد 6.
في سيليكون وقد كشف التحليل أن matrisome، الذي يعرف بأنه مجموعة متكاملة من ECM والبروتينات المرتبطة ECM، ويضم منتجات من عدة مئات من الجينات في كل من الإنسان والفأر الجينوم 1،7،8. ومع ذلك، فإن الذوبان من البروتينات ECM أعاق توصيف منهجي للتكوين في الجسم الحي مصفوفات خارج الخلية من العينات الطبيعية والمرضية. نحن في الآونة الأخيرة أظهرت أن هذا الذوبان يمكن أن تتحول إلى ميزة ويمكن استخدامها لتخصيب البروتينات ECM 8-10. نحن وغيرنا أثبتت أيضا أن قياس الطيف الكتلي هو الأسلوب المفضل لتوصيف تكوين موبينيل 8-10، 13.
نحنهنا وصف الإجراء decellularization التي تتكون من حضانات متتابعة في مخازن درجة الحموضة المختلفة وتركيز الملح والمنظفات. ويؤدي هذا الإجراء في استخراج (أو استنزاف) من عصاري خلوي والطاقة النووية، وغشاء هيكل الخلية البروتينات وإثراء البروتينات ECM. نحن ثم تصف كيفية هضم البروتين الاستعدادات التخصيب ECM في الببتيدات لتحليلها لاحقا من قبل مطياف الكتلة.
باستخدام الإجراءات التفصيلية ويتضح هنا، لقد أثرى بنجاح وتتميز قياس الطيف الكتلي مصفوفات خارج الخلية من عشرة الأنسجة المختلفة وأنواع الأورام: سرطان الرئة طبيعية الفئران 8 والبشرية والقولون الفئران 8،9، الكبد البشري 9، وأورام القولون والمستقيم الإنسان والمشتقة الانبثاث الكبد 9، xenografts سرطان الجلد 8، xenografts ورم الثدي 10، الجزر البنكرياسية الفئران وinsulinomas الفئران (النبأ آخرون، غير منشورة). مقارنة بين matrisom مختلفةكشفت وفاق التوقيعات ECM نسيجيا وورم محددة من شأنه أن يزيد أن تستخدم المؤشرات الحيوية التشخيص أو النذير المحتملة.
ونحن نعتقد أن هذا الإجراء يمكن تطبيقها على عينات أخرى أو مع أي تعديلات طفيفة نسبيا.
Protocol
ملاحظة: يمكن إجراء الإجراء على الأنسجة الطازجة أو المجمدة فلاش. ونحن نوصي perfusing الأنسجة أوعية دموية للغاية مع برنامج تلفزيوني في وقت تشريح للقضاء على خلايا الدم الحمراء وبروتينات البلازما. نحن لا ننصح إجراء الإجراء على الأنسجة الثابتة كما تثبيت (أي، يشابك الكيميائية) يتداخل مع decellularization ويمكن أيضا بخرق كبير لاحق تحليل الطيف الكتلي. لهذا الإجراء بأكمله، ونحن نوصي باستخدام أنابيب المنخفض الاحتفاظ ونصائح ماصة لتحقيق أقصى قدر من البروتين والببتيد الانتعاش.
1. Decellularization من الأنسجة أو الأورام
ملاحظة: قبل البدء، وإعداد الكواشف وإضافة مثبطات الأنزيم البروتيني (المقدمة مع المقصورة عدة استخراج البروتين) إلى حجم المطلوب من كل العازلة. يجب أن تبقى جميع مخازن والعينات على الجليد لمدة التجربة باستثناء CS العازلة التي تحتاج إلى أن تبقى في RT لمنع SDS precipitation.
ملاحظة: بروتوكول يستخدم سلسلة من الحضانة في مخازن درجة الحموضة المختلفة والتي تحتوي على كمية مختلفة من الأملاح والمنظفات لبالتسلسل استخراج البروتينات داخل الخلايا وإثراء للبروتينات ECM غير قابلة للذوبان (الشكل 1، الجدول 1؛ انظر أيضا مناقشة عن بدائل لاستخدام مجموعة تجارية مفصلة هنا). كميات الكواشف الواردة أدناه هي ل100 ملغ من الأنسجة أو الأورام (انظر الجدول 1) وتحتاج إلى تعديلها بشكل مناسب.
- التجانس 100 ملغ من الأنسجة في 500 ميكرولتر من العازلة C التي تحتوي على مثبطات الأنزيم البروتيني باستخدام الخالط الأنسجة حتى يتم تعطيل الأنسجة تماما، ويتم الحصول على تعليق متجانسة.
ملاحظة: إضافة ديوكسي ريبونيوكلياز I (تركيز النهائي: 200 ميكروغرام / مل، وأعيد تشكيلها وفقا لتعليمات الشركة الصانعة) وريبونوكلياز A (تركيز النهائي: 20 ميكروغرام / مل، وأعيد تشكيلها وفقا لتعليمات الشركة الصانعة) لعازلة N. - استخراج متتابعة من بروتينات قابلة للذوبان داخل الخلايا
- استخراج البروتينات عصاري خلوي. احتضان جناسة على محور دوار أنبوب لمدة 20 دقيقة على 4 درجات مئوية. حفظ قسامة صغيرة (10 ميكرولتر من 20 ميكرولتر) من جناسة لاحقا تحليل لطخة غربية (انظر القسم النتائج المتوقعة والشكل 2).
- أجهزة الطرد المركزي لجناسة في 16000 x ج لمدة 20 دقيقة على 4 درجات مئوية. جمع طاف في أنبوب نظيفة، وهذا سوف يشكل جزء عصاري خلوي (C) للتحليل لطخة غربية. فلاش تجميد هذا الكسر وتخزينها في -80 ° C.
- أن يغسل، resuspend وبيليه في 400 ميكرولتر من العازلة W تحتوي على مثبطات الأنزيم البروتيني، واحتضان العينة على محور دوار أنبوب لمدة 20 دقيقة على 4 درجات مئوية. أجهزة الطرد المركزي لجناسة في 16000 x ج لمدة 20 دقيقة على 4 درجات مئوية. تجاهل طاف.
- لاستخراج، والبروتينات النووية، Resuspend وبيليه في 150 ميكرولتر من العازلة N تحتوي على مثبطات الأنزيم البروتيني، deoxyribonucleaI حد ذاته وريبونوكلياز ألف واحتضان العينة على محور دوار أنبوب لمدة 30 دقيقة على 4 درجات مئوية.
- أجهزة الطرد المركزي في العينة 16000 x ج لمدة 30 دقيقة في 4 درجات مئوية وجمع طاف في أنبوب نظيفة. كرر هذه الخطوة مرة واحدة: بعد الطرد المركزي العينة للمرة الثانية، إضافة إلى طاف طاف السابق: فإن ذلك سيشكل النووي (N) جزء من تحليل لطخة غربية. فلاش تجميد هذا الكسر وتخزينها في -80 ° C. ثم، نفذ الغسيل وفقا خطوة 1.2.3.
- لاستخراج البروتينات الغشاء، resuspend وبيليه في 100 ميكرولتر من العازلة M التي تحتوي على مثبطات الأنزيم البروتيني، واحتضان العينة على محور دوار أنبوب لمدة 30 دقيقة على 4 درجات مئوية. أجهزة الطرد المركزي في العينة 16000 x ج لمدة 30 دقيقة في 4 درجات مئوية
- جمع طاف في أنبوب نظيف: هذا سوف تشكل جزء الغشاء (M) للتحليل لطخة غربية. فلاش تجميد هذا الكسر وتخزينها في -80 ° C.
- لاستخراج البروتينات هيكل الخلية، resuspend الكرية في 200 ميكرولتر من العازلة CS التي تحتوي على مثبطات الأنزيم البروتيني، واحتضان العينة على محور دوار أنبوب لمدة 30 دقيقة في RT.
لاحظ أن بيليه لن تذوب تماما. نقترح تعطيل بيليه بواسطة pipetting صعودا ونزولا حتى مراقبة تعطيل بيليه. - أجهزة الطرد المركزي في العينة 16000 x ج لمدة 30 دقيقة في RT. جمع طاف في أنبوب نظيفة. نلاحظ في هذه المرحلة إلى مزيد من الانخفاض الملحوظ في حجم الكرية (انظر الفيديو).
- Resuspend وبيليه في 150 ميكرولتر من العازلة C مثبطات الأنزيم البروتيني تحتوي على واحتضان العينة على محور دوار أنبوب لمدة 20 دقيقة على 4 درجات مئوية. أجهزة الطرد المركزي في العينة 16000 x ج لمدة 20 دقيقة على 4 درجات مئوية.
- جمع طاف وإضافته إلى طاف السابق: فإن ذلك سيشكل جزء هيكل الخلية (CS) من تحليل لطخة غربية. فلاش تجميد هذا الكسر وتخزينها في -80 ° C.
- أداء يغسل إضافية. Resuspend وبيليه في 500 ميكرولتر من PBS تحتوي على مثبطات الأنزيم البروتيني لالثانية احتضان العينة على محور دوار أنبوب لمدة 5 دقائق على 4 درجات مئوية. أجهزة الطرد المركزي في العينة 16000 x ج لمدة 5 دقائق عند 4 درجات مئوية. تجاهل طاف. كرر هذه الخطوة ثلاث مرات.
ملاحظة: جميع آثار المنظفات تحتاج إلى إزالتها عن طريق يغسل واسعة قبل هضم البروتينات إلى ببتيدات (انظر القسم 3). في هذه المرحلة، يمكن للبيليه التخصيب ECM يكون فلاش المجمدة والاحتفاظ بها في -80 ° C. لاحظ أن حجم الكرية سوف تعتمد على كمية غير قابلة للذوبان (ECM) البروتينات في المواد البداية وكفاءة decellularization.
2. مراقبة الجودة من Decellularization / ECM التخصيب بحلول SDS-PAGE والغربية وصمة عار
- مزيج 10-20 ميكرولتر قسامة من إجمالي استخراج الأنسجة و50 مكل من كسور متوسطة مع Laemmli العازلة التي تحتوي على 100 ملي DTT. Resuspend والتخصيب ECM، جزء غير قابل للذوبان في 3X Laemmli العازلة التي تحتوي على 100 ملي DTT.
ملاحظة: إنه رفع تركيزاتمن DTT وSDS المساعدة في إذابة البروتينات ECM التي هي غير قابلة للذوبان نسبيا. - فصل البروتينات بواسطة SDS-PAGE ونقل على الأغشية النيتروسليلوز.
- أداء البقع المناعية باستخدام أجسام مضادة لمراقبة ممثل البروتينات لكل من عصاري خلوي والطاقة النووية، غشاء، هيكل الخلية وECM الكسور (انظر القسم ممثل النتائج، جدول 2 والشكل 2).
3. في حل هضم البروتينات إلى ببتيدات لتحليل الطيف الكتلي
ملاحظة: بيليه الحصول عليها بعد إجراء decellularization وإزالة SDS هي غنية جدا في البروتينات ECM غير قابلة للذوبان لمزيد من التحليل بواسطة مطياف الكتلة تحتاج هذه البروتينات ليتم هضمها في الببتيدات. لاحظ أنه نتيجة لECM البروتين الذوبان، فإنه من غير الممكن في هذه الخطوة لقياس تركيز البروتين من العينة. وبالتالي نحن نقدم أحجام الكواشف لهضم ECM-ENRIعينات جنة التعليم العالي في الببتيدات على أساس حجم (مم) أو الوزن الجاف للبيليه التخصيب ECM (الجدول 3). تحتاج إلى أن تكون مستعدة طازجة الحلول من بيكربونات الأمونيوم واليوريا، DTT، iodoacetamide وحمض trifluoroacetic جميع.
- Resuspend وعينة التخصيب ECM عن طريق إضافة حجم مناسب من 8 M اليوريا إلى بيليه التخصيب ECM وإضافة DTT بتركيز نهائي من 10MM (انظر الجدول 3). احتضان مع الإثارة مستمرة في 1400 دورة في الدقيقة لمدة 2 ساعة على 37 درجة مئوية.
ملاحظة: في هذه المرحلة البروتينات ECM لن يتم حلها بشكل كامل ويجب عدم تجاهل جزيئات البروتين الكبيرة بشكل واضح عن طريق الطرد المركزي أو الترشيح. وتعليق واضحة على deglycosylation والهضم (انظر الفيديو). - الألكلة
- إعداد الحل iodoacetamide في الماء HPLC الصف. تبرد العينة إلى RT وإضافة iodoacetamide إلى التركيز النهائي من 25 مم. لالألكلة كاملة، وDTT: يجب أن تكون نسبة iodoacetamide بين 1: 2.5 و 1: 3.
- احتضان في الظلام لمدة 30 دقيقة في RT.
- Deglycosylation:
وهناك حاجة deglycosylation لإزالة السلاسل الجانب الكربوهيدرات التي تتداخل مع تحديد الببتيدات المعدلة N -linked بالغليكوزيل: مذكرة.- تمييع إلى 2 M اليوريا مع 100 ملي بيكربونات الأمونيوم الرقم الهيدروجيني 8.0 وإضافة كمية مناسبة من PNGaseF (انظر الجدول 3). احتضان مع الإثارة مستمرة في 1400 دورة في الدقيقة لمدة 2 ساعة على 37 درجة مئوية.
- الهضم
- إضافة ليز-C واحتضان مع الإثارة مستمرة في 1400 دورة في الدقيقة لمدة 2 ساعة على 37 درجة مئوية. إضافة التربسين واحتضان مع الإثارة مستمرة في 1400 دورة في الدقيقة O / N عند 37 درجة مئوية.
ملاحظة: تعليق-ECM الغنية التي بدأت غائمة على إعادة الأولية في 8M اليوريا تظهر واضحة بعد O / N الهضم (انظر الفيديو). - إضافة قسامة الثانية من التربسين إلى العينة واحتضان مع الإثارة مستمرة في 1400 دورة في الدقيقة لمدة 2 ساعة إضافية عند 37 درجة مئوية.
- إضافة ليز-C واحتضان مع الإثارة مستمرة في 1400 دورة في الدقيقة لمدة 2 ساعة على 37 درجة مئوية. إضافة التربسين واحتضان مع الإثارة مستمرة في 1400 دورة في الدقيقة O / N عند 37 درجة مئوية.
- تحمض
- عند الانتهاء من عملية الهضم، إبطال نشاط التربسين التي كتبها المحمضة العينة مع الطازجة 50٪، trifluoro حمض الخل (TFA). يجب أن يصل إلى عينة الرقم الهيدروجيني <2. نقترح إضافة 1-1،5 ميكرولتر من 50٪ TFA في وقت وباستخدام 1 ميكرولتر من الحل الببتيد لقياس الرقم الهيدروجيني للمحلول باستخدام ورقة الأس الهيدروجيني (انظر الفيديو).
- الطرد المركزي العينة المحمضة في 16000 x ج لمدة 5 دقائق على RT. جمع طاف في أنبوب نظيفة المنخفض الاحتفاظ بهم. في هذه المرحلة، يمكن تخزين حل الببتيد في -20 ° C.
- تحلية
ملاحظة: التي عادة ما تتم هذه الخطوة الأخيرة في منشأة قياس الطيف الكتلي وفقا للأساليب المفضلة الخاصة بهم.- قبل تحليل البروتينات، تحلية العينات والببتيدات مزال مع الطازجة الأسيتونتريل 60٪، حمض trifluoroacetic 0.1٪، تليها تركيز في فراغ المكثف. resuspend والببتيدات في الطازجة 3٪ acetonitrإيل، حمض trifluoroacetic 0.1٪ 8.
ملاحظة: أنه بعد إزالة الملوحة وتركيز المحلول الببتيد يمكن قياس الطيفي (انظر القسم النتائج المتوقعة). - الآن تحليل عينة عن طريق قياس الطيف الكتلي، ومرة أخرى وفقا للإجراءات المثلى للمنشأة قياس الطيف الكتلي.
ملاحظة: نحن نشجع الباحثين المهتمين في وصف تكوين موبينيل باستخدام مطياف الكتلة إلى الرجوع إلى غيرها من المطبوعات 8-10 الموقع والتي تقدم شرحا مفصلا آخر، بما في ذلك معايير LC-MS / MS، الشامل البحث عن البيانات الطيف لتحديد وتحليل البيانات البروتين استخدام في سيليكون matrisome الشرح أداة نحن يعدون 8.
- قبل تحليل البروتينات، تحلية العينات والببتيدات مزال مع الطازجة الأسيتونتريل 60٪، حمض trifluoroacetic 0.1٪، تليها تركيز في فراغ المكثف. resuspend والببتيدات في الطازجة 3٪ acetonitrإيل، حمض trifluoroacetic 0.1٪ 8.
النتائج
مراقبة جودة الإجراء decellularization
كفاءة decellularization يمكن رصدها من خلال تحليل محتوى البروتين في كل جزء لطخة الغربية. الجدول 2 قوائم البروتينات ذات قيمة تشخيصية لتقييم نوعية الإجراء decellularization. ويبين الشكل 2A استخراج كفاءة في الكسور وسيطة من عصاري خلوي (GAPDH )، النووية (الهستونات)، الغشاء (β1 إنتغرين) وهيكل الخلية (الأكتين) البروتينات، في حين لم البروتينات ECM (الكولاجين I) تم الكشف في هذه الكسور (الشكل 2). في المقابل، أثرت بيليه النهائي للبروتينات ECM واستنفدت إلى حد كبير من البروتينات داخل الخلايا (الشكل 2A). الشكل 2B يعرض مرضية استنزاف البروتين داخل الخلايا (لم يتم الكشف عن هيستون في جزء-ECM الغنية)، على الرغم من الأكتين لا يزال من الممكن الكشف عنها في جزء-ECM الغنية واستنزاف أحادى الكولاجين I- واضح الوزن الجزيئي ~ 110 كيلو دالتون، المفترض الموافق الكولاجين المفكك I - يمكن ملاحظتها في جزء CS.
نحن أيضا مراقبة روتينية البروتينات ECM إضافية مثل فبرونيكتين و laminin، على الرغم من أنه في بعض الأنسجة هذه المكونات يمكن أن تذوب جزئيا في أجزاء سابقة 10/08. على سبيل المثال، يحدث فبرونيكتين أيضا قابلة للذوبان كما فبرونيكتين البلازما التي لم يتم إدراجها في ECM. نضح من أنسجة قبل استخراج يقلل تركيز البلازما فبرونيكتين ولكن لا يلغي دائما. في بعض الأنسجة، وجدت المرتبطة laminins فضفاضة مع سطح الخلية أو ECM واستخراج ما في بطونها وسيطة. إذا حدث هذا فإنه يمكن معالجتها عن طريق تغيير الظروف استخراج (انظر مناقشة).
لاحظ أنه في إثراء البروتينات ECM واستنزاف ما يصاحب ذلك من مكونات الخلايا تقوم على الذوبان النسبي من البروتينات في مخازن مختلفة. عشرهو يختلف بين الأنسجة المختلفة - في بعض الحالات الهستونات والأكتين يتم استخراج بسهولة أكبر مما كانت عليه في الآخرين. نلاحظ أيضا أنه على الرغم من المتوقع أن يتم استخراجها في N جزء (الشكل 2B) الهستونات، فإننا كثيرا ما نلاحظ استنزاف أكثر اكتمالا من الهستونات في M أو CS جزء (الشكل 2A وباء).
تركيز الببتيد يدل المتوقع
تركيز من الحل الببتيد التي تم الحصول عليها بعد الهضم، والحموضة وتحلية يمكن قياس الطيفي إما عن طريق قياس الامتصاصية من الحل الببتيد باستخدام الطول الموجي 280 نانومتر الموافق التربتوفان، التيروزين، أو باستخدام الطول الموجي 205 نانومتر الموافق الامتصاصية من الببتيد السندات.
قمنا بقياس تركيز حلول الببتيد تم الحصول عليها من decellularization ثلاثة الرئتين عينات الفئران (82 ملغ و 100 ملغ و 100 ملغ على التوالي) استعداداتالأحمر بالتوازي والحصول عليها من كل من: 424 نانوغرام / ميكرولتر، 450 نانوغرام / ميكرولتر، و 580 نانوغرام / ميكرولتر من الببتيدات على التوالي.
تحديد الببتيدات ECM التي كتبها الطيف الكتلي
التحليل الطيفي الشامل لتكوين عينات البروتين التخصيب ECM، أعد كما هو موضح هنا، أن> 70٪ من كثافة إشارة يناظر ECM والبروتينات المرتبطة ECM 10/08.
الجدول 1. حجم الكواشف من المجزئ استخراج عدة لdecellularize 100 ملغ (الوزن الرطب) من الأنسجة أو الورم. يسرد هذا الجدول تكوين وحجم كل العازلة المستخدمة لإجراء decellularization من 100 ملغ من الأنسجة أو الورم. ويرد مزيج من مثبطات الأنزيم البروتيني كحل 50X ويحتاج إلى أن تضاف إلى كل العازلة 2.
| الكواشف من حجرة البروتين استخراج كيت | حجم 100 ملغ من الأنسجة | تكوين (على أساس ميليبور رقة القط # 2145 1) |
| عازلة C | 500 ميكرولتر | HEPES (الرقم الهيدروجيني 7.9 3)، MgCl 2، بوكل، بتوقيت شرق الولايات المتحدة 4، السكروز، الجلسرين، الصوديوم Orthovanadate 5 |
| عازلة W | 400 ميكرولتر | HEPES (درجة الحموضة 7.9)، MgCl 2، بوكل، EDTA، السكروز، الجلسرين، Orthovanadate الصوديوم |
| عازلة N | 150 ميكرولتر × 2 | HEPES (درجة الحموضة 7.9)، MgCl 2، كلوريد الصوديوم، EDTA، الجلسرين، Orthovanadate الصوديوم |
| عازلة W | 400 ميكرولتر | HEPES (درجة الحموضة 7.9)، MgCl 2، بوكل، EDTA، السكروز، الجلسرين، Orthovanadate الصوديوم |
| عازلة M | 100 ميكرولتر | HEPES (درجة الحموضة 7.9)، MgCl 2، بوكل، EDTA، السكروز، الجلسرين، deoxycholate الصوديوم (DOC) 6، NP-40 6 ، Orthovanadate الصوديوم |
| عازلة CS | 200 ميكرولتر | مواسير (درجة الحموضة 6.8)، MgCl 2، كلوريد الصوديوم، EDTA، السكروز، الصوديوم دوديسيل كبريتات (SDS) 7، Orthovanadate الصوديوم |
| عازلة C | 150 ميكرولتر | HEPES (درجة الحموضة 7.9)، MgCl 2، بوكل، EDTA، السكروز، الجلسرين، Orthovanadate الصوديوم |
| برنامج تلفزيوني 1X | 500 ميكرولتر / غسيل | - |
ملاحظات:
1 لأسباب الملكية، وكنا قادرين على الحصول على التركيب الدقيق للمخازن من المورد من هذه المجموعة، ولكننا هنا تشمل بعض الملاحظات بناء على تجربتنا الخاصة باستخدام مخازن محلية الصنع لإجراء عمليات الاستخراج مماثلة.
2 مثبط البروتياز: فإنه من المستحسن لتشمل مجموعة متنوعة من مثبطات ضد السيستين، سيرين وpeptidases ثريونين، esterases سيرين، metalloproteinases تعتمد على الموجبة ثنائي التكافؤ الخوجود العديد من المتاحة تجاريا الكوكتيلات مثبط البروتياز.
3 درجة الحموضة فوق 7.0 هو مثبط البروتياز الفعال للالليزوزومية.
4 EDTA (تستخدم عادة في 2 ملم) هو المانع الفعال للالبروتياز التي تعتمد على الموجبة ثنائي التكافؤ.
5 orthovanadate الصوديوم هو المانع الفوسفاتيز. ومن شأن التركيز الفعال نموذجي يكون 0،5-5 ملم.
6 NP40 عند 0.1٪ -0.5٪ غير كافية لإذابة الدهون أكثر الغشاء. الجمع بين NP40 وDOC - غالبا ما تستخدم في تركيزات متساوية (على سبيل المثال، 0.5٪ لكل منهما) - كثيرا ما يستخدم باعتباره استخراج أكثر صرامة التي لا تزال تترك العديد من تفاعلات البروتين البروتين سليمة.
7 SDS هو المنظفات الأيونية أكثر صرامة (CMC 0.1٪). ويمكن أيضا أن تستخدم في تركيبة مع الأخريين المنظفات SDS / NP40 / DOC 0.1 / 0.5 / 0.5٪ حيث وجود مخزن مؤقت صرامة وسيطة.
الجدول 2. البروتينات التشخيص لمراقبة جودة الإجراء decellularization. يسرد هذا الجدول أمثلة من البروتينات التي هي خصائص كل مقصورة التحت خلوية (العصارة الخلوية، نواة، غشاء البلازما، والهيكل الخلوي وECM) التي يمكن استخدامها لمراقبة نوعية الإجراء decellularization وكفاءة ECM-التخصيب.
| بين الخلايا مقصورة | البروتينات التشخيصية |
| البروتينات عصاري خلوي | نازعة غليسيرألدهيد 3-فوسفات (GAPDH) |
| البروتينات النووية | الهستونات، Lamins، Nucleoporin |
| بروتينات الغشاء | Integrins، ترانسفيرين مستقبلات |
| البروتينات هيكل الخلية | الأكتين، تويولين، Vimentin |
| الغشاء القاعدي البروتينات ECM | الكولاجين IV، Nidogens، Laminins |
| البروتينات ECM الخلالي (فراغي) | أنا الكولاجين، الكولاجين الثالث، الكولاجين VI، فيبرونكتين] |
للتوصية على الأجسام المضادة، راجع منشوراتنا 10/08.
الجدول 3. حجم الكواشف لهضم عينات التخصيب ECM في الببتيدات. يسرد هذا الجدول الكواشف المستخدمة ل resuspend عينات البروتين التخصيب ECM والحد، يؤلكل، deglycosylate وهضم البروتينات العينات في الببتيدات قبل تحليل الطيف الكتلي.
| الكواشف | إعداد | نهائي تركيز / المبلغ المتعلق بيليه 1 مم سميكة (~ 5-10 الوزن الجاف ملغ) | حجم لبيليه 1 مم سميكة (~ 5-10 الوزن الجاف ملغ) |
| بيكربونات الأمونيوم (NH 4 HCO 3) | 100 ملي حل في الماء HPLC الصف | - | - |
| اليوريا | 8 M حل في 100 ملي بيكربونات الأمونيوم | 8 M | 50 ميكرولتر |
| Dithiothreitol | إعادة في الماء HPLC الصف في 500 ملي | 10 ملي | 1 ميكرولتر |
| Iodoacetamide | إعادة في الماء HPLC الصف في 500 ملي | 25 ملي | 2.5 ميكرولتر |
| Peptide- N -Glycosidase F (PNGaseF) | حل تجاري في 500 U / ميكرولتر | 1000 U | 2 ميكرولتر |
| Endoproteinase LysC، الكتلة الطيفي الصف | إعادة في الماء HPLC الصف عند 0.5 ميكروغرام / ميكرولتر | 1 ميكروغرام | 2 ميكرولتر |
| التربسين، الكتلة الطيفي الصف (الجولة 1) | الحل التجاري عند 0.5 ميكروغرام / ميكرولتر | 3 ميكروغرام | 6 ميكرولتر |
| التربسين، الكتلة الطيفي الصف (الجولة 2) | الحل التجاري عند 0.5 ميكروغرام / ميكرولتر | 1.5 ميكروغرام | 3 ميكرولتر |
| حمض الخليك Trifluoro-(TFA) | حل 50٪ في الماء HPLC الصف | - | 2-5 ميكرولتر |
| الأسيتونتريل (شطف) | حل 60٪ بنسبة 0.1٪ TFA في الماء HPLC الصف | - | 500 ميكرولتر |
| الأسيتونتريل (إعادة) | حل 3٪ مع 0.1٪ TFA في الماء HPLC الصف | - | 100 ميكرولتر |
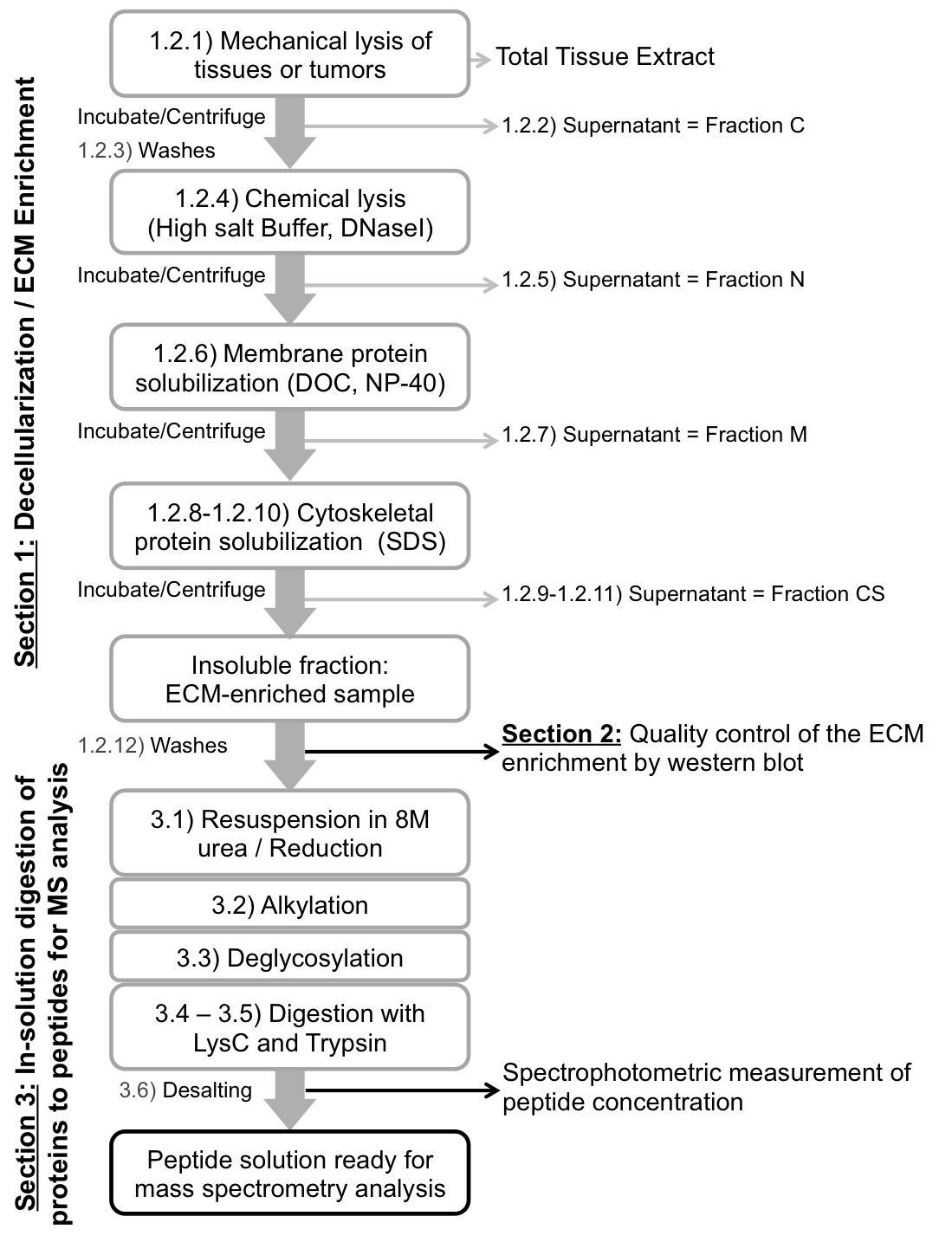
الشكل 1. مخطط إجراء التجارب. سير العمل التخطيطي لprotocoلتر إلى decellularize الأنسجة (القسم 1)، والسيطرة على نوعية decellularization وتقييم تخصيب ECM (القسم 2)، وهضم البروتين عينات التخصيب ECM إلى ببتيدات قبل تحليل الطيف الكتلي (القسم 3).
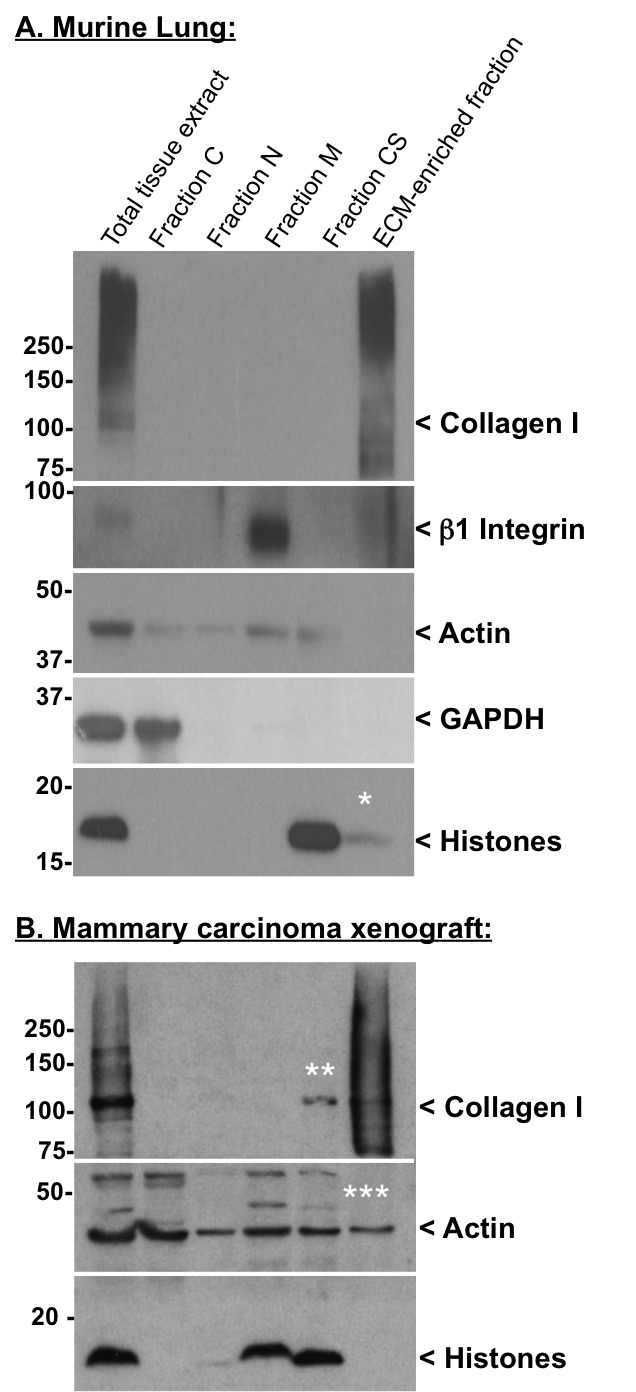
الرقم السيطرة 2. جودة الإجراء decellularization من قبل لطخة غربية أجريت البقع الغربية في الرئة الفئران (A) والثدي البشري سرطان طعم أجنبي (B) العينات باستخدام الأجسام المضادة التالية: أرنب المضادة للالأكتين (استنساخ 14-1) وأرنب المضادة -β1 إنتغرين الأجسام المضادة المنتجة في المختبر لدينا. كنا أرنب مكافحة أنا الكولاجين، والماوس مكافحة GAPDH والأجسام المضادة أرنب المضادة للعموم الهستونات من ميليبور. بعد حضانة الأجسام المضادة الأولية، وكانت تغسل الأغشية والمحتضنة في وجود HRP-مترافق الماعز المضادة للأرنب أو الماعز المضادة للمذكرة التفاهمحد ذاته الأجسام المضادة الثانوية من مختبر جاكسون ImmunoResearch. وأخيرا، تم غسلها أغشية وحضنت في غرب البرق ™ التوهج الكاشف (PERKINELMER LAS). * تشير إلى الحد الأدنى من التلوث هيستون المتبقية من الكسر-ECM الغنية. ** يدل على نضوب الجزئي للأحادى (المفكك المفترض) الكولاجين أنا في جزء CS. *** يدل على تلوث الأكتين المتبقية من الكسر-ECM الغنية. مسحة الكشف مع الأجسام المضادة لمكافحة الكولاجين تمثل مستويات مختلفة من التعديلات بعد متعدية (على سبيل المثال، عبر ربط، بالغليكوزيل).
Discussion
التعديلات
على الرغم من أننا يعمل هذا الإجراء المحدد لإثراء ECM من عشرة الأنسجة وأنواع الأورام 8-10، ينبغي النظر في إدخال تعديلات على بروتوكول في الحالات التالية:
1) الكشف عن البروتينات ECM في الكسور وسيطة.
قد تختلف مصفوفات خارج الخلية من الأنسجة المختلفة أو أنواع الأورام في هم الاستخلاصية / الذوبان، كما نوقش أعلاه لفبرونيكتين وlaminins. على سبيل المثال، يعتقد أن ECM من أنسجة متليفة أو الأنسجة إعادة عرض يقلب حيوي للغاية، وبالتالي يمكن للمرء أن يلاحظ ارتفاع نسبة البروتينات ECM في تلك الأنسجة إلى أن تكون أكثر للاستخراج 12 بسهولة. اعتمادا على جزء التي يتم فيها الكشف عن البروتينات ECM، نقترح تخفيض فترة حضانة الخطوة مما تسبب في استخراج البروتينات ECM أو حذف تلك الخطوة.
2) Detection من نسبة كبيرة من مكونات الخلايا في بيليه التخصيب ECM. في بعض الأنسجة أو أنواع الأورام الخلايا نسبة: ECM هي مرتفعة بشكل خاص (الأورام على سبيل المثال، الكبد، الطحال، غير صلدة). في هذه الحالة، تلوث كبير من الكسر التخصيب ECM من البروتينات داخل الخلايا (خاصة البروتينات هيكل الخلية و / أو الهستونات) ويمكن ملاحظة. في استنزاف البروتينات داخل الخلايا بشكل فعال، فإننا نقترح تكرار مرتين حضانة في مخزن M و / أو عازلة CS (سواء المنظفات التي تحتوي على هذا يستنزف عادة البروتينات داخل الخلايا وفيرة). وثمة بديل آخر يتمثل في استخدام المخازن بديلة مع تركيز المنظفات العليا، مع التحذير من أن ذلك قد يؤدي إلى استنزاف البروتينات ECM أكثر قابلية للذوبان نسبيا وكذلك (انظر الفقرة التالية).
3) البديل لاستخدام عدة التجارية.
كنا قادرين، لأسباب الملكية، للحصول على التركيب الدقيق للمخازن جيئة وذهابام المورد من المجزئ عدة استخراج البروتين. ومع ذلك، أدرجنا في الجدول الملاحظات 1 بناء على تجربتنا الخاصة باستخدام مخازن محلية الصنع مع المنظفات محددة (NP-40، deoxycholate الصوديوم وSDS) تركيزات لإجراء عمليات الاستخراج مماثلة. أبرزت دراسة حديثة أيضا على أهمية الرقم الهيدروجيني للمخازن decellularization للاحتفاظ البروتينات ECM 13.
القيود المفروضة على تقنية
الطريقة المعروضة هنا تعتمد على حقيقة أن البروتينات ECM هي في جوهرها غير قابلة للذوبان أكثر من معظم البروتينات داخل الخلايا. ومع ذلك، وصفت طريقة decellularization هنا مقتطفات بالتأكيد المكونات القابلة للذوبان الموجودة داخل ECM مثل بعض عوامل النمو أو إنزيمات إعادة عرض ECM. وعلى الرغم من الكشف عن البروتينات المرتبطة ECM بإحكام للبروتينات ECM التي كتبها البروتينات في عينات أعد كما هو موضح، قد تكون هذه الطريقة الصارمة جدا لمحة تماما تكوين المرتبطة matrisomeالبروتينات.
أهمية هذه التقنية فيما يتعلق بأساليب أخرى
الاستفادة من الطريقة المعروضة هنا خلال وسائل أخرى هي أنه يمكن أن يكون متلائما مع طبيعة ECM من الفائدة: الخطوات الوسيطة يمكن حذف أو تكرار للحيلولة دون فقدان البروتينات ECM أو زيادة استنزاف وتلويث البروتينات داخل الخلايا على التوالي. هذا الأسلوب أيضا يستخدم سوى كميات ضئيلة من المنظفات التي تشطف لمنع التداخل مع إعداد الببتيد لاحق ومطياف الكتلة. وأخيرا، فإن الطريقة الموصوفة هنا لهضم الاستعدادات البروتين ECM الغنية إلى ببتيدات أيضا لديه ميزة لا تتطلب البروتينات لتكون قابلة للذوبان، ويمكن أن تجرى على "الخام" كسور التخصيب ECM.
طرق decellularization بديلة باستخدام chaotropes (مثل غوانيدين هيدروكلوريد) لدراسة تكوين موبينيل التي كتبها الطيف الكتلي وبذكرت التابعين في الأدب (إعادة النظر في 14) واستخدمت في تركيبة مع مطياف الكتلة لتحديد تكوين ECM الغضروف 15،16، 17 القلب، الغدة الثديية 18 و 19 و الأوعية الدموية الكبيبي 20 الأغشية الطابق السفلي.
توصيات
طرق Decellularization توظيف التربسين الهضم خارج الخلايا لا ينبغي ان تستخدم اذا كان يتم إثراء موبينيل لالبروتينات اللاحقة التحليلات، كما trypsinization سيؤدي في الهضم الجزئي ECM وفقدان البروتينات ECM والببتيدات. وبالمثل، إذا كانت كولاجيناز الهضم لاستخدامها لمساعدة اختلال الأنسجة، وأنها تحتاج إلى الرصد الدقيق لأنه يسبب ECM الهضم وفقدان البروتينات ECM والببتيدات.
في مقابل حل الهضم في جل؟ البروتينات ECM هي عبر ربط وغير قابلة للذوبان للغاية، وحتى عندما معلق في المخزن 3X Laemmli (التي تحتوي على 6٪ SDS) و100MM DTT، ص منفصلأورلي على المواد الهلامية SDS. وهكذا في جل الهضم ليس الأسلوب المفضل.
التطبيقات المستقبلية
تجدر الإشارة إلى أنه في حين لم تناقش هنا، ويمكن أيضا أن يتم تحليلها وتكوين كل من الكسور المتوسطة التي تم جمعها خلال decellularization بواسطة مطياف الكتلة. قد يكون هذا قيمة خاصة عند دراسة عينات صغيرة جدا (أي الخزعات الإنسان) أو عند الرغبة المعلومات حول الكسور الخلوية الأخرى.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
The authors would like to thank Drs. Amanda Del Rosario and Guillaume Carmona for critical reading of the manuscript. This work was supported by grants from the Department of Defense DOD Innovator Award (W81XWH-14-1-0240 to ROH); the National Cancer Institute (U54 CA126515/CA163109); the Broad Institute of MIT and Harvard; the Howard Hughes Medical Institute, of which ROH is an Investigator; and in part by the Support Grant from the National Cancer Institute to the Koch Institute for Integrative Cancer Research at MIT (P30-CA14051). AN received postdoctoral fellowships from the Howard Hughes Medical Institute and the Ludwig Center for Cancer Research at MIT.
Materials
| Name | Company | Catalog Number | Comments |
| Tissue homogenizer: Bullet blender + beads | Next Advance | BB24-AU | |
| Compartmental Extraction kit | Millipore | 2145 | |
| Deoxyribonuclease I | Sigma-Aldrich | DN25 | |
| Ribonuclease A | Qiagen | 19101 | |
| HPLC-grade water | Sigma-Aldrich | 34877 | |
| Urea | Sigma-Aldrich | U4883 | |
| Dithiotreitol (DTT) | Thermo Scientific | 20291 | |
| Ammonium bicarbonate (NH4HCO3) | Sigma-Aldrich | 9830 | |
| Iodoacetamide | Sigma-Aldrich | A3221 | |
| Peptide-N-Glycosidase F (PNGaseF) | New England Biolabs | P0704S | |
| Endoproteinase LysC, mass spectrometry-grade | Wako | 125-05061 | |
| Trypsin, mass spectrometry-grade | Promega | V5111 | |
| Trifluoro-acetic Acid | Sigma-Aldrich | T6508 | |
| Acetonitrile, mass spectrometry-grade | Thermo Scientific | 51101 | |
| Desalting columns: Oasis HLB 1 cc, 10 mg Sorbent per Cartridge | Waters | 186000383 |
References
- Hynes, R. O., Naba, A. Overview of the matrisome--an inventory of extracellular matrix constituents and functions. Cold Spring Harb Perspect Biol. 4 (1), a004903 (2012).
- Mouw, J. K., Ou, G., Weaver, V. M. Extracellular matrix assembly: a multiscale deconstruction. Nat. Rev. Mol. Cell Biol. 15 (12), (2014).
- Hynes, R. O. The extracellular matrix: not just pretty fibrils. Science. 326 (5957), 1216-1219 (2009).
- Bonnans, C., Chou, J., Werb, Z. Remodelling the extracellular matrix in development and disease. Nat. Rev. Mol. Cell Biol. 15 (12), 786-801 (2014).
- Dvir, T., Timko, B. P., Kohane, D. S., Langer, R. Nanotechnological strategies for engineering complex tissues. Nat Nanotechnol. 6 (1), 13-22 (2011).
- Wilson, R. The extracellular matrix: an underexplored but important proteome. Expert Rev Proteomics. 7 (6), 803-806 (2010).
- Naba, A., Hoersch, S., Hynes, R. O. Towards definition of an ECM parts list: an advance on GO categories. Matrix Biol. 31 (7-8), 371-372 (2012).
- Naba, A., Clauser, K. R., Hoersch, S., Liu, H., Carr, S. A., Hynes, R. O. The matrisome: in silico definition and in vivo. characterization by proteomics of normal and tumor extracellular matrices. Mol. Cell Proteomics. 11 (4), M111.014647 (2012).
- Naba, A., Clauser, K. R., Whittaker, C. A., Carr, S. A., Tanabe, K. K., Hynes, R. O. Extracellular matrix signatures of human primary metastatic colon cancers and their metastases to liver. BMC Cancer. 14 (1), 518 (2014).
- Naba, A., Clauser, K. R., Lamar, J. M., Carr, S. A., Hynes, R. O. Extracellular matrix signatures of human mammary carcinoma identify novel metastasis promoters. eLife. 3, e01308 (2014).
- Naba, A., Ding, H., Whittaker, C. A., Hynes, R. O., et al. Proteomic analysis of altered extracellular matrix turnover in bleomycin-induced pulmonary fibrosis. Mol. Cell Proteomics. 13 (7), 1741-1752 (2014).
- Tsuchiya, T., Balestrini, J. L., Mendez, J. J., Calle, E. A., Zhao, L., Niklason, L. Influence of pH on extracellular matrix preservation during lung decellularization. Tissue Eng Part C Methods. 20 (12), 1028-1036 (2014).
- Byron, A., Humphries, J. D., Humphries, M. J. Defining the extracellular matrix using proteomics. Int J Exp Pathol. 94 (2), 75-92 (2013).
- Wilson, R., Diseberg, A. F., et al. Comprehensive profiling of cartilage extracellular matrix formation and maturation using sequential extraction and label-free quantitative proteomics. Mol. Cell Proteomics. 9 (6), 1296-1313 (2010).
- Belluoccio, D., Wilson, R., Thornton, D. J., Wallis, T. P., Gorman, J. J., Bateman, J. F. Proteomic analysis of mouse growth plate cartilage. Proteomics. 6 (24), 6549-6553 (2006).
- Barallobre-Barreiro, J., Didangelos, A., Yin, X., Doménech, N., Mayr, M. A sequential extraction methodology for cardiac extracellular matrix prior to proteomics analysis. In. Heart Proteomics: Methods and Protocols. 1005, 215-223 (2013).
- Hansen, K. C., Kiemele, L., et al. An in-solution ultrasonication-assisted digestion method for improved extracellular matrix proteome coverage. Mol. Cell Proteomics. 8 (7), 1648-1657 (2009).
- Didangelos, A., Yin, X., Mandal, K., Baumert, M., Jahangiri, M., Mayr, M. Proteomics characterization of extracellular space components in the human aorta. Mol. Cell Proteomics. 9 (9), 2048-2062 (2010).
- Lennon, R., Byron, A., et al. Global analysis reveals the complexity of the human glomerular extracellular matrix. J. Am. Soc. Nephrol. 25 (5), 939-951 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved