Method Article
質量分析のためのペプチドに組織および消化から細胞外マトリックスタンパク質の濃縮
要約
This protocol describes a procedure for enriching ECM proteins from tissues or tumors and deglycosylating and digesting the ECM-enriched preparations into peptides to analyze their protein composition by mass spectrometry.
要約
細胞外マトリックス(ECM)は、ECMは、心血管などの開発における多様な病態に重要な役割を果たしている細胞の増殖、生存、遊走などの主要な調節因子である生物物理学的および生化学的な手がかりを提供して架橋されたタンパク質の複雑な網目構造でありますと筋骨格疾患、線維症、および癌。したがって、正常および疾患組織のECMの組成を特徴づけることは、新規な予後および診断バイオマーカーおよび潜在的な新規治療標的の同定につながる可能性があります。しかし、ECMタンパク質(大型、架橋および共有結合、高度にグリコシル化)の性質は、困難のECMの生化学的分析をレンダリングしています。この課題を克服するために、我々は、ECMタンパク質の不溶性を利用しています新鮮または凍結組織および腫瘍からECMを豊かにする方法を開発しました。ここでは詳細にシーケンシャルIで構成されて脱細胞化の手順を説明します異なるpHおよび塩および界面活性剤の濃度の緩衝液中ncubations、その1の結果)は、細胞内(サイトゾル、核、膜および細胞骨格)タンパク質およびECMタンパク質の2)濃縮の抽出。それから、脱グリコシル化し、質量分析によるその後の分析のためのペプチドにECMに富むタンパク質製剤を消化する方法について説明します。
概要
細胞外マトリックス(ECM)は、複雑な細胞や定義のアーキテクチャをサポートし、足場を提供し、架橋やグリコシル化タンパク質の網目構造、部分的には、組織「生体力学的特性1,2です。 ECMタンパク質は、細胞に直接的にその受容体( 例えば、インテグリン、シンデカン、 等 )を介して、または3の増殖因子シグナル伝達を調節することによって、信号。 ECMは、このように等増殖、生存、偏光、分化、移動、などの細胞プロセスの主要な調節因子である生物物理学的および生化学的な手がかりを提供します
ECMは、生理学、開発および4老化において重要な役割を果たしています。また、このような心血管疾患、線維症、筋骨格疾患、癌、などのいくつかの病状は、によって引き起こされる、または、ECMの変化をもたらします。さらに、ECMは、幹細胞ニッチの維持に寄与し、第鍵ECM分子を同定しますサポート幹細胞性で組織工学と再生医療5に直接適用があります。しかし、その重要性にもかかわらず、ECMが残っている、最近まで、6 underexplored。
インシリコ分析では ECMのアンサンブル及びECM関連タンパク質として定義matrisome、ことを明らかにした、ヒトおよびマウスゲノム1,7,8数百の遺伝子の生成物を含みます。ただし、ECMタンパク質の不溶性は、正常および病理標本の in vivoでの細胞外マトリックスの組成の系統的な特性化を妨げてきました。 10 -我々は最近、この不溶性が有利になってすることができ、ECMタンパク質8を豊かにするために使用されることを実証しました。 10、13 -私たちなどは、さらに質量分析のECM 8の組成物を特徴づけるために最適な方法であることを実証しました。
我々ここでは、順次異なるpHと塩の緩衝液中でインキュベーションし、洗剤濃度で構成されて脱細胞化の手順を説明します。サイトゾル、核、膜と細胞骨格タンパク質およびECMタンパク質の濃縮の抽出(または枯渇)この手順をもたらします。私たちはその後、質量分析によって、その後の分析のためのペプチドにECMに富むタンパク質製剤を消化する方法について説明します。
詳細ここで示されている手順を使用して、我々は正常に10の異なる組織および腫瘍型から細胞外マトリックスを豊かにし、質量分析により特徴付けた:通常のマウスの肺8、ヒトおよびマウスの大腸8,9を 、ヒト肝臓9、ヒト結腸直腸腫瘍および派生肝転移9、メラノーマ異種移植片8、乳腺腫瘍異種移植片10、マウスの膵島およびマウスインスリノーマ(NABA ら 、未発表)。異なるmatrisomの比較ESはさらに、潜在的な診断または予後バイオマーカーとして使用することができる組織と腫瘍特異ECM署名を明らかにしました。
我々は、この手順がないか、比較的軽微な変更を加えて他の試料に適用することができると信じています。
プロトコル
注:手順は、新鮮またはフラッシュ凍結組織で実施することができます。我々は、赤血球と血漿タンパク質を除去するために切開の時にPBSで高度に血管組織を灌流をお勧めします。我々は、固定( すなわち、化学的架橋は)脱細胞化を妨害し、また大幅に後続の質量分析を損なう可能性があるとして、固定組織の手続きを行うことはお勧めしません。手順全体については、我々は、タンパク質やペプチド回収を最大化するために、低保持チューブやピペットチップを使用することをお勧めします。
組織または腫瘍の1脱細胞化
注:開始する前に、試薬を準備し、各バッファの所望の容量に(コンパートメントタンパク質抽出キットに付属)、プロテアーゼ阻害剤を追加します。全ての緩衝液サンプルをSDSの降水量を防止するために、RTで維持する必要があるバッファCS除く実験期間中、氷上で維持されるべきですitation。
注:プロトコルは順次細胞内タンパク質を抽出し、不溶性のECMタンパク質を濃縮するために異なるpHの緩衝液中でのインキュベーションのシリーズを使用し、塩および界面活性剤の異なる量を含有する( 図1、表1;の使用の代替にも議論を参照してください。市販キット)ここでは詳述。下記の試薬 の体積は、組織または腫瘍の100 mgのためのものである( 表1を参照)、適切に調整される必要があります。
- 組織が完全に破壊され、均一な懸濁液が得られるまで、組織ホモジナイザーを使用して、プロテアーゼ阻害剤を含有する緩衝液Cを500μlの組織100mgをホモジナイズします。
注:Iデオキシ加える(最終濃度は200μg/ mlのは、製造者の指示に従って再構成する)、および(最終濃度を20μg/ mlで、製造業者の指示に従って再構成)をリボヌクレアーゼにバッファN. - 細胞内の可溶性タンパク質の逐次抽出
- サイトゾルタンパク質の抽出。 4℃で20分間、チューブ回転のホモジネートをインキュベートします。その後のウェスタンブロット分析(期待される結果セクションおよび図2を参照)のためのホモジネートの小アリコート(20μlに10μl)を保存します。
- 4℃で20分間、16,000×gでホモジネートを遠心。きれいなチューブに上清を収集し、これは、ウェスタンブロット分析のサイトゾル(C)画分を構成します。 Flashでは、-80℃で、この画分およびストアを凍結します。
- 洗浄するために、プロテアーゼ阻害剤を含有するWバッファー400μlの中にペレットを再懸濁し、4℃で20分間チューブローテーター上でサンプルをインキュベートします。 4℃で20分間、16,000×gでホモジネートを遠心。上清を捨てます。
- 、核タンパク質を抽出するために、プロテアーゼ阻害剤を含有する緩衝液Nの150μlのdeoxyribonucleaをペレットを再懸濁SE IとリボヌクレアーゼAと4℃で30分間、チューブ回転でサンプルをインキュベートします。
- 4℃で30分間16,000×gでサンプルを遠心し、清潔なチューブに上清を収集します。この手順を1回繰り返します。二度目のサンプルを遠心分離した後、前の上清に上清を追加します。これは、ウェスタンブロット分析の核(N)画分を構成します。 Flashでは、-80℃で、この画分およびストアを凍結します。そして、ステップ1.2.3の通り洗を行います。
- 膜タンパク質を抽出するために、プロテアーゼ阻害剤を含有する緩衝液Mの100μl中にペレットを再懸濁し、4℃で30分間、チューブ回転でサンプルをインキュベートします。 4℃で30分間16,000×gで試料を遠心
- きれいなチューブに上清を収集します。これは、ウェスタンブロット分析の膜(M)画分を構成します。 Flashでは、-80℃で、この画分およびストアを凍結します。
- 細胞骨格タンパク質を抽出するために、2にペレットを再懸濁バッファCSの00μlを、プロテアーゼ阻害剤を含有し、室温で30分間チューブローテーターでサンプルをインキュベートします。
ペレットが完全に溶解しないことに注意してください。私たちは、ペレットの破壊を観察するまでピペットでダウンペレットを中断することを示唆しています。 - 室温で30分間、16,000×gでサンプルを遠心。きれいなチューブに上清を収集します。 (ビデオを見る)この時点でペレットのサイズをさらに顕著に減少に注意してください。
- プロテアーゼ阻害剤を含有する緩衝液Cを150μlにペレットを再懸濁し、4℃で20分間、チューブ回転でサンプルをインキュベートします。 4℃で20分間、16,000×gでサンプルを遠心。
- 上清を収集し、前の上清に追加します。これは、ウェスタンブロット分析の細胞骨格(CS)画分を構成します。 Flashでは、-80℃で、この画分およびストアを凍結します。
- 追加の洗浄を行います。 PBS500μlのプロテアーゼ阻害剤を含有するでペレットを再懸濁ND 4℃で5分間チューブローテーター上のサンプルをインキュベートします。 4℃で5分間、16,000×gでサンプルを遠心。上清を捨てます。この工程を3回繰り返します。
注:洗剤のすべてのトレースは、(第3章参照)前のペプチドへのタンパク質の消化に徹底的な洗浄によって除去する必要があります。この時点で、ECMに富むペレットを瞬間凍結することができ、-80℃で保存しました。ペレットの大きさは、出発物質に不溶(ECM)タンパク質の量および脱細胞化の効率に依存することに注意してください。
2. SDS-PAGEおよびウエスタンブロットによって脱細胞/ ECMの濃縮の品質のモニタリング
- 全組織抽出物の10〜20μlのアリコートとLaemmliのバッファーは100 mMのDTTを含有する中間留分の50μlのアリコートを混ぜます。 100mMのDTTを含む3倍のLaemmli緩衝液中のECMに富む、不溶性画分を再懸濁します。
注:彼は濃度が上昇DTTおよびSDSの比較的不溶性であるECMタンパク質の可溶化を補助します。 - SDS-PAGEによりタンパク質を分離し、ニトロセルロース膜上に移しました。
- サイトゾル、核、膜、細胞骨格とECMの各分画のタンパク質の代表を監視するために抗体を用いて免疫ブロットを実行します(代表的な結果セクション、 表2および図2を参照)。
質量分析のためのペプチドへのタンパク質の3溶液内消化
注:SDSの脱細胞化手順および除去後に得られたペレットは、非常に質量分析によるさらなる分析のために不溶性のECMタンパク質に富むこれらのタンパク質はペプチドに消化される必要があります。 ECMタンパク質の不溶性の結果として、それは、サンプルのタンパク質濃度を測定するために、この段階では不可能である、ということに注意してください。そこで我々は、ECM-当研究所を消化するための試薬の体積を提供しますECMに富むペレット( 表3)のサイズ(mm)または乾燥重量に基づいて、ペプチドへCHEDサンプル。重炭酸アンモニウム、尿素、DTT、ヨードアセトアミド、トリフルオロ酢酸の溶液すべてを新たに調製する必要があります。
- ECMに富むペレットを8M尿素の適切な量を添加することによって、ECMに富む試料を再懸濁し、10mMの最終濃度にDTTを添加した( 表3参照 )。 37℃で2時間、1400 rpmで連続的に攪拌しながらインキュベートします。
注:この時点でのECMタンパク質が完全に溶解されず、目に見えて大きなタンパク質粒子は、遠心分離または濾過によって廃棄されるべきではありません。懸濁液を脱グリコシル化し、消化(ビデオ参照)の際にクリアされます。 - アルキル化
- HPLCグレードの水にヨードアセトアミド溶液を調製します。 RTにサンプルを冷却し、25 mMの最終濃度にヨードアセトアミドを追加します。完全なアルキル化のために、DTT:2:ヨードアセトアミド比は1の間であるべきです。5〜1:3。
- RTで30分間、暗所でインキュベートします。
- 脱グリコシル化:
注:脱グリコシル化は、N結合型グリコシル化によって修飾されたペプチドの同定を妨害する炭水化物側鎖を除去するために必要とされます。- 100mMの重炭酸アンモニウムpH8.0で2 M尿素に希釈し、PNGアーゼFの適切な量を追加した( 表3参照 )。 37℃で2時間、1400 rpmで連続的に攪拌しながらインキュベートします。
- 消化
- のLys-Cを追加し、37℃で2時間、1400 rpmで連続的に攪拌しながらインキュベートします。トリプシンを追加し、37℃で1400 rpmでO / Nでの連続攪拌しながらインキュベートします。
注:8M尿素、初期再構成時に曇っ始めたECMに富む懸濁液(ビデオを見る)O / N消化の後に明確に表示されます。 - サンプルにトリプシンの第二のアリコートを追加し、37℃でさらに2時間、1400 rpmで連続的に攪拌しながらインキュベートします。
- のLys-Cを追加し、37℃で2時間、1400 rpmで連続的に攪拌しながらインキュベートします。トリプシンを追加し、37℃で1400 rpmでO / Nでの連続攪拌しながらインキュベートします。
- 酸性化
- 消化が完了すると、新たに調製した50%のトリフルオロ酢酸(TFA)を用いてサンプルを酸性化することによってトリプシンを不活性化します。サンプルでは、我々は一度に50%TFAの1〜1.5μLを添加し、(ビデオを見る)pH試験紙を用いて溶液のpHを測定するために、ペプチド溶液1μlを使用することをお勧めしてpH <2に到達する必要があります。
- 室温で5分間、16,000×gで酸性化した試料を遠心します。クリーンな低保持チューブに上清を収集します。この時点で、ペプチド溶液を-20℃で保存することができます。
- 脱塩
注:この最後のステップは、通常、自分の好ましい方法によれば、質量分析施設で行われていること。- プロテオミクス分析の前に、真空濃縮器で濃縮し、新たに調製した60%のアセトニトリル、0.1%トリフルオロ酢酸で溶出した試料およびペプチドを脱塩。新たに調製した3%acetonitr中のペプチドを再懸濁しイル、0.1%トリフルオロ酢酸8。
注:脱塩した後、ペプチド溶液の濃度は、分光光度法によって測定することができる(期待される結果のセクションを参照)。 - ここでもう一度、質量分析施設の最適な手順に従って、質量分析によって、試料を分析します。
注:私たちは、他の出版物8を参照するために質量分析法を用いたECMの組成を特徴付けるに興味を持って研究者奨励- LC-MS / MSパラメータを含む更なる詳細な説明を提供する10のウェブサイトを、タンパク質同定、およびデータ分析のための質量分析データの検索私たちは8を開発しインシリコ matrisome注釈ツールを使用して。
- プロテオミクス分析の前に、真空濃縮器で濃縮し、新たに調製した60%のアセトニトリル、0.1%トリフルオロ酢酸で溶出した試料およびペプチドを脱塩。新たに調製した3%acetonitr中のペプチドを再懸濁しイル、0.1%トリフルオロ酢酸8。
結果
脱細胞化手順の品質管理
脱細胞化の効率は、ウェスタンブロットにより各分画のタンパク質含有量を分析することによってモニターすることができる。診断価値の表2のタンパク質脱細胞化手順の品質を評価する。 図2Aは、細胞質ゾルの中間の画分における効率的な抽出(GAPDHを示します)、核(ヒストン)、膜(β1インテグリン)と細胞骨格(アクチン)、タンパク質、何のECMタンパク質(コラーゲンI)は、これらの画分に検出されなかったのに対し( 図2)。ターンでは、最終ペレットは、ECMタンパク質について濃縮されており、主に細胞内タンパク質( 図2A)が枯渇。アクチンはまだで検出することができる、が、 図2Bは 、(何のヒストンは、ECMに富む画分に検出されない)良好な細胞内タンパク質の枯渇を提示しますECMに富む画分および単量体コラーゲンIの枯渇- 見かけの分子量〜110 kDaの、推定上私が組み立てられていないコラーゲンに対応する - CS画分に観察することができます。
いくつかの組織では、これらのコンポーネントの一部は、以前の画分8-10中に可溶化することができ、が、我々はまた、日常的に、フィブロネクチンおよびラミニンなどの追加のECMタンパク質を監視します。例えば、フィブロネクチンはまた、ECM中に組み込まれていないなどの可溶性血漿フィブロネクチンを発生します。抽出前に組織の灌流は、血漿フィブロネクチン濃度を低下させるが、常にそれを排除しません。いくつかの組織では、ラミニンは緩く、細胞表面または中間留分におけるECMと抽出に関連付けられて発見されました。このような場合には、(説明を参照)、抽出条件を変更することによって対処することができます。
ECMタンパク質や細胞内成分の同時枯渇の濃縮は異なるバッファ中のタンパク質の相対的な溶解性に基づいていることに注意してください。目異なる組織間で異なります - いくつかのケースではヒストンおよびアクチンがより容易に他のものに比べて抽出されます。また、ヒストンがN画分( 図2B)で抽出されることが期待されているが、我々は多くの場合、MまたはCS画分( 図2AおよびB)にヒストンのより完全な枯渇を観察する、ということに注意してください。
予想されることを示すペプチド濃度
消化、酸性化及び脱塩後に得られたペプチド溶液の濃度は、分光光度法のいずれかによって、トリプトファン、チロシンに相当する280nmの波長を用いてペプチド溶液の吸光度を測定し、またはペプチドの吸光度に対応する205 nmの波長を用いて測定することができます債券。
我々は、(それぞれ、82ミリグラム、100ミリグラム、100ミリグラム)は、3つのマウスの肺サンプルの脱細胞化から得られたペプチド溶液の濃度を測定しprepa424 ng /μLで、450 ng /μLであり、それぞれのペプチドの580 ng /μLで:赤を並列にし、それぞれから得られます。
質量分析によるECMペプチドの同定
ここに記載のように調製ECMに富むタンパク質サンプルの組成の質量分析は、信号強度の> 70%がECMとECM関連タンパク質8-10に対応することを示しました。
組織または腫瘍の100 mgの(湿重量)を脱細胞化するためのコンパートメント抽出キットからの試薬 の表1巻。この表は、組成物および組織または腫瘍の100ミリグラムの脱細胞化を行うために使用される各バッファの容量を示しています。プロテアーゼインヒビターのカクテルは、50倍溶液として提供し、各バッファ2に追加する必要があります。
| コンパートメントタンパク質抽出キットからの試薬 | 100mgの組織のボリューム | 組成物(ミリポアデータシートカタログ番号に基づいて、2145 1) |
| 緩衝液C | 500μlの | HEPES(pHが7.9 3)、 塩化マグネシウム、塩化カリウム、EDT 4、スクロース、グリセロール、ナトリウムオルトバナジン5 |
| バッファW | 400μlの | HEPES(pHは7.9)、 塩化マグネシウム、塩化カリウム、EDTA、スクロース、グリセリン、ナトリウムオルトバナジン |
| バッファN | 150μlの×2 | HEPES(pHは7.9)、 塩化マグネシウム、塩化ナトリウム、EDTA、グリセロール、ナトリウムオルトバナジン |
| バッファW | 400μlの | HEPES(pHは7.9)、 塩化マグネシウム、塩化カリウム、EDTA、スクロース、グリセリン、ナトリウムオルトバナジン |
| バッファM | 100μlの | HEPES(pHは7.9)、 塩化マグネシウム、塩化カリウム、EDTA、スクロース、グリセロール、デオキシコール酸ナトリウム(DOC)6、NP-40 6 、ナトリウムオルトバナジン |
| バッファCS | 200μlの | PIPES(pHは6.8)、 塩化マグネシウム、塩化ナトリウム、EDTA、スクロース、ドデシル硫酸ナトリウム(SDS)7、ナトリウムオルトバナジン |
| 緩衝液C | 150μlの | HEPES(pHは7.9)、 塩化マグネシウム、塩化カリウム、EDTA、スクロース、グリセリン、ナトリウムオルトバナジン |
| 1×PBS | 500μL/ウォッシュ | - |
注意事項 :
1は、独自の理由から、我々は、キットの供給者からのバッファの正確な組成物を得ることができなかったが、私たちはここに同様の抽出を行うために自家製のバッファを使用して、私たち自身の経験に基づいて、いくつかの注意事項があります。
2プロテアーゼ阻害剤:それはなど 、システイン、セリンおよびトレオニンペプチダーゼ、セリンエステラーゼ、二価カチオン依存性メタロに対する阻害剤の様々なを含めることをお勧めします多くの市販のプロテアーゼ阻害剤カクテルが存在します。
7.0以上のpHを3は、リソソームプロテアーゼの有効な阻害剤です。
(通常は2 mmに使用される)4 EDTAは、二価カチオン依存性プロテアーゼの有効な阻害剤です。
5オルトバナジン酸ナトリウムは、ホスファターゼ阻害剤です。典型的な有効濃度は0.5〜5 mMであろう。
0.1%-0.5%で6 NP40は、ほとんどの膜脂質を可溶化するのに十分です。 NP40とDOCの組み合わせは-多くの場合、まだ無傷の多くのタンパク質-タンパク質相互作用を残すより厳しい抽出として使用されている-多くの場合( 例えば 、それぞれの0.5%)が等しい濃度で使用されます。
7 SDSは、より厳しいイオン性界面活性剤(CMC 0.1%)です。また、他の二つの界面活性剤SDS / NP40 / DOC中間ストリンジェンシーバッファーとして0.1 / 0.5 / 0.5%と組み合わせて使用することができます。
表2.診断タンパク質へ脱細胞化手順の品質を監視する。この表では、脱細胞化手順の質と効率をモニターするために使用することができ、各細胞内区画(細胞質ゾル、核、原形質膜、細胞骨格およびECM)の特徴であるタンパク質の例を示しECM-濃縮。
| 細胞内区画 | 診断タンパク質 |
| サイトゾルタンパク質 | グリセルアルデヒド3-リン酸デヒドロゲナーゼ(GAPDH) |
| 核タンパク質 | ヒストン、ラミン、ヌクレオポリン |
| 膜タンパク質 | インテグリン、トランスフェリン受容体 |
| 細胞骨格タンパク質 | アクチン、チューブリン、ビメンチン |
| 基底膜のECMタンパク質 | IV型コラーゲン、Nidogens、ラミニン |
| 間質ECMタンパク質(間質) | コラーゲンI、コラーゲンIII、コラーゲンVI、フィブロネクチン |
抗体上の勧告については、当社の出版物8-10を参照してください。
ペプチドへECMに富む試料を消化するための試薬 の表3巻。この表は、ECMに富むタンパク質試料を再懸濁し、減らす、アルキレート、脱グリコシル化および質量分析の前にペプチドにタンパク質試料を消化するために使用される試薬を示しています。
| 試薬 | 準備 | 厚さ1mmのペレットのための最終的な濃度/量(〜5〜10mgの乾燥重量) | 厚さ1mmのペレットのボリューム(〜5〜10mgの乾燥重量) |
| 重炭酸アンモニウム(NH 4 HCO 3) | HPLCグレードの水中の100 mM溶液 | - | - |
| 尿素 | 100mMの重炭酸アンモニウム中の8M溶液 | 8 M | 50μlの |
| ジチオスレイトール | 500 mmにHPLCグレードの水に再構成 | 10 mMの | 1μL |
| ヨードアセトアミド | 500 mmにHPLCグレードの水に再構成 | 25 mMの | 2.5μL |
| ペプチドN -Glycosidase F(PNGアーゼF) | 500 U /μLで商用ソリューション | 千U | 2μL |
| エンドプロテアーゼのLysC、質量分析グレード | 0.5μgの/μLでHPLCグレードの水に再構成 | 1μgの | 2μL |
| トリプシン、質量分析グレード( ラウンド1) | 0.5μgの/μLで商用ソリューション | 3μgの | 6μL |
| トリプシン、質量分析グレード( ラウンド2) | 0.5μgの/μLで商用ソリューション | 1.5μgの | 3μL |
| トリフルオロ酢酸(TFA) | HPLC等級の水中の50%溶液 | - | 2-5μL |
| アセトニトリル( 溶出 ) | HPLC等級の水中の0.1%TFAで60%溶液 | - | 500μlの |
| アセトニトリル( 再構成 ) | HPLC等級の水中の0.1%TFAで3%溶液 | - | 100μlの |
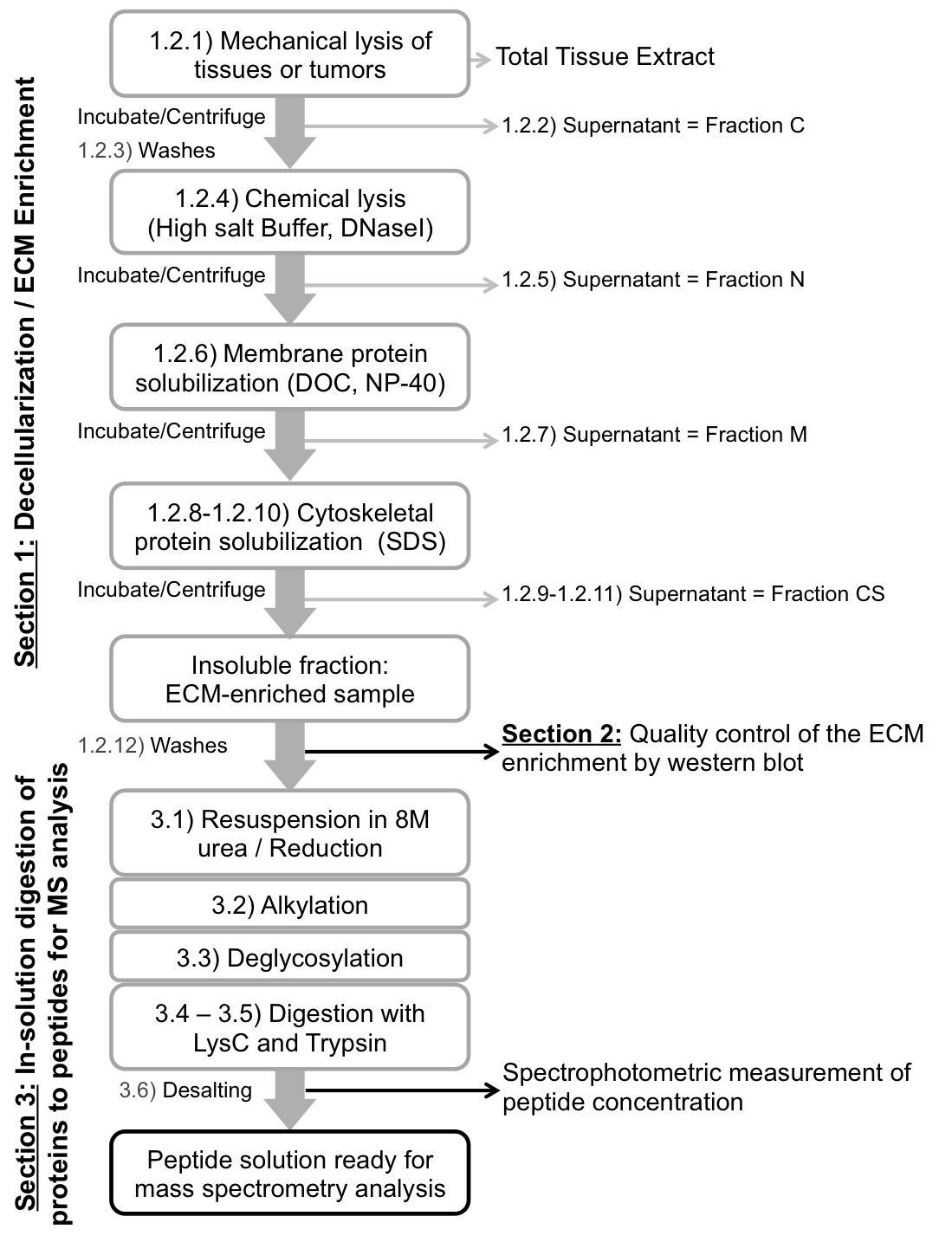
実験手順の図1のスキーム。protocoの概略ワークフローlは、組織(第1節)を脱細胞化脱細胞化の品質を制御し、ECM濃縮(第2節)を評価し、質量分析(第3節)の前にペプチドにECMに富むタンパク質試料を消化します。
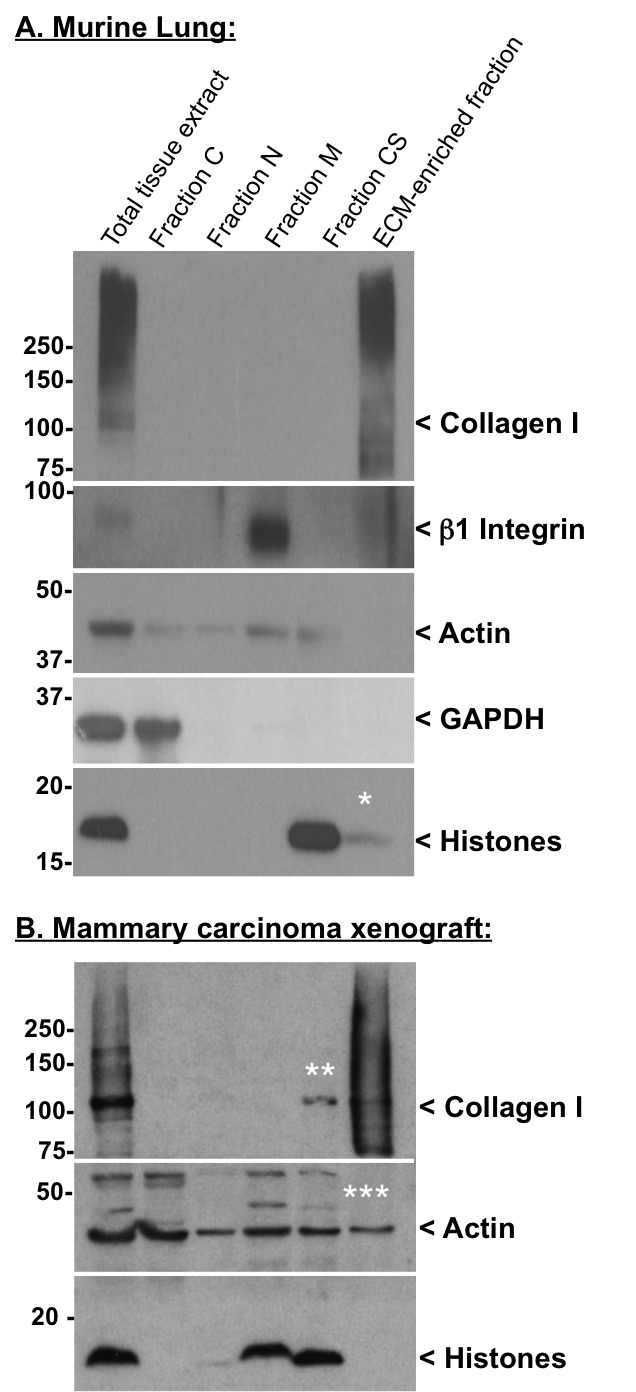
ウェスタンブロットによる脱細胞化手順を図2品質管理ウェスタンブロットを、マウス肺(A)およびヒト乳癌異種移植片(B)以下の抗体を使用して、サンプルに対して実施した:ウサギ抗アクチン(クローン14-1)およびウサギ抗我々の研究室で作製し-β1インテグリン抗体;ウサギ抗コラーゲンI、マウス抗GAPDHウサギ抗汎ヒストン抗体はMillipore社から入手しました。一次抗体のインキュベーション後、膜を洗浄し、HRP結合ヤギ抗ウサギまたはヤギ抗MOUの存在下でインキュベートしジャクソンイムノリサーチ研究所から南東に二次抗体。最後に、膜を洗浄し、ウェスタンライトニング™化学発光試薬(パーキンエルマーLAS)中でインキュベートしました。 * ECMに富む画分の微小残存ヒストン汚染を示しています。 ** CS画分中の単量体(推定的組み立てられていない)コラーゲンIの部分的な減少を示しています。 *** ECMに富む画分の残留アクチン汚染を示しています。抗コラーゲン抗体を用いて検出したスミアは、翻訳後修飾( 例えば、架橋結合、グリコシル化)の異なるレベルを表しています。
ディスカッション
修正
私たちは10の組織および腫瘍型8からのECMを豊かにするために、この正確な手順を採用しているが- 10、プロトコルの変更は、次の場合に考慮されるべきです:
中間留分におけるECMタンパク質の1)検出。
フィブロネクチンおよびラミニンのために上述したように、異なる組織または腫瘍型から細胞外マトリックスは、その抽出性/不溶性に異なる場合があります。例えば、線維性組織または改造組織のECMは非常に動的にオーバーターンと考えられているため、一方がより容易に12抽出であることが、これらの組織におけるECMタンパク質のより高い割合を観察することがあります。 ECMタンパク質が検出される割合に応じて、我々は、ECMタンパク質の抽出を引き起こすか、そのステップを省略し、ステップのインキュベーション時間を減らすことを示唆しています。
2)DECMに富むペレット中の細胞内成分のかなりの割合のetection。いくつかの組織または腫瘍型比細胞では:ECMが特に高い( 例えば、肝臓、脾臓、非線維形成性腫瘍)です。その場合には、(特定の細胞骨格タンパク質および/またはヒストンで)細胞内タンパク質によるECMに富む画分の著しい汚染を観察することができます。効率的に細胞内タンパク質を枯渇させるために、我々はバッファMおよび/またはバッファーCSで二回のインキュベーションを繰り返す(両方を含む洗剤、これは通常、豊富な細胞内タンパク質を枯渇させる)を示唆しています。別の方法として、(次の段落を参照)、これは同様に比較的より可溶性ECMタンパク質の枯渇につながる可能性があることの警告で、より高い界面活性剤濃度で別の緩衝液を使用することであろう。
市販のキットを使用して3)の代替。
我々は、あちこちのバッファの正確な組成を得るために、独自の理由のために、不可能でしたコンパートメントタンパク質抽出キットの供給をメートル。しかし、我々は同様の抽出を行うために定義された界面活性剤(NP-40、デオキシコール酸ナトリウムおよびSDS)の濃度で自家製のバッファを使用して、私たち自身の経験に基づいて、表1のノートに含まれています。最近の研究はまた、ECMタンパク質13を保持するために、脱細胞化緩衝液のpHの重要性を強調しました。
技術の限界
ここで紹介する方法は、ECMタンパク質は、ほとんどの細胞内タンパク質よりも本質的にそれ以上の不溶性であるという事実に依存しています。しかし、ここで説明する脱細胞化方法は、確かに、このようないくつかの増殖因子またはECMリモデリング酵素のようなECM内に存在する可溶性成分を抽出します。記載されているようにしっかりとECMタンパク質に結合したECM関連タンパク質を調製した試料中のプロテオミクスによって検出されたが、この方法は、完全に組成物をプロファイルするためにあまりにも厳しいこともありmatrisome関連タンパク質。
他の方法に対する技術の意義
中間工程を省略することができ、又はECMタンパク質の損失を防ぐか、それぞれの細胞内タンパク質の汚染の減少を増加させるために繰り返される。他の方法に比べて、ここで提示された方法の利点は、関心のECMの性質に合わせて調整することができることです。この方法はまた、唯一のその後のペプチドの調製および質量分析との干渉を防止するために洗い流されている界面活性剤の最小量を使用します。最後に、ペプチドにECMに富むタンパク質調製物を消化するために、ここで説明する方法はまた、可溶性タンパク質であることを必要としないという利点を有しており、「粗」ECMに富む画分について行うことができます。
(例えば、塩酸グアニジンなど)カオトロープを用いた代替脱細胞化の方法 質量分析法でのECMの組成を研究するためにBを持っていますEENは、(14に概説)は、文献に報告され、軟骨15,16、心臓17、乳腺18と血管19と、糸球体基底膜20のECM組成物を特徴づけるために質量分析と組み合わせて使用されてきました。
提言
ECMの分析、その後のプロテオミクスのために濃縮されている場合、トリプシン処理が部分ECM消化およびECMタンパク質およびペプチドの損失になりますように、細胞を消化するトリプシンを用いた脱細胞化の方法は、使用すべきではありません。コラゲナーゼ消化の組織破壊を補助するために使用された場合も、それはECMの消化およびECMタンパク質およびペプチドの損失を引き起こすように、注意深く監視する必要があります。
溶液内でゲル内消化対? ECMタンパク質は、架橋された、高度に不溶性であり、3×Laemmli緩衝液中に再懸濁させた場合でも(6%SDSを含有する)および100mMのDTT、別個の経口SDSゲル上オルリー。したがって、ゲル内消化は好ましい方法ではありません。
将来の応用
これは、ここで説明されていないが、脱細胞化中に収集、中間留分のそれぞれの組成物は、質量分析法によって分析することができる、ということは注目に値します。非常に少量の試料( すなわち、ヒトの生検)、または情報を他の細胞画分に望まれる研究場合に特に価値があります。
開示事項
The authors declare that they have no competing financial interests.
謝辞
The authors would like to thank Drs. Amanda Del Rosario and Guillaume Carmona for critical reading of the manuscript. This work was supported by grants from the Department of Defense DOD Innovator Award (W81XWH-14-1-0240 to ROH); the National Cancer Institute (U54 CA126515/CA163109); the Broad Institute of MIT and Harvard; the Howard Hughes Medical Institute, of which ROH is an Investigator; and in part by the Support Grant from the National Cancer Institute to the Koch Institute for Integrative Cancer Research at MIT (P30-CA14051). AN received postdoctoral fellowships from the Howard Hughes Medical Institute and the Ludwig Center for Cancer Research at MIT.
資料
| Name | Company | Catalog Number | Comments |
| Tissue homogenizer: Bullet blender + beads | Next Advance | BB24-AU | |
| Compartmental Extraction kit | Millipore | 2145 | |
| Deoxyribonuclease I | Sigma-Aldrich | DN25 | |
| Ribonuclease A | Qiagen | 19101 | |
| HPLC-grade water | Sigma-Aldrich | 34877 | |
| Urea | Sigma-Aldrich | U4883 | |
| Dithiotreitol (DTT) | Thermo Scientific | 20291 | |
| Ammonium bicarbonate (NH4HCO3) | Sigma-Aldrich | 9830 | |
| Iodoacetamide | Sigma-Aldrich | A3221 | |
| Peptide-N-Glycosidase F (PNGaseF) | New England Biolabs | P0704S | |
| Endoproteinase LysC, mass spectrometry-grade | Wako | 125-05061 | |
| Trypsin, mass spectrometry-grade | Promega | V5111 | |
| Trifluoro-acetic Acid | Sigma-Aldrich | T6508 | |
| Acetonitrile, mass spectrometry-grade | Thermo Scientific | 51101 | |
| Desalting columns: Oasis HLB 1 cc, 10 mg Sorbent per Cartridge | Waters | 186000383 |
参考文献
- Hynes, R. O., Naba, A. Overview of the matrisome--an inventory of extracellular matrix constituents and functions. Cold Spring Harb Perspect Biol. 4 (1), a004903(2012).
- Mouw, J. K., Ou, G., Weaver, V. M. Extracellular matrix assembly: a multiscale deconstruction. Nat. Rev. Mol. Cell Biol. 15 (12), (2014).
- Hynes, R. O. The extracellular matrix: not just pretty fibrils. Science. 326 (5957), 1216-1219 (2009).
- Bonnans, C., Chou, J., Werb, Z. Remodelling the extracellular matrix in development and disease. Nat. Rev. Mol. Cell Biol. 15 (12), 786-801 (2014).
- Dvir, T., Timko, B. P., Kohane, D. S., Langer, R. Nanotechnological strategies for engineering complex tissues. Nat Nanotechnol. 6 (1), 13-22 (2011).
- Wilson, R. The extracellular matrix: an underexplored but important proteome. Expert Rev Proteomics. 7 (6), 803-806 (2010).
- Naba, A., Hoersch, S., Hynes, R. O. Towards definition of an ECM parts list: an advance on GO categories. Matrix Biol. 31 (7-8), 371-372 (2012).
- Naba, A., Clauser, K. R., Hoersch, S., Liu, H., Carr, S. A., Hynes, R. O. The matrisome: in silico definition and in vivo. characterization by proteomics of normal and tumor extracellular matrices. Mol. Cell Proteomics. 11 (4), M111.014647(2012).
- Naba, A., Clauser, K. R., Whittaker, C. A., Carr, S. A., Tanabe, K. K., Hynes, R. O. Extracellular matrix signatures of human primary metastatic colon cancers and their metastases to liver. BMC Cancer. 14 (1), 518(2014).
- Naba, A., Clauser, K. R., Lamar, J. M., Carr, S. A., Hynes, R. O. Extracellular matrix signatures of human mammary carcinoma identify novel metastasis promoters. eLife. 3, e01308(2014).
- Naba, A., Ding, H., Whittaker, C. A., Hynes, R. O., et al. Proteomic analysis of altered extracellular matrix turnover in bleomycin-induced pulmonary fibrosis. Mol. Cell Proteomics. 13 (7), 1741-1752 (2014).
- Tsuchiya, T., Balestrini, J. L., Mendez, J. J., Calle, E. A., Zhao, L., Niklason, L. Influence of pH on extracellular matrix preservation during lung decellularization. Tissue Eng Part C Methods. 20 (12), 1028-1036 (2014).
- Byron, A., Humphries, J. D., Humphries, M. J. Defining the extracellular matrix using proteomics. Int J Exp Pathol. 94 (2), 75-92 (2013).
- Wilson, R., Diseberg, A. F., et al. Comprehensive profiling of cartilage extracellular matrix formation and maturation using sequential extraction and label-free quantitative proteomics. Mol. Cell Proteomics. 9 (6), 1296-1313 (2010).
- Belluoccio, D., Wilson, R., Thornton, D. J., Wallis, T. P., Gorman, J. J., Bateman, J. F. Proteomic analysis of mouse growth plate cartilage. Proteomics. 6 (24), 6549-6553 (2006).
- Barallobre-Barreiro, J., Didangelos, A., Yin, X., Doménech, N., Mayr, M. A sequential extraction methodology for cardiac extracellular matrix prior to proteomics analysis. In. Heart Proteomics: Methods and Protocols. 1005, 215-223 (2013).
- Hansen, K. C., Kiemele, L., et al. An in-solution ultrasonication-assisted digestion method for improved extracellular matrix proteome coverage. Mol. Cell Proteomics. 8 (7), 1648-1657 (2009).
- Didangelos, A., Yin, X., Mandal, K., Baumert, M., Jahangiri, M., Mayr, M. Proteomics characterization of extracellular space components in the human aorta. Mol. Cell Proteomics. 9 (9), 2048-2062 (2010).
- Lennon, R., Byron, A., et al. Global analysis reveals the complexity of the human glomerular extracellular matrix. J. Am. Soc. Nephrol. 25 (5), 939-951 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved