Method Article
3D هيدروجيل السقالات لالمفصلي خلية غضروفية الثقافة والجيل الغضروف
In This Article
Summary
Cartilage repair represents an unmet medical challenge and cell-based approaches to engineer human articular cartilage are a promising solution. Here, we describe three-dimensional (3D) biomimetic hydrogels as an ideal tool for the expansion and maturation of human articular chondrocytes.
Abstract
Human articular cartilage is highly susceptible to damage and has limited self-repair and regeneration potential. Cell-based strategies to engineer cartilage tissue offer a promising solution to repair articular cartilage. To select the optimal cell source for tissue repair, it is important to develop an appropriate culture platform to systematically examine the biological and biomechanical differences in the tissue-engineered cartilage by different cell sources. Here we applied a three-dimensional (3D) biomimetic hydrogel culture platform to systematically examine cartilage regeneration potential of juvenile, adult, and osteoarthritic (OA) chondrocytes. The 3D biomimetic hydrogel consisted of synthetic component poly(ethylene glycol) and bioactive component chondroitin sulfate, which provides a physiologically relevant microenvironment for in vitro culture of chondrocytes. In addition, the scaffold may be potentially used for cell delivery for cartilage repair in vivo. Cartilage tissue engineered in the scaffold can be evaluated using quantitative gene expression, immunofluorescence staining, biochemical assays, and mechanical testing. Utilizing these outcomes, we were able to characterize the differential regenerative potential of chondrocytes of varying age, both at the gene expression level and in the biochemical and biomechanical properties of the engineered cartilage tissue. The 3D culture model could be applied to investigate the molecular and functional differences among chondrocytes and progenitor cells from different stages of normal or aberrant development.
Introduction
With its limited self-repair potential, human articular cartilage undergoes frequent irreversible damages. Extensive efforts are currently focused on the development of efficient cell-based approaches for treatment of articular cartilage injuries. The success of these cell-based therapies is highly dependent on the selection of an optimal cell source and the maintenance of its regenerative potential. Chondrocytes are a common cell source for cartilage repair, but they are limited in supply and can de-differentiate during in vitro expansion in 2D monolayer culture thereby limiting their generation of hyaline cartilage 1.
The aim of this protocol is to establish a 3-dimensional hydrogel platform for an in vitro comparative study of human chondrocytes from different ages and disease state. Unlike conventional two-dimensional (2D) culture, three-dimensional (3D) hydrogels allow chondrocytes to maintain their morphology and phenotype and provides a physiologically relevant environment enabling chondrocytes to produce cartilage tissue 2,3. In addition to providing a 3D physical structure for chondrocyte culture, hydrogels mimic the function of native cartilage extracellular matrix (ECM). Specifically, the inclusion of chondroitin sulfate methacrylate provides a potential reservoir for secreted paracrine factors 4 and enables cell-mediated degradation and matrix turnover 5. Although many 3D hydrogel culture systems have been utilized widely in various studies including agarose and alginate gels, we have used a biomimetic 3D culture system that has some distinct advantages for chondrocyte culture. Chondroitin sulfate (CS) is an abundant component in articular cartilage and the PEG-CS hydrogels have been shown to maintain and even enhance chondrogenic phenotype and facilitate cell-mediated matrix degradation and turnover 2,5. In addition, the mechanical properties of the hydrogel scaffold can be easily modulated by changing concentration of PEG and hence can be utilized to further enhance the regeneration potential of chondrocytes or a related cell type 6,7. PEG/CSMA is also biocompatible and hence has the potential for a direct clinical application in cartilage defects for example. The limitation for this system is its complexity and the use of photopolymerization that can potentially affect cell viability as compared to simpler systems like agarose, however the advantages for the chondrocyte culture outweigh the potential limitations.
The 3D hydrogel culture is compatible with conventional assay for evaluation of cell phenotype (gene expression, protein immunostaining) and functional outcome (quantification of cartilage matrix production, mechanical testing). This favorable 3D environment was tested to compare the tissue regeneration potential of human chondrocytes from three different aged populations in long-term 3D cultures.
The outcomes were evaluated via both phenotypic and functional assays. Juvenile, adult and OA chondrocytes showed differential responses in the 3D biomimetic hydrogel culture. After 3 and 6 weeks, chondrogenic gene expression was upregulated in juvenile and adult chondrocytes but was downregulated in OA chondrocytes. Deposition of cartilage tissue components including aggrecan, type II collagen, and glycosaminoglycan (GAG) was high for juvenile and adult chondrocytes but not for OA chondrocytes. The compressive moduli of the resulting cartilage constructs also exhibited similar trends. In conclusion, both juvenile and adult chondrocytes exhibited chondrogenic and cartilage matrix disposition up to 6 weeks of 3D culture in hydrogels. In contrast, osteoarthritic chondrocytes revealed a loss of cartilage phenotype and minimal ability to generate robust cartilage.
Protocol
تم تنفيذ جميع التجارب وفقا للمبادئ التوجيهية للموضوعات جامعة ستانفورد الإنسان وافق بروتوكول مجلس المراجعة المؤسسية.
1. المفصلي خلية غضروفية عزل
- الحصول على الغضروف من الأنسجة التخلص منها خلال تقويم مفاصل الركبة الكلي وتشريح كما هو موضح سابقا 8.
- بصريا تحديد اللقم الفخذ وسطي أو الجانبية للعينات الغضروف لالأسطح الملساء وجعل شق على سطح الغضروف من خلال مشرط من أجل إزالة 4-5 الخزعات مم الغضروف دون التأثير على العظام تحت الغضروف.
- عزل غضروفية من المصفوفة خارج الخلية التي تفارق الأنزيمية للأنسجة مع O / N العلاج مع كولاجيناز النقاء. استخدام نسبة 1: 1 من كولاجيناز الثاني (125 U / مل)، وكولاجيناز الرابع (160 U / مل) في وسائل الإعلام نمو خلية غضروفية عند 37 درجة مئوية.
- في اليوم التالي، تصفية الأنسجة هضمها تحتوي على خلايا فصلها خلال 70مم المسام شبكة حجم النايلون. غسل مرتين مع 20 مل من DMEM / F12 وأجهزة الطرد المركزي في 600 x ج لمدة 5 دقائق.
- لوحة للغضروفية المعزولة في مناطق ذات كثافة من 1 × 10 6 خلايا / 60 مم طبق الثقافة بعد اعادة تعليق في DMEM / F12 تستكمل مع 10٪ مصل بقري جنيني (FBS)، و 25 ميكروغرام / أسكوربات مل، 2 مم L-الجلوتامين، مضادات الميكروبات (100 U / البنسلين مل، 100 ميكروغرام / مل الستربتومايسين، و 0.25 ميكروغرام / مل fungizone). الحفاظ على لوحات في 37 ° C والحفاظ على الثقافات خلية غضروفية الأولية باعتبارها أحادي الطبقة عالية الكثافة قبل التغليف في الهلاميات المائية الجزيئية الحيوية.
2. المحاكاة البيولوجية هيدروجيل تلفيق
ملاحظة: يسمح هذا الأسلوب توليف هيدروجيل بيوميمتيك تحتوي على بولي (جلايكول الإثيلين diacrylate) (PEGDA، MW 5000 جم / مول)، كبريتات شوندروتن-ميتاكريليت (CS-MA) في DPBS. إضافة photoinitiator تمكن يشابك photoactivated. تكوين هيدروجيل النهائي يحتوي على 7٪ تزنر / الحجم (ث / ت) من PEGDA، 3٪ ث / ت من CS-MA، و 0.05٪ ث / ت من photoinitiator.
- توليف CS-MA كتبها functionalizing CS البوليمر مع مجموعات ميتاكريليت.
- يعد حل مخزنة من 50 ملم حمض 2-morpholinoethanesulfonic (MES) و 0.5 M كلوريد الصوديوم (كلوريد الصوديوم) عن طريق إذابة 1.952 غرام من MES و 5.84 غرام من كلوريد الصوديوم في 200 مل من الماء منزوع الأيونات (DiH 2 O). حل 5 غرام من كبريتات شوندروتن ملح الصوديوم في حل مخزنة.
- إضافة 0.532 غرام (4.62 ملمول) N-hydroxysuccinimide (NHS) و1.771 غرام (9.24 ملمول) 1-ايثيل-3- (3-dimethylaminopropyl) هيدروكلوريد -carbodiimide (EDC) (نسبة المولي من NHS: EDC = 1: 2) ل الحل ويقلب لمدة 5 دقائق.
- إضافة 0.765 غرام (4.62 ملمول) ميتاكريليت 2-aminoethyl (AEMA) (نسبة المولي من NHS: EDC: AEMA = 1: 2: 1) إلى حل، والحفاظ على رد الفعل عند RT لمدة 24 ساعة.
- تنقية خليط من قبل غسيل الكلى ضد الماء منزوع الأيونات (diH 2 O) لمدة 4 أيام باستخدام أنابيب غسيل الكلى (12-14 كيلو دالتون MWCO).
- تصفية عحل urified من خلال مرشح 0.22 ميكرون ووضع الأنابيب مفتوحة تحتوي على الحل في المجفف والفراغ O / N. تأكد من أن جميع الأنابيب محمية من الضوء. تخزين البوليمر يذوب عند درجة حرارة -20 ° C محمية من الضوء والرطوبة.
تغليف 3. خلية
- الأوتوكلاف الفيلم وأسطواني قضبان PCR (لكمة من الهلاميات المائية خلايا محملة 3D) وتعقيم أسطواني العفن هلام مصنوعة خصيصا من قبل الانغمار في 0.2 ميكرون تصفية 70٪ من الإيثانول في زراعة الأنسجة غطاء محرك السيارة تحت ضوء الأشعة فوق البنفسجية.
- ختم الجزء السفلي من العفن هلام مع تعقيمها فيلم PCR دون فقاعات الهواء أو الثغرات لمنع التسرب. يبقيه في معقمة 150 ملم لوحة.
- في اليوم السابق لتغليف الخلايا في هيدروجيل بيوميمتيك، تنأى عالية الكثافة خلية غضروفية أحادي الطبقة مع O / N العلاج في كولاجيناز الثاني والرابع كولاجيناز الحل. استخدام 125 U / مل كولاجيناز II و 160 U / مل كولاجيناز السادس كل في نمو خلية غضروفية وسائل الإعلامفي 37 ° C.
- خذ أنبوب 50 مل وتضيف وزنا 5٪ / حجم (ث / ت) (diacrylate جلايكول الإثيلين) بولي (PEGDA، MW = 5000 جم / مول)، و 3٪ ث / ت شوندروتن كبريتات-ميتاكريليت (CS-MA)، و 0.05٪ ث / ت photoinitiator في DPBS. دوامة أنبوب لخلط الحل ويبقيه جانبا. حماية أنبوب من الضوء.
- جمع الخلايا فصل في أنبوب فالكون 50 مل، عد وأجهزة الطرد المركزي في 460 x ج لمدة 5 دقائق. نضح كل وسائل الاعلام من الأنبوب الخلايا وإضافة مادة هلام المختلطة أعلاه لإعادة تعليق الخلايا في مناطق ذات كثافة من 15 × 10 6 خلية / مل. مزجها 30 مرة بدقة مع تجنب فقاعات الهواء التشكيل.
- ماصة 72 ميكرولتر من تعليق خلية هيدروجيل أو هيدروجيل وحدها في هلام أسطواني العفن حسب الطلب ولحث دبق من خلال التعرض للأشعة فوق البنفسجية (365 نانومتر الطول الموجي) في 3 ميغاواط / م 2 لمدة 5 دقائق. إعداد بعض الحلول هيدروجيل مع أي محتوى الخلية. استخدام هذه التركيبات والضوابط السلبية لاختبار الكيمياء الحيوية والميكانيكية في المستقبل. Measuإعادة شدة ضوء الأشعة فوق البنفسجية مع متر كثافة الأشعة فوق البنفسجية. لضبط شدة، تغيير المسافة بين مصدر الضوء فوق البنفسجية وسقالة هيدروجيل خلال دبق.
ملاحظة: منذ هيدروجيل يحتوي CS، يتم طرح مساهمة ديكي من محتوى GAG البيوكيميائية للالهلاميات المائية خلية لادن لا تمثل سوى GAG الخلوية. - استخدام مشرط لقطع فيلم لسهولة تقشر وإزالته بعناية. مع مساعدة من قضبان اسطوانية، ودفع من الجل إلى 6 وحة جيدا مع 5 مل من DPBS معقمة ليغسل هلام unpolymerized والخلايا فضفاضة.
- ثقافة الهلاميات المائية خلية لادن في 24 لوحات جيدة تحتوي على 1.5 مل من وسائط النمو خلية غضروفية في كل بئر. استخدام ملعقة المتاح لنقل الهلاميات المائية غسلها في البئر.
- تقييم بقاء الخلية التي كتبها live ميت تلطيخ 24 ساعة بعد التغليف باستخدام طقم الجدوى / cytotoxity. ثقافة الهلاميات المائية خلية لادن والهلاميات المائية فارغة لمدة 3-6 أسابيع إلى تغيير غرو خلية غضروفية جديدةوث وسائل الإعلام قبل كل أيام 2 حصاد للتحاليل.
4. استخراج الحمض النووي الريبي وجين تحليلات التعبير
- نضح بعناية وسائل الإعلام ووضع معقم PBS 1X على الخلية لادن وكذلك الهلاميات المائية السيطرة فارغة.
- مع مساعدة من ملعقة العقيمة، ونقل كل هيدروجيل إلى نظيفة 1.5 مل أنبوب إيبندورف وإضافة 250 ميكرولتر من ثلاثي كاشف لكل أنبوب. اتبع تعليمات الشركة الصانعة لعزل الحمض النووي الريبي.
- بعد عزل الحمض النووي الريبي وتقدير استخدام 1 ميكروغرام منه من كل عينة وإجراء النسخ عكس إلى كدنا] باستخدام عالية السعة كدنا] عكس النسخ كيت.
- لالكمي PCR استخدام TAQMAN صالحة التعبير الجيني لفحص للتعبير عن الجينات اهتمامك. تطبيع مستويات التعبير الجيني داخليا لGAPDH.
- لظروف PCR تشمل الحضانة 2 دقيقة في 50 ° C إلى تعطيل amplicons السابقة مع glycosylase-DNA اليوراسيل، تليها 1060؛ دقيقة الحضانة عند 95 درجة مئوية لتفعيل بوليميريز طق. ثم نفذ أربعين دورات PCR، ويتألف من 15 ثانية في 95 درجة مئوية، و 1 دقيقة في 60 ° C.
5. تحليل الكيمياء الحيوية
- لكل يبني خلايا هيدروجيل تحديد الحمض النووي وغلكسمينوغلكن] مكبرت (sGAG) الإنتاج على النحو التالي.
- نضح بعناية وسائل الإعلام ووضع معقم PBS 1X على الخلية لادن وكذلك الهلاميات المائية السيطرة فارغة. تزن أنبوب فارغ ووضع هيدروجيل داخل بعد النشاف على المناديل الورقية وتسجيل الوزن أو الوزن الرطب للالهلاميات المائية.
- تجميد كل هيدروجيل في -20 درجة مئوية في 1.5 مل إيبندورف أنبوب منفصل لعملية الهضم الأنزيمي وبعد ذلك استخدام قسامة من المنتج هضمها لتشغيل Picogreen فحص (لDNA) وثنائي ميثيل-الميثيلين الأزرق فحص (لGAG).
- إعداد الحل papainase لعملية الهضم الأنزيمي من الهلاميات المائية.
- أولا إعداد المخزن المؤقت PBE وزنها عن طريق 7،1 غرام من الصوديوم الفوسفاطالبريد ثنائي القاعدة (نا 2 هبو 4) و 1.6 غرام من حمض Ethylenediaminetetraacetic الصوديوم والملح (EDTA-نا 2). تذوب في 500 مل من درهم 2 O، وضبط درجة الحموضة إلى 6.5 وتصفية حل تنقيته من خلال 0.22 ملم مرشح.
- حل 0.035 غرام من L-السيستين في 20 مل من العازلة PBE. تصفية الحل و 100 ميكرولتر من انزيم غراء العقيمة.
- عندما تصبح جاهزة لإجراء فحوصات، واتخاذ أنابيب من -20 ° C وإضافة 300 ميكرولتر من محلول غراء على استعداد لالهلاميات المائية المجمدة. سحق هلام مع هاون ومدقة وتخلط جيدا مع مدقة السيارات.
- تحقيق وحدة التخزين إلى 500 ميكرولتر مع الحل غراء إضافية. تنفيذ نفس الإجراء لالهلام السيطرة. احتضان عند 60 درجة مئوية لمدة 16 ساعة 3،9. وبالتالي يمكن للمحلول يحتوي على هيدروجيل هضمها تستخدم لDNA وGAG الكمي. قياس محتوى الحمض النووي باستخدام فحص Picogreen مع امدا DNA فج وفقا لمعايير التالية العلاقات العامة الشركة المصنعةotocol.
- تحديد محتوى مكبرت-GAG باستخدام الأزرق 1،9-dimethylmethylene (DMMB) ملزم صبغ مقايسة مع الكوندروتن القرش كبريتات وفقا لمعايير 10. تحديد محتوى GAG بقسمة مبلغ GAG للوزن الرطب المقابلة.
6. اختبار الميكانيكية
- إجراء اختبارات الضغط غير المحصورة باستخدام نظام اختبار INSTRON 5944 مزودة بخلية تحميل 10 N.
- بعد أيام المرجوة من الثقافة في المختبر، إجراء اختبار الضغط على سقالة خلايا هيدروجيل والهلاميات المائية السيطرة ديكي.
- غمر العينات في حمام PBS في RT وضغط بمعدل 1٪ سلالة / ثانية لسلالة الحد الأقصى من 15٪ 11،12 منذ سلالة الفسيولوجية التي يمر بها أنسجة الغضروف تحت ظروف التحميل تم الإبلاغ عن أن تكون 10-20٪ 13،14.
- إنشاء الإجهاد مقابل منحنيات سلالة ومنحنى تناسب باستخدام معادلة متعددة الحدود من الدرجة الثالثة. تحديد ل compressive معامل الظل من منحنى تناسب المعادلة في قيم سلالة من 15٪.
النتائج
الهلاميات المائية الحيوية النشطة التي تحتوي على PEG والأنصاف CS (الشكل 1) تمثل منصة مثالية للثقافة ونضوج مفصلي الإنسان غضروفية 2،3،5،7. يمكن تربيتها غضروفية من مختلف الأعمار والحالات المرضية مع الطريقة الموصوفة وتحليلها لالنمط الظاهري، التعبير الجيني وممتلكاتهم الحيوية والميكانيكية للأنسجة الغضروف الذي تم إنشاؤه. ثلاث عينات خلية غضروفية، juvenile- 6 أشهر، adult- 34 عاما وosteoarthritic- 74 عاما، تم حصادها بعد 3 أسابيع من الثقافة في الهلاميات المائية 3D المحاكاة البيولوجية. تحليل التعبير الجيني من غضروفية العادية، سواء الأحداث والبالغين، أظهرت زيادة في التعبير عن الجينات خلية غضروفية Col2a1 وCol6a1. على العكس من ذلك، أظهرت غضروفية المريضة انخفاضا كبيرا في Col2a1 مع المحافظة على التعبير عن Col6a1 (الشكل 2) يدل على فقدان النمط الظاهري مكون للغضروف على الرغم من كونه مثقف في بيئة مواتية الجزيئية الحيوية.
الهلاميات المائية CS-PEG أيضا بمثابة بيئة ديناميكية للغضروفية لتتكاثر، هضم مصفوفة موجودة مسبقا من PEG وCS وتودع المحيطة بالخلايا وخارج الخلية المصفوفة، والمكونات الرئيسية للأنسجة الغضروف ناضجة. ونظرا لهذه القدرات، وتوسيع خلية غضروفية بعد 3 أسابيع من الثقافة في المختبر يمكن تقدير الكمي من الحمض النووي مع صبغة Picogreen. تظهر تحليل مقارن لثلاث مجموعات من الخلايا التي كثافة الخلية من الأحداث والبالغين السكان لم تتغير في حين أظهرت غضروفية OA انخفاضا كبيرا مقارنة مع يوم 1 من الثقافة. ولوحظ وجود خسائر في محتوى الحمض النووي أيضا لOA لكن ليس غضروفية اخرى تشير الى موت الخلايا الممكن خلال ثقافة على المدى الطويل (الشكل 3). وكان كميا المصفوفة يفرز كمحتوى مكبرت-GAG التي كتبها DMMB ملزم صبغ الفحص في المرحلة نقطة النهاية بعد 3 أسابيع من الثقافات. وتطبيع محتوى هفوة من الوزن الرطب للهيدروجيل كما recorدائرة التنمية الاقتصادية قبل الهضم الأنزيمي والمساهمة ديكي هو مطروح. كما هو مبين في الشكل (4)، غضروفية أودعت مبلغ كبير مماثل من GAG خلال 3 أسابيع من الثقافة في الهلاميات المائية 3D.
وجود سقالة البدنية يسمح للتقييم خصائص النشاط الحيوي من العينات من خلال الاختبارات غير محصورة ضغط 2،3. وفي حين تخضع الهلاميات المائية ديكي انخفاض في الضغط الرجوعية، حافظت يبني خلايا لادن الرجوعية الضغط بعد 3 أسابيع في الثقافة (الشكل 4). والمظهرية، والتحليلات الكيميائية الحيوية والنشاط الحيوي وصفها هنا وبالتالي مفيد لتقييم وفهم إمكانات السكان خلية غضروفية مختلفة للهندسة الغضروف.

الشكل 1. PEG-CS الهلاميات المائية المحاكاة البيولوجية للخلية غضروفية 3D طريق مسدودمعلق تلح. غضروفية في مزيج يحتوي على بولي (جلايكول الإثيلين diacrylate) (PEGDA) وكبريتات شوندروتن-ميتاكريليت (CS-MA) ومسبوكة في قالب أسطواني هلام حسب الطلب. بعد التعرض للأشعة فوق البنفسجية، عزز يتم جمع المواد الهلامية من قوالب ويتم تقييم قابلية الخلية عن طريق تلطيخ الميت الحي 24 ساعة بعد التغليف. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2. التعبير عن الجينات المولدة للغضروف في غضروفية البشرية المستزرعة في الهلاميات المائية 3D المحاكاة البيولوجية. التعبير الجيني الكمي للعلامات الغضروف Col2a1 وCol6a1 التي كتبها غضروفية الأحداث وتعليم الكبار وOA بعد 3 أسابيع من الثقافة في الهلاميات المائية 3D المحاكاة البيولوجية. يتم تطبيع القيم إلى مستوى التعبير الجيني في اليوم 1. خطأ بARS تمثل يعني ± SD. ص * <0.05 على النحو الذي يحدده تي اختبار ثنائي الطرف الطالب. تعديل من Smeriglio وآخرون. 2 الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الرقم محتوى 3. DNA في الخلايا الغضروفية البشرية المستزرعة في الهلاميات المائية الجزيئية الحيوية 3D. الكمي الحمض النووي عن طريق فحص Picogreen في غضروفية الأحداث وتعليم الكبار وOA بعد 3 أسابيع من الثقافة في الهلاميات المائية 3D المحاكاة البيولوجية. يتم تطبيع القيم إلى مستوى DNA في اليوم 1. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
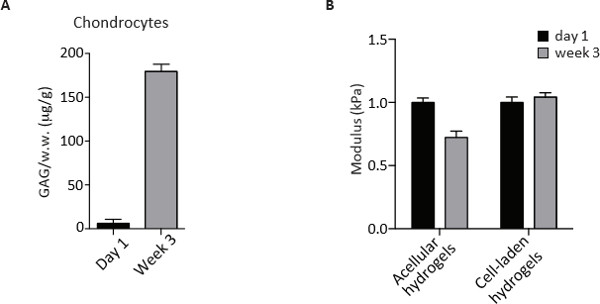 <ر /> الشكل 4. GAG قياس المحتوى وغير محصورة اختبار ضغط غضروفية الإنسان في يوم 1 وبعد 3 أسابيع من الثقافة في الهلاميات المائية 3D المحاكاة البيولوجية. (A) GAG الكمي من قبل DMMB فحص في غضروفية في يوم 1 وبعد 3 أسابيع من الثقافة في 3D الهلاميات المائية الجزيئية الحيوية. القيم هي طبيعية لترطيب الوزن (رطب) ويعبر عنها ميكروغرام / غرام. (B) معامل الانضغاط (باسكال) من اخلوي وخلايا لادن الهلاميات المائية في يوم 1 وبعد 3 أسابيع من الثقافة في الهلاميات المائية الجزيئية الحيوية 3D. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
<ر /> الشكل 4. GAG قياس المحتوى وغير محصورة اختبار ضغط غضروفية الإنسان في يوم 1 وبعد 3 أسابيع من الثقافة في الهلاميات المائية 3D المحاكاة البيولوجية. (A) GAG الكمي من قبل DMMB فحص في غضروفية في يوم 1 وبعد 3 أسابيع من الثقافة في 3D الهلاميات المائية الجزيئية الحيوية. القيم هي طبيعية لترطيب الوزن (رطب) ويعبر عنها ميكروغرام / غرام. (B) معامل الانضغاط (باسكال) من اخلوي وخلايا لادن الهلاميات المائية في يوم 1 وبعد 3 أسابيع من الثقافة في الهلاميات المائية الجزيئية الحيوية 3D. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
كما ورد في هذا البروتوكول، والهلاميات المائية 3D هي قادرة على الحفاظ على خلية غضروفية النمط الظاهري في الثقافة، وتجنب عملية فقد التمايز الخلوي في خلايا الغضروف الليفي عادة اجه مع الثقافات أحادي الطبقة 15. وعلاوة على ذلك، كشفت الثقافات على المدى الطويل هيدروجيل بناء chondrocytes- بيئة مواتية التي تحافظ على الميزات خلية الجوهرية المرتبطة مع التقدم في السن والمرض.
استخدام هيدروجيل بيوميمتيك 3D ديها العديد من المزايا. أولا، إدراج شوندروتن كبريتات (CS)، عنصرا رئيسيا وجدت في الغضروف المفصلي، تمكن الخلايا من تدهور مصفوفة هيدروجيل عن طريق إفراز chondroitinase ووضع الغضروف تصنيعه حديثا خارج الخلوي مصفوفة 5، 16. وبالإضافة إلى ذلك، فقد تبين CS أن لها خصائص مضادة للالتهاب في المفصل الملتهب. ويمكن أيضا هيدروجيل بيوميمتيك أن تستخدم كمادة سقالات للتسليم خلية في إصلاح الغضروف، ويمكن تعديله كيميائيالتسهيل أفضل الأنسجة بيولوجية التكامل 17،18.
استخدام الهلاميات المائية PEG-CS يسمح الثقافات على المدى الطويل غضروفية وتقييم الخصائص الحيوية والميكانيكية. نحن هنا تظهر كيف يمكن لهذا النظام الأساسي أن يكون مفيدا للتحليلات مقارنة من مصادر مختلفة من الخلايا الغضروفية متباينة من أجل تحديد نوع الخلية الأمثل للهندسة الغضروف. ومن المثير للاهتمام، غضروفية مغلفة في الهلاميات المائية لا تزال قابلة للحياة وتتكاثر وفقا لقدراتهم الذاتية. ويدعم تكوين هيدروجيل، في الواقع، ونمو الأحداث والبالغين غضروفية صحية كما هو مبين في الشكل (2). وتكوينها وهيكلها من الهلاميات المائية وصفها أيضا يعزز تكوين الأنسجة الغضروف كما يتضح من ترسب مصفوفة خارج الخلية الوظيفية المقررة من قبل غلكسمينوغلكن] (GAG ) الكمي.
ميزة إضافية هي أن يبني-خلية غضروفية هيدروجيليمكن تقييمها للالخواص الميكانيكية للأنسجة الغضاريف التي شكلت حديثا. لاحظ أن اختبار ضغط غير محصورة ينبغي أن يقوم على هيدروجيل لا خلوي للمقارنة. الهلاميات المائية، في الواقع، لديهم تصلب الجوهرية بسبب صلابة من الأنصاف CS. سلالة ضغط غير محصورة من 5-20٪ (بمعدل 1٪ سلالة / ثانية) يمكن تطبيقها لاختبار الميكانيكية الغضروف نسيج 11،12 منذ سلالة الفسيولوجية التي يمر بها أنسجة الغضروف تحت ظروف التحميل تم الإبلاغ عن أن تكون 10-20 ٪ 13،14. تم تقييم استجابة كل خلية لادن واخلوي الهلاميات المائية لاختبار الميكانيكية في ثقافة نقطة النهاية. في المثال المذكورة أعلاه لاحظنا صلابة مقارنة للبنيات التي تحتوي على غضروفية الكبار والأحداث على النقيض من صلابة أقل من بنيات التي تحتوي على غضروفية OA. هذه الخواص الميكانيكية للبناء خلايا هيدروجيل تسمح بتقييم الخصائص الفنية للالأنسجة شكلت إعطاء تحليل متعمق من القدرة نضوج الخلية.
في الختام، واستخدام الهلاميات المائية 3D المحاكاة البيولوجية لدراسة إمكانيات السكان خلية غضروفية مختلفة لتوليد أنسجة الغضروف يمكن تطبيقها على نطاق واسع. إلى جانب الدراسات في المختبر الموصوفة هنا، في الجسم الحي زرع يبني خلايا محملة يمكن تصوره لدراسة نضوج الخلايا وإمكانات التجدد في سياق الفسيولوجية. ويمكن أيضا إدخال تعديلات إضافية من منصة هيدروجيل مع العوامل الجزيئية الحيوية إضافية يمكن تصوره لتحسين انتشار خلية غضروفية والنضج.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to acknowledge Stanford Department of Orthopaedic Surgery and Stanford Coulter Translational Seed Grant for funding. J.H.L. would like to thank National Science Foundation Graduate Fellowship and DARE Doctoral Fellowship for support.
Materials
| Name | Company | Catalog Number | Comments |
| juvenile chondrocytes (Clonetics Normal Human Chondrocyte Cell System ) | Lonza | CC-2550 | |
| adult chondrocytes (Clonetics Normal Human Chondrocyte Cell System) | Lonza | CC-2550 | |
| poly(ethylene glycol diacrylate) | Laysan Bio | ACRL-PEG-ACRL-1000-1g | |
| 2-morpholinoethanesulfonic acid | Sigma | M5287 | |
| photoinitiator | Irgacure | 2959 | |
| sodium chloride | Sigma | S9888 | |
| chondroitin sulfate sodium salt | Sigma | C9819 | |
| N-hydroxysuccinimide | Sigma | 130672 | |
| 1-ethyl-3-(3-dimethylaminopropyl)-carbodiimide hydrochloride | Sigma | E1769 | |
| 2-aminoethyl methacrylate | Sigma | 516155 | |
| dialysis tubing | Spectrum Laboratories | 132700 | |
| Collagenase 2 | Worthington Biochemical | LS004177 | |
| Collagenase 4 | Worthington Biochemical | LS004189 | |
| DMEM/F12 media | HyClone, Thermo Scientific | SH3002301 | |
| live/dead assay | Life Technologies | L3224 | |
| Tri reagent | Life Technologies | AM9738 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Invitrogen | P11496 | |
| Sodium phosphate dibasic | Sigma | S3264 | |
| Ethylenediaminetetraacetic acid disodium salt | Sigma | E5134 | |
| L-Cysteine | Sigma | C1276 | |
| 1,9-dimethylmethylene blue | Sigma | 341088 | |
| Instruments | |||
| UV light equipment - XX-15LW Bench Lamp, 365 nm | UVP | 95-0042-07 | |
| Instron 5944 testing system | Instron Corporation | E5940 |
References
- Roberts, S., Menage, J., Sandell, L. J., Evans, E. H., Richardson, J. B. Immunohistochemical study of collagen types I and II and procollagen IIA in human cartilage repair tissue following autologous chondrocyte implantation. Knee. 16, 398-404 (2009).
- Smeriglio, P., et al. Comparative Potential of Juvenile and Adult Human Articular Chondrocytes for Cartilage Tissue Formation in Three-Dimensional Biomimetic Hydrogels. Tissue engineering. Part A. , (2014).
- Lai, J. H., Kajiyama, G., Smith, R. L., Maloney, W., Yang, F. Stem cells catalyze cartilage formation by neonatal articular chondrocytes in 3D biomimetic hydrogels. Scientific reports. 3, 3553 (2013).
- Taipale, J., Keski-Oja, J. Growth factors in the extracellular matrix. FASEB journal : official publication of the Federation of American Societies for Experimental Biology. 11, 51-59 (1997).
- Varghese, S., et al. Chondroitin sulfate based niches for chondrogenic differentiation of mesenchymal stem cells. Matrix Biol. 27, 12-21 (2008).
- Park, J. S., et al. The effect of matrix stiffness on the differentiation of mesenchymal stem cells in response to TGF-beta. Biomaterials. 32, 3921-3930 (2011).
- Wang, T., Lai, J. H., Han, L. H., Tong, X., Yang, F. Chondrogenic Differentiation of Adipose-Derived Stromal Cells in Combinatorial Hydrogels Containing Cartilage Matrix Proteins with Decoupled Mechanical Stiffness. Tissue engineering. Part A. , (2014).
- Smith, R. L., et al. Effects of intermittent hydrostatic pressure and BMP-2 on osteoarthritic human chondrocyte metabolism in vitro. J Orthop Res. 29, 361-368 (2011).
- Buschmann, M. D., Gluzband, Y. A., Grodzinsky, A. J., Kimura, J. H., Hunziker, E. B. Chondrocytes in agarose culture synthesize a mechanically functional extracellular matrix. J Orthop Res. 10, 745-758 (1992).
- Farndale, R. W., Buttle, D. J., Barrett, A. J. Improved quantitation and discrimination of sulphated glycosaminoglycans by use of dimethylmethylene blue. Biochim Biophys Acta. 883, 173-177 (1986).
- Lai, J. H., Levenston, M. E. Meniscus and cartilage exhibit distinct intra-tissue strain distributions under unconfined compression. Osteoarthritis and cartilage / OARS, Osteoarthritis Research Society. 18, 1291-1299 (2010).
- Li, L. P., Buschmann, M. D., Shirazi-Adl, A. Strain-rate dependent stiffness of articular cartilage in unconfined compression. Journal of biomechanical engineering. 125, 161-168 (2003).
- Armstrong, C. G., Bahrani, A. S., Gardner, D. L. In vitro measurement of articular cartilage deformations in the intact human hip joint under load. The Journal of bone and joint surgery. American. 61, 744-755 (1979).
- Macirowski, T., Tepic, S., Mann, R. W. Cartilage stresses in the human hip joint. Journal of biomechanical engineering. 116, 10-18 (1994).
- Benya, P. D., Shaffer, J. D. Dedifferentiated chondrocytes reexpress the differentiated collagen phenotype when cultured in agarose gels. Cell. 30, 215-224 (1982).
- Buckwalter, J. A., Mankin, H. J. Articular cartilage: tissue design and chondrocyte-matrix interactions. Instructional course lectures. 47, 477-486 (1998).
- Wang, D. A., et al. Multifunctional chondroitin sulphate for cartilage tissue-biomaterial integration. Nat Mater. 6, 385-392 (2007).
- Simson, J. A., Strehin, I. A., Allen, B. W., Elisseeff, J. H. Bonding and fusion of meniscus fibrocartilage using a novel chondroitin sulfate bone marrow tissue adhesive. Tissue engineering. Part A. 19, 1843-1851 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved