Method Article
3D Hidrogel Andaimes para articular de condrócitos Cultura e Geração de cartilagem
Neste Artigo
Resumo
Cartilage repair represents an unmet medical challenge and cell-based approaches to engineer human articular cartilage are a promising solution. Here, we describe three-dimensional (3D) biomimetic hydrogels as an ideal tool for the expansion and maturation of human articular chondrocytes.
Resumo
Human articular cartilage is highly susceptible to damage and has limited self-repair and regeneration potential. Cell-based strategies to engineer cartilage tissue offer a promising solution to repair articular cartilage. To select the optimal cell source for tissue repair, it is important to develop an appropriate culture platform to systematically examine the biological and biomechanical differences in the tissue-engineered cartilage by different cell sources. Here we applied a three-dimensional (3D) biomimetic hydrogel culture platform to systematically examine cartilage regeneration potential of juvenile, adult, and osteoarthritic (OA) chondrocytes. The 3D biomimetic hydrogel consisted of synthetic component poly(ethylene glycol) and bioactive component chondroitin sulfate, which provides a physiologically relevant microenvironment for in vitro culture of chondrocytes. In addition, the scaffold may be potentially used for cell delivery for cartilage repair in vivo. Cartilage tissue engineered in the scaffold can be evaluated using quantitative gene expression, immunofluorescence staining, biochemical assays, and mechanical testing. Utilizing these outcomes, we were able to characterize the differential regenerative potential of chondrocytes of varying age, both at the gene expression level and in the biochemical and biomechanical properties of the engineered cartilage tissue. The 3D culture model could be applied to investigate the molecular and functional differences among chondrocytes and progenitor cells from different stages of normal or aberrant development.
Introdução
With its limited self-repair potential, human articular cartilage undergoes frequent irreversible damages. Extensive efforts are currently focused on the development of efficient cell-based approaches for treatment of articular cartilage injuries. The success of these cell-based therapies is highly dependent on the selection of an optimal cell source and the maintenance of its regenerative potential. Chondrocytes are a common cell source for cartilage repair, but they are limited in supply and can de-differentiate during in vitro expansion in 2D monolayer culture thereby limiting their generation of hyaline cartilage 1.
The aim of this protocol is to establish a 3-dimensional hydrogel platform for an in vitro comparative study of human chondrocytes from different ages and disease state. Unlike conventional two-dimensional (2D) culture, three-dimensional (3D) hydrogels allow chondrocytes to maintain their morphology and phenotype and provides a physiologically relevant environment enabling chondrocytes to produce cartilage tissue 2,3. In addition to providing a 3D physical structure for chondrocyte culture, hydrogels mimic the function of native cartilage extracellular matrix (ECM). Specifically, the inclusion of chondroitin sulfate methacrylate provides a potential reservoir for secreted paracrine factors 4 and enables cell-mediated degradation and matrix turnover 5. Although many 3D hydrogel culture systems have been utilized widely in various studies including agarose and alginate gels, we have used a biomimetic 3D culture system that has some distinct advantages for chondrocyte culture. Chondroitin sulfate (CS) is an abundant component in articular cartilage and the PEG-CS hydrogels have been shown to maintain and even enhance chondrogenic phenotype and facilitate cell-mediated matrix degradation and turnover 2,5. In addition, the mechanical properties of the hydrogel scaffold can be easily modulated by changing concentration of PEG and hence can be utilized to further enhance the regeneration potential of chondrocytes or a related cell type 6,7. PEG/CSMA is also biocompatible and hence has the potential for a direct clinical application in cartilage defects for example. The limitation for this system is its complexity and the use of photopolymerization that can potentially affect cell viability as compared to simpler systems like agarose, however the advantages for the chondrocyte culture outweigh the potential limitations.
The 3D hydrogel culture is compatible with conventional assay for evaluation of cell phenotype (gene expression, protein immunostaining) and functional outcome (quantification of cartilage matrix production, mechanical testing). This favorable 3D environment was tested to compare the tissue regeneration potential of human chondrocytes from three different aged populations in long-term 3D cultures.
The outcomes were evaluated via both phenotypic and functional assays. Juvenile, adult and OA chondrocytes showed differential responses in the 3D biomimetic hydrogel culture. After 3 and 6 weeks, chondrogenic gene expression was upregulated in juvenile and adult chondrocytes but was downregulated in OA chondrocytes. Deposition of cartilage tissue components including aggrecan, type II collagen, and glycosaminoglycan (GAG) was high for juvenile and adult chondrocytes but not for OA chondrocytes. The compressive moduli of the resulting cartilage constructs also exhibited similar trends. In conclusion, both juvenile and adult chondrocytes exhibited chondrogenic and cartilage matrix disposition up to 6 weeks of 3D culture in hydrogels. In contrast, osteoarthritic chondrocytes revealed a loss of cartilage phenotype and minimal ability to generate robust cartilage.
Protocolo
Todos os experimentos foram realizados de acordo com as orientações dos sujeitos Stanford University Humanos e aprovado protocolo Institutional Review Board.
1. Articular condrócitos Isolamento
- Obter cartilagem a partir de tecido descartado durante artroplastia total do joelho e dissecar como descrito anteriormente 8.
- Visualmente seleccionar os côndilos femorais mediais ou laterais de amostras de cartilagem de superfícies lisas e fazer incisão na superfície da cartilagem por meio de um bisturi de forma a remover as biópsias 4-5 mm de cartilagem sem afectar o osso subcondral.
- Isolar condrócitos a partir da matriz extracelular por dissociação enzimática do tecido com tratamento / N O com colagenase purificados. Use proporção 1: 1 de colagenase II (125 U / ml) e a colagenase IV (160 U / mL) em meio de crescimento de condrócitos a 37 ° C.
- No dia seguinte, filtra-se o tecido digerido contendo as células dissociadas através de uma 70mm tamanho dos poros da malha de nylon. Lavar duas vezes com 20 ml de DMEM / F12 e centrifugar a 600 xg durante 5 min.
- Placa os condrócitos isoladas a uma densidade de 1 x 10 6 células / 60 mm prato de cultura a seguir re-suspensão em meio DMEM / F12 suplementado com 10% de Soro Fetal Bovino (FBS), 25 ug / ascorbato mL, 2 mM de L-glutamina, antimicrobianos (100 U / ml de penicilina, 100 ug / ml de estreptomicina, e 0,25 ug / ml de fungizona). Manter as placas a 37 ° C e manter as culturas de condrócitos primários como uma monocamada de alta densidade antes da encapsulação em hidrogéis biomiméticos.
2. Biomimético Hidrogel Fabrication
NOTA: Este método permite a síntese de um hidrogel biomimética contendo poli (etileno-glicol diacrilato) (PEGDA, PM 5000 g / mol), sulfato de condroitina-metacrilato (CS-MA) em DPBS. A adição de foto-iniciador de reticulação permite fotoactivado. A composição de hidrogel final contém 7% pesart / volume (w / v) de PEGDA, 3% w / v de CS-MA, e 0,05% w / v do foto-iniciador.
- Sintetizar CS-MA por funcionalização polímero CS com grupos de metacrilato.
- Preparar uma solução tamponada de 50 mM de ácido 2-morpholinoethanesulfonic (MES) 0,5 M e cloreto de sódio (NaCl) por dissolução de 1,952 g de MES e 5,84 g de NaCl em 200 ml de água desionizada (DIH 2 O). Dissolve-se 5 g de sal de sulfato de condroitina de sódio na solução tamponada.
- Adicionar 0,532 g (4,62 mmol) de N-hidroxissuccinimida (NHS) e 1,771 g (9,24 mmol) de 1-etil-3- (3-dimetilaminopropil) -carbodiimida (EDC) (proporção molar de NHS: EDC = 1: 2) para a solução e agita-se durante 5 min.
- Adicionar 0,765 g (4,62 mmol) de metacrilato de 2-aminoetilo (AEMA) (proporção molar de NHS: EDC: AEMA = 1: 2: 1) à solução e manter a reacção à temperatura ambiente durante 24 h.
- Purifica-se a mistura através de diálise contra água desionizada (DIH 2 O) durante 4 dias, utilizando tubagem de diálise (MWCO de 12-14 kDa).
- Filtra-se a purified solução através de um filtro de 0,22 um e coloque os tubos abertos contendo a solução no exsicador de vácuo e S / N. Assegurar que todos os tubos são protegidas da luz. Armazenar o polímero dissolvido à temperatura de -20 ° C ao abrigo da luz e humidade.
Encapsulation 3. celular
- Autoclave o filme e cilíndricas hastes de PCR (para perfurar os hidrogéis 3D de células-laden) e esterilizar o molde gel cilíndrico feito por encomenda por submersão em 0,2 m filtrada 70% de etanol em cultura de tecidos capô sob luz UV.
- Fecha-se o fundo do molde de gel com película de PCR autoclavado sem bolhas de ar ou aberturas para evitar a fuga. Mantê-lo em um estéril placa de 150 mm.
- O dia antes da encapsulação de células em hidrogel biomimética, dissociar a condrócitos de monocamada de alta densidade com tratamento / N O em colagenase II e solução de colagenase IV. Use 125 U / ml para a colagenase II e 160 U / ml de colagenase para cada VI em meios de crescimento de condrócitosa 37 ° C.
- Tomar um tubo de 50 ml e adicionam-se 5% em peso / volume (w / v) (diacrilato de etileno-glicol) poli (PEGDA, PM = 5.000 g / mol), 3% w / v de sulfato de condroitina-metacrilato (CS-MA), e 0,05% w / v fotoiniciador em DPBS. Vortex do tubo para misturar a solução e mantê-lo de lado. Proteger o tubo de luz.
- Recolher as células dissociadas num tubo Falcon de 50 ml, contar e centrifugar a 460 xg durante 5 min. Aspirar todo o material da tubo de células e adicionar o material de gel misturado acima para re-suspender as células a uma densidade de 15 x 10 6 células / ml. Misturá-lo 30 vezes completamente, evitando a formação de bolhas de ar.
- Pipetar 72 ul da suspensão de células de hidrogel ou hidrogel sozinho para dentro do molde de gel cilíndrico feito por encomenda e induzir a gelificação por exposição à luz UV (365 nm de comprimento de onda) a 3 mW / m 2 durante 5 min. Prepare alguma solução de hidrogel sem conteúdo celular. Use essas construções como controlos negativos para o futuro de testes bioquímicos e mecânica. Measure a intensidade da luz UV com um medidor de intensidade da radiação UV. Para ajustar a intensidade, alterar a distância entre a fonte de luz UV e o andaime hidrogel durante a gelificação.
Observação: Uma vez que o hidrogel contém CS, a contribuição acelular é subtraído do conteúdo de GAG bioquímica dos hidrogéis de células carregadas para representar apenas o GAG celular. - Use um bisturi para cortar o filme para fácil peel off e com cuidado remova-o. Com a ajuda das hastes cilíndricas, empurrar para fora do gel para uma placa de 6 poços com 5 ml de DPBS estéril para lavar gel não polimerizado e células soltas.
- Cultura os hidrogéis de células carregadas em placas de 24 poços contendo 1,5 mL de meio de crescimento de condrócitos em cada poço. Usar uma espátula descartável para transferir os hidrogéis lavou no bem.
- Avaliar a viabilidade celular por mortos vivem coloração 24 horas pós-encapsulamento usando um kit de viabilidade / citotoxicidade. Cultura os hidrogéis de células-laden e os hidrogéis vazios para 3-6 semanas mudando para gro de condrócitos frescoswth mídia a cada 2 dias antes da colheita para as análises.
4. RNA Extração e Análise de Expressão Gênica
- Aspirar cuidadosamente a mídia e colocar estéril PBS 1X na célula-laden, bem como os hidrogéis de controle vazios.
- Com a ajuda de uma espátula estéril, transferir cada um hidrogel a um tubo eppendorf de 1,5 ml limpo e adicionar 250 ul de Tri-reagente a cada tubo. Siga as instruções do fabricante para isolar RNA.
- Após o isolamento de RNA e quantificação utilização de 1 ug de cada amostra que e efectuar uma transcrição invertida em ADNc utilizando o High Capacity cDNA Kit de Transcrição Reversa.
- Para PCR quantitativo usar TaqMan Gene Expression Arrays para exame da expressão de seus genes de interesse. Normalizar os níveis de expressão do gene de GAPDH internamente.
- Para as condições de PCR incluem a 2 min de incubação a 50 ° C para inactivar amplicões anteriores com glicosilase de uracilo de ADN, seguido por um 1060; min de incubação a 95 ° C para activar a polimerase de Taq. Em seguida, executar ciclos de PCR quarenta, que consistem de 15 seg a 95 ° C e 1 min a 60 ° C.
5. As análises bioquímicas
- Para cada estruturas celulares de hidrogel quantificar DNA e glicosaminoglicanos sulfatados (sGAG) produção como acompanhamento.
- Aspirar cuidadosamente a mídia e colocar estéril PBS 1X na célula-laden, bem como os hidrogéis de controle vazios. Pesar um tubo vazio e colocar o hidrogel dentro após a secagem-lo em papel de seda e registrar o peso ou peso úmido dos hidrogéis.
- Congelar cada hidrogel à temperatura de -20 ° C em um tubo Eppendorf de 1,5 ml separado para a digestão enzimática e depois usar-se uma alíquota do produto digerido a executar ensaio de Picogreen (para o DNA) e dimetil-metileno ensaio de azul (por GAG).
- Preparar a solução de papainase por digestão enzimática dos hidrogéis.
- Primeiro prepare o tampão PBE por pesando 7,1 g de sódio phosphate dibico (Na 2 HPO 4) e 1,6 g do ácido etilenodiaminotetracético, sal dissódico (EDTA-Na2). Dissolver em 500 ml de dH 2 O, ajustar o pH para 6,5 e a solução purificada filtrar através de um filtro de 0,22 mm.
- Dissolve-se 0,035 g de L-cisteína em 20 ml de tampão de PBE. Filtra-se a solução e 100 ul de enzima papaína estéril.
- Quando estiver pronto para realizar os ensaios, levar os tubos de -20 ° C e adicionar 300 ul da solução de papaína pronto para os hidrogéis congelados. Esmagar o gel com um almofariz e pilão e misture bem com o pilão motor.
- Levar o volume para 500 ul com solução de papaína adicional. Realizar o mesmo procedimento para os geles de controlo. Incubar a 60 ° C durante 16 horas 3,9. A solução contendo o hidrogel pode digerido por conseguinte, utilizados para quantificação de ADN e de GAG. Medir o teor de ADN, utilizando o ensaio de Picogreen com fago lambda de ADN como padrão seguinte PR do fabricanteotocol.
- Quantificar o conteúdo sulfatada-GAG utilizando o azul 1,9-dimetilmetileno (DMMB) ensaio de ligação de corante com sulfato de condroitina tubarão como padrão 10. Determinar o teor de GAG dividindo-se a quantidade de GAG para o peso húmido correspondente.
6. Ensaios Mecânicos
- Realizar ensaios de compressão simples, utilizando um Instron 5944 sistema de testes equipada com uma célula de carga de 10 N.
- Depois dos dias desejados de cultura in vitro, execute o teste de compressão no cadafalso célula-hidrogel e os hidrogéis de controle acelular.
- Submergir as amostras em um banho de PBS à temperatura ambiente e comprimir a uma taxa de 1% de deformação / seg para uma tensão máxima de 15% 11,12 desde o esforço fisiológico experimentado por tecido de cartilagem sob condições de carga tem sido relatada como sendo de 10-20% 13,14.
- Criar estresse vs. curvas de tensão e ajuste de curva usando uma equação polinomial de terceira ordem. Determinar os comprmódulo tangente essive partir da curva de ajuste equação em valores de deformação de 15%.
Resultados
Hidrogéis bioactivos contendo PEG e porções CS (Figura 1) representam uma plataforma ideal para a cultura e maturação de condrócitos articulares humanos 2,3,5,7. Os condrócitos a partir de diferentes idades e estados de doença podem ser cultivadas com o método descrito e analisado para o seu fenótipo, a expressão do gene e propriedades bioquímicas e mecânicas do tecido de cartilagem gerado. Três amostras de condrócitos, juvenile- 6 meses, adulto-34 anos e 74 anos osteoarthritic-, foram colhidos após 3 semanas de cultura em hidrogéis biomiméticos 3D. Análises de condrócitos normais, tanto adulto e juvenil expressão de genes, apresentaram um aumento na expressão dos genes de condrócitos COL2A1 e COL6A1. Pelo contrário, os condrócitos doentes apresentaram uma diminuição dramática no COL2A1 enquanto se mantinha a expressão de COL6A1 (Figura 2) mostra uma perda de fenótipo condrogénica apesar de ser cultivadas num ambiente biomimética favorável.
Os hidrogeles de PEG-CS também servir como um ambiente dinâmico para os condrócitos a proliferar, digerir a matriz pré-existente de PEG e CS e depositar sua matriz pericelular e extracelular, os principais componentes do tecido de cartilagem madura. Tendo em conta estas qualidades, a expansão de condrócitos após 3 semanas de cultura in vitro pode ser estimada pela quantificação de ADN com o corante Picogreen. A análise comparativa dos três grupos de células demonstram que a densidade de populações de células juvenis e adultas foi inalterada enquanto os condrócitos OA exibiram uma diminuição dramática em comparação com o dia 1 de cultura. A perda de teor de ADN foi também observado por OA mas não outros condrócitos sugerindo a possibilidade de a morte das células durante a cultura a longo prazo (Figura 3). A matriz segregada foi quantificada como teor de GAG sulfatado-por ensaio de ligação de corante DMMB na fase de ponto final após 3 semanas de cultura. MORDAÇA conteúdo é normalizada pelo peso úmido do hidrogel como recorDED antes da digestão enzimática e da contribuição acelular é subtraído. Como mostrado na Figura 4, os condrócitos depositada uma quantidade significativa de GAG semelhante durante 3 semanas de cultura em hidrogéis 3D.
A presença de uma estrutura de suporte físico permite a avaliação de propriedades biomecânicas das amostras não confinada por meio de ensaios de compressão 2,3. Embora os hidrogéis acelulares submetido a um decréscimo na módulos de compressão, as construções de células-mantida em carga os módulos de compressão ao fim de 3 semanas em cultura (Figura 4). O fenotípica, análises bioquímicas e biomecânicas aqui descritas são, portanto, úteis para avaliar e compreender o potencial de diferentes populações de condrócitos para a cartilagem de engenharia.

Figura 1. PEG-CS hidrogéis biomiméticos para condrócitos cul 3Dtura. Os condrócitos são ressuspensas numa mistura que contém o poli (etileno glicol diacrilato) (PEGDA) e sulfato de condroitina-metacrilato (CS-MA) e fundido para dentro do molde de gel cilíndrico feito por encomenda. Após a exposição UV, solidificou géis são recolhidos a partir dos moldes e viabilidade celular é avaliada por coloração morto ao vivo 24 horas pós-encapsulamento. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2. Expressão de genes condrogênicos em condrócitos humanos cultivados em hidrogéis biomiméticos 3D. Quantitativa de expressão do gene COL2A1 marcadores da cartilagem e COL6A1 por juvenis, adultos e OA condrócitos após 3 semanas de cultura em hidrogéis biomiméticos 3D. Os valores são normalizados para o nível expressão gênica no dia 1. Erro bars representam a média ± SD. * p <0,05, conforme determinado por um teste t de Student bicaudal. Modificado de Smeriglio et al. 2 Por favor, clique aqui para ver uma versão maior desta figura.

Figura 3. teor de ADN em condrócitos humanos cultivados em hidrogéis biomiméticos 3D. Quantificação por ensaio de ADN Picogreen em juvenis, adultos e OA condrócitos após 3 semanas de cultura em hidrogéis biomiméticos 3D. Os valores são normalizados para nível DNA no dia 1. Por favor, clique aqui para ver uma versão maior desta figura.
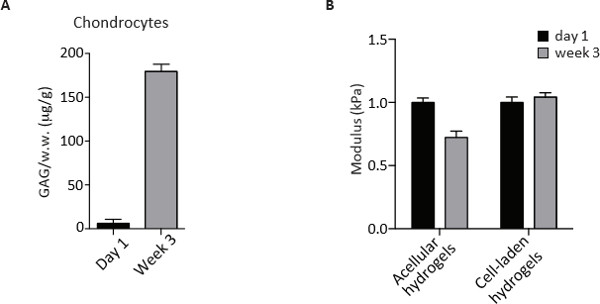
Figura 4. GAG medição de conteúdo e teste de compressão simples de condrócitos humanos no dia 1 e depois de 3 semanas de cultura em hidrogéis biomiméticos 3D. (A) GAG quantificação por ensaio DMMB em condrócitos no dia 1 e depois de 3 semanas de cultura em hidrogéis biomiméticos 3D. Os valores são normalizados para molhar peso (ww) e expressos como ug / g. (B) módulo de compressão (kPa) de acelular e celulares carregados de hidrogéis no dia 1 e depois de 3 semanas de cultura em hidrogéis biomiméticos 3D. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Conforme relatado no presente protocolo, os hidrogéis 3D são capazes de manter condrócitos fenótipo na cultura, evitando o processo de desdiferenciação celular em células fibrocartilagem normalmente encontrados com culturas em monocamada 15. Além disso, as culturas a longo prazo do construto hidrogel chondrocytes- revelou um ambiente favorável que mantém as características intrínsecas de células associadas com a idade e a doença.
A utilização de um hidrogel biomimética 3D tem várias vantagens. Em primeiro lugar, a inclusão de sulfato de condroitina (CS), um componente principal encontrado na cartilagem articular, permitir que as células de degradar a matriz de hidrogel através da secreção de condroitinase e deitou-se cartilagem recém-sintetizado extra-celular da matriz 5, 16. Além disso, o CS foi mostrado que têm propriedades anti-inflamatórias nas articulações artríticas. O hidrogel biomimética também pode ser utilizado como um material de andaimes para entrega em células de reparação de cartilagem, e podem ser quimicamente modificadospara facilitar uma melhor integração 17,18 tecido-biomaterial.
A utilização de hidrogeles de PEG-CS permite culturas a longo prazo de condrócitos e a avaliação das propriedades bioquímicas e mecânicas. Aqui mostramos como esta plataforma pode ser útil para as análises comparativas de diferentes fontes de condrócitos diferenciados, a fim de definir o tipo celular ideal para a engenharia de cartilagem. Curiosamente, condrócitos encapsulados em hidrogéis permanecer viável e proliferam de acordo com as suas capacidades intrínsecas. Os suportes composição de hidrogel, na verdade, o crescimento de jovens e adultos condrócitos saudáveis, como mostrado na Figura 2. A composição e estrutura dos hidrogeles descritos também promove a formação de tecido de cartilagem, como indicado pela deposição de uma matriz extracelular funcional avaliada por glicosaminoglicano (GAG ) quantificação.
Uma vantagem adicional é que as construções de condrócitos-hidrogelpode ser avaliada para as propriedades mecânicas do tecido de cartilagem recém-formado. Note-se que o ensaio de compressão simples deve ser executada no hidrogel acelular para comparação. Os hidrogeles, de facto, tem uma rigidez intrínseca devido à rigidez das porções CS. Estirpe compressão simples de 5-20% (a uma velocidade de deformação de 1% / s) podem ser aplicados para o teste mecânico de tecido de cartilagem 11,12 desde o esforço fisiológico experimentado por tecido de cartilagem sob condições de carga tem sido relatada como sendo 10-20 % 13,14. A resposta de ambos célula de carga e acelulares hidrogéis ao teste mecânico foi avaliada no ponto final da cultura. No exemplo descrito acima, observou-se uma rigidez comparável das construções contendo adulto e juvenil condrócitos em contraste com a rigidez mais baixa das construções contendo condrócitos OA. Tais propriedades mecânicas da construção de células-hidrogel permitem a avaliação das propriedades funcionais dotecido formado dando uma análise aprofundada da capacidade maturação celular.
Em conclusão, a utilização dos hidrogeles biomiméticos 3D para estudar o potencial de diferente população de condrócitos para gerar tecido de cartilagem pode ser amplamente aplicada. Além dos estudos in vitro descrito aqui, o transplante in vivo das construções de células-carga pode ser concebido para estudar a maturação de células e o potencial regenerador no contexto fisiológico. Outras modificações da plataforma de hidrogel com factores adicionais biomiméticos também pode ser prevista para optimizar a proliferação de condrócitos e maturação.
Divulgações
The authors have nothing to disclose.
Agradecimentos
The authors would like to acknowledge Stanford Department of Orthopaedic Surgery and Stanford Coulter Translational Seed Grant for funding. J.H.L. would like to thank National Science Foundation Graduate Fellowship and DARE Doctoral Fellowship for support.
Materiais
| Name | Company | Catalog Number | Comments |
| juvenile chondrocytes (Clonetics Normal Human Chondrocyte Cell System ) | Lonza | CC-2550 | |
| adult chondrocytes (Clonetics Normal Human Chondrocyte Cell System) | Lonza | CC-2550 | |
| poly(ethylene glycol diacrylate) | Laysan Bio | ACRL-PEG-ACRL-1000-1g | |
| 2-morpholinoethanesulfonic acid | Sigma | M5287 | |
| photoinitiator | Irgacure | 2959 | |
| sodium chloride | Sigma | S9888 | |
| chondroitin sulfate sodium salt | Sigma | C9819 | |
| N-hydroxysuccinimide | Sigma | 130672 | |
| 1-ethyl-3-(3-dimethylaminopropyl)-carbodiimide hydrochloride | Sigma | E1769 | |
| 2-aminoethyl methacrylate | Sigma | 516155 | |
| dialysis tubing | Spectrum Laboratories | 132700 | |
| Collagenase 2 | Worthington Biochemical | LS004177 | |
| Collagenase 4 | Worthington Biochemical | LS004189 | |
| DMEM/F12 media | HyClone, Thermo Scientific | SH3002301 | |
| live/dead assay | Life Technologies | L3224 | |
| Tri reagent | Life Technologies | AM9738 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Invitrogen | P11496 | |
| Sodium phosphate dibasic | Sigma | S3264 | |
| Ethylenediaminetetraacetic acid disodium salt | Sigma | E5134 | |
| L-Cysteine | Sigma | C1276 | |
| 1,9-dimethylmethylene blue | Sigma | 341088 | |
| Instruments | |||
| UV light equipment - XX-15LW Bench Lamp, 365 nm | UVP | 95-0042-07 | |
| Instron 5944 testing system | Instron Corporation | E5940 |
Referências
- Roberts, S., Menage, J., Sandell, L. J., Evans, E. H., Richardson, J. B. Immunohistochemical study of collagen types I and II and procollagen IIA in human cartilage repair tissue following autologous chondrocyte implantation. Knee. 16, 398-404 (2009).
- Smeriglio, P., et al. Comparative Potential of Juvenile and Adult Human Articular Chondrocytes for Cartilage Tissue Formation in Three-Dimensional Biomimetic Hydrogels. Tissue engineering. Part A. , (2014).
- Lai, J. H., Kajiyama, G., Smith, R. L., Maloney, W., Yang, F. Stem cells catalyze cartilage formation by neonatal articular chondrocytes in 3D biomimetic hydrogels. Scientific reports. 3, 3553 (2013).
- Taipale, J., Keski-Oja, J. Growth factors in the extracellular matrix. FASEB journal : official publication of the Federation of American Societies for Experimental Biology. 11, 51-59 (1997).
- Varghese, S., et al. Chondroitin sulfate based niches for chondrogenic differentiation of mesenchymal stem cells. Matrix Biol. 27, 12-21 (2008).
- Park, J. S., et al. The effect of matrix stiffness on the differentiation of mesenchymal stem cells in response to TGF-beta. Biomaterials. 32, 3921-3930 (2011).
- Wang, T., Lai, J. H., Han, L. H., Tong, X., Yang, F. Chondrogenic Differentiation of Adipose-Derived Stromal Cells in Combinatorial Hydrogels Containing Cartilage Matrix Proteins with Decoupled Mechanical Stiffness. Tissue engineering. Part A. , (2014).
- Smith, R. L., et al. Effects of intermittent hydrostatic pressure and BMP-2 on osteoarthritic human chondrocyte metabolism in vitro. J Orthop Res. 29, 361-368 (2011).
- Buschmann, M. D., Gluzband, Y. A., Grodzinsky, A. J., Kimura, J. H., Hunziker, E. B. Chondrocytes in agarose culture synthesize a mechanically functional extracellular matrix. J Orthop Res. 10, 745-758 (1992).
- Farndale, R. W., Buttle, D. J., Barrett, A. J. Improved quantitation and discrimination of sulphated glycosaminoglycans by use of dimethylmethylene blue. Biochim Biophys Acta. 883, 173-177 (1986).
- Lai, J. H., Levenston, M. E. Meniscus and cartilage exhibit distinct intra-tissue strain distributions under unconfined compression. Osteoarthritis and cartilage / OARS, Osteoarthritis Research Society. 18, 1291-1299 (2010).
- Li, L. P., Buschmann, M. D., Shirazi-Adl, A. Strain-rate dependent stiffness of articular cartilage in unconfined compression. Journal of biomechanical engineering. 125, 161-168 (2003).
- Armstrong, C. G., Bahrani, A. S., Gardner, D. L. In vitro measurement of articular cartilage deformations in the intact human hip joint under load. The Journal of bone and joint surgery. American. 61, 744-755 (1979).
- Macirowski, T., Tepic, S., Mann, R. W. Cartilage stresses in the human hip joint. Journal of biomechanical engineering. 116, 10-18 (1994).
- Benya, P. D., Shaffer, J. D. Dedifferentiated chondrocytes reexpress the differentiated collagen phenotype when cultured in agarose gels. Cell. 30, 215-224 (1982).
- Buckwalter, J. A., Mankin, H. J. Articular cartilage: tissue design and chondrocyte-matrix interactions. Instructional course lectures. 47, 477-486 (1998).
- Wang, D. A., et al. Multifunctional chondroitin sulphate for cartilage tissue-biomaterial integration. Nat Mater. 6, 385-392 (2007).
- Simson, J. A., Strehin, I. A., Allen, B. W., Elisseeff, J. H. Bonding and fusion of meniscus fibrocartilage using a novel chondroitin sulfate bone marrow tissue adhesive. Tissue engineering. Part A. 19, 1843-1851 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados