Method Article
3D hydrogel échafaudages pour articulaire chondrocytes Culture and Cartilage Generation
Dans cet article
Résumé
Cartilage repair represents an unmet medical challenge and cell-based approaches to engineer human articular cartilage are a promising solution. Here, we describe three-dimensional (3D) biomimetic hydrogels as an ideal tool for the expansion and maturation of human articular chondrocytes.
Résumé
Human articular cartilage is highly susceptible to damage and has limited self-repair and regeneration potential. Cell-based strategies to engineer cartilage tissue offer a promising solution to repair articular cartilage. To select the optimal cell source for tissue repair, it is important to develop an appropriate culture platform to systematically examine the biological and biomechanical differences in the tissue-engineered cartilage by different cell sources. Here we applied a three-dimensional (3D) biomimetic hydrogel culture platform to systematically examine cartilage regeneration potential of juvenile, adult, and osteoarthritic (OA) chondrocytes. The 3D biomimetic hydrogel consisted of synthetic component poly(ethylene glycol) and bioactive component chondroitin sulfate, which provides a physiologically relevant microenvironment for in vitro culture of chondrocytes. In addition, the scaffold may be potentially used for cell delivery for cartilage repair in vivo. Cartilage tissue engineered in the scaffold can be evaluated using quantitative gene expression, immunofluorescence staining, biochemical assays, and mechanical testing. Utilizing these outcomes, we were able to characterize the differential regenerative potential of chondrocytes of varying age, both at the gene expression level and in the biochemical and biomechanical properties of the engineered cartilage tissue. The 3D culture model could be applied to investigate the molecular and functional differences among chondrocytes and progenitor cells from different stages of normal or aberrant development.
Introduction
With its limited self-repair potential, human articular cartilage undergoes frequent irreversible damages. Extensive efforts are currently focused on the development of efficient cell-based approaches for treatment of articular cartilage injuries. The success of these cell-based therapies is highly dependent on the selection of an optimal cell source and the maintenance of its regenerative potential. Chondrocytes are a common cell source for cartilage repair, but they are limited in supply and can de-differentiate during in vitro expansion in 2D monolayer culture thereby limiting their generation of hyaline cartilage 1.
The aim of this protocol is to establish a 3-dimensional hydrogel platform for an in vitro comparative study of human chondrocytes from different ages and disease state. Unlike conventional two-dimensional (2D) culture, three-dimensional (3D) hydrogels allow chondrocytes to maintain their morphology and phenotype and provides a physiologically relevant environment enabling chondrocytes to produce cartilage tissue 2,3. In addition to providing a 3D physical structure for chondrocyte culture, hydrogels mimic the function of native cartilage extracellular matrix (ECM). Specifically, the inclusion of chondroitin sulfate methacrylate provides a potential reservoir for secreted paracrine factors 4 and enables cell-mediated degradation and matrix turnover 5. Although many 3D hydrogel culture systems have been utilized widely in various studies including agarose and alginate gels, we have used a biomimetic 3D culture system that has some distinct advantages for chondrocyte culture. Chondroitin sulfate (CS) is an abundant component in articular cartilage and the PEG-CS hydrogels have been shown to maintain and even enhance chondrogenic phenotype and facilitate cell-mediated matrix degradation and turnover 2,5. In addition, the mechanical properties of the hydrogel scaffold can be easily modulated by changing concentration of PEG and hence can be utilized to further enhance the regeneration potential of chondrocytes or a related cell type 6,7. PEG/CSMA is also biocompatible and hence has the potential for a direct clinical application in cartilage defects for example. The limitation for this system is its complexity and the use of photopolymerization that can potentially affect cell viability as compared to simpler systems like agarose, however the advantages for the chondrocyte culture outweigh the potential limitations.
The 3D hydrogel culture is compatible with conventional assay for evaluation of cell phenotype (gene expression, protein immunostaining) and functional outcome (quantification of cartilage matrix production, mechanical testing). This favorable 3D environment was tested to compare the tissue regeneration potential of human chondrocytes from three different aged populations in long-term 3D cultures.
The outcomes were evaluated via both phenotypic and functional assays. Juvenile, adult and OA chondrocytes showed differential responses in the 3D biomimetic hydrogel culture. After 3 and 6 weeks, chondrogenic gene expression was upregulated in juvenile and adult chondrocytes but was downregulated in OA chondrocytes. Deposition of cartilage tissue components including aggrecan, type II collagen, and glycosaminoglycan (GAG) was high for juvenile and adult chondrocytes but not for OA chondrocytes. The compressive moduli of the resulting cartilage constructs also exhibited similar trends. In conclusion, both juvenile and adult chondrocytes exhibited chondrogenic and cartilage matrix disposition up to 6 weeks of 3D culture in hydrogels. In contrast, osteoarthritic chondrocytes revealed a loss of cartilage phenotype and minimal ability to generate robust cartilage.
Protocole
Toutes les expériences ont été réalisées en conformité avec les lignes directrices des sujets Stanford University humaines et approuvés protocole Institutional Review Board.
1. articulaire chondrocytes Isolation
- Obtenir cartilage à partir de tissus rejetés durant arthroplastie totale du genou et de disséquer comme décrit précédemment 8.
- Sélectionner visuellement les condyles fémoraux interne ou externe d'échantillons de cartilage pour surfaces lisses et de faire l'incision à la surface du cartilage par le biais d'un scalpel afin d'éliminer les biopsies 4-5 mm de cartilage sans affecter l'os sous-chondral.
- Isoler des chondrocytes à partir de la matrice extracellulaire par dissociation enzymatique du tissu avec traitement O / N avec de la collagénase purifiée. Utilisation rapport 1: 1 de collagénase II (125 U / ml) et de la collagénase IV (160 U / ml) dans des milieux de croissance des chondrocytes à 37 ° C.
- Le jour suivant, filtrer le tissu digéré contenant les cellules dissociées à travers un 70mm pores maillage de nylon. Laver deux fois avec 20 ml de DMEM / F12 et centrifuger à 600 g pendant 5 min.
- Plaque chondrocytes isolées à une densité de 1 x 10 6 cellules / 60 mm boîte de culture suivant la remise en suspension dans du DMEM / F12 supplémenté avec 10% de sérum bovin fœtal (FBS), 25 pg / ascorbate ml, 2 mM de L-glutamine, antibiotiques (100 U / ml de pénicilline, 100 ug / ml de streptomycine, et 0,25 pg / ml fungizone). Conserver les plaques à 37 ° C et maintenir les cultures primaires de chondrocytes en monocouche à haute densité préalablement à l'encapsulation dans des hydrogels biomimétiques.
2. biomimétique hydrogel Fabrication
Remarque: cette méthode permet la synthèse biomimétique d'un hydrogel contenant du poly (diacrylate d'éthylèneglycol) (PEGDA, MW 5000 g / mole), la chondroïtine sulfate-méthacrylate (CS-MA) dans du DPBS. L'ajout de photo-initiateur permet réticulation photoactivé. La composition d'hydrogel finale contient 7% de peséet / volume (p / v) de PEGDA, 3% p / v de CS-MA, et 0,05% p / v de photo-initiateur.
- Synthétiser CS-MA par fonctionnalisation polymère CS avec des groupes méthacrylate.
- Préparer une solution tamponnée de 50 mM d'acide 2-morpholinoéthanesulfonique (MES) et 0,5 M de chlorure de sodium (NaCl) en dissolvant 1,952 g de MES et 5,84 g de NaCl dans 200 ml d'eau désionisée (DIH 2 O). Dissoudre 5 g de sel de sodium de sulfate de chondroïtine dans la solution tamponnée.
- Ajouter 0,532 g (4,62 mmol) de N-hydroxysuccinimide (NHS) et 1,771 g (9,24 mmol) de (3-diméthylaminopropyl) carbodiimide chlorhydrate (EDC) 1-éthyl-3- (rapport molaire NHS: EDC = 1: 2) à la solution et remuer pendant 5 min.
- Ajouter 0,765 g (4,62 mmoles) de méthacrylate de 2-aminoéthyle (AEMA) (rapport molaire de NHS: EDC: AEMA = 1: 2: 1) à la solution et maintenir la réaction à température ambiante pendant 24 h.
- Purifier le mélange par dialyse contre de l'eau déminéralisée (diH 2 O) pour 4 jours en utilisant un tube de dialyse (12-14 kDa MWCO).
- Filtrer la purified solution à travers un filtre de 0,22 um et placer les tubes ouverts contenant la solution dans le dessiccateur et le vide O / N. Veiller à ce que tous les tubes sont protégés de la lumière. Stocker le polymère dissous à -20 ° C à l'abri de la lumière et de l'humidité.
3. Cellule Encapsulation
- Autoclaver les films et cylindriques tiges PCR (pour poinçonner les hydrogels 3D cellules chargées) et stériliser le moule cylindrique de gel sur-mesure par immersion dans 0,2 um filtrée éthanol à 70% en culture de tissus hotte sous lumière UV.
- Sceller le fond du moule de gel avec un film PCR autoclave sans bulles d'air ou des lacunes pour éviter les fuites. Gardez-le dans une plaque stérile de 150 mm.
- Le jour avant l'encapsulation des cellules dans hydrogel biomimétique, dissocier le chondrocyte monocouche de haute densité avec O / N collagénase II dans le traitement et la collagénase IV solution. Utilisez 125 U / ml pour la collagénase II et 160 U / ml pour chaque collagénase VI de la croissance des chondrocytes médiasà 37 ° C.
- Prendre un tube de 50 ml et ajouter 5% en poids / volume (p / v) de poly (diacrylate d'éthylèneglycol) (PEGDA, MM = 5000 g / mole), 3% p / v de sulfate de chondroïtine-méthacrylate (CS-MA), et 0,05% p / v dans du DPBS photoinitiateur. Vortex le tube pour mélanger la solution et le garder de côté. Protéger le tube de la lumière.
- Recueillir les cellules dissociées dans un tube Falcon de 50 ml, compter et centrifuger à 460 g pendant 5 min. Aspirer tout le support du tube de cellules et ajouter le matériau de gel mixte ci-dessus pour les cellules remettre en suspension à une densité de 15 x 10 6 cellules / ml. Mélangez-le 30 fois à fond, tout en évitant la formation de bulles d'air.
- Pipette 72 ul de la suspension ou d'hydrogel seule cellule-hydrogel dans le moule de gel cylindrique sur mesure et d'induire la gélification par l'exposition à la lumière UV (365 nm de longueur d'onde) à 3 mW / m 2 pendant 5 min. Préparer une solution d'hydrogel sans contenu cellulaire. Utilisez ces constructions que les contrôles négatifs pour l'avenir des tests biochimiques et mécaniques. Measure l'intensité de la lumière UV avec une intensité de mètre UV. Pour ajuster l'intensité, modifier la distance entre la source de lumière UV et l'échafaudage d'hydrogel pendant la gélification.
REMARQUE: Depuis l'hydrogel contient CS, la contribution acellulaire est soustraite de la teneur en GAG biochimique des hydrogels de cellules chargées de représenter uniquement les GAG cellulaire. - Utiliser un scalpel pour couper le film pour peler facilement et retirez soigneusement. Avec l'aide des tiges cylindriques, pousser le gel dans une plaque à 6 puits avec 5 ml de DPBS stériles pour se laver de gel non polymérisé et les cellules lâches.
- Culture de cellules hydrogels chargés dans des plaques de 24 puits contenant 1,5 ml de milieu de croissance des chondrocytes dans chaque puits. Utilisez une spatule jetable pour transférer les hydrogels lavés dans le puits.
- Évaluer la viabilité des cellules par coloration morts 24 heures après l'encapsulation en direct en utilisant un kit viabilité / cytotoxicité. Culture hydrogels de cellules chargées et les hydrogels vides pour 3-6 semaines changeant en gro de chondrocytes fraiswth médias tous les 2 jours avant la récolte pour les analyses.
4. Extraction de l'ARN et le gène d'expression Analyses
- Aspirer délicatement le support et mettez stérile PBS 1X sur la cellule chargée ainsi que les hydrogels de commande vides.
- Avec l'aide d'une spatule stérile, transférer chaque hydrogel à 1,5 ml tube Eppendorf propre et ajouter 250 ul de Tri-réactif dans chaque tube. Suivez les instructions du fabricant pour isoler l'ARN.
- Après isolement de l'ARN et quantification utilisation de celui-ci 1 ug de chaque échantillon et effectuer une transcription inverse en ADNc en utilisant le kit de transcription inverse en Haute Capacité ADNc.
- Pour utiliser la PCR quantitative TaqMan Arrays Gene Expression pour l'examen de l'expression de vos gènes d'intérêt. Normaliser les niveaux d'expression des gènes à l'intérieur de GAPDH.
- Pour les conditions de PCR comprennent une incubation de 2 min à 50 ° C pour inactiver les amplicons précédents avec l'uracile ADN glycosylase, suivie d'une 1060; min d'incubation à 95 ° C pour activer la polymérase Taq. Puis effectuer quarante cycles de PCR, composé de 15 sec à 95 ° C, et de 1 min à 60 ° C.
5. Analyses biochimiques
- Pour chacune des constructions cellulaires-hydrogel de quantifier l'ADN et des glycosaminoglycanes sulfatés (sGAG) la production comme suit.
- Aspirer délicatement le support et mettez stérile PBS 1X sur la cellule chargée ainsi que les hydrogels de commande vides. Peser un tube vide et de mettre l'hydrogel à l'intérieur après buvard sur papier de soie et enregistrer le poids ou le poids humide des hydrogels.
- Congeler chaque hydrogel à -20 ° C dans un tube Eppendorf de 1,5 ml séparé pour la digestion enzymatique et utiliser plus tard une aliquote du produit digéré de fonctionner dosage Picogreen (pour l'ADN) et de diméthyl-méthylène dosage bleu (pour GAG).
- Préparer la solution de papainase pour digestion enzymatique des hydrogels.
- Préparer d'abord le tampon PBE en pesant 7,1 g de sodium phosphat dee dibasique (Na 2 HPO 4) et 1,6 g de sel de disodium éthylènediaminetétraacétique acide (EDTA-Na 2). Dissoudre dans 500 ml de dH 2 O, ajuster le pH à 6,5 et filtrer la solution purifiée à travers un filtre de 0,22 mm.
- Dissoudre 0,035 g de L-cystéine dans 20 ml de tampon PBE. Filtrer la solution et 100 ul d'enzyme papaïne stérile.
- Lorsqu'il est prêt pour effectuer les essais, prendre les tubes de -20 ° C et ajouter 300 ul de la solution de papaïne prêt à hydrogels congelés. Ecrasez le gel avec un mortier et un pilon et bien mélanger avec le pilon du moteur.
- Porter le volume à 500 pl avec une solution de papaïne supplémentaire. Effectuez la même procédure pour les gels de contrôle. Incuber à 60 ° C pendant 16 heures 3,9. La solution contenant l'hydrogel peut donc digéré l'ADN utilisé pour la quantification et GAG. Mesurer la teneur en ADN en utilisant le test Picogreen avec Lambda ADN de phage en standard la suite de la pr du fabricantotocole.
- Quantifier le contenu sulfaté GAG utilisant le bleu de 1,9-diméthylméthylène (DMMB) Essai de fixation de colorant avec du sulfate de chondroïtine requin en standard 10. Déterminer la teneur en GAG en divisant la quantité de GAG pour le poids humide correspondante.
6. Essais mécaniques
- Effectuer des tests de compression non confinés en utilisant un système d'essai Instron 5944 équipée d'une cellule de charge 10 N.
- Après les jours souhaités de la culture in vitro, effectuer le test de compression sur l'échafaud de la cellule-hydrogel et les hydrogels de contrôle acellulaire.
- Plonger les échantillons dans un bain de PBS à la température ambiante et de compresser à un taux de 1% de déformation / sec à une souche maximum de 15% depuis la souche 11,12 physiologique connu par le tissu du cartilage sous condition de chargement a été signalé à 10-20% 13,14.
- Créer la tension en fonction des courbes de contrainte et ajustement de la courbe en utilisant une équation polynomiale de troisième ordre. Déterminer les compressive module tangent de la courbe équation d'ajustement pour des valeurs de contrainte de 15%.
Résultats
Hydrogels bioactifs contenant PEG et groupements CS (Figure 1) représentent une plateforme idéale pour la culture et la maturation des chondrocytes articulaires humains 2,3,5,7. Les chondrocytes provenant de différents âges et états pathologiques peuvent être cultivées à la méthode décrite et analysés pour déterminer leur phénotype, l'expression des gènes et des propriétés biochimiques et mécaniques du tissu cartilagineux généré. Trois échantillons de chondrocytes, juvenile- 6 mois, 34 ans et adulte-osteoarthritic- de 74 ans, ont été récoltés après 3 semaines de culture dans des hydrogels biomimétiques 3D. Analyse de l'expression génique des chondrocytes normaux, les deux juvéniles et adultes, a montré une augmentation de l'expression des gènes COL2A1 et COL6A1 chondrocytes. Au contraire, les chondrocytes malades ont montré une diminution spectaculaire de Col2a1 tout en conservant l'expression de COL6A1 (figure 2) montre une perte de phénotype chondrogénique en dépit d'être cultivées dans un milieu favorable biomimétique.
Les hydrogels CS-PEG servent aussi un environnement dynamique pour les chondrocytes de proliférer, digèrent la matrice pré-existante de PEG et CS et déposent leur matrice péricellulaire et extracellulaire, les principaux composants du tissu cartilagineux mature. Compte tenu de ces capacités, l'expansion des chondrocytes après 3 semaines de culture in vitro peut être estimée par quantification de l'ADN avec le colorant Picogreen. L'analyse comparative des trois groupes de cellules montrent que la densité de cellules de juvéniles et adultes populations était inchangée alors que les chondrocytes arthrosiques présentaient une diminution spectaculaire par rapport à jour 1 de la culture. Une perte de la teneur en ADN a également été observée pour d'autres OA mais pas possible chondrocytes suggérant la mort cellulaire lors de la culture à long terme (figure 3). La matrice sécrétée a été quantifiée comme le contenu sulfaté GAG par dosage de liaison au colorant DMMB au stade de point final après 3 semaines de cultures. Contenu GAG est normalisée par le poids humide de l'hydrogel comme Recorded avant la digestion enzymatique et la contribution acellulaire est soustraite. Comme le montre la Figure 4, les chondrocytes déposé une quantité importante de GAG similaire pendant 3 semaines de culture en 3D hydrogels.
La présence d'un échafaudage physique permet l'évaluation des propriétés biomécaniques des échantillons grâce à des essais de compression non confiné 2,3. Alors que les hydrogels acellulaires subissent une diminution de la compression des modules, des constructions de cellules chargées de maintenir les modules en compression au bout de 3 semaines en culture (figure 4). Le phénotypique, des analyses biochimiques et biomécaniques décrites ici sont donc utiles pour évaluer et comprendre le potentiel des populations de chondrocytes différentes pour le cartilage d'ingénierie.

Figure 1. PEG-CS hydrogels biomimétiques pour 3D chondrocytes culture. Les chondrocytes sont remis en suspension dans un mélange contenant du poly (diacrylate d'éthylèneglycol) (PEGDA) et la chondroïtine sulfate-méthacrylate (CS-MA) et coulé dans le moule cylindrique de gel-mesure. Après l'exposition aux UV, solidifiés gels sont collectées à partir des moules et la viabilité cellulaire est évaluée par coloration morts en direct 24 h post-encapsulation. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2. Expression des gènes chondrogéniques dans les chondrocytes humains cultivés dans des hydrogels biomimétiques 3D. D'expression génique quantitative des marqueurs du cartilage Col2a1 et COL6A1 par juvéniles, adultes et OA chondrocytes après 3 semaines de culture dans des hydrogels biomimétiques 3D. Les valeurs sont normalisées au niveau de l'expression des gènes au jour 1. Erreur bars représentent moyenne ± SD. p * <0,05 comme déterminé par un test t de Student bilatéral. Modifié à partir Smeriglio et al. 2 S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3. contenu de l'ADN dans les chondrocytes humains cultivés dans des hydrogels biomimétiques 3D. ADN de quantification par dosage Picogreen dans juvéniles, adultes et OA chondrocytes après 3 semaines de culture dans des hydrogels biomimétiques 3D. Les valeurs sont normalisées à niveau de l'ADN au jour 1. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
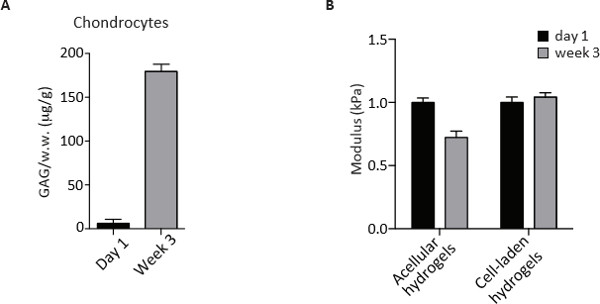
la figure 4. GAG mesure de la teneur et non confiné essai de compression de chondrocytes humains au jour 1 et au bout de 3 semaines de culture dans des hydrogels biomimétiques 3D. (A) GAG quantification par dosage DMMB en chondrocytes au jour 1 et au bout de 3 semaines de culture, hydrogels biomimétiques 3D. Les valeurs sont normalisées à poids (ww) mouiller et exprimées en pg / g. (B) Module de compression (kPa) de acellulaires et cellulaires chargés hydrogels au jour 1 et après 3 semaines de culture dans les hydrogels biomimétiques 3D. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Comme indiqué dans ce protocole, les hydrogels 3D sont capables de maintenir chondrocytes phénotype dans la culture, en évitant le processus de dédifférenciation cellulaire dans les cellules fibrocartilagineuses habituellement rencontrés avec les cultures monocouches 15. En outre, des cultures à long terme de la construction chondrocytes- hydrogel ont révélé un environnement favorable qui maintient les caractéristiques cellulaires intrinsèques associés à l'âge et la maladie.
Utilisation d'un hydrogel biomimétique 3D présente plusieurs avantages. Tout d'abord, l'inclusion de sulfate de chondroïtine (CS), une composante majeure trouvé dans le cartilage articulaire, permettent aux cellules de dégrader la matrice d'hydrogel en sécrétant chondroitinase et fixer cartilage nouvellement synthétisé extra-cellulaire matrice 5, 16. En outre, CS a été démontré pour avoir des propriétés anti-inflammatoires dans l'articulation arthritique. L'hydrogel biomimétique peut également être utilisé en tant que matériau d'échafaudage pour la distribution des cellules dans la réparation du cartilage, et peut être modifié chimiquementpour faciliter une meilleure intégration de 17,18 tissu biomatériau.
L'utilisation des hydrogels de PEG-CS permet cultures à long terme des chondrocytes et l'évaluation des propriétés biochimiques et mécaniques. Ici, nous montrons comment cette plate-forme peut être utile pour les analyses comparatives des diverses sources de chondrocytes différenciés afin de définir le type de cellule optimale pour l'ingénierie de cartilage. Fait intéressant, les chondrocytes encapsulés dans des hydrogels restent viables et prolifèrent en fonction de leurs capacités intrinsèques. Les supports de la composition d'hydrogel, en fait, la croissance de sains jeunes et adultes chondrocytes comme représenté sur la Figure 2. La composition et la structure des hydrogels décrits favorise également la formation de tissu cartilagineux, comme indiqué par le dépôt d'une matrice extracellulaire fonctionnelle évaluée par des glycosaminoglycanes (GAG ) quantification.
Un avantage supplémentaire est que les constructions de chondrocytes hydrogelpeuvent être évalués pour les propriétés mécaniques du tissu cartilagineux nouvellement formé. Notez que le test de compression simple doit être effectué sur l'hydrogel acellulaire pour la comparaison. Les hydrogels, en fait, ont une rigidité intrinsèque en raison de la rigidité des groupements CS. Souche de compression simple de 5-20% (à un taux de déformation de 1% / s) peut être appliqué pour le contrôle mécanique du tissu cartilagineux 11,12 depuis la souche physiologique connu par le tissu du cartilage sous condition de chargement a été signalé à être 10-20 13,14%. La réponse des deux cellules chargées et acellulaire hydrogels à contrôle mécanique a été évaluée à la culture point final. Dans l'exemple décrit ci-dessus, nous avons observé une rigidité comparable des constructions contenant des chondrocytes juvéniles et adultes par opposition à la raideur inférieure des constructions contenant des chondrocytes arthrosiques. De telles propriétés mécaniques de la construction de cellules d'hydrogel permettent l'évaluation des propriétés fonctionnelles de latissu formé donnant une analyse en profondeur de la capacité de la maturation des cellules.
En conclusion, l'utilisation des hydrogels biomimétiques 3D pour étudier le potentiel différent de population de chondrocytes pour générer tissu cartilagineux peut être largement appliquée. Outre les études in vitro décrits ici, la transplantation in vivo des constructions cellulaires chargées peut être envisagé d'étudier la maturation des cellules et le potentiel de régénération dans le contexte physiologique. D'autres modifications de la plate-forme d'hydrogel avec des facteurs biomimétiques supplémentaires peuvent également être envisagées pour optimiser la prolifération des chondrocytes et de la maturation.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
The authors would like to acknowledge Stanford Department of Orthopaedic Surgery and Stanford Coulter Translational Seed Grant for funding. J.H.L. would like to thank National Science Foundation Graduate Fellowship and DARE Doctoral Fellowship for support.
matériels
| Name | Company | Catalog Number | Comments |
| juvenile chondrocytes (Clonetics Normal Human Chondrocyte Cell System ) | Lonza | CC-2550 | |
| adult chondrocytes (Clonetics Normal Human Chondrocyte Cell System) | Lonza | CC-2550 | |
| poly(ethylene glycol diacrylate) | Laysan Bio | ACRL-PEG-ACRL-1000-1g | |
| 2-morpholinoethanesulfonic acid | Sigma | M5287 | |
| photoinitiator | Irgacure | 2959 | |
| sodium chloride | Sigma | S9888 | |
| chondroitin sulfate sodium salt | Sigma | C9819 | |
| N-hydroxysuccinimide | Sigma | 130672 | |
| 1-ethyl-3-(3-dimethylaminopropyl)-carbodiimide hydrochloride | Sigma | E1769 | |
| 2-aminoethyl methacrylate | Sigma | 516155 | |
| dialysis tubing | Spectrum Laboratories | 132700 | |
| Collagenase 2 | Worthington Biochemical | LS004177 | |
| Collagenase 4 | Worthington Biochemical | LS004189 | |
| DMEM/F12 media | HyClone, Thermo Scientific | SH3002301 | |
| live/dead assay | Life Technologies | L3224 | |
| Tri reagent | Life Technologies | AM9738 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Invitrogen | P11496 | |
| Sodium phosphate dibasic | Sigma | S3264 | |
| Ethylenediaminetetraacetic acid disodium salt | Sigma | E5134 | |
| L-Cysteine | Sigma | C1276 | |
| 1,9-dimethylmethylene blue | Sigma | 341088 | |
| Instruments | |||
| UV light equipment - XX-15LW Bench Lamp, 365 nm | UVP | 95-0042-07 | |
| Instron 5944 testing system | Instron Corporation | E5940 |
Références
- Roberts, S., Menage, J., Sandell, L. J., Evans, E. H., Richardson, J. B. Immunohistochemical study of collagen types I and II and procollagen IIA in human cartilage repair tissue following autologous chondrocyte implantation. Knee. 16, 398-404 (2009).
- Smeriglio, P., et al. Comparative Potential of Juvenile and Adult Human Articular Chondrocytes for Cartilage Tissue Formation in Three-Dimensional Biomimetic Hydrogels. Tissue engineering. Part A. , (2014).
- Lai, J. H., Kajiyama, G., Smith, R. L., Maloney, W., Yang, F. Stem cells catalyze cartilage formation by neonatal articular chondrocytes in 3D biomimetic hydrogels. Scientific reports. 3, 3553 (2013).
- Taipale, J., Keski-Oja, J. Growth factors in the extracellular matrix. FASEB journal : official publication of the Federation of American Societies for Experimental Biology. 11, 51-59 (1997).
- Varghese, S., et al. Chondroitin sulfate based niches for chondrogenic differentiation of mesenchymal stem cells. Matrix Biol. 27, 12-21 (2008).
- Park, J. S., et al. The effect of matrix stiffness on the differentiation of mesenchymal stem cells in response to TGF-beta. Biomaterials. 32, 3921-3930 (2011).
- Wang, T., Lai, J. H., Han, L. H., Tong, X., Yang, F. Chondrogenic Differentiation of Adipose-Derived Stromal Cells in Combinatorial Hydrogels Containing Cartilage Matrix Proteins with Decoupled Mechanical Stiffness. Tissue engineering. Part A. , (2014).
- Smith, R. L., et al. Effects of intermittent hydrostatic pressure and BMP-2 on osteoarthritic human chondrocyte metabolism in vitro. J Orthop Res. 29, 361-368 (2011).
- Buschmann, M. D., Gluzband, Y. A., Grodzinsky, A. J., Kimura, J. H., Hunziker, E. B. Chondrocytes in agarose culture synthesize a mechanically functional extracellular matrix. J Orthop Res. 10, 745-758 (1992).
- Farndale, R. W., Buttle, D. J., Barrett, A. J. Improved quantitation and discrimination of sulphated glycosaminoglycans by use of dimethylmethylene blue. Biochim Biophys Acta. 883, 173-177 (1986).
- Lai, J. H., Levenston, M. E. Meniscus and cartilage exhibit distinct intra-tissue strain distributions under unconfined compression. Osteoarthritis and cartilage / OARS, Osteoarthritis Research Society. 18, 1291-1299 (2010).
- Li, L. P., Buschmann, M. D., Shirazi-Adl, A. Strain-rate dependent stiffness of articular cartilage in unconfined compression. Journal of biomechanical engineering. 125, 161-168 (2003).
- Armstrong, C. G., Bahrani, A. S., Gardner, D. L. In vitro measurement of articular cartilage deformations in the intact human hip joint under load. The Journal of bone and joint surgery. American. 61, 744-755 (1979).
- Macirowski, T., Tepic, S., Mann, R. W. Cartilage stresses in the human hip joint. Journal of biomechanical engineering. 116, 10-18 (1994).
- Benya, P. D., Shaffer, J. D. Dedifferentiated chondrocytes reexpress the differentiated collagen phenotype when cultured in agarose gels. Cell. 30, 215-224 (1982).
- Buckwalter, J. A., Mankin, H. J. Articular cartilage: tissue design and chondrocyte-matrix interactions. Instructional course lectures. 47, 477-486 (1998).
- Wang, D. A., et al. Multifunctional chondroitin sulphate for cartilage tissue-biomaterial integration. Nat Mater. 6, 385-392 (2007).
- Simson, J. A., Strehin, I. A., Allen, B. W., Elisseeff, J. H. Bonding and fusion of meniscus fibrocartilage using a novel chondroitin sulfate bone marrow tissue adhesive. Tissue engineering. Part A. 19, 1843-1851 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon