Method Article
3D Hydrogel פיגומים למפרקים הכונדרוציטים תרבות וסחוס דור
In This Article
Summary
Cartilage repair represents an unmet medical challenge and cell-based approaches to engineer human articular cartilage are a promising solution. Here, we describe three-dimensional (3D) biomimetic hydrogels as an ideal tool for the expansion and maturation of human articular chondrocytes.
Abstract
Human articular cartilage is highly susceptible to damage and has limited self-repair and regeneration potential. Cell-based strategies to engineer cartilage tissue offer a promising solution to repair articular cartilage. To select the optimal cell source for tissue repair, it is important to develop an appropriate culture platform to systematically examine the biological and biomechanical differences in the tissue-engineered cartilage by different cell sources. Here we applied a three-dimensional (3D) biomimetic hydrogel culture platform to systematically examine cartilage regeneration potential of juvenile, adult, and osteoarthritic (OA) chondrocytes. The 3D biomimetic hydrogel consisted of synthetic component poly(ethylene glycol) and bioactive component chondroitin sulfate, which provides a physiologically relevant microenvironment for in vitro culture of chondrocytes. In addition, the scaffold may be potentially used for cell delivery for cartilage repair in vivo. Cartilage tissue engineered in the scaffold can be evaluated using quantitative gene expression, immunofluorescence staining, biochemical assays, and mechanical testing. Utilizing these outcomes, we were able to characterize the differential regenerative potential of chondrocytes of varying age, both at the gene expression level and in the biochemical and biomechanical properties of the engineered cartilage tissue. The 3D culture model could be applied to investigate the molecular and functional differences among chondrocytes and progenitor cells from different stages of normal or aberrant development.
Introduction
With its limited self-repair potential, human articular cartilage undergoes frequent irreversible damages. Extensive efforts are currently focused on the development of efficient cell-based approaches for treatment of articular cartilage injuries. The success of these cell-based therapies is highly dependent on the selection of an optimal cell source and the maintenance of its regenerative potential. Chondrocytes are a common cell source for cartilage repair, but they are limited in supply and can de-differentiate during in vitro expansion in 2D monolayer culture thereby limiting their generation of hyaline cartilage 1.
The aim of this protocol is to establish a 3-dimensional hydrogel platform for an in vitro comparative study of human chondrocytes from different ages and disease state. Unlike conventional two-dimensional (2D) culture, three-dimensional (3D) hydrogels allow chondrocytes to maintain their morphology and phenotype and provides a physiologically relevant environment enabling chondrocytes to produce cartilage tissue 2,3. In addition to providing a 3D physical structure for chondrocyte culture, hydrogels mimic the function of native cartilage extracellular matrix (ECM). Specifically, the inclusion of chondroitin sulfate methacrylate provides a potential reservoir for secreted paracrine factors 4 and enables cell-mediated degradation and matrix turnover 5. Although many 3D hydrogel culture systems have been utilized widely in various studies including agarose and alginate gels, we have used a biomimetic 3D culture system that has some distinct advantages for chondrocyte culture. Chondroitin sulfate (CS) is an abundant component in articular cartilage and the PEG-CS hydrogels have been shown to maintain and even enhance chondrogenic phenotype and facilitate cell-mediated matrix degradation and turnover 2,5. In addition, the mechanical properties of the hydrogel scaffold can be easily modulated by changing concentration of PEG and hence can be utilized to further enhance the regeneration potential of chondrocytes or a related cell type 6,7. PEG/CSMA is also biocompatible and hence has the potential for a direct clinical application in cartilage defects for example. The limitation for this system is its complexity and the use of photopolymerization that can potentially affect cell viability as compared to simpler systems like agarose, however the advantages for the chondrocyte culture outweigh the potential limitations.
The 3D hydrogel culture is compatible with conventional assay for evaluation of cell phenotype (gene expression, protein immunostaining) and functional outcome (quantification of cartilage matrix production, mechanical testing). This favorable 3D environment was tested to compare the tissue regeneration potential of human chondrocytes from three different aged populations in long-term 3D cultures.
The outcomes were evaluated via both phenotypic and functional assays. Juvenile, adult and OA chondrocytes showed differential responses in the 3D biomimetic hydrogel culture. After 3 and 6 weeks, chondrogenic gene expression was upregulated in juvenile and adult chondrocytes but was downregulated in OA chondrocytes. Deposition of cartilage tissue components including aggrecan, type II collagen, and glycosaminoglycan (GAG) was high for juvenile and adult chondrocytes but not for OA chondrocytes. The compressive moduli of the resulting cartilage constructs also exhibited similar trends. In conclusion, both juvenile and adult chondrocytes exhibited chondrogenic and cartilage matrix disposition up to 6 weeks of 3D culture in hydrogels. In contrast, osteoarthritic chondrocytes revealed a loss of cartilage phenotype and minimal ability to generate robust cartilage.
Protocol
כל הניסויים בוצעו בהתאם להנחיות של נבדקי סטנפורד אדם האוניברסיטה ואישרו פרוטוקול Institutional Review Board.
1. בידוד Articular הכונדרוציטים
- להשיג סחוס מהרקמה שהושלכה במהלך החלפת מפרק הברך ולנתח כפי שתואר לעיל 8.
- מבחינה ויזואלית לבחור condyles הירך המדיאלי או לרוחב של דגימות סחוס למשטחים חלקים ולעשות חתך על פני השטח של הסחוס באמצעות אזמל כדי להסיר 4-5 ביופסיות סחוס מ"מ מבלי להשפיע על עצם subchondral.
- לבודד כונדרוציטים מהמטריצה תאית על ידי ניתוק האנזימטית של הרקמה עם O טיפול / N עם collagenase המטוהר. השתמש 1: 1 יחס של Collagenase השני (125 U / ml) וCollagenase IV (160 U / ml) בתקשורת צמיחה הכונדרוציטים על 37 מעלות צלזיוס.
- למחרת, לסנן את הרקמה מתעכל המכיל את התאים ניתקו דרך 70מ"מ נקבובית רשת ניילון גודל. לשטוף פעמיים עם 20 מיליליטר של DMEM / F12 וצנטריפוגות ב 600 XG במשך 5 דקות.
- פלייט כונדרוציטים המבודדים בצפיפות של צלחת תרבות 1 x 10 6 תאים / 60 מ"מ הבא מחדש השעיה בDMEM / F12 בתוספת 10% העוברי בסרום שור (FBS), 25 מיקרוגרם / מיליליטר ascorbate, L-גלוטמין 2 מ"מ, אנטיביוטיקה (100 U / פניצילין מיליליטר, 100 מיקרוגרם / מיליליטר סטרפטומיצין, ו 0.25 מיקרוגרם / fungizone מיליליטר). שמור את הצלחות על 37 מעלות צלזיוס ולשמור על התרבויות הכונדרוציטים העיקריות כmonolayer צפיפות גבוהה לפני אנקפסולציה בהידרוג'ל biomimetic.
ייצור 2. Biomimetic Hydrogel
הערה: שיטה זו מאפשרת את הסינתזה של הידרוג'ל biomimetic המכיל פולי (diacrylate אתילן גליקול) (PEGDA, גרם MW 5000 / שומה), סולפט-methacrylate כונדרואיטין (CS-MA) בDPBS. התוספת של photoinitiator מאפשרת crosslinking photoactivated. הרכב הידרוג'ל הסופי מכיל 7% לשקולt / נפח (w / v) של PEGDA, 3% w / v של CS-MA, ושל 0.05% w / v של photoinitiator.
- לסנתז CS-MA ידי functionalizing פולימר CS עם קבוצות methacrylate.
- הכן את הפתרון שנאגרו של 50 מ"מ חומצה 2-morpholinoethanesulfonic (MES) ו0.5 M נתרן כלורי (NaCl) על ידי המסת 1.952 גרם של MES ו5.84 גרם של NaCl ב200 מיליליטר של מים ללא יונים (DiH 2 O). לפזר 5 גרם של מלח נתרן כונדרואיטין סולפט בפתרון שנאגרו.
- להוסיף .532 גרם (4.62 mmol) N-hydroxysuccinimide (NHS) ו1.771 גרם (9.24 mmol) 1-אתיל-3 (3-dimethylaminopropyl) hydrochloride -carbodiimide (EDC) (יחס טוחנת של NHS: EDC = 1: 2) ל הפתרון ומערבבים במשך 5 דקות.
- להוסיף .765 גרם (4.62 mmol) methacrylate 2-aminoethyl (AEMA) (יחס טוחנת של NHS: EDC: AEMA = 1: 2: 1) לפתרון ולשמור על התגובה ב RT למשך 24 שעות.
- לטהר את התערובת על ידי דיאליזה נגד מים ללא יונים (diH 2 O) במשך 4 ימים באמצעות צינורות דיאליזה (12-14 kDa MWCO).
- סנן את pפתרון urified דרך מסנן 0.22 מיקרומטר ולמקם את הצינורות הפתוחים המכילים את הפתרון בO הייבוש והוואקום / N. ודא שכל הצינורות מוגנים מפני אור. אחסן את הפולימר המומס ב -20 ° C המוגנים מפני אור ולחות.
Encapsulation 3. הסלולרי
- החיטוי מוטות סרט וגלילי PCR (על חבטות את הידרוג 3D תא-לאדן) ולעקר את תבנית ג'ל הגלילית מחוייט על ידי טבילה ב0.2 מיקרומטר אתנול 70% מסוננים במכסת מנוע בתרבית רקמה תחת אור UV.
- לאטום את תחתית תבנית ג'ל עם סרט PCR autoclaved ללא בועות אוויר או פערים כדי למנוע הדלפות. שמור את זה בצלחת 150 מ"מ סטרילי.
- היום לפני אנקפסולציה התא בהידרוג'ל biomimetic, לנתק את monolayer הכונדרוציטים בצפיפות גבוהה עם O טיפול / N בCollagenase השני ופתרון Collagenase IV. השתמש 125 U / ml לCollagenase השני ו -160 U / ml לCollagenase VI כל בצמיחה הכונדרוציטים תקשורתעל 37 מעלות צלזיוס.
- קח צינור 50 מ"ל ולהוסיף 5% במשקל / נפח (w / v) (diacrylate אתילן גליקול) פולי (PEGDA, MW = g 5000 / שומה), 3% w / סולפט-methacrylate נ 'כונדרואיטין (CS-MA), ו 0.05% w / v photoinitiator בDPBS. מערבולת הצינור לערבב את הפתרון ולשמור אותו בצד. להגן על הצינור מהאור.
- לאסוף את התאים ניתקו בצינור פלקון 50 מיליליטר, ולספור צנטריפוגות ב 460 XG במשך 5 דקות. לשאוב את כל התקשורת מצינור התאים ולהוסיף חומר ג'ל המעורב לעיל כדי מחדש להשעות תאים בצפיפות של 15 × 10 6 תאים / מיליליטר. מערבבים אותו 30 פעמים ביסודיות, תוך הימנעות היווצרות בועות אוויר.
- פיפטה 72 μl של ההשעיה התא-הידרוג'ל או הידרוג'ל לבד לתוך תבנית ג'ל הגלילי מחוייט ולהשרות gelation באמצעות חשיפה לאור UV (365 ננומטר אורך גל) בשעה 3 mW / m 2 למשך 5 דקות. הכן כמה פתרון הידרוג'ל ללא תוכן סלולארי. השתמש במבנים אלה כפקדים שליליים לבדיקה ביוכימית ומכאנית העתיד. Measuמחדש את עוצמת אור UV עם מד עוצמת קרינת UV. כדי להתאים את עוצמת, לשנות את המרחק בין מקור אור UV ופיגום הידרוג'ל במהלך gelation.
הערה: מאחר הידרוג'ל מכיל CS, תרומת acellular יורדת מתוכן GAG ביוכימיים של הידרוג'ל התא-לאדן לייצג GAG הסלולרי בלבד. - השתמש באזמל כדי לחתוך את הסרט לקליפה קלה והסר אותו בזהירות. בעזרת המוטות גליליות, לדחוף את הג'ל לתוך צלחת גם 6 עם 5 מיליליטר של DPBS סטרילי כדי לשטוף את הג'ל unpolymerized ותאים רופפים.
- תרבות הידרוג התא-לאדן ב -24 צלחות גם מכילות 1.5 מיליליטר של תקשורת צמיחה הכונדרוציטים לכל אחד. השתמש במרית חד פעמית להעביר את הידרוג שטף לתוך הבאר.
- להעריך את כדאיויות תא על ידי צביעת 24 הודעה אנקפסולציה-שעות מתות החי באמצעות ערכת הכדאיות / cytotoxity. תרבות הידרוג התא-לאדן והידרוג הריק במשך 3-6 שבועות משתנה לGro הכונדרוציטים הטריwth תקשורת כל 2 ימים לפני קציר לניתוחים.
4. ניתוח ביטוי RNA חילוץ וג'ין
- בזהירות לשאוב התקשורת ולשים סטרילי PBS 1X בתא-לאדן, כמו גם את הידרוג השליטה הריק.
- בעזרת מרית סטרילי, להעביר את כל הידרוג'ל לצינור Eppendorf נקי 1.5 מיליליטר ולהוסיף 250 μl של Tri-מגיב על צינור אחד. עקוב אחר ההוראות של היצרן לבודד RNA.
- לאחר בידוד RNA וכימות שימוש 1 מיקרוגרם שלו מכל מדגם ולבצע שעתוק הפוך לcDNA באמצעות הקיבולת גבוהה cDNA הפוך תמלול ערכה.
- לPCR כמו להשתמש מערכי ביטוי גני TaqMan לבחינת הביטוי של גני עניין שלך. לנרמל את רמות ביטוי גנים פנימיים לGAPDH.
- לתנאי PCR כולל דגירה 2 דקות ב 50 מעלות צלזיוס כדי להשבית amplicons הקודמת עם glycosylase אורציל-דנ"א, ואחריו 1060; דקות דגירה על 95 מעלות צלזיוס כדי להפעיל את פולימראז תקי. ואז לבצע מחזורים ארבעים של PCR, בהיקף של 15 שניות על 95 מעלות צלזיוס, ודקות 1 ב 60 ° C.
5. ניתוח ביוכימיה
- לכל מבני תא-הידרוג'ל לכמת DNA וייצור glycosaminoglycan הגופריתי (sGAG) כדלקמן.
- בזהירות לשאוב התקשורת ולשים סטרילי PBS 1X בתא-לאדן, כמו גם את הידרוג השליטה הריק. לשקול צינור ריק ולשים בתוך הידרוג'ל לאחר סופג את זה על נייר ולרשום את המשקל או המשקל רטוב של הידרוג'ל.
- להקפיא כל הידרוג'ל ב -20 ° C בצינור 1.5 מיליליטר נפרד eppendorf לעיכול אנזימטי ולאחר מכן להשתמש aliquot של המוצר מתעכל לרוץ assay PicoGreen (לDNA) וassay הכחול דימתיל-מתילן (לGAG).
- הכן את פתרון papainase לעיכול אנזימטי של הידרוג'ל.
- ראשון להכין את חיץ PBE על ידי שקילה מתוך 7.1 גרם של נתרן phosphatdibasic דואר (Na 2 4 HPO) ו -1.6 גרם של מלח disodium חומצת Ethylenediaminetetraacetic (EDTA-Na 2). ממיסים בכ -500 מיליליטר של DH 2 O, להתאים את ה- pH 6.5 ולסנן את הפתרון המטוהר דרך מסנן 0.22 מ"מ.
- ממיסים 0.035 גרם של L-ציסטאין ב 20 מיליליטר של חיץ PBE. סנן את הפתרון ושל אנזים פפאין סטרילי 100 μl.
- כאשר מוכן לבצע את מבחני, לקחת את הצינורות מ-20 ° C ולהוסיף 300 μl של פתרון פפאין מוכן הידרוג הקפוא. למחוץ את הג'ל עם מכתש ועלי ולערבב אותו היטב עם העלי המנוע.
- תביא את הנפח 500 μl עם פתרון פפאין נוסף. בצע את אותו ההליך לג'לי השליטה. לדגור על 60 מעלות צלזיוס במשך 16 שעות 3,9. התמיסה המכילה הידרוג'ל מתעכל ולכן יכולה לשמש לדנ"א וכימות GAG. מדוד את תוכן ה- DNA באמצעות assay PicoGreen עם DNA הפאג מבדה כסטנדרט הבא יחסי הציבור של היצרןotocol.
- לכמת את התוכן הגופריתי-GAG באמצעות כחול 1.9-dimethylmethylene (DMMB) assay מחייב צבע עם כונדרואיטין סולפט הכריש כמו 10 סטנדרטיים. לקבוע את תוכן GAG על ידי חלוקת הסך של GAG למשקל הרטוב המקביל.
6. מכאני בדיקה
- לבצע בדיקות דחיסת unconfined באמצעות מערכת בדיקת Instron 5944 מצוידות בתא מטען 10 N.
- לאחר הימים הרצויים של תרבות במבחנה, לבצע את בדיקת הדחיסה על פיגום התא-הידרוג'ל והידרוג שליטת acellular.
- להטביע את הדגימות באמבט PBS ב RT ולדחוס בשיעור של 1% מתח / sec למתח מרבי של 15% מאז 11,12 המתח הפיזיולוגי חווה ברקמת סחוס בתנאי טעינה כבר דיווח להיות 10-20% 13,14.
- ליצור מתח לעומת עקומות מתח וכושר עקום באמצעות משוואת פולינום סדר שלישי. לקבוע comprמודול משיק essive ממשוואת הכושר העקום בערכי מתח של 15%.
תוצאות
הידרוג ביו המכיל PEG וmoieties CS (איור 1) מייצג פלטפורמה אידיאלית לתרבות והתבגרות של 2,3,5,7 כונדרוציטים במפרק אנושיים. כונדרוציטים מגילים שונים ומצבי מחלה יכולים להיות מתורבת בשיטה שתוארה ונותחו לפנוטיפ, ביטוי גנים שלהם ומאפיינים ביוכימיים ומכאניים של רקמת הסחוס שנוצרה. שלוש דגימות הכונדרוציטים, juvenile- 6 חודשים, למבוגר 34 שנים וosteoarthritic- 74 שנים, נקצרו לאחר 3 שבועות של התרבות בהידרוג'ל biomimetic 3D. ביטוי גני מנתח של כונדרוציטים רגילים, שניהם צעירים ומבוגר, הראה עלייה בביטוי של גנים הכונדרוציטים Col2a1 וCol6a1. להיפך, כונדרוציטים חולים הראו ירידה דרמטית בCol2a1 תוך שמירה על הביטוי של Col6a1 (איור 2) מראה הפסד של פנוטיפ chondrogenic למרות היותו מתורבת בסביבת biomimetic חיובית.
גם הידרוג CS-PEG לשמש כסביבה דינמית לכונדרוציטים להתרבות, לעכל את המטריצה קיימת מראש של PEG וCS ולהפקיד מטריצת pericellular והתאית שלהם, המרכיבים העיקריים של רקמת הסחוס הבוגרת. בהתחשב ביכולות אלה, הרחבה הכונדרוציטים לאחר 3 שבועות של תרבות במבחנה יכולות להיות מוערכות על ידי כימות של ה- DNA עם צבע PicoGreen. ניתוח השוואתי של שלוש הקבוצות של תאים מראה כי צפיפות התאים של אוכלוסיות לנוער ומבוגרים הייתה ללא שינוי ואילו כונדרוציטים OA הציגו ירידה דרמטית בהשוואה ליום 1 של התרבות. אובדן תוכן DNA נצפה גם עבור OA אבל לא כונדרוציטים אחרים המצביעים על מוות של תאים אפשריים במהלך התרבות לטווח הארוך (איור 3). המטריצה המופרשת הייתה לכמת כתוכן הגופריתי-GAG ידי assay מחייב צבע DMMB בשלב נקודת סיום לאחר 3 שבועות של תרבויות. תוכן GAG מנורמל על ידי המשקל הרטוב של הידרוג'ל כrecorded לפני עיכול אנזימטי ותרומת acellular מופחת. כפי שניתן לראות באיור 4, כונדרוציטים הופקדו סכום משמעותי דומה של GAG במהלך 3 שבועות של התרבות בהידרוג 3D.
נוכחותו של פיגום פיזי מאפשרת ההערכה של נכסים ביו-מכאניים של הדגימות באמצעות 2,3 בדיקות דחיסת unconfined. בעוד הידרוג acellular לעבור ירידה בmoduli הדחיסה, בונה תאים העמוסים נשמרה moduli הדחיסה לאחר 3 שבועות בתרבות (איור 4). פנוטיפי, ניתוחים ביוכימיים וביו-מכאניים שתוארו כאן הם אפוא שימושי להערכה והבנת הפוטנציאל של אוכלוסיות שונות להכונדרוציטים סחוס הנדסה.

איור 1. הידרוג biomimetic PEG-CS לרחוב ללא הכונדרוציטים 3Dture. כונדרוציטים הם resuspended בתערובת המכילה פולי (diacrylate אתילן גליקול) (PEGDA) וסולפט-methacrylate כונדרואיטין (CS-MA) ויציקה לתוך תבנית ג'ל הגלילית מחוייט. לאחר חשיפה לקרינת UV, הגדילו את ג'לי נאספים מהתבניות וכדאיויות תא מוערכת על ידי צביעה המתה חי פוסט-אנקפסולציה 24 שעות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 2. ביטוי של גני chondrogenic בכונדרוציטים אנושיים בתרבית הידרוג biomimetic 3D. ביטוי גני כמותי של סמני סחוס Col2a1 וCol6a1 ידי כונדרוציטים לנוער, למבוגרים וOA לאחר 3 שבועות של התרבות בהידרוג'ל biomimetic 3D. ערכים הם מנורמלים לרמת ביטוי גן ביום ב 1. שגיאהערס מייצג ממוצע ± SD. * P <0.05, כפי שנקבע על ידי מבחן t סטודנטים שני זנב. שונה מSmeriglio et al. 2 אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

תוכן איור 3. DNA בכונדרוציטים אנושיים בתרבית הידרוג biomimetic 3D. כימות DNA על ידי assay PicoGreen בכונדרוציטים לנוער, למבוגרים וOA לאחר 3 שבועות של התרבות בהידרוג'ל biomimetic 3D. ערכים הם מנורמלים לרמת ה- DNA ביום 1. אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
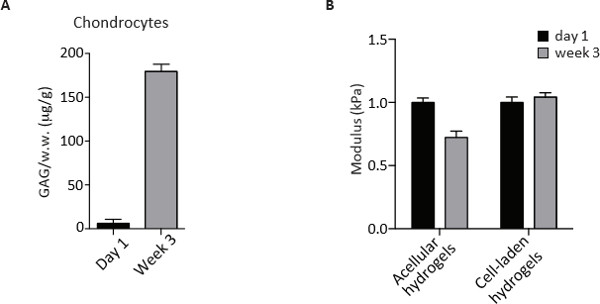
איור תוכן מדידת 4. GAG ובדיקת דחיסת unconfined של כונדרוציטים אנושיים ביום 1 ולאחר 3 שבועות של התרבות בהידרוג'ל biomimetic 3D. () כימות GAG ידי assay DMMB בכונדרוציטים ביום 1 ולאחר 3 שבועות של תרבות ב הידרוג biomimetic 3D. ערכים הם מנורמלים להרטיב משקל (ww) והביעו כמיקרוגרם / g. (ב) מודולוס לחיצה (kPa) של הידרוג'ל acellular ותא-לאדן ביום 1 ולאחר 3 שבועות של התרבות בהידרוג'ל biomimetic 3D. אנא לחצו כאן לצפייה גרסה גדולה יותר של דמות זו.
Discussion
כפי שדווח בפרוטוקול זה, הידרוג 3D הם מסוגלים לשמור על הפנוטיפ הכונדרוציטים בתרבות, הימנעות התהליך של dedifferentiation תא לתאי fibrocartilage נתקלו בדרך כלל בתרבויות monolayer 15. יתר על כן, תרבויות לטווח ארוך של מבנה הידרוג'ל chondrocytes- חשפו סביבה נוחה השומרת על תכונות תא הפנימיות הקשורים לגיל ומחלה.
השימוש בהידרוג'ל biomimetic 3D יש מספר יתרונות. ראשית, הכללתו של כונדרואיטין סולפט (CS), מרכיב עיקרי שנמצא בסחוס במפרק, מאפשר לתאים לבזות את מטריצת הידרוג'ל על ידי הפרשת chondroitinase ונשכב סחוס מסונתז חדש נוספת הסלולר מטריצה 5, 16. בנוסף, CS הוכח יש תכונות אנטי דלקתיות במפרק דלקת פרקים. גם הידרוג'ל biomimetic עשוי לשמש כחומר פיגומים למסירת תא בתיקון סחוס, ועשוי להיות שינוי כימיכדי להקל 17,18 שילוב רקמות ביולוגי טוב יותר.
השימוש בהידרוג PEG-CS מאפשר טווח ארוך תרבויות של כונדרוציטים וההערכה של נכסים ביוכימיים ומכאניים. כאן אנו מראים כיצד פלטפורמה זו יכולה להיות שימושית עבור הניתוחים ההשוואתיים של מקורות שונים של כונדרוציטים מובחנים כדי להגדיר את סוג התא האופטימלי להנדסת סחוס. מעניין לציין, כונדרוציטים במארז בהידרוג'ל להישאר קיימא ולהתרבות על פי היכולות הפנימיות שלהם. תומך הרכב הידרוג'ל, למעשה, הצמיחה של כונדרוציטים לנוער ומבוגרים בריאים, כפי שמוצגת באיור 2. הרכב והמבנה של הידרוג'ל תאר גם מקדמים היווצרות רקמת סחוס כפי שצוין על ידי התצהיר של מטריקס תפקודי הוערך על ידי glycosaminoglycan (GAG כימות).
יתרון נוסף הוא שהמבנים הכונדרוציטים-הידרוג'לניתן להעריך לתכונות מכאניות של רקמת הסחוס החדש שנוצרה. שים לב שבדיקת דחיסת unconfined צריכה להתבצע על הידרוג'ל acellular להשוואה. הידרוג'ל, למעשה, יש לי נוקשות פנימיות בשל הקשיחות של moieties CS. זן unconfined דחיסה של 5-20% (בשיעור של 1% מתח / ים) יכול להיות מיושם לבדיקה המכנית של רקמת סחוס 11,12 מאז את המתח הפיזיולוגי חווה ברקמת סחוס בתנאי טעינה כבר דיווח להיות 10-20 % 13,14. התגובה של הידרוג'ל שני התאים-לאדן וacellular לבדיקות מכאניות הוערכה בסוף נקודות התרבות. בדוגמא שתוארה לעיל צפינו קשיחות דומה של המבנים המכילים כונדרוציטים מבוגרים ונוער בניגוד לקשיחות הנמוכה של המבנים המכילים כונדרוציטים OA. תכונות מכאניות כזה של מבנה התא-הידרוג'ל מאפשרות ההערכה של המאפיינים הפונקציונליים שלרקמה שנוצרה נותנת ניתוח מעמיק של יכולת התבגרות תא.
לסיכום, השימוש בהידרוג'ל biomimetic 3D כדי לחקור את הפוטנציאל של אוכלוסייה הכונדרוציטים שונה כדי ליצור רקמת סחוס יכול להיות מיושם באופן נרחב. מלבד המחקרים במבחנה המתוארים כאן, השתלת in vivo של מבני התא-לאדן יכולה להיות שחזתה ללמוד התבגרות תא ופוטנציאל התחדשות בהקשר הפיזיולוגי. שינויים נוספים של פלטפורמת הידרוג'ל עם גורמי biomimetic נוספים יכולים להיות גם חזה כדי לייעל התפשטות הכונדרוציטים והתבגרות.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to acknowledge Stanford Department of Orthopaedic Surgery and Stanford Coulter Translational Seed Grant for funding. J.H.L. would like to thank National Science Foundation Graduate Fellowship and DARE Doctoral Fellowship for support.
Materials
| Name | Company | Catalog Number | Comments |
| juvenile chondrocytes (Clonetics Normal Human Chondrocyte Cell System ) | Lonza | CC-2550 | |
| adult chondrocytes (Clonetics Normal Human Chondrocyte Cell System) | Lonza | CC-2550 | |
| poly(ethylene glycol diacrylate) | Laysan Bio | ACRL-PEG-ACRL-1000-1g | |
| 2-morpholinoethanesulfonic acid | Sigma | M5287 | |
| photoinitiator | Irgacure | 2959 | |
| sodium chloride | Sigma | S9888 | |
| chondroitin sulfate sodium salt | Sigma | C9819 | |
| N-hydroxysuccinimide | Sigma | 130672 | |
| 1-ethyl-3-(3-dimethylaminopropyl)-carbodiimide hydrochloride | Sigma | E1769 | |
| 2-aminoethyl methacrylate | Sigma | 516155 | |
| dialysis tubing | Spectrum Laboratories | 132700 | |
| Collagenase 2 | Worthington Biochemical | LS004177 | |
| Collagenase 4 | Worthington Biochemical | LS004189 | |
| DMEM/F12 media | HyClone, Thermo Scientific | SH3002301 | |
| live/dead assay | Life Technologies | L3224 | |
| Tri reagent | Life Technologies | AM9738 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Invitrogen | P11496 | |
| Sodium phosphate dibasic | Sigma | S3264 | |
| Ethylenediaminetetraacetic acid disodium salt | Sigma | E5134 | |
| L-Cysteine | Sigma | C1276 | |
| 1,9-dimethylmethylene blue | Sigma | 341088 | |
| Instruments | |||
| UV light equipment - XX-15LW Bench Lamp, 365 nm | UVP | 95-0042-07 | |
| Instron 5944 testing system | Instron Corporation | E5940 |
References
- Roberts, S., Menage, J., Sandell, L. J., Evans, E. H., Richardson, J. B. Immunohistochemical study of collagen types I and II and procollagen IIA in human cartilage repair tissue following autologous chondrocyte implantation. Knee. 16, 398-404 (2009).
- Smeriglio, P., et al. Comparative Potential of Juvenile and Adult Human Articular Chondrocytes for Cartilage Tissue Formation in Three-Dimensional Biomimetic Hydrogels. Tissue engineering. Part A. , (2014).
- Lai, J. H., Kajiyama, G., Smith, R. L., Maloney, W., Yang, F. Stem cells catalyze cartilage formation by neonatal articular chondrocytes in 3D biomimetic hydrogels. Scientific reports. 3, 3553 (2013).
- Taipale, J., Keski-Oja, J. Growth factors in the extracellular matrix. FASEB journal : official publication of the Federation of American Societies for Experimental Biology. 11, 51-59 (1997).
- Varghese, S., et al. Chondroitin sulfate based niches for chondrogenic differentiation of mesenchymal stem cells. Matrix Biol. 27, 12-21 (2008).
- Park, J. S., et al. The effect of matrix stiffness on the differentiation of mesenchymal stem cells in response to TGF-beta. Biomaterials. 32, 3921-3930 (2011).
- Wang, T., Lai, J. H., Han, L. H., Tong, X., Yang, F. Chondrogenic Differentiation of Adipose-Derived Stromal Cells in Combinatorial Hydrogels Containing Cartilage Matrix Proteins with Decoupled Mechanical Stiffness. Tissue engineering. Part A. , (2014).
- Smith, R. L., et al. Effects of intermittent hydrostatic pressure and BMP-2 on osteoarthritic human chondrocyte metabolism in vitro. J Orthop Res. 29, 361-368 (2011).
- Buschmann, M. D., Gluzband, Y. A., Grodzinsky, A. J., Kimura, J. H., Hunziker, E. B. Chondrocytes in agarose culture synthesize a mechanically functional extracellular matrix. J Orthop Res. 10, 745-758 (1992).
- Farndale, R. W., Buttle, D. J., Barrett, A. J. Improved quantitation and discrimination of sulphated glycosaminoglycans by use of dimethylmethylene blue. Biochim Biophys Acta. 883, 173-177 (1986).
- Lai, J. H., Levenston, M. E. Meniscus and cartilage exhibit distinct intra-tissue strain distributions under unconfined compression. Osteoarthritis and cartilage / OARS, Osteoarthritis Research Society. 18, 1291-1299 (2010).
- Li, L. P., Buschmann, M. D., Shirazi-Adl, A. Strain-rate dependent stiffness of articular cartilage in unconfined compression. Journal of biomechanical engineering. 125, 161-168 (2003).
- Armstrong, C. G., Bahrani, A. S., Gardner, D. L. In vitro measurement of articular cartilage deformations in the intact human hip joint under load. The Journal of bone and joint surgery. American. 61, 744-755 (1979).
- Macirowski, T., Tepic, S., Mann, R. W. Cartilage stresses in the human hip joint. Journal of biomechanical engineering. 116, 10-18 (1994).
- Benya, P. D., Shaffer, J. D. Dedifferentiated chondrocytes reexpress the differentiated collagen phenotype when cultured in agarose gels. Cell. 30, 215-224 (1982).
- Buckwalter, J. A., Mankin, H. J. Articular cartilage: tissue design and chondrocyte-matrix interactions. Instructional course lectures. 47, 477-486 (1998).
- Wang, D. A., et al. Multifunctional chondroitin sulphate for cartilage tissue-biomaterial integration. Nat Mater. 6, 385-392 (2007).
- Simson, J. A., Strehin, I. A., Allen, B. W., Elisseeff, J. H. Bonding and fusion of meniscus fibrocartilage using a novel chondroitin sulfate bone marrow tissue adhesive. Tissue engineering. Part A. 19, 1843-1851 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved