Method Article
관절 연골 세포 문화와 연골 생성을위한 3D 하이드로 겔 공사장 공중 발판
요약
Cartilage repair represents an unmet medical challenge and cell-based approaches to engineer human articular cartilage are a promising solution. Here, we describe three-dimensional (3D) biomimetic hydrogels as an ideal tool for the expansion and maturation of human articular chondrocytes.
초록
Human articular cartilage is highly susceptible to damage and has limited self-repair and regeneration potential. Cell-based strategies to engineer cartilage tissue offer a promising solution to repair articular cartilage. To select the optimal cell source for tissue repair, it is important to develop an appropriate culture platform to systematically examine the biological and biomechanical differences in the tissue-engineered cartilage by different cell sources. Here we applied a three-dimensional (3D) biomimetic hydrogel culture platform to systematically examine cartilage regeneration potential of juvenile, adult, and osteoarthritic (OA) chondrocytes. The 3D biomimetic hydrogel consisted of synthetic component poly(ethylene glycol) and bioactive component chondroitin sulfate, which provides a physiologically relevant microenvironment for in vitro culture of chondrocytes. In addition, the scaffold may be potentially used for cell delivery for cartilage repair in vivo. Cartilage tissue engineered in the scaffold can be evaluated using quantitative gene expression, immunofluorescence staining, biochemical assays, and mechanical testing. Utilizing these outcomes, we were able to characterize the differential regenerative potential of chondrocytes of varying age, both at the gene expression level and in the biochemical and biomechanical properties of the engineered cartilage tissue. The 3D culture model could be applied to investigate the molecular and functional differences among chondrocytes and progenitor cells from different stages of normal or aberrant development.
서문
With its limited self-repair potential, human articular cartilage undergoes frequent irreversible damages. Extensive efforts are currently focused on the development of efficient cell-based approaches for treatment of articular cartilage injuries. The success of these cell-based therapies is highly dependent on the selection of an optimal cell source and the maintenance of its regenerative potential. Chondrocytes are a common cell source for cartilage repair, but they are limited in supply and can de-differentiate during in vitro expansion in 2D monolayer culture thereby limiting their generation of hyaline cartilage 1.
The aim of this protocol is to establish a 3-dimensional hydrogel platform for an in vitro comparative study of human chondrocytes from different ages and disease state. Unlike conventional two-dimensional (2D) culture, three-dimensional (3D) hydrogels allow chondrocytes to maintain their morphology and phenotype and provides a physiologically relevant environment enabling chondrocytes to produce cartilage tissue 2,3. In addition to providing a 3D physical structure for chondrocyte culture, hydrogels mimic the function of native cartilage extracellular matrix (ECM). Specifically, the inclusion of chondroitin sulfate methacrylate provides a potential reservoir for secreted paracrine factors 4 and enables cell-mediated degradation and matrix turnover 5. Although many 3D hydrogel culture systems have been utilized widely in various studies including agarose and alginate gels, we have used a biomimetic 3D culture system that has some distinct advantages for chondrocyte culture. Chondroitin sulfate (CS) is an abundant component in articular cartilage and the PEG-CS hydrogels have been shown to maintain and even enhance chondrogenic phenotype and facilitate cell-mediated matrix degradation and turnover 2,5. In addition, the mechanical properties of the hydrogel scaffold can be easily modulated by changing concentration of PEG and hence can be utilized to further enhance the regeneration potential of chondrocytes or a related cell type 6,7. PEG/CSMA is also biocompatible and hence has the potential for a direct clinical application in cartilage defects for example. The limitation for this system is its complexity and the use of photopolymerization that can potentially affect cell viability as compared to simpler systems like agarose, however the advantages for the chondrocyte culture outweigh the potential limitations.
The 3D hydrogel culture is compatible with conventional assay for evaluation of cell phenotype (gene expression, protein immunostaining) and functional outcome (quantification of cartilage matrix production, mechanical testing). This favorable 3D environment was tested to compare the tissue regeneration potential of human chondrocytes from three different aged populations in long-term 3D cultures.
The outcomes were evaluated via both phenotypic and functional assays. Juvenile, adult and OA chondrocytes showed differential responses in the 3D biomimetic hydrogel culture. After 3 and 6 weeks, chondrogenic gene expression was upregulated in juvenile and adult chondrocytes but was downregulated in OA chondrocytes. Deposition of cartilage tissue components including aggrecan, type II collagen, and glycosaminoglycan (GAG) was high for juvenile and adult chondrocytes but not for OA chondrocytes. The compressive moduli of the resulting cartilage constructs also exhibited similar trends. In conclusion, both juvenile and adult chondrocytes exhibited chondrogenic and cartilage matrix disposition up to 6 weeks of 3D culture in hydrogels. In contrast, osteoarthritic chondrocytes revealed a loss of cartilage phenotype and minimal ability to generate robust cartilage.
프로토콜
모든 실험은 스탠포드 대학 인간 피험자의 지침에 따라 수행 기관 심사위원회 프로토콜을 승인했다.
1. 관절 연골 세포의 분리
- 슬관절 전 치환술시 폐기 조직에서 연골을 얻기 이전 8 설명한 바와 같이 해부.
- 시각적으로 매끄러운 표면에 대한 연골 샘플들의 내측 또는 외측 대퇴골을 선택 및 연골 하골에 영향을주지 않고 4~5mm 연골 생검을 제거하기 위해 메스 통해 연골의 표면에 절개를.
- 정제 콜라게나 제와 O / N 처리와 조직의 효소 분해하여 세포 외 기질에서 연골 세포를 분리합니다. 37 ° C에서 연골 세포 성장 미디어 콜라게나 II (125 U / ㎖) 및 콜라게나 IV (160 U / ㎖)의 1의 비율 : 1을 사용합니다.
- 다음 날, 70를 통해 해리 세포를 포함하는 조직 분해를 필터링mm 크기의 나일론 메쉬 기공. 5 분 동안 600 XG에 DMEM / F12와 원심 분리기 20 ㎖로 2 회 세척 할 것.
- 10 % 소 태아 혈청 (FBS)이 보충 된 DMEM / F12 재 현탁액 25 μg의 / ㎖ 아스코르브 산, 2 mM L- 글루타민, 항생제 다음 1 × 106 세포 / 60mm 배양 접시의 밀도로 격리 연골 판형 (100 U / ㎖ 페니실린, 100 μg의 / ㎖ 스트렙토 마이신, 0.25 μg의 / ㎖ fungizone). 이전에 생체 모방 히드로 겔에 캡슐에 37 ° C에서 접시를 유지하고 고밀도 단층로 기본 연골 세포 배양을 유지한다.
2. 생체 모방 하이드로 겔의 제조
참고 :이 방법은 허용 된 폴리 (에틸렌 글리콜 디 아크릴 레이트) (PEGDA, MW 5,000g / 몰), DPBS에 콘드로이틴 설페이트 - 메타 크릴 레이트 (CS-MA)를 함유하는 하이드로 겔의 생체 모방 합성. 광개시제의 첨가는 광 활성화 가교 결합을 가능하게한다. 최종적인 하이드로 겔 조성물이 7 %가 체중이 포함T / 볼륨 (W / V) PEGDA의 3 % CS-MA의 V / W 및 광개시제의 V / W 0.05 %.
- 메타 크릴 레이트 그룹과 CS 폴리머를 기능화하여 CS-MA를 합성.
- MES의 1.952 g 및 탈 이온수 200 ㎖의 염화나트륨 5.84 G (DiH 2 O)을 용해하여 50 mM의 2 morpholinoethanesulfonic 산 (MES) 및 0.5 M 염화 나트륨 (NaCl을)의 완충 용액을 준비합니다. 완충 용액에 콘드로이틴 설페이트 나트륨 염 5 g의 용해.
- (: EDC = 1 : 2의 몰비 NHS)로 0.532 g (4.62 mmol)의 N- 히드 록시 숙신이 미드 (NHS) 및 1.771 g (9.24 밀리몰), 1- 에틸 -3- (3- 디메틸 아미노 프로필) 카르 보디이 미드 히드로 클로라이드 (EDC)를 추가 5 분을위한 솔루션 및 교반.
- 용액을 24 시간 동안 실온에서 반응을 유지한다 (2 : 1 : EDC : AEMA NHS = 1의 몰비) 0.765 g (4.62 밀리몰)의 2- 아미노 에틸 메타 크릴 레이트 (AEMA)를 추가한다.
- 투석 튜브 (12 ~ 14 kDa의 MWCO)를 사용하여 4 일 동안 탈 이온수에 대한 투석 (diH 2 O)에 의한 혼합물을 정화.
- P 필터0.22 μm의 필터를 통해 urified 솔루션 및 건조기, 진공 O / N에서 솔루션을 포함하는 개방형 튜브를 놓습니다. 모든 튜브는 빛으로부터 보호되어 있는지 확인합니다. 빛과 습기로부터 보호 -20 ° C에서 용해 된 폴리머를 저장합니다.
3. 세포 캡슐화
- (셀 - 라덴 3D 하이드로 겔을 펀칭에 대한) PCR 필름과 원통형 막대를 압력솥과 자외선 아래에서 조직 문화 후드에서 0.2 μm의 필터링 된 70 % 에탄올에 침수에 의해 주문 제작 원통형 겔 금형을 소독.
- 기포 또는 누수를 방지하기위한 간극없이 멸균 PCR 막을 겔 몰드의 하부를 밀봉. 멸균 150mm 판에 보관하십시오.
- 종래의 하이드로 겔의 생체 모방 전지 밀봉에 날, 콜라게나 제 II에서 O / N 처리 및 콜라게나 제 IV 용액 고밀도 연골 세포 단층을 해리. 콜라게나 VI 각 연골 세포 성장 미디어 콜라게나 II 125 U / ㎖와 160 U는 / ㎖를 사용하여37 ° C에서.
- 50 ㎖ 튜브를 가지고 추가 5 % 중량 / 부피 (w / v)의 폴리 (에틸렌 글리콜 디 아크릴 레이트) (PEGDA, MW = 5,000g / 몰), w 3 % / V 콘드로이틴 설페이트 - 메타 크릴 레이트 (CS-MA)를, 및 DPBS에 V 광개시제 / W 0.05 %. 솔루션을 혼합하여 따로 보관 유지하는 튜브를 소용돌이. 빛으로부터 튜브를 보호합니다.
- , 50 mL의 팔콘 튜브에 세포를 수집 해리 5 분 동안 460 XG에 카운트 원심. 흡 인물은 모든 셀 관으로부터 미디어 및 15 × 106 세포 / ml의 밀도로 세포를 다시 일시 중단 상기 혼합 겔 물질을 추가한다. 공기를 피하는 형성 거품 동안 30 회 철저하게 섞는다.
- 피펫 (72) 사용자 정의 만든 원통형 겔 금형에 셀 하이드로 겔 현탁액 또는 단독으로 하이드로 겔의 μL 및 5 분 동안 3 mW의 / 평방 미터에 자외선 (365 nm 파장)에 대한 노출을 통해 겔화를 유도한다. 더 셀 내용 일부 하이드로 겔 솔루션을 준비합니다. 미래의 생화학 적 및 기계적 시험에 대한 음성 대조군 이러한 구조를 사용합니다. MeasuUV 강도 측정기 UV 광의 세기 재. 강도를 조정하기 위해, UV 광원 겔화시 하이드로 겔 지지체 사이의 거리를 변경.
참고 : 하이드로 겔 (CS)를 포함하기 때문에, 무 세포 기여 만 휴대 개그를 표현하기 위해 세포 함유 하이드로 겔의 생화학 개그 내용에서 제외됩니다. - 오프 쉽게 껍질의 필름을 잘라 메스를 사용하여 조심스럽게 제거합니다. 원통형 막대의 도움으로, 비중 합 젤 느슨한 세포를 씻어 살균 DPBS 5 ㎖로 6 웰 플레이트에 젤을 밀어.
- 문화 아니라 각으로 연골 세포의 성장 매체의 1.5 ml에 포함 된 24 웰 플레이트의 세포 함유 하이드로 겔. 우물에 세척 하이드로 겔을 전송하는 일회용 주걱을 사용합니다.
- 생존 / 세포 독성 키트를 사용하여 라이브 죽은 염색 24 시간 후 캡슐에 의해 세포 생존 능력을 평가합니다. 문화 신선한 연골 세포 촉진제로 변경 3~6주의 세포 함유 하이드로 겔과 빈 하이드로 겔2 일마다 분석을 위해 수확 전에 미디어 WTH.
4. RNA 추출 및 유전자 발현 분석
- 조심스럽게 미디어를 기음과 세포 - 라덴뿐만 아니라 빈 제어 하이드로 겔에 멸균 PBS 1X했습니다.
- 멸균 주걱의 도움으로, 깨끗한 1.5 ㎖의 에펜 도르프 튜브에 각각의 하이드로 겔을 전송하고 각 튜브에 트라이 시약 250 μL를 추가합니다. RNA를 분리 제조업체의 지침을 따르십시오.
- RNA 분리 및 정량 사용 각 샘플에서 그것의 1 μg의 이후 대용량 cDNA를 역 전사 키트를 사용하는 cDNA로 반전 전사를 수행합니다.
- 정량 PCR에 관심의 유전자의 발현의 시험에의 TaqMan 유전자 발현의 배열을 사용합니다. 내부적 GAPDH 유전자 발현 수준을 정상화.
- PCR 조건 : 10이어서 우라실 DNA 글리코와 이전 증폭 물을 불 활성화하여 50 ℃에서 2 분의 인큐베이션을 포함60; 95 ° C에서 배양 분당의 Taq 중합 효소를 활성화합니다. 이어서 95 ° C에서 15 초로 구성된 PCR 사이클의 마흔을 수행하고, 60 ℃에서 1 분.
5. 생화학 적 분석
- 각 셀 하이드로 겔 구조를 들어 DNA와 다음과 같은 황산 글리코 사 미노 글리 칸 (sGAG) 생산을 정량화.
- 조심스럽게 미디어를 기음과 세포 - 라덴뿐만 아니라 빈 제어 하이드로 겔에 멸균 PBS 1X했습니다. 빈 튜브를 달아 티슈 페이퍼에 그것을 블로 팅 후 내부의 하이드로 겔을 넣고 하이드로 겔의 중량 젖은 무게를 기록한다.
- 효소 소화에 대한 별도의 1.5 ㎖의 에펜 도르프 튜브에 -20 ° C에서 각각의 하이드로 겔을 동결 이상 (GAG에 대한) (DNA에 대한) Picogreen 분석 및 디메틸 메틸렌 블루 분석을 실행하는 소화 제품의 나누어지는을 사용합니다.
- 하이드로 겔의 효소 소화 papainase 솔루션을 준비합니다.
- 제 phosphat 나트륨 7.1 g을 칭량하여 PBE 버퍼를 준비전자 이염 (나 2 HPO 4) 및 에틸렌 디아민 테트라 아세트산이 나트륨 염 (EDTA-나 2) 1.6 g을. , DH 2 O 500ml에 녹이고 6.5로 pH를 조정하고 0.22 mm 필터를 통해 정화 된 용액을 필터.
- PBE 완충액 20ml에 -L- 시스테인 0.035 g을 녹인다. 솔루션 및 멸균 파파인 효소의 100 μl를 필터링합니다.
- 준비 분석을 수행 할 때, -20 ° C에서 튜브를 타고 얼어 붙은 하이드로 겔을 준비 파파인 솔루션의 300 μl를 추가합니다. 박격포와 유 봉 젤 크러시와 모터 유봉과 잘 섞는다.
- 추가 파파인 용액 500 μL에 볼륨을 가져와. 제어 겔에 대해 동일한 절차를 수행한다. 16 시간 3,9 60 ° C에서 품어. 소화 하이드로 겔을 포함하는 용액 따라서 DNA와 개그 정량에 사용 할 수 있습니다. 제조자의 PR 다음 표준 람다 파아지 DNA와 Picogreen 분석법을 이용 DNA 함량을 측정otocol.
- 1,9- 디메틸 메틸렌 블루 (DMMB) 표준 10 상어 콘드로이틴 설페이트와 염료 결합 분석법을 이용하여 황산 GAG 함량을 정량화. 해당 젖은 무게 GAG의 양을 분할함으로써 GAG 함량을 결정한다.
6. 기계적 시험
- 10 N 하중 셀이 장착 5944 인스 트론 시험 장치를 이용하여 일축 압축 시험을 수행한다.
- 체외 배양의 바람직한 일 후, 세포 - 하이드로 겔 지지체와 무 세포 제어 하이드로 겔에 압축 시험을 수행한다.
- RT에서 PBS 욕에서 시험편을 담그고 하중 조건 하에서 연골 조직에 의해 경험 생리 변형 때문에 15 % (11, 12)의 최대 변형률 1 % 스트레인 / sec의 속도로 압축하는 것은 10 내지 20 %의 것으로보고되었다 (13, 14).
- 3 차 다항식을 사용하여 변형 곡선과 곡선 맞춤 대 스트레스를 만듭니다. COMPR 결정15 %의 변형률 값의 곡선에 맞게 방정식에서 (메모리) 접선 계수.
결과
PEG 및 CS 부분 (그림 1)를 포함하는 생리 활성 하이드로 겔은 인간의 관절 연골 세포의 2,3,5,7의 문화와 성숙을위한 이상적인 플랫폼을 나타냅니다. 다양한 연령 및 질환 상태에서 연골 세포는 배양 한 방법 및 그 표현형, 유전자 발현 및 생성 된 연골 조직의 생화학 적 및 기계적 성질에 대해 분석 할 수있다. 세 연골 세포 샘플, juvenile- 6개월, adult- 34년 및 osteoarthritic- 74년는 3D 생체 모방 히드로 겔 문화 3 주 후에 수확했다. 유전자 발현이 정상 연골, 청소년 및 성인 둘 분석, 연골 세포 및 유전자 Col2a1 Col6a1의 발현 증가를 보였다. Col6a1 (도 2)의 발현을 유지 유리한 생체 모방 환경에서 배양 표현형 불구 연골의 손실을 표시하는 동안 반대로, 병든 연골 Col2a1의 극적인 감소를 나타내었다.
CS-PEG 하이드로 겔은 또한, 연골 세포가 증식하는 동적 환경 역할 PEG 및 CS의 기존 매트릭스를 소화하고 그들의 pericellular 및 세포 외 기질, 성숙한 연골 조직의 주성분을 침착. 체외 배양 3 주 후 연골 세포의 확장, 이러한 능력을 감안할 때이 Picogreen 염료와 DNA의 정량에 의해 추정 할 수있다. 세포의 세 그룹의 비교 분석은 OA 연골 세포는 배양 1 일째에 비해 극적으로 감소 발휘하면서 청소년 및 성인 인구의 셀 밀도는 변하지 것을 보여준다. DNA 함량의 감소는 장기 배양 (도 3) 중에 가능한 세포 사멸을 시사 다른 OA 연골 위해 아니지만 관찰되었다. 분비 매트릭스는 배양 3 주 후에 종료점 단계 DMMB 염료 결합 분석하여 설페이트 화 - GAG 함량으로 정량 하였다. GAG 컨텐츠 recor 같은 하이드로 겔의 습윤 중량을 기준으로 규격화DED 효소 소화와 무 세포 기여 전에 뺀다. 도 4에 도시 된 바와 같이, 연골 세포는 하이드로 겔의 3 차원 배양 3 주 동안 GAG 유사한 상당한 양의 증착.
물리적 골격의 존재는 일축 압축 시험의 2,3를 통해 샘플의 생체 역학적 특성의 평가를 할 수 있습니다. 무 세포 하이드로 겔은 압축 계수의 감소를 겪는 동안, 세포 - 라덴 구조는 문화 3 주 (그림 4) 후 압축 계수를 유지했다. 표현형, 여기에 설명 된 생화학 및 생 역학적 분석 평가 및 엔지니어링 연골에 대해 서로 다른 연골 세포 인구의 잠재력을 이해 때문에 유용하다.

3D의 연골 세포의 막 다른 1. PEG-CS 생체 모방 하이드로 겔 그림스트럭처. 연골 세포는 폴리 (에틸렌 글리콜 디 아크릴 레이트) (PEGDA) 콘드로이틴 설페이트 - 메타 크릴 레이트 (CS-MA) 및 주문 제작 겔 원통형 금형에 캐스팅을 포함하는 혼합물에 재현 탁된다. 자외선 노출 후, 젤은 금형에서 수집 및 세포 생존 라이브 죽은 염색 24 시간 후 캡슐에 의해 평가된다 응고. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3D 생체 모방 하이드로 겔에서 배양 된 연골 세포에서 연골 유전자의 2 식입니다. 3D 생체 모방 히드로 겔 문화 3 주 후에 청소년, 성인 및 OA 연골 세포로 연골 마커 Col2a1 및 Col6a1의 정량적 유전자 발현. 값이 1 일 때 오류 B에서 유전자 발현 수준으로 정상화된다ARS는 평균 ± SD 나타냅니다. * P는 <양측 '학생의 t 분포'에 의해 결정되는 바와 같이, 0.05. Smeriglio 등에서 수정. (2) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

3D 생체 모방 하이드로 겔에서 배양 된 연골 세포 그림 3. DNA 콘텐츠. 3D 생체 모방 히드로 겔 문화 3 주 후에 청소년, 성인 및 골관절염 연골 세포에서 Picogreen 분석에 의한 DNA 정량. 값은 하루 1에서 DNA 수준으로 정상화되는 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
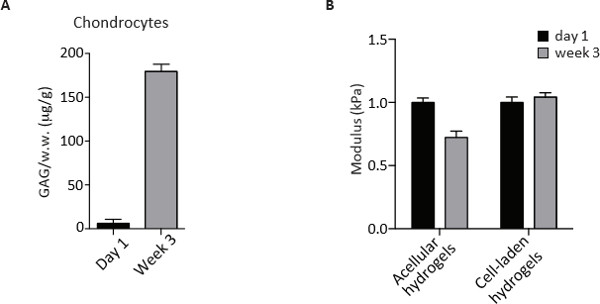
그림 4. 개그 콘텐츠 측정 및 1 일에서 3 차원 생체 모방 히드로 겔 문화 3 주 후에 인간의 연골 세포의 일축 압축 시험. 1 일에서 연골 세포와 문화 3 주 후에 DMMB 분석에 의해 (A) 개그 정량 3D 생체 모방 하이드로 겔. 값은 무게 (전주) 적시에 정규화 및 μg의 / G로 표시됩니다. 하루에 1에서와 3D 생체 모방 히드로 겔 문화 3 주 후에 무 세포 및 세포 함유 하이드로 겔의 (B) 압축 계수 (kPa의). 보려면 여기를 클릭하십시오 이 그림의 더 큰 버전.
토론
이 프로토콜에보고 된 바와 같이, 3D 하이드로 겔은 일반적으로 단층 배양 물 (15)가 발생 섬유 연골 세포로 세포의 탈분화 과정을 회피 배양 연골 세포 표현형을 유지할 수있다. 또한, chondrocytes- 하이드로 겔 구조의 장기 문화는 연령과 질병에 관련된 고유 세포 기능을 유지하는 유리한 환경을 밝혔다.
3D 생체 모방 하이드로 겔의 사용은 몇 가지 장점을 갖는다. 우선, 콘드로이틴 설페이트의 포함 (CS), 관절 연골에서 발견되는 주요 성분은, chondroitinase 분비하여 하이드로 겔 매트릭스를 분해 및 세포 외 매트릭스 5, 16 새로 합성 된 연골 누워 세포를 가능하게한다. 또한, CS는 도시 된 관절염 관절의 항 염증 특성을 가지고있다. 하이드로 겔은 또한 생체 모방 연골 복구 세포 전달을위한 발판 재료로서 사용될 수 있고, 화학적으로 변형 될 수있다좋은 생체 조직 (17, 18)를 통합 촉진한다.
PEG-CS 하이드로 겔의 사용은 장기간의 연골 세포의 배양 및 생화학 적 및 기계적 성질의 평가를 허용한다. 여기에서 우리는이 플랫폼은 연골 엔지니어링을위한 최적의 세포 유형을 정의하기 위해 차별화 된 연골 세포의 다양한 소스의 비교 분석에 유용 할 수 방법을 보여줍니다. 흥미롭게도, 하이드로 겔에 캡슐화 된 연골 세포는 자신의 고유 능력에 따라 가능한 유지 및 증식. 하이드로 겔 조성물 지지체는 사실상 건강한 소아 및 성인 연골 세포의 성장은도 2에 도시 된 바와 같이. 기술 된 하이드로 겔의 조성과 구조는 연골 조직의 형성을 촉진하는 글리코 사 미노 글리 칸에 의해 평가 기능 외 기질의 증착 (GAG로 나타낸 바와 ) 정량.
추가적인 장점은 연골 - 하이드로 겔 구조이다새로 형성된 연골 조직의 기계적 특성에 대해 평가 될 수있다. 일축 압축 시험 비교를 위해 무 세포 하이드로 겔에서 수행되어야합니다. 하이드로 겔은 사실 때문에 CS 부분의 강성 극한 강도를 갖는다. (변형 속도 / s 1 %에서) 5-20%의 일축 압축 변형은 하중 조건 하에서 연골 조직에 의해 경험 생리 균주 보낸 연골 조직 (11, 12)의 기계적 시험에 적용될 수는 10-20 인 것으로보고되었다 % (13, 14). 기계적 시험에 세포 - 라덴과 무 세포 모두 하이드로 겔의 응답은 문화 엔드 포인트에서 평가 하였다. 설명 된 예에서는 OA 연골 세포를 포함하는 구조체의 하부의 강성 대조적 성인 및 청소년 연골 함유 구조체의 강성을 비교 관찰 위에. 셀 하이드로 겔 구조의 기계적 특성의 기능적 특성의 평가를 허용세포 성숙 능력에 대한 심층적 인 분석을 제공 형성 조직.
결론적으로, 연골 조직을 생성하기 위해 다른 연골 세포 모집단의 잠재력을 연구하는 3D 생체 모방 하이드로 겔의 사용은 광범위하게 적용될 수있다. 여기에 기술 된 시험 관내 연구 이외에도, 세포 함유 구조체의 생체 내 이식 생리 컨텍스트에서 세포 성숙 및 재생 가능성을 연구하기 위해 구상 될 수있다. 추가적인 생체 모방 인자 하이드로 플랫폼의 추가 수정은 연골 세포의 증식 및 성숙을 최적화하기 위해 구상 될 수있다.
공개
The authors have nothing to disclose.
감사의 말
The authors would like to acknowledge Stanford Department of Orthopaedic Surgery and Stanford Coulter Translational Seed Grant for funding. J.H.L. would like to thank National Science Foundation Graduate Fellowship and DARE Doctoral Fellowship for support.
자료
| Name | Company | Catalog Number | Comments |
| juvenile chondrocytes (Clonetics Normal Human Chondrocyte Cell System ) | Lonza | CC-2550 | |
| adult chondrocytes (Clonetics Normal Human Chondrocyte Cell System) | Lonza | CC-2550 | |
| poly(ethylene glycol diacrylate) | Laysan Bio | ACRL-PEG-ACRL-1000-1g | |
| 2-morpholinoethanesulfonic acid | Sigma | M5287 | |
| photoinitiator | Irgacure | 2959 | |
| sodium chloride | Sigma | S9888 | |
| chondroitin sulfate sodium salt | Sigma | C9819 | |
| N-hydroxysuccinimide | Sigma | 130672 | |
| 1-ethyl-3-(3-dimethylaminopropyl)-carbodiimide hydrochloride | Sigma | E1769 | |
| 2-aminoethyl methacrylate | Sigma | 516155 | |
| dialysis tubing | Spectrum Laboratories | 132700 | |
| Collagenase 2 | Worthington Biochemical | LS004177 | |
| Collagenase 4 | Worthington Biochemical | LS004189 | |
| DMEM/F12 media | HyClone, Thermo Scientific | SH3002301 | |
| live/dead assay | Life Technologies | L3224 | |
| Tri reagent | Life Technologies | AM9738 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Invitrogen | P11496 | |
| Sodium phosphate dibasic | Sigma | S3264 | |
| Ethylenediaminetetraacetic acid disodium salt | Sigma | E5134 | |
| L-Cysteine | Sigma | C1276 | |
| 1,9-dimethylmethylene blue | Sigma | 341088 | |
| Instruments | |||
| UV light equipment - XX-15LW Bench Lamp, 365 nm | UVP | 95-0042-07 | |
| Instron 5944 testing system | Instron Corporation | E5940 |
참고문헌
- Roberts, S., Menage, J., Sandell, L. J., Evans, E. H., Richardson, J. B. Immunohistochemical study of collagen types I and II and procollagen IIA in human cartilage repair tissue following autologous chondrocyte implantation. Knee. 16, 398-404 (2009).
- Smeriglio, P., et al. Comparative Potential of Juvenile and Adult Human Articular Chondrocytes for Cartilage Tissue Formation in Three-Dimensional Biomimetic Hydrogels. Tissue engineering. Part A. , (2014).
- Lai, J. H., Kajiyama, G., Smith, R. L., Maloney, W., Yang, F. Stem cells catalyze cartilage formation by neonatal articular chondrocytes in 3D biomimetic hydrogels. Scientific reports. 3, 3553 (2013).
- Taipale, J., Keski-Oja, J. Growth factors in the extracellular matrix. FASEB journal : official publication of the Federation of American Societies for Experimental Biology. 11, 51-59 (1997).
- Varghese, S., et al. Chondroitin sulfate based niches for chondrogenic differentiation of mesenchymal stem cells. Matrix Biol. 27, 12-21 (2008).
- Park, J. S., et al. The effect of matrix stiffness on the differentiation of mesenchymal stem cells in response to TGF-beta. Biomaterials. 32, 3921-3930 (2011).
- Wang, T., Lai, J. H., Han, L. H., Tong, X., Yang, F. Chondrogenic Differentiation of Adipose-Derived Stromal Cells in Combinatorial Hydrogels Containing Cartilage Matrix Proteins with Decoupled Mechanical Stiffness. Tissue engineering. Part A. , (2014).
- Smith, R. L., et al. Effects of intermittent hydrostatic pressure and BMP-2 on osteoarthritic human chondrocyte metabolism in vitro. J Orthop Res. 29, 361-368 (2011).
- Buschmann, M. D., Gluzband, Y. A., Grodzinsky, A. J., Kimura, J. H., Hunziker, E. B. Chondrocytes in agarose culture synthesize a mechanically functional extracellular matrix. J Orthop Res. 10, 745-758 (1992).
- Farndale, R. W., Buttle, D. J., Barrett, A. J. Improved quantitation and discrimination of sulphated glycosaminoglycans by use of dimethylmethylene blue. Biochim Biophys Acta. 883, 173-177 (1986).
- Lai, J. H., Levenston, M. E. Meniscus and cartilage exhibit distinct intra-tissue strain distributions under unconfined compression. Osteoarthritis and cartilage / OARS, Osteoarthritis Research Society. 18, 1291-1299 (2010).
- Li, L. P., Buschmann, M. D., Shirazi-Adl, A. Strain-rate dependent stiffness of articular cartilage in unconfined compression. Journal of biomechanical engineering. 125, 161-168 (2003).
- Armstrong, C. G., Bahrani, A. S., Gardner, D. L. In vitro measurement of articular cartilage deformations in the intact human hip joint under load. The Journal of bone and joint surgery. American. 61, 744-755 (1979).
- Macirowski, T., Tepic, S., Mann, R. W. Cartilage stresses in the human hip joint. Journal of biomechanical engineering. 116, 10-18 (1994).
- Benya, P. D., Shaffer, J. D. Dedifferentiated chondrocytes reexpress the differentiated collagen phenotype when cultured in agarose gels. Cell. 30, 215-224 (1982).
- Buckwalter, J. A., Mankin, H. J. Articular cartilage: tissue design and chondrocyte-matrix interactions. Instructional course lectures. 47, 477-486 (1998).
- Wang, D. A., et al. Multifunctional chondroitin sulphate for cartilage tissue-biomaterial integration. Nat Mater. 6, 385-392 (2007).
- Simson, J. A., Strehin, I. A., Allen, B. W., Elisseeff, J. H. Bonding and fusion of meniscus fibrocartilage using a novel chondroitin sulfate bone marrow tissue adhesive. Tissue engineering. Part A. 19, 1843-1851 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유