A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إعداد Hexahelicene functionalized Corannulene من قبل النحاس (I) -catalyzed Cycloaddition آلكاين-أزيد من وحدات Nonplanar العطرية المتعددة
In This Article
Summary
هنا، نقدم بروتوكول لتجميع مركب عضوي معقد يتكون من ثلاث وحدات العطرية المتعددة nonplanar، وتجميعها بسهولة مع عوائد معقولة.
Abstract
The main purpose of this video is to show 6 reaction steps of a convergent synthesis and prepare a complex molecule containing up to three nonplanar polyaromatic units, which are two corannulene moieties and a racemic hexahelicene linking them. The compound described in this work is a good host for fullerenes. Several common organic reactions, such as free-radical reactions, C-C coupling or click chemistry, are employed demonstrating the versatility of functionalization that this compound can accept. All of these reactions work for planar aromatic molecules. With subtle modifications, it is possible to achieve similar results for nonplanar polyaromatic compounds.
Introduction
نظرا لاحتياجاتهم الخاصة الهندسة، corannulene وhelicenes هي عبارة عن جزيئات يمكن أن تبني الهيكل بعيدا عن بلاناريتي وتؤدي إلى خصائص مثيرة للاهتمام. 1-15 وفي السنوات القليلة الماضية، والبحث من المستقبلات الجزيئية لأنابيب الكربون النانوية والفلورين هي منطقة نشطة للغاية 16-19 بسبب، بشكل رئيسي، إلى التطبيقات المحتملة كمواد للخلايا العضوية الشمسية، والترانزستورات، وأجهزة الاستشعار وغيرها من الأجهزة. 20-28 وقد اجتذبت التكامل الممتاز في الشكل بين corannulene والفوليرين انتباه العديد من الباحثين بهدف تصميم مستقبلات جزيئية قادرة على تشكيل جمعية supramolecular من قبل قوات التشتت. 29-39
كيمياء المركبات العطرية المتعددة nonplanar المذكورة أعلاه مماثلة لتلك التي وصفها لجزيئات مستو تماما، ولكن من الصعب أحيانا أن تجد الظروف المناسبة لتحقيق الإختياريات والعوائد المرجوة. 40 في هذا العمل نقدم تركيب جزيء (7) وجود ثلاث وحدات العطرية المتعددة في خطوات قليلة مع عوائد جيدة من خلال تطبيق تقنيات سهلة ونموذجية وجدت في كل مختبر أبحاث. جزيء له أهمية كبيرة لأنه يمكن أن تبني التشكل تشبه الكماشة لإقامة تفاعلات جيدة مع C 60 37 في الحل. وأنه قد فتح خط الأبحاث بمثابة مستقبلات المحتملة لارتفاع الفلورين بفضل مراوان إلى رابط helicene، وهو جزيء انطباقي بسبب وجود محور stereogenic. 41-45 ومع ذلك، لن يستخدم إلا في helicene الرزيمية في هذا العمل.
في هذه المرحلة، والقيد الوحيد لتجميع هذه المستقبلات هي إعداد helicenes وcorannulenes، لأنها ليست متاحة تجاريا. ولكن، وفقا لأساليب جديدة نشرت في أماكن أخرى 46-48 يمكن الحصول عليها بكميات مناسبة في فترة قصيرة معقولة من الزمن.
Protocol
1. Functionalization من 2،15-Dimethylhexahelicene
- Dibromination من 2،15-dimethylhexahelicene
- تزن 0.356 غرام (1.0 ملمول) من 2،15-dimethylhexahelicene، 0.374 غرام (2.1 ملمول) من بلورته حديثا -bromosuccinimide N (المصلحة) و 24 ملغ (0.07 ملمول) من البنزويل بيروكسايد (BPO) (70٪ بالوزن مع 30٪ من المياه كما استقرار). وضع جميع المواد الصلبة في 100 مل قارورة Schlenk مع شريط مغناطيسي. وضعت تحت جو النيتروجين ثلاث دورات الإخلاء الغاز تليها إعادة تعبئة مع غاز خامل في خط Schlenk.
- إضافة 21 مل من رابع كلوريد الكربون (لجنة علم المناخ 4). ديغا حل عن طريق عملية الإخلاء / عملية إعادة تعبئة (الخطوة 1.1.1) مع التحريك قوية وبعناية من أجل منع خسائر فادحة في المذيبات.
- الحرارة في الجزر (77 ° C) الخليط مع حمام الزيت لمدة 4 ساعات. تحقق رد فعل من قبل بالرنين المغناطيسي 1 H-النووي (NMR). الحلل بين 3.7 جزء في المليون و 4.0 جزء في المليون شوتظهر يونيتبول. أنها تشير إلى وجود -CH diastereotopic 2 - مجموعات (الشكل 1).
- الانتهاء مرة واحدة، تبريد الخليط إلى درجة حرارة الغرفة، وإزالة المذيب تحت فراغ. إعداد فخ مليئة النيتروجين السائل لتجنب التلوث مضخة.
- تنحل النفط الخام في 30 مل من ثنائي كلورو ميثان (DCM)، ونقل إلى قارورة جولة القاع وتخلط مع 4 غرام من هلام السيليكا (عادة إضافة 5 أضعاف وزن الخام). تركيز الخليط في المبخر الدوار.
- في هذه الأثناء، وملء العمود (الطول حوالي 20 سم وسماكة 4.5 سم) مع شافي 2 هلام مختلطة سابقا مع خلات الهكسان / الإيثيلي (95: 5)، والطور المتحرك. إضافة الخليط إلى الجزء العلوي من العمود ثم إضافة طبقة من الرمل (2 سم).
- صب بعناية في المرحلة المحمولة الجديدة وأداء اللوني من خلال جمع الكسور في أنابيب الاختبار (عادة 20 مل لكل أنبوب و 4 مل بالقرب من شطف المنتج المتوقع). تحقق الكسور رقيقة اللوني طبقة(TLC) مع نفس المرحلة المتنقلة (الهكسان / خلات الإيثيل 95: 5)، وصورة تحت ضوء الأشعة فوق البنفسجية. المنتج المتوقع (4B) يجب أن أزل في عامل الاحتفاظ (RF) من 0.35 كزيت الأصفر بعد دمج جميع الكسور المطلوبين وإزالة من المذيب في المبخر الدوار. ويجب الحصول على 334 ملغ (تسفر عن 65٪).
ملاحظة: جميع تقنيات Schlenk، واستخدام حمام الزيت للتدفئة والعمود إعدادات اللوني سوف تستخدم على نطاق واسع في معظم البروتوكولات، لذلك من الآن فصاعدا، لن تكون مشمولة في التفاصيل وفقط عدد قليل من التعليقات، عند الضرورة، سوف أن تعطي.
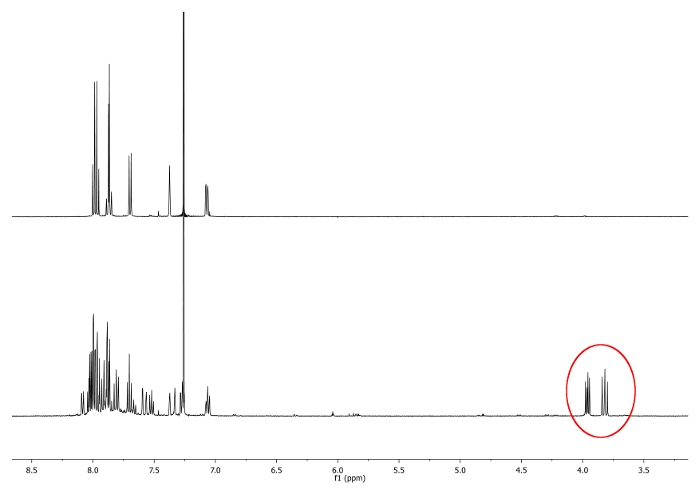
. الرقم 1 1 H-NMR الأطياف (500 ميغاهيرتز، CDCl 3) من 2،15 -dimethylhelicene (أعلى) وقسامة التي اتخذت بعد 2 ساعة إشارات جديدة، الموافق -CH 2 -، ما يصور في دائرة حمراء (القاع) الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- توليف 2،15 مكرر (azidomethyl) hexahelicene
- تزن 0.103 غرام (0.2 ملمول) من 2،15 مكرر (bromomethyl) hexahelicene و0.390 غ (6 ملمول) من أزيد الصوديوم. وضع كل من المواد الصلبة في 50 مل دورق شلينك مجهزة شريط المغناطيسي وضعت في جو من النيتروجين.
- خلط 8.6 مل من رباعي هيدرو الفوران (THF) مع 5.2 مل من الماء (H 2 O) ويصب الخليط من المذيبات في قارورة Schlenk. ديغا الحل.
- الحرارة في الجزر (65 درجة مئوية) لمدة 3 ساعات. تحقق من رد فعل من 1 H-NMR. ينبغي أن يتحول إشارات إلى 3.75 جزء في المليون (الشكل 2) - -CH 2.
- بعد ذلك، سجعل أسفل الخليط إلى درجة حرارة الغرفة، وإزالة THF في ظل فراغ. تمييع مع 50 مل من H 2 O.
- نقل الخليط لقمع فصل واستخراج ثلاث مرات مع 40 مل من DCM. الجمع بين جميع المراحل العضوية وغسل مع H 2 O النقي (50 مل).
- تنقية النفط الخام عن طريق العمود اللوني على هلام السيليكا باستخدام خلات الهكسان / الإيثيلي (85:15) كمرحلة المتنقلة لإعطاء النفط الأصفر في الترددات اللاسلكية = 0.38 الموافق 2،15 مكرر (azomethyl) hexahelicene (5B). ويجب الحصول على 70 ملغ (تسفر عن 80٪).
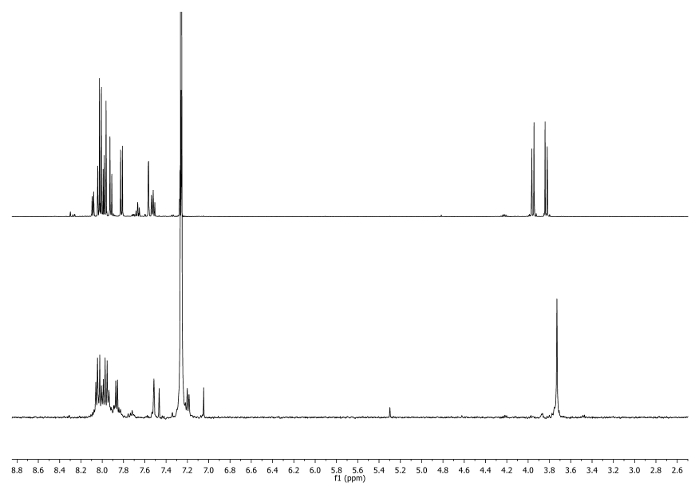
الشكل 2: 1 H-NMR الأطياف (500 ميغاهيرتز، CDCl 3) من 4 ب (أعلى) وقسامة التي اتخذت بعد 3 ساعات(القاع). ملاحظة التغييرات في المنطقة الأليفاتية. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
2. Functionalization من Corannulene
- Monobromination من Corannulene
- تزن 0.125 غرام (0.5 ملمول) من corannulene، 89 ملغ (0.5 ملمول) من مصلحة الدولة للاحصاء بلورته الطازج و 17 ملغ من الذهب (III) هيدرات كلوريد.
- إخضاع جميع المركبات إلى 10 مل قارورة مصممة خصيصا لردود الفعل الميكروويف مجهزة شريط مغناطيسي ومن ثم وضعت في جو النيتروجين مع مساعدة من 2 العنق قارورة ذهابا وأسفل.
- إضافة 7 مل من 1،2-ثنائي كلورو إيثان (DCE) وديغا الحل.
- يصوتن الخليط لمدة 2 دقيقة لتفريق جزيئات الملح الذهب.
- الحرارة داخل المفاعل الميكروويف عند 100 درجة مئوية لمدة 2 ساعة.
- عند الانتهاء، ونقل النفط الخام إلى قارورة جولة القاع وإزالة المذيب بواسطة ROTARتبخر ذ.
- تنقية النفط الخام عن طريق العمود اللوني على شافي 2 هلام باستخدام الهكسان كما الطور المتحرك.
ملاحظة: Bromocorannulene (4A) يتم الحصول كمادة صلبة صفراء في الترددات اللاسلكية = 0.38. ويجب الحصول على 99 ملغ (تسفر عن 60٪). corannulene المتفاعل (3A) يمكن استرداد وتخزينها لاستخدامات أخرى. ويبدو في الترددات اللاسلكية = 0.29.
- Sonogashira اقتران من Bomocorannulene وEthynyltrimethylsilane
- وزن 49 ملغم (0.15 ملمول) من bromocorannulene، 11 ملغ (0.015 ملمول) من [PdCl 2 (dppf)] 49،50 (dppf كونها 1،1-'bis (diphenylphsphino) الفيروسين، 3 ملغ (0.015 ملمول) تسوى. 51
- وضع جميع المواد الصلبة في 50 مل دورق شلينك جنبا إلى جنب مع شريط المغناطيسي وضعت في جو من النيتروجين.
- إضافة 5.0 مل من ثلاثي الإيثيلامين (صافي 3) وديغا الخليط.
- أخيرا، إضافة 104 ميكرولتر (0.75 ملمول) من ethynyltrimethylsilane.
- يصوتن الخليط لمدة 2 دقيقة لتفريق جزيئات الملح المعدنية.
- الحرارة عند 85 درجة مئوية لمدة 24 ساعة مع صوتنة الدوري لمنع ترسب الأملاح المعدنية.
ملاحظة: لون الخليط تحولت إلى اللون الأسود قريبا، مشيرا إلى وجود البلاديوم (0). - يبرد إلى درجة حرارة الغرفة وتتبخر شبكة 3 في الخلاء.
- تنحل في 20 مل من DCM وتنقية بواسطة عمود اللوني على هلام السيليكا يبلغ حجمه مع الهكسان لإعطاء مادة صلبة صفراء في الترددات اللاسلكية = 0.28 الموافق 5A. ويجب الحصول على 41 ملغ (تسفر عن 78٪).
ملاحظة: إذا كان يتم تصفية النفط الخام من خلال لوحة Celite في DCM، يمكن الحصول على عينة نقية معقولة، لكن المشتقات الفوسفين ولم يستبعد تماما.
- إعداد Ethynylcorannulene التي كتبها Deprotection TMS
- وزن 35 ملغم (0.10 ملمول) من 5A و 7.3 ملغ (0.125 ملمول) من فلوريد البوتاسيوم اللامائية.
- وضع جميع المواد الصلبة في 50 مل دورق شلينك مجهزة الحانة المغناطيسيد ضعت في جو من النيتروجين.
- مزيج 4 مل من THF و 4 مل من الميثانول (MeOH) ويصب الخليط في قارورة Schlenk. ديغا بدقة.
- السماح للرد في درجة حرارة الغرفة، وحافظ على قارورة بعيدا عن الضوء من خلال تغطية ذلك مع فيلم مبهمة. تحقق من رد فعل من 1 H-NMR من خلال النظر في 3.48 جزء من المليون. إشارة الموافق -CCH يجب أن تظهر (الشكل 3).
ملاحظة: على الرغم من أن هذا المركب يحمل آلكاين المحطة وهذا هو رد الفعل وتتحلل بسهولة، لم نعثر على أي مشاكل أثناء العمل حتى هو موضح أدناه. تم تنفيذه تحت الضوء الطبيعي. - الانتهاء مرة واحدة، وإزالة THF تحت فراغ وتمييع مع 10 مل من الماء، وتحويل كل شيء إلى قمع فصل.
- استخراج مع DCM (3 × 15 مل)، والجمع بين جميع المراحل العضوية في قارورة جولة القاع والتركيز في المبخر الدوار في درجة حرارة الغرفة لتحصل في النهاية على صلب أصفر الموافق 6A. وينبغي الحصول على 27 ملغ (العائد الكمي).
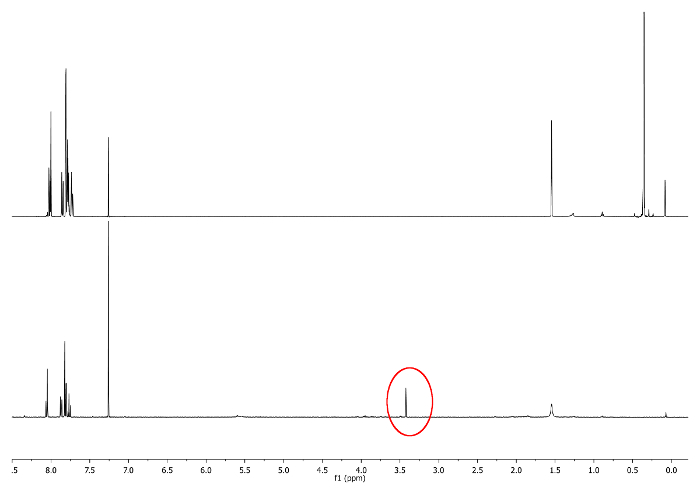
الرقم 3: 1 H-NMR الأطياف (500 ميغاهيرتز، CDCl 3) من 5 إلى (أعلى) و 6 ل(القاع) وصفت القميص -CCH في دائرة حمراء الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
3. الجمعية الختامية التي انقر الكيمياء
- تزن 15.3 ملغ (0.035 ملمول) من 5B، 20.0 ملغ (0.073 ملمول) من 6A، 1.4 ملغ (0.007 ملمول) من حامض الاسكوربيك ملح الصوديوم، 1.7 ملغ (0.007 ملمول) من كبريتات النحاس 4 · 5H 2 O.
- وضع جميع المواد الصلبة في قارورة 50 مل Schlenk مجهزة صباحاشريط agnetic وضعت في جو من النيتروجين.
- مزيج 3 مل من H 2 O و 12 مل من THF ويصب الخليط في قارورة Schlenk. ديغا حل شامل.
- الحرارة عند 65 درجة مئوية لمدة 3 أيام مع مكثف متصلة الجزء العلوي من القارورة وتحقق دوريا رد فعل للسيطرة على درجة الحرارة، واثارة وحجم المذيبات. تحقق من رد فعل من 1 H-NMR. إشارة إلى 3.48 جزء في المليون يجب أن تختفي وأن تحولت إلى 7.27 جزء في المليون مما يدل على استهلاك corannulene إيثينيل وجود وحدة التريازول (الشكل 4).
- عند الانتهاء، إزالة THF تحت فراغ وتمييع مع 20 مل من الماء، وتحويل الخليط إلى قمع فصل.
- استخراج مع DCM (3 × 20 مل)، والجمع بين جميع المراحل العضوية في قارورة جولة القاع والتركيز في المبخر الدوار.
- تنقية النفط الخام عن طريق العمود اللوني على شافي 2 هلام يبلغ حجمه مع الهكسان / خلات الإيثيل (1: 1) لإعطاء اللون الأصفر الشاحب الصلبة في الترددات اللاسلكية = 0.59الموافق 7. ويجب الحصول على 27 ملغ (تسفر عن 75٪).
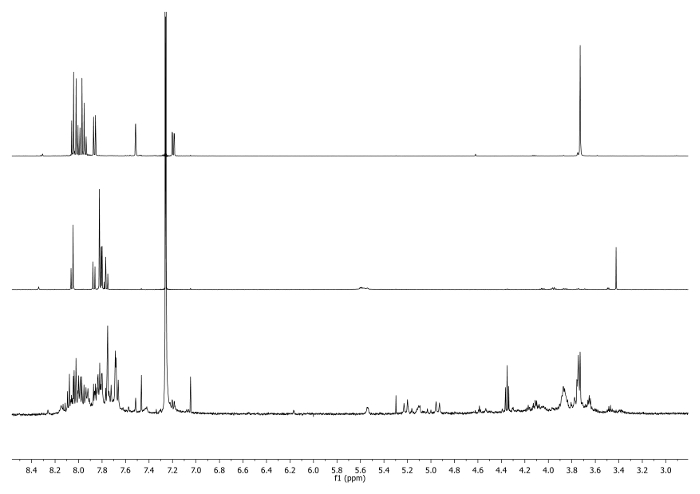
الشكل 4: 1 H-NMR الأطياف (500 ميغاهيرتز، CDCl 3) من 5 ب (أعلى)، و 6 ل(وسط) وقسامة التي اتخذت بعد 2 أيام (القاع) لاحظ اختفاء اشارة -CCH في النفط الخام. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
النتائج
Corannulene (3 أ) و 2،15-dimethylhexahelicene (3 ب) يمكن إعداد التالية الأساليب الحالية 46-48 بطريقة واضحة مع غلة جيدة جدا (الشكل 5). نشترك جزيء المشترك، 2،7-dimethylnaphthalene، كمادة البدء، مما أدى إلى متباينة إلى التوليف متقارب?...
Discussion
وقد تم إعداد مجمع النهائي 7 بعد 6 خطوات من السلائف العطرية المتعددة nonplanar 3 أ و 3 ب مع معتدلة إلى غلة جيدة جدا في كل رد فعل. وكان القيد الرئيسي لوحظ في هذا الطريق والبرومين كل من المركبات العطرية المتعددة nonplanar. ومع ذلك، في حال...
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was funded by the Spanish Ministerio de Economìa y Competitividad (CTQ 2013-41067-P). H.B. acknowledge with thanks a MEC-FPI grant.
Materials
| Name | Company | Catalog Number | Comments |
| 2,15-Dimethylhexahelicene | N/A | N/A | Prepared according to reference 5b,c in the main text. |
| Corannulene | N/A | N/A | Prepared according to reference 5a in the main text. |
| N-Bromosuccinimide (NBS) | Sigma Aldrich | B8.125-5 | ReagentPlus®, 99%. Recrystallized from hot water. |
| Benzoyl peroxide (BPO) | Sigma Aldrich | B-2030 | ~70% (titration). 30% water as stabilizer. |
| Sodium azide | Sigma Aldrich | S2002 | ReagentPlus®, ≥99.5%. |
| Gold (III) chloride Hydrate | Sigma Aldrich | 50778 | puriss. p.a., ACS reagent, ≥49% Au basis. |
| Ethynyltrimethylsilane | Sigma Aldrich | 218170 | 98%. |
| [PdCl2(dppf)] | N/A | N/A | Prepared according to reference 6 in the main text. |
| CuI | N/A | N/A | Prepared according to reference 7 in the main text. |
| KF | Sigma Aldrich | 307599 | 99%, spray-dried. |
| (+)-Sodium L-ascorbate | Fluka | 11140 | BioXtra, ≥99.0% (NT). |
| Copper(II) Sulphate 5-hydrate | Panreac | 131270 | for analysis. |
| Carbon tetrachloride (CCl4) | Fluka | 87030 | for IR spectroscopy, ≥99.9%. |
| Dichloromethane (DCM) | Fisher Scientific | D/1852/25 | Analytical reagent grade. Distilled prior to use. |
| Hexane | Fisher Scientific | H/0355/25 | Analytical reagent grade. Distilled prior to use. |
| Ethyl acetate | Scharlau | AC0145025S | Reagent grade. Distilled prior to use. |
| Tetrahydrofuran (THF) | Fisher Scientific | T/0701/25 | Analytical reagent grade. Distilled prior to use. |
| 1,2-Dichloroethane (DCE) | Sigma Aldrich | D6,156-3 | ReagentPlus®, 99%. |
| Methanol (MeOH) | VWR | 20847.36 | AnalaR NORMAPUR. |
| Triethyl amine (NEt3) | Sigma Aldrich | T0886 | ≥99%. |
| Silica gel | Acros | 360050010 | Particle size 40-60mm. |
| Sand - low iron | Fisher Scientific | S/0360/63 | General purpose grade. |
| TLC Silica gel 60 F254 | Merck | 1.05554.0001 | |
| Monowave 300 (Microwave reactor) | Anton Para | ||
| Sonicator | Grupo Selecta | 3000513 | 6 Litres. |
References
- Scott, L. T., Hashemi, M. M., Bratcher, M. S. Corannulene bowl-to-bowl inversion is rapid at room temperature. J. Am. Chem. Soc. 114 (5), 1920-1921 (1992).
- Sygula, A., et al. Bowl stacking in curved polynuclear aromatic hydrocarbons: crystal and molecular structure of cyclopentacorannulene. J. Chem. Soc., Chem. Commun. (22), 2571-2572 (1994).
- Nuckolls, C., et al. Circular Dichroism and UV−Visible Absorption Spectra of the Langmuir−Blodgett Films of an Aggregating Helicene. J. Am. Chem. Soc. 120 (34), 8656-8660 (1998).
- Beljonne, D., et al. Electro-optic response of chiral helicenes in isotropic media. J. Chem. Phys. 108 (4), 1301-1304 (1998).
- Treboux, G., Lapstun, P., Wu, Z., Silverbrook, K. Electronic conductance of helicenes. Chem. Phys. Lett. 301 (5-6), 493-497 (1999).
- Katz, T. J. Syntheses of Functionalized and Aggregating Helical Conjugated Molecules. Angew. Chem., Int. Ed. 39 (11), 1921-1923 (2000).
- Furche, F., et al. Circular Dichroism of Helicenes Investigated by Time-Dependent Density Functional Theory. J. Am. Chem. Soc. 122 (8), 1717-1724 (2000).
- Urbano, A. Recent Developments in the Synthesis of Helicene-Like Molecules. Angew. Chem., Int. Ed. 42 (34), 3986-3989 (2003).
- Botek, E., Champane, B., Turki, M., André, J. M. Theoretical study of the second-order nonlinear optical properties of [N]helicenes and [N]phenylenes. J. Chem. Phys. 120 (4), 2042-2048 (2004).
- Lovas, F. J., et al. Interstellar Chemistry: A Strategy for Detecting Polycyclic Aromatic Hydrocarbons in Space. J. Am. Chem. Soc. 127 (12), 4345-4349 (2005).
- Wigglesworth, T. J., Sud, D., Norsten, T. B., Lekhi, V. S., Branda, N. R. Chiral Discrimination in Photochromic Helicenes. J. Am. Chem. Soc. 127 (20), 7272-7273 (2005).
- Wu, Y. -. T., Siegel, J. S. Aromatic Molecular-Bowl Hydrocarbons: Synthetic Derivatives, Their Structures, and Physical Properties. Chem. Rev. 106 (12), 4843-4867 (2006).
- Tsefrikas, V. M., Scott, L. T. Geodesic Polyarenes by Flash Vacuum Pyrolysis. Chem. Rev. 106 (12), 4868-4884 (2006).
- Wu, Y. -. T., Hayama, T., Baldrige, K. K., Linden, A., Siegel, J. S. Synthesis of Fluoranthenes and Indenocorannulenes: Elucidation of Chiral Stereoisomers on the Basis of Static Molecular Bowls. J. Am. Chem. Soc. 128 (21), 6870-6884 (2006).
- Wu, Y. -. T., Siegel, J. S. Synthesis, structures, and physical properties of aromatic molecular-bowl hydrocarbons. Top. Curr. Chem. 349, 63-120 (2014).
- Pérez, E. M., Martìn, N. Curves ahead: molecular receptors for fullerenes based on concave-convex complementarity. Chem. Soc. Rev. 37 (8), 1512-1519 (2008).
- Tashiro, K., Aida, T. Metalloporphyrin hosts for supramolecular chemistry of fullerenes. Chem. Soc. Rev. 36 (2), 189-197 (2007).
- Kawase, T. Ball- Bowl- and Belt-Shaped Conjugated Systems and Their Complexing Abilities: Exploration of the Concave−Convex π−π Interaction. Chem. Rev. 106 (12), 5250-5273 (2006).
- Martin, N., Pérez, E. M. Molecular tweezers for fullerenes. Pure Appl. Chem. 82 (3), 523-533 (2010).
- Hoppe, H., Sariciftci, N. S. Morphology of polymer/fullerene bulk heterojunction solar cells. J. Mater. Chem. 16 (1), 45-61 (2006).
- Kim, S. N., Rusling, J. F., Papadimitrakopoulos, F. Carbon Nanotubes for Electronic and Electrochemical Detection of Biomolecules. Adv. Mater. 19 (20), 3214-3228 (2007).
- Dennler, G., Scharber, M. C., Brabec, C. J. Polymer-Fullerene Bulk-Heterojunction Solar Cells. Adv. Mater. 21 (13), 1323-1338 (2009).
- Helgesen, M., Søndergaard, R., Krebs, F. C. Advanced materials and processes for polymer solar cell devices. J. Mater. Chem. 20 (1), 36-60 (2010).
- Brabec, C. J., et al. Polymer-Fullerene Bulk-Heterojunction Solar Cells. Adv. Mater. 22 (34), 3839-3856 (2010).
- Delgado, J. L., Bouit, P. -. A., Filippone, S., Herranz, M. A., Martìn, N. Organic photovoltaics: a chemical approach. Chem. Commun. 46 (27), 4853-4865 (2010).
- Schnorr, J. M., Swager, T. M. Emerging Applications of Carbon Nanotubes. Chem. Mater. 23 (3), 646-657 (2011).
- Wang, C., Takei, K., Takahashi, T., Javey, A. Carbon nanotube electronics - moving forward. Chem. Soc. Rev. 42 (7), 2592-2609 (2013).
- Park, S., Vosguerichian, M., Bao, Z. A review of fabrication and applications of carbon nanotube film-based flexible electronics. Nanoscale. 5, 1727-1752 (2013).
- Mizyed, S., et al. Embracing C60 with Multiarmed Geodesic Partners. J. Am. Chem. Soc. 123 (51), 12770-12774 (2001).
- Sygula, A., Sygula, R., Ellern, A., Rabideau, P. W. Novel Twin Corannulene: Synthesis and Crystal Structure Determination of a Dicorannulenobarrelene Dicarboxylate. Org. Lett. 5 (15), 2595-2597 (2003).
- Georghiou, P. E., Tran, A. H., Mizyed, S., Bancu, M., Scott, L. T. Concave Polyarenes with Sulfide-Linked Flaps and Tentacles: New Electron-Rich Hosts for Fullerenes. J. Org. Chem. 70 (16), 6158-6163 (2005).
- Sygula, A., Fronczek, F. R., Sygula, R., Rabideau, P. W., Olmstead, M. M. A Double Concave Hydrocarbon Buckycatcher. J. Am. Chem. Soc. 129 (13), 3842-3843 (2007).
- Yanney, M., Sygula, A. Tridental molecular clip with corannulene pincers: is three better than two?. Tetrahedron Lett. 54 (21), 2604-2607 (2013).
- Stuparu, M. C. Rationally Designed Polymer Hosts of Fullerene. Angew. Chem., Int. Ed. 52 (30), 7786-7790 (2013).
- Le, V. H., Yanney, M., McGuire, M., Sygula, A., Lewis, E. A. Thermodynamics of Host-Guest Interactions between Fullerenes and a Buckycatcher. J. Phys. Chem. B. 118 (41), 11956-11964 (2014).
- Álvarez, C. M. Enhanced association for C70 over C60 with a metal complex with corannulene derivate ligands. Dalton Trans. 43 (42), 15693-15696 (2014).
- Álvarez, C. M. Assembling Nonplanar Polyaromatic Units by Click Chemistry. Study of Multicorannulene Systems as Host for Fullerenes. Org. Lett. 17 (11), 2578-2581 (2015).
- Yanney, M., Fronczek, F. R., Sygula, A. A 2:1 Receptor/C60 Complex as a Nanosized Universal Joint. Angew. Chem. Int. Ed. 54 (38), 11153-11156 (2015).
- Kuragama, P. L. A., Fronczek, F. R., Sygula, A. Bis-corannulene Receptors for Fullerenes Based on Klärner's Tethers: Reaching the Affinity Limits. Org. Lett. 17 (21), (2015).
- George, S. R. D., Frith, T. D. H., Thomas, D. S., Harper, J. B. Putting corannulene in its place. Reactivity studies comparing corannulene with other aromatic hydrocarbons. Org. Biomol. Chem. 13 (34), 9035-9041 (2015).
- Shen, Y., Chen, C. -. F. Helicenes: Synthesis and Applications. Chem. Rev. 112 (3), 1463-1535 (2012).
- Crassous, J., Saleh, N., Shen, C. Helicene-based transition metal complexes: synthesis, properties and applications. Chem. Sci. 5 (10), 3680-3694 (2014).
- Nakamura, K., Furumi, S., Takeuchi, M., Shibuya, T., Tanaka, K. Enantioselective Synthesis and Enhanced Circularly Polarized Luminescence of S-Shaped Double Azahelicenes. J. Am. Chem. Soc. 136 (15), 5555-5558 (2014).
- Schweinfurth, D., Zalibera, M., Kathan, M., Shen, C., Mazzolini, M., Trapp, N., Crassous, J., Gescheidt, G., Diederich, F. Helicene Quinones: Redox-Triggered Chiroptical Switching and Chiral Recognition of the Semiquinone Radical Anion Lithium Salt by Electron Nuclear Double Resonance Spectroscopy. J. Am. Chem. Soc. 136 (37), 13045-13052 (2014).
- Šámal, M., Chercheja, S., Rybáček, J., Vacek Chocholoušová, J., Vacek, J., Bednárová, L., Šaman, D., Stará, I. G., Starý, I. An Ultimate Stereocontrol in Asymmetric Synthesis of Optically Pure Fully Aromatic Helicenes. J. Am. Chem. Soc. 137 (26), 8469-8474 (2015).
- Siegel, J. S., Butterfield, A. M., Gilomen, B. Kilogram scale production of corannulene. Organic Process Research & Development. 16 (4), 664-676 (2012).
- Mallory, F. B., Mallory, C. W. Photocyclization of stilbenes and related molecules. Organic Reactions. , (1984).
- Sato, M., et al. Convenient synthesis and reduction properties of [7] circulene. J. Chem. Soc., Perkin Trans. 2. (9), 1909-1914 (1998).
- Anderson, G. K., Lin, M. Bis(Benzonitrile)dichloro complexes of palladium and platinum. Inorg Synth. 28, 60-63 (1990).
- Nataro, C., Fosbenner, S. M. Synthesis and Characterization of Transition-Metal Complexes Containing 1,1'-Bis(diphenylphosphino)ferrocene. J. Chem. Ed. 86 (12), 1412-1415 (2009).
- Kauffman, G. B., Pinnell, R. P. Copper (I) Iodide. Inorg. Synth. 6, 3-6 (1960).
- Sonogashira, K. J. Development of Pd-Cu catalyzed cross-coupling of terminal acetylenes with sp2-carbon halides. Organomet. Chem. 653 (1-2), 46-49 (2002).
- Chinchilla, R., Nájera, C. Recent advances in Sonogashira reactions. Chem. Soc. Rev. 40 (10), 5084-5121 (2011).
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click Chemistry: Diverse Chemical Function from a Few Good Reactions. Angew. Chem. Int. Ed. 40 (11), 2004-2021 (2001).
- Spiteri, C., Moses, J. E. Copper-Catalyzed Azide-Alkyne Cycloaddition: Regioselective Synthesis of 1,4,5-Trisubstituted 1,2,3-Triazoles. Angew. Chem. Int. Ed. 49 (1), 31-33 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved