A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הכנת Hexahelicene Corannulene הפונקציונלית ידי נחושת (I) -catalyzed אלקין-יזיד cycloaddition יחידות Nonplanar Polyaromatic
In This Article
Summary
כאן, אנו מציגים פרוטוקול לסנתז תרכובת אורגנית מורכבת מורכבת משלוש יחידות polyaromatic nonplanar, התאספה בקלות עם תשואות סבירות.
Abstract
The main purpose of this video is to show 6 reaction steps of a convergent synthesis and prepare a complex molecule containing up to three nonplanar polyaromatic units, which are two corannulene moieties and a racemic hexahelicene linking them. The compound described in this work is a good host for fullerenes. Several common organic reactions, such as free-radical reactions, C-C coupling or click chemistry, are employed demonstrating the versatility of functionalization that this compound can accept. All of these reactions work for planar aromatic molecules. With subtle modifications, it is possible to achieve similar results for nonplanar polyaromatic compounds.
Introduction
בשל הגיאומטריה, corannulene ו helicenes המיוחד שלהם, הם מולקולות אשר יכול לאמץ מבנה רחוק planarity להצמיח תכונות מעניינות. 1-15 בשנים האחרונות, החיפוש של קולטנים מולקולריים עבור ננו-צינוריות פחמן פולרנים הוא אזור פעיל מאוד 16-19 בשל, בעיקר, ליישומים הפוטנציאל שלהם כחומריים עבור תאים סולריים אורגניים, טרנזיסטורים, חיישנים והתקנים אחרים. 20-28 המשלה המעולה בכושר בין corannulene וכן פולרן משך את תשומת לבם של כמה חוקרים במטרה בעיצוב קולטנים מולקולריים מסוגלים הקמת עמותה מולקולרית ידי כוחות פיזור. 29-39
הכימיה של תרכובות polyaromatic nonplanar הנ"ל דומה לזה שתואר עבור מולקולות מישוריים לחלוטין, אבל זה לפעמים קשה למצוא תנאים מתאימים כדי להשיג selectivities רצוי ותשואות. 40 בעבודה זו אנו מציגים את הסינתזה של מולקולה (7) בעל שלוש יחידות polyaromatic בעוד כמה צעדים עם תשואות טובות על ידי יישום טכניקות קלות טיפוסיות המופיעות בכל מעבדת מחקר. המולקולה היא בעלת חשיבות רבה, כי זה יכול לאמץ קונפורמציה מלקחיים דמויים להקים אינטראקציות טובות עם C 60 37 בתמיסה; והוא עשוי לפתוח קו מחקר כמו קולטן פוטנציאל הודות פולרנים כיראליות גבוה כדי והמקשר helicene, שהינה מולקולה כיראליות בשל קיומו של ציר stereogenic. 41-45 עם זאת, רק helicene רצמית ישמש בעבודה זו.
בשלב זה, המגבלה היחידה לסנתז קולטנים אלה היא ההכנה helicenes ו corannulenes, שכן הם אינם זמינים מסחריים. אבל, על פי שיטות חדשות שפורסם במקומות אחר 46-48 הם ניתן להשיג בכמויות מתאימות בתוך פרק זמן קצר זמן סביר.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. Functionalization של 2,15-Dimethylhexahelicene
- Dibromination של 2,15-dimethylhexahelicene
- לשקול 0.356 גרם (1.0 מילימול) של 2,15-dimethylhexahelicene, 0.374 גרם (2.1 מילימול) של -bromosuccinimide N recrystallized טרי (NBS) ו -24 מ"ג (0.07 מילימול) של חמצן בנזואיל (BPO) (70% wt עם 30% של מים כמו מייצב). מניחים את כל מוצקים בבקבוק 100 מ"ל Schlenk עם בר ומערבבים מגנטי. שים תחת אווירת חנקן על ידי שלושה מחזורים של פינוי גז ואחריו מילוי עם גז אינרטי בקו Schlenk.
- להוסיף 21 מ"ל של פחמן טטרא (CCL 4). הפתרון דג ידי אותו הפינוי / מילוי תהליך (שלב 1.1.1) עם ערבוב נמרץ ובזהירות כדי למנוע אובדן מסיבי של ממס.
- מחממים על ריפלוקס (77 ° C) את התערובת עם אמבט שמנים למשך 4 שעות. בדוק את התגובה על ידי 1 H-גרעין תהודה מגנטית (NMR). כפילויות בין 3.7 עמודים לדקה ו -4.0 ppm shoULD להופיע. הם מצביעים על נוכחות של diastereotopic -CH 2 - קבוצות (איור 1).
- בסיום, לקרר את התערובת בטמפרטורת החדר להסיר את הממס תחת ואקום. הגדרת מלכודת מלאה בחנקן נוזלי, כדי למנוע זיהום משאבה.
- Redissolve הגס ב 30 מ"ל של dichloromethane (DCM), להעביר בבקבוק מסביב לתחתית ומערבבים עם 4 גרם של ג'ל סיליקה (בדרך כלל להוסיף 5-לקפל את משקל גולמי). לרכז את התערובת מאיידת סיבובית.
- בינתיים, למלא טור (אורך כ -20 ס"מ עובי של 4.5 ס"מ) עם ג'ל SiO 2 מעורב בעבר עם אצטט הקסאן / אתיל (95: 5) כשלב ניידים. מוסיפים את תערובת לחלק העליון של העמודה ולאחר מכן להוסיף שכבה של חול (2 ס"מ).
- יוצקים בזהירות בשלב סלולרי חדש ולבצע את כרומטוגרפיה על ידי איסוף שברים במבחנות (בדרך כלל 20 מ"ל לכל צינור ו -4 מ"ל ליד elution התוצר הצפוי). בדוק שברים על ידי כרומטוגרפיה בשכבה דקה(TLC) עם אותו בשלב ניידים (הקסאן / אתיל אצטט 95: 5) ותמונה תחת אור UV. המוצר הצפוי (4 ב) צריך elute ב גורם שייר (RF) של 0.35 כשמן צהוב לאחר שילוב כולם רצו שברים והסירו את ממס המאייד הסיבובי. 334 מ"ג צריכה להתקבל (תשואה 65%).
הערה: כל טכניקות Schlenk, השימוש באמבט שמן הגדרות כרומטוגרפיה חימום ועמודה ישמשו נרחב ביותר של פרוטוקולים, אז מעכשיו, הם לא יהיו מכוסים בפירוט ורק כמה הערות, בעת הצורך, יהיה להינתן.
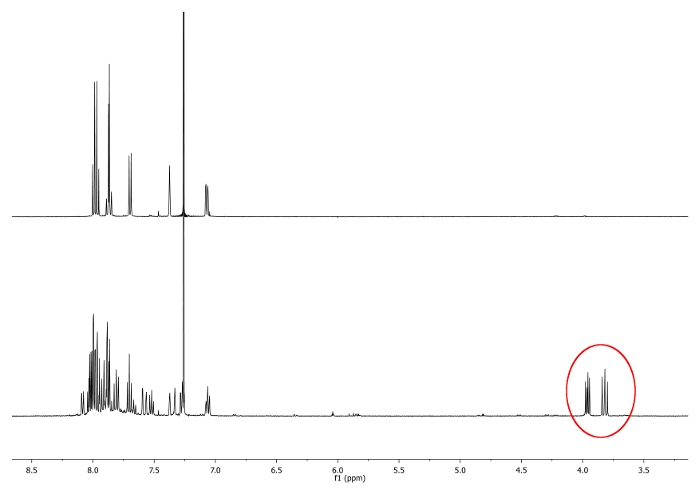
. איור 1 ספקטרום H-NMR 1 (500 מגה-הרץ, CDCl 3) של 2,15 -dimethylhelicene (למעלה) ו aliquot נלקח לאחר שעת 2 אותות חדשים, מתאים -CH 2 -.., מתוארים עיגול אדום (למטה) אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- סינתזה של 2,15-bis (azidomethyl) hexahelicene
- לשקול 0.103 גרם (0.2 מילימול) של 2,15-bis (bromomethyl) hexahelicene ו 0.390 גרם (6 mmol) של אזיד הנתרן. מניחים שני מוצקים בבקבוק 50 מ"ל Schlenk מצויד בר מגנטי ולשים תחת אווירה חנקן.
- מערבבים 8.6 מ"ל של tetrahydrofuran (THF) עם 5.2 מ"ל מים (O H 2) ויוצקים את התערובת של ממיסים לתוך הבקבוק Schlenk. דגת הפתרון.
- מחממים על ריפלוקס (65 מעלות צלזיוס) במשך 3 שעות. בדוק את התגובה על ידי 1 H-NMR. 2 -CH - אותות צריכים לעבור 3.75 ppm (איור 2).
- לאחר מכן, cool מטה את התערובת לטמפרטורת החדר ולהסיר THF תחת ואקום. לדלל עם 50 מ"ל של H 2 O.
- מעבירים את התערובת משפך separatory ולחלץ שלוש פעמים עם 40 מ"ל של DCM. מערבב את כל השלבים האורגניים ולשטוף עם H 2 O הטהור (50 מיליליטר).
- לטהר את גולמי ידי כרומטוגרפיה טור על ג'ל סיליקה באמצעות אצטט הקסאן / אתיל (85:15) כשלב הנייד לתת שמן צהוב ב Rf = 0.38 מתאים 2,15-bis (azomethyl) hexahelicene (5 ב '). 70 מ"ג צריכה להתקבל (תשואה 80%).
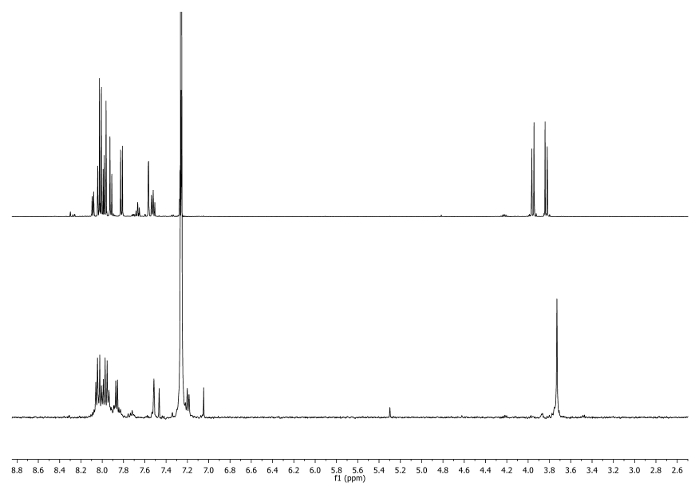
איור 2: 1 ספקטרום H-NMR (500 מגה-הרץ, CDCl 3) של 4 ב (למעלה) ו aliquot נלקח לאחר 3 שעות(למטה). יש לשים לב לשינויים באזור אליפטיות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
2. Functionalization של Corannulene
- Monobromination של Corannulene
- לשקול 0.125 גרם (0.5 מילימול) של corannulene, 89 מ"ג (0.5 מילימול) של NBS recrystallized טרי ו -17 מ"ג של זהב (III) מימה כלוריד.
- מניח את כל התרכובות לתוך 10 מיליליטר בקבוקון תוכננו במיוחד עבור תגובות מיקרוגל מאובזרות עם בר מגנטי ולאחר מכן הכניסו לתוך אווירת חנקן בעזרת בקבוק 2-צוואר מסביב לתחתית.
- הוסף 7 מ"ל של 1,2-dichloroethane (DCE) דגה הפתרון.
- Sonicate את התערובת במשך 2 דקות כדי לפזר חלקיקי מלח זהב.
- חום בתוך כור המיקרוגל ב 100 מעלות צלזיוס למשך 2 שעות.
- בסיום, להעביר את הגולמי בבקבוק מסביב לתחתית ולהסיר ממס על ידי Rotarאידוי y.
- לטהר את גולמי ידי כרומטוגרפיה טור על ג'ל SiO 2 באמצעות הקסאן כשלב נייד.
הערה: Bromocorannulene (4 א) מתקבלת צהוב מוצקה Rf = 0.38. 99 מ"ג צריכה להתקבל (תשואה 60%). Corannulene unreacted (3a) ניתן לשחזר ומאוחסנים לשימושים נוספים. זה מופיע Rf = 0.29.
- Sonogashira עגינת Bomocorannulene ו Ethynyltrimethylsilane
- לשקול 49 מ"ג (0.15 מילימול) של bromocorannulene, 11 מ"ג (0.015 mmol) של [PdCl 2 (dppf)] 49,50 (dppf להיות 1,1-'bis (diphenylphsphino) ferrocene, 3 מ"ג (0.015 mmol) של קואי. 51
- מניחים את כל מוצקים בבקבוק 50 מ"ל Schlenk יחד עם בר מגנטי ולשים תחת אווירה חנקן.
- להוסיף 5.0 מ"ל של triethylamine (נטו 3) ודגה את התערובת.
- לבסוף, להוסיף 104 μl (0.75 מילימול) של ethynyltrimethylsilane.
- Sonicate את התערובת במשך 2 דקות כדילפזר חלקיקי מלח מתכת.
- מחממים על 85 מעלות צלזיוס במשך 24 שעות עם sonication תקופתי כדי למנוע בתצהיר של מלחי מתכות.
הערה: צבע התערובת הפך לשחור בקרוב, המעיד על הנוכחות של פלדיום (0). - להתקרר לטמפרטורת החדר להתאדות נטו 3 בריק.
- Redissolve ב 20 מ"ל של DCM ולטהר ידי כרומטוגרפיה טור על ג'ל סיליקה משחררי עם הקסאן לתת מוצק צהוב Rf = 0.28 המתאים 5a. 41 מ"ג צריכה להתקבל (תשואה 78%).
הערה: אם הגולמי מסונן דרך כרית Celite ב DCM, דוגמא טהורה סבירה עשויה להיות מושגת, עם זאת נגזרת phosphine לא יוסר לחלוטין.
- הכנת Ethynylcorannulene ידי TMS Deprotection
- לשקול 35 מ"ג (0.10 מילימול) של 5a ו -7.3 מ"ג (0.125 mmol) של פלואוריד אשלגן נטול מים.
- מניחים את כל מוצקים בבקבוק 50 מ"ל Schlenk מצויד בר מגנטיד לשים תחת אווירת חנקן.
- מערבבים 4 מ"ל של THF ו -4 מ"ל של מתנול (MeOH) ויוצקים את התערובת לתוך הבקבוק Schlenk. דגה ביסודיות.
- אפשר להגיב בטמפרטורת החדר, שמור את הבקבוק מן האור על ידי כיסוי אותו עם סרט אטום. בדוק את התגובה על ידי 1 H-NMR ע"י הסתכלות 3.48 ppm. אות המתאימה -CCH חייב לצוץ (איור 3).
הערה: למרות תרכובת זו נושאת אלקין מסוף כי הוא מגיב מתפרק בקלות, לא מצאנו בעיות במהלך למעלה העבודה המתוארת להלן. זה בוצע תחת אור טבעי. - בסיום, להסיר THF תחת ואקום לדלל עם 10 מ"ל מים, מעבירים הכל כדי משפך separatory.
- חלץ עם DCM (3 x 15 מיליליטר), לשלב את כל השלבים האורגניים בבקבוק מסביב לתחתית ולהתרכז ב מאייד סיבובי בטמפרטורת חדר ולבסוף לקבל מקביל מוצק צהוב 6 א. 27 מ"ג צריכה להתקבל (תשואה כמוני).
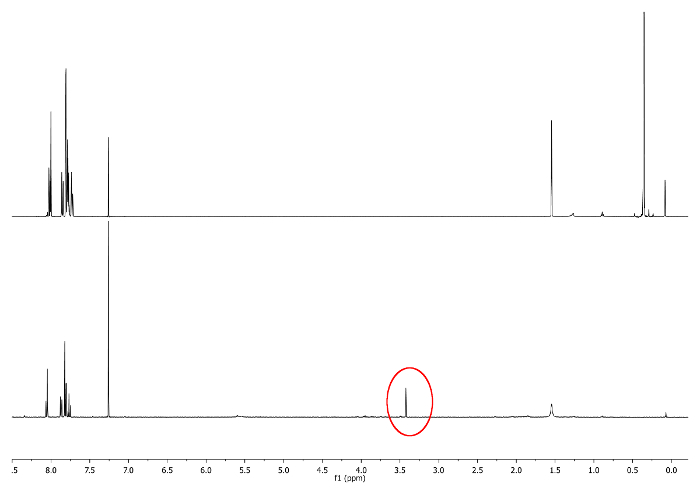
איור 3:.. 1 ספקטרום H-NMR (500 מגה-הרץ, CDCl 3) של 5 א (למעלה) ו -6 מספר (למטה) גופיה -CCH מתואר עיגול אדום נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
3. הרכבה סופית על ידי כימיה לחץ
- לשקול 15.3 מ"ג (0.035 mmol) של 5b, 20.0 מ"ג (0.073 mmol) של 6 א, 1.4 מ"ג (0.007 mmol) של מלח נתרן חומצה אסקורבית, 1.7 מ"ג (0.007 mmol) של CuSO 4 · 5H 2 O.
- מניחים את כל מוצקים בבקבוק 50 מ"ל Schlenk מצויד בבוקרבר ולשים agnetic תחת אווירת חנקן.
- מערבבים 3 מ"ל של H 2 O ו -12 מ"ל של THF ויוצקים את התערובת לתוך הבקבוק Schlenk. דגת הפתרון ביסודיות.
- מחמם על 65 מעלות צלזיוס במשך 3 ימים עם קבל מחובר לחלק העליון של הבקבוק ולבדוק מעת לעת התגובה לשלוט בטמפרטורה, ערבוב ונפח ממס. בדוק את התגובה על ידי 1 H-NMR. האות ב 3.48 ppm צריכה להיעלם ולהיות עבר 7.27 ppm המציין את צריכת corannulene ethynyl וקיומה של יחידת triazole (איור 4).
- בסיום, להסיר THF תחת ואקום לדלל עם 20 מ"ל מים, העברת תערובת משפך separatory.
- חלץ עם DCM (3 x 20 מיליליטר), לשלב את כל השלבים האורגניים בבקבוק מסביב לתחתית ולהתרכז ב מאייד סיבובי.
- לטהר את גולמי ידי כרומטוגרפיה טור על SiO 2 ג 'ל משחררי עם הקסאן / אתיל אצטט (1: 1) לתת מוצק צהוב חיוור ב Rf = 0.59המקביל ל 7. 27 מ"ג צריכה להתקבל (תשואה 75%).
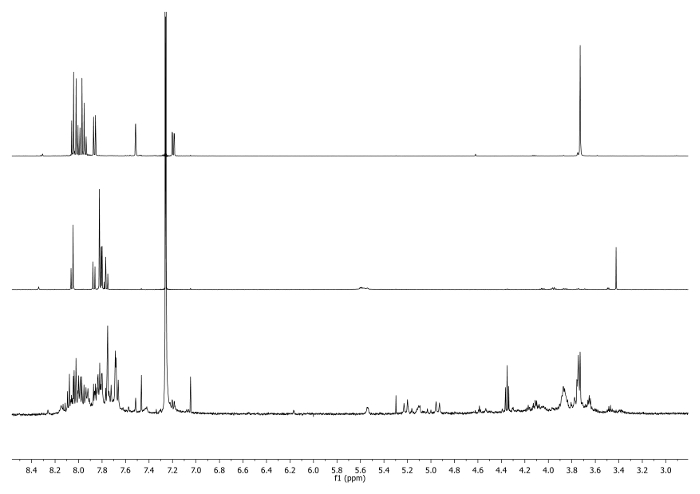
איור 4: 1 ספקטרום H-NMR (500 מגה-הרץ, CDCl 3) 5 ב (למעלה), 6 (באמצע) ו aliquot שצולמו לאחר 2 ימים (למטה) הערה היעלמות אות -CCH ב גולמי.. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Access restricted. Please log in or start a trial to view this content.
תוצאות
Corannulene (3 א) ו- 2,15-dimethylhexahelicene (3 ב) יכול להיות מוכן בא שיטות קיימות 46-48 בצורה פשוטה עם תשואות טובות מאוד (איור 5). שניהם חולקים מולקולה נפוצה, 2,7-dimethylnaphthalene, כחומר המוצא, והוליד מתבדרים סינתזה מתכנסת של המ...
Access restricted. Please log in or start a trial to view this content.
Discussion
מתחם סופי 7 הוכן לאחר 6 צעדים מקדימים polyaromatic nonplanar 3 א ו 3 ב עם עד בינוני תשואות טובות מאוד בכל תגובה. המגבלה העיקרית שנצפתה מסלול זה היה bromination של תרכובות שניהם polyaromatic nonplanar. עם זאת, במקרה של מתחם 4 א, בסכו...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was funded by the Spanish Ministerio de Economìa y Competitividad (CTQ 2013-41067-P). H.B. acknowledge with thanks a MEC-FPI grant.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 2,15-Dimethylhexahelicene | N/A | N/A | Prepared according to reference 5b,c in the main text. |
| Corannulene | N/A | N/A | Prepared according to reference 5a in the main text. |
| N-Bromosuccinimide (NBS) | Sigma Aldrich | B8.125-5 | ReagentPlus®, 99%. Recrystallized from hot water. |
| Benzoyl peroxide (BPO) | Sigma Aldrich | B-2030 | ~70% (titration). 30% water as stabilizer. |
| Sodium azide | Sigma Aldrich | S2002 | ReagentPlus®, ≥99.5%. |
| Gold(III) chloride Hydrate | Sigma Aldrich | 50778 | puriss. p.a., ACS reagent, ≥49% Au basis. |
| Ethynyltrimethylsilane | Sigma Aldrich | 218170 | 98% |
| [PdCl2(dppf)] | N/A | N/A | Prepared according to reference 6 in the main text. |
| CuI | N/A | N/A | Prepared according to reference 7 in the main text. |
| KF | Sigma Aldrich | 307599 | 99%, spray-dried. |
| (+)-Sodium L-ascorbate | Fluka | 11140 | BioXtra, ≥99.0% (NT). |
| Copper(II) Sulphate 5-hydrate | Panreac | 131270 | For analysis. |
| Carbon tetrachloride (CCl4) | Fluka | 87030 | For IR spectroscopy, ≥99.9%. |
| Dichloromethane (DCM) | Fisher Scientific | D/1852/25 | Analytical reagent grade. Distilled prior to use. |
| Hexane | Fisher Scientific | H/0355/25 | Analytical reagent grade. Distilled prior to use. |
| Ethyl acetate | Scharlau | AC0145025S | Reagent grade. Distilled prior to use. |
| Tetrahydrofuran (THF) | Fisher Scientific | T/0701/25 | Analytical reagent grade. Distilled prior to use. |
| 1,2-Dichloroethane (DCE) | Sigma Aldrich | D6,156-3 | ReagentPlus®, 99%. |
| Methanol (MeOH) | VWR | 20847.36 | AnalaR NORMAPUR. |
| Triethyl amine (NEt3) | Sigma Aldrich | T0886 | ≥99% |
| Silica gel | Acros | 360050010 | Particle size 40-60 mm. |
| Sand - low iron | Fisher Scientific | S/0360/63 | General purpose grade. |
| TLC Silica gel 60 F254 | Merck | 1.05554.0001 | |
| Monowave 300 (Microwave reactor) | Anton Para | ||
| Sonicator | Grupo Selecta | 3000513 | 6 Litres. |
References
- Scott, L. T., Hashemi, M. M., Bratcher, M. S. Corannulene bowl-to-bowl inversion is rapid at room temperature. J. Am. Chem. Soc. 114 (5), 1920-1921 (1992).
- Sygula, A., et al. Bowl stacking in curved polynuclear aromatic hydrocarbons: crystal and molecular structure of cyclopentacorannulene. J. Chem. Soc., Chem. Commun. (22), 2571-2572 (1994).
- Nuckolls, C., et al. Circular Dichroism and UV−Visible Absorption Spectra of the Langmuir−Blodgett Films of an Aggregating Helicene. J. Am. Chem. Soc. 120 (34), 8656-8660 (1998).
- Beljonne, D., et al. Electro-optic response of chiral helicenes in isotropic media. J. Chem. Phys. 108 (4), 1301-1304 (1998).
- Treboux, G., Lapstun, P., Wu, Z., Silverbrook, K. Electronic conductance of helicenes. Chem. Phys. Lett. 301 (5-6), 493-497 (1999).
- Katz, T. J. Syntheses of Functionalized and Aggregating Helical Conjugated Molecules. Angew. Chem., Int. Ed. 39 (11), 1921-1923 (2000).
- Furche, F., et al. Circular Dichroism of Helicenes Investigated by Time-Dependent Density Functional Theory. J. Am. Chem. Soc. 122 (8), 1717-1724 (2000).
- Urbano, A. Recent Developments in the Synthesis of Helicene-Like Molecules. Angew. Chem., Int. Ed. 42 (34), 3986-3989 (2003).
- Botek, E., Champane, B., Turki, M., André, J. M. Theoretical study of the second-order nonlinear optical properties of [N]helicenes and [N]phenylenes. J. Chem. Phys. 120 (4), 2042-2048 (2004).
- Lovas, F. J., et al. Interstellar Chemistry: A Strategy for Detecting Polycyclic Aromatic Hydrocarbons in Space. J. Am. Chem. Soc. 127 (12), 4345-4349 (2005).
- Wigglesworth, T. J., Sud, D., Norsten, T. B., Lekhi, V. S., Branda, N. R. Chiral Discrimination in Photochromic Helicenes. J. Am. Chem. Soc. 127 (20), 7272-7273 (2005).
- Wu, Y. -T., Siegel, J. S. Aromatic Molecular-Bowl Hydrocarbons: Synthetic Derivatives, Their Structures, and Physical Properties. Chem. Rev. 106 (12), 4843-4867 (2006).
- Tsefrikas, V. M., Scott, L. T. Geodesic Polyarenes by Flash Vacuum Pyrolysis. Chem. Rev. 106 (12), 4868-4884 (2006).
- Wu, Y. -T., Hayama, T., Baldrige, K. K., Linden, A., Siegel, J. S. Synthesis of Fluoranthenes and Indenocorannulenes: Elucidation of Chiral Stereoisomers on the Basis of Static Molecular Bowls. J. Am. Chem. Soc. 128 (21), 6870-6884 (2006).
- Wu, Y. -T., Siegel, J. S. Synthesis, structures, and physical properties of aromatic molecular-bowl hydrocarbons. Top. Curr. Chem. 349, 63-120 (2014).
- Pérez, E. M., Martìn, N. Curves ahead: molecular receptors for fullerenes based on concave-convex complementarity. Chem. Soc. Rev. 37 (8), 1512-1519 (2008).
- Tashiro, K., Aida, T. Metalloporphyrin hosts for supramolecular chemistry of fullerenes. Chem. Soc. Rev. 36 (2), 189-197 (2007).
- Kawase, T. Ball- Bowl- and Belt-Shaped Conjugated Systems and Their Complexing Abilities: Exploration of the Concave−Convex π−π Interaction. Chem. Rev. 106 (12), 5250-5273 (2006).
- Martin, N., Pérez, E. M. Molecular tweezers for fullerenes. Pure Appl. Chem. 82 (3), 523-533 (2010).
- Hoppe, H., Sariciftci, N. S. Morphology of polymer/fullerene bulk heterojunction solar cells. J. Mater. Chem. 16 (1), 45-61 (2006).
- Kim, S. N., Rusling, J. F., Papadimitrakopoulos, F. Carbon Nanotubes for Electronic and Electrochemical Detection of Biomolecules. Adv. Mater. 19 (20), 3214-3228 (2007).
- Dennler, G., Scharber, M. C., Brabec, C. J. Polymer-Fullerene Bulk-Heterojunction Solar Cells. Adv. Mater. 21 (13), 1323-1338 (2009).
- Helgesen, M., Søndergaard, R., Krebs, F. C. Advanced materials and processes for polymer solar cell devices. J. Mater. Chem. 20 (1), 36-60 (2010).
- Brabec, C. J., et al. Polymer-Fullerene Bulk-Heterojunction Solar Cells. Adv. Mater. 22 (34), 3839-3856 (2010).
- Delgado, J. L., Bouit, P. -A., Filippone, S., Herranz, M. A., Martìn, N. Organic photovoltaics: a chemical approach. Chem. Commun. 46 (27), 4853-4865 (2010).
- Schnorr, J. M., Swager, T. M. Emerging Applications of Carbon Nanotubes. Chem. Mater. 23 (3), 646-657 (2011).
- Wang, C., Takei, K., Takahashi, T., Javey, A. Carbon nanotube electronics - moving forward. Chem. Soc. Rev. 42 (7), 2592-2609 (2013).
- Park, S., Vosguerichian, M., Bao, Z. A review of fabrication and applications of carbon nanotube film-based flexible electronics. Nanoscale. 5, 1727-1752 (2013).
- Mizyed, S., et al. Embracing C60 with Multiarmed Geodesic Partners. J. Am. Chem. Soc. 123 (51), 12770-12774 (2001).
- Sygula, A., Sygula, R., Ellern, A., Rabideau, P. W. Novel Twin Corannulene: Synthesis and Crystal Structure Determination of a Dicorannulenobarrelene Dicarboxylate. Org. Lett. 5 (15), 2595-2597 (2003).
- Georghiou, P. E., Tran, A. H., Mizyed, S., Bancu, M., Scott, L. T. Concave Polyarenes with Sulfide-Linked Flaps and Tentacles: New Electron-Rich Hosts for Fullerenes. J. Org. Chem. 70 (16), 6158-6163 (2005).
- Sygula, A., Fronczek, F. R., Sygula, R., Rabideau, P. W., Olmstead, M. M. A Double Concave Hydrocarbon Buckycatcher. J. Am. Chem. Soc. 129 (13), 3842-3843 (2007).
- Yanney, M., Sygula, A. Tridental molecular clip with corannulene pincers: is three better than two? Tetrahedron Lett. 54 (21), 2604-2607 (2013).
- Stuparu, M. C. Rationally Designed Polymer Hosts of Fullerene. Angew. Chem., Int. Ed. 52 (30), 7786-7790 (2013).
- Le, V. H., Yanney, M., McGuire, M., Sygula, A., Lewis, E. A. Thermodynamics of Host-Guest Interactions between Fullerenes and a Buckycatcher. J. Phys. Chem. B. 118 (41), 11956-11964 (2014).
- Álvarez, C. M. Enhanced association for C70 over C60 with a metal complex with corannulene derivate ligands. Dalton Trans. 43 (42), 15693-15696 (2014).
- Álvarez, C. M. Assembling Nonplanar Polyaromatic Units by Click Chemistry. Study of Multicorannulene Systems as Host for Fullerenes. Org. Lett. 17 (11), 2578-2581 (2015).
- Yanney, M., Fronczek, F. R., Sygula, A. A 2:1 Receptor/C60 Complex as a Nanosized Universal Joint. Angew. Chem. Int. Ed. 54 (38), 11153-11156 (2015).
- Kuragama, P. L. A., Fronczek, F. R., Sygula, A. Bis-corannulene Receptors for Fullerenes Based on Klärner's Tethers: Reaching the Affinity Limits. Org. Lett. 17 (21), (2015).
- George, S. R. D., Frith, T. D. H., Thomas, D. S., Harper, J. B. Putting corannulene in its place. Reactivity studies comparing corannulene with other aromatic hydrocarbons. Org. Biomol. Chem. 13 (34), 9035-9041 (2015).
- Shen, Y., Chen, C. -F. Helicenes: Synthesis and Applications. Chem. Rev. 112 (3), 1463-1535 (2012).
- Crassous, J., Saleh, N., Shen, C. Helicene-based transition metal complexes: synthesis, properties and applications. Chem. Sci. 5 (10), 3680-3694 (2014).
- Nakamura, K., Furumi, S., Takeuchi, M., Shibuya, T., Tanaka, K. Enantioselective Synthesis and Enhanced Circularly Polarized Luminescence of S-Shaped Double Azahelicenes. J. Am. Chem. Soc. 136 (15), 5555-5558 (2014).
- Schweinfurth, D., Zalibera, M., Kathan, M., Shen, C., Mazzolini, M., Trapp, N., Crassous, J., Gescheidt, G., Diederich, F. Helicene Quinones: Redox-Triggered Chiroptical Switching and Chiral Recognition of the Semiquinone Radical Anion Lithium Salt by Electron Nuclear Double Resonance Spectroscopy. J. Am. Chem. Soc. 136 (37), 13045-13052 (2014).
- Šámal, M., Chercheja, S., Rybáček, J., Vacek Chocholoušová, J., Vacek, J., Bednárová, L., Šaman, D., Stará, I. G., Starý, I. An Ultimate Stereocontrol in Asymmetric Synthesis of Optically Pure Fully Aromatic Helicenes. J. Am. Chem. Soc. 137 (26), 8469-8474 (2015).
- Siegel, J. S., Butterfield, A. M., Gilomen, B. Kilogram scale production of corannulene. Organic Process Research & Development. 16 (4), 664-676 (2012).
- Mallory, F. B., Mallory, C. W. Photocyclization of stilbenes and related molecules. Organic Reactions. , Wiley: Hoboken, NJ. (1984).
- Sato, M., et al. Convenient synthesis and reduction properties of [7] circulene. J. Chem. Soc., Perkin Trans. 2. (9), 1909-1914 (1998).
- Anderson, G. K., Lin, M. Bis(Benzonitrile)dichloro complexes of palladium and platinum. Inorg Synth. 28, 60-63 (1990).
- Nataro, C., Fosbenner, S. M. Synthesis and Characterization of Transition-Metal Complexes Containing 1,1'-Bis(diphenylphosphino)ferrocene. J. Chem. Ed. 86 (12), 1412-1415 (2009).
- Kauffman, G. B., Pinnell, R. P. Copper (I) Iodide. Inorg. Synth. 6, 3-6 (1960).
- Sonogashira, K. J. Development of Pd-Cu catalyzed cross-coupling of terminal acetylenes with sp2-carbon halides. Organomet. Chem. 653 (1-2), 46-49 (2002).
- Chinchilla, R., Nájera, C. Recent advances in Sonogashira reactions. Chem. Soc. Rev. 40 (10), 5084-5121 (2011).
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click Chemistry: Diverse Chemical Function from a Few Good Reactions. Angew. Chem. Int. Ed. 40 (11), 2004-2021 (2001).
- Spiteri, C., Moses, J. E. Copper-Catalyzed Azide-Alkyne Cycloaddition: Regioselective Synthesis of 1,4,5-Trisubstituted 1,2,3-Triazoles. Angew. Chem. Int. Ed. 49 (1), 31-33 (2010).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved