É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Preparação de um Hexahelicene Corannulene-funcionalizado por cobre (I) catalisada por cicloadição alcino azida de unidades não planar aromáticos policíclicos
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para sintetizar um composto orgânico complexo composto de três unidades poliaromáticos não planas, montadas facilmente com rendimentos razoáveis.
Resumo
The main purpose of this video is to show 6 reaction steps of a convergent synthesis and prepare a complex molecule containing up to three nonplanar polyaromatic units, which are two corannulene moieties and a racemic hexahelicene linking them. The compound described in this work is a good host for fullerenes. Several common organic reactions, such as free-radical reactions, C-C coupling or click chemistry, are employed demonstrating the versatility of functionalization that this compound can accept. All of these reactions work for planar aromatic molecules. With subtle modifications, it is possible to achieve similar results for nonplanar polyaromatic compounds.
Introdução
Devido à sua geometria especial, corannulene e helicenes são moléculas que podem adoptar uma estrutura longe de planaridade e dão origem a propriedades interessantes. 1-15 Nos últimos anos, a pesquisa de receptores moleculares de nanotubos de carbono e fulerenos é uma área muito activa 16-19, devido, principalmente, às suas potenciais aplicações como materiais para células solares orgânicas, transistores, sensores e outros dispositivos. 20-28 a excelente complementaridade em forma entre corannulene e um fulereno têm atraído a atenção de vários pesquisadores, com o objetivo de projetar receptores moleculares capazes de estabelecer associação supramolecular pelas forças de dispersão. 29-39
A química dos compostos poliaromáticos não planares acima mencionados é semelhante ao descrito para moléculas totalmente planas, mas às vezes é difícil encontrar condições adequadas para a realização selectividades e os rendimentos desejados. 40 Neste trabalho apresentamos a síntese de uma molécula (7) que tem três unidades poliaromáticos em poucos passos com bons rendimentos através da aplicação de técnicas simples e típicos encontrados em cada laboratório de pesquisa. A molécula é de grande importância porque pode adotar uma conformação tipo tenaz para estabelecer boas interações com C 60 37 em solução; e que pode abrir uma linha de pesquisa como um receptor potencial para maiores fulerenos quirais graças ao ligante helicene, que é uma molécula quiral, devido à existência de um eixo estereogénico. 41-45 No entanto, apenas helicene racémica será usado neste trabalho.
Neste ponto, a única limitação para sintetizar estes receptores é a preparação de helicenes corannulenes e, uma vez que não estão disponíveis comercialmente. Mas, de acordo com novos métodos publicados em outras posições 46-48 que pode ser obtido em quantidades adequadas num curto período de tempo razoável.
Protocolo
1. A funcionalização de 2,15-Dimethylhexahelicene
- Dibromination de 2,15-dimethylhexahelicene
- Pesar 0,356 g (1,0 mmol) de 2,15-dimethylhexahelicene, 0,374 g (2,1 mmol) de bromo-succinimida recristalizado recém-N (NBS) e 24 mg (0,07 mmol) de peróxido de benzoilo (BPO) (70% em peso com 30% de água como estabilizador). Coloque todos os sólidos num balão de Schlenk de 100 mL com uma barra de agitação magnética. Coloque sob atmosfera de azoto por três ciclos de evacuação de gás seguido de preenchimento de gás inerte na linha de Schlenk.
- Adicionar 21 ml de tetracloreto de carbono (CCI4). Desgaseificar a solução por o mesmo evacuação / reenchimento processo (passo 1.1.1) com agitação vigorosa e cuidadosamente a fim de evitar a perda de massa de solvente.
- Aquece-se ao refluxo (77 ° C) a mistura com um banho de óleo durante 4 horas. Verifique a reacção por ressonância magnética nuclear de 1H (RMN). Doublets entre 3,7 ppm e 4,0 ppm shoaparecem uld. Eles indicam a presença de diastereotópico -CH 2 - grupos (Figura 1).
- Uma vez terminado, a mistura arrefecer até à temperatura ambiente e remover o solvente sob vácuo. Criar uma armadilha preenchido com nitrogênio líquido para evitar a contaminação da bomba.
- Redissolve-se o produto bruto em 30 ml de diclorometano (DCM), transferir para um balão de fundo redondo e misturar com 4 g de gel de sílica (tipicamente adicionar 5 vezes o peso bruto). Concentra-se a mistura num evaporador rotativo.
- Neste meio tempo, encher uma coluna (comprimento cerca de 20 cm e uma espessura de 4,5 cm) com SiO2 gel misturado previamente com hexano / acetato de etilo (95: 5) como fase móvel. Adicionar a mistura ao topo da coluna e, em seguida, adicionar uma camada de areia (2 cm).
- Com cuidado, despeje na nova fase móvel e realizar a cromatografia através da recolha de fracções em tubos de ensaio (normalmente 20 ml por tubo e 4 ml perto da eluição produto esperado). Verificar fracções por cromatografia em camada fina(TLC) com a mesma fase móvel (hexano / acetato de etilo 95: 5) e uma imagem com luz UV. O produto pretendido (4b) deve eluir com um factor de retenção (Rf) de 0,35, como um óleo amarelo após a combinação de todas as fracções e queria remover-se o solvente no evaporador rotativo. 334 mg devem ser obtidos (rendimento de 65%).
NOTA: Todas as técnicas de Schlenk, o uso de um banho de óleo para as configurações de cromatografia de aquecimento e colunas serão amplamente utilizados na maioria dos protocolos, por isso a partir de agora, eles não serão cobertos em detalhes e apenas alguns comentários, quando necessário, seja dado.
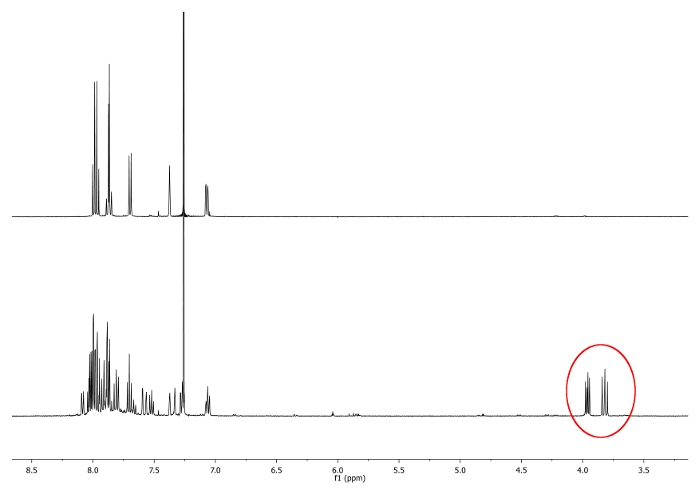
. Figura 1 1 H-RMN Os espectros (500 MHz, CDCl 3) de 2,15 -dimethylhelicene (parte superior) e uma alíquota tomada após 2 horas Novos sinais, correspondente a -CH 2 -.., são retratados em um círculo vermelho (inferior) Por favor clique aqui para ver uma versão maior desta figura.
- Síntese de 2,15-bis (azidometil) hexahelicene
- Pesar 0,103 g (0,2 mmol) de 2,15-bis (bromometil) hexahelicene e 0,390 g (6 mmol) de azida de sódio. Coloque ambos os sólidos em um frasco de 50 ml Schlenk equipado com barra magnética e colocado sob atmosfera de azoto.
- Misturar 8,6 ml de tetra-hidrofurano (THF) com 5,2 ml de água (H2O) e verter a mistura de solventes para o balão de Schlenk. Desgaseificar a solução.
- Aquece-se ao refluxo (65 ° C) durante 3 h. Verifique a reacção por 1H-RMN. -CH 2 - sinais deve mudar para 3,75 ppm (Figura 2).
- Depois, cool para baixo a mistura até à temperatura ambiente e remover o THF sob vácuo. Dilui-se com 50 ml de H 2 O.
- Transferir a mistura para uma ampola de decantação e extrai-se três vezes com 40 ml de DCM. Combinar todas as fases orgânicas e lava-se com puro H2O (50 ml).
- Purifica-se o produto em bruto por cromatografia em coluna sobre gel de sílica usando hexano / acetato de etilo (85:15) como fase móvel para dar um óleo amarelo, a Rf = 0,38 correspondente a 2,15-bis (azomethyl) hexahelicene (5b). 70 mg deve ser obtidos (rendimento de 80%).
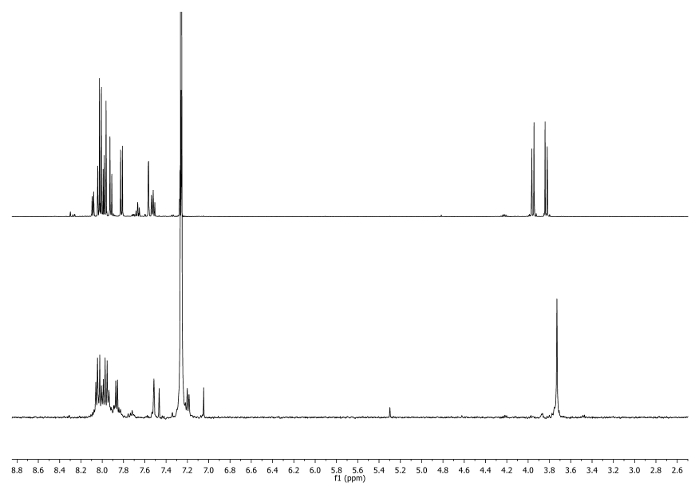
Figura 2: 1 H-RMN Os espectros (500 MHz, CDCl3) de 4 b (em cima) e uma alíquota tomada depois de 3 h(parte inferior). Observe as mudanças na região alifático. Por favor clique aqui para ver uma versão maior desta figura.
2. A funcionalização da Corannulene
- Monobromination de Corannulene
- Pesar 0,125 g (0,5 mmol) de corannulene, 89 mg (0,5 mmol) de NBS recentemente recristalizado e 17 mg de ouro (III) hidrato de cloreto.
- Coloque todos os compostos em um frasco de 10 ml especialmente concebidos para reacções de microondas equipado com uma barra magnética e, em seguida, colocado em atmosfera de azoto, com a ajuda de um balão de fundo redondo com duas tubuladuras.
- Adicionar 7 ml de 1,2-dicloroetano (DCE) e desgaseificar a solução.
- Sonicar a mistura durante 2 minutos para dispersar as partículas de sal de ouro.
- O calor no interior do reactor de micro-ondas a 100 ° C durante 2 h.
- Quando terminou, transferir o produto em bruto para um balão de fundo redondo e remover o solvente por rotarY evaporação.
- Purifica-se o produto em bruto por cromatografia em coluna sobre gel de SiO2, utilizando hexano como fase móvel.
NOTA: Bromocorannulene (4a) é obtido na forma de um sólido de cor amarela, a Rf = 0,38. 99 mg deve ser obtidos (rendimento de 60%). Corannulene que não reagiu (3a) pode ser recuperado e armazenado para outras utilizações. Ele aparece a um Rf = 0,29.
- Acoplamento de Sonogashira de Bomocorannulene e etiniltrimetilsilano
- Pesar 49 mg (0,15 mmol) de bromocorannulene, 11 mg (0,015 mmol) de [PdCl2 (dppf)] 49,50 (dppf sendo 1,1-'bis (diphenylphsphino) ferroceno, 3 mg (0,015 mmol) de Cul. 51
- Coloque todos os sólidos num num frasco Schlenk de 50 ml junto com uma barra magnética e colocar sob atmosfera de azoto.
- Adicionar 5,0 ml de trietilamina (NEt3) e desgaseificar a mistura.
- Finalmente, adicionar 104 ul (0,75 mmol) de etiniltrimetilsilano.
- Sonicar a mistura durante 2 min adispersar partículas de sal de metal.
- Aquece-se a 85 ° C durante 24 h com ultra-sons periódica para evitar a deposição de sais metálicos.
NOTA: A mistura tornou-se de cor para preto em breve, indicando a presença de paládio (0). - Arrefecer até à temperatura ambiente e evapora-se NEt 3 em vácuo.
- Redissolve-se em 20 ml de DCM e purifica-se por cromatografia em coluna sobre gel de sílica eluindo com hexano para dar um sólido de cor amarela, a Rf = 0,28 correspondente a 5a. 41 mg deve ser obtidos (rendimento de 78%).
NOTA: Se o produto em bruto é filtrado através de uma almofada de Celite em DCM, pode ser obtida uma amostra pura razoável, contudo derivados de fosfina não são removidos totalmente.
- Preparação de Ethynylcorannulene por desprotecção TMS
- Pesar 35 mg (0,10 mmol) de 5-A e 7,3 mg (0,125 mmol) de fluoreto de potássio anidro.
- Coloque todos os sólidos num balão de Schlenk de 50 ml equipado com uma barra magnética de umd colocado sob atmosfera de azoto.
- Mistura-se 4 ml de THF e 4 ml de metanol (MeOH) e derramar a mistura para dentro do balão de Schlenk. Degas completamente.
- Deixar reagir à temperatura ambiente, mantem o balão ao abrigo da luz, cobrindo-o com uma película opaca. Verifique a reacção por 1H-RMN, olhando para 3,48 ppm. Um sinal correspondente a -CCH deve surgir (Figura 3).
NOTA: Embora este composto tem uma alcino terminal que é reativo e decompõe facilmente, não encontramos problemas durante o trabalho de descrito abaixo. Foi realizado sob luz natural. - Uma vez terminado, remover o THF sob vácuo e dilui-se com 10 ml de água, transferindo tudo para um funil de separação.
- Extrai-se com DCM (3 x 15 mL), combinam todas as fases orgânicas, num balão de fundo redondo e concentra-se num evaporador rotativo à temperatura ambiente para finalmente obter um sólido amarelo correspondente a 6a. 27 mg deve ser obtidos (rendimento quantitativo).
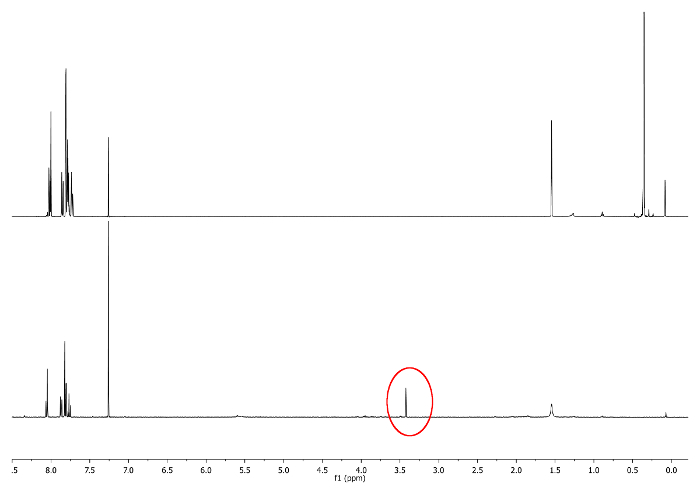
Figura 3:.. 1 H-NMR espectro (500 MHz, CDCl3) de 5-A (superior) e 6-A (baixo) singlet -CCH é retratado em um círculo vermelho Por favor clique aqui para ver uma versão maior desta figura.
3. Montagem Final por Click Química
- Pesar 15,3 mg (0,035 mmol) de 5-B, 20,0 mg (0,073 mmol) de 6a, 1,4 mg (0,007 mmol) de sal de sódio de ácido ascórbico, 1,7 mg (0,007 mmol) de CuSO 4 5H 2 O. ·
- Coloque todos os sólidos num balão de Schlenk de 50 ml equipado com AMbar agnetic e colocado sob atmosfera de azoto.
- Misturar 3 ml de H2O e 12 ml de THF e derramar a mistura para dentro do balão de Schlenk. Desgaseificar a solução completamente.
- Aquece-se a 65 ° C durante 3 dias, com um condensador ligado ao topo do frasco e verificar periodicamente a reacção para controlar a temperatura, agitação e o volume de solvente. Verifique a reacção por 1H-RMN. O sinal a 3,48 ppm deve desaparecer e ser desviado para 7,27 ppm indicando o consumo de corannulene etinilo e a existência da unidade triazole (Figura 4).
- Quando terminado, remover o THF sob vácuo e dilui-se com 20 ml de água, transferindo a mistura para um funil de separação.
- Extrai-se com DCM (3 x 20 mL), combinam todas as fases orgânicas, num balão de fundo redondo e concentra-se num evaporador rotativo.
- Purifica-se o produto em bruto por cromatografia em coluna sobre gel de SiO 2 eluindo-se com hexano / acetato de etilo (1: 1) para dar um sólido amarelo pálido, a Rf = 0,59correspondente a 7. 27 mg deve ser obtidos (rendimento de 75%).
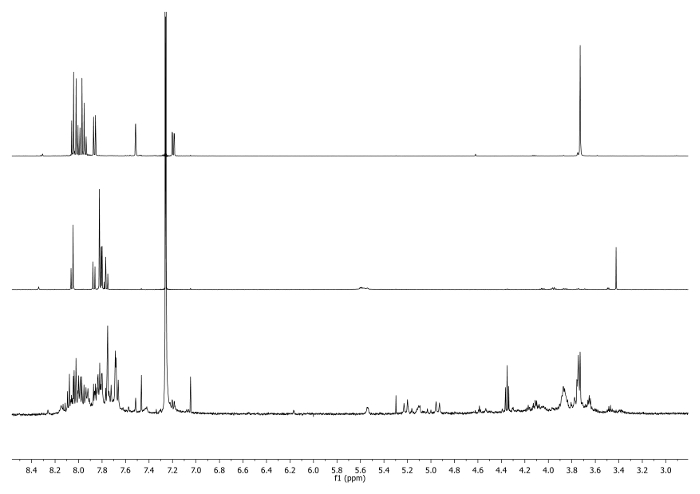
Figura 4: 1 H-RMN Os espectros (500 MHz, CDCl3) de 5 b (parte superior), 6 um (meio) e uma alíquota tomada depois de 2 dias (inferior) Nota o desaparecimento do sinal a -CCH em bruto.. Por favor clique aqui para ver uma versão maior desta figura.
Resultados
Corannulene (3-A) e 2,15-dimethylhexahelicene (3 b) pode ser preparado seguindo os métodos actuais 46-48 de uma forma simples com muito bons rendimentos (Figura 5). Ambos compartilham uma molécula comum, 2,7-dimetilnaftaleno, como o material de partida, dando origem a um divergente de síntese convergente da molécula final.
<...
Discussão
O composto final 7 foi preparado após 6 passos a partir de precursores poliaromáticos não planares e um 3 3 b com moderada a muito bons rendimentos de cada reacção. A principal limitação observada nesta via foi a bromação de ambos os compostos poliaromáticos não planas. No entanto, no caso de um composto 4, uma quantidade importante de corannulene livre pode ser recuperada para outras utiliza...
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was funded by the Spanish Ministerio de Economìa y Competitividad (CTQ 2013-41067-P). H.B. acknowledge with thanks a MEC-FPI grant.
Materiais
| Name | Company | Catalog Number | Comments |
| 2,15-Dimethylhexahelicene | N/A | N/A | Prepared according to reference 5b,c in the main text. |
| Corannulene | N/A | N/A | Prepared according to reference 5a in the main text. |
| N-Bromosuccinimide (NBS) | Sigma Aldrich | B8.125-5 | ReagentPlus®, 99%. Recrystallized from hot water. |
| Benzoyl peroxide (BPO) | Sigma Aldrich | B-2030 | ~70% (titration). 30% water as stabilizer. |
| Sodium azide | Sigma Aldrich | S2002 | ReagentPlus®, ≥99.5%. |
| Gold (III) chloride Hydrate | Sigma Aldrich | 50778 | puriss. p.a., ACS reagent, ≥49% Au basis. |
| Ethynyltrimethylsilane | Sigma Aldrich | 218170 | 98%. |
| [PdCl2(dppf)] | N/A | N/A | Prepared according to reference 6 in the main text. |
| CuI | N/A | N/A | Prepared according to reference 7 in the main text. |
| KF | Sigma Aldrich | 307599 | 99%, spray-dried. |
| (+)-Sodium L-ascorbate | Fluka | 11140 | BioXtra, ≥99.0% (NT). |
| Copper(II) Sulphate 5-hydrate | Panreac | 131270 | for analysis. |
| Carbon tetrachloride (CCl4) | Fluka | 87030 | for IR spectroscopy, ≥99.9%. |
| Dichloromethane (DCM) | Fisher Scientific | D/1852/25 | Analytical reagent grade. Distilled prior to use. |
| Hexane | Fisher Scientific | H/0355/25 | Analytical reagent grade. Distilled prior to use. |
| Ethyl acetate | Scharlau | AC0145025S | Reagent grade. Distilled prior to use. |
| Tetrahydrofuran (THF) | Fisher Scientific | T/0701/25 | Analytical reagent grade. Distilled prior to use. |
| 1,2-Dichloroethane (DCE) | Sigma Aldrich | D6,156-3 | ReagentPlus®, 99%. |
| Methanol (MeOH) | VWR | 20847.36 | AnalaR NORMAPUR. |
| Triethyl amine (NEt3) | Sigma Aldrich | T0886 | ≥99%. |
| Silica gel | Acros | 360050010 | Particle size 40-60mm. |
| Sand - low iron | Fisher Scientific | S/0360/63 | General purpose grade. |
| TLC Silica gel 60 F254 | Merck | 1.05554.0001 | |
| Monowave 300 (Microwave reactor) | Anton Para | ||
| Sonicator | Grupo Selecta | 3000513 | 6 Litres. |
Referências
- Scott, L. T., Hashemi, M. M., Bratcher, M. S. Corannulene bowl-to-bowl inversion is rapid at room temperature. J. Am. Chem. Soc. 114 (5), 1920-1921 (1992).
- Sygula, A., et al. Bowl stacking in curved polynuclear aromatic hydrocarbons: crystal and molecular structure of cyclopentacorannulene. J. Chem. Soc., Chem. Commun. (22), 2571-2572 (1994).
- Nuckolls, C., et al. Circular Dichroism and UV−Visible Absorption Spectra of the Langmuir−Blodgett Films of an Aggregating Helicene. J. Am. Chem. Soc. 120 (34), 8656-8660 (1998).
- Beljonne, D., et al. Electro-optic response of chiral helicenes in isotropic media. J. Chem. Phys. 108 (4), 1301-1304 (1998).
- Treboux, G., Lapstun, P., Wu, Z., Silverbrook, K. Electronic conductance of helicenes. Chem. Phys. Lett. 301 (5-6), 493-497 (1999).
- Katz, T. J. Syntheses of Functionalized and Aggregating Helical Conjugated Molecules. Angew. Chem., Int. Ed. 39 (11), 1921-1923 (2000).
- Furche, F., et al. Circular Dichroism of Helicenes Investigated by Time-Dependent Density Functional Theory. J. Am. Chem. Soc. 122 (8), 1717-1724 (2000).
- Urbano, A. Recent Developments in the Synthesis of Helicene-Like Molecules. Angew. Chem., Int. Ed. 42 (34), 3986-3989 (2003).
- Botek, E., Champane, B., Turki, M., André, J. M. Theoretical study of the second-order nonlinear optical properties of [N]helicenes and [N]phenylenes. J. Chem. Phys. 120 (4), 2042-2048 (2004).
- Lovas, F. J., et al. Interstellar Chemistry: A Strategy for Detecting Polycyclic Aromatic Hydrocarbons in Space. J. Am. Chem. Soc. 127 (12), 4345-4349 (2005).
- Wigglesworth, T. J., Sud, D., Norsten, T. B., Lekhi, V. S., Branda, N. R. Chiral Discrimination in Photochromic Helicenes. J. Am. Chem. Soc. 127 (20), 7272-7273 (2005).
- Wu, Y. -. T., Siegel, J. S. Aromatic Molecular-Bowl Hydrocarbons: Synthetic Derivatives, Their Structures, and Physical Properties. Chem. Rev. 106 (12), 4843-4867 (2006).
- Tsefrikas, V. M., Scott, L. T. Geodesic Polyarenes by Flash Vacuum Pyrolysis. Chem. Rev. 106 (12), 4868-4884 (2006).
- Wu, Y. -. T., Hayama, T., Baldrige, K. K., Linden, A., Siegel, J. S. Synthesis of Fluoranthenes and Indenocorannulenes: Elucidation of Chiral Stereoisomers on the Basis of Static Molecular Bowls. J. Am. Chem. Soc. 128 (21), 6870-6884 (2006).
- Wu, Y. -. T., Siegel, J. S. Synthesis, structures, and physical properties of aromatic molecular-bowl hydrocarbons. Top. Curr. Chem. 349, 63-120 (2014).
- Pérez, E. M., Martìn, N. Curves ahead: molecular receptors for fullerenes based on concave-convex complementarity. Chem. Soc. Rev. 37 (8), 1512-1519 (2008).
- Tashiro, K., Aida, T. Metalloporphyrin hosts for supramolecular chemistry of fullerenes. Chem. Soc. Rev. 36 (2), 189-197 (2007).
- Kawase, T. Ball- Bowl- and Belt-Shaped Conjugated Systems and Their Complexing Abilities: Exploration of the Concave−Convex π−π Interaction. Chem. Rev. 106 (12), 5250-5273 (2006).
- Martin, N., Pérez, E. M. Molecular tweezers for fullerenes. Pure Appl. Chem. 82 (3), 523-533 (2010).
- Hoppe, H., Sariciftci, N. S. Morphology of polymer/fullerene bulk heterojunction solar cells. J. Mater. Chem. 16 (1), 45-61 (2006).
- Kim, S. N., Rusling, J. F., Papadimitrakopoulos, F. Carbon Nanotubes for Electronic and Electrochemical Detection of Biomolecules. Adv. Mater. 19 (20), 3214-3228 (2007).
- Dennler, G., Scharber, M. C., Brabec, C. J. Polymer-Fullerene Bulk-Heterojunction Solar Cells. Adv. Mater. 21 (13), 1323-1338 (2009).
- Helgesen, M., Søndergaard, R., Krebs, F. C. Advanced materials and processes for polymer solar cell devices. J. Mater. Chem. 20 (1), 36-60 (2010).
- Brabec, C. J., et al. Polymer-Fullerene Bulk-Heterojunction Solar Cells. Adv. Mater. 22 (34), 3839-3856 (2010).
- Delgado, J. L., Bouit, P. -. A., Filippone, S., Herranz, M. A., Martìn, N. Organic photovoltaics: a chemical approach. Chem. Commun. 46 (27), 4853-4865 (2010).
- Schnorr, J. M., Swager, T. M. Emerging Applications of Carbon Nanotubes. Chem. Mater. 23 (3), 646-657 (2011).
- Wang, C., Takei, K., Takahashi, T., Javey, A. Carbon nanotube electronics - moving forward. Chem. Soc. Rev. 42 (7), 2592-2609 (2013).
- Park, S., Vosguerichian, M., Bao, Z. A review of fabrication and applications of carbon nanotube film-based flexible electronics. Nanoscale. 5, 1727-1752 (2013).
- Mizyed, S., et al. Embracing C60 with Multiarmed Geodesic Partners. J. Am. Chem. Soc. 123 (51), 12770-12774 (2001).
- Sygula, A., Sygula, R., Ellern, A., Rabideau, P. W. Novel Twin Corannulene: Synthesis and Crystal Structure Determination of a Dicorannulenobarrelene Dicarboxylate. Org. Lett. 5 (15), 2595-2597 (2003).
- Georghiou, P. E., Tran, A. H., Mizyed, S., Bancu, M., Scott, L. T. Concave Polyarenes with Sulfide-Linked Flaps and Tentacles: New Electron-Rich Hosts for Fullerenes. J. Org. Chem. 70 (16), 6158-6163 (2005).
- Sygula, A., Fronczek, F. R., Sygula, R., Rabideau, P. W., Olmstead, M. M. A Double Concave Hydrocarbon Buckycatcher. J. Am. Chem. Soc. 129 (13), 3842-3843 (2007).
- Yanney, M., Sygula, A. Tridental molecular clip with corannulene pincers: is three better than two?. Tetrahedron Lett. 54 (21), 2604-2607 (2013).
- Stuparu, M. C. Rationally Designed Polymer Hosts of Fullerene. Angew. Chem., Int. Ed. 52 (30), 7786-7790 (2013).
- Le, V. H., Yanney, M., McGuire, M., Sygula, A., Lewis, E. A. Thermodynamics of Host-Guest Interactions between Fullerenes and a Buckycatcher. J. Phys. Chem. B. 118 (41), 11956-11964 (2014).
- Álvarez, C. M. Enhanced association for C70 over C60 with a metal complex with corannulene derivate ligands. Dalton Trans. 43 (42), 15693-15696 (2014).
- Álvarez, C. M. Assembling Nonplanar Polyaromatic Units by Click Chemistry. Study of Multicorannulene Systems as Host for Fullerenes. Org. Lett. 17 (11), 2578-2581 (2015).
- Yanney, M., Fronczek, F. R., Sygula, A. A 2:1 Receptor/C60 Complex as a Nanosized Universal Joint. Angew. Chem. Int. Ed. 54 (38), 11153-11156 (2015).
- Kuragama, P. L. A., Fronczek, F. R., Sygula, A. Bis-corannulene Receptors for Fullerenes Based on Klärner's Tethers: Reaching the Affinity Limits. Org. Lett. 17 (21), (2015).
- George, S. R. D., Frith, T. D. H., Thomas, D. S., Harper, J. B. Putting corannulene in its place. Reactivity studies comparing corannulene with other aromatic hydrocarbons. Org. Biomol. Chem. 13 (34), 9035-9041 (2015).
- Shen, Y., Chen, C. -. F. Helicenes: Synthesis and Applications. Chem. Rev. 112 (3), 1463-1535 (2012).
- Crassous, J., Saleh, N., Shen, C. Helicene-based transition metal complexes: synthesis, properties and applications. Chem. Sci. 5 (10), 3680-3694 (2014).
- Nakamura, K., Furumi, S., Takeuchi, M., Shibuya, T., Tanaka, K. Enantioselective Synthesis and Enhanced Circularly Polarized Luminescence of S-Shaped Double Azahelicenes. J. Am. Chem. Soc. 136 (15), 5555-5558 (2014).
- Schweinfurth, D., Zalibera, M., Kathan, M., Shen, C., Mazzolini, M., Trapp, N., Crassous, J., Gescheidt, G., Diederich, F. Helicene Quinones: Redox-Triggered Chiroptical Switching and Chiral Recognition of the Semiquinone Radical Anion Lithium Salt by Electron Nuclear Double Resonance Spectroscopy. J. Am. Chem. Soc. 136 (37), 13045-13052 (2014).
- Šámal, M., Chercheja, S., Rybáček, J., Vacek Chocholoušová, J., Vacek, J., Bednárová, L., Šaman, D., Stará, I. G., Starý, I. An Ultimate Stereocontrol in Asymmetric Synthesis of Optically Pure Fully Aromatic Helicenes. J. Am. Chem. Soc. 137 (26), 8469-8474 (2015).
- Siegel, J. S., Butterfield, A. M., Gilomen, B. Kilogram scale production of corannulene. Organic Process Research & Development. 16 (4), 664-676 (2012).
- Mallory, F. B., Mallory, C. W. Photocyclization of stilbenes and related molecules. Organic Reactions. , (1984).
- Sato, M., et al. Convenient synthesis and reduction properties of [7] circulene. J. Chem. Soc., Perkin Trans. 2. (9), 1909-1914 (1998).
- Anderson, G. K., Lin, M. Bis(Benzonitrile)dichloro complexes of palladium and platinum. Inorg Synth. 28, 60-63 (1990).
- Nataro, C., Fosbenner, S. M. Synthesis and Characterization of Transition-Metal Complexes Containing 1,1'-Bis(diphenylphosphino)ferrocene. J. Chem. Ed. 86 (12), 1412-1415 (2009).
- Kauffman, G. B., Pinnell, R. P. Copper (I) Iodide. Inorg. Synth. 6, 3-6 (1960).
- Sonogashira, K. J. Development of Pd-Cu catalyzed cross-coupling of terminal acetylenes with sp2-carbon halides. Organomet. Chem. 653 (1-2), 46-49 (2002).
- Chinchilla, R., Nájera, C. Recent advances in Sonogashira reactions. Chem. Soc. Rev. 40 (10), 5084-5121 (2011).
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click Chemistry: Diverse Chemical Function from a Few Good Reactions. Angew. Chem. Int. Ed. 40 (11), 2004-2021 (2001).
- Spiteri, C., Moses, J. E. Copper-Catalyzed Azide-Alkyne Cycloaddition: Regioselective Synthesis of 1,4,5-Trisubstituted 1,2,3-Triazoles. Angew. Chem. Int. Ed. 49 (1), 31-33 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados