È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Preparazione di un Hexahelicene corannulene-funzionalizzati da rame (I) -catalyzed Acetilene-azide cicloaddizione di unità non planare policiclici aromatici
In questo articolo
Riepilogo
Qui, vi presentiamo un protocollo per sintetizzare un complesso composto organico composto da tre unità poliaromatici non planari, montato facilmente con rendimenti ragionevoli.
Abstract
The main purpose of this video is to show 6 reaction steps of a convergent synthesis and prepare a complex molecule containing up to three nonplanar polyaromatic units, which are two corannulene moieties and a racemic hexahelicene linking them. The compound described in this work is a good host for fullerenes. Several common organic reactions, such as free-radical reactions, C-C coupling or click chemistry, are employed demonstrating the versatility of functionalization that this compound can accept. All of these reactions work for planar aromatic molecules. With subtle modifications, it is possible to achieve similar results for nonplanar polyaromatic compounds.
Introduzione
Grazie alla loro particolare geometria, corannulene e helicenes sono molecole che possono adottare una struttura lontano dalla planarità e dar luogo a proprietà interessanti. 1-15 Negli ultimi anni, la ricerca dei recettori molecolari per nanotubi di carbonio e fullereni è una zona molto attiva 16-19 a causa, principalmente, alle loro potenziali applicazioni come materiali per le celle organiche solari, transistor, sensori e altri dispositivi. 20-28 l'ottima complementarietà di forma tra il corannulene e un fullerene hanno attirato l'attenzione di numerosi ricercatori, con l'obiettivo di progettare recettori molecolari in grado di stabilire un'associazione supramolecolare da parte delle forze di dispersione. 29-39
La chimica dei composti poliaromatici non planari suddetti è simile a quella descritta per le molecole totalmente planari, ma a volte è difficile trovare condizioni adatte per raggiungere le selettività e le rese desiderati. 40 In questo lavoro presentiamo la sintesi di una molecola (7) avente tre unità poliaromatici in pochi passi con buone rese applicando tecniche semplici e tipiche presenti in ogni laboratorio di ricerca. La molecola è di grande importanza perché può adottare una conformazione tenaglia per stabilire buone interazioni con C 60 37 in soluzione; e può aprire una linea di ricerca come potenziale recettore per maggiori fullereni chirali grazie al linker eliceni, che è una molecola chirale a causa dell'esistenza di un asse stereogenico. 41-45 Tuttavia, solo eliceni racemico saranno utilizzati in questo lavoro.
A questo punto, l'unica limitazione per sintetizzare questi recettori è la preparazione di helicenes e corannulenes, dal momento che non sono disponibili in commercio. Ma, secondo i nuovi metodi pubblicati altrove 46-48 possono essere ottenuti in quantità adatte in un breve periodo di tempo ragionevole.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Funzionalizzazione di 2,15-Dimethylhexahelicene
- Dibromination di 2,15-dimethylhexahelicene
- Pesare 0,356 g (1,0 mmol) di 2,15-dimethylhexahelicene, 0,374 g (2,1 mmoli) di -bromosuccinimide appena ricristallizzato N (NBS) e 24 mg (0,07 mmoli) di perossido di benzoile (BPO) (70% in peso con il 30% di acqua come stabilizzatore). Mettere tutti i solidi in un pallone da 100 ml Schlenk con ancoretta magnetica. Mettere in atmosfera di azoto da tre cicli di evacuazione gas seguita da riempimento con gas inerte nella linea Schlenk.
- Aggiungere 21 ml di tetracloruro di carbonio (CCL 4). Degassare la soluzione dallo stesso evacuazione / processo di riempimento (fase 1.1.1) sotto vigorosa agitazione e con attenzione per evitare perdita massiccia di solvente.
- Calore a riflusso (77 ° C) la miscela con un bagno di olio per 4 ore. Controllare la reazione mediante risonanza magnetica 1 H-nucleare (NMR). Doppietti tra 3,7 ppm e 4,0 ppm shoULD appaiono. Essi indicano la presenza di -CH diastereotopici 2 - gruppi (Figura 1).
- Una volta terminato, raffreddare la miscela a temperatura ambiente e rimuovere il solvente sotto vuoto. Impostare una trappola piena di azoto liquido per evitare la contaminazione della pompa.
- Riprendere il grezzo in 30 ml di diclorometano (DCM), trasferire in un pallone a fondo rotondo e mescolare con 4 g di gel di silice (tipicamente aggiungere 5 volte il peso grezzo). Concentrare la miscela in un evaporatore rotante.
- Nel frattempo, riempire una colonna (lunghezza circa 20 cm ed uno spessore di 4,5 cm) con SiO 2 gel miscelato in precedenza con esano / acetato di etile (95: 5) come fase mobile. Aggiungere la miscela al superiore della colonna e quindi aggiungere uno strato di sabbia (2 cm).
- Versare con cautela nella nuova fase mobile e eseguire la cromatografia attraverso la raccolta di frazioni in provette (in genere 20 ml per provetta e 4 ml vicino l'eluizione del prodotto atteso). Controllare frazioni di cromatografia su strato sottile(TLC) con la stessa fase mobile (esano / acetato di etile 95: 5) e l'immagine sotto luce UV. Il prodotto atteso (4b) dovrebbe eluire con un fattore di ritenzione (Rf) di 0,35 come olio giallo dopo aver combinato tutti frazioni voluto e rimuovendo il solvente in evaporatore rotante. 334 mg dovrebbero essere ottenuti (resa 65%).
NOTA: Tutte le tecniche Schlenk, l'uso di un bagno d'olio per riscaldamento e di colonna impostazioni cromatografiche saranno ampiamente utilizzati nella maggior parte dei protocolli, così da ora in poi, non verrà descritta in dettaglio e solo poche osservazioni, quando necessario, essere dato.
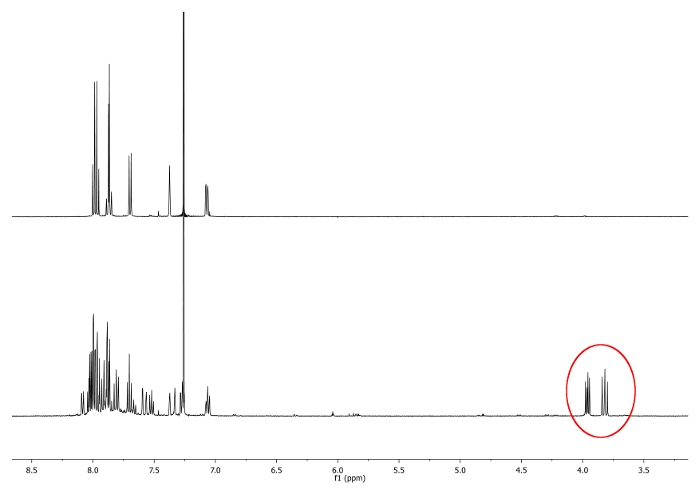
. Figura 1 1 H-NMR (500 MHz, CDCl 3) di 2,15 -dimethylhelicene (in alto) e una aliquota scattata dopo 2 ore nuovi segnali, corrispondenti a -CH 2 -.., sono raffigurati in un cerchio rosso (in basso) Clicca qui per vedere una versione più grande di questa figura.
- Sintesi di 2,15-bis (azidomethyl) hexahelicene
- Pesare 0,103 g (0,2 mmol) di 2,15-bis (bromometil) hexahelicene e 0,390 g (6 mmoli) di sodio azide. Posizionare entrambi i solidi in un matraccio da 50 ml dotato di Schlenk barra magnetica e posto sotto atmosfera di azoto.
- Mescolare 8,6 ml di tetraidrofurano (THF) con 5,2 ml di acqua (H 2 O) e versare la miscela di solventi nel pallone Schlenk. Degassare la soluzione.
- Calore a riflusso (65 ° C) per 3 ore. Controllare la reazione 1 H-NMR. -CH 2 - segnali dovrebbero trasferire al 3,75 ppm (Figura 2).
- In seguito, cool giù la miscela a temperatura ambiente e rimuovere THF sotto vuoto. Diluire con 50 ml di H 2 O.
- Trasferire la miscela in un imbuto separatore ed estrarre tre volte con 40 ml di DCM. Unire tutte le fasi organiche e lavare con puro H 2 O (50 ml).
- Purificare il grezzo mediante cromatografia su colonna su gel di silice usando esano / acetato di etile (85:15) come fase mobile per dare un olio giallo a Rf = 0,38 corrispondente a 2,15-bis (azomethyl) hexahelicene (5b). 70 mg dovrebbe essere ottenuto (resa 80%).
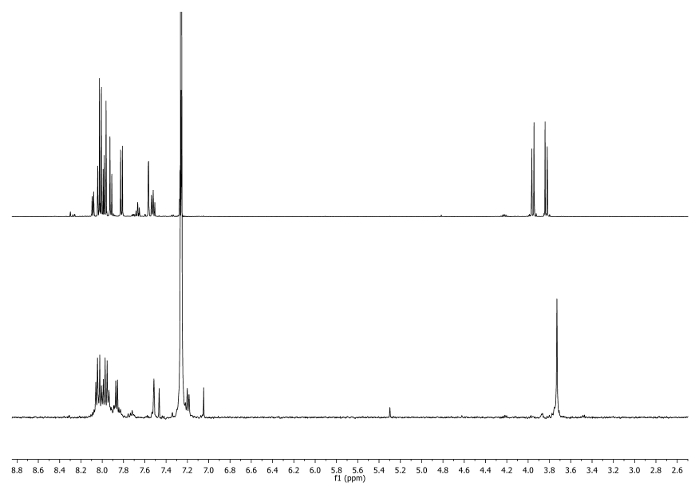
Figura 2: 1 H-NMR (500 MHz, CDCl 3) 4 b (in alto) e un'aliquota presa dopo 3 ore(in basso). Notare i cambiamenti nella regione alifatici. Cliccate qui per vedere una versione più grande di questa figura.
2. Funzionalizzazione di corannulene
- Monobromination di corannulene
- Pesare 0,125 g (0,5 mmoli) di corannulene, 89 mg (0,5 mmol) di appena ricristallizzato NBS e 17 mg di oro (III) cloruro idrato.
- Mettere tutti i composti in un flaconcino da 10 ml appositamente progettati per le reazioni a microonde dotati di una barra magnetica e poi messo in atmosfera di azoto, con l'aiuto di un pallone a 2 colli.
- Aggiungere 7 ml di 1,2-dicloroetano (DCE) e degassare la soluzione.
- Sonicare la miscela per 2 minuti per disperdere particelle di sale d'oro.
- Il calore all'interno del reattore a microonde a 100 ° C per 2 ore.
- Al termine, trasferire il grezzo in un pallone a fondo rotondo e rimuovere il solvente dal rotarevaporazione y.
- Purificare il grezzo mediante cromatografia su colonna su SiO 2 gel usando esano come fase mobile.
NOTA: Bromocorannulene (4a) è ottenuto come solido giallo a Rf = 0.38. 99 mg dovrebbe essere ottenuto (resa 60%). Corannulene non reagito (3a) può essere recuperato e conservato per ulteriori usi. Sembra a Rf = 0,29.
- Sonogashira Accoppiamento di Bomocorannulene e Ethynyltrimethylsilane
- Pesare 49 mg (0,15 mmol) di bromocorannulene, 11 mg (0,015 mmol) di [PdCl 2 (dppf)] 49,50 (dppf essere 1,1-'bis (diphenylphsphino) ferrocene, 3 mg (0,015 mmol) di cui. 51
- Mettere tutti i solidi in un matraccio da 50 ml Schlenk assieme con una barra magnetica e posto sotto atmosfera di azoto.
- Aggiungere 5,0 ml di trietilammina (Net 3) e degassare la miscela.
- Infine, aggiungere 104 ml (0,75 mmol) di ethynyltrimethylsilane.
- Sonicare la miscela per 2 minuti perdisperdere le particelle di sale di metallo.
- Riscaldare a 85 ° C per 24 ore con sonicazione periodica per evitare la deposizione di sali metallici.
NOTA: Il colore della miscela acceso al nero presto, indicando la presenza di palladio (0). - Raffreddare a temperatura ambiente ed evaporare NEt 3 sotto vuoto.
- Riprendere in 20 ml di DCM e purificare mediante cromatografia in colonna su gel di silice eluendo con esano per dare un solido giallo a Rf = 0,28 corrispondente a 5a. 41 mg dovrebbe essere ottenuto (resa 78%).
NOTA: Se il grezzo viene filtrato attraverso un tampone di Celite in DCM, un campione puro ragionevole potrebbe essere ottenuto, comunque derivati fosfinici non vengono rimossi completamente.
- Preparazione di Ethynylcorannulene da TMS deprotezione
- Pesare 35 mg (0,10 mmoli) di 5a e 7,3 mg (0,125 mmoli) di fluoruro di potassio anidro.
- Mettere tutti i solidi in un matraccio da 50 ml Schlenk attrezzato con una barra di magneticad Mettere in atmosfera di azoto.
- Mescolare 4 ml di THF e 4 ml di metanolo (MeOH) e versare il composto nel pallone Schlenk. Degas a fondo.
- Lasciar reagire a temperatura ambiente, Mantenere il matraccio lontano dalla luce coprendolo con una pellicola opaca. Controllare la reazione 1 H-NMR, cercando in 3,48 ppm. Un segnale corrispondente -CCH deve emergere (Figura 3).
NOTA: Anche se questo composto ha una alkyne terminale che è reattivo e si decompone facilmente, abbiamo riscontrato problemi durante il lavoro fino descritto di seguito. È stata effettuata sotto la luce naturale. - Una volta terminato, rimuovere THF sotto vuoto e diluire con 10 ml di acqua, trasferire tutto in un imbuto separatore.
- Estrarre con DCM (3 x 15 ml), combinare tutte le fasi organiche in un pallone a fondo rotondo e concentrato in un evaporatore rotante a temperatura ambiente per ottenere finalmente un solido giallo corrispondente 6a. 27 mg dovrebbe essere ottenuto (resa quantitativa).
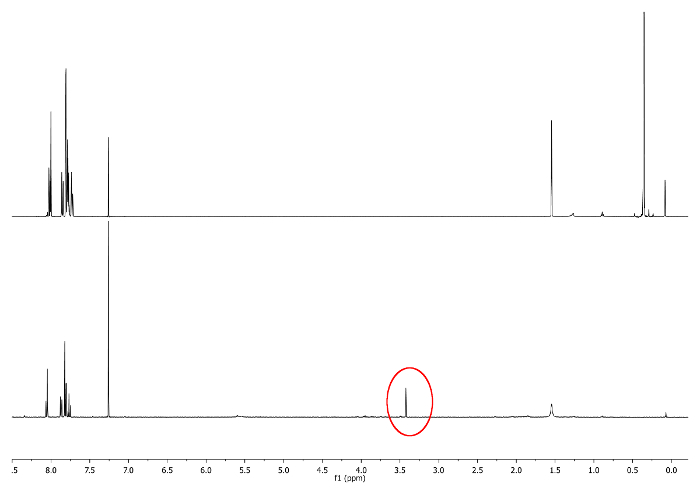
Figura 3:.. 1 H-NMR (500 MHz, CDCl 3) di 5 A (in alto) e 6 bis (basso) singoletto -CCH è raffigurato in un cerchio rosso Clicca qui per vedere una versione più grande di questa figura.
3. Montaggio finale da Click Chimica
- Pesare 15,3 mg (0,035 mmoli) di 5b, 20,0 mg (0,073 mmoli) di 6a, 1,4 mg (0,007 mmoli) di sale sodico dell'acido ascorbico, 1,7 mg (0,007 mmoli) di CuSO 4 · 5H 2 O.
- Mettere tutti i solidi in un matraccio da 50 ml dotato di Schlenk ambar agnetica e messo in atmosfera di azoto.
- Mescolare 3 ml di H 2 O e 12 ml di THF e versare il composto nel pallone Schlenk. Degassare bene la soluzione.
- Riscaldare a 65 ° C per 3 giorni con un condensatore collegato alla sommità del pallone e controllare periodicamente la reazione per controllare la temperatura, agitazione e volume di solvente. Controllare la reazione 1 H-NMR. Il segnale a 3.48 ppm dovrebbe scomparire e essere spostato a 7.27 ppm indicante il consumo di etinil corannulene e l'esistenza del gruppo triazolo (Figura 4).
- Al termine, rimuovere THF sotto vuoto e diluire con 20 ml di acqua, trasferendo la miscela in un imbuto separatore.
- Estrarre con DCM (3 x 20 ml), combinare tutte le fasi organiche in un pallone a fondo rotondo e concentrato in un evaporatore rotante.
- Purificare il grezzo mediante cromatografia su colonna su gel di SiO 2 eluendo con esano / acetato di etile (1: 1) per dare un solido giallo pallido a Rf = 0,59corrispondente al 7. 27 mg dovrebbe essere ottenuto (resa 75%).
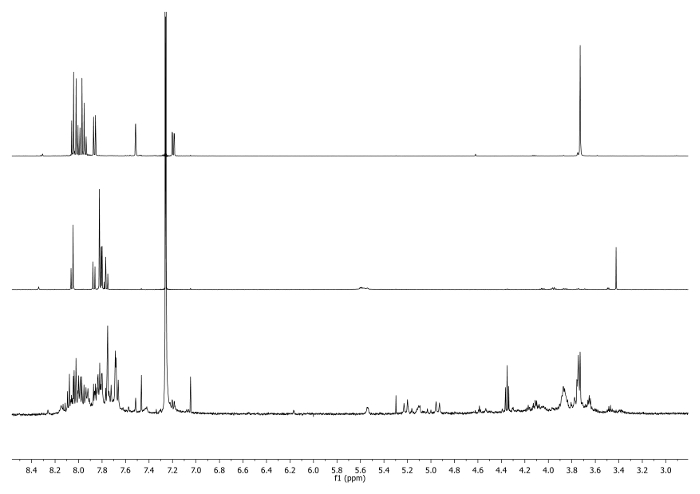
Figura 4: 1 H-NMR (500 MHz, CDCl 3) di 5 B (in alto), 6 bis (al centro) e una aliquota prelevata dopo 2 giorni (in basso) Si noti la scomparsa del segnale di -CCH nel greggio.. Si prega clicca qui per vedere una versione più grande di questa figura.
Access restricted. Please log in or start a trial to view this content.
Risultati
Corannulene (3 a) e 2,15-dimethylhexahelicene (3 b) può essere preparato secondo i metodi attuali 46-48 in modo semplice con ottime rese (Figura 5). Entrambi condividono una molecola comune, 2,7-dimetilnaftalene, come materiale di partenza, dando luogo a una divergente alla sintesi convergente della molecola finale.
Access restricted. Please log in or start a trial to view this content.
Discussione
Composto finale 7 è stato preparato dopo 6 passi da precursori poliaromatici non planari 3 A e 3 B da moderata a molto buone rese in ogni reazione. La limitazione principale osservata in questo percorso è stata la bromurazione di composti poliaromatici non planari. Tuttavia, nel caso del composto 4 bis, una quantità importante di corannulene libero può essere recuperato per altri usi. La sintesi di ...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
This work was funded by the Spanish Ministerio de Economìa y Competitividad (CTQ 2013-41067-P). H.B. acknowledge with thanks a MEC-FPI grant.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 2,15-Dimethylhexahelicene | N/A | N/A | Prepared according to reference 5b,c in the main text. |
| Corannulene | N/A | N/A | Prepared according to reference 5a in the main text. |
| N-Bromosuccinimide (NBS) | Sigma Aldrich | B8.125-5 | ReagentPlus®, 99%. Recrystallized from hot water. |
| Benzoyl peroxide (BPO) | Sigma Aldrich | B-2030 | ~70% (titration). 30% water as stabilizer. |
| Sodium azide | Sigma Aldrich | S2002 | ReagentPlus®, ≥99.5%. |
| Gold(III) chloride Hydrate | Sigma Aldrich | 50778 | puriss. p.a., ACS reagent, ≥49% Au basis. |
| Ethynyltrimethylsilane | Sigma Aldrich | 218170 | 98% |
| [PdCl2(dppf)] | N/A | N/A | Prepared according to reference 6 in the main text. |
| CuI | N/A | N/A | Prepared according to reference 7 in the main text. |
| KF | Sigma Aldrich | 307599 | 99%, spray-dried. |
| (+)-Sodium L-ascorbate | Fluka | 11140 | BioXtra, ≥99.0% (NT). |
| Copper(II) Sulphate 5-hydrate | Panreac | 131270 | For analysis. |
| Carbon tetrachloride (CCl4) | Fluka | 87030 | For IR spectroscopy, ≥99.9%. |
| Dichloromethane (DCM) | Fisher Scientific | D/1852/25 | Analytical reagent grade. Distilled prior to use. |
| Hexane | Fisher Scientific | H/0355/25 | Analytical reagent grade. Distilled prior to use. |
| Ethyl acetate | Scharlau | AC0145025S | Reagent grade. Distilled prior to use. |
| Tetrahydrofuran (THF) | Fisher Scientific | T/0701/25 | Analytical reagent grade. Distilled prior to use. |
| 1,2-Dichloroethane (DCE) | Sigma Aldrich | D6,156-3 | ReagentPlus®, 99%. |
| Methanol (MeOH) | VWR | 20847.36 | AnalaR NORMAPUR. |
| Triethyl amine (NEt3) | Sigma Aldrich | T0886 | ≥99% |
| Silica gel | Acros | 360050010 | Particle size 40-60 mm. |
| Sand - low iron | Fisher Scientific | S/0360/63 | General purpose grade. |
| TLC Silica gel 60 F254 | Merck | 1.05554.0001 | |
| Monowave 300 (Microwave reactor) | Anton Para | ||
| Sonicator | Grupo Selecta | 3000513 | 6 Litres. |
Riferimenti
- Scott, L. T., Hashemi, M. M., Bratcher, M. S. Corannulene bowl-to-bowl inversion is rapid at room temperature. J. Am. Chem. Soc. 114 (5), 1920-1921 (1992).
- Sygula, A., et al. Bowl stacking in curved polynuclear aromatic hydrocarbons: crystal and molecular structure of cyclopentacorannulene. J. Chem. Soc., Chem. Commun. (22), 2571-2572 (1994).
- Nuckolls, C., et al. Circular Dichroism and UV−Visible Absorption Spectra of the Langmuir−Blodgett Films of an Aggregating Helicene. J. Am. Chem. Soc. 120 (34), 8656-8660 (1998).
- Beljonne, D., et al. Electro-optic response of chiral helicenes in isotropic media. J. Chem. Phys. 108 (4), 1301-1304 (1998).
- Treboux, G., Lapstun, P., Wu, Z., Silverbrook, K. Electronic conductance of helicenes. Chem. Phys. Lett. 301 (5-6), 493-497 (1999).
- Katz, T. J. Syntheses of Functionalized and Aggregating Helical Conjugated Molecules. Angew. Chem., Int. Ed. 39 (11), 1921-1923 (2000).
- Furche, F., et al. Circular Dichroism of Helicenes Investigated by Time-Dependent Density Functional Theory. J. Am. Chem. Soc. 122 (8), 1717-1724 (2000).
- Urbano, A. Recent Developments in the Synthesis of Helicene-Like Molecules. Angew. Chem., Int. Ed. 42 (34), 3986-3989 (2003).
- Botek, E., Champane, B., Turki, M., André, J. M. Theoretical study of the second-order nonlinear optical properties of [N]helicenes and [N]phenylenes. J. Chem. Phys. 120 (4), 2042-2048 (2004).
- Lovas, F. J., et al. Interstellar Chemistry: A Strategy for Detecting Polycyclic Aromatic Hydrocarbons in Space. J. Am. Chem. Soc. 127 (12), 4345-4349 (2005).
- Wigglesworth, T. J., Sud, D., Norsten, T. B., Lekhi, V. S., Branda, N. R. Chiral Discrimination in Photochromic Helicenes. J. Am. Chem. Soc. 127 (20), 7272-7273 (2005).
- Wu, Y. -T., Siegel, J. S. Aromatic Molecular-Bowl Hydrocarbons: Synthetic Derivatives, Their Structures, and Physical Properties. Chem. Rev. 106 (12), 4843-4867 (2006).
- Tsefrikas, V. M., Scott, L. T. Geodesic Polyarenes by Flash Vacuum Pyrolysis. Chem. Rev. 106 (12), 4868-4884 (2006).
- Wu, Y. -T., Hayama, T., Baldrige, K. K., Linden, A., Siegel, J. S. Synthesis of Fluoranthenes and Indenocorannulenes: Elucidation of Chiral Stereoisomers on the Basis of Static Molecular Bowls. J. Am. Chem. Soc. 128 (21), 6870-6884 (2006).
- Wu, Y. -T., Siegel, J. S. Synthesis, structures, and physical properties of aromatic molecular-bowl hydrocarbons. Top. Curr. Chem. 349, 63-120 (2014).
- Pérez, E. M., Martìn, N. Curves ahead: molecular receptors for fullerenes based on concave-convex complementarity. Chem. Soc. Rev. 37 (8), 1512-1519 (2008).
- Tashiro, K., Aida, T. Metalloporphyrin hosts for supramolecular chemistry of fullerenes. Chem. Soc. Rev. 36 (2), 189-197 (2007).
- Kawase, T. Ball- Bowl- and Belt-Shaped Conjugated Systems and Their Complexing Abilities: Exploration of the Concave−Convex π−π Interaction. Chem. Rev. 106 (12), 5250-5273 (2006).
- Martin, N., Pérez, E. M. Molecular tweezers for fullerenes. Pure Appl. Chem. 82 (3), 523-533 (2010).
- Hoppe, H., Sariciftci, N. S. Morphology of polymer/fullerene bulk heterojunction solar cells. J. Mater. Chem. 16 (1), 45-61 (2006).
- Kim, S. N., Rusling, J. F., Papadimitrakopoulos, F. Carbon Nanotubes for Electronic and Electrochemical Detection of Biomolecules. Adv. Mater. 19 (20), 3214-3228 (2007).
- Dennler, G., Scharber, M. C., Brabec, C. J. Polymer-Fullerene Bulk-Heterojunction Solar Cells. Adv. Mater. 21 (13), 1323-1338 (2009).
- Helgesen, M., Søndergaard, R., Krebs, F. C. Advanced materials and processes for polymer solar cell devices. J. Mater. Chem. 20 (1), 36-60 (2010).
- Brabec, C. J., et al. Polymer-Fullerene Bulk-Heterojunction Solar Cells. Adv. Mater. 22 (34), 3839-3856 (2010).
- Delgado, J. L., Bouit, P. -A., Filippone, S., Herranz, M. A., Martìn, N. Organic photovoltaics: a chemical approach. Chem. Commun. 46 (27), 4853-4865 (2010).
- Schnorr, J. M., Swager, T. M. Emerging Applications of Carbon Nanotubes. Chem. Mater. 23 (3), 646-657 (2011).
- Wang, C., Takei, K., Takahashi, T., Javey, A. Carbon nanotube electronics - moving forward. Chem. Soc. Rev. 42 (7), 2592-2609 (2013).
- Park, S., Vosguerichian, M., Bao, Z. A review of fabrication and applications of carbon nanotube film-based flexible electronics. Nanoscale. 5, 1727-1752 (2013).
- Mizyed, S., et al. Embracing C60 with Multiarmed Geodesic Partners. J. Am. Chem. Soc. 123 (51), 12770-12774 (2001).
- Sygula, A., Sygula, R., Ellern, A., Rabideau, P. W. Novel Twin Corannulene: Synthesis and Crystal Structure Determination of a Dicorannulenobarrelene Dicarboxylate. Org. Lett. 5 (15), 2595-2597 (2003).
- Georghiou, P. E., Tran, A. H., Mizyed, S., Bancu, M., Scott, L. T. Concave Polyarenes with Sulfide-Linked Flaps and Tentacles: New Electron-Rich Hosts for Fullerenes. J. Org. Chem. 70 (16), 6158-6163 (2005).
- Sygula, A., Fronczek, F. R., Sygula, R., Rabideau, P. W., Olmstead, M. M. A Double Concave Hydrocarbon Buckycatcher. J. Am. Chem. Soc. 129 (13), 3842-3843 (2007).
- Yanney, M., Sygula, A. Tridental molecular clip with corannulene pincers: is three better than two? Tetrahedron Lett. 54 (21), 2604-2607 (2013).
- Stuparu, M. C. Rationally Designed Polymer Hosts of Fullerene. Angew. Chem., Int. Ed. 52 (30), 7786-7790 (2013).
- Le, V. H., Yanney, M., McGuire, M., Sygula, A., Lewis, E. A. Thermodynamics of Host-Guest Interactions between Fullerenes and a Buckycatcher. J. Phys. Chem. B. 118 (41), 11956-11964 (2014).
- Álvarez, C. M. Enhanced association for C70 over C60 with a metal complex with corannulene derivate ligands. Dalton Trans. 43 (42), 15693-15696 (2014).
- Álvarez, C. M. Assembling Nonplanar Polyaromatic Units by Click Chemistry. Study of Multicorannulene Systems as Host for Fullerenes. Org. Lett. 17 (11), 2578-2581 (2015).
- Yanney, M., Fronczek, F. R., Sygula, A. A 2:1 Receptor/C60 Complex as a Nanosized Universal Joint. Angew. Chem. Int. Ed. 54 (38), 11153-11156 (2015).
- Kuragama, P. L. A., Fronczek, F. R., Sygula, A. Bis-corannulene Receptors for Fullerenes Based on Klärner's Tethers: Reaching the Affinity Limits. Org. Lett. 17 (21), (2015).
- George, S. R. D., Frith, T. D. H., Thomas, D. S., Harper, J. B. Putting corannulene in its place. Reactivity studies comparing corannulene with other aromatic hydrocarbons. Org. Biomol. Chem. 13 (34), 9035-9041 (2015).
- Shen, Y., Chen, C. -F. Helicenes: Synthesis and Applications. Chem. Rev. 112 (3), 1463-1535 (2012).
- Crassous, J., Saleh, N., Shen, C. Helicene-based transition metal complexes: synthesis, properties and applications. Chem. Sci. 5 (10), 3680-3694 (2014).
- Nakamura, K., Furumi, S., Takeuchi, M., Shibuya, T., Tanaka, K. Enantioselective Synthesis and Enhanced Circularly Polarized Luminescence of S-Shaped Double Azahelicenes. J. Am. Chem. Soc. 136 (15), 5555-5558 (2014).
- Schweinfurth, D., Zalibera, M., Kathan, M., Shen, C., Mazzolini, M., Trapp, N., Crassous, J., Gescheidt, G., Diederich, F. Helicene Quinones: Redox-Triggered Chiroptical Switching and Chiral Recognition of the Semiquinone Radical Anion Lithium Salt by Electron Nuclear Double Resonance Spectroscopy. J. Am. Chem. Soc. 136 (37), 13045-13052 (2014).
- Šámal, M., Chercheja, S., Rybáček, J., Vacek Chocholoušová, J., Vacek, J., Bednárová, L., Šaman, D., Stará, I. G., Starý, I. An Ultimate Stereocontrol in Asymmetric Synthesis of Optically Pure Fully Aromatic Helicenes. J. Am. Chem. Soc. 137 (26), 8469-8474 (2015).
- Siegel, J. S., Butterfield, A. M., Gilomen, B. Kilogram scale production of corannulene. Organic Process Research & Development. 16 (4), 664-676 (2012).
- Mallory, F. B., Mallory, C. W. Photocyclization of stilbenes and related molecules. Organic Reactions. , Wiley: Hoboken, NJ. (1984).
- Sato, M., et al. Convenient synthesis and reduction properties of [7] circulene. J. Chem. Soc., Perkin Trans. 2. (9), 1909-1914 (1998).
- Anderson, G. K., Lin, M. Bis(Benzonitrile)dichloro complexes of palladium and platinum. Inorg Synth. 28, 60-63 (1990).
- Nataro, C., Fosbenner, S. M. Synthesis and Characterization of Transition-Metal Complexes Containing 1,1'-Bis(diphenylphosphino)ferrocene. J. Chem. Ed. 86 (12), 1412-1415 (2009).
- Kauffman, G. B., Pinnell, R. P. Copper (I) Iodide. Inorg. Synth. 6, 3-6 (1960).
- Sonogashira, K. J. Development of Pd-Cu catalyzed cross-coupling of terminal acetylenes with sp2-carbon halides. Organomet. Chem. 653 (1-2), 46-49 (2002).
- Chinchilla, R., Nájera, C. Recent advances in Sonogashira reactions. Chem. Soc. Rev. 40 (10), 5084-5121 (2011).
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click Chemistry: Diverse Chemical Function from a Few Good Reactions. Angew. Chem. Int. Ed. 40 (11), 2004-2021 (2001).
- Spiteri, C., Moses, J. E. Copper-Catalyzed Azide-Alkyne Cycloaddition: Regioselective Synthesis of 1,4,5-Trisubstituted 1,2,3-Triazoles. Angew. Chem. Int. Ed. 49 (1), 31-33 (2010).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon