A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
القائم HPLC الفحص لمراقبة خارج الخلية النكليوتيد / نوكليوزيد الأيض في خلايا سرطان الدم الليمفاوي المزمن الإنسان
In This Article
Summary
The protocol described here represents an easy and reproducible method that employs reverse phase high-performance liquid chromatography (RP-HPLC) to measure purine metabolism on chronic lymphocytic leukemia (CLL) cells cultured under different conditions.
Abstract
يصف هذا الأسلوب حساسة ومحددة وموثوقة وقابلة للتكرار عكس المرحلة عالية الأداء اللوني السائل (RP-HPLC) فحص المتقدمة والتحقق من صحتها لتقدير حجم النيوكليوتيدات خارج الخلية البيورين ونوكليوسدس التي تنتجها النقي سرطان الدم الليمفاوي المزمن (CLL) الخلايا تحت الظروف ثقافة مختلفة . يتم تنفيذ الفصل الكروماتوغرافي من الأدينوزين 5'-الأدينوزين (AMP)، الأدينوزين (ADO) وإينوزين (INO) في RT على، عمود مرحلة عكس القائمة على السيليكا التي تستخدم للاحتفاظ مركب قطبي. يتضمن الأسلوب الطور المتحرك الثنائية، والتي تتكون من خلات الأمونيوم 7 مم والأسيتونتريل مع معدل التدفق من 1.00 مل / دقيقة. ورصدت eluates باستخدام كاشف الأشعة فوق البنفسجية الثنائي الضوئي صفيف وضعت في 260 نانومتر. يتم إنشاء منحنى المعايرة القياسية لحساب المعادلة لتقدير تحليلي من كل مركب البيورين. ثم يتم تنفيذ نظام مراقبة، والحصول على البيانات وتحليلها. تطبيق هذا البروتوكول، وAMP، INO وادو أزل في 7 و 11 و 11.9 دقيقة، على التوالي، ووقت التشغيل الكلي لكل عينة هو 20 دقيقة. ويمكن تطبيق هذا البروتوكول إلى أنواع الخلايا وخطوط الخلايا (على حد سواء تعليق وتمسكا) مختلفة، وذلك باستخدام وسائل الإعلام ثقافة مثل المصفوفة. من مزايا وسهولة وسرعة إعداد العينات واشتراط وجود كمية صغيرة من طاف للتحليل. وعلاوة على ذلك، فإن استخدام وسيلة خالية من المصل يسمح تخطي الخطوة البروتين هطول الأمطار مع الأسيتونتريل أن يؤثر على تركيز النهائي من مركبات البيورين. واحد من أوجه القصور في طريقة هو الشرط العمود موازنة تشغيل قبل كل عينة تشغيل واحد، مما يجعل وقت التشغيل الكلي للتجربة أطول ومنع التطبيقات فحص عالية الإنتاجية.
Introduction
الأدينوزين (ADO) هو نوكليوزيد البيورين مع جزيء الأدينين تعلق على الريبوز السكر جزيء شاردة من خلال رابطة غليكوسيدية. عندما تكون موجودة في البيئة خارج الخلية، لأنه يحمي الخلايا من التلف المفرط بفعل الجهاز المناعي. وقد تم تسليط الضوء على هذا الدور باستخدام نماذج مختلفة من المرض، مثل التهاب القولون 1، 2 من داء السكري، والربو 3، 4 تعفن الدم، والإصابة الدماغية 5. واحدة من المهام الرئيسية ADO هو تثبيط الاستجابات المناعية في المكروية الورم، والمساهمة في الورم التهرب المناعة 6. لهذا السبب، فإن الآليات التي تشارك في تكوين ADO وإشارات ذات أهمية علاجية كبيرة 7.
مستويات ADO في المكروية الأنسجة منخفضة نسبيا في ظل الظروف الفسيولوجية العادية، وبالتأكيد دون عتبة حساسية الخلايا المناعية. ومع ذلك، أثناء نقص الأكسجين، ونقص التروية، والتهاب، والعدوى، التمثيل الغذائيالتوتر وتحول ورم أنها تزيد بسرعة 8. مستويات ADO خارج الخلية مرتفعة في الاستجابة لإشارات تشويش الأنسجة لها وظيفة مزدوجة: أن يقدم إصابة الأنسجة بطريقة autocrine ونظير الصماوي وتوليد استجابات الأنسجة التي يمكن أن ينظر إليه عادة باعتباره سيتوبروتيكتيفي.
خارج الخلية ADO يمكن تشكيلها من خلال مجموعة متنوعة من الآليات، التي تشمل الإفراج عن حجرات داخل الخلايا بوساطة النقل نوكليوزيد 9 أو تراكم بسبب تدهور ضعاف تديرها نازعة أمين الأدينوزين. المسار الرئيسي مما يؤدي إلى زيادة مستويات الخلية ADO ينطوي على عمل سلسلة من ectonucleotidases، وهي غشاء المرتبطة ectoenzymes توليد ADO بواسطة phosphohydrolysis من النيوكليوتيدات صدر من الخلايا الميتة أو التي تحتضر. يمضي هذا المسار من خلال عمل متتابعة من CD39 (ثلاثي ectonucleoside diphosphohydrolase-1) الذي يحول الخلية أدينوسين ثلاثي الفوسفات 5'-(ATP) أو الأدينوزين 5'-ثنائي الفوسفات (ADP) إلى الأدينوزين 5'-الأدينوزين (AMP) وCD73 (5'-نوكليوتيداز)، والذي يحول AMP إلى ADO 10.
يتسبب خارج الخلية ADO الاستجابات الفسيولوجية ملزمة لأربعة الغشاء ADO المستقبلات، وهي A1، A2A، A2B وA3. كل مستقبل له الانتماءات المختلفة لادو وتوزيع الأنسجة محددة. جميع المستقبلات لها سبعة المجالات عبر الغشاء، وهي G-بروتين بالإضافة إلى الخلايا البروتينات ملزم GTP (البروتينات G)، التي يمكن أن تحدث (البروتين غس) أو تمنع (غي البروتين) النشاط محلقة الأدينيلات و، في وقت لاحق، والإنتاج من المخيم داخل الخلايا. لذلك، والتغيرات في هيولي تأثير مستويات المخيم على الخلايا نشاط البروتين كيناز خلال الاستجابات الفسيولوجية 11. في ظل الظروف الفسيولوجية ADO خارج الخلية أقل من 1 ميكرومتر، والتي يمكن تفعيلها بشكل عشوائي A1، A2A ومستقبلات A3. ومع ذلك، فإن تفعيل A2B سلالة يتطلب أعلى بكثيرتركيزات نوكليوزيد، مثل تلك التي تم إنشاؤها في ظل ظروف الفيزيولوجية المرضية. بدلا من ذلك، ADO خارج الخلية يمكن أن يتحلل إلى إينوزين (INO) من خلال نازعة أمين الأدينوزين (ADA) وCD26، وهو بروتين ADA كومبليكسينج توطين ADA على سطح الخلية. والاحتمال الآخر هو أن ADO وداخليا من قبل الخلية من خلال الناقلين equilibrative نوكليوزيد (ENT) وفسفرته إلى AMP التي كتبها ADO بروتين كيناز 12،13.
والهدف من هذا البروتوكول هو لوصف الطريقة التحليلية المرحلة العكسية عالية الأداء اللوني السائل (RP-HPLC) لتحديد في شوط واحد وAMP الركيزة وادو المنتجات وINO، والتي تم إنشاؤها بواسطة الخلايا الليمفاوية الإنسان. تم الحصول على تجربتنا في البداية باستخدام خلايا من سرطان الدم الليمفاوي (CLL) المرضى المزمنين، والتي تتميز التوسع في عدد السكان ناضجة من الخلايا الليمفاوية CD19 + / CD5 + B معربا جوهري CD39 14،15. أظهرنا ما يقرب من 30٪من CLL المرضى تعبر عن إنزيم خارجي CD73 وأن هذا النمط الظاهري يرتبط بسوء التشخيص 16. هذا حيوانية من خلايا اللوكيميا شارك في التعبير عن CD39 و CD73 يمكن أن تنتج بنشاط ADO خارج الخلية من ADP و / أو AMP. حضن مسبق من CD73 + CLL الخلايا مع α، β-الميثيلين-ADP (APCP)، مثبط معروفة من CD73 النشاط الأنزيمي، وكتل تماما التوليف ADO خارج الخلية يؤكد أن CD73 يمثل انزيم زجاجة الرقبة من أن سلسلة 16.
خلايا CLL أيضا التعبير عن ADA وADA كومبليكسينج البروتين CD26، التي تعتبر مسؤولة عن تحويل ADO إلى INO. باستخدام مثبطات ADA محددة، مثل erythro-9- (2-هيدروكسي-3-نونيل) أنا wiadenine (احنا) هيدروكلوريد وdeoxycoformycin (DCF)، فمن الممكن لمنع تدهور ADO خارج الخلية إلى INO. وعلاوة على ذلك، المعالجة مع مثبط ADA في تركيبة مع ديبيريدامول، الذي يمنع النقل نوكليوزيد، ويعزز تراكم ADO في الخليةsupernatants.
لقد امتدت بعد ذلك هذا البروتوكول إلى الخلايا المشتقة من الأنساب الأخرى، بما في ذلك الخلايا اللمفية تي وخلايا الدم النخاعي، مؤكدا إنتاج ADO تعتمد على CD73. وتشير هذه النتائج إلى أن هذا البروتوكول HPLC هو تنوعا للغاية، وأنه يمكن تطبيقها على الأنساب مختلفة من الخلايا ولظروف ثقافة مختلفة (الشكل 1).
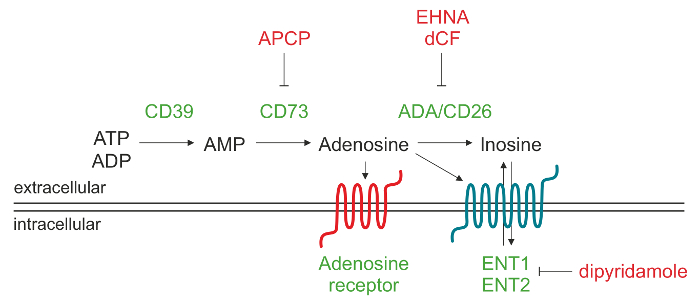
الشكل 1. تمثيل تخطيطي للآلية الأنزيمية مسؤولة عن إنتاج ADO خارج الخلية. أدينوسين ثلاثي الفوسفات 5'-(ATP) و / أو الأدينوزين 5'-ثنائي الفوسفات (ADP) يمكن أن يتحلل من CD39 إلى الأدينوزين 5'-الأدينوزين (AMP)، الذي بدوره تحويلها من قبل CD73 في الأدينوزين نوكليوزيد (ADO). مرة واحدة ويتم إنتاج ADO في الفضاء خارج الخلية، قد أعد إدخال الخلية من خلال الناقلين نوكليوزيد (ENT)، يتم تحويلها إلى إينوزين (INO) أوربط أنواع مختلفة من المستقبلات P1 ADO. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
ويتم الحصول على عينات الدم CLL وفقا للمبادئ التوجيهية المؤسسية وإعلان هلسنكي.
1. عزل اللوكيميا اللمفاوية من عينات الدم من المرضى CLL
- جمع عينة الدم في الهيبارين الصوديوم (الأخضر أعلى) أنبوب 17.
- جعل 1: 3 التخفيف من الدم الكامل مع RT 1X الفوسفات مخزنة المالحة (PBS).
- تنقية الخلايا وحيدة النواة الدموية المحيطية (PBMC) من عينات الدم عن طريق الطرد المركزي التدرج الكثافة.
- الأساس الذي تقوم عليه 5 مل من وسائل الاعلام الطرد المركزي الكثافة (على سبيل المثال، Ficoll) في أنبوب الطرد المركزي 15 مل وبعناية نقل 10 مل من الدم المخفف. أجهزة الطرد المركزي على الفور في 1500 x ج لمدة 20 دقيقة في RT.
- نضح جزءا من طاف مع ماصة باستير الزجاج متصلة مضخة فراغ وجمع عصابة PBMC في الطور البيني بين وسائل الإعلام الطرد المركزي كثافة البلازما والمخفف مع ماصة 5 مل. نقل إلى أنبوب 50 مل الطرد المركزي، ويغسل مع برنامج تلفزيوني (50 مل الحجم النهائي). أجهزة الطرد المركزي في 500 x ج لمدة 5 دقائق في 4 درجات مئوية.
- نضح في وطاف مع ماصة باستير الزجاج، Resuspend وبيليه في 50 مل من برنامج تلفزيوني وعد الخلايا باستخدام عدادة الكريات.
- PBMCs وصمة عار مع anti-CD19 و-CD5 الأجسام المضادة لالتدفق الخلوي يلي بروتوكول قياسي لالمناعية وتحقق من PBMC تكوين حيوانية 18.
ملاحظة: الخلايا الليمفاوية CLL هي CD19 + / CD5 +. - افحص٪ من CD19 + / CD5 + الخلايا باستخدام قياس التدفق الخلوي 18. تنقية الخلايا الليمفاوية B من المرضى الذين يعانون من ≥95٪ من CD19 + / CD5 + خلايا اللوكيميا اتباع التعليمات المفصلة في الخطوة 2 لعزل السلبية للخلايا B 19.
2. تنقية خلايا اللوكيميا B من عزل سلبي
- و resuspend 10 7 PBMCs / مل في برنامج تلفزيوني 0.1٪ زلال المصل البقري (BSA) 2 ملي EDTA، ودرجة الحموضة 7.4 (عازلة العزلة).
- إضافة 101؛ غرام من الماوس وحيدة النسيلة المضادة للCD3، -CD14 و-CD16 الأجسام المضادة الأولية لمدة 10 7 الخلايا واحتضان لمدة 30 دقيقة على 4 درجات مئوية.
- غسل الخلايا مع المخزن المؤقت العزلة وأجهزة الطرد المركزي في 500 x ج لمدة 5 دقائق في 4 درجات مئوية.
- resuspend الخلايا في المنطقة العازلة عزل في 10 7 PBMCs / مل.
- قبل احتضان مع الخلايا، و resuspend الأغنام المضادة للماوس مفتش حبات مغناطيسية في قارورة. نقل 100 ميكرولتر من الخرز في 10 7 خلايا لأنبوب.
- إضافة 1 مل من العازلة العزل ووضع أنبوب في حامل المغناطيس لمدة 1 دقيقة. تجاهل طاف مع ماصة 5 مل.
- إزالة أنبوب من المغناطيس و resuspend حبات غسلها في 100 ميكرولتر من العازلة العزلة.
- احتضان 10 7 الخلايا مع 100 ميكرولتر من الخرز المغناطيسي لمدة 30 دقيقة على 4 درجات مئوية مع إمالة لطيف والتناوب.
- وضع أنبوب في حامل المغناطيس لمدة 2 دقيقة ونقل طاف مع الخلايا غير منضم CD19 + / + CD5لأنبوب جديد مع ماصة 5 مل.
- في نهاية بروتوكول العزلة، وصمة عار 100 ميكرولتر من الخلايا مع مكافحة CD19 و-CD5 الأجسام المضادة لالتدفق الخلوي واحتضان 30 دقيقة على 4 درجات مئوية. غسل الخلايا مع 3 مل من برنامج تلفزيوني 1٪ BSA، ونبذ الفائض من طاف وتحقق B خلية نقاء مرة أخرى عن طريق التدفق الخلوي 19.
ملاحظة: إجراء خطوة عزلة سلبية إضافية إذا نقاء الخلايا البائية أقل من 95٪.
3. إعداد المعيار ومثبطات حلول المالية
- لإعداد AMP، تزن من 0.00345 غرام من AMP وحلها في 5 مل من المتوسط خالية من المصل لدينا حل 2 مم قياسي من AMP.
- لإعداد ADO، تزن من 0.00265 غرام من ADO وحلها في 5 مل من المتوسط خالية من المصل لدينا حل 2 مم قياسي من ADO.
- لإعداد INO، تزن من 0.00268 غرام من INO وحلها في 5 مل من المتوسط خالية من المصل لدينا حل 2 مم قياسي من INO.
- يعد حل 400 ميكرومتر من AMP، ADO وINO عن طريق خلط 1 مل من 2 ملي حل الأسهم في 4 مل من (5 مل الحجم النهائي) المصل خالية المتوسطة.
- جعل 1: 4 التخفيف من كل حل القياسية 400 ميكرومتر إلى الحصول على تركيز 100 ميكرومتر من قبل pipetting 500 ميكرولتر من حل 400 ميكرومتر في 1500 ميكرولتر من المصل خالية المتوسطة (2 مل الحجم النهائي).
- إعداد التخفيفات المسلسل من كل مجمع في المصل خالية المتوسطة للحصول على تركيزات التالية: 100 ميكرومتر - 50 ميكرومتر - 25 ميكرومتر - 10 ميكرومتر - 5 ميكرومتر - 2.5 ميكرومتر - 1 ميكرومتر - 0.5 ميكرومتر - 0.25 ميكرومتر.
ملاحظة: على سبيل المثال، ماصة 1 مل من محلول 100 ميكرومتر في 1 مل من المصل خالية المتوسطة (1: 2 تمييع) للحصول على 50 ميكرومتر تركيز والمضي قدما في التخفيفات المتبقية.
- إعداد ملي حل الأسهم 10 من APCP الذائبة في برنامج تلفزيوني. قسامة والأسهم في - 30 درجة مئوية.
- إعداد 10 الحلول الأسهم ملم من احنا هيدروكلوريد، خصم التدفقات النقدية وديبيريدامول الذائبة في سلفوكسيد ثنائي ميثيل ([دمس])؛ قسامة والسهم عند -30° C.
4. برنامج طريقة HPLC
- إعداد العازلة خلات الأمونيوم 7 ملم عن طريق إذابة 0.770 غرام من خلات الأمونيوم في 2 لتر من الماء منزوع الأيونات مزدوج (الاحتياطي A). ضبط لدرجة الحموضة 3.0 مع حمض الهيدروكلوريك.
- تحضير زجاجة تحتوي على ما لا يقل عن 2 لتر من الأسيتونتريل عالى النقاء لHPLC (B الاحتياطي) وربط العمود الحرس والعمود إلى HPLC.
ملاحظة: الأعمدة ومخازن هي في RT في حين الاستخدام. - تسجيل الدخول إلى البرنامج HPLC وحدد زر "مشروع الاستعراض". انتقل إلى القائمة "ملف" وحدد "طريقة جديدة" ثم "طريقة أداة".
- برنامج موازنة طريقة العمود كما في الجدول 1. تعيين معدل التدفق من 1.00 مل / دقيقة وبرنامج للكشف عن الأشعة فوق البنفسجية لقراءة عند 260 نانومتر. حفظ طريقة أداة واختر مرة أخرى "طريقة جديدة" من القائمة "ملف" ثم "مجموعة الأسلوب". اختيار طريقة أداة المحفوظة مسبقاوحفظ الطريقة الحالية التي تم تحديدها مع نفس الاسم.
| مرة | معدل التدفق (مل / دقيقة) | ٪ا | ٪ب |
| 1.00 | 100 | 0 | |
| 1.24 | 1.00 | 100 | 0 |
| 6.22 | 1.00 | 2 | 98 |
| 18.65 | 1.00 | 2 | 98 |
الجدول 1: موازنة طريقة العمود تمثيل تخطيطي من التغييرات المذيبات لموازنة العمود. العازلة ج: 7 خلات الأمونيوم مم، ودرجة الحموضة 3.0. B العازلة: الأسيتونتريل.
- كرر الخطوة 4.3 لبرنامج طريقة تشغيل العينة هو مبين في الجدول 2. تعيين معدل تدفق 1.00 مL / دقيقة، وبرنامج للكشف عن الأشعة فوق البنفسجية لقراءة عند 260 نانومتر. حفظ طريقة أداة وكرر نفس الإجراء كما هو موضح في الخطوة 4.4 لانقاذ مجموعة طريقة ..
| مرة | معدل التدفق (مل / دقيقة) | ٪ا | ٪ب |
| 1.00 | 0 | 100 | |
| 3.74 | 1.00 | 0 | 100 |
| 13.71 | 1.00 | 15 | 85 |
| 17.00 | 1.00 | 100 | 0 |
| 20.00 | 1.00 | 100 | 0 |
الجدول 2: تشغيل أسلوب العينة. التمثيل التخطيطي للتغيرات مذيب للقياس HPLC من مركبات البيورين. برتقاليإيه A: 7 ملي خلات الأمونيوم، ودرجة الحموضة 3.0. B العازلة: الأسيتونتريل.
- حدد زر "عينات تشغيل"، اختر "جديد أسلوب مجموعة عينة" من القائمة "ملف".
- حدد الخيار "فارغة" وأدخل عدد من القارورة (في الاوتوماتيكى)، اسم العينة، وحجم الحقن (50 ميكرولتر). حدد مجموعة طريقة حفظها قبل للعمود "طريقة مجموعة" وأدخل وقت التشغيل الكلي (دقيقة).
ملاحظة: أدخل طريقة العمود موازنة (الجدول 1) في "طريقة مجموعة" العمود قبل تشغيل كل عينة وأدخل وقت التشغيل الكلي (دقيقة).
5. الجيل من منحنى المعايرة القياسية لكل مجمع
- ضخ 50 ميكرولتر من (المصل خالية المتوسطة معين، والتي لا تحتوي على الأدينوزين نازعة أمين) فارغة ومن كل عينة القياسية التالية الطرق الموضحة في الجدول رقم 1 والجدول 2.
- استخدام عمود موازنةطريقة (الجدول 1) قبل تشغيل كل عينة وتهيئة الظروف التدرج هو موضح في الجدول رقم 2 للحصول على ذروة فصل كاف. الرجوع إلى الجدول رقم 3 لمرات الاحتفاظ ذكرت من AMP، ADO وإنو في ظل هذه الظروف HPLC.
| الاحتفاظ الوقت | λ ماكس | |
| AMP | 8.00 دقيقة | 260 |
| انا لا | 11.00 دقيقة | 260 |
| ADO | 11.90 دقيقة | 260 |
الجدول 3: مرات الاحتفاظ مركبات البيورين مرات الاحتفاظ نموذجي لاحظ لامبير، ADO وINO. مبرمجة للكشف عن الأشعة فوق البنفسجية لقراءة عند 260 نانومتر.
- تحديد منطقة ذروة AMP، ADO وINO بتركيزات مختلفة اختيار زر "عملية" في البرنامج HPLC وبجوار الخيار "دمج". بدلا من ذلك يدويا تحديد البداية والنهاية نقطة لكل الذروة.
- رسم مناطق ذروة ضد تركيز الاسمي لكل معيار للحصول على منحنى المعايرة تسع نقاط (100، 50، 25، 10، 5، 2.5، 1، 0.5، 0.25 ميكرومتر).
- حساب معادلة خط مستقيم لامبير، ADO وINO: ص = م × + ب،
حيث x هو تركيز ميكرومتر و y تتوافق مع منطقة الذروة.
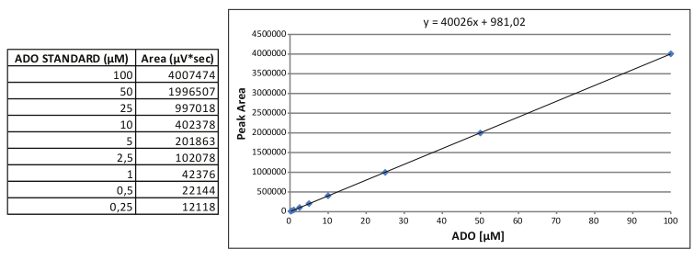
الشكل 2. توليد منحنى القياسية الداخلية. منحنى الممثل المعايرة القياسية لادو والمعادلة النسبية التي حصل عليها. يرجى النقر لهاالبريد لعرض نسخة أكبر من هذا الرقم.
6. المعالجة مع مثبطات والحضانة مع الركيزة (AMP)
- لاختبار AMP الاستهلاك، ADO وتوليد INO دون تثبيط CD73، ADA والنقل نوكليوزيد، و resuspend 2 × 10 6 CD19 + / خلايا CD5 + CLL (معزولة وتنقيته في الخطوات 1 و 2) في 250 ميكرولتر من المصل خالية المتوسطة و خلايا لوحة في لوحة جيدا 48 (أو في أنبوب microcentrifuge 1.5 مل).
- لمنع النشاط الأنزيمي CD73، وتمييع 1: 1000 محلول المخزون من APCP (10 ملم) في مستنبت للحصول على التركيز النهائي 10 ميكرومتر. و resuspend 2 × 10 6 خلايا CLL في 250 ميكرولتر من مستنبت تحتوي على APCP ويمهد للمعالجة 60 دقيقة عند 37 درجة مئوية في حاضنة الثقافة الخلية.
- لمنع تحويل ADO إلى INO، وتمييع 1: 1000 محلول المخزون من احنا هيدروكلوريد و / أو التدفقات النقدية المخصومة (على حد سواء 10 ملم) في المصل خالية المتوسطة لديها تركيز النهائي 10 ميكرومتر.و resuspend 2 × 10 6 خلايا CLL في 250 ميكرولتر من مستنبت يحتوي احنا و / أو التدفقات النقدية المخصومة. احتضان لمدة 30 دقيقة عند 37 درجة مئوية في حاضنة الثقافة الخلية.
- لمنع امتصاص ADO من خلال شركات النقل نوكليوزيد، وتمييع 1: 1000 محلول المخزون من ديبيريدامول (10 ملم) في المصل خالية المتوسطة أن يكون تركيز النهائي 10 ميكرومتر. و resuspend 2 × 10 6 خلايا CLL في 250 ميكرولتر من ثقافة المتوسط تحتوي على ديبيريدامول واحتضان لمدة 30 دقيقة عند 37 درجة مئوية في حاضنة الثقافة الخلية.
- إعداد الحلول احدة من APCP، احنا، خصم التدفقات النقدية وديبيريدامول المخفف 1: 1000 في 400 ميكرومتر AMP.
- إضافة 250 ميكرولتر من 400 ميكرومتر AMP أو AMP بالإضافة إلى مثبطات للحصول على التركيز النهائي من 200 ميكرومتر AMP. تتضمن شرطا في غياب الركيزة لاستخدامها عينة فارغة.
- احتضان 30-60 دقيقة عند 37 درجة مئوية.
ملاحظة: إن تركيز الأمثل للAMP وفترة حضانة تم تحديدها بشكل تجريبي. - في تيانه في نهاية الوقت الحضانة، وجمع 500 ميكرولتر من supernatants في أنابيب microcentrifuge الباردة (على الجليد) وأجهزة الطرد المركزي على الفور في 17000 x ج في 4 درجة مئوية لمدة 5 دقائق.
- نقل supernatants في أنابيب microcentrifuge 1.5 مل جديدة وتخزينها على الفور في -80 درجة مئوية أو الشروع في تحضير العينة ليدير HPLC.
7. عينات التحضير للHPLC
- تصفية supernatants في أنابيب microcentrifuge 1.5 مل جديدة مع 0.2 ميكرومتر مرشحات حقنة. استخدام المحاقن 1 مل لتصفية.
- إذا تم توفير نظام HPLC مع الاوتوماتيكى، وإعداد قوارير زجاجية لHPLC واستخدام 0.1 مل إدراج الدقيقة لكميات صغيرة من العينة.
- نقل لا يقل عن 100 ميكرولتر من العينة في قارورة زجاجية مع micropipette أو ماصة باستير الزجاج. كن حريصا على نقل بدون فقاعات وإغلاق القارورة مع غطاء المسمار.
- عينات جاهزة الآن لتحليلها من قبل RP-HPLC.
8. HPLC قنينةrements من البيورينات
- حدد زر "عينات المدى". اختر "جديد أسلوب مجموعة عينة" من القائمة "ملف".
- حدد الخيار "فارغة" والإشارة إلى الآتي: عدد من القارورة (في الاوتوماتيكى)، اسم العينة، وحجم الحقن (50 ميكرولتر).
- حدد طريقة العمود موازنة وطريقة التشغيل عينة هو موضح في الجدول رقم 1 والجدول رقم 2، على التوالي، لجميع أشواط فارغة والعينة التي تتبع.
ملاحظة: تعيين طريقة العمود موازنة (الجدول 1) قبل تشغيل كل عينة. - ضخ 50 ميكرولتر من (المصل خالية المتوسطة) فارغة ومن كل عينة.
- تحديد تركيز البيورينات في كل عينة، قياس AMP، ADO وINO عن طريق الحصول على مناطق الذروة في الأوقات الاحتفاظ موضح في الجدول 3.
- حدد "عملية" الزر وبجوار الخيار "دمج". اختيار بدلا من يدويا بدءنقطة الثانية نهاية كل قمة واحدة للحصول على قياس المنطقة. ويتم ذلك عن طريق تتبع خط بين بداية ونهاية نقاط الذروة.
- تحديد تركيز ميكرومتر تطبيق المعادلة التي تم الحصول عليها لمنحنى القياسية: ص = م × + ب، حيث x يمثل تركيز ميكرومتر و y هو منطقة ذروة تقاس من عينة مجهولة.
ملاحظة: أفادت الأخبار مثال على ADO معايرة المنحنى القياسي في الشكل 2، حيث: س = (منطقة ذ - 981.02) / 40026
- وبالنظر إلى أن 2 × 10 6 خلايا ومعلق في 0.500 مل من المتوسط، وحساب μmoles من AMP، ADO وINO تستهلك و / أو إنتاجها بنسبة 10 6 خلايا CLL تطبيق نسبة التالية:
μmoles: 1000 مل = س μmoles: 0.250 مل
ملاحظة: μmoles في 1000 مل (μmoles عدد في 1 لتر) من تعادل تركيز ميكرومتر و x هي μmoles من نوcleotide أو نوكليوزيد التي تنتجها الخلايا 6 10.- وأخيرا، تحويل μmoles إلى nmoles المستهلكة و / أو التي تنتجها 10 6 خلايا CLL:
nmoles = μmoles س 1000
- وأخيرا، تحويل μmoles إلى nmoles المستهلكة و / أو التي تنتجها 10 6 خلايا CLL:
النتائج
لتقييم نسبة (٪) من خلايا اللوكيميا في PBMCs تنقيته حديثا من مريض CLL التمثيلي، وتتميز الخلايا مع مكافحة CD19 وأضداد CD5. وتمثل اللوحة اليسرى من الشكل 3 نقطة مؤامرة cytofluorimetric مع بوابة انتقائية على الخلايا الحية. ويبين الشكل 3 مثالا للPBMC من مر?...
Discussion
بروتوكول صفها هنا يسمح لتقييم نشاط CD39 / CD73 الآلات adenosinergic في وسائل الإعلام ثقافة خلية من خلايا اللوكيميا الإنسان النقاء. من خلال هذا الأسلوب HPLC يمكننا متابعة وكميا قياس الجيل الأنزيمي ادو (CD73 التي تعتمد على)، وتدهور لاحقا لإنو (CD26 / ADA التابعة). استخدام مثبطات إنزيم يسمح...
Disclosures
The authors have nothing to disclose.
Acknowledgements
ويؤيد هذا العمل من قبل Associazione الإيطالية يسر كل من Ricerca Cancro (IG # 12754).
Materials
| Name | Company | Catalog Number | Comments |
| Human blood | |||
| Milli-Q water | Millipore | double deionised water | |
| Ficoll-Paque Plus | GE-Healthcare | 17-1440-03 | |
| purified anti-CD3, -CD14, -CD16 | made in-house | mouse monoclonal | |
| PE-labeled anti-CD19 | Miltenyi Biotec | 120-014-229 | |
| FITC-labeled anti-CD5 | Miltenyi Biotec | 130-096-574 | |
| Dynabeads sheep anti-mouse IgG | Invitrogen | 11031 | |
| Phosphate-buffered saline (PBS) | Amresco | E404-200TABS | tablets |
| bovine serum albumin (BSA) | ID bio | 1000-70 | standard grade |
| isolation buffer | PBS 0.1% BSA 2 mM EDTA, pH 7.4 | ||
| AIM V serum free medium | GIBCO | 12055-091 | liquid (research grade) |
| adenosine 5’-diphosphate (ADP) | Sigma-Aldrich | A2754 | |
| adenosine 5’-monosphate (AMP) | Sigma-Aldrich | A1752 | |
| adenosine (ADO) | Sigma-Aldrich | A9251 | |
| inosine (INO) | Sigma-Aldrich | I4125 | |
| α,β-methylene-ADP (APCP) | Sigma-Aldrich | M8386 | CD73 inhibitor |
| EHNA hydrochloride | Sigma-Aldrich | E114 | adenosine deaminase inhibitor |
| Deoxycoformycin (dCF) | Tocris | 2033 | adenosine deaminase inhibitor |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Dipyridamole | Sigma-Aldrich | D9766 | nucleoside transporter inhibitor |
| acetonitrile (CHROMASOLV Plus) | Sigma-Aldrich | 34998 | HPLC-grade |
| ammonium acetate | Sigma-Aldrich | 9688 | 7 mM, pH 3.0 |
| hydrochloric acid | Sigma-Aldrich | 30721-1L | min. 37% |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Bürker cell counter | VWR | 631-0920 | hemocytometer |
| DynaMag-15 Magnet | Invitrogen | 12301D | Dynal magnetic bead separator |
| microcentrifuge safe-lock tubes | Eppendorf | 030-120-0086 | 1.5 ml |
| PET centrifuge tubes | Corning | 430053/430304 | 15 – 50 ml |
| Minisart RC4 syringe filters | Sartorius Stedim Biotech | 17821 | membrane 0.2 µm |
| short thread vials | VWR | 548-0029 | 1.5 ml/glass |
| micro-inserts | VWR | 548-0006 | 0.1 ml/glass |
| screw caps | VWR | 548-0085 | 9 mm/PP blue |
| Atlantis dC18 Column | Waters | 186001344 | 5 µm, 4.6 mm x 150 mm |
| Atlantis dC18 Guard Column | Waters | 186001323 | 5 µm, 4.6 mm x 20 mm |
| Waters Alliance 2965 Separations Module | Waters | HPLC separation module | |
| Waters 2998 Photodiode Array (PDA) Detector | Waters | UV detector | |
| Waters Empower2 software | Waters |
References
- Naganuma, M., Wiznerowicz, E. B., Lappas, C. M., Linden, J., Worthington, M. T., Ernst, P. B. Cutting edge: Critical role for A2A adenosine receptors in the T cell-mediated regulation of colitis. J Immunology. 177 (5), 2765-2769 (2006).
- Nemeth, Z. H., et al. Adenosine receptor activation ameliorates type 1 diabetes. FASEB J. 21 (10), 2379-2388 (2007).
- Fan, M., Jamal Mustafa, S. Role of adenosine in airway inflammation in an allergic mouse model of asthma. Int Immunopharmacol. 6 (1), 36-45 (2006).
- Csoka, B., et al. A2B adenosine receptors protect against sepsis-induced mortality by dampening excessive inflammation. J Immunol. 185 (1), 542-550 (2010).
- Peart, J. N., Headrick, J. P. Adenosinergic cardioprotection: multiple receptors, multiple pathways. Pharmacol Ther. 114 (2), 208-221 (2007).
- Ohta, A., et al. A2A adenosine receptor protects tumors from antitumor T cells. Proc Natl Acad Sci U S A. 103 (35), 13132-13137 (2006).
- Hasko, G., Linden, J., Cronstein, B., Pacher, P. Adenosine receptors: therapeutic aspects for inflammatory and immune diseases. Nat Rev Drug Discov. 7 (9), 759-770 (2008).
- Cronstein, B. N. Adenosine, an endogenous anti-inflammatory agent. J Appl Physiol (1985). 76 (1), 5-13 (1994).
- Molina-Arcas, M., Casado, F. J., Pastor-Anglada, M. Nucleoside transporter proteins. Curr Vasc Pharmacol. 7 (4), 426-434 (2009).
- Deaglio, S., et al. Adenosine generation catalyzed by CD39 and CD73 expressed on regulatory T cells mediates immune suppression. J Exp Med. 204 (6), 1257-1265 (2007).
- Linden, J. Regulation of leukocyte function by adenosine receptors. Adv Pharmacol. 61, 95-114 (2011).
- Antonioli, L., Blandizzi, C., Pacher, P., Hasko, G. Immunity, inflammation and cancer: a leading role for adenosine. Nat Rev Cancer. 13 (12), 842-857 (2013).
- Antonioli, L., Csoka, B., Fornai, M., et al. Adenosine and inflammation: what's new on the horizon. Drug Discov Today. 19 (8), 1051-1068 (1051).
- Chiorazzi, N., Rai, K. R., Ferrarini, M. Chronic lymphocytic leukemia. N Engl J Med. 352 (8), 804-815 (2005).
- Abousamra, N. K., Salah El-Din, M., Hamza Elzahaf, E., Esmael, M. E. Ectonucleoside triphosphate diphosphohydrolase-1 (E-NTPDase1/CD39) as a new prognostic marker in chronic lymphocytic leukemia. Leuk Lymphoma. 56 (1), 113-119 (2015).
- Serra, S., et al. CD73-generated extracellular adenosine in chronic lymphocytic leukemia creates local conditions counteracting drug-induced cell death. Blood. 118 (23), 6141-6152 (2011).
- Chen, L. S., Keating, M. J., Gandhi, V. Blood collection methods affect cellular protein integrity: implications for clinical trial biomarkers and ZAP-70 inn CLL. Blood. 124 (7), 1192-1195 (2014).
- Kalina, T., et al. EuroFlow standardization of flow cytometer instrument settings and immunophenotyping protocols. Leukemia. 26 (9), 1986-2010 (2012).
- Deaglio, S., et al. CD38 and ZAP-70 are functionally linked and mark CLL cells with high migratory potential. Blood. 110 (12), 4012-4021 (2007).
- Sachsenmeier, K. F., et al. Development of a novel ectonucleotidase assay suitable for high-throughput screening. J Biomol Screen. 17 (7), 993-998 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved