Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
HPLC tabanlı Testi İnsan Kronik Lenfositik Lösemi Hücrelerinde Ekstraselüler Nükleotid / Nükleozid Metabolizması Monitör
Bu Makalede
Özet
The protocol described here represents an easy and reproducible method that employs reverse phase high-performance liquid chromatography (RP-HPLC) to measure purine metabolism on chronic lymphocytic leukemia (CLL) cells cultured under different conditions.
Özet
Bu yöntem, bir duyarlı, spesifik, güvenilir ve tekrarlanabilir bir ters fazlı yüksek performanslı sıvı kromatografisi (RP-HPLC) deneyi geliştirilmiştir ve farklı kültür koşulları altında, saflaştırılmış kronik lenfositik lösemi tarafından üretilen hücre dışı purin nükleotitleri ve nükleosidler (CLL) hücre ölçümü için geçerli tarif . kromatografik adenozin 5'-monofosfat ayrılması (AMP), adenosin (ADO) ve inosin (INO) polar bileşik tutulması için kullanılan bir silika olan, ters-fazlı sütun üzerinde oda sıcaklığında gerçekleştirilir. Yöntem / dk 1.00 ml bir akış oranı ile 7 mM amonyum asetat ve asetonitril oluşan bir ikili mobil faz içerir. yıkama sıvıları, 260 nm'de ayarlanmış bir Fotodiyot Dizi UV detektör kullanılarak izlenir. Standart kalibrasyon eğrisi her pürin bileşiğin analitik ölçümü için denklemi hesaplamak için oluşturulur. Sistem kontrolü, veri toplama ve analizi, daha sonra gerçekleştirilir. Bu protokolü uygulayarak, AMP INO ve ADO, sırasıyla, 7, 11 ve 11.9 dakika ile elüt ve her bir örnek için toplam çalışma süresi 20 dakikadır. Bu protokol, matris olarak bir kültür ortamı kullanılarak, hücre tipleri ve hücre çizgileri (süspansiyon ve yapışık hem de) farklı tatbik edilebilir. avantajlar kolay ve hızlı bir numune hazırlığı ve analiz için yüzer bir miktar ihtiyacı vardır. Bundan başka, bir serum barındırmayan ortam içinde kullanımı Asetonitril ile protein tortulaşması atlayarak olanak sağlayan etkiler pürin bileşiklerin nihai konsantrasyonu. yöntemin sınırlamaları biri tek tek her numune çalışması önce çalıştırmak dengeleme sütun gereksinimi, uzun deney toplam çalışma süresini yapma ve yüksek verimli tarama uygulamaları engelliyor.
Giriş
Adenosin (ADO), bir glikosidik bağ ile riboz şeker molekülü grubuna bağlı bir adenin molekülü ile bir purin nükleosid olan. Tüm hücre dışı ortamda mevcut olan bağışıklık sisteminin harekete aşırı zarar hücreleri korur. Bu rol, böyle kolit 1, diyabet 2, astım 3, sepsis 4, ve iskemik hasar 5 gibi farklı hastalık modelleri kullanılarak vurgulanmıştır. Ana ADO fonksiyonlarından biri tümör immün kaçırma 6 katkıda tümör mikro-bağışıklık tepkilerinin inhibisyonudur. Bu nedenle, ADO oluşumu ve sinyalizasyon dahil mekanizmalar ölçüde terapötik ilgi 7 vardır.
doku çevresinde ADO düzeyleri, normal fizyolojik koşullar altında ve kesinlikle immün hücrelerin duyarlılığı eşiğinin altında nispeten düşüktür. Bununla birlikte, hipoksi sırasında, iskemi, enflamasyon, enfeksiyon, metabolikStres ve tümör dönüşümü hızla 8 artış. otokrin ve parakrin şekilde doku hasarını bildirmek ve genellikle hücre koruyucu olarak görülebilir doku tepkileri üretmek için: doku bozucu sinyallerine karşılık olarak, yüksek hücre dışı ADO düzeyleri iki işlevi vardır.
Hücre dışı ADO için adenosin deaminaz işletmesinde bozulmuş bozulma nükleosid taşıyıcı 9 veya birikiminin aracılık ettiği hücre içi bölmelerden salım mekanizmalarının, çeşitli yoluyla oluşturulabilir. artmış hücre dışı ADO seviyelere giden ana yol ölü veya ölmekte hücrelerden salınan nükleotidlerin phosphohydrolysis ADO üreten membran bağlantılı ectoenzymes olan ectonucleotidases, bir kaskad bir işlem içerir. Bu yol CD39 sıralı hareket ilerler (ectonucleoside trifosfat diphosphohydrolase-1) ekstraselüler adenozin 5'-trifosfat dönüştürür (ATP) veya AMP 10 ADO'ya dönüştürür adenozin 5'-monofosfat (AMP) ve CD73 (5'-nükleotidaz) adenozin 5'-difosfat (ADP),.
Hücre dışı ADO dört transmembran ADO reseptörleri, yani A1, A2a, A2b ve A3 bağlanarak fizyolojik tepkileri ortaya koyar. Her bir reseptör Ado ve spesifik doku dağıtımı için farklı afinitelere sahiptir. Tüm reseptörleri yedi transmembran ve G-proteini, hücre içi GTP bağlayıcı proteinler (G proteinleri) birleştirilmiş, bu neden (G proteini) ya da daha sonra, hücre içi cAMP üretimini inhibe (Gi proteini) adenilat siklaz aktivitesi ve yararlanılabilir. Bu nedenle, fizyolojik yanıtlar sırasında 11 hücre içi protein kinaz aktivitesine sitoplazmik cAMP seviyelerinin etkisi değişir. Fizyolojik koşullar altında, hücre dışı ADO gelişigüzel A1, A2A ve A3 reseptörlerini aktive edebilen 1 uM, altındadır. Ancak, A2B alt tipi aktivasyonu önemli ölçüde daha yüksek gerektirirBu patofizyolojik koşullarda üretilenler gibi nükleosit konsantrasyonları. Alternatif olarak, hücre dışı ADO adenozin deaminaz (ADA) ve CD26, hücre yüzeyinde ADA lokalize bir ADA kompleks protein tarafından inosin (INO) bozulmuş olabilir. Diğer bir olasılık, ADO ADO kinaz proteinin 12,13 tarafından AMP equilibrative nükleosid taşıyıcı (KBB) ve fosforile yoluyla hücre tarafından içselleştirilir olmasıdır.
Bu protokolün amacı insan lenfositleri tarafından oluşturulan, tek bir kerede alt-tabaka AMP ve ürünler ADO ve INO ölçmek için ters fazlı yüksek performanslı sıvı kromatografi (RP-HPLC) analitik bir yöntem tanımlamaktır. Tecrübemiz ilk kurucu CD39 14,15 eksprese CD19 + / CD5 + B lenfositlerin olgun bir popülasyonunda genişleme ile karakterize edilen kronik lenfositik lösemi (CLL) hastanın hücreleri kullanılarak elde edilmiştir. Biz yaklaşık% 30 gösterdiKLL hastaları CD73 ectoenzyme ifade ve bu fenotip kötü prognoz 16 ile ilişkilidir. CD39 ve CD73 ko-eksprese eden lösemi hücrelerinin bu alt grubu aktif ADP ve / veya AMP den hücre dışı ADO üretebilir. A ile CD73 + CLL hücreleri önceden bekletme, β-metilen-ADP (APCP), CD73 enzimatik aktivitesinin bilinen bir önleyicisi, tamamen bloke hücre dışı ADO sentezi CD73 bu kaskadın 16 şişe boynu enzimi temsil ettiği teyit etmektedir.
KLL hücreleri de INO içine ADO dönüşümünden sorumlu olan ADA ve ADA kompleks protein CD26, ifade eder. Bu eritro-9 gibi belirli ADA inhibitörleri kullanarak (2-Hidroksi-3-nonil, i) wiadenine (EHNA) hidroklorür ve deoksikoformisin (DCF), bu INO ekstraselüler ADO bozulmasını engellemek mümkündür. Ayrıca, dipiridamol ile bir arada bir ADA inhibitörü ile ön-muamele, bloklar nükleosid taşıyıcılar bu, hücre ADO birikimini arttıransüpernatantlar.
Daha sonra CD73-bağımlı ADO üretimini teyit T lenfositler ve miyeloid hücreler de dahil olmak üzere, diğer soylar, elde edilen hücreler için bu protokolü genişletmiştir. Bu bulgular, bu HPLC protokolü çok yönlüdür ve (Şekil 1), farklı hücre soyları ve farklı kültür koşullarında tatbik edilebilir olduğunu göstermektedir.
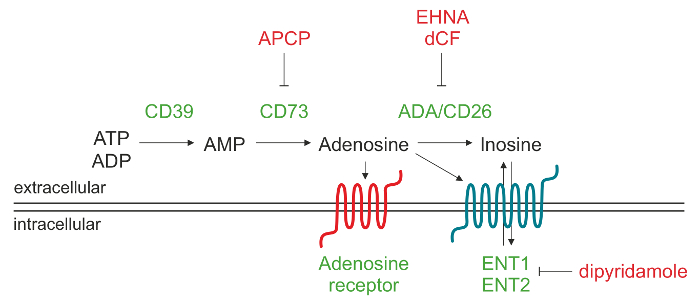
Hücre-dışı ADO üretiminden sorumlu olan enzimatik mekanizmaya Şekil 1. şematik temsili. Adenosin 5'-trifosfat (ATP) ve / veya adenozin 5'-difosfat (ADP), adenosin 5'-monofosfat (AMP) 'e CD39 tarafından parçalandığı ulaşılabilen bu da nükleosid adenosin (ADO) içerisine CD73 ile dönüştürülür. ADO hücre dışı alan üretilir sonra, nükleosid taşıyıcı (KBB) aracılığıyla hücreyi tekrar girebilecektir, inosin dönüştürülebilir (INO) ya daP1 ADO reseptörlerinin farklı türde bağlanırlar. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Protokol
KLL kan örnekleri Kurumsal Kuralları ve Helsinki Bildirgesi uyarınca elde edilir.
KLL Hastaların Kan Örneklerinden Lösemi Lenfositler 1. İzolasyonu
- Sodyum heparin (yeşil-üst) tüp 17 kan örneği toplayın.
- RT 1X fosfat tamponlu salin (PBS) ile tam kan 3 seyreltme: 1 sağlayın.
- yoğunluk gradyan santrifüjü ile kan örnekleri alınan periferal kan tek-çekirdekli hücreleri (PBMC) saflaştınlır.
- Dikkatle örtü 5, bir 15 ml santrifüj tüpü içinde, yoğunluk santrifüj ortamın (örneğin, Ficoll) içinde çözdürülür ve seyreltilmiş 10 ml kan transferi. Hemen, oda sıcaklığında 20 dakika boyunca 1500 x g'de santrifüjlenir.
- bir vakum pompasına birleştirilmiş bir cam Pasteur pipeti ile süpernatan aspire kısmı ve 5 ml pipet yoğunluk santrifüj ortam ve seyreltilmiş plazma arasındaki interfaz PBMC halka toplar. (50 m 50 ml'lik bir santrifüj tüpüne aktarılır ve PBS ile yıkayınl nihai hacim). 4 ° C'de 5 dakika boyunca 500 x g'de santrifüjleyin.
- Aspire cam Pasteur pipeti ile yüzer, PBS, 50 ml pelet ve bir hemasitometre kullanarak hücreleri sayın.
- Leke, anti-CD19 ile PBMC'ler ve akış için -CD5 antikorlar sitometri immün için standart bir protokol takip ve PBMC ICSI'nin kompozisyon 18 için kontrol edin.
Not: KLL lenfositler CD19 + / CD5 + vardır. - 18 bir akış sitometrisi kullanılarak CD19 + / CD5 + hücreler% edin. CD19 + / CD5 + B hücreleri 19 negatif izolasyonu için adım 2'de detaylı bilgi, aşağıdaki lösemik hücre ≥95% hastalarda B lenfositleri saflaştınlır.
Negatif İzolasyon tarafından Lösemi B Hücreleri 2. saflaştırılması
- PBS,% 0.1 büyükbaş hayvan serum albümini (BSA), 2 mM EDTA, pH 7.4 (izolasyon tamponu) içinde yeniden süspanse 10 7 PBMC / ml olmuştur.
- 10 ekle1, fare monoklonal anti-CD3, -CD14 ve 10 7 hücreleri için -CD16 birincil antikor g ve 4 ° C'de 30 dakika inkübe edilir.
- 4 ° C'de 5 dakika boyunca 500 x g'de izole tamponu ve santrifüj ile hücreler yıkanır.
- 10 7 PBMC'ler / ml izolasyon tampon hücrelerin tekrar.
- hücrelerle inkübe edildi, koyun anti-fare IgG'si şişede manyetik boncuklar tekrar süspansiyon. Bir tübe 10 7 hücre başına boncuk 100 ul aktarın.
- yalıtım tamponu 1 ml ilave edilir ve 1 dakika süre ile bir mıknatıs tutucu tüp yerleştirin. 5 ml pipet ile süpernatant atın.
- mıknatıstan tüpü çıkarın ve izolasyon tampon 100 ul yıkanmış boncuklar tekrar süspansiyon.
- Yumuşak bir eğme ve rotasyon ile 4 ° C sıcaklıkta 30 dakika boyunca manyetik boncuk 100 ul ile 10 7 hücreleri inkübe.
- 2 dakika süreyle mıknatıs tutucu tüp yerleştirin ve CD19 + / CD5 + ilişkisiz hücrelerle süpernatant transferi5 ml pipet ile yeni bir tüp.
- yalıtım protokolünün sonunda, sitometrisi, anti-CD19 ile birlikte hücre, 100 ul akış -CD5 antikorları leke ve 4 ° C'de 30 dakika inkübe edilir. PBS% 1 BSA, 3 ml hücreleri yıkayın süpernatan fazlasının atmak ve 19 akış sitometrisi ile daha B hücresi saflığını kontrol.
Not: B hücre saflık% 95 daha düşük ise, ek bir negatif yalıtım aşamasını gerçekleştirir.
Standart ve İnhibitörleri Stok Çözümleri 3. hazırlanması
- AMP hazırlamak için, AMP 0.00345 g tartılır ve AMP 2mM lik bir standart solüsyon için, serum barındırmayan ortam içinde, 5 ml içinde çözülür.
- ADO hazırlamak için, ADO üzerinden 0,00265 g ağırlığında ve ADO 2 mm standart solüsyon için, serum barındırmayan ortam 5 ml içinde çözülür.
- INO hazırlamak için, INO üzerinden 0,00268 g ağırlığında ve iNO 2mM lik bir standart solüsyon için, serum barındırmayan ortam 5 ml içinde çözülür.
- AMP, ADO 400 mcM çözüm hazırlayın veINO serum içermeyen aracı madde (5 ml nihai hacim), 4 ml 2 mM stok çözeltisi, 1 ml karıştırılarak.
- Her biri 400 uM standart çözelti 4 dilüsyon serumsuz ortam (2 ml nihai hacim) 1500 ul 400 uM çözeltisi 500 ul pipetleme 100 uM konsantrasyonunu elde etmek için 1 sağlayın.
- Aşağıdaki konsantrasyonları elde etmek için, serum barındırmayan ortam içinde Her bir bileşiğin seri dilüsyonları hazırlayın: 100 uM - 50 uM - 25 uM - 10 uM - 5 uM - 2.5 uM - 1 uM - 0.5 uM - 0.25 uM.
Not: Örneğin, serumsuz ortam 1 ml 100 uM çözeltisi pipetle 1 ml (1: 2 seyreltme) 50 uM konsantrasyonu elde etmek üzere, geri kalan seyreltmeleri ile devam edin.
- PBS içinde çözülmüş APCP bir 10 mM stok çözelti hazırlayın; 30 ° C - en kısım ve stok.
- dimetil sülfoksit içinde eritildi EHNA hidroklorür DCF ve dipiridamol 10 mM stok çözeltileri (DMSO) hazırlanması; kısım ve stok -30° C.
4. Program HPLC Yöntemi
- çifte iyonsuzlaştırılmış su 2 L (Tampon A) içinde amonyum asetatın 0.770 g eritilerek 7 mM amonyum asetat tamponu hazırlayın. hidroklorik asit ile pH 3.0'a ayarlayın.
- HPLC (Tampon B) için ultra saf asetonitril en az 2 L içeren bir cam şişe hazırlayın ve koruma sütunu ve HPLC sütun bağlayın.
Not: Kullanım sırasında kolonlar ve tamponlar oda sıcaklığında vardır. - HPLC yazılımı giriş yapın ve "Gözat projesi" düğmesini seçin. "Dosya" menüsüne gidin ve "yeni bir yöntem" ve ardından "alet yöntemi" seçeneğini seçin.
- Program Tablo 1 'deki gibi dengeleme kolon yöntemi. 1.00 ml / dk bir akış hızını ayarlayın ve 260 nm'de okundu UV detektörü programlamak. alet yöntemi kaydedin ve sonra "yöntemi seti" "Dosya" menüsünden tekrar "yeni bir yöntem" i seçin ve. Önceden kaydedilmiş alet yöntemini seçinve aynı adla ayarlanmış geçerli yöntem kaydedin.
| Zaman | Akış hızı (ml / dakika) | % A | % B |
| 1.00 | 100 | 0 | |
| 1.24 | 1.00 | 100 | 0 |
| 6.22 | 1.00 | 2 | 98 |
| 18.65 | 1.00 | 2 | 98 |
Tablo 1: Dengeleme kolon yöntemi kolon dengeleme için çözücü değişim şematik temsili.. Bir tampon: 7 mM amonyum asetat, pH 3.0. Tampon B: asetonitril.
- Set 1.00 m akış hızı Tablo 2'de belirtilen çalışma örnek yöntemini programlamak için adım 4.3 tekrarlayınL / dk ve programın UV detektör 260 nm'de okumak için. alet yöntemi kaydedin ve yöntem kümesi kaydetmek için adım 4.4 açıklandığı gibi aynı prosedürü tekrarlayın ..
| Zaman | Akış hızı (ml / dakika) | % A | % B |
| 1.00 | 0 | 100 | |
| 3.74 | 1.00 | 0 | 100 |
| 13.71 | 1.00 | 15 | 85 |
| 17.00 | 1.00 | 100 | 0 |
| 20.00 | 1.00 | 100 | 0 |
Tablo 2: Çalışma örnek yöntemi. purin bileşiklerin HPLC ölçümü için çözücü değişim şematik gösterimi. devetüyü rengier: 7 mM amonyum asetat, pH 3.0. Tampon B: asetonitril.
- "Dosya" menüsünden "yeni bir örnek kümesi yöntemi" seçin, "run örnekleri" düğmesini seçin.
- "Boş" seçeneğini seçin ve (alıcısı içinde) flakon sayısı, örnek adı, enjeksiyon hacmi (50 ul) girin. "Yöntemi seti" sütun için daha önce kaydedilmiş bir yöntem setini seçin ve toplam çalışma süresini (dakika) girin.
Not: Her numune çalıştırmadan önce "yöntemi seti" sütununda dengeleme kolon metodu (Tablo 1) girin ve toplam çalışma süresini (dakika) girin.
Her bileşik için bir standart kalibrasyon eğrisi 5. Kuşak
- Boş (adenozin deaminaz içermeyen belirli bir serumsuz ortam) ve Tablo 1 ve Tablo 2'de tarif edilen yöntemler takip edilerek, her bir standart numune 50 ul enjekte edilir.
- dengeleme sütunu kullanınyöntem (Tablo 1) önce her numune çalışması ve yeterli zirve ayırma elde etmek için Tablo 2'de anlatılan degrade koşulları belirlemektedir. Bu HPLC koşulları altında AMP, ADO ve INO bildirilen tutma süreleri için Tablo 3'e bakınız.
| Tutma Süresi | λ max | |
| AMP | 8.00 dakika | 260 |
| BEN HAYIR | 11.00 dakika | 260 |
| ADO | 11.90 dk | 260 |
Tablo 3: purin bileşiklerinin tutma süreleri AMP, ADO ve INO için gözlemlenen tipik tutma süreleri verir.. UV detektörü 260 nm'de okunmuştur için programlanmıştır.
- HPLC yazılımı ve "entegre" seçeneği yanındaki "süreç" düğmesini seçerek farklı konsantrasyonlarda AMP, ADO ve INO zirve bölgeyi belirleyin. Alternatif el ile her tepe başlangıç ve bitiş noktalarını işaretleyin.
- Dokuz noktalı bir kalibrasyon eğrisi elde etmek için, her bir standart nominal konsantrasyonuna karşı pik alanları alanı (100, 50, 25, 10, 5, 2.5, 1, 0.5, 0.25 uM).
- AMP, ADO ve INO için düz bir çizgi denklemi hesaplayın: y = mx + b,
X uM konsantrasyonu, y ise pik alanına karşılık gelmektedir.
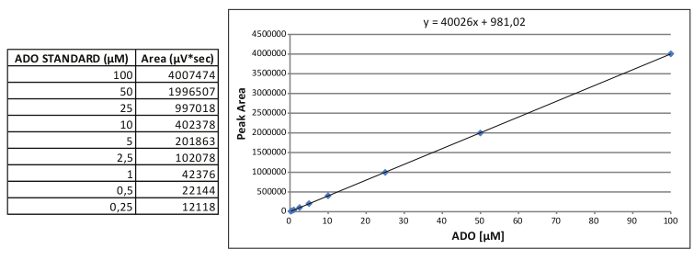
Bir iç standart eğrinin Şekil 2. Nesil. Temsili kalibrasyon standardı ADO eğrisi ve elde edilen göreli denklemi. Onu tıklayınızE bu rakamın daha büyük bir versiyonunu görmek için.
Substrat ile İnhibitörleri ve İnkübasyon 6. Tedavi öncesi (AMP)
- CD73, ADA inhibisyonu ve nükleosid taşıyıcılar, tekrar süspansiyon olmayan AMP tüketimi ADO ve INO üretimini test etmek için, 2 x 10 6 CD19 + / CD5 + CLL hücreleri (izole edilmiş ve adım 1 saflaştırıldı ve 2) serumsuz ortam 250 ul ve 48 çukurlu bir levhanın levha hücreleri (ya da 1.5 ml mikrosantrifüj tüpü içinde).
- CD73 enzimatik aktivitesini engellemek için, 1 seyreltin: 1.000 APCP (10 mM) stok çözeltisi, kültür ortamı içinde 10 uM nihai konsantrasyon elde edildi. APCP içeren kültür ortamı 250 ul 2 x 10 6 CLL hücreleri yeniden süspanse edin ve bir hücre kültürü inkübatöründe 37 ° C'de 60 dakika ön işleme tabi.
- INO halinde ADO dönüşümünü engellemek için, 1 seyreltin: 1000 serumsuz ortam içinde EHNA hidroklorür ve / veya dCF stok çözeltisi (her ikisi de 10 mM), 10 uM nihai konsantrasyona sahip olmak üzere.EHNA ve / veya DCF içeren kültür ortamında 250 ul 2 x 10 6 KLL hücreleri tekrar süspansiyon. Hücre kültürü kuluçka makinesi içinde 37 ° C'de 30 dakika süreyle inkübe edilir.
- 10 uM nihai konsantrasyona sahip olacağı şekilde, serum içermeyen ortam içinde dipiridamol 1000 stok çözeltisi (10 mM): nükleosid taşıyıcıları aracılığıyla ADO alımını engellemek için, 1 seyreltin. Kültür ortamı ihtiva eden dipiridamol 250 ul 2 x 10 6 CLL hücreleri yeniden süspanse edin ve hücre kültürü kuluçka makinesi içinde 37 ° C'de 30 dakika inkübe edilir.
- APCP, EHNA, dCF tek çözüm hazırlayın ve dipiridamol 1 seyreltilmiş: 1000 400 uM AMP.
- 200 uM AMP bir nihai konsantrasyon elde etmek için 400 uM AMP veya AMP artı önleyicileri 250 ul ekleyin. alt madde yokluğunda bir koşul boş numune olarak kullanılmak üzere içerir.
- 30 ile 37 ° C 'de 60 dakika kadar inkübe edin.
Not: AMP ve inkübasyon süresi optimal konsantrasyonu deneysel olarak tespit edilmiştir. - tO, İnkübasyon süresi sonunda (buz üzerinde), soğuk mikrosantrifüj tüpleri içinde yüzer 500 ul toplamak ve hemen 5 dakika boyunca 4 ° C'de 17,000 x g'de santrifüjlenir.
- Yeni 1.5 ml mikrosantrifüj tüpler süpernatantlar aktarın ve hemen -80 ° C'de saklamak veya HPLC çalışır hazırlık örnek geçin.
7. Numuneler, HPLC Hazırlık
- 0.2 um şırınga filtreleri ile yeni bir 1.5 ml mikrosantrifüj tüplerine süpernatantlar filtre. filtreleme için 1 ml şırınga kullanın.
- HPLC sistemi, bir otomatik numune alıcı ile donatılmış ise, HPLC için cam şişeleri hazırlanması ve numunenin küçük miktarlar için 0.1 ml mikro uçlar kullanın.
- Transfer mikropipet veya cam Pasteur pipeti ile bir cam şişe içinde, örneğin, en az 100 ul. kabarcıklar olmadan aktarmak ve vidalı kapaklı şişeyi kapatın için dikkatli olun.
- Örnekler Şimdi, RP-HPLC ile analiz için hazırdır.
8. HPLC measuPürin rements
- "Run örnekleri" düğmesini seçin; "Dosya" menüsünden "yeni bir örnek kümesi yöntemi" seçin.
- "Boş" seçeneğini seçin ve gösterir: (alıcısı içinde) flakon sayısı, örnek adı, enjeksiyon hacmi (50 ul).
- Dengelenme sütun yöntemi ve Tablo 1 ve Tablo 2'de anlatılan çalışma örnek yöntemini seçin, sırasıyla aşağıdaki tüm boş ve örnek koşular için.
Not: her bir örnek çalışma önce dengeleme kolon metodu (Tablo 1) ayarlar. - Boş (serumsuz ortam) ve her bir örneğin 50 ul enjekte edilir.
- Her numunedeki pürin konsantrasyonunu belirlemek Tablo 3'te tarif edilen tutma zamanlarda pik alanları elde ederek AMP, ADO ve INO ölçmek.
- "Süreç" düğmesini ve "entegre" seçeneği yanındaki seçin. Bir başlangıç Alternatif elle seçmekHer bir tepe nd bitiş noktaları alan ölçümünü elde etmek. Bu tepe başlangıç ve bitiş noktaları arasında bir çizgi izleme yapılır.
- Standart eğri için elde edilen denklem uygulanarak uM konsantrasyonunu belirlemek: y = x uM konsantrasyonunu temsil eder ve Y, bilinmeyen bir örnek ölçülen tepe alanı mx + b.
Not: ADO kalibrasyon standart eğri bir örneği, Şekil 2'de rapor edilir: X = (y alan - 981,02) / 40026
- AMP umol hesaplamak 2 x 10 6 hücre ortamı 0.500 ml yeniden süspansiyon haline olduğu göz önüne alındığında, ADO ve INO tüketilen ve / veya aşağıdaki oranını tatbik 10 6 CLL hücreleri tarafından üretilen:
umol: 1000 ml = X umol: 0.250 mi
Not: 1.000 ml umol (sayı 1 L umol) uM konsantrasyonuna eşittir ve x, nu umol olan bölgesinincleotide veya nükleosit 10 6 hücre ile üretilir.- Son olarak, 10 6 KLL hücreleri tarafından tüketilen ve / veya üretilen nmol içine umol dönüştürmek:
nmol = umol x 1.000
- Son olarak, 10 6 KLL hücreleri tarafından tüketilen ve / veya üretilen nmol içine umol dönüştürmek:
Sonuçlar
Bir Örnek CLL hastadan taze saflaştınldı PBMC'ler lösemik hücrelerin yüzdesini (%) değerlendirmek için, hücreler, anti-CD19 ve anti-CD5 antikorlar ile işaretlenmiştir. Şekil 3'ün sol panel canlı hücreler üzerinde seçici kapısı ile sitoflüorimetrik nokta grafiğidir. 3 önce (orta panel), bir CLL hastadan PBMC örneği göstermektedir ve sonrası (sağ panel), B hücresi saflaştırılması.
Tartışmalar
Burada açıklanan protokol saflaştınlmış insan lösemi hücreleri, hücre kültür ortamı içinde CD39 / CD73 adenozinerjik makine etkinliğini değerlendirmek için izin verir. Bu HPLC yöntemi ile, takip ve kantitatif ADO (CD73-bağımlı) ve INO olan sonraki bozulma (CD26 / ADA bağlıdır) enzımatik oluşma ölçebilir. enzim inhibitörlerinin kullanılması protokolü kontrol etmek ve iç kontrol etmenizi sağlar. Bu protokolün avantajları ve yenilikleri de ii) kültür ortamı az miktarda gerektirir ve ii...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
Bu çalışma Associazione Italiana Ricerca Yengeç (IG # 12754) tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Human blood | |||
| Milli-Q water | Millipore | double deionised water | |
| Ficoll-Paque Plus | GE-Healthcare | 17-1440-03 | |
| purified anti-CD3, -CD14, -CD16 | made in-house | mouse monoclonal | |
| PE-labeled anti-CD19 | Miltenyi Biotec | 120-014-229 | |
| FITC-labeled anti-CD5 | Miltenyi Biotec | 130-096-574 | |
| Dynabeads sheep anti-mouse IgG | Invitrogen | 11031 | |
| Phosphate-buffered saline (PBS) | Amresco | E404-200TABS | tablets |
| bovine serum albumin (BSA) | ID bio | 1000-70 | standard grade |
| isolation buffer | PBS 0.1% BSA 2 mM EDTA, pH 7.4 | ||
| AIM V serum free medium | GIBCO | 12055-091 | liquid (research grade) |
| adenosine 5’-diphosphate (ADP) | Sigma-Aldrich | A2754 | |
| adenosine 5’-monosphate (AMP) | Sigma-Aldrich | A1752 | |
| adenosine (ADO) | Sigma-Aldrich | A9251 | |
| inosine (INO) | Sigma-Aldrich | I4125 | |
| α,β-methylene-ADP (APCP) | Sigma-Aldrich | M8386 | CD73 inhibitor |
| EHNA hydrochloride | Sigma-Aldrich | E114 | adenosine deaminase inhibitor |
| Deoxycoformycin (dCF) | Tocris | 2033 | adenosine deaminase inhibitor |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Dipyridamole | Sigma-Aldrich | D9766 | nucleoside transporter inhibitor |
| acetonitrile (CHROMASOLV Plus) | Sigma-Aldrich | 34998 | HPLC-grade |
| ammonium acetate | Sigma-Aldrich | 9688 | 7 mM, pH 3.0 |
| hydrochloric acid | Sigma-Aldrich | 30721-1L | min. 37% |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Bürker cell counter | VWR | 631-0920 | hemocytometer |
| DynaMag-15 Magnet | Invitrogen | 12301D | Dynal magnetic bead separator |
| microcentrifuge safe-lock tubes | Eppendorf | 030-120-0086 | 1.5 ml |
| PET centrifuge tubes | Corning | 430053/430304 | 15 – 50 ml |
| Minisart RC4 syringe filters | Sartorius Stedim Biotech | 17821 | membrane 0.2 µm |
| short thread vials | VWR | 548-0029 | 1.5 ml/glass |
| micro-inserts | VWR | 548-0006 | 0.1 ml/glass |
| screw caps | VWR | 548-0085 | 9 mm/PP blue |
| Atlantis dC18 Column | Waters | 186001344 | 5 µm, 4.6 mm x 150 mm |
| Atlantis dC18 Guard Column | Waters | 186001323 | 5 µm, 4.6 mm x 20 mm |
| Waters Alliance 2965 Separations Module | Waters | HPLC separation module | |
| Waters 2998 Photodiode Array (PDA) Detector | Waters | UV detector | |
| Waters Empower2 software | Waters |
Referanslar
- Naganuma, M., Wiznerowicz, E. B., Lappas, C. M., Linden, J., Worthington, M. T., Ernst, P. B. Cutting edge: Critical role for A2A adenosine receptors in the T cell-mediated regulation of colitis. J Immunology. 177 (5), 2765-2769 (2006).
- Nemeth, Z. H., et al. Adenosine receptor activation ameliorates type 1 diabetes. FASEB J. 21 (10), 2379-2388 (2007).
- Fan, M., Jamal Mustafa, S. Role of adenosine in airway inflammation in an allergic mouse model of asthma. Int Immunopharmacol. 6 (1), 36-45 (2006).
- Csoka, B., et al. A2B adenosine receptors protect against sepsis-induced mortality by dampening excessive inflammation. J Immunol. 185 (1), 542-550 (2010).
- Peart, J. N., Headrick, J. P. Adenosinergic cardioprotection: multiple receptors, multiple pathways. Pharmacol Ther. 114 (2), 208-221 (2007).
- Ohta, A., et al. A2A adenosine receptor protects tumors from antitumor T cells. Proc Natl Acad Sci U S A. 103 (35), 13132-13137 (2006).
- Hasko, G., Linden, J., Cronstein, B., Pacher, P. Adenosine receptors: therapeutic aspects for inflammatory and immune diseases. Nat Rev Drug Discov. 7 (9), 759-770 (2008).
- Cronstein, B. N. Adenosine, an endogenous anti-inflammatory agent. J Appl Physiol (1985). 76 (1), 5-13 (1994).
- Molina-Arcas, M., Casado, F. J., Pastor-Anglada, M. Nucleoside transporter proteins. Curr Vasc Pharmacol. 7 (4), 426-434 (2009).
- Deaglio, S., et al. Adenosine generation catalyzed by CD39 and CD73 expressed on regulatory T cells mediates immune suppression. J Exp Med. 204 (6), 1257-1265 (2007).
- Linden, J. Regulation of leukocyte function by adenosine receptors. Adv Pharmacol. 61, 95-114 (2011).
- Antonioli, L., Blandizzi, C., Pacher, P., Hasko, G. Immunity, inflammation and cancer: a leading role for adenosine. Nat Rev Cancer. 13 (12), 842-857 (2013).
- Antonioli, L., Csoka, B., Fornai, M., et al. Adenosine and inflammation: what's new on the horizon. Drug Discov Today. 19 (8), 1051-1068 (1051).
- Chiorazzi, N., Rai, K. R., Ferrarini, M. Chronic lymphocytic leukemia. N Engl J Med. 352 (8), 804-815 (2005).
- Abousamra, N. K., Salah El-Din, M., Hamza Elzahaf, E., Esmael, M. E. Ectonucleoside triphosphate diphosphohydrolase-1 (E-NTPDase1/CD39) as a new prognostic marker in chronic lymphocytic leukemia. Leuk Lymphoma. 56 (1), 113-119 (2015).
- Serra, S., et al. CD73-generated extracellular adenosine in chronic lymphocytic leukemia creates local conditions counteracting drug-induced cell death. Blood. 118 (23), 6141-6152 (2011).
- Chen, L. S., Keating, M. J., Gandhi, V. Blood collection methods affect cellular protein integrity: implications for clinical trial biomarkers and ZAP-70 inn CLL. Blood. 124 (7), 1192-1195 (2014).
- Kalina, T., et al. EuroFlow standardization of flow cytometer instrument settings and immunophenotyping protocols. Leukemia. 26 (9), 1986-2010 (2012).
- Deaglio, S., et al. CD38 and ZAP-70 are functionally linked and mark CLL cells with high migratory potential. Blood. 110 (12), 4012-4021 (2007).
- Sachsenmeier, K. F., et al. Development of a novel ectonucleotidase assay suitable for high-throughput screening. J Biomol Screen. 17 (7), 993-998 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır