Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
ВЭЖХ на основе анализа для мониторинга внеклеточного нуклеотидную / нуклеозид Метаболизм в человека хронический лимфолейкоз клеток
В этой статье
Резюме
The protocol described here represents an easy and reproducible method that employs reverse phase high-performance liquid chromatography (RP-HPLC) to measure purine metabolism on chronic lymphocytic leukemia (CLL) cells cultured under different conditions.
Аннотация
Этот метод описан чувствительный, специфический, надежный и воспроизводимый обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) анализа, разработанной и апробирован для количественного определения внеклеточных пуриновых нуклеотидов и нуклеозиды, полученные очищенном хронического лимфолейкоза (ХЛЛ) клеток при различных условиях культивирования , Хроматографическое разделение аденозин-5'-монофосфат (АМФ), аденозин (АДО) и инозин (ИНО) проводят при комнатной температуре на, обращенно-фазовой колонке на основе диоксида кремния, который используется для полярного удержания соединения. Способ включает в себя двоичную подвижную фазу, которая состоит из 7 мМ ацетата аммония и ацетонитрила, при скорости потока 1,00 мл / мин. Элюаты контролируют с помощью УФ-детектора Фотодиод установку настроек при длине волны 260 нм. Стандартной калибровочной кривой, генерируется для вычисления уравнения для аналитического определения количества каждого пуринового соединения. Система управления, сбора и анализа данных, затем выполняется. Применяя этот протокол, А.М.P, ИНО и АДО вымывается на 7, 11 и 11,9 мин соответственно, а общее время выполнения для каждого образца составляет 20 мин. Этот протокол может быть применен для различных типов клеток и клеточных линий (как подвесные и прилипшие), с использованием культуральной среды в качестве матрицы. Преимущества легко и быстро пробоподготовки и требование небольшого количества супернатанта для анализа. Кроме того, использование сыворотки среде позволяет пропускать стадию осаждения белка с ацетонитрилом, который влияет на конечную концентрацию пуриновых соединений. Одним из недостатков этого метода является требование колонки уравновешивающим выполняется перед каждым один прогон образца, в результате чего общее время выполнения эксперимента больше и предотвращение приложений скрининга высокой пропускной способностью.
Введение
Аденозин (ADO) представляет собой пуриновый нуклеозид с молекулой-аденин прикрепленной к молекуле рибозы фрагмента сахара через гликозидной связи. Когда они присутствуют во внеклеточной среде, он защищает клетки от чрезмерного повреждения под действием иммунной системы. Эта роль была подчеркнута использованием различных моделей заболеваний, таких как колит 1, сахарный диабет 2, астма 3, сепсис 4 и ишемического повреждения 5. Одной из главных функций ADO является ингибирование иммунного ответа у опухоли микроокружения, способствуя опухоли иммунной уклонением 6. По этой причине, механизмы , участвующие в формировании восклицания и сигнализации представляют значительный терапевтический интерес 7.
ADO уровни в микросреде ткани являются относительно низкими в нормальных физиологических условиях, и, безусловно, ниже порога чувствительности иммунных клеток. Тем не менее, при гипоксии, ишемии, воспаление, инфекция, метаболическийстресс и трансформация опухоли быстро растут 8. Повышенные уровни внеклеточного ADO в ответ на сигналы ткани-возмущающих имеют двойную функцию: сообщать повреждение тканей в аутокринном и паракринной образом и генерировать ответы тканей, которые обычно можно рассматривать как Цитопротекторное.
Внеклеточный АДО может быть сформирован с помощью различных механизмов, которые включают высвобождение из внутриклеточных , опосредованных нуклеозидов транспортеров 9 или накопления из - за нарушенного деградации эксплуатируемых аденозиндезаминазы. Основной путь, ведущий к увеличению внеклеточного АДО уровней включает в себя действие каскада ectonucleotidases, которые связаны мембранные эктоэнзимов генерирующие ADO путем phosphohydrolysis нуклеотидов, освобожденных из мертвых или умирающих клеток. Этот путь проходит через последовательного действия CD39 (ectonucleoside трифосфат diphosphohydrolase-1), который преобразует внеклеточного аденозин-5'-трифосфата (АТФ) или аденозин 5'-дифосфат (АДФ) с аденозин 5'-монофосфата (AMP) и CD73 (5'-нуклеотидазе), который преобразует AMP в ADO 10.
Внеклеточной ADO вызывает свои физиологические реакции путем связывания с четырьмя трансмембранных рецепторов ADO, а именно A1, A2A, A2B и А3. Каждый рецептор имеет различные сродством к АДО и специфическим распределением ткани. Все рецепторы имеют семь трансмембранных доменов, и являются G-белок, соединенный с внутриклеточными ГТФ-связывающих белков (G белки), которые могут индуцировать (белок Гс) или ингибируют (Gi белка) активность аденилатциклазы и, в дальнейшем, производство внутриклеточного цАМФ. Таким образом, изменения в цитоплазме влияния уровней цАМФ на внутриклеточный активности протеинкиназы во время физиологических реакций 11. В физиологических условиях внеклеточного АДО ниже 1 мкМ, который может активировать без разбора A1, A2A и рецепторы A3. Тем не менее, активация A2B подтипа требует значительно выше,Концентрации нуклеозида, такие как те, которые генерируются в патофизиологических условиях. В качестве альтернативы, внеклеточный АДО может разлагаться до инозина (ИНО) путем аденозиндезаминазы (ADA) и CD26, в АДА комплексообразующего белка локализирующем ADA на поверхности клетки. Другая возможность состоит в том, что ADO интернализируется клеткой через equilibrative нуклеозидов транспортеров (ЛОР) и фосфорилируется до АМФ по АДО киназы белка 12,13.
Целью данного протокола является описание аналитического метода обратной фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) для количественного определения в одном запуске АМП субстрат и продукты ADO и INO, а порождена лимфоцитов человека. Наш опыт был первоначально получен с использованием клеток от хронического лимфолейкоза (ХЛЛ) пациентов, которые характеризуются расширением зрелого населения CD19 + / CD5 + B - лимфоцитов , экспрессирующих CD39 конститутивно 14,15. Мы показали около 30%ХЛЛ пациенты выражают ectoenzyme CD73 и что этот фенотип коррелирует с плохим прогнозом 16. Это субпопуляции лейкозных клеток коэкспрессирующей CD39 и CD73 может активно продуцируют внеклеточный ADO из АДФ и / или AMP. Преинкубация CD73 + клеток ХЛЛ с а, β-метилен-АДФ (APCP), известный ингибитор ферментативной активности CD73, полностью блокирует синтез внеклеточного АДО , подтверждающий , что CD73 представляет собой узкость фермент этого каскада 16.
ХЛЛ клетки также выражают ADA и ADA комплексообразования белка CD26, которые отвечают за превращение в ADO ИНО. Используя специфические ингибиторы ADA, такие как эритро-9- (2-гидрокси-3-нонил) Я wiadenine (EHNA) гидрохлорид и deoxycoformycin (DCF), можно блокировать внеклеточный деградацию СУЕТЫ в ИНО. Кроме того, предварительная обработка ингибитором ADA в сочетании с дипиридамолом, который блокирует нуклеозидов транспортеров, усиливает накопление в клетке ADOСупернатанты.
Мы затем распространили этот протокол в клетки, полученные из других родов, в том числе Т-лимфоцитов и миелоидных клеток, подтверждающих CD73-зависимого производства ADO. Эти данные позволяют предположить , что этот протокол ВЭЖХ является универсальным и что он может быть применен к дифференцировки различных клеток , и в различных условиях культивирования (рисунок 1).
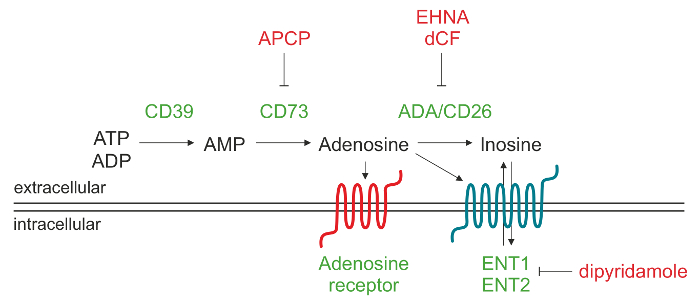
Рисунок 1. Схематическое изображение ферментативного механизма отвечает за внеклеточного АДО. Аденозин - 5'-трифосфата (АТФ) , и / или аденозин 5'-дифосфат (АДФ) может разлагаться под действием CD39 на аденозин 5'-монофосфат (АМФ), который в свою очередь, преобразуется в CD73 нуклеозида аденозина (ADO). После того, как АДО производится во внеклеточном пространстве, он может повторно ввести клетку через нуклеозидов транспортеров (ЛОР), быть превращено в инозин (ИНО) илисвязываются с различными типами рецепторов P1 ADO. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
протокол
Образцы крови ХЛЛ получены в соответствии с ведомственным руководящим принципам и Хельсинкской декларации.
1. Выделение лейкозных лимфоцитах из крови Образцы ХЛЛ пациентов
- Соберите образец крови в гепарин натрия (зеленый-топ) трубки 17.
- Заварить 1: 3 разведение цельной крови с RT 1x фосфатным буферным раствором (PBS).
- Очищают мононуклеарные клетки периферической крови (РВМС) из образцов крови путем центрифугирования в градиенте плотности.
- Подложка 5 мл плотности центрифугирования сред (например, Ficoll) в центрифужную пробирку 15 мл и осторожно перевести 10 мл разведенной крови. Сразу центрифуге при 1500 х г в течение 20 мин при комнатной температуре.
- Отберите часть надосадочной жидкости с помощью стеклянной пипетки Пастера, соединенный с вакуумным насосом и собирать РВМС кольцо в интерфазе между плотностью центрифугирование сред и разреженной плазмы с 5 мл пипетки. Переезд в 50 мл центрифужные пробирки и промывают PBS (50 мл конечный объем). Центрифуга при 500 мкг в течение 5 мин при температуре 4 ° С.
- Аспирата супернатант со стеклянной пипетки Пастера, ресуспендируют осадок в 50 мл PBS и подсчета клеток с помощью гемоцитометра.
- Пятно МНПК с анти-CD19 и -CD5 антитела для проточной цитометрии после стандартного протокола для иммунным окрашиванием и проверить РВМС субпопуляционной композиции 18.
Примечание: ХЛЛ лимфоциты CD19 + / CD5 +. - Проверьте% от CD19 + / CD5 + клеток с использованием проточного цитометра 18. Очищают В - лимфоциты от пациентов с ≥95% CD19 + / CD5 + лейкозных клеток после инструкции подробно описанные в шаге 2 для отрицательной изоляции В - клеток 19.
2. Очистка лейкозных В-клеток изоляция в условиях отрицательного
- Ресуспендируют 10 7 РВМС / мл в PBS 0,1% бычьего сывороточного альбумина (БСА) 2 мМ ЭДТА, рН 7,4 (буфер) изоляции.
- Добавить 101; г мышиных моноклональных антител к CD3, -CD14 и -CD16 первичными антителами в течение 10 7 клеток и инкубируют в течение 30 мин при температуре 4 ° С.
- Промывают клетки с буфером изоляции и центрифуге при 500 мкг в течение 5 мин при 4 ° C.
- Ресуспендируют клеток в буфере изоляции при 10 7 РВМС / мл.
- Перед инкубацией с клетками, ресуспендируют Sheep анти-мышиного IgG магнитные шарики во флаконе. Перенести 100 мкл шариков на 10 7 клеток в пробирку.
- Добавить 1 мл буфера изоляции и поместите пробирку в магнитный держатель в течение 1 мин. Жидкость над осадком сливают с 5 мл пипетки.
- Снимите трубку от магнита и ресуспендируют промытый бусин в 100 мкл буфера изоляции.
- Инкубируют 10 7 клеток с 100 мкл магнитных гранул в течение 30 мин при температуре 4 ° С при осторожном наклона и поворота.
- Поместите пробирку в держатель магнита в течение 2 мин и переносят супернатант с несвязанных клеток CD19 + / CD5 +в новую пробирку с 5 мл пипетки.
- В конце протокола изоляции, окрасить 100 мкл клеток с анти-CD19 и -CD5 антитела для проточной цитометрии и инкубировать 30 минут при 4 ° С. Промывают клетки с 3 мл ФБС 1% БСА, отбрасывать избыток супернатанта и проверить чистоту клеток B снова с помощью проточной цитометрии 19.
Примечание: Выполнить дополнительный отрицательный стадии выделения, если чистота В-клеток ниже, чем 95%.
3. Подготовка стандартных и ингибиторов маточных растворов
- Для подготовки AMP, отвесить 0.00345 г AMP и растворить его в 5 мл бессывороточной среды, чтобы иметь 2 мМ стандартного раствора AMP.
- Для подготовки ADO, отвесили 0,00265 г восклицания и растворить его в 5 мл бессывороточной среды, чтобы иметь 2 мМ стандартного раствора ADO.
- Для подготовки INO, отвесили 0,00268 г ИНО и растворить его в 5 мл бессывороточной среды, чтобы иметь 2 мМ стандартного раствора ИНО.
- Подготовьте 400 мкМ раствор AMP, ADO иИНО путем смешивания 1 мл 2 мМ исходного раствора в 4 мл не содержащей сыворотки среде (5 мл конечного объема).
- Сделать 1: 4 разбавление каждого 400 мкМ стандартного раствора для получения концентрации 100 мкм с помощью пипетки 500 мкл раствора 400 мкМ в 1500 мкл не содержащей сыворотки среде (2 мл конечный объем).
- Готовят серийные разведения каждого соединения в среде без сыворотки, чтобы получить следующие концентрации: 100 мкМ - 50 мкМ - 25 мкМ - 10 мкМ - 5 мкМ - 2,5 мкМ - 1 мкМ - 0,5 мкМ - 0,25 мкМ.
Примечание: Например, пипеткой 1 мл раствора 100 мкМ в 1 мл не содержащей сыворотки среде (1: 2) для разбавления, чтобы получить 50 мкМ концентрации и продолжить с остальными разведений.
- Готовят 10 мМ исходного раствора APCP, растворенного в PBS; Аликвоту и запас на - 30 ° C.
- Готовят 10 мМ исходные растворы EHNA гидрохлорида, ДДП и дипиридамол, растворенное в диметилсульфоксиде (ДМСО); Аликвоту и запас при -30° С.
4. Программа Метод ВЭЖХ
- Готовят ацетатный буфер аммония 7 мМ растворением 0,770 г ацетата аммония в 2 л дважды деионизованной водой (буфер A). Отрегулировать до рН 3,0 с помощью хлористоводородной кислоты.
- Приготовьте стеклянную бутылку, содержащую, по меньшей мере 2 л сверхчистой ацетонитрила для ВЭЖХ (буфер B) и подключить колонку охраны и колонка ВЭЖХ.
Примечание: Столбцы и буферы при комнатной температуре, а в использовании. - Войдите в программное обеспечение высокоэффективной жидкостной хроматографии и нажмите кнопку "Выбор проекта". Перейдите в меню "Файл" и выберите "новый метод", а затем "метод" инструмента.
- Программа уравновешивание метод колонки в соответствии с таблицей 1. Установка скорости потока 1,00 мл / мин и запрограммировать УФ - детектора , чтобы читать при длине волны 260 нм. Сохраните метод инструмента и снова выберите "новый метод" из меню "Файл", а затем "метод набора". Выберите метод инструмента ранее сохраненногои сохранить текущий метод набора с тем же именем.
| Время | Скорость потока (мл / мин) | % A | % В |
| 1,00 | 100 | 0 | |
| 1,24 | 1,00 | 100 | 0 |
| 6,22 | 1,00 | 2 | 98 |
| 18.65 | 1,00 | 2 | 98 |
Таблица 1: Уравновешивание метод колонки Схематическое представление растворителя изменений для уравновешивания колонки.. Буфер А: 7 мМ ацетата аммония, рН 3,0. Буфер В: ацетонитрил.
- Повторите шаг 4.3 для программирования метод запуска образца, указанного в таблице 2. Установите скорость потока 1,00 мЛ / мин и программа УФ-детектор для чтения при 260 нм. Сохранить метод инструмента и повторите ту же процедуру, как описано в шаге 4.4 для сохранения заданного метода ..
| Время | Скорость потока (мл / мин) | % A | % В |
| 1,00 | 0 | 100 | |
| 3,74 | 1,00 | 0 | 100 |
| 13.71 | 1,00 | 15 | 85 |
| 17.00 | 1,00 | 100 | 0 |
| 20.00 | 1,00 | 100 | 0 |
Таблица 2: Выполнить метод выборки. Схематическое представление растворителя изменений для измерения ВЭЖХ пуриновых соединений. любительэр А: 7 мМ ацетата аммония, рН 3,0. Буфер В: ацетонитрил.
- Нажмите кнопку "Run Samples", выберите "новый набор образцов метод" из меню "Файл".
- Выберите "пустой" опцию и введите номер флакона (в автосамплера), имя образца, объем впрыска (50 мкл). Выберите набор метод, сохраненный ранее в колонке "Метод набора" и введите общее время работы (мин).
Примечание: Введите метод столбца уравновешивания (таблица 1) в колонке "Метод набора" перед каждым образца прогона и введите общее время работы (мин).
5. Формирование кривой калибровочного стандарта для каждого соединения
- Вводят 50 мкл заготовки (специфической среде без сыворотки, которая не содержит аденозиндезаминазу) и каждого стандартного образца , следуя методикам , описанным в таблице 1 и таблице 2.
- Используйте столбец уравновешиванияМетод (Таблица 1) перед каждой пробы спуска и установки условий градиента , описанных в таблице 2 , чтобы получить адекватное разнесение вершин. Обратитесь к таблице 3 для зарегистрированных времен удерживания AMP, ADO и ИНО в этих условиях ВЭЖХ.
| Время удержания | λ макс | |
| AMP | 8.00 мин | 260 |
| Я НЕ | 11.00 мин | 260 |
| АДО | 11.90 мин | 260 |
Таблица 3: Времена удерживания пуриновых соединений Типичное время удерживания , наблюдаемые для AMP, ADO и ИНО.. УФ-детектор запрограммирован для чтения при длине волны 260 нм.
- Определить площадь пика AMP, ADO и ИНО в различных концентрациях, выбирающих кнопку "процесс" в программном обеспечении высокоэффективной жидкостной хроматографии и рядом с опцией "интегрировать". Можно также выбрать вручную начальные и конечные точки каждого пика.
- Участок площади пиков по отношению к номинальной концентрации каждого стандарта, чтобы получить девяти точек калибровочной кривой (100, 50, 25, 10, 5, 2,5, 1, 0,5, 0,25 мкМ).
- Вычислить уравнение прямой линии для AMP, ADO и ИНО: у = тх + Ь,
где х означает концентрацию мкМ и Y соответствуют площади пика.
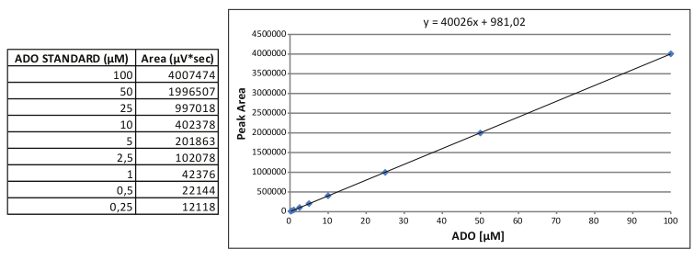
Рисунок 2. Формирование внутренней стандартной кривой. Представитель стандарт калибровочной кривой для ADO и относительное уравнение , полученное. Пожалуйста , нажмите еее, чтобы просмотреть большую версию этой фигуры.
6. Предварительная обработка с ингибиторам и инкубацию с субстратом (АМФ)
- Для тестирования AMP потребления, ADO и генерацию INO без ингибирования CD73, ADA и нуклеозидов транспортеров, Ресуспендируют 2 х 10 6 CD19 + / CD5 + ХЛЛ клетки (выделяют и очищают на стадиях 1 и 2) в 250 мкл бессывороточной среды и пластина клеток в 48-луночный планшет (или в 1,5 мл трубки микроцентрифужных).
- Для того, чтобы блокировать ферментативную активность CD73, разбавленным 1: 1000 Исходный раствор APCP (10 мМ) в культуральной среде для получения конечной концентрации 10 мкМ. Ресуспендируют 2 х 10 6 клеток ХЛЛ в 250 мкл культуральной среды , содержащей APCP и предварительной обработки 60 мин при 37 ° С в инкубаторе для клеточных культур.
- Для того, чтобы блокировать превращение в ADO INO, разбавленным 1: 1000 Исходный раствор EHNA гидрохлорида и / или DCF (как 10 мМ) в среде без сыворотки, чтобы получить конечную концентрацию 10 мкМ.Ресуспендируют 2 х 10 6 клеток ХЛЛ в 250 мкл культуральной среды , содержащей EHNA и / или DCF. Инкубировать в течение 30 мин при 37 ° С в инкубаторе для клеточных культур.
- Для того, чтобы блокировать поглощение через ADO нуклеозида транспортеров, разбавленным 1: 1000 Исходный раствор дипиридамола (10 мМ) в среде без сыворотки, чтобы получить конечную концентрацию 10 мкМ. Ресуспендируют 2 х 10 6 клеток ХЛЛ в 250 мкл культуральной среды , содержащей дипиридамол и инкубировать в течение 30 мин при 37 ° С в инкубаторе для клеточных культур.
- Подготовить единичные решения APCP, EHNA, DCF и дипиридамол разводили 1: 1000 в 400 мкМ AMP.
- Добавьте 250 мкл 400 мкМ AMP или AMP плюс ингибиторов, чтобы получить конечную концентрацию 200 мкМ AMP. Включить условие в отсутствие субстрата для использования в качестве холостой пробы.
- Инкубировать от 30 до 60 мин при температуре 37 ° С.
Примечание: Оптимальная концентрация АМФ и времени инкубации были определены экспериментально. - В тон окончании времени инкубации, собирают 500 мкл супернатанта в холодных микропробирок (на льду) и немедленно центрифугировать при 17000 х г при температуре 4 ° С в течение 5 мин.
- Передача супернатанты в новых 1,5 мл микропробирок и немедленно хранят при -80 ° С или приступить к подготовке образцов для прогонов ВЭЖХ.
7. Образцы Подготовка для высокоэффективной жидкостной хроматографии
- Фильтр супернатанты в новых 1,5 мл микропробирок с шприцами фильтрами 0,2 мкм. Используйте 1 мл шприцы для фильтрации.
- Если система ВЭЖХ снабжена автоматическим пробоотборником, готовят стеклянные флаконы для ВЭЖХ и используют 0,1 мл микро-вставки для небольших объемов образца.
- Передача по меньшей мере, 100 мкл образца в стеклянной пробирке с помощью микропипетки или стеклянной пипетки Пастера. Будьте осторожны, чтобы передать без пузырьков и закройте флакон с завинчивающейся крышкой.
- Образцы теперь готовы для анализа с помощью ОФ-ВЭЖХ.
8. ВЭЖХ колбыбований пуринов
- Нажмите кнопку "Run" образцов; выберите "новый набор образцов метод" из меню "Файл".
- Выберите "пустой" опцию и указать: номер флакона (в автосамплера), имя образца, объем впрыска (50 мкл).
- Выберите метод уравновешивания колонки и метод запуска образца , описанного в таблице 1 и таблице 2, соответственно, для всех пустых и выборочных трасс , которые следуют.
Примечание: Установить метод колонки уравновешивающим (таблица 1) перед каждым образца прогона. - Вводят 50 мкл заготовки (не содержащей сыворотки среде) и каждого образца.
- Определить концентрацию пуринов в каждом образце, количественно AMP, ADO и INO путем получения площадей пиков при времени удерживания , описанных в таблице 3.
- Нажмите кнопку "процесс" и следующий вариант "интеграции". В качестве альтернативы выбрать Вручную начатьй конечные точки каждого отдельного пика для получения измерения площади. Это делается путем отслеживания линии между начальной и конечной точками пика.
- Определить концентрацию мкМ с применением уравнения , полученного для стандартной кривой: у = х + Ь, где х представляет собой концентрацию мкм и Y является площадь пика , измеренная от неизвестного образца.
Примечание: Пример калибровки стандартной кривой ADO сообщается на рисунке 2, где: х = (у площадь - 981,02) / 40026
- Учитывая , что 2 х 10 6 клеток ресуспендировали в 0,500 мл среды, вычислить мкмоль AMP, АДО и ИНО потребляться и / или производства 10 6 клеток ХЛЛ с использованием следующей пропорции:
мкмолей: 1000 мл = х мкмолей: 0,250 мл
Примечание: мкмолей в 1000 мл (количество мкмолей в 1 л) эквивалентны концентрации мкМ и х являются мкмолей нюcleotide или нуклеозид получают 10 6 клеток.- И, наконец, преобразовать в текущем нмоль мкмоль потребленных и / или производимых 10 6 клеток ХЛЛ:
нмоль = мкмолей х 1000
- И, наконец, преобразовать в текущем нмоль мкмоль потребленных и / или производимых 10 6 клеток ХЛЛ:
Результаты
Для того, чтобы оценить процент (%) лейкозных клеток в свежеочищенного МНПК от представителя пациента ХЛЛ, клетки помечены анти-CD19 и анти-CD5 антитела. На левой панели на фиг.3 представляет собой cytofluorimetric точечный участок с селективным затвором на живые клетки. Н...
Обсуждение
Протокол, описанный здесь, позволяет оценить активность CD39 / CD73 adenosinergic техники в среде для культивирования клеток из очищенных лейкозных клеток человека. С помощью этого метода ВЭЖХ мы можем следовать и количественно измерить ферментативную поколение ADO (CD73-зависимых) и его последующе...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Эта работа поддерживается Associazione Italiana Ricerca (IG Рак # 12754).
Материалы
| Name | Company | Catalog Number | Comments |
| Human blood | |||
| Milli-Q water | Millipore | double deionised water | |
| Ficoll-Paque Plus | GE-Healthcare | 17-1440-03 | |
| purified anti-CD3, -CD14, -CD16 | made in-house | mouse monoclonal | |
| PE-labeled anti-CD19 | Miltenyi Biotec | 120-014-229 | |
| FITC-labeled anti-CD5 | Miltenyi Biotec | 130-096-574 | |
| Dynabeads sheep anti-mouse IgG | Invitrogen | 11031 | |
| Phosphate-buffered saline (PBS) | Amresco | E404-200TABS | tablets |
| bovine serum albumin (BSA) | ID bio | 1000-70 | standard grade |
| isolation buffer | PBS 0.1% BSA 2 mM EDTA, pH 7.4 | ||
| AIM V serum free medium | GIBCO | 12055-091 | liquid (research grade) |
| adenosine 5’-diphosphate (ADP) | Sigma-Aldrich | A2754 | |
| adenosine 5’-monosphate (AMP) | Sigma-Aldrich | A1752 | |
| adenosine (ADO) | Sigma-Aldrich | A9251 | |
| inosine (INO) | Sigma-Aldrich | I4125 | |
| α,β-methylene-ADP (APCP) | Sigma-Aldrich | M8386 | CD73 inhibitor |
| EHNA hydrochloride | Sigma-Aldrich | E114 | adenosine deaminase inhibitor |
| Deoxycoformycin (dCF) | Tocris | 2033 | adenosine deaminase inhibitor |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Dipyridamole | Sigma-Aldrich | D9766 | nucleoside transporter inhibitor |
| acetonitrile (CHROMASOLV Plus) | Sigma-Aldrich | 34998 | HPLC-grade |
| ammonium acetate | Sigma-Aldrich | 9688 | 7 mM, pH 3.0 |
| hydrochloric acid | Sigma-Aldrich | 30721-1L | min. 37% |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Bürker cell counter | VWR | 631-0920 | hemocytometer |
| DynaMag-15 Magnet | Invitrogen | 12301D | Dynal magnetic bead separator |
| microcentrifuge safe-lock tubes | Eppendorf | 030-120-0086 | 1.5 ml |
| PET centrifuge tubes | Corning | 430053/430304 | 15 – 50 ml |
| Minisart RC4 syringe filters | Sartorius Stedim Biotech | 17821 | membrane 0.2 µm |
| short thread vials | VWR | 548-0029 | 1.5 ml/glass |
| micro-inserts | VWR | 548-0006 | 0.1 ml/glass |
| screw caps | VWR | 548-0085 | 9 mm/PP blue |
| Atlantis dC18 Column | Waters | 186001344 | 5 µm, 4.6 mm x 150 mm |
| Atlantis dC18 Guard Column | Waters | 186001323 | 5 µm, 4.6 mm x 20 mm |
| Waters Alliance 2965 Separations Module | Waters | HPLC separation module | |
| Waters 2998 Photodiode Array (PDA) Detector | Waters | UV detector | |
| Waters Empower2 software | Waters |
Ссылки
- Naganuma, M., Wiznerowicz, E. B., Lappas, C. M., Linden, J., Worthington, M. T., Ernst, P. B. Cutting edge: Critical role for A2A adenosine receptors in the T cell-mediated regulation of colitis. J Immunology. 177 (5), 2765-2769 (2006).
- Nemeth, Z. H., et al. Adenosine receptor activation ameliorates type 1 diabetes. FASEB J. 21 (10), 2379-2388 (2007).
- Fan, M., Jamal Mustafa, S. Role of adenosine in airway inflammation in an allergic mouse model of asthma. Int Immunopharmacol. 6 (1), 36-45 (2006).
- Csoka, B., et al. A2B adenosine receptors protect against sepsis-induced mortality by dampening excessive inflammation. J Immunol. 185 (1), 542-550 (2010).
- Peart, J. N., Headrick, J. P. Adenosinergic cardioprotection: multiple receptors, multiple pathways. Pharmacol Ther. 114 (2), 208-221 (2007).
- Ohta, A., et al. A2A adenosine receptor protects tumors from antitumor T cells. Proc Natl Acad Sci U S A. 103 (35), 13132-13137 (2006).
- Hasko, G., Linden, J., Cronstein, B., Pacher, P. Adenosine receptors: therapeutic aspects for inflammatory and immune diseases. Nat Rev Drug Discov. 7 (9), 759-770 (2008).
- Cronstein, B. N. Adenosine, an endogenous anti-inflammatory agent. J Appl Physiol (1985). 76 (1), 5-13 (1994).
- Molina-Arcas, M., Casado, F. J., Pastor-Anglada, M. Nucleoside transporter proteins. Curr Vasc Pharmacol. 7 (4), 426-434 (2009).
- Deaglio, S., et al. Adenosine generation catalyzed by CD39 and CD73 expressed on regulatory T cells mediates immune suppression. J Exp Med. 204 (6), 1257-1265 (2007).
- Linden, J. Regulation of leukocyte function by adenosine receptors. Adv Pharmacol. 61, 95-114 (2011).
- Antonioli, L., Blandizzi, C., Pacher, P., Hasko, G. Immunity, inflammation and cancer: a leading role for adenosine. Nat Rev Cancer. 13 (12), 842-857 (2013).
- Antonioli, L., Csoka, B., Fornai, M., et al. Adenosine and inflammation: what's new on the horizon. Drug Discov Today. 19 (8), 1051-1068 (1051).
- Chiorazzi, N., Rai, K. R., Ferrarini, M. Chronic lymphocytic leukemia. N Engl J Med. 352 (8), 804-815 (2005).
- Abousamra, N. K., Salah El-Din, M., Hamza Elzahaf, E., Esmael, M. E. Ectonucleoside triphosphate diphosphohydrolase-1 (E-NTPDase1/CD39) as a new prognostic marker in chronic lymphocytic leukemia. Leuk Lymphoma. 56 (1), 113-119 (2015).
- Serra, S., et al. CD73-generated extracellular adenosine in chronic lymphocytic leukemia creates local conditions counteracting drug-induced cell death. Blood. 118 (23), 6141-6152 (2011).
- Chen, L. S., Keating, M. J., Gandhi, V. Blood collection methods affect cellular protein integrity: implications for clinical trial biomarkers and ZAP-70 inn CLL. Blood. 124 (7), 1192-1195 (2014).
- Kalina, T., et al. EuroFlow standardization of flow cytometer instrument settings and immunophenotyping protocols. Leukemia. 26 (9), 1986-2010 (2012).
- Deaglio, S., et al. CD38 and ZAP-70 are functionally linked and mark CLL cells with high migratory potential. Blood. 110 (12), 4012-4021 (2007).
- Sachsenmeier, K. F., et al. Development of a novel ectonucleotidase assay suitable for high-throughput screening. J Biomol Screen. 17 (7), 993-998 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены