A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
المعالجة من Lignocellulosic الكتلة الحيوية مع منخفضة التكلفة أيوني السوائل
In This Article
Summary
The pretreatment of lignocellulosic biomass with protic low-cost ionic liquids is shown, resulting in a delignified cellulose-rich pulp and a purified lignin. The pulp gives rise to high glucose yields after enzymatic saccharification.
Abstract
A number of ionic liquids (ILs) with economically attractive production costs have recently received growing interest as media for the delignification of a variety of lignocellulosic feedstocks. Here we demonstrate the use of these low-cost protic ILs in the deconstruction of lignocellulosic biomass (Ionosolv pretreatment), yielding cellulose and a purified lignin. In the most generic process, the protic ionic liquid is synthesized by accurate combination of aqueous acid and amine base. The water content is adjusted subsequently. For the delignification, the biomass is placed into a vessel with IL solution at elevated temperatures to dissolve the lignin and hemicellulose, leaving a cellulose-rich pulp ready for saccharification (hydrolysis to fermentable sugars). The lignin is later precipitated from the IL by the addition of water and recovered as a solid. The removal of the added water regenerates the ionic liquid, which can be reused multiple times. This protocol is useful to investigate the significant potential of protic ILs for use in commercial biomass pretreatment/lignin fractionation for producing biofuels or renewable chemicals and materials.
Introduction
الطلب على الطاقة البشرية تلبية لنحو مستدام، هي واحدة من أكبر التحديات التي تواجه حضارتنا. ومن المتوقع استخدام الطاقة لمضاعفة في السنوات ال 50 المقبلة، ووضع مزيد من الضغط على موارد الوقود الأحفوري. 1 تراكم الغازات المسببة للاحتباس الحراري (غازات الدفيئة) في الغلاف الجوي من خلال استخدام الوقود الأحفوري واسعة الانتشار هو مشكلة خاصة، كما CO 2 الناتجة عن احتراق الوقود الأحفوري هي المسؤولة عن 50٪ من تأثير الدفيئة البشرية المنشأ. 2 لذلك، تطبيق على نطاق واسع من التقنيات محايدة المتجددة والكربون هو ضروري لتلبية الاحتياجات المتزايدة للطاقة والمواد الأجيال القادمة. 1، 3
الكتلة الحيوية النباتية هي الموارد المتجددة الأكثر تنوعا، كما أنها يمكن أن تستخدم لإنتاج الحرارة والكهرباء وكذلك المعتمدة على الكربون المواد الكيميائية والمواد والوقود. المزايا الأساسية للكتلة الحيوية lignocellulosic على أنواع الكتلة الحيوية الأخرى في وفرة، وقدرتها على عوائد عالية PEمنطقة ص الأراضي وغالبا بكثير أعلى التوفير انبعاث ثاني أكسيد الكربون 2، والذي يتضمن الحفاظ على نسبة عالية من الكربون في التربة. 4، 5 فوائد إضافية لاستخدام الكتلة الحيوية وتشمل التوفر في الأسواق المحلية، متطلبات رأس المال منخفضة لتحويل الكتلة الحيوية إلى الطاقة، ومنع تآكل التربة. 8
المنتجين الرئيسيين للمواد الأولية lignocellulosic هي صناعة الغابات والقطاع الزراعي، فضلا عن إدارة النفايات البلدية. 6 إنتاج مادة الخشب لديه القدرة على توسيعها، مع الاعتبار للحد من إزالة الغابات وتجنب استبدال المحاصيل الغذائية وإطلاق الملوثات المحتملة. 7 الكتلة الحيوية المتجددة لتصبح مصدرا واسع النطاق قابلة للحياة من وقود النقل السائلة والمواد الكيميائية، ويجب معالجته تصبح قادرة على المنافسة اقتصاديا مع تقنيات تحويل الوقود الأحفوري. 9، 10 مفتاح لتحقيق ذلك هو زيادة المحصول وجودة السلع الوسيطة المشتقة من الكتلة الحيوية مع الحد التكلفة.
تحتوي غنوسيللولوز على نسبة عالية من السكريات التي يمكن تحويلها إلى وقود ومواد كيميائية عن طريق التحويلات الحفازة والميكروبية. 11 هذه السكريات موجودة في غنوسيللولوز في شكل البوليمر كما السليلوز وهيميسيلولوز. ويمكن تحلل إلى جلوكوز وغيرها من السكر أحادية ومن ثم استخدامها لإنتاج الإيثانول وغيرها من المواد الكيميائية المشتقة من الحيوية والمذيبات. 12
من أجل الوصول إلى السكريات السليلوزية، المعالجة من الكتلة الحيوية اللازمة من خلال الفيزيائية والكيميائية، أو العمليات مجتمعة. 4 المعالجة يمكن القول إن الخطوة الأكثر تكلفة في تثمين الكتلة الحيوية lignocellulosic. ومن ثم البحث في عمليات المعالجة المحسنة أمر حتمي.
تتوفر تقنيات المعالجة المختلفة. ذات أهمية خاصة هي تلك التي تفصل بين اللجنين من السليلوز (المعالجة fractionative). اللجنين، المكون الرئيسي الثالث فيغنوسيللولوز، يحد من وصول hydrolyzing كلاء لالسليلوز وهيميسيلولوز ويقلل من محصول السكر للطن الواحد من المواد الخام. 11 ويمكن الاستفادة من اللجنين فصل بمثابة معامل تكرير أحيائية إضافي وسيطة إذا تم عزلها في نوعية مناسبة. 13 واحدة عملية fractionative هي عملية كرافت التي هي المعالجة الأكثر شيوعا لإنتاج الورق / السليلوز. في كرافت اللب، وتوضع رقائق الخشب في مزيج من هيدروكسيد الصوديوم وكبريتيد الصوديوم ويسخن في درجات حرارة مرتفعة حوالي 170 درجة مئوية تحت ضغط عال. 14 ردود الفعل قلوية إزالة هيميسيلولوز واللجنين عن طريق كسر البوليمرات وصولا الى شظايا قصيرة عبر أليف النواة و الحفز قاعدة، وعن طريق إذابة شظايا اللجنين عن طريق دي بروتوناتيون من مجموعات الهيدروكسيل / الكحول الفينول. عملية إزالة اللجنين مشتركة أخرى هي عملية Organosolv التي شظايا أيضا ويذوب اللجنين وهيميسيلولوز. بدلا من استخدام aqueo القلويةلنا حل، وتستخدم المذيبات العضوية مثل الإيثانول وحمض الخليك في درجات حرارة عالية تتراوح ما بين 160-200 درجة مئوية والضغوط 5-30 بار. Organosolv المعالجة لديها بعض المزايا أكثر من كرافت اللب في ذلك أنها تنتج كمية أقل من الهواء وتلوث المياه. 15 كلتا العمليتين تمتلك بعض التحديات الاقتصادية، إذا تم استخدامها لإنتاج المواد الكيميائية والوقود بدلا من السليلوز. 16 وتستخدم المعالجة Ionosolv السوائل الأيونية، والتي هي الأملاح التي لدينا نقطة ذوبان أقل من 100 درجة مئوية، ونتيجة للتفاعلات Coulombic قوية، وضغط بخار منخفض جدا. 17 وهذا يلغي تلوث الهواء في عملية المعالجة، ويمكن معالجة في أو بالقرب من الضغط الجوي.
في حين يتم إنشاء معظم ILS في شاقة، توليفات متعددة الخطوات، ILS بروتيتش يمكن توليفها في عملية من خطوة واحدة من السلع الكيماوية، مما يجعلها أقل تكلفة. وتشير التقديرات إلى أن بعض ILS يمكن أن يتم إنتاجها على نطاق واسع بالجملة لسعر 1.24 $ للكيلوغرام الواحد وهو مشابه للمذيبات العضوية المشتركة مثل الأسيتون والتولوين. 18 القدرة على إعادة تدوير وإعادة استخدام هذه ILS للتخصيص في عملية تعمل في درجات حرارة وضغوط أقل نسبيا يجعل هذا بديل أكثر اعتدالا ومرشحا جذابا اقتصاديا لتكرير حيوي.
يوضح هذا البروتوكول الفيديو مفصل نسخة مختبر مقياس للعملية Ionosolv لإزالة اللجنين الكتلة الحيوية lignocellulosic وتسكر الأنزيمي في نهاية المطاف من اللب السليلوز الغنية فضلا عن استرداد عالية النقاء اللجنين خالية من رائحة. 19
Protocol
ملاحظة: يتم تجميع السوائل الأيونية بروتيتش المستخدمة في عملية في المختبر لدينا، على الرغم من أن البعض قد تكون أو تصبح متاحة تجاريا. السوائل الأيونية الناتجة الحمضية وتآكل وربما إلى مهيجات الجلد / العين (اعتمادا على أمين المستخدمة)، وبالتالي يجب التعامل معها بحذر ارتداء معدات الوقاية الشخصية المناسبة (معطف المختبر، والمواصفات سلامة، قفازات المقاومة).
1. إعداد
- إعداد وتخزين الكتلة الحيوية lignocellulosic
- الحصول على الكتلة الحيوية lignocellulosic قبل التجربة بكميات كافية، على سبيل المثال 100 جرام حتى 5 كجم.
ملاحظة: كل تجربة يتطلب على الأقل 3 غرام من الكتلة الحيوية (1 غرام لكل منهما في ثلاث نسخ). - تقليل نسبة الرطوبة بعد وقت قصير من الحصاد وتخزين الكتلة الحيوية في شكل المجفف في الهواء في المختبر. الهواء الجاف من الكتلة الحيوية من خلال نشر الكتلة الحيوية على طاولة أو مقعد وتركها لمدة 2 أسابيع أو حتى يظهر الجاف. نقل وتحويل الكتلة الحيوية خلال روقته لتسريع هذه العملية. إجراء التجارب تجزئة في غضون سنة من الحصاد.
ملاحظة: مباشرة بعد الحصاد، والكتلة الحيوية الخشبية يمكن أن تحتوي على ما يصل إلى 50٪ بالوزن الرطوبة، في حين يحتوي المجفف في الهواء الكتلة الحيوية، والتي هي أكثر استقرارا، 5-12٪ بالوزن الرطوبة. - طحن وغربال الكتلة الحيوية لتحديد مدى حجم الجسيمات. تخزين الكتلة الحيوية المجففة في أكياس بلاستيكية أو حاويات أخرى مناسبة حتى الاستخدام.
ملاحظة: للحصول على عينات صغيرة التعامل معها في هذا البروتوكول، وينصح انخفاض حجم الجسيمات، على سبيل المثال 180-850 ميكرون.
- الحصول على الكتلة الحيوية lignocellulosic قبل التجربة بكميات كافية، على سبيل المثال 100 جرام حتى 5 كجم.
- تحديد محتوى الرطوبة في الكتلة الحيوية (وفقا لبروتوكول المختبر الوطني) 20
- لتحديد محتوى الرطوبة من الكتلة الحيوية، preweigh قطعة من رقائق الألومنيوم (حجم ما يقرب من 5 سم × 5 سم) على الميزان التحليلي وتسجيل الوزن من احباط (م احباط). تزن بها ما يقرب من 100 ملغ من الكتلة الحيوية الهواء المجفف على رقائق الألومنيوم وتسجيل بالضبط الهواء حديد الاختزال المباشرالوزن إد (م ADW).
- طوى رقائق الألومنيوم لجعل علبة وضعها في الفرن بمساعدة مروحة في 105 درجة مئوية خلال الليل (على الأقل لمدة 4 ساعة).
- اتخاذ حزمة من وضعها مباشرة في مجفف لمدة 5 دقائق، ثم وزن الحزمة فورا وتسجيل الوزن الدقيق للوزن فرن المجفف بالإضافة إلى رقائق (م ODW + احباط). حساب محتوى الرطوبة (في المائة) من BM الكتلة الحيوية مولودية وفقا لمعادلة 1:
 مكافئ. 1
مكافئ. 1
حيث m ODW + احباط هو وزن الحزمة المجفف الفرن (الكتلة الحيوية فرن المجفف بالإضافة إلى رقائق)، م احباط هو وزن احباط وم ADW هو الوزن المجفف في الهواء من الكتلة الحيوية. يجب أن تكون جميع الأوزان إما في غرام أو في ملغ.
- توليف أيوني السائل
- في غطاء الدخان أو الضميمة تنفيس، تزن 1 الخلدمن أمين (ثلاثي الإيثيلامين) في 1 لتر دورق كروي مع شريط مغناطيسي. ضع الدورق في حمام الثلج على لوحة النمام المغناطيسي. إضافة 250 مل قمع اضافه فورا للحد من تبخر أمين.
ملاحظة: ضمان حمض الصحيح: نسبة قاعدة ذات أهمية عالية لتحقيق استنساخ التجارب المعالجة. - قياس من 1 مول من حمض الكبريتيك باستخدام محلول تركيز معروفة (في هذا المثال 5 مول / لتر) وقارورة حجمية (200 مل). نقل حامض الكبريتيك في قمع الإضافة وشطف أي حمض التمسك جدران القارورة الحجمية في قمع اضافه مع الماء منزوع الأيونات.
- إضافة قطرة قطرة حامض الكبريتيك إلى أمين مع التحريك بقوة. تأكد من أن الحل لا تسخن، وهذا من شأنه أن يؤدي إلى درجة الغليان للأمين ونسبة غير دقيقة من حمض إلى قاعدة. شطف الداخل من قمع الإضافة باستخدام الماء منزوع الأيونات لضمان حمض ينقل كميا.
ملاحظة: يجوز دفعات أكبر من حل السائل الأيونية عن طريق زيادة كمية أمين وحامض الكبريتيك وكذلك حجم القارورة وفقا لذلك. - تتبخر معظم المياه باستخدام المبخر الدوار. يجب أن يكون محتوى الماء أقل من محتوى الماء اللازمة لمعالجة أولية.
ملاحظة: ليس من الضروري أن تجف تماما السائل الأيونية. قد يكون من المفيد أن يترك بعض الماء في السائل الأيونية، حيث أن بعض السوائل الأيونية المجففة، بما في ذلك كبريتات الهيدروجين triethylammonium، والمواد الصلبة في درجة حرارة الغرفة. ويمكن أيضا مجفف تجميد استخدامها لخفض المحتوى المائي.
- في غطاء الدخان أو الضميمة تنفيس، تزن 1 الخلدمن أمين (ثلاثي الإيثيلامين) في 1 لتر دورق كروي مع شريط مغناطيسي. ضع الدورق في حمام الثلج على لوحة النمام المغناطيسي. إضافة 250 مل قمع اضافه فورا للحد من تبخر أمين.
- تأكيد وضبط محتوى الماء من الحل IL
ملاحظة: محتوى الماء هو متغير التجريبي المهم. هناك ثلاثة مصادر أن الماء في الخليط المعالجة قد يأتي من. كل منهم يجب أن تؤخذ في الاعتبار: (1) الماء الوارد في حل السائل الأيونية تصنيعه أو تم شراؤها (2) الماء الوارد في تيانه الكتلة الحيوية المجفف في الهواء و (3) أي الماء المضاف مع ماصة لتحقيق محتوى الماء المطلوب النهائي.- تحديد محتوى الماء من الحل السائل الأيونية تصنيعه أو تم شراؤها من قبل الحجمي المعايرة كارل فيشر وفقا للتعليمات الصادرة من قبل الشركة المصنعة titrator. إضافة بضع قطرات من IL في titrator باستخدام حقنة وزنه قبل. أدخل وزن السائل وأضاف في titrator والانتظار حتى يعرض titrator القراءة. تسجيل محتوى الماء.
- اتخاذ قرار بشأن المحتوى المائي للالمعالجة الكتلة الحيوية. في هذه التجربة، استخدم 20٪ بالوزن. تقليل المحتوى المائي 5٪ بالوزن أقل من محتوى الماء المطلوب باستخدام المبخر الدوار والتأكد من محتوى جديد للمياه من قبل كارل فيشر المعايرة كما هو موضح في 1.4.1.
ملاحظة: يتم الحصول على نتائج جيدة مع الماء 20٪ بالوزن. ولكن هذا قد لا يكون دائما هو الأمثل لمعالجة أولية. يمكن اختيار والمحتوى المائي العالي من أجل خفض التكاليف المذيبات أو لزوجة منخفضة.
<لى> الحسابات للتجربة. - اتخاذ قرار بشأن مبلغ الأيونية حل السائل م سول، المباراة النهائية ونسبة BM الكتلة الحيوية إلى المذيب / سول النهائي. هنا، استخدم 10 غراما من حل السائل الأيونية تحتوي على 20٪ بالوزن ماء ونسبة من 1:10 ز / ز الكتلة الحيوية إلى المذيبات.
ملاحظة: الأنابيب المستخدمة في هذا البروتوكول يمكن أن تتناسب مع ما يصل إلى 18 غراما من حل IL إذا كانت الكتلة الحية للمذيب النسبة 01:10 (وزن / وزن). وارتفاع نسبة الكتلة الحيوية إلى مذيب (تصل إلى 1: 2 أو حتى 1: 1) هو ملائم من الناحية الاقتصادية، ولكنها قد تؤثر سلبا على كفاءة المعالجة في نطاق ضيق. - تحديد مقدار (الخالي من الماء) السائل الأيوني المطلوبة لكل عينة وفقا للمعادلة التالية: 2
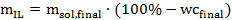 مكافئ. 2
مكافئ. 2
حيث m IL هو المبلغ المطلوب من السوائل الأيونية في غرام، م سول، النهائي هو المبلغ المطلوب من حل السائل الأيونية في غرام، ومرحاض نهائي </ دون> هو محتوى الماء المطلوب (في المائة) في حل السائل الأيونية. - بعد ذلك، حساب كمية تصنيعه أو اشترى حل السائل الأيونية التي يمكن ان تضاف في كل أنبوب ضغط وفقا للمعادلة التالية: 3
 مكافئ. 3
مكافئ. 3
حيث m سول هو مقدار حل لتضاف إلى كل أنبوب ضغط (بالغرام)، م IL هو المبلغ المطلوب من السوائل الأيونية (بالغرام)، ومرحاض سول هو محتوى الماء في حل السائل الأيونية (في المائة) كما هو محدد من قبل كارل فيشر المعايرة. - تحديد مقدار الكتلة الحيوية (على أساس الوزن فرن المجفف) التي يمكن ان تضاف الى حل السائل الأيونية باستخدام المعادلة (4) أدناه. في هذه التجربة، استخدم 1 غرام من المجفف فرن ميسكانتوس الكتلة الحيوية في أنبوب الضغط.
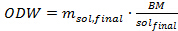 مكافئ. 4
مكافئ. 4
حيث ODW هو مقدار الكتلة الحيوية إلى أن إضافةإد في كل أنبوب ضغط (بالغرام)، م سول، النهائي هو المبلغ المطلوب من حل السائل الأيونية (بالغرام) وBM / سول النهائية هي النسبة المرجوة من حل السائل الكتلة الحيوية إلى الأيونية. - تحديد وزن الكتلة الحيوية المجفف في الهواء الذي يحتاج إلى أن يضاف إلى الأنبوب باستخدام المعادلة التالية: 5
 مكافئ. 5
مكافئ. 5
حيث ADW هو الوزن المجفف في الهواء من الكتلة الحيوية التي يمكن ان تضاف في أنبوب (بالغرام)، ODW والوزن من الكتلة الحيوية اللازمة لتجربة (تحدد في 1.5.4 في غرام) الفرن المجفف ومولودية BM هو القيمة تحدد في 1.2.3. - حساب كمية المياه يحتاج إلى إضافته مع ماصة لتحقيق المحتوى المائي النهائي المطلوب وفقا للمعادلة التالية: 6
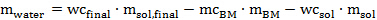 مكافئ. 6
مكافئ. 6
حيث m الماء هو مقدارالمياه التي يمكن ان تضاف، نهائي مرحاض هو محتوى الماء المطلوب في خليط المعالجة (هنا 20٪ بالوزن)، م sol.final هو كمية المذيب (هنا 10 غرام)، مولودية BM هو محتوى الرطوبة من الكتلة الحيوية المجفف في الهواء ، م BM هو مقدار الكتلة الحيوية المجفف في الهواء إلى أن تضاف، مرحاض سول هو محتوى الماء من الحل السائل الأيونية تصنيعه أو شراؤها، وم سول هو مقدار حل السائل الأيونية.
2. المعالجة
ملاحظة: قد تنقطع عملية في أي لحظة من خلال ترك العينات في درجة حرارة الغرفة (لبضعة أيام) أو في الثلاجة (لفترات أطول).
- قبل تزن ثلاثة 15 مل أنابيب الضغط مع قبعات تفلون والسيليكون الحلقات. تفقد البصر أنابيب الضغط لضمان حصولهم على أي شروخ أو عيوب.
ملاحظة: أكبر أنابيب الضغط المناسب السائل أكثر الأيونية والكتلة الحيوية يمكن استخدامها إذا رغبت في ذلك، على الرغم من أن نتائج المعالجة سوف لاتكون قابلة للمقارنة مباشرة بين المعالجة عينات في أحجام قنينة مختلفة. من المستحسن استخدام القبعات ختم اجهة لأفضل الختم. - مع ماصة 10 مل، إضافة المبلغ المطلوب من حل السائل الأيونية في مكانة أنبوب ضغط على نطاق واسع. استخدام حلقات الفلين للحفاظ على أنبوب واقفا. تسجيل وزن المحلول السائل الأيونية المضافة. إضافة الكمية المطلوبة من الماء إلى حل تحديدها في 1.5.6 باستخدام ماصة، على افتراض أن كثافة من الماء لتكون 1 غرام / مل.
- إضافة المبلغ المطلوب من غنوسيللولوز المجفف في الهواء عن طريق وضع قطعة من رقائق الألومنيوم (أبعاد 3 سم × 8 سم) على التوازن، taring التوازن وزنها من الكتلة الحيوية. الفارغة التوازن وإضافة الحيوية إلى الأنبوب. وضع رقائق فارغة مرة أخرى على التوازن وتسجيل الفرق.
ملاحظة: بدلا من ذلك، يمكن استخدام القوارب وزنها التحجر. - إغلاق الغطاء مع غطاء تفلون مع سيليكون يا الدائري. تحقق من وجود ختم جيدة دون الإفراط في تشديد. تسجيل الوزن من عأنابيب ressure تحتوي على الكتلة الحيوية والسوائل الأيونية. خلط محتويات الأنبوب باستخدام شاكر دوامة حتى كل من الكتلة الحيوية على اتصال مع السائل الأيونية.
ملاحظة: ليست كل المواد يا الدائري الصمود يجري في اتصال مع السوائل الأيونية في درجة حرارة مرتفعة. وجدنا أن السيليكون يعمل بشكل جيد. - وضع أنابيب الضغط في فرن بمساعدة مروحة الذي تم قبل تسخينها إلى درجة الحرارة المطلوبة. على سبيل المثال، وترك الأنابيب لمدة 8 ساعة على 120 درجة مئوية أو لمدة 1 ساعة على 150 درجة مئوية.
ملاحظة: الوقت ودرجة الحرارة متغيرات التجريبية الهامة. مرة أخرى - تركيبات درجة الحرارة يمكن أن تستخدم. - إزالة قارورة من الفرن باستخدام قفاز الفرن ووضعها في غطاء الدخان السماح لهم بارد لدرجة حرارة الغرفة. التحقق من وزن قارورة بعد التبريد لضمان عدم الماء هرب أثناء الطهي.
3. اللب غسل
- نقل محتويات كل أنبوب إلى أنبوب الطرد المركزي 50 مل باستخدام 40 مل من مطلقالبريد الإيثانول. هز أنبوب باستخدام شاكر دوامة لمدة 1 دقيقة لتخلط جيدا وتترك الأنبوبة في درجة حرارة الغرفة لمدة 1 ساعة على الأقل.
ملاحظة: يمكن أيضا أن يتم الفصل بها باستخدام الترشيح، ومع ذلك، يمكن ملاحظة أقل دقة لحجم العينة المقترحة. - هز أنبوب باستخدام شاكر دوامة لمدة 30 ثانية أخرى، ثم الطرد المركزي أنبوب لمدة 50 دقيقة في 2000 ز س. السائل المنفصل وصلبة عن طريق الصب دقيق. جمع السائل في نظيفة 250 مل دورق كروي بقضيب.
- إضافة 40 مل ايثانول جديدة في الأنبوب وكرر الخطوة 50 مل 3.2 ثلاث مرات.
- إزالة الإيثانول من السائل الأيونية عن طريق وضع جولة القاع القوارير على كتلة التدفئة. ربط كل منهم إلى مضخة فراغ مع فخ بارد. ملء فخ مع الثلج الجاف وتعيين التدفئة إلى 40 درجة مئوية. التبديل على التحريك ومضخة.
ملاحظة: تستخدم هذه التجربة لالصنع مواز المبخر انشاء بناء على التوليف الموازي انشاء. مبخرات موازية يمكن أيضا أن تكون الشرائيةإد الجاهزة. بدلا من ذلك المبخر الدوار يمكن استخدامها.
- إزالة الإيثانول من السائل الأيونية عن طريق وضع جولة القاع القوارير على كتلة التدفئة. ربط كل منهم إلى مضخة فراغ مع فخ بارد. ملء فخ مع الثلج الجاف وتعيين التدفئة إلى 40 درجة مئوية. التبديل على التحريك ومضخة.
4. سوكسليت استخراج اللب
- نقل اللب غسلها الرطب في الكشتبانات السليلوز وتسمية كل كشتبان باستخدام قلم رصاص.
- ملء الإيثانول 150 مل المطلق في نظيفة 250 مل قارورة بقضيب جولة القاع. إدراج كشتبان التي تحتوي على العينة إلى 40 مل جهاز سوكسلت، إضافة مكثف وتثبيت كل شيء على محطة عمل مستخرج موازية متصلة التبريد إعادة تدوير.
ملاحظة: إذا تم استخدام الإيثانول لنقل اللب، إضافة فقط الفارق الى 150 مل إلى دورق كروي. - عندما يتم تحميل جميع العينات، وتبدأ اثارة، ضبط درجة الحرارة إلى 135 درجة مئوية، وتشغيل recirculator (تحديد درجة الحرارة 18 درجة مئوية). استخراج عينات اللب لمدة 20 ساعة في المجموع.
- إيقاف تشغيل التدفئة للسماح التكثيف الراجع للتوصل إلى وقف. ثم التبديل على حد سواء اثارة وتهدئة. خذ الكشتبانات من جهاز سوكسلتباستخدام الملقط، والسماح للجفاف اللب الرطب في ليلة وضحاها كشتبان في غطاء الدخان.
- إضافة السائل من استخراج سوكسليت إلى السائل من غسل الكتلة الحيوية والاستمرار تبخير الايثانول من غسل الكتلة الحيوية مع المبخر مواز أو المبخر الدوار عند 40 درجة مئوية.
- نقل اللب المجفف في الهواء من كشتبان على قطعة من رقائق الألومنيوم tared على الميزان التحليلي، تسجيل الوزن المجفف في الهواء من اللب المستخرج ونقله في كيس من البلاستيك المسمى. محاولة لاستعادة كل شيء في حين لا كشط المواد كشتبان خارج الجدار.
- تحديد محتوى الرطوبة من اللب مباشرة لحساب العائد على السندات لفرن المجفف (كما هو موضح سابقا في الخطوة 1.4).
5. اللجنين عزل
- عندما يتبخر الإيثانول، يعجل اللجنين عن طريق نقل السائل الأيونية من القارورة ذهابا وأسفل في أنبوب 50 مل الطرد المركزي باستخدام 30 مل من الماء. مزيج تعليق وتترك لمدة لا تقل عن 1 ساعة.أجهزة الطرد المركزي لمدة 20 دقيقة في 2000 x ج، وفصل حل من مادة صلبة عن طريق الصب.
ملاحظة: في هذا البروتوكول، وتستخدم 3 حكمه من المياه كما antisolvent. أقل antisolvent يمكن استخدامها، إذا رغبت في ذلك. يغسل يمكن جمعها، وإزالة المياه والسوائل الأيونية استردادها للاستخدام تكرار. - إضافة 30 مل من الماء المقطر لبيليه اللجنين داخل أنبوب الطرد المركزي. كرر الاختلاط، حضانة لمدة 1 ساعة والطرد المركزي. كرر هذه الخطوة ليصبح المجموع 3 يغسل اللجنين.
- تجفيف اللجنين داخل أنبوب الطرد المركزي باستخدام فرن فراغ وغطاء مثقوب في 45 درجة مئوية خلال الليل. لتحديد العائد اللجنين، ضع قطعة من رقائق الألومنيوم على التوازن، الفارغة الوزن، إضافة اللجنين من الفرن وتسجيل الوزن على الفور. نقل اللجنين في قارورة للتخزين.
النتائج
المبلغ المحدد للإزالة اللجنين وهطول الأمطار اللجنين، تعافى اللب والعائد الجلوكوز تعتمد على نوع من الكتلة الحيوية المستخدمة، ودرجة الحرارة التي يتم تشغيل العلاج ومدة العلاج. مرات المعالجة قصيرة ودرجات الحرارة المنخفضة تؤدي إلى المعالجة غير مكتمل?...
Discussion
تقنية للتجزئة من الكتلة الحيوية lignocellulosic المقدمة هنا تنتج لب السليلوز الغنية واللجنين. تذوب معظم hemicelluloses في السائل الأيونية وتحلل، ولكن لم يشف. وإذا رغبت السكريات هيميسيلولوز، قد يكون من الضروري على هيميسيلولوز قبل استخراج خطوة مسبقة لإزالة اللجنين Ionosolv. فقد كان من ...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
الكتاب يعترف معهد جرانثام لتغير المناخ والبيئة والمناخ، الشركة الكويتية للاستثمار وEPSRC (EP / K038648 / 1 و EP / K014676 / 1) للحصول على التمويل وبيار بوفييه لتوفير البيانات التجريبية لالمعالجة المسبقة الصنوبر.
Materials
| Name | Company | Catalog Number | Comments | |
| IL synthesis | ||||
| Round bottom flask, with standard ground joint 24/29 NS, 1000 ml | Lenz | 3 0024 70 | VWR product code 271-1309 | |
| 250mL Addition Funnel, Graduated, 29/26 Joint Size, 0-4mm PTFE Valve | GPE | CG-1714-16 | ||
| Dish-shaped dewar flask, SCH 31 CAL | KGW-Isotherm | 1197 | ||
| Volumetric flask, 200 ml | VWR | 612-3745 | ||
| Cork rings, pasteur pipettes and teet, wash bottle with deionised water, large magentic stir bar | ||||
| Biomass size reduction | ||||
| Heavy Duty Cutting Mill SM2000 | Retsch | Discontinued | Replaced with Cutting Mill SM 200 (20.728.0001) | |
| Bottom sieves (10 mesh square holes, for particle size <2 mm) | Retsch | 03.647.0318 | Part of cutting mill | |
| Analytical Sieve Shaker AS 200 | Retsch | 30.018.0001 | Part of sieving machine | |
| Test Sieve 200 mm Ø x 50 mm height ISO 3310/1 (180 µm) | Retsch | 60.131.000180 | Part of sieving machine | |
| Test Sieve 200 mm Ø x 50 mm height ISO 3310/1 (850 µm) | Retsch | 60.131.000850 | Part of sieving machine | |
| Collecting pan, stainless steel, 200 mm Ø, height 50 mm | Retsch | 69.720.0050 | Part of sieving machine | |
| Rotary evaporator: | ||||
| Rotary evaporator (Rotavapor R-210) | Buchi | Discontinued | Replaced with Rotavapor R-300 | |
| Water bath (Heating bath B-491) | Buchi | 48201 | Part of rotary evaporator | |
| Recirculator | Julabo | F25 | Part of rotary evaporator | |
| Vacuum pump (MPC 101 Z) | Ilmvac GmbH | 412522 | Part of rotary evaporator | |
| Vacuum controller (Vacuum Control Box VCB 521) | Ilmvac GmbH | 600053 | Part of rotary evaporator | |
| Parallel evaporator: | ||||
| StarFish Base Plate 135mm (for Radleys & IKA) | Radleys | RR95010 | Part of parallel evaporator | |
| Monoblock for 5 x 250ml Flasks | Radleys | RR95130 | Part of parallel evaporator | |
| Telescopic 5-way Clamp with Velcro | Radleys | RR95400 | Part of parallel evaporator | |
| Gas/Vacuum Manifold with connectors | Radleys | RR95510 | Part of parallel evaporator | |
| 650mm Rod | Radleys | RR95665 | Part of parallel evaporator | |
| Quick Release Male, R/A Barbed 6.4mm + Shut-off (3.2mm ID) | Radleys | RR95520 | Part of parallel evaporator | |
| Stirrer/hot plate | Radleys | RR98072 | Part of soxhlet extractor | |
| Temperature controller | Radleys | RR98073 | Part of soxhlet extractor | |
| Elliptical Stirring Bar 15mm Rare Earth | Radleys | RR98097 | Part of parallel evaporator | |
| Vacuum cold trap, plastic coated, PTFE stopcock | Chemglass | CG-4519-01 | Part of parallel evaporator | |
| Vacuum pump (MPC 101 Z) | Ilmvac GmbH | 412522 | Part of parallel evaporator | |
| Tygon tubing E-3603, 6,40 mm (internal) 12,80 mm (external) | Saint-Gobain/VWR | 228-1292 | Part of parallel evaporator | |
| Parallel Soxhlet extractor: | ||||
| StarFish Base Plate 135mm (for Radleys & IKA) | Radleys | RR95010 | Part of soxhlet extractor | |
| Monoblock for 5 x 250ml Flasks | Radleys | RR95130 | Part of soxhlet extractor | |
| Telescopic 5-way Clamp with Velcro | Radleys | RR95400 | Part of soxhlet extractor | |
| Telescopic 5-way Clamp with Silicone Strap and Long Handle | Radleys | RR95410 | Part of soxhlet extractor | |
| Water Manifold with connectors | Radleys | RR95500 | Part of soxhlet extractor | |
| 650mm Rod | Radleys | RR95665 | Part of soxhlet extractor | |
| Quick Release Male, R/A Barbed 6.4mm + Shut-off (3.2mm ID) | Radleys | RR95520 | Part of soxhlet extractor | |
| Coil condensers with standard ground joints 29/32 NS | Lenz | 5.2503.04 | Part of soxhlet extractor | |
| Extractor Soxhlet 40mL borosilicate glass 29/32 socket 24/29 cone | Quickfit | EX5/43 | Part of soxhlet extractor | |
| Stirrer/hot plate | Radleys | RR98072 | Part of soxhlet extractor | |
| Temperature controller | Radleys | RR98073 | Part of soxhlet extractor | |
| Recirculator | Grant | LTC1 | Part of soxhlet extractor | |
| Cellulose extraction thimble | Whatman | 2280-228 | ||
| Tweezers | Excelta | 20A-S-SE | ||
| Vacuum drying oven: | ||||
| Vacuum drying oven | Binder | VD 23 | Part of vacuum oven | |
| Dewar vessel 2L 100x290mm with handle | KGW-Isotherm | 10613 | Part of vacuum oven | |
| Vacuum Trap | GPE | CG-4532-01 | Part of vacuum oven | |
| Other equipment: | ||||
| Analytical balance | A&D | GH-252 | accuracy to ± 0.1 mg | |
| Volumetric Karl Fischer titrator | Mettler Toledo | V20 | ||
| 10 mL disposable pipette | Corning Inc | Costar 4101 10 mL Stripette | ||
| Eppendorf Research plus pipette, variable volume, volume 100-1000 μL | Eppendorf | 3120000062 | ||
| Desiccator | Jencons | JENC250-028BOM | ||
| Ace pressure tube bushing type, Front seal, volume 15 mL | Ace Glass | 8648-04 | ||
| Ace O-rings, silicone, 2.6 mm, I.D. 9.2 mm | Ace Glass | 7855216 | O-ring for pressure tube | |
| Vortex shaker | VWR International | 444-1378 (UK) | ||
| Fan-assisted convection oven | ThermoScientific | HeraTherm OMH60 | ||
| Oven glove (Crusader Flex) | Ansel Edmont | 42-325 | ||
| 250 mL Round bottom flask single neck ground joint 24/29 (Pyrex) | Quickfit | FR250/3S | ||
| Rotaflo stopcock adapter with cone 24/29 | Rotaflo England | MF11/2/SC | ||
| 50 mL Falcon tube | Heraeus/Kendro | HERA 76002844 | ||
| Centrifuge (Mega Star 3.0) | VWR | 521-1751 | ||
| Reagents: | ||||
| Ethanol absolute | VWR | 20820.464 | ||
| Triethylamine | Sigma-Aldrich | T0886 | ||
| Sulfuric acid 5 mol/l (10N) AVS TITRINORM volumetric solution Safe-break bottle 2,5L | VWR | 191665V | ||
| Purified water (15 MΩ ressitance) | Elga | CENTRA R200 | ||
| Lignocellulosic biomass: | ||||
| Miscanthus X gigantheus | ||||
| Pinus sylvestris |
References
- Lewis, N. S., Nocera, D. G. Powering the planet: chemical challenges in solar energy utilization. Proc.Natl.Acad.Sci.U.S.A. 103 (43), 15729-15735 (2006).
- Dincer, I. Renewable energy and sustainable development: a crucial review. Renewable and Sustainable Energy Reviews. 4 (2), 157-175 (2000).
- Zweibel, K., Mason, J., Fthenakis, V. A solar grand plan. Sci. Am. 298 (1), 64-73 (2008).
- Lee, J. Biological conversion of lignocellulosic biomass to ethanol. J. Biotechnol. 56 (1), 1-24 (1997).
- Carrott, P., Ribeiro Carrott, M. Lignin-from natural adsorbent to activated carbon: A review. Bioresour.Technol. 98 (12), 2301-2312 (2007).
- Cardona Alzate, C., Sánchez Toro, O. Energy consumption analysis of integrated flowsheets for production of fuel ethanol from lignocellulosic biomass. Energy. 31 (13), 2447-2459 (2006).
- Field, C. B., Campbell, J. E., Lobell, D. B. Biomass energy: the scale of the potential resource. Trends Biochem Sci. 23 (2), 65-72 (2008).
- Hoogwijk, M., et al. Exploration of the ranges of the global potential of biomass for energy. Biomass Bioenergy. 25 (2), 119-133 (2003).
- Goldemberg, J. Ethanol for a sustainable energy future. Science. 315 (5813), 808-810 (2007).
- Himmel, M. E., et al. Biomass recalcitrance: engineering plants and enzymes for biofuels production. Science. 315 (5813), 804-807 (2007).
- Mosier, N., et al. Features of promising technologies for pretreatment of lignocellulosic biomass. Bioresour.Technol. 96 (6), 673-686 (2005).
- Kumar, P., Barrett, D. M., Delwiche, M. J., Stroeve, P. Methods for pretreatment of lignocellulosic biomass for efficient hydrolysis and biofuel production. Ind Eng Chem Res. 48 (8), 3713-3729 (2009).
- Hu, F., Ragauskas, A. Suppression of pseudo-lignin formation under dilute acid pretreatment conditions. RSC Advances. 4 (9), 4317-4323 (2014).
- Chakar, F. S., Ragauskas, A. J. Review of current and future softwood kraft lignin process chemistry. Ind Crop Prod. 20 (2), 131-141 (2004).
- Mutjé, P., Pelach, M., Vilaseca, F., García, J., Jiménez, L. A comparative study of the effect of refining on organosolv pulp from olive trimmings and kraft pulp from eucalyptus wood. Bioresour.Technol. 96 (10), 1125-1129 (2005).
- Zhao, X., Cheng, K., Liu, D. Organosolv pretreatment of lignocellulosic biomass for enzymatic hydrolysis. Appl. Microbiol. Biotechnol. 82 (5), 815-827 (2009).
- Brandt, A., Gräsvik, J., Hallett, J. P., Welton, T. Deconstruction of lignocellulosic biomass with ionic liquids. Green Chem. 15, 550 (2012).
- Chen, L., et al. Inexpensive ionic liquids:[HSO 4]−-based solvent production at bulk scale). Green Chem. 16 (6), 3098-3106 (2014).
- Brandt, A., Chen, L., van Dongen, B. E., Welton, T., Hallett, J. P. Structural changes in lignins isolated using an acidic ionic liquid water mixture. Green Chem. 17, 5019-5034 (2015).
- Sluiter, A., et al. NREL/TP-510-42621. Determination of Total Solids in Biomass and Total Dissolved Solids in Liquid Process Samples. , (2008).
- Sluiter, A., et al. NREL/ TP - 510 - 42618Determination of Structural Carbohydrates and Lignin in Biomass. Determination of Structural Carbohydrates and Lignin in Biomass. , (2011).
- Resch, M. G., Baker, S. R., Decker, NREL/TP-5100-63351. Low Solids Enzymatic Saccharificatin of Lignocellulosic Biomass. , (2015).
- Brandt, A., Ray, M. J., To, T. Q., Leak, D. J., Murphy, R. J., Welton, T. Ionic liquid pretreatment of lignocellulosic biomass with ionic liquid-water mixtures. Green Chem. 13 (9), 2489-2499 (2011).
- Aver, K., Scortegagna, A., Fontana, R., Camassola, M. Saccharification of ionic-liquid-pretreated sugar cane bagasse using Penicillium echinulatum enzymes. J Taiwan Inst Chem Eng. 45 (5), 2060-2067 (2014).
- George, A., et al. Design of low-cost ionic liquids for lignocellulosic biomass pretreatment. Green Chem. 17 (3), 1728 (2015).
- Verdía, P., Brandt, A., Hallett, J. P., Ray, M. J., Welton, T. Fractionation of lignocellulosic biomass with the ionic liquid 1-butylimidazolium hydrogen sulfate. Green Chem. 16 (3), 1617-1627 (2014).
- Brandt, A., et al. Ionic liquid pretreatment of lignocellulosic biomass with ionic liquid-water mixtures. Green Chem. 13 (9), 2489-2499 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved