Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Vorbehandlung von Lignocellulose-Biomasse mit Low-Cost-ionischen Flüssigkeiten
In diesem Artikel
Zusammenfassung
The pretreatment of lignocellulosic biomass with protic low-cost ionic liquids is shown, resulting in a delignified cellulose-rich pulp and a purified lignin. The pulp gives rise to high glucose yields after enzymatic saccharification.
Zusammenfassung
A number of ionic liquids (ILs) with economically attractive production costs have recently received growing interest as media for the delignification of a variety of lignocellulosic feedstocks. Here we demonstrate the use of these low-cost protic ILs in the deconstruction of lignocellulosic biomass (Ionosolv pretreatment), yielding cellulose and a purified lignin. In the most generic process, the protic ionic liquid is synthesized by accurate combination of aqueous acid and amine base. The water content is adjusted subsequently. For the delignification, the biomass is placed into a vessel with IL solution at elevated temperatures to dissolve the lignin and hemicellulose, leaving a cellulose-rich pulp ready for saccharification (hydrolysis to fermentable sugars). The lignin is later precipitated from the IL by the addition of water and recovered as a solid. The removal of the added water regenerates the ionic liquid, which can be reused multiple times. This protocol is useful to investigate the significant potential of protic ILs for use in commercial biomass pretreatment/lignin fractionation for producing biofuels or renewable chemicals and materials.
Einleitung
Treffen der Menschheit Energiebedarf nachhaltig eine der größten Herausforderungen, die unsere Zivilisation steht. Der Energieverbrauch wird voraussichtlich in den nächsten 50 Jahren verdoppeln, eine größere Belastung auf fossilen Ressourcen setzen. 1 Der Aufbau von Treibhausgasen (THG) in der Atmosphäre durch weitverbreitete Verwendung fossiler Brennstoffe ist besonders problematisch, da CO 2 erzeugt aus der Verbrennung von fossilen Brennstoffen ist verantwortlich für 50% des anthropogenen Treibhauseffekt. 2 daher groß angelegte Anwendung erneuerbarer und kohlenstoffneutrale Technologien ist entscheidend für die Erfüllung der gestiegenen Energie- und materiellen Bedürfnisse der zukünftigen Generationen. 1, 3
Pflanzenbiomasse ist der vielseitigste erneuerbare Ressource, wie es verwendet werden kann, Wärme, Strom sowie auf Kohlenstoff basierende Chemikalien, Materialien und Kraftstoffe herzustellen. Primäre Vorteile von Lignocellulose über andere Biomassearten sind seine Fülle, Potenzial für hohe Erträge per Bereich des Landes und oft viel höhere CO 2 Emissionseinsparungen, die hohe Retention von Kohlenstoff im Boden umfasst. 4, 5 Weitere Vorteile von Biomasse sind lokale Verfügbarkeit, geringen Kapitalbedarf Biomasse zu Energie umwandeln, und die Bodenerosion Prävention. 8
Die wichtigsten Herstellung von Lignocellulose - Einsatzstoffe sind die Forstwirtschaft und der Landwirtschaft sowie der kommunalen Abfallwirtschaft. 6 Lignocellulose Produktion das Potenzial erweitert werden muss, mit einem Geist der Entwaldung und der Vermeidung der Ersatz von Nahrungspflanzen und die Freisetzung von potentiellen Schadstoffen zu begrenzen. 7 Für erneuerbare Biomasse eine tragfähige weit verbreitete Quelle flüssigen Treibstoffen und Chemikalien zu werden, muss die Verarbeitung wirtschaftlich wettbewerbsfähig zu werden mit fossilen Brennstoffen Umwandlungstechnologien. 9, 10 ein Schlüssel dazu ist die Ausbeute und die Qualität der Biomasse-Zwischenprodukte zu steigern bei gleichzeitiger Reduzierung Kosten.
Lignocellulose enthält einen hohen Anteil an Zucker , die gegenüber Kraftstoffen und Chemikalien durch katalytische und mikrobieller Umwandlungen umgewandelt werden können. 11 Diese Zucker in polymerer Form wie Cellulose und Hemicellulose in Lignocellulose vorhanden sind. Sie können in Glukose und andere Zucker Monomeren hydrolysiert werden und dann verwendet für die Herstellung von Bioethanol und anderen Bio-derived Chemikalien und Lösungsmittel. 12
Um die Zellulose Zucker für den Zugriff auf eine Vorbehandlung der Biomasse ist notwendig , durch physikalische, chemische oder kombinierte Verfahren. 4 Die Vorbehandlung ist wohl der teuerste Schritt in der Valorisierung von Lignocellulose - Biomasse. Daher Forschung in verbesserte Vorbehandlungsverfahren ist zwingend notwendig.
Verschiedene Vorbehandlungstechnologien zur Verfügung. Von besonderem Interesse sind diejenigen, die das Lignin aus Zellulose (fractionative Vorbehandlung) trennen. Lignin, die dritte Hauptkomponente inLignocellulose, beschränkt den Zugang von Agenten an Cellulose und Hemicellulose und reduziert die Zuckerausbeute pro Tonne Beschickungsmaterial zu hydrolysieren. 11 Die abgetrennte Lignin kann Zwischen als zusätzliche biorefinery verwendet werden , wenn es in geeigneter Qualität isoliert wird. 13. Ein fractionative Verfahren ist das Kraft - Verfahren das ist die häufigste Vorbehandlung für Papier / Zellstoff-Produktion. In Kraftpulpenprozesses, Holzhackschnitzel in einem Gemisch aus Natriumhydroxid und Natriumsulfid und erwärmt bei erhöhten Temperaturen von etwa 170 ° C unter hohen Druck gesetzt werden. 14 Die alkalischen Reaktionen , die durch Aufbrechen der Polymere bis zu kurzen Fragmenten über nukleophile Hemicellulose und Lignin zu entfernen und basenkatalysiert und durch die Ligninfragmente über de-protoniert phenolischen Hydroxyl / Alkoholgruppen auflöst. Ein weiteres gemeinsames Delignifizierungsverfahren ist der Organosolv- Prozess, der auch Fragmente und löst das Lignin und Hemicellulose. Anstatt eine alkalische aqueo mitus Lösung, organische Lösungsmittel, wie Ethanol und Essigsäure werden bei hohen Temperaturen im Bereich von 160-200 ° C und Drücken von 5 bis 30 bar verwendet. Organosolv- Vorbehandlung hat einige Vorteile gegenüber Kraft in Aufschließen , dass es weniger Luft und Wasserverschmutzung erzeugt. 15 Beide Prozesse einige wirtschaftliche Herausforderungen besitzen, wenn für die Produktion von Chemikalien und Brennstoffe anstatt Cellulose. 16 Die Ionosolv Vorbehandlung verwendet ionische Flüssigkeiten, die Salze sind , dass haben Schmelzpunkte unter 100 ° C und, als Ergebnis ihrer starken Coulomb - Wechselwirkungen, sehr niedrige Dampfdrücke. 17 Dies eliminiert die Verunreinigung der Luft in dem Vorbehandlungsverfahren und ermöglicht eine Verarbeitung bei oder nahe Atmosphärendruck.
Während die meisten ILs in mühsamer, Synthesen mehrstufiges erstellt werden, können protischen ILs in einem von Grundchemikalien Prozess in einem Schritt synthetisiert werden, wodurch sie weniger teuer macht; es wird geschätzt, dass einige ILs bei Bulk Skala für ein hergestellt werden könntenPreis von $ 1,24 pro kg , die zu den üblichen organischen Lösungsmitteln wie Aceton und Toluol vergleichbar ist. 18 Die Fähigkeit , diese anpassbare ILs in einem Prozess zu recyceln und wiederverwenden , die diese eine gutartige Alternative und eine wirtschaftlich attraktive Kandidaten bei vergleichsweise niedrigeren Temperaturen und Drücken macht arbeitet für Bioraffinerie.
Diese detaillierte Video - Protokoll zeigt eine Labormaßstab Version des Ionosolv Verfahren zur Delignifizierung von Lignocellulose und die eventuelle enzymatischen Verzuckerung der Cellulose-reiche Zellstoff sowie die Gewinnung von hochreinem geruchsfreies Lignin. 19
Protokoll
Hinweis: Die protischen ionischen Flüssigkeiten in dem Verfahren verwendet werden synthetisiert in unserem Labor, obwohl einige oder vielleicht kommerziell verfügbar werden. Die resultierenden ionischen Flüssigkeiten sind sauer und ätzend und wahrscheinlich Haut / Augenreizungen (je nach verwendetem Amin) und diese mit größter Sorgfalt tragen geeignete PSA (Laborkittel, Schutzbrille, beständige Handschuhe) behandelt werden.
1. Vorbereitung
- Vorbereiten und Speichern der Lignocellulose
- Erhalten, die Lignocellulose vor dem Experiment in ausreichenden Mengen, beispielsweise 100 g bis 5 kg.
Hinweis: Jeder Versuch mindestens 3 g Biomasse erfordert (je 1 g in dreifacher Ausfertigung). - Zu reduzieren, den Feuchtigkeitsgehalt kurz nach der Ernte und speichern die Biomasse in luftgetrockneter Form im Labor. Der Luft trocknen die Biomasse durch die Biomasse auf einem Tisch oder eine Bank ausgebreitet und für 2 Wochen verlassen oder bis es trocken erscheint. Bewegen und drehen Sie die Biomasse während tseine Zeit, den Prozess zu beschleunigen. Führen Sie die Fraktionierungsexperimente innerhalb eines Jahres nach der Ernte.
Anmerkung: Unmittelbar nach der Ernte können Holzbiomasse enthalten bis zu 50 Gew% Feuchtigkeit, während der Luft getrocknet Biomasse, die stabiler ist, enthält 5-12 Gew% Feuchtigkeit. - Grind und Sieb der Biomasse auf eine ausgewählte Partikelgrößenbereich. Das getrocknete Biomasse in Plastiktüten oder anderen geeigneten Behältern bis zum Gebrauch.
Anmerkung: Für den kleinen Proben in diesem Protokoll behandelt, eine reduzierte Partikelgrße wird empfohlen, beispielsweise 180 bis 850 & mgr; m.
- Erhalten, die Lignocellulose vor dem Experiment in ausreichenden Mengen, beispielsweise 100 g bis 5 kg.
- Bestimmung der Feuchtigkeitsgehalt der Biomasse (gemäß der NREL protocol) 20
- Um den Feuchtigkeitsgehalt der Biomasse zu bestimmen, preweigh ein Stück Aluminiumfolie (Größe ca. 5 cm x 5 cm) auf einer Analysenwaage und aufzuzeichnen , das Gewicht der Folie (m - Folie). Man wiegt etwa 100 mg Luft getrocknete Biomasse auf die Aluminiumfolie und notieren Sie die genaue Luft-dried Gewicht (m ADW).
- Fold der Aluminiumfolie ein Paket und in einen Umluftofen bei 105 ° C über Nacht (mindestens 4 Stunden) zu machen.
- Nehmen Sie das Paket heraus und legen Sie sie sofort in einem Exsikkator für 5 Minuten, dann wiegen das Paket sofort und nehmen Sie das genaue Gewicht der ofengetrockneten Gewicht plus Folie (m ODW + Folie). Berechnen des Feuchtigkeitsgehalts (in%) der Biomasse mc BM nach Gleichung 1:
 Gl. 1
Gl. 1
Wo m + ODW Folie das Gewicht des ofengetrockneten Paket (otro Biomasse und Folie) ist, ist m Folie das Gewicht der Folie und m ADW ist die Luft-Trockengewicht der Biomasse. Alle Gewichte sollten entweder in Gramm oder in mg liegen.
- Synthese von ionischen Flüssigkeiten
- In einem Abzug oder belüfteten Gehäuse, wiegt 1 moldes Amins (Triethylamin) in einen 1 l-Rundkolben mit magnetischem Rührstab. Der Kolben wird in einem Eisbad auf einem Magnetrührer Platte. Fügen Sie einen 250 ml Zugabetrichter sofort die Verdampfung des Amins zu minimieren.
Hinweis: Die Gewährleistung der richtigen Säure: Basen-Verhältnis ist von hoher Bedeutung für die Reproduzierbarkeit der Experimente Vorbehandlung zu erreichen. - Auszumessen 1 Mol Schwefelsäure mit einer Lösung bekannter Konzentration unter Verwendung von (in diesem Beispiel 5 mol / L) und einem volumetrischen Kolben (200 ml). Übertragen Sie die Schwefelsäure in den Zugabetrichter und spülen Sie alle an den Wänden des Messkolben in den Zugabetrichter mit entsalztem Wasser anhaftende Säure.
- Fügen Sie die Schwefelsäure tropfenweise zu dem Amin unter kräftigem Rühren. Stellen Sie sicher, dass die Lösung nicht erwärmt, da dies zum Sieden des Amins führen und ein ungenaues Verhältnis von Säure zu Base. Spülen des Inneren des Zugabetrichters deionisiertem Wasser unter Verwendung der Säure zu gewährleisten, wird quantitativ überführt.
Hinweis: Größere Chargen von ionischen flüssigen Lösung kann durch Erhöhen der Menge an Amin und Schwefelsäure sowie die Kolbenvolumen entsprechend vorgenommen werden. - Man dampft das meiste des Wassers am Rotationsverdampfer. Der Wassergehalt sollte für die Vorbehandlung erforderlich niedriger ist als der Wassergehalt sein.
Anmerkung: Es ist nicht notwendig, um vollständig die ionische Flüssigkeit trocknen. Es kann vorteilhaft sein, etwas Wasser in der ionischen Flüssigkeit, wie einige getrocknet ionische Flüssigkeiten verlassen, einschließlich Triethylammonium-hydrogensulfat, sind Feststoffe bei Raumtemperatur. Ein Gefriertrockner kann auch verwendet werden, um den Wassergehalt zu senken.
- In einem Abzug oder belüfteten Gehäuse, wiegt 1 moldes Amins (Triethylamin) in einen 1 l-Rundkolben mit magnetischem Rührstab. Der Kolben wird in einem Eisbad auf einem Magnetrührer Platte. Fügen Sie einen 250 ml Zugabetrichter sofort die Verdampfung des Amins zu minimieren.
- Bestätigen und Einstellen des Wassergehalts der IL - Lösung
Hinweis: Der Wassergehalt ist eine wichtige experimentelle Variable. Es gibt drei Quellen, dass das Wasser in der Vorbehandlungsmischung von kommen. Alle von ihnen müssen berücksichtigt werden: (1) das Wasser im synthetisiert oder gekauft ionische flüssige Lösung (2) das Wasser in t enthalten sind enthaltener luftgetrocknet Biomasse und (3) ein Wasser mit einer Pipette hinzugefügt, um den gewünschten endgültigen Wassergehalt zu erreichen.- Bestimmen Sie den Wassergehalt des synthetisierten oder gekauft ionische flüssige Lösung durch volumetrische Karl-Fischer-Titration nach Anweisungen vom Titrator Hersteller ausgestellt. Fügen Sie ein paar Tropfen der IL in den Titrator eine vorher gewogene Spritze. Geben Sie das Gewicht der Flüssigkeit in den Titrator hinzugefügt und warten, bis der Titrator eine Lesung anzeigt. Nehmen Sie den Wassergehalt.
- Entscheiden Sie sich für einen Wassergehalt für die Biomasse Vorbehandlung. In diesem Experiment verwenden 20 Gew%. Reduzieren Sie den Wassergehalt 5 Gew% unter dem gewünschten Wassergehalt am Rotationsverdampfer und bestätigen Sie den neuen Wassergehalt durch Karl-Fischer-Titration, wie in 1.4.1 beschrieben.
Hinweis: Gute Ergebnisse mit 20 Gew% Wasser erhalten werden; jedoch muss dies nicht immer der optimale für die Vorbehandlung ist. Ein höherer Wassergehalt kann gewählt werden, um Lösungsmittelkosten zu reduzieren oder zu niedriger Viskosität.
- Berechnungen für das Experiment.
- Entscheiden Sie sich für die Menge der ionischen Flüssigkeit Lösung m sol, endgültig und einem Biomasse-zu-Lösungsmittel - Verhältnis BM / sol endgültig. Hier verwenden 10 g Ionenflüssigkeitslösung, enthaltend 20 Gew% Wasser und eine Biomasse-zu-Lösungsmittel-Verhältnis von 1:10 g / g.
Anmerkung: Die Rohre in diesem Protokoll verwendet werden, können bis zu 18 g IL-Lösung passen, wenn die Biomasse Verhältnis zum Lösungsmittel beträgt 1:10 (wt / wt). Eine hohe Biomasse-zu-Lösungsmittel-Verhältnis (bis zu 1: 2 oder sogar 1: 1) ist günstig aus wirtschaftlicher Sicht, sondern könnte die Vorbehandlung Wirksamkeit bei geringem Umfang beeinträchtigen. - Bestimmung der Menge an (wasserfrei) ionische Flüssigkeit für jede Probe benötigt, gemäß der folgenden Gleichung 2:
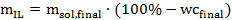 Gl. 2
Gl. 2
Wobei m IL wird die erforderliche Menge an ionischer Flüssigkeit in Gramm, m sol, endgültig die gewünschte Menge an ionischer Flüssigkeit Lösung in Gramm und wc final </ Sub> ist der gewünschte Wassergehalt (in%) in der ionischen Flüssigkeit Lösung. - Als nächstes berechnen die Menge an ionischer Flüssigkeit Lösung synthetisiert oder gekauft wurde in jedes Druckrohr hinzugefügt werden entsprechend der folgenden Gleichung 3:
 Gl. 3
Gl. 3
Wobei m sol die Menge der Lösung wird in jedes Druckrohr hinzugefügt werden (in Gramm), m IL ist die erforderliche Menge an ionischer Flüssigkeit (in Gramm) und wc Sol ist der Wassergehalt in der Ionischen Flüssigkeit Lösung (in%) wie durch Karl Fischer Titration bestimmt. - Bestimmung der Menge an Biomasse (otro Gewichtsbasis) zu der ionischen Flüssigkeit Lösung zugegeben werden unter Verwendung von Gleichung 4 unten. In diesem Experiment verwendet werden 1 g ofengetrockneten Miscanthus Biomasse pro Druckrohr.
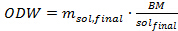 Gl. 4
Gl. 4
Wo ODW ist die Menge an Biomasse zu addierened in jedes Druckrohr (in Gramm), m sol, endgültig die gewünschte Menge an ionischer Flüssigkeit - Lösung (in Gramm) und BM / sol endgültig ist das gewünschte Verhältnis von Biomasse-zu-ionische Flüssigkeit Lösung. - Bestimmen das Gewicht der luftgetrockneten Biomasse, die 5 durch Verwendung der folgenden Gleichung in die Röhrchen gegeben werden muss:
 Gl. 5
Gl. 5
wo ADW das luftgetrocknete Gewicht der Biomasse in das Röhrchen hinzugefügt werden (in Gramm) wird ODW Gewicht der Biomasse für das Experiment (bestimmt in 1.5.4 in Gramm) , die erforderlich Ofen getrocknet und mc BM ist der Wert , in 1.2.3 bestimmt. - Berechnen, wie viel Wasser muss mit einer Pipette hinzugefügt werden, um die gewünschte endgültige Wassergehalt nach der folgenden Gleichung zu erreichen 6:
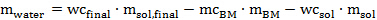 Gl. 6
Gl. 6
Wobei m Wasser ist die Menge anWasser hinzugefügt werden, wc final ist der gewünschte Wassergehalt in der Vorbehandlungsmischung (hier 20 wt%), m sol.final ist die Menge des Lösungsmittels (hier 10 g), mc BM ist der Feuchtigkeitsgehalt der Luft getrocknet Biomasse m BM, ist die Menge an Luft getrocknet Biomasse hinzugefügt werden, wc sol liegt der Wassergehalt des synthetisierten oder ionische flüssige Lösung gekauft und m Sols ist die Menge an ionischer Flüssigkeit Lösung.
- Entscheiden Sie sich für die Menge der ionischen Flüssigkeit Lösung m sol, endgültig und einem Biomasse-zu-Lösungsmittel - Verhältnis BM / sol endgültig. Hier verwenden 10 g Ionenflüssigkeitslösung, enthaltend 20 Gew% Wasser und eine Biomasse-zu-Lösungsmittel-Verhältnis von 1:10 g / g.
2. Vorbehandlung
Hinweis: Der Vorgang kann durch Belassen der Proben bei Raumtemperatur (für ein paar Tage) oder im Kühlschrank (längere Zeit) an jedem Punkt unterbrochen werden.
- Pre-wiegen drei 15-ml-Druckröhrchen mit Teflonkappen und Silikon-O-Ringe. Sichtprüfung der Druckschläuche sie keine Risse oder Mängel zu gewährleisten haben.
Hinweis: Größere Druckrohre Einbau mehrerer ionischer Flüssigkeit und Biomasse kann, wenn gewünscht, verwendet werden, obwohl Vorbehandlungs Ergebnisse nichtwerden direkt vergleichbar zwischen den Proben in verschiedenen Fläschchen Größen behandelt. Wir empfehlen die Verwendung von Front-Verschlusskappen für eine bessere Abdichtung. - Mit einer 10 ml Pipette, fügen Sie die erforderliche Menge an ionischen Flüssigkeit Lösung in das Druckrohr, die auf der Skala. Verwenden Kork Ringe das Rohr im Stehen zu halten. Das Gewicht der ionischen Flüssigkeit Lösung gegeben. Fügen Sie die erforderliche Menge an Wasser auf die in 1.5.6 bestimmt Lösung mit einer Pipette, die Dichte von Wasser unter der Annahme zu 1 g / ml.
- Fügen Sie die erforderliche Menge an der Luft getrocknet Lignocellulose durch ein Stück Alufolie legen (Abmessungen 3 cm x 8 cm) auf einer Waage, Tarierung der Waage und die Biomasse mit einem Gewicht aus. die Waage tariert und die Biomasse mit dem Rohr hinzuzufügen. Legen Sie die leere Folie zurück auf die Waage und die Differenz aufzuzeichnen.
Hinweis: Alternativ antistatischem Wägeschiffchen verwendet werden. - Schließen Sie den Deckel mit einem Teflon-Kappe mit Silikon-O-Ring. Überprüfen Sie für eine gute Abdichtung ohne Überdrehen. Das Gewicht des pruck-Röhrchen, die Biomasse und ionische Flüssigkeit. Mischen Sie den Inhalt des Rohrs durch Verwendung eines Vortex-Schüttler, bis alle der Biomasse in Kontakt mit der ionischen Flüssigkeit ist.
Hinweis: Nicht alle O-Ring-Materialien standhalten in Kontakt mit ionischen Flüssigkeiten bei erhöhter Temperatur zu sein. Wir fanden, dass Silikon funktioniert gut. - Platzieren Sie die Druckschläuche in einem Umluftofen, der auf die gewünschte Temperatur vorgewärmt wurde. Zum Beispiel lassen die Rohre für 8 h bei 120 ° C oder 1 Stunde bei 150 ° C.
Hinweis: Zeit und Temperatur sind wichtige experimentelle Variablen. Andere Zeit - Temperatur-Kombinationen verwendet werden. - Entfernen Sie die Ampullen aus dem Ofen eine Ofenhandschuh mit und legen Sie sie in einem Abzug sie auf Raumtemperatur abkühlen zu lassen. Überprüfen Sie das Gewicht der Flaschen nach dem Abkühlen kein Wasser, um sicherzustellen, während des Kochens entkommen.
3. Pulp Wash
- Transferieren des Inhalts jedes Röhrchens in ein 50 ml Zentrifugenröhrchen unter Verwendung von 40 ml absolute Ethanol. Schütteln Sie das Rohr mit einem Vortex-Schüttler für 1 min unter Verwendung von gut zu mischen und die Röhrchen bei Raumtemperatur für mindestens 1 Stunde verlassen.
Anmerkung: Die Trennung auch durchgeführt unter Verwendung von Filtration werden kann, jedoch eine geringere Genauigkeit kann für die vorgeschlagene Stichprobengröße zu beobachten. - Schütteln Sie die Röhre mit einem Vortex-Schüttler für weitere 30 sec verwenden, dann zentrifugieren Sie das Röhrchen 50 min bei 2.000 x g. Separate Flüssigkeit und Feststoff durch sorgfältige Umfüllen. Sammeln Sie die Flüssigkeit in einem sauberen 250 ml-Rundkolben, der mit einem Rührstab.
- In 40 ml frischem Ethanol in den 50-ml-Röhrchen und wiederholen Sie den Schritt 3.2 dreimal.
- Entfernen Sie das Ethanol aus der ionischen Flüssigkeit durch die Runde platzieren Kolben auf einem Heizblock. Verbinden jedes von ihnen mit einer Vakuumpumpe mit einer Kühlfalle. Füllen Sie die Falle mit Trockeneis und stellen Sie die Heizung auf 40 ° C. Schalten Sie das Rühren und Pumpe.
Hinweis: Dieses Experiment wird ein hausgemachtes parallel Verdampfer Aufbau basiert auf einer Parallelsynthese Set-up. Parallel Verdampfer können auch purchas seined fertige. Alternativ kann ein Rotationsverdampfer verwendet werden.
- Entfernen Sie das Ethanol aus der ionischen Flüssigkeit durch die Runde platzieren Kolben auf einem Heizblock. Verbinden jedes von ihnen mit einer Vakuumpumpe mit einer Kühlfalle. Füllen Sie die Falle mit Trockeneis und stellen Sie die Heizung auf 40 ° C. Schalten Sie das Rühren und Pumpe.
4. Soxhlet Extraktion von Pulp
- Übertragen Sie die nassen gewaschene Pulpe in Cellulose Fingerhüte und beschriften jedes Fingerhut mit einem Bleistift.
- Füllen Sie 150 ml absolutem Ethanol in einen sauberen 250 ml-Rundkolben, der mit einem Rührstab. Legen Sie die Probe enthaltenden Fingerhut in einen 40 ml Soxhlet-Extraktor, fügen Sie einen Kondensator und installieren Sie alles auf der parallel Extraktor Arbeitsstation zu einem Umlaufkühler verbunden.
Hinweis: Wenn Ethanol verwendet wurde die Pulpe zu übertragen, fügen nur die Differenz zu 150 ml mit dem Rundkolben. - Wenn alle Proben geladen werden, beginnen Rühren die Temperatur auf 135 ° C und schalten Sie den Rezirkulator (Temperatur 18 ° C eingestellt). Extrahieren Sie die Zellstoffproben für 20 Stunden insgesamt.
- Schalten Sie die Heizung aus, damit unter Rückfluß zum Stillstand zu kommen. Dann schalten beide Rühren und Kühlen ab. Nehmen Sie die Fingerhut aus dem Soxhlet-Extraktormit einer Pinzette und die nasse Zellstoff trocken in der Fingerhut über Nacht in einem Abzug lassen.
- Fügen Sie die Flüssigkeit aus der Soxhlet-Extraktion auf die Flüssigkeit aus der Biomasse zu waschen und weiterhin das Ethanol aus der Biomasse Waschung mit dem Parallelverdampfer verdampft oder einem Rotationsverdampfer bei 40 ° C.
- Übertragen Sie die luftgetrockneten Zellstoff aus dem Fingerhut auf ein Stück tarierte Aluminiumfolie auf einer Analysenwaage, notieren Sie die luftgetrocknete Gewicht des extrahierten Zellstoff- und gibt sie in eine Plastiktüte beschriftet. Versuchen Sie, alles zu erholen, während nicht Fingerhut Material von der Wand kratzen.
- Bestimmung der Feuchtigkeitsgehalt der Pulpe unmittelbar den Ofen getrocknet Ausbeute zu berechnen (wie zuvor gezeigt in Schritt 1.4).
5. Lignin Isolation
- Wenn alles Ethanol verdampft ist, fällt das Lignin durch die ionische Flüssigkeit aus dem Rundkolben in ein 50 ml Zentrifugenröhrchen übertragen 30 ml Wasser. Mischen Sie die Suspension und lassen Sie für mindestens 1 Stunde.Zentrifuge für 20 min bei 2000 xg und trennen die Lösung von dem Feststoff dekantiert.
Anmerkung: In diesem Protokoll wurden 3 Äquivalente Wasser als Antilösungsmittel verwendet wird. Weniger Antisolvent kann verwendet werden, falls gewünscht. Die Waschungen können gesammelt werden, um das Wasser entfernt und die ionische Flüssigkeit zur wiederholten Nutzung zurückgewonnen. - 30 ml destilliertes Wasser zu dem Lignin Pellet im Inneren des Zentrifugenröhrchens. Wiederholen Sie das Mischen, Inkubation für 1 Stunde und Zentrifugation. Wiederholen Sie diesen Schritt für insgesamt 3 Lignin Wäschen.
- Trocknen des Lignins im Inneren des Zentrifugenröhrchens einen Vakuumofen und einen durchbohrten Deckel bei 45 ° C über Nacht unter Verwendung von. Um das Lignin Ausbeute, legen Sie ein Stück Aluminiumfolie auf der Waage tariert das Gewicht zu bestimmen, fügen Lignin aus dem Ofen nehmen und notieren sofort das Gewicht. Übertragen Sie das Lignin in ein Fläschchen für die Lagerung.
Ergebnisse
Die genaue Menge an Lignin Entfernung und Ligninausfällung erholten sich die Zellstoff- und Glucoseausbeute von der Art der Biomasse abhängen verwendet, bei dem die Temperatur die Behandlung durchgeführt wird, und die Dauer der Behandlung. Kurzvorbehandlungszeiten und niedrigen Temperaturen führen zu unvollständiger Vorbehandlung während bei höheren Temperaturen die Cellulose in der ionischen Flüssigkeit instabil wird, was zu einer Hydrolyse und Abbau. Die ausgewählte ionische F...
Diskussion
Die Technik zur Fraktionierung von Lignocellulose hier präsentierten erzeugt eine cellulosereiche Pulpe und Lignin. Die meisten der Hemicellulosen werden in der ionischen Flüssigkeit gelöst und hydrolysiert, jedoch nicht zurückgewonnen. Wenn Hemicellulose Zucker gewünscht werden, kann eine Hemicellulose Vorextraktionsschritt vor dem Ionosolv Delignifizierung erforderlich sein. Es wurde bisher nicht möglich gewesen, vollständig die Massenbilanz für die Biomasse zu schließen, da es nicht möglich ist, alle Abbaup...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren erkennen die Grantham - Institut für Klimawandel und Umwelt, Klima-KIC und EPSRC (EP / K038648 / 1 und EP / K014676 / 1) für die Finanzierung und Pierre Bouvier für experimentelle Daten für Kiefer Vorbehandlungen bieten.
Materialien
| Name | Company | Catalog Number | Comments | |
| IL synthesis | ||||
| Round bottom flask, with standard ground joint 24/29 NS, 1000 ml | Lenz | 3 0024 70 | VWR product code 271-1309 | |
| 250mL Addition Funnel, Graduated, 29/26 Joint Size, 0-4mm PTFE Valve | GPE | CG-1714-16 | ||
| Dish-shaped dewar flask, SCH 31 CAL | KGW-Isotherm | 1197 | ||
| Volumetric flask, 200 ml | VWR | 612-3745 | ||
| Cork rings, pasteur pipettes and teet, wash bottle with deionised water, large magentic stir bar | ||||
| Biomass size reduction | ||||
| Heavy Duty Cutting Mill SM2000 | Retsch | Discontinued | Replaced with Cutting Mill SM 200 (20.728.0001) | |
| Bottom sieves (10 mesh square holes, for particle size <2 mm) | Retsch | 03.647.0318 | Part of cutting mill | |
| Analytical Sieve Shaker AS 200 | Retsch | 30.018.0001 | Part of sieving machine | |
| Test Sieve 200 mm Ø x 50 mm height ISO 3310/1 (180 µm) | Retsch | 60.131.000180 | Part of sieving machine | |
| Test Sieve 200 mm Ø x 50 mm height ISO 3310/1 (850 µm) | Retsch | 60.131.000850 | Part of sieving machine | |
| Collecting pan, stainless steel, 200 mm Ø, height 50 mm | Retsch | 69.720.0050 | Part of sieving machine | |
| Rotary evaporator: | ||||
| Rotary evaporator (Rotavapor R-210) | Buchi | Discontinued | Replaced with Rotavapor R-300 | |
| Water bath (Heating bath B-491) | Buchi | 48201 | Part of rotary evaporator | |
| Recirculator | Julabo | F25 | Part of rotary evaporator | |
| Vacuum pump (MPC 101 Z) | Ilmvac GmbH | 412522 | Part of rotary evaporator | |
| Vacuum controller (Vacuum Control Box VCB 521) | Ilmvac GmbH | 600053 | Part of rotary evaporator | |
| Parallel evaporator: | ||||
| StarFish Base Plate 135mm (for Radleys & IKA) | Radleys | RR95010 | Part of parallel evaporator | |
| Monoblock for 5 x 250ml Flasks | Radleys | RR95130 | Part of parallel evaporator | |
| Telescopic 5-way Clamp with Velcro | Radleys | RR95400 | Part of parallel evaporator | |
| Gas/Vacuum Manifold with connectors | Radleys | RR95510 | Part of parallel evaporator | |
| 650mm Rod | Radleys | RR95665 | Part of parallel evaporator | |
| Quick Release Male, R/A Barbed 6.4mm + Shut-off (3.2mm ID) | Radleys | RR95520 | Part of parallel evaporator | |
| Stirrer/hot plate | Radleys | RR98072 | Part of soxhlet extractor | |
| Temperature controller | Radleys | RR98073 | Part of soxhlet extractor | |
| Elliptical Stirring Bar 15mm Rare Earth | Radleys | RR98097 | Part of parallel evaporator | |
| Vacuum cold trap, plastic coated, PTFE stopcock | Chemglass | CG-4519-01 | Part of parallel evaporator | |
| Vacuum pump (MPC 101 Z) | Ilmvac GmbH | 412522 | Part of parallel evaporator | |
| Tygon tubing E-3603, 6,40 mm (internal) 12,80 mm (external) | Saint-Gobain/VWR | 228-1292 | Part of parallel evaporator | |
| Parallel Soxhlet extractor: | ||||
| StarFish Base Plate 135mm (for Radleys & IKA) | Radleys | RR95010 | Part of soxhlet extractor | |
| Monoblock for 5 x 250ml Flasks | Radleys | RR95130 | Part of soxhlet extractor | |
| Telescopic 5-way Clamp with Velcro | Radleys | RR95400 | Part of soxhlet extractor | |
| Telescopic 5-way Clamp with Silicone Strap and Long Handle | Radleys | RR95410 | Part of soxhlet extractor | |
| Water Manifold with connectors | Radleys | RR95500 | Part of soxhlet extractor | |
| 650mm Rod | Radleys | RR95665 | Part of soxhlet extractor | |
| Quick Release Male, R/A Barbed 6.4mm + Shut-off (3.2mm ID) | Radleys | RR95520 | Part of soxhlet extractor | |
| Coil condensers with standard ground joints 29/32 NS | Lenz | 5.2503.04 | Part of soxhlet extractor | |
| Extractor Soxhlet 40mL borosilicate glass 29/32 socket 24/29 cone | Quickfit | EX5/43 | Part of soxhlet extractor | |
| Stirrer/hot plate | Radleys | RR98072 | Part of soxhlet extractor | |
| Temperature controller | Radleys | RR98073 | Part of soxhlet extractor | |
| Recirculator | Grant | LTC1 | Part of soxhlet extractor | |
| Cellulose extraction thimble | Whatman | 2280-228 | ||
| Tweezers | Excelta | 20A-S-SE | ||
| Vacuum drying oven: | ||||
| Vacuum drying oven | Binder | VD 23 | Part of vacuum oven | |
| Dewar vessel 2L 100x290mm with handle | KGW-Isotherm | 10613 | Part of vacuum oven | |
| Vacuum Trap | GPE | CG-4532-01 | Part of vacuum oven | |
| Other equipment: | ||||
| Analytical balance | A&D | GH-252 | accuracy to ± 0.1 mg | |
| Volumetric Karl Fischer titrator | Mettler Toledo | V20 | ||
| 10 mL disposable pipette | Corning Inc | Costar 4101 10 mL Stripette | ||
| Eppendorf Research plus pipette, variable volume, volume 100-1000 μL | Eppendorf | 3120000062 | ||
| Desiccator | Jencons | JENC250-028BOM | ||
| Ace pressure tube bushing type, Front seal, volume 15 mL | Ace Glass | 8648-04 | ||
| Ace O-rings, silicone, 2.6 mm, I.D. 9.2 mm | Ace Glass | 7855216 | O-ring for pressure tube | |
| Vortex shaker | VWR International | 444-1378 (UK) | ||
| Fan-assisted convection oven | ThermoScientific | HeraTherm OMH60 | ||
| Oven glove (Crusader Flex) | Ansel Edmont | 42-325 | ||
| 250 mL Round bottom flask single neck ground joint 24/29 (Pyrex) | Quickfit | FR250/3S | ||
| Rotaflo stopcock adapter with cone 24/29 | Rotaflo England | MF11/2/SC | ||
| 50 mL Falcon tube | Heraeus/Kendro | HERA 76002844 | ||
| Centrifuge (Mega Star 3.0) | VWR | 521-1751 | ||
| Reagents: | ||||
| Ethanol absolute | VWR | 20820.464 | ||
| Triethylamine | Sigma-Aldrich | T0886 | ||
| Sulfuric acid 5 mol/l (10N) AVS TITRINORM volumetric solution Safe-break bottle 2,5L | VWR | 191665V | ||
| Purified water (15 MΩ ressitance) | Elga | CENTRA R200 | ||
| Lignocellulosic biomass: | ||||
| Miscanthus X gigantheus | ||||
| Pinus sylvestris |
Referenzen
- Lewis, N. S., Nocera, D. G. Powering the planet: chemical challenges in solar energy utilization. Proc.Natl.Acad.Sci.U.S.A. 103 (43), 15729-15735 (2006).
- Dincer, I. Renewable energy and sustainable development: a crucial review. Renewable and Sustainable Energy Reviews. 4 (2), 157-175 (2000).
- Zweibel, K., Mason, J., Fthenakis, V. A solar grand plan. Sci. Am. 298 (1), 64-73 (2008).
- Lee, J. Biological conversion of lignocellulosic biomass to ethanol. J. Biotechnol. 56 (1), 1-24 (1997).
- Carrott, P., Ribeiro Carrott, M. Lignin-from natural adsorbent to activated carbon: A review. Bioresour.Technol. 98 (12), 2301-2312 (2007).
- Cardona Alzate, C., Sánchez Toro, O. Energy consumption analysis of integrated flowsheets for production of fuel ethanol from lignocellulosic biomass. Energy. 31 (13), 2447-2459 (2006).
- Field, C. B., Campbell, J. E., Lobell, D. B. Biomass energy: the scale of the potential resource. Trends Biochem Sci. 23 (2), 65-72 (2008).
- Hoogwijk, M., et al. Exploration of the ranges of the global potential of biomass for energy. Biomass Bioenergy. 25 (2), 119-133 (2003).
- Goldemberg, J. Ethanol for a sustainable energy future. Science. 315 (5813), 808-810 (2007).
- Himmel, M. E., et al. Biomass recalcitrance: engineering plants and enzymes for biofuels production. Science. 315 (5813), 804-807 (2007).
- Mosier, N., et al. Features of promising technologies for pretreatment of lignocellulosic biomass. Bioresour.Technol. 96 (6), 673-686 (2005).
- Kumar, P., Barrett, D. M., Delwiche, M. J., Stroeve, P. Methods for pretreatment of lignocellulosic biomass for efficient hydrolysis and biofuel production. Ind Eng Chem Res. 48 (8), 3713-3729 (2009).
- Hu, F., Ragauskas, A. Suppression of pseudo-lignin formation under dilute acid pretreatment conditions. RSC Advances. 4 (9), 4317-4323 (2014).
- Chakar, F. S., Ragauskas, A. J. Review of current and future softwood kraft lignin process chemistry. Ind Crop Prod. 20 (2), 131-141 (2004).
- Mutjé, P., Pelach, M., Vilaseca, F., García, J., Jiménez, L. A comparative study of the effect of refining on organosolv pulp from olive trimmings and kraft pulp from eucalyptus wood. Bioresour.Technol. 96 (10), 1125-1129 (2005).
- Zhao, X., Cheng, K., Liu, D. Organosolv pretreatment of lignocellulosic biomass for enzymatic hydrolysis. Appl. Microbiol. Biotechnol. 82 (5), 815-827 (2009).
- Brandt, A., Gräsvik, J., Hallett, J. P., Welton, T. Deconstruction of lignocellulosic biomass with ionic liquids. Green Chem. 15, 550 (2012).
- Chen, L., et al. Inexpensive ionic liquids:[HSO 4]−-based solvent production at bulk scale). Green Chem. 16 (6), 3098-3106 (2014).
- Brandt, A., Chen, L., van Dongen, B. E., Welton, T., Hallett, J. P. Structural changes in lignins isolated using an acidic ionic liquid water mixture. Green Chem. 17, 5019-5034 (2015).
- Sluiter, A., et al. NREL/TP-510-42621. Determination of Total Solids in Biomass and Total Dissolved Solids in Liquid Process Samples. , (2008).
- Sluiter, A., et al. NREL/ TP - 510 - 42618Determination of Structural Carbohydrates and Lignin in Biomass. Determination of Structural Carbohydrates and Lignin in Biomass. , (2011).
- Resch, M. G., Baker, S. R., Decker, NREL/TP-5100-63351. Low Solids Enzymatic Saccharificatin of Lignocellulosic Biomass. , (2015).
- Brandt, A., Ray, M. J., To, T. Q., Leak, D. J., Murphy, R. J., Welton, T. Ionic liquid pretreatment of lignocellulosic biomass with ionic liquid-water mixtures. Green Chem. 13 (9), 2489-2499 (2011).
- Aver, K., Scortegagna, A., Fontana, R., Camassola, M. Saccharification of ionic-liquid-pretreated sugar cane bagasse using Penicillium echinulatum enzymes. J Taiwan Inst Chem Eng. 45 (5), 2060-2067 (2014).
- George, A., et al. Design of low-cost ionic liquids for lignocellulosic biomass pretreatment. Green Chem. 17 (3), 1728 (2015).
- Verdía, P., Brandt, A., Hallett, J. P., Ray, M. J., Welton, T. Fractionation of lignocellulosic biomass with the ionic liquid 1-butylimidazolium hydrogen sulfate. Green Chem. 16 (3), 1617-1627 (2014).
- Brandt, A., et al. Ionic liquid pretreatment of lignocellulosic biomass with ionic liquid-water mixtures. Green Chem. 13 (9), 2489-2499 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten