Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Le prétraitement de la biomasse lignocellulosique avec les liquides ioniques à faible coût
Dans cet article
Résumé
The pretreatment of lignocellulosic biomass with protic low-cost ionic liquids is shown, resulting in a delignified cellulose-rich pulp and a purified lignin. The pulp gives rise to high glucose yields after enzymatic saccharification.
Résumé
A number of ionic liquids (ILs) with economically attractive production costs have recently received growing interest as media for the delignification of a variety of lignocellulosic feedstocks. Here we demonstrate the use of these low-cost protic ILs in the deconstruction of lignocellulosic biomass (Ionosolv pretreatment), yielding cellulose and a purified lignin. In the most generic process, the protic ionic liquid is synthesized by accurate combination of aqueous acid and amine base. The water content is adjusted subsequently. For the delignification, the biomass is placed into a vessel with IL solution at elevated temperatures to dissolve the lignin and hemicellulose, leaving a cellulose-rich pulp ready for saccharification (hydrolysis to fermentable sugars). The lignin is later precipitated from the IL by the addition of water and recovered as a solid. The removal of the added water regenerates the ionic liquid, which can be reused multiple times. This protocol is useful to investigate the significant potential of protic ILs for use in commercial biomass pretreatment/lignin fractionation for producing biofuels or renewable chemicals and materials.
Introduction
la demande d'énergie de l'humanité Réunion est durablement l'un des plus grands défis que notre civilisation est confrontée. La consommation d'énergie devrait doubler dans les 50 prochaines années, en mettant plus de pression sur les ressources en combustibles fossiles. 1 L'accumulation de gaz à effet (GES) dans l'atmosphère à travers répandue l' utilisation de combustibles fossiles est particulièrement problématique, que le CO 2 généré par la combustion de combustibles fossiles est responsable de 50% de l'effet de serre anthropique. 2 par conséquent, l' application à grande échelle de technologies neutres renouvelables et de carbone est essentielle pour répondre aux besoins énergétiques et matériels accrus des générations futures. 1, 3
La biomasse végétale est la ressource renouvelable la plus polyvalent, car il peut être utilisé pour produire de la chaleur, l'électricité, ainsi que des produits chimiques, des matériaux et des combustibles à base de carbone. Les principaux avantages de la biomasse lignocellulosique par rapport aux autres types de biomasse sont son abondance, le potentiel de rendements élevés pezone r de terre et souvent beaucoup plus de CO 2 économies d'émissions, qui comprend une forte rétention du carbone dans le sol. 4, 5 autres avantages de l' utilisation de la biomasse comprennent la disponibilité locale, faibles besoins en capitaux pour convertir la biomasse en énergie, et la prévention de l' érosion des sols. 8
Les principaux producteurs de matières premières lignocellulosiques sont l'industrie forestière et le secteur agricole, ainsi que la gestion des déchets municipaux. 6 production lignocellulose a le potentiel pour être étendu, avec un esprit de limiter la déforestation et à éviter le remplacement des cultures vivrières et des rejets de polluants potentiels. 7 pour la biomasse renouvelable pour devenir une source généralisée viable des carburants et des produits chimiques liquides pour le transport, le traitement doit devenir économiquement compétitive avec les technologies de conversion des combustibles fossiles. 9, 10 une clé pour y parvenir est d'augmenter le rendement et la qualité des produits intermédiaires dérivés de la biomasse tout en réduisant coût.
La lignocellulose contient une forte proportion de sucres qui peuvent être convertis en carburants et produits chimiques via des conversions catalytiques et microbiennes. 11 Ces sucres sont présents dans la lignocellulose sous forme polymère que la cellulose et l' hémicellulose. Ils peuvent être hydrolyses en glucose et autres sucres monomères et ensuite utilisés pour la production de bioéthanol et d' autres produits chimiques bio-dérivés et les solvants. 12
Pour accéder aux sucres cellulosiques, le prétraitement de la biomasse est nécessaire grâce à des processus combinés physiques, chimiques, ou 4. Le prétraitement est sans doute l'étape la plus coûteuse dans la valorisation de la biomasse lignocellulosique. D'où la recherche de procédés de prétraitement améliorés est impératif.
Diverses technologies de prétraitement sont disponibles. D'un intérêt particulier sont celles qui séparent la lignine de la cellulose (prétraitement fractionative). La lignine, la troisième composante majeurelignocellulose, limite l' accès des agents à la cellulose et de l' hémicellulose en hydrolysant et réduit le rendement en sucre par tonne de charge d' alimentation. 11 La lignine séparée peut être utilisée comme une bioraffinerie intermédiaire supplémentaire , si elle est isolée dans la qualité appropriée. 13 Un procédé fractionative est le procédé Kraft qui est le prétraitement la plus courante pour la production du papier / cellulose. Dans le procédé kraft, les copeaux de bois sont placés dans un mélange d'hydroxyde de sodium et du sulfure de sodium et on chauffe à des températures élevées d'environ 170 ° C sous une pression élevée. 14 Les réactions alcalines éliminent l' hémicellulose et la lignine en brisant les polymères jusqu'à fragments courts par l' intermédiaire nucléophile et catalyse basique, et en dissolvant les fragments de lignine par l' intermédiaire de-protonation des groupes hydroxyle / alcool phénoliques. Un autre procédé de délignification commun est le processus Organosolv qui fragmente également et dissout la lignine et l'hémicellulose. Plutôt que d'utiliser un Aqueo alcalinSolution nous, les solvants organiques tels que l'éthanol et l'acide acétique sont utilisés à des températures élevées comprises entre 160 à 200 ° C et des pressions de 5 à 30 bars. Organosolv prétraitement a certains avantages par rapport à la pâte kraft en ce qu'il produit moins d' air et de la pollution de l' eau. 15 Les deux procédés possèdent des défis économiques, si elle est utilisée pour la production de produits chimiques et des carburants plutôt que de la cellulose. 16 Le prétraitement Ionosolv utilise des liquides ioniques, qui sont des sels qui ont des points de fusion inférieurs à 100 ° C et, en raison de leurs interactions coulombiennes puissants, des pressions de vapeur très faibles. 17 Ceci élimine la pollution de l' air dans le processus de pré - traitement, et permet le traitement au niveau ou près de la pression atmosphérique.
Alors que la plupart des ILs sont créés dans laborieuses, des synthèses multi-étapes, ILs protiques peuvent être synthétisés dans un procédé à une seule étape à partir de produits chimiques de base, ce qui les rend moins coûteux; on estime que certains ILs peuvent être produits à grande échelle en vrac pour uneprix de 1,24 $ par kg , ce qui est comparable aux solvants organiques courants tels que l' acétone et le toluène. 18 La capacité de recycler et de réutiliser ces ILs personnalisables dans un processus qui fonctionne à des températures relativement faibles et des pressions en fait une alternative plus bénigne et un candidat économiquement attrayante pour bioraffinage.
Ce protocole vidéo montre une version détaillée l' échelle du laboratoire du processus Ionosolv pour la délignification de la biomasse lignocellulosique et de la saccharification enzymatique éventuelle de la pâte de cellulose riche ainsi que la récupération d'une lignine sans odeur de haute pureté 19.
Protocole
Remarque: Les liquides ioniques protiques utilisés dans le procédé sont synthétisés dans notre laboratoire, bien que certains puissent être ou deviennent disponibles dans le commerce. Les liquides ioniques résultant sont acides et corrosifs et irritants probablement la peau / des yeux (en fonction de l'amine utilisée), et doivent donc être manipulés avec soin de porter des EPI appropriés (blouse de laboratoire, caractéristiques de sécurité, des gants résistant).
1. Préparation
- La préparation et le stockage de la biomasse lignocellulosique
- Obtenir la biomasse lignocellulosique avant l'expérience en quantité suffisante, par exemple de 100 g à 5 kg.
Note: Chaque expérience nécessite au moins 3 g de biomasse (1 g chacun en triple). - Réduire la teneur en humidité, peu après la récolte et de stocker la biomasse sous forme séchée à l'air dans le laboratoire. Air-sécher la biomasse par la propagation de la biomasse sur une table ou un banc et laisser pendant 2 semaines ou jusqu'à ce qu'il apparaisse sec. Déplacer et tourner la biomasse lors de tson temps pour accélérer le processus. Effectuer les expériences de fractionnement dans une année de récolte.
Remarque: Directement après la récolte, la biomasse ligneuse peut contenir jusqu'à 50% en poids d'humidité, tandis que l'air séché la biomasse, qui est plus stable, contient 5-12% en poids d'humidité. - Broyer et tamiser la biomasse à une sélection gamme de taille des particules. Rangez la biomasse séchée dans des sacs en plastique ou autres récipients appropriés jusqu'à l'utilisation.
Remarque: Pour les petits échantillons traités dans ce protocole, une taille de particule réduite est recommandée, par exemple 180-850 um.
- Obtenir la biomasse lignocellulosique avant l'expérience en quantité suffisante, par exemple de 100 g à 5 kg.
- La détermination de la teneur en humidité de la biomasse (selon le protocole de NREL) 20
- Pour déterminer la teneur en humidité de la biomasse, prépesée un morceau de feuille d'aluminium (taille d' environ 5 cm x 5 cm) sur une balance analytique et enregistrer le poids de la feuille (m feuille). Peser environ 100 mg de l'air sec de la biomasse sur la feuille d'aluminium et d'enregistrer l'exacte air-dripoids ed (m ADW).
- Plier la feuille d'aluminium pour faire un paquet et placer dans un four ventilé à 105 ° C pendant une nuit (au moins pendant 4 heures).
- Prenez le paquet et placez - le immédiatement dans un dessiccateur pendant 5 minutes, puis peser le paquet immédiatement et enregistrer le poids exact du poids séché au four , plus une feuille (m ODW + feuille). Calculer la teneur en humidité (en%) de la biomasse BM mc selon l'équation 1:
 Éq. 1
Éq. 1
Où m + ODW feuille est le poids du sachet séché au four (biomasse séchées au four ainsi que la feuille), la feuille m est le poids de la feuille et ADW m est la masse séchée à l'air de la biomasse. Tous les poids doivent être soit en g ou en mg.
- Synthèse du liquide ionique
- Dans une hotte ou une enceinte ventilée, peser 1 molede l'amine (triéthylamine) dans un ballon à fond rond de 1 L avec une barre d'agitation magnétique. Placer la fiole dans un bain de glace sur une plaque d'agitateur magnétique. Ajouter 250 ml d'une ampoule d'addition immédiatement afin de minimiser l'évaporation de l'aminé.
Remarque: Veiller à l'acide correct: rapport de base est d'une grande importance pour atteindre la reproductibilité des expériences de prétraitement. - Mesurer 1 mole d'acide sulfurique, en utilisant une solution de concentration connue (dans cet exemple 5 mol / l) et un flacon volumétrique (200 ml). Transférer l'acide sulfurique dans l'entonnoir d'addition et de rincer tout acide adhérant aux parois de la fiole jaugée dans l'entonnoir d'addition avec de l'eau déminéralisée.
- Ajouter goutte à goutte de l'acide sulfurique à l'aminé, tout en agitant vigoureusement. Assurez-vous que la solution ne chauffe pas, car cela conduirait à l'ébullition de l'amine et un rapport inexact de l'acide à la base. Rincer l'intérieur de l'entonnoir d'addition en utilisant de l'eau déminéralisée pour assurer l'acide est transféré quantitativement.
Remarque: Grands lots de solution de liquide ionique peut être faite en augmentant la quantité d'amine et d'acide sulfurique, ainsi que le volume du ballon en conséquence. - S'évaporer la majeure partie de l'eau en utilisant un évaporateur rotatif. La teneur en eau doit être inférieure à la teneur en eau nécessaire pour le prétraitement.
Remarque: Il est nécessaire de sécher complètement le liquide ionique. Il peut être avantageux de laisser un peu d'eau dans le liquide ionique, comme des liquides ioniques séchées, y compris le sulfate de triéthylammonium d'hydrogène, sont solides à la température ambiante. Un lyophilisateur peut également être utilisé pour abaisser la teneur en eau.
- Dans une hotte ou une enceinte ventilée, peser 1 molede l'amine (triéthylamine) dans un ballon à fond rond de 1 L avec une barre d'agitation magnétique. Placer la fiole dans un bain de glace sur une plaque d'agitateur magnétique. Ajouter 250 ml d'une ampoule d'addition immédiatement afin de minimiser l'évaporation de l'aminé.
- La confirmation et l' ajustement de la teneur en eau de la solution d' IL
Remarque: La teneur en eau est une variable expérimentale importante. Il existe trois sources que l'eau contenue dans le mélange de pré-traitement peut provenir. Chacun d'entre eux doivent être pris en compte: (1) l'eau contenue dans la solution liquide ionique synthétisé ou acheté (2) l'eau contenue dans til biomasse séchée à l'air et (3) toute eau ajoutée avec une pipette pour obtenir la teneur en eau finale souhaitée.- Déterminer la teneur en eau de la solution liquide ionique synthétisé ou acheté par titrage volumétrique Karl Fischer selon les instructions fournies par le fabricant du titreur. Ajouter quelques gouttes de l'IL dans le titrateur à l'aide d'une seringue pré-pesé. Entrez le poids du liquide ajouté dans le titreur et attendre jusqu'à ce que le titreur affiche une lecture. Notez la teneur en eau.
- Décider d'une teneur en eau pour le prétraitement de la biomasse. Dans cette expérience, utiliser 20% en poids. Réduire la teneur en eau de 5% en poids en dessous de la teneur en eau souhaitée à l'aide d'un évaporateur rotatif et confirmer le nouveau contenu de l'eau par titrage Karl Fischer comme décrit dans 1.4.1.
Nota: De bons résultats sont obtenus avec 20% en poids d'eau; mais cela peut ne pas être toujours l'optimum pour le prétraitement. Une teneur en eau plus élevée peut être choisie afin de réduire le coût du solvant ou à faible viscosité.
- Les calculs pour l'expérience.
- Décider de la quantité de liquide ionique solution de m sol, finale et un ratio BM biomasse à solvant / finale sol. Ici, en utilisant 10 g d'une solution liquide ionique contenant 20% en poids d'eau et un rapport de la biomasse en solvant de 01:10 g / g.
Remarque: Les tubes utilisés dans ce protocole peut accueillir jusqu'à 18 g de solution IL si la biomasse sur solvant est de 1:10 (poids / poids). Un ratio élevé de la biomasse à solvant (jusqu'à 1: 2 ou même 1: 1) est favorable d'un point de vue économique, mais pourrait compromettre l'efficacité de prétraitement à petite échelle. - Déterminer la quantité de liquide ionique (exempt d'eau) requis pour chaque échantillon selon l'équation 2 suivante:
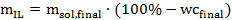 Éq. 2
Éq. 2
Où m IL est la quantité requise de liquide ionique en grammes, m sol, final est la quantité désirée de solution liquide ionique en grammes, et dernier wc </ Sub> est la teneur en eau souhaitée (en%) dans la solution de liquide ionique. - Ensuite, calculer la quantité de solution liquide ionique synthétisé ou acheté à ajouter dans chaque tube de pression selon l'équation 3 suivante:
 Éq. 3
Éq. 3
Où m sol est la quantité de solution à ajouter dans chaque tube de pression (en grammes), m IL est la quantité requise de liquide ionique (en grammes), et wc sol est la teneur en eau dans la solution liquide ionique (en%) tel que déterminé par titrage Karl Fischer. - Déterminer la quantité de biomasse (sur la base du poids séché au four) à ajouter à la solution de liquide ionique en utilisant l'équation 4 ci-dessous. Dans cette expérience, utiliser 1 g de séché au four Miscanthus biomasse par tube de pression.
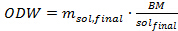 Éq. 4
Éq. 4
Où ODW est la quantité de biomasse à ajoutered dans chaque tube de pression (en grammes), m sol, finale est la quantité souhaitée de solution liquide ionique (en grammes) et BM / sol final est le rapport désiré de la solution de la biomasse en liquide ionique. - Déterminer le poids de la biomasse séchée à l'air qui doit être ajouté dans le tube en utilisant l'équation 5 suivante:
 Éq. 5
Éq. 5
où ADW est le poids séché à l'air de la biomasse à ajouter dans le tube (en grammes), est ODW poids de la biomasse nécessaire pour l'expérience (déterminé 1.5.4 en grammes) séché au four et mc est la valeur BM déterminé à 1.2.3. - Calculer la quantité d'eau doit être ajoutée à la pipette pour obtenir la teneur désirée en eau finale, selon l'équation 6 suivante:
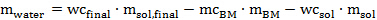 Éq. 6
Éq. 6
Où m d' eau est la quantité deeau à ajouter, wc final est la teneur en eau désirée dans le mélange de pré - traitement (ici 20% en poids), m sol.final est la quantité de solvant (ici 10 g), mc BM est la teneur en humidité de la biomasse séchée à l'air m BM est la quantité de biomasse séchée à l'air doit être ajouté, wC sol est la teneur en eau de la solution liquide ionique synthétisé ou acheté, et m sol est la quantité de solution liquide ionique.
- Décider de la quantité de liquide ionique solution de m sol, finale et un ratio BM biomasse à solvant / finale sol. Ici, en utilisant 10 g d'une solution liquide ionique contenant 20% en poids d'eau et un rapport de la biomasse en solvant de 01:10 g / g.
2. Prétraitement
Remarque: Le processus peut être interrompu à tout moment en laissant les échantillons à température ambiante (pendant quelques jours) ou dans le réfrigérateur (pour de plus longues périodes).
- Pré-peser trois tubes de 15 ml de pression avec des bouchons en téflon et anneaux en silicone O. Inspecter visuellement les tubes de pression pour assurer qu'ils ont pas de fissures ou défauts.
Note: les tubes de pression plus grands ajustés liquide et la biomasse plus ionique peuvent être utilisés si on le souhaite, bien que les résultats de prétraitement ne sera pasêtre directement comparables entre les échantillons traités dans différentes tailles de flacons. Nous recommandons l'utilisation de bouchons avant-étanchéité pour une meilleure étanchéité. - Avec une pipette de 10 ml, ajouter la quantité requise de solution de liquide ionique dans le tube de pression permanente sur l'échelle. Utilisez les anneaux de liège pour maintenir le tube debout. Enregistrer le poids de la solution de liquide ionique ajouté. Ajouter la quantité d'eau nécessaire à la solution déterminée 1.5.6 à l'aide d'une pipette, en supposant que la densité de l'eau à 1 g / ml.
- Ajouter la quantité requise de lignocellulose séché à l'air en plaçant un morceau de papier d'aluminium (dimensions 3 cm x 8 cm) sur une balance, tarer la balance et peser la biomasse. Tarer la balance et ajouter la biomasse au tube. Placez la feuille vide de retour sur la balance et enregistrer la différence.
Remarque: Alternativement, les bateaux de pesage antistatiques peuvent être utilisés. - Fermez le couvercle avec un bouchon en téflon avec joint torique en silicone. Vérifiez pour une bonne étanchéité sans trop serrer. Enregistrer le poids de la pdes tubes de ression contenant de la biomasse et le liquide ionique. Mélanger le contenu du tube à l'aide d'un agitateur à vortex jusqu'à ce que la totalité de la biomasse est en contact avec le liquide ionique.
Remarque: Tous les matériaux des joints toriques résistent en étant en contact avec des liquides ioniques à température élevée. Nous avons trouvé que le silicone fonctionne bien. - Placer les tubes de pression dans un four à circulation d'air qui a été préchauffé à la température souhaitée. Par exemple, laisser les tubes pendant 8 heures à 120 ° C ou pendant 1 heure à 150 ° C.
Remarque: Le temps et la température sont des variables expérimentales importantes. Autres temps - combinaisons de température peuvent être utilisés. - Retirer les flacons du four à l'aide d'un gant de four et les placer dans une hotte pour les laisser refroidir à température ambiante. Vérifiez le poids des flacons après refroidissement pour assurer sans eau échappé pendant la cuisson.
3. Pulp Wash
- Transférer le contenu de chaque tube dans un tube à centrifuger de 50 ml en utilisant 40 ml d'absolue éthanol. Agiter le tube à l'aide d'un agitateur à vortex pendant 1 min pour bien mélanger et laisser le tube à la température ambiante pendant au moins 1 h.
Remarque: La séparation peut aussi être réalisée en utilisant une filtration, cependant, moins de précision peut être observée pour la taille de l'échantillon suggérée. - Agiter le tube à l'aide d'un agitateur à vortex pendant 30 secondes, puis centrifuger le tube pendant 50 min à 2000 x g. liquide séparé et solide par décantation soigneuse. Recueillir le liquide dans un endroit propre rond de 250 ml flacon à fond avec une barre d'agitation.
- Ajouter 40 ml d'éthanol frais dans les 50 ml tube et répétez l'étape 3.2 trois fois.
- Éliminer l'éthanol à partir du liquide ionique en plaçant le ballon à fond des flacons sur un bloc chauffant. Connectez chacun d'eux à une pompe à vide avec un piège à froid. Remplissez le piège de la glace sèche et régler le chauffage à 40 ° C. Allumez agitation et de la pompe.
Remarque: Cette expérience utilise un évaporateur parallèle set-up fait maison basée sur une synthèse parallèle set-up. évaporateurs parallèles peuvent aussi être Purchased ready-made. En variante, un évaporateur rotatif, peut être utilisé.
- Éliminer l'éthanol à partir du liquide ionique en plaçant le ballon à fond des flacons sur un bloc chauffant. Connectez chacun d'eux à une pompe à vide avec un piège à froid. Remplissez le piège de la glace sèche et régler le chauffage à 40 ° C. Allumez agitation et de la pompe.
4. Soxhlet Extraction de Pulp
- Transférer la pâte lavée humide dans cosses de cellulose et étiqueter chaque virole en utilisant un crayon.
- Remplir l'éthanol 150 ml absolue dans un propre ballon de 250 ml avec une barre d'agitation à fond rond. Insérez la cartouche contenant l'échantillon dans un 40 ml extracteur Soxhlet, ajouter un condenseur et tout installer sur la station parallèle extracteur de travail relié à un refroidisseur à circulation.
Remarque: Si l'éthanol a été utilisé pour transférer la pâte à papier, ajouter que la différence à 150 ml dans le ballon à fond rond. - Lorsque tous les échantillons sont chargés, commencer l'agitation, régler la température à 135 ° C et allumez le recirculateur (réglage de la température 18 ° C). Extraire les échantillons de pâte pendant 20 heures au total.
- Eteignez le chauffage pour permettre au reflux à venir à une halte. Puis passer à la fois l'agitation et refroidissement. Prenez les cosses de l'extracteur Soxhleten utilisant des pinces et laisser le mouillé à sec de la pâte dans la nuit cartouche dans une hotte.
- Ajouter le liquide provenant de l'extraction Soxhlet au liquide de lavage de la biomasse et poursuivre l'évaporation de l'éthanol provenant du lavage de la biomasse à l'évaporateur parallèle ou d'un évaporateur rotatif à 40 ° C.
- Transférer la pâte séchée à l'air de la cartouche sur un morceau de papier d'aluminium taré sur une balance analytique, enregistrer le poids séché à l'air de la pâte extraite et le transférer dans un sac en plastique étiquetés. Essayez de récupérer tout sans raclage matériau virole sur le mur.
- Déterminer la teneur en humidité de la pâte immédiatement pour calculer le rendement séché au four (comme indiqué précédemment à l'étape 1.4).
5. lignine Isolation
- Quand tout l'éthanol est évaporé, de précipiter la lignine en transférant le liquide ionique dans le ballon à fond rond dans un tube de centrifugation de 50 ml en utilisant 30 ml d'eau. Mélanger la suspension et laisser reposer pendant au moins 1 h.Centrifuger pendant 20 min à 2000 x g, et on sépare la solution du solide par décantation.
Remarque: Dans ce protocole, 3 équivalents d'eau sont utilisés comme antisolvant. Moins antisolvant peut être utilisé, si désiré. Les lavages peuvent être collectés, l'eau éliminée et le liquide ionique récupéré pour une utilisation répétée. - Ajouter 30 ml d'eau distillée à la pastille de lignine à l'intérieur du tube de centrifugation. Répéter le mélange, l'incubation pendant 1 h, et la centrifugation. Répétez cette étape pour un total de 3 lavages de lignine.
- Sécher la lignine à l'intérieur du tube de centrifugation en utilisant un four à vide et un couvercle percé à 45 ° C pendant une nuit. Pour déterminer le rendement de la lignine, placez un morceau de papier d'aluminium sur la balance, tarer le poids, ajouter la lignine du four et enregistrer le poids immédiatement. Transférer la lignine dans un flacon pour le stockage.
Résultats
La quantité exacte d'élimination de la lignine et de la lignine précipitation, récupérer la pâte et le rendement du glucose dépendent du type de biomasse utilisée, la température à laquelle le traitement est exécuté et la durée du traitement. temps de prétraitement courts et des températures basses conduisent à un prétraitement incomplète tandis qu'à des températures plus élevées de la cellulose devient instable dans le liquide ionique, conduisant à l'h...
Discussion
La technique pour le fractionnement de la biomasse lignocellulosique présenté ici produit une pâte riche en cellulose et la lignine. La plupart des hémicelluloses sont dissous dans le liquide ionique et hydrolysé, mais non récupérés. Si les sucres hémicellulosiques sont désirés, une étape de pré-extraction d'hémicellulose avant la délignification Ionosolv peut être nécessaire. Il a été jusqu'ici impossible de fermer complètement l'équilibre de masse pour la biomasse, car il est impossibl...
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Les auteurs reconnaissent l'Institut Grantham pour le changement climatique et l'environnement, Climate-KIC et EPSRC (EP / K038648 / 1 et EP / K014676 / 1) pour le financement et Pierre Bouvier pour fournir des données expérimentales pour prétraitements de pin.
matériels
| Name | Company | Catalog Number | Comments | |
| IL synthesis | ||||
| Round bottom flask, with standard ground joint 24/29 NS, 1000 ml | Lenz | 3 0024 70 | VWR product code 271-1309 | |
| 250mL Addition Funnel, Graduated, 29/26 Joint Size, 0-4mm PTFE Valve | GPE | CG-1714-16 | ||
| Dish-shaped dewar flask, SCH 31 CAL | KGW-Isotherm | 1197 | ||
| Volumetric flask, 200 ml | VWR | 612-3745 | ||
| Cork rings, pasteur pipettes and teet, wash bottle with deionised water, large magentic stir bar | ||||
| Biomass size reduction | ||||
| Heavy Duty Cutting Mill SM2000 | Retsch | Discontinued | Replaced with Cutting Mill SM 200 (20.728.0001) | |
| Bottom sieves (10 mesh square holes, for particle size <2 mm) | Retsch | 03.647.0318 | Part of cutting mill | |
| Analytical Sieve Shaker AS 200 | Retsch | 30.018.0001 | Part of sieving machine | |
| Test Sieve 200 mm Ø x 50 mm height ISO 3310/1 (180 µm) | Retsch | 60.131.000180 | Part of sieving machine | |
| Test Sieve 200 mm Ø x 50 mm height ISO 3310/1 (850 µm) | Retsch | 60.131.000850 | Part of sieving machine | |
| Collecting pan, stainless steel, 200 mm Ø, height 50 mm | Retsch | 69.720.0050 | Part of sieving machine | |
| Rotary evaporator: | ||||
| Rotary evaporator (Rotavapor R-210) | Buchi | Discontinued | Replaced with Rotavapor R-300 | |
| Water bath (Heating bath B-491) | Buchi | 48201 | Part of rotary evaporator | |
| Recirculator | Julabo | F25 | Part of rotary evaporator | |
| Vacuum pump (MPC 101 Z) | Ilmvac GmbH | 412522 | Part of rotary evaporator | |
| Vacuum controller (Vacuum Control Box VCB 521) | Ilmvac GmbH | 600053 | Part of rotary evaporator | |
| Parallel evaporator: | ||||
| StarFish Base Plate 135mm (for Radleys & IKA) | Radleys | RR95010 | Part of parallel evaporator | |
| Monoblock for 5 x 250ml Flasks | Radleys | RR95130 | Part of parallel evaporator | |
| Telescopic 5-way Clamp with Velcro | Radleys | RR95400 | Part of parallel evaporator | |
| Gas/Vacuum Manifold with connectors | Radleys | RR95510 | Part of parallel evaporator | |
| 650mm Rod | Radleys | RR95665 | Part of parallel evaporator | |
| Quick Release Male, R/A Barbed 6.4mm + Shut-off (3.2mm ID) | Radleys | RR95520 | Part of parallel evaporator | |
| Stirrer/hot plate | Radleys | RR98072 | Part of soxhlet extractor | |
| Temperature controller | Radleys | RR98073 | Part of soxhlet extractor | |
| Elliptical Stirring Bar 15mm Rare Earth | Radleys | RR98097 | Part of parallel evaporator | |
| Vacuum cold trap, plastic coated, PTFE stopcock | Chemglass | CG-4519-01 | Part of parallel evaporator | |
| Vacuum pump (MPC 101 Z) | Ilmvac GmbH | 412522 | Part of parallel evaporator | |
| Tygon tubing E-3603, 6,40 mm (internal) 12,80 mm (external) | Saint-Gobain/VWR | 228-1292 | Part of parallel evaporator | |
| Parallel Soxhlet extractor: | ||||
| StarFish Base Plate 135mm (for Radleys & IKA) | Radleys | RR95010 | Part of soxhlet extractor | |
| Monoblock for 5 x 250ml Flasks | Radleys | RR95130 | Part of soxhlet extractor | |
| Telescopic 5-way Clamp with Velcro | Radleys | RR95400 | Part of soxhlet extractor | |
| Telescopic 5-way Clamp with Silicone Strap and Long Handle | Radleys | RR95410 | Part of soxhlet extractor | |
| Water Manifold with connectors | Radleys | RR95500 | Part of soxhlet extractor | |
| 650mm Rod | Radleys | RR95665 | Part of soxhlet extractor | |
| Quick Release Male, R/A Barbed 6.4mm + Shut-off (3.2mm ID) | Radleys | RR95520 | Part of soxhlet extractor | |
| Coil condensers with standard ground joints 29/32 NS | Lenz | 5.2503.04 | Part of soxhlet extractor | |
| Extractor Soxhlet 40mL borosilicate glass 29/32 socket 24/29 cone | Quickfit | EX5/43 | Part of soxhlet extractor | |
| Stirrer/hot plate | Radleys | RR98072 | Part of soxhlet extractor | |
| Temperature controller | Radleys | RR98073 | Part of soxhlet extractor | |
| Recirculator | Grant | LTC1 | Part of soxhlet extractor | |
| Cellulose extraction thimble | Whatman | 2280-228 | ||
| Tweezers | Excelta | 20A-S-SE | ||
| Vacuum drying oven: | ||||
| Vacuum drying oven | Binder | VD 23 | Part of vacuum oven | |
| Dewar vessel 2L 100x290mm with handle | KGW-Isotherm | 10613 | Part of vacuum oven | |
| Vacuum Trap | GPE | CG-4532-01 | Part of vacuum oven | |
| Other equipment: | ||||
| Analytical balance | A&D | GH-252 | accuracy to ± 0.1 mg | |
| Volumetric Karl Fischer titrator | Mettler Toledo | V20 | ||
| 10 mL disposable pipette | Corning Inc | Costar 4101 10 mL Stripette | ||
| Eppendorf Research plus pipette, variable volume, volume 100-1000 μL | Eppendorf | 3120000062 | ||
| Desiccator | Jencons | JENC250-028BOM | ||
| Ace pressure tube bushing type, Front seal, volume 15 mL | Ace Glass | 8648-04 | ||
| Ace O-rings, silicone, 2.6 mm, I.D. 9.2 mm | Ace Glass | 7855216 | O-ring for pressure tube | |
| Vortex shaker | VWR International | 444-1378 (UK) | ||
| Fan-assisted convection oven | ThermoScientific | HeraTherm OMH60 | ||
| Oven glove (Crusader Flex) | Ansel Edmont | 42-325 | ||
| 250 mL Round bottom flask single neck ground joint 24/29 (Pyrex) | Quickfit | FR250/3S | ||
| Rotaflo stopcock adapter with cone 24/29 | Rotaflo England | MF11/2/SC | ||
| 50 mL Falcon tube | Heraeus/Kendro | HERA 76002844 | ||
| Centrifuge (Mega Star 3.0) | VWR | 521-1751 | ||
| Reagents: | ||||
| Ethanol absolute | VWR | 20820.464 | ||
| Triethylamine | Sigma-Aldrich | T0886 | ||
| Sulfuric acid 5 mol/l (10N) AVS TITRINORM volumetric solution Safe-break bottle 2,5L | VWR | 191665V | ||
| Purified water (15 MΩ ressitance) | Elga | CENTRA R200 | ||
| Lignocellulosic biomass: | ||||
| Miscanthus X gigantheus | ||||
| Pinus sylvestris |
Références
- Lewis, N. S., Nocera, D. G. Powering the planet: chemical challenges in solar energy utilization. Proc.Natl.Acad.Sci.U.S.A. 103 (43), 15729-15735 (2006).
- Dincer, I. Renewable energy and sustainable development: a crucial review. Renewable and Sustainable Energy Reviews. 4 (2), 157-175 (2000).
- Zweibel, K., Mason, J., Fthenakis, V. A solar grand plan. Sci. Am. 298 (1), 64-73 (2008).
- Lee, J. Biological conversion of lignocellulosic biomass to ethanol. J. Biotechnol. 56 (1), 1-24 (1997).
- Carrott, P., Ribeiro Carrott, M. Lignin-from natural adsorbent to activated carbon: A review. Bioresour.Technol. 98 (12), 2301-2312 (2007).
- Cardona Alzate, C., Sánchez Toro, O. Energy consumption analysis of integrated flowsheets for production of fuel ethanol from lignocellulosic biomass. Energy. 31 (13), 2447-2459 (2006).
- Field, C. B., Campbell, J. E., Lobell, D. B. Biomass energy: the scale of the potential resource. Trends Biochem Sci. 23 (2), 65-72 (2008).
- Hoogwijk, M., et al. Exploration of the ranges of the global potential of biomass for energy. Biomass Bioenergy. 25 (2), 119-133 (2003).
- Goldemberg, J. Ethanol for a sustainable energy future. Science. 315 (5813), 808-810 (2007).
- Himmel, M. E., et al. Biomass recalcitrance: engineering plants and enzymes for biofuels production. Science. 315 (5813), 804-807 (2007).
- Mosier, N., et al. Features of promising technologies for pretreatment of lignocellulosic biomass. Bioresour.Technol. 96 (6), 673-686 (2005).
- Kumar, P., Barrett, D. M., Delwiche, M. J., Stroeve, P. Methods for pretreatment of lignocellulosic biomass for efficient hydrolysis and biofuel production. Ind Eng Chem Res. 48 (8), 3713-3729 (2009).
- Hu, F., Ragauskas, A. Suppression of pseudo-lignin formation under dilute acid pretreatment conditions. RSC Advances. 4 (9), 4317-4323 (2014).
- Chakar, F. S., Ragauskas, A. J. Review of current and future softwood kraft lignin process chemistry. Ind Crop Prod. 20 (2), 131-141 (2004).
- Mutjé, P., Pelach, M., Vilaseca, F., García, J., Jiménez, L. A comparative study of the effect of refining on organosolv pulp from olive trimmings and kraft pulp from eucalyptus wood. Bioresour.Technol. 96 (10), 1125-1129 (2005).
- Zhao, X., Cheng, K., Liu, D. Organosolv pretreatment of lignocellulosic biomass for enzymatic hydrolysis. Appl. Microbiol. Biotechnol. 82 (5), 815-827 (2009).
- Brandt, A., Gräsvik, J., Hallett, J. P., Welton, T. Deconstruction of lignocellulosic biomass with ionic liquids. Green Chem. 15, 550 (2012).
- Chen, L., et al. Inexpensive ionic liquids:[HSO 4]−-based solvent production at bulk scale). Green Chem. 16 (6), 3098-3106 (2014).
- Brandt, A., Chen, L., van Dongen, B. E., Welton, T., Hallett, J. P. Structural changes in lignins isolated using an acidic ionic liquid water mixture. Green Chem. 17, 5019-5034 (2015).
- Sluiter, A., et al. NREL/TP-510-42621. Determination of Total Solids in Biomass and Total Dissolved Solids in Liquid Process Samples. , (2008).
- Sluiter, A., et al. NREL/ TP - 510 - 42618Determination of Structural Carbohydrates and Lignin in Biomass. Determination of Structural Carbohydrates and Lignin in Biomass. , (2011).
- Resch, M. G., Baker, S. R., Decker, NREL/TP-5100-63351. Low Solids Enzymatic Saccharificatin of Lignocellulosic Biomass. , (2015).
- Brandt, A., Ray, M. J., To, T. Q., Leak, D. J., Murphy, R. J., Welton, T. Ionic liquid pretreatment of lignocellulosic biomass with ionic liquid-water mixtures. Green Chem. 13 (9), 2489-2499 (2011).
- Aver, K., Scortegagna, A., Fontana, R., Camassola, M. Saccharification of ionic-liquid-pretreated sugar cane bagasse using Penicillium echinulatum enzymes. J Taiwan Inst Chem Eng. 45 (5), 2060-2067 (2014).
- George, A., et al. Design of low-cost ionic liquids for lignocellulosic biomass pretreatment. Green Chem. 17 (3), 1728 (2015).
- Verdía, P., Brandt, A., Hallett, J. P., Ray, M. J., Welton, T. Fractionation of lignocellulosic biomass with the ionic liquid 1-butylimidazolium hydrogen sulfate. Green Chem. 16 (3), 1617-1627 (2014).
- Brandt, A., et al. Ionic liquid pretreatment of lignocellulosic biomass with ionic liquid-water mixtures. Green Chem. 13 (9), 2489-2499 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon