É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Pré-tratamento de biomassa lignocelulósica com baixo custo líquidos iônicos
Neste Artigo
Resumo
The pretreatment of lignocellulosic biomass with protic low-cost ionic liquids is shown, resulting in a delignified cellulose-rich pulp and a purified lignin. The pulp gives rise to high glucose yields after enzymatic saccharification.
Resumo
A number of ionic liquids (ILs) with economically attractive production costs have recently received growing interest as media for the delignification of a variety of lignocellulosic feedstocks. Here we demonstrate the use of these low-cost protic ILs in the deconstruction of lignocellulosic biomass (Ionosolv pretreatment), yielding cellulose and a purified lignin. In the most generic process, the protic ionic liquid is synthesized by accurate combination of aqueous acid and amine base. The water content is adjusted subsequently. For the delignification, the biomass is placed into a vessel with IL solution at elevated temperatures to dissolve the lignin and hemicellulose, leaving a cellulose-rich pulp ready for saccharification (hydrolysis to fermentable sugars). The lignin is later precipitated from the IL by the addition of water and recovered as a solid. The removal of the added water regenerates the ionic liquid, which can be reused multiple times. This protocol is useful to investigate the significant potential of protic ILs for use in commercial biomass pretreatment/lignin fractionation for producing biofuels or renewable chemicals and materials.
Introdução
a demanda de energia da humanidade Reunião de forma sustentável é um dos maiores desafios que a nossa civilização enfrenta. O uso de energia está prevista para dobrar nos próximos 50 anos, colocando maior pressão sobre os recursos de combustíveis fósseis. 1 O acúmulo de gases de efeito estufa (GEE) na atmosfera através da generalizada uso de combustíveis fósseis é particularmente problemática, como o CO 2 gerado a partir da combustão de combustíveis fósseis é responsável por 50% do efeito de estufa antropogénico. 2 Portanto, a aplicação em grande escala de tecnologias neutras renováveis e de carbono é essencial para satisfazer as maiores necessidades de energia e materiais das gerações futuras. 1, 3
biomassa de plantas é o recurso renovável mais versátil, uma vez que pode ser utilizado para produzir calor, electricidade, bem como produtos químicos à base de carbono, e materiais combustíveis. principais vantagens da biomassa lignocelulósica em relação a outros tipos de biomassa são sua abundância, potencial para altos rendimentos peárea de r de terra e frequentemente muito mais elevada poupança de emissões de CO 2, que inclui alta retenção de carbono no solo. 4, 5 Adicional benefícios da utilização da biomassa incluem a disponibilidade local, baixos requisitos de capital para converter biomassa em energia, ea prevenção da erosão do solo. 8
Grandes produtores de matérias-primas lignocelulósicas são a indústria florestal e no sector agrícola, bem como a gestão de resíduos urbanos. 6 produção de lignocelulose tem o potencial para ser expandida, com uma mente para limitar o desmatamento e evitar a substituição de culturas alimentares e liberação de potenciais poluentes. 7 para biomassa renovável para se tornar uma fonte generalizada viável de transporte de combustíveis líquidos e produtos químicos, seu processamento deve tornar-se economicamente competitiva com as tecnologias de conversão de combustíveis fósseis. 9, 10 a chave para alcançar este objetivo é aumentar a produtividade ea qualidade dos produtos intermédios derivados de biomassa, reduzindo custo.
Lignocelulose contém uma elevada proporção de açúcares que podem ser convertidos em combustíveis e produtos químicos através de conversões catalíticas e microbianas. 11 Estes açúcares estão presentes em lignocelulose em forma polimérica como celulose e hemicelulose. Eles podem ser hidrolisados em glucose e outros açúcares monómeros e, em seguida, utilizado para a produção de etanol e outros produtos químicos derivados de bio e solventes. 12
Para acessar os açúcares celulósicos, o pré-tratamento da biomassa é necessário através de processos combinados físicos, químicos, ou 4. O pré-tratamento é sem dúvida o passo mais caro na valorização da biomassa lignocelulósica. Daí a investigação de processos de pré-tratamento melhorados é imperativo.
Várias tecnologias de pré-tratamento estão disponíveis. De particular interesse são aqueles que separar a lenhina da celulose (pré-tratamento fractionative). A lignina, o terceiro componente principal emlignocelulose, limita o acesso de agentes para a celulose e hemicelulose hidrolisar e reduz o rendimento de açúcar por tonelada de matéria-prima. 11 A lignina separada pode ser utilizada como um biorrefinaria adicional intermédia se é isolado na qualidade adequada. 13 Um processo fractionative é o processo de Kraft que é o pré-tratamento mais comum para a produção de papel / celulose. No cozimento kraft, as aparas de madeira são colocados numa mistura de hidróxido de sódio e sulfeto de sódio e aqueceu-se a temperaturas elevadas de cerca de 170 ° C e sob alta pressão. 14 As reacções alcalinas remover hemicelulose e lignina, quebrando os polímeros de baixo para pequenos fragmentos via nucleofilica e catálise básica, e dissolvendo os fragmentos de lenhina por meio de-protonação de grupos hidroxilo / álcool fenólicos. Outro processo de deslignif icação comum é o processo Organosolv que também fragmentos e dissolve a lenhina e hemicelulose. Em vez de utilizar um aqueo alcalinonos solução, solventes orgânicos tais como etanol e ácido acético são utilizados a temperaturas elevadas variando entre 160-200 ° C e pressões de 5-30 bar. Organossolve pré-tratamento tem algumas vantagens sobre processos kraft na medida em que produz menos poluição do ar e da água. 15 Ambos os processos possuem alguns desafios económicos, se usado para a produção de produtos químicos e combustíveis, em vez de celulose. 16 O pré-tratamento Ionosolv usa líquidos iônicos, que são sais que têm pontos de fusão inferiores a 100 ° C e, como um resultado das suas interacções de Coulomb fortes, as pressões de vapor muito baixa. 17 Isto elimina a poluição do ar no processo de pré-tratamento, e permite o processamento em ou próximo da pressão atmosférica.
Enquanto a maioria dos LIs são criados em trabalhoso, sínteses de várias etapas, a ILS próticos podem ser sintetizadas num processo de um-passo a partir de produtos químicos de base, o que os torna menos dispendioso; estima-se que cerca de LIs pode ser produzido em grandes quantidades para uma escalapreço de $ 1,24 por kg, que é comparável com solventes orgânicos comuns, tais como acetona e tolueno. 18 A capacidade de reciclar e reutilizar estes LIs personalização num processo que opera a temperaturas relativamente baixas e pressões torna esta uma alternativa mais benigna e um candidato economicamente atraente para biorefinação.
Este protocolo de vídeo detalhada demonstra uma versão em escala laboratorial do processo Ionosolv para a deslignificação de biomassa lignocelulósica e a eventual sacarificação enzimática da celulose ricos em celulose, bem como a recuperação de um lignina livre de odor de alta pureza 19.
Protocolo
Nota: Os líquidos iónicos próticos utilizados no processo são sintetizados no nosso laboratório, embora alguns possam ser ou tornar-se comercialmente disponíveis. Os líquidos iônicos resultantes são ácidas e provavelmente irritantes da pele / olho (dependendo da amina utilizada) corrosivo e, pelo que deve ser manuseado com cuidado usando EPI adequado (bata de laboratório, óculos de segurança, luvas resistentes).
1. Preparação
- Preparação e armazenamento da biomassa lignocelulósica
- Obter a biomassa lignocelulósica antes da experiência, em quantidade suficiente, por exemplo, 100 g até 5 kg.
Nota: Cada experiência requer, pelo menos, 3 g de biomassa (1 g cada um em triplicado). - Reduzir o teor em humidade, pouco depois da colheita e armazenar a biomassa em forma seca ao ar no laboratório. Ar seco da biomassa por espalhar a biomassa em uma mesa ou bancada e deixá-lo por 2 semanas ou até que apareça seco. Mover e transformar a biomassa em tsua vez para acelerar o processo. Execute as experiências de fracionamento dentro de um ano da colheita.
Nota: Imediatamente após a colheita, a biomassa lenhosa pode conter até 50% em peso de humidade, enquanto que a biomassa seca ao ar, que é mais estável, contém 5-12% em peso de humidade. - Moer e peneirar a biomassa a um seleto gama de tamanho de partícula. Armazenar a biomassa seca em sacos de plástico ou outros recipientes adequados até à sua utilização.
Nota: Para as pequenas amostras tratadas neste protocolo, um tamanho de partícula reduzido é recomendado, por exemplo 180-850 mm.
- Obter a biomassa lignocelulósica antes da experiência, em quantidade suficiente, por exemplo, 100 g até 5 kg.
- Determinação do teor de humidade da biomassa (de acordo com o protocolo NREL) 20
- Para determinar o teor de humidade da biomassa, pr�pesagem um pedaço de folha de alumínio (dimensão de cerca de 5 cm x 5 cm) sobre uma balança analítica e registar o peso da folha (folha m). Pesar cerca de 100 mg de biomassa seca de ar sobre a folha de alumínio e registrar o exato ar-dripeso ed (m ADW).
- Dobrar a folha de alumínio para fazer um pacote e colocar num forno ventilado a 105 ° C durante a noite (pelo menos, durante 4 horas).
- Leve o pacote para fora e colocá-lo imediatamente em um secador durante 5 minutos, em seguida, pesar o pacote imediatamente e registrar o peso exato do peso seco em estufa além folha (m ODW + folha). Calcular o teor de humidade (em%) da BM biomassa MC de acordo com a equação 1:
 Eq. 1
Eq. 1
Em que m + ODW folha é o peso do pacote, seco no forno (biomassa seca em estufa de mais de folha), m é o peso da folha da folha de ADW e M é o peso seco ao ar da biomassa. Todos os pesos devem ser, ou em g ou em mg.
- Síntese de líquidos iónicos
- Em um exaustor ou caixa ventilada, pesar 1 moleda amina (trietilamina) em uma de 1 L de fundo redondo com balão barra de agitação magnética. Colocar o balão num banho de gelo sobre uma placa de agitação magnética. Adicionar um funil de adição de 250 ml imediatamente para minimizar a evaporação da amina.
Nota: Garantir o ácido correto: quociente da base é de grande importância para alcançar a reprodutibilidade dos experimentos de pré-tratamento. - Meça a 1 mole de ácido sulfúrico usando uma solução de concentração conhecida (neste exemplo, 5 mol / L) e um frasco volumétrico (200 mL). Transferir o ácido sulfúrico para o funil de adição e enxaguar qualquer ácido que adere às paredes do balão volumétrico para o funil de adição com a água desionizada.
- Adicionar gota a gota, a ácido sulfúrico para a amina, enquanto se agitava vigorosamente. Certifique-se a solução não aquece, pois isso levaria a ebulição da amina e uma relação imprecisa de ácido para a base. Lavar o interior do funil de adição usando água desionizada para garantir que o ácido é transferido quantitativamente.
Nota: Lotes maiores de solução de líquido iónico pode ser feito através do aumento da quantidade de amina e ácido sulfúrico, bem como o volume de balão em conformidade. - Evapora-se a maior parte da água usando um evaporador rotativo. O teor de água deve ser menor do que o teor de água necessária para o pré-tratamento.
Nota: Não é necessário secar completamente o líquido iónico. Pode ser benéfico para deixar um pouco de água no líquido iónico, como alguns líquidos iónicos secas, incluindo sulfato de trietilamónio de hidrogénio, são sólidos à temperatura ambiente. Um secador por congelação pode também ser utilizada para diminuir o teor de água.
- Em um exaustor ou caixa ventilada, pesar 1 moleda amina (trietilamina) em uma de 1 L de fundo redondo com balão barra de agitação magnética. Colocar o balão num banho de gelo sobre uma placa de agitação magnética. Adicionar um funil de adição de 250 ml imediatamente para minimizar a evaporação da amina.
- Confirmando e ajustando o teor de água da solução de IL
Nota: O conteúdo de água é uma variável experimental importante. Existem três fontes que a água na mistura de pré-tratamento podem ser provenientes de. Todos eles têm de ser tomadas em consideração: (1) a água contida na solução líquido iónico sintetizado ou comprados (2) a água contida no tele biomassa seca ao ar e (3) qualquer água adicionada com uma pipeta para alcançar o teor final de água desejado.- Determinar o teor de água da solução líquido iônico sintetizados ou comprado por volumétrica de titulação Karl Fischer acordo com as instruções emitidas pelo fabricante titulador. Adicionar algumas gotas de IL no titulador usando uma seringa pré-pesado. Digite o peso do líquido adicionado ao titulador e aguarde até que o titulador exibe uma leitura. Grave o teor de água.
- Decidir sobre um conteúdo de água para o pré-tratamento da biomassa. Nesta experiência, utilizar 20% em peso. Reduzir o teor de água abaixo de 5% em peso do teor de água desejado usando um evaporador rotativo e confirmar o novo teor de água por titulação de Karl Fischer tal como descrito em 1.4.1.
Nota: São obtidos bons resultados com 20% em peso de água; no entanto, este pode nem sempre ser o ideal para o pré-tratamento. Um conteúdo de água mais elevada pode ser escolhida a fim de reduzir o custo do solvente ou à menor viscosidade.
- Cálculos para o experimento.
- Decidir sobre a quantidade de iônica solução líquida m sol, final e um BM proporção de biomassa-a-solvente / FINAL sol. Aqui, utilizar 10 g de solução de líquido iónico contendo 20% de água em peso e uma proporção de biomassa em solvente de 1:10 g / g.
Nota: Os tubos utilizados no presente protocolo podem encaixar-se a 18 g de solução de IL se a biomassa relativamente ao solvente é de 1:10 (p / p). A alta taxa de biomassa para solvente (até 1: 2 ou mesmo 1: 1) é favorável do ponto de vista económico, mas pode comprometer a eficácia do pré-tratamento em pequena escala. - Determinar a quantidade de líquido iónico (isento de água) requerida para cada amostra de acordo com a seguinte equação 2:
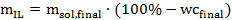 Eq. 2
Eq. 2
Onde m IL é a quantidade necessária de líquido iónico, em gramas, sol m, final é a quantidade desejada de solução em gramas de líquido iónico, e última wc </ Sub> é o teor de água desejado (em%) na solução líquido iónico. - Em seguida, calcular a quantidade de solução de líquido iónico sintetizado ou comprados a ser adicionado a cada tubo de pressão de acordo com a seguinte equação 3:
 Eq. 3
Eq. 3
Onde m solenóide é a quantidade de solução a ser adicionada a cada tubo de pressão (em gramas), m IL é a quantidade necessária de líquido iónico (em gramas), e WC Sol é o teor de água na solução líquido iónico (em%) conforme determinado por titulação de Karl Fischer. - Determinar a quantidade de biomassa (peso em base seca em forno) a ser adicionada à solução de líquido iónico por meio da equação 4 abaixo. Nesta experiência, utilizar um g de seco no forno Miscanthus biomassa por tubo de pressão.
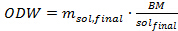 Eq. 4
Eq. 4
Onde ODW é a quantidade de biomassa de ser adicionared em cada tubo de pressão (em gramas), m Sol, final é a quantidade desejada de solução de líquido iónico (em gramas) e a BM / Sol final é a proporção desejada da solução líquida de biomassa-a-iónico. - Determinar o peso de biomassa seca por ar que tem de ser adicionado para dentro do tubo utilizando a seguinte equação 5:
 Eq. 5
Eq. 5
onde ADW é o peso seco ao ar da biomassa a ser adicionado no interior do tubo (em gramas), ODW é o peso da biomassa necessária para o experimento (determinado em 1.5.4 em gramas) e seca em estufa de MC BM é o valor determinada no ponto 1.2.3. - Calcular a quantidade de água tem de ser adicionado com uma pipeta para alcançar o conteúdo de água final desejado de acordo com a seguinte equação 6:
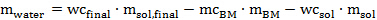 Eq. 6
Eq. 6
Quando m é água a quantidade deágua a ser adicionada, WC final é o teor de água desejado na mistura de pré-tratamento (aqui 20% em peso), m sol.final é a quantidade de solvente (aqui 10 g), MC BM é o teor de biomassa seca por ar humidade , BM m é a quantidade de biomassa seca ao ar para ser adicionado, WC Sol é o conteúdo de água da solução líquido iónico sintetizado ou adquirido, e m solenóide é a quantidade de solução de líquido iónico.
- Decidir sobre a quantidade de iônica solução líquida m sol, final e um BM proporção de biomassa-a-solvente / FINAL sol. Aqui, utilizar 10 g de solução de líquido iónico contendo 20% de água em peso e uma proporção de biomassa em solvente de 1:10 g / g.
2. Pré-tratamento
Nota: O processo pode ser interrompido em qualquer ponto, deixando as amostras à temperatura ambiente (durante alguns dias) ou no frigorífico (por períodos mais longos).
- Pré-pesam três tubos de 15 ml de pressão com tampas de Teflon e anéis de silicone S. Inspeccione visualmente os tubos de pressão para garantir que eles não têm fissuras ou falhas.
Nota: tubos de maior pressão correspondentes ao líquido mais iónica e a biomassa pode ser usada se desejado, embora os resultados de pré-tratamento não seráser directamente comparável entre amostras tratadas em diferentes tamanhos de frasco. Recomendamos o uso de tampas de vedação de frente para uma melhor vedação. - Com uma pipeta de 10 ml, adicionar a quantidade necessária de solução de líquido iónico para o tubo de pressão permanente na escala. Use anéis de cortiça para manter o tubo de pé. Registar o peso da solução do líquido iónico adicionado. Adicionar a quantidade necessária de água à solução determinada em 1.5.6, utilizando uma pipeta, assumindo que a densidade da água ser de 1 g / mL.
- Adicionar a quantidade necessária de material lignocelulósico seco ao ar, colocando um pedaço de folha de alumínio (dimensões 3 centímetros x 8 cm) sobre uma balança, tarar a balança de pesagem e a biomassa. Tarar a balança e adicionar a biomassa para o tubo. Coloque a folha vazia de volta ao equilíbrio e gravar a diferença.
Nota: Em alternativa, pode ser utilizado barcos de pesagem antiestáticos. - Fechar a tampa com uma tampa de Teflon com o O-ring de silicone. Verifique se há uma boa vedação, sem excesso de aperto. Registar o peso do ptubos ressure contendo biomassa e líquido iônico. Misturar o conteúdo do tubo por meio de um agitador de vórtice até que toda a biomassa está em contacto com o líquido iónico.
Nota: Nem todos os materiais de O-ring suportar estar em contato com líquidos iônicos a temperatura elevada. Descobrimos que o silicone funciona bem. - Colocar os tubos de pressão num forno ventilado que foi pré-aquecido até à temperatura desejada. Por exemplo, deixar os tubos durante 8 h a 120 ° C ou durante 1 hora a 150 ° C.
Nota: O tempo ea temperatura são variáveis experimentais importantes. Outros tempo - combinações de temperatura pode ser utilizado. - Retirar os frascos do forno usando uma luva de forno e coloque-os em um exaustor para deixá-los esfriar à temperatura ambiente. Verificar o peso dos frascos após o arrefecimento para assegurar nenhuma água escapado durante o cozimento.
3. Pulp Wash
- Transferir o conteúdo de cada tubo dentro de um tubo de centrífuga de 50 mL, utilizando 40 ml de absolutae etanol. Agitar o tubo por meio de um agitador de vórtice durante 1 minuto para misturar bem e deixar o tubo à temperatura ambiente durante pelo menos 1 h.
Nota: A separação também pode ser realizada utilizando filtração, no entanto, menos precisão pode ser observado para o tamanho da amostra sugerido. - Agitar o tubo por meio de um agitador de vórtex durante mais 30 s, em seguida, Centrifugar o tubo durante 50 minutos a 2000 x g. líquido e sólido separado por decantação cuidadosa. Recolher o líquido em um ambiente limpo de 250 ml frasco de fundo redondo com barra de agitação.
- Adicionar 40 ml de etanol fresco para a etapa de tubo e repita 50 ml 3.2 três vezes.
- Remover o etanol a partir do líquido iónico, colocando o fundo redondo, frascos de em um bloco de aquecimento. Ligue cada um deles a uma bomba de vácuo com uma câmara de frio. Encher a armadilha com gelo seco e definir o aquecimento a 40 ° C. Ligue agitação e bomba.
Nota: Este experimento usa um home-made paralelo evaporador set-up com base em uma síntese paralela set-up. evaporadores em paralelo também pode ser adquied ready-made. Alternativamente um evaporador rotativo pode ser usado.
- Remover o etanol a partir do líquido iónico, colocando o fundo redondo, frascos de em um bloco de aquecimento. Ligue cada um deles a uma bomba de vácuo com uma câmara de frio. Encher a armadilha com gelo seco e definir o aquecimento a 40 ° C. Ligue agitação e bomba.
4. Soxhlet Extração de Celulose
- Transfira a polpa lavada úmida em dedais de celulose e etiquetar cada dedal usando um lápis.
- Preencha etanol 150 ml absoluta em um ambiente limpo balão de 250 ml com barra de agitação de fundo redondo. Insira o dedal contendo amostra em um 40 ml extractor Soxhlet, adicionar um condensador e instalar tudo na estação de trabalho extractor paralelo conectado a um resfriador de recirculação.
Nota: Se o etanol foi usado para transferir a pasta de papel, adicionar apenas a diferença para 150 ml para o balão de fundo redondo. - Quando todas as amostras são carregadas, começar a agitação, ajustar a temperatura para 135 ° C e ligar o recirculador (ajuste de temperatura 18 ° C). Extrair as amostras de polpa durante 20 horas no total.
- Desligue o aquecimento para permitir ao refluxo para chegar a um impasse. Em seguida, mudar tanto se agitava e se refrescar. Tome as dedais fora do extractor Soxhletusando uma pinça e deixar secar polpa molhada na noite dedal em um exaustor.
- Adicionar o líquido a partir da extracção de Soxhlet para o líquido de lavagem a biomassa e continuar a evaporação do etanol a partir da biomassa de lavagem com o evaporador paralelo ou num evaporador rotativo a 40 ° C.
- Transferir a polpa seca por ar a partir do dedal sobre um pedaço de folha de alumínio tarado numa balança analítica, registar o peso seco ao ar da polpa extractada e transferi-lo para um saco de plástico rotulados. Tentar recuperar tudo, enquanto não raspar o material dedal fora da parede.
- Determinar o teor de humidade da polpa imediatamente para calcular o rendimento seco no forno (como mostrado anteriormente no passo 1.4).
5. A lignina Isolamento
- Quando todo o etanol se ter evaporado, precipitar a lenhina através da transferência do líquido iónico do balão de fundo redondo para um tubo de centrífuga de 50 ml, utilizando 30 ml de água. Misture a suspensão e deixar durante pelo menos 1 h.Centrifugar durante 20 minutos a 2000 xg, e separar a solução do sólido por decantação.
Nota: Neste protocolo, 3 equivalentes de água são usados como anti-solvente. Menos anti-solvente pode ser utilizado, se desejado. As lavagens podem ser recolhidos, a água removida e o líquido iónico recuperado para uso repetido. - Adicionar 30 ml de água destilada para o sedimento da lenhina no interior do tubo de centrifugação. Repetir a mistura, incubação durante 1 hora e centrifugação. Repetir esta etapa para um total de 3 lavagens de lignina.
- Seca-se a lenhina no interior do tubo de centrífuga usando um forno de vácuo e uma tampa perfurada, a 45 ° C durante a noite. Para determinar o rendimento de lignina, coloque um pedaço de papel alumínio sobre o saldo, convulsionou o peso, adicione lignina do forno e registrar o peso imediatamente. Transferir a lignina num frasco de armazenamento.
Resultados
A quantidade exacta de remoção de lignina e a precipitação de lignina, celulose e recuperado um rendimento de glicose dependem do tipo de biomassa utilizada, a temperatura à qual o tratamento é administrado e a duração do tratamento. tempos de pré-tratamento curtos e baixas temperaturas conduzir a pré-tratamento incompleto, enquanto a temperaturas mais elevadas a celulose torna-se instável no líquido iónico, levando a hidrólise e a degradação. O líquido iónico seleccion...
Discussão
A técnica para o fraccionamento da biomassa lenhocelulica aqui apresentado produz uma polpa ricos em celulose e lignina. A maioria das hemiceluloses são dissolvidos no líquido iónico e hidrolisada, mas não recuperados. Se acares hemicelulicos são desejados, uma hemicelulose passo de pré-extracção antes da deslignificação Ionosolv pode ser necessário. Tem sido até agora impossível de fechar completamente o balanço de massa para a biomassa, uma vez que não é possível identificar e quantificar os produtos...
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
Os autores reconhecem o Instituto Grantham para a Mudança Climática e Meio Ambiente, da Climate-KIC e EPSRC (EP / K038648 / 1 e EP / K014676 / 1) para financiamento e Pierre Bouvier para fornecer dados experimentais para a pré-tratamentos de pinheiros.
Materiais
| Name | Company | Catalog Number | Comments | |
| IL synthesis | ||||
| Round bottom flask, with standard ground joint 24/29 NS, 1000 ml | Lenz | 3 0024 70 | VWR product code 271-1309 | |
| 250mL Addition Funnel, Graduated, 29/26 Joint Size, 0-4mm PTFE Valve | GPE | CG-1714-16 | ||
| Dish-shaped dewar flask, SCH 31 CAL | KGW-Isotherm | 1197 | ||
| Volumetric flask, 200 ml | VWR | 612-3745 | ||
| Cork rings, pasteur pipettes and teet, wash bottle with deionised water, large magentic stir bar | ||||
| Biomass size reduction | ||||
| Heavy Duty Cutting Mill SM2000 | Retsch | Discontinued | Replaced with Cutting Mill SM 200 (20.728.0001) | |
| Bottom sieves (10 mesh square holes, for particle size <2 mm) | Retsch | 03.647.0318 | Part of cutting mill | |
| Analytical Sieve Shaker AS 200 | Retsch | 30.018.0001 | Part of sieving machine | |
| Test Sieve 200 mm Ø x 50 mm height ISO 3310/1 (180 µm) | Retsch | 60.131.000180 | Part of sieving machine | |
| Test Sieve 200 mm Ø x 50 mm height ISO 3310/1 (850 µm) | Retsch | 60.131.000850 | Part of sieving machine | |
| Collecting pan, stainless steel, 200 mm Ø, height 50 mm | Retsch | 69.720.0050 | Part of sieving machine | |
| Rotary evaporator: | ||||
| Rotary evaporator (Rotavapor R-210) | Buchi | Discontinued | Replaced with Rotavapor R-300 | |
| Water bath (Heating bath B-491) | Buchi | 48201 | Part of rotary evaporator | |
| Recirculator | Julabo | F25 | Part of rotary evaporator | |
| Vacuum pump (MPC 101 Z) | Ilmvac GmbH | 412522 | Part of rotary evaporator | |
| Vacuum controller (Vacuum Control Box VCB 521) | Ilmvac GmbH | 600053 | Part of rotary evaporator | |
| Parallel evaporator: | ||||
| StarFish Base Plate 135mm (for Radleys & IKA) | Radleys | RR95010 | Part of parallel evaporator | |
| Monoblock for 5 x 250ml Flasks | Radleys | RR95130 | Part of parallel evaporator | |
| Telescopic 5-way Clamp with Velcro | Radleys | RR95400 | Part of parallel evaporator | |
| Gas/Vacuum Manifold with connectors | Radleys | RR95510 | Part of parallel evaporator | |
| 650mm Rod | Radleys | RR95665 | Part of parallel evaporator | |
| Quick Release Male, R/A Barbed 6.4mm + Shut-off (3.2mm ID) | Radleys | RR95520 | Part of parallel evaporator | |
| Stirrer/hot plate | Radleys | RR98072 | Part of soxhlet extractor | |
| Temperature controller | Radleys | RR98073 | Part of soxhlet extractor | |
| Elliptical Stirring Bar 15mm Rare Earth | Radleys | RR98097 | Part of parallel evaporator | |
| Vacuum cold trap, plastic coated, PTFE stopcock | Chemglass | CG-4519-01 | Part of parallel evaporator | |
| Vacuum pump (MPC 101 Z) | Ilmvac GmbH | 412522 | Part of parallel evaporator | |
| Tygon tubing E-3603, 6,40 mm (internal) 12,80 mm (external) | Saint-Gobain/VWR | 228-1292 | Part of parallel evaporator | |
| Parallel Soxhlet extractor: | ||||
| StarFish Base Plate 135mm (for Radleys & IKA) | Radleys | RR95010 | Part of soxhlet extractor | |
| Monoblock for 5 x 250ml Flasks | Radleys | RR95130 | Part of soxhlet extractor | |
| Telescopic 5-way Clamp with Velcro | Radleys | RR95400 | Part of soxhlet extractor | |
| Telescopic 5-way Clamp with Silicone Strap and Long Handle | Radleys | RR95410 | Part of soxhlet extractor | |
| Water Manifold with connectors | Radleys | RR95500 | Part of soxhlet extractor | |
| 650mm Rod | Radleys | RR95665 | Part of soxhlet extractor | |
| Quick Release Male, R/A Barbed 6.4mm + Shut-off (3.2mm ID) | Radleys | RR95520 | Part of soxhlet extractor | |
| Coil condensers with standard ground joints 29/32 NS | Lenz | 5.2503.04 | Part of soxhlet extractor | |
| Extractor Soxhlet 40mL borosilicate glass 29/32 socket 24/29 cone | Quickfit | EX5/43 | Part of soxhlet extractor | |
| Stirrer/hot plate | Radleys | RR98072 | Part of soxhlet extractor | |
| Temperature controller | Radleys | RR98073 | Part of soxhlet extractor | |
| Recirculator | Grant | LTC1 | Part of soxhlet extractor | |
| Cellulose extraction thimble | Whatman | 2280-228 | ||
| Tweezers | Excelta | 20A-S-SE | ||
| Vacuum drying oven: | ||||
| Vacuum drying oven | Binder | VD 23 | Part of vacuum oven | |
| Dewar vessel 2L 100x290mm with handle | KGW-Isotherm | 10613 | Part of vacuum oven | |
| Vacuum Trap | GPE | CG-4532-01 | Part of vacuum oven | |
| Other equipment: | ||||
| Analytical balance | A&D | GH-252 | accuracy to ± 0.1 mg | |
| Volumetric Karl Fischer titrator | Mettler Toledo | V20 | ||
| 10 mL disposable pipette | Corning Inc | Costar 4101 10 mL Stripette | ||
| Eppendorf Research plus pipette, variable volume, volume 100-1000 μL | Eppendorf | 3120000062 | ||
| Desiccator | Jencons | JENC250-028BOM | ||
| Ace pressure tube bushing type, Front seal, volume 15 mL | Ace Glass | 8648-04 | ||
| Ace O-rings, silicone, 2.6 mm, I.D. 9.2 mm | Ace Glass | 7855216 | O-ring for pressure tube | |
| Vortex shaker | VWR International | 444-1378 (UK) | ||
| Fan-assisted convection oven | ThermoScientific | HeraTherm OMH60 | ||
| Oven glove (Crusader Flex) | Ansel Edmont | 42-325 | ||
| 250 mL Round bottom flask single neck ground joint 24/29 (Pyrex) | Quickfit | FR250/3S | ||
| Rotaflo stopcock adapter with cone 24/29 | Rotaflo England | MF11/2/SC | ||
| 50 mL Falcon tube | Heraeus/Kendro | HERA 76002844 | ||
| Centrifuge (Mega Star 3.0) | VWR | 521-1751 | ||
| Reagents: | ||||
| Ethanol absolute | VWR | 20820.464 | ||
| Triethylamine | Sigma-Aldrich | T0886 | ||
| Sulfuric acid 5 mol/l (10N) AVS TITRINORM volumetric solution Safe-break bottle 2,5L | VWR | 191665V | ||
| Purified water (15 MΩ ressitance) | Elga | CENTRA R200 | ||
| Lignocellulosic biomass: | ||||
| Miscanthus X gigantheus | ||||
| Pinus sylvestris |
Referências
- Lewis, N. S., Nocera, D. G. Powering the planet: chemical challenges in solar energy utilization. Proc.Natl.Acad.Sci.U.S.A. 103 (43), 15729-15735 (2006).
- Dincer, I. Renewable energy and sustainable development: a crucial review. Renewable and Sustainable Energy Reviews. 4 (2), 157-175 (2000).
- Zweibel, K., Mason, J., Fthenakis, V. A solar grand plan. Sci. Am. 298 (1), 64-73 (2008).
- Lee, J. Biological conversion of lignocellulosic biomass to ethanol. J. Biotechnol. 56 (1), 1-24 (1997).
- Carrott, P., Ribeiro Carrott, M. Lignin-from natural adsorbent to activated carbon: A review. Bioresour.Technol. 98 (12), 2301-2312 (2007).
- Cardona Alzate, C., Sánchez Toro, O. Energy consumption analysis of integrated flowsheets for production of fuel ethanol from lignocellulosic biomass. Energy. 31 (13), 2447-2459 (2006).
- Field, C. B., Campbell, J. E., Lobell, D. B. Biomass energy: the scale of the potential resource. Trends Biochem Sci. 23 (2), 65-72 (2008).
- Hoogwijk, M., et al. Exploration of the ranges of the global potential of biomass for energy. Biomass Bioenergy. 25 (2), 119-133 (2003).
- Goldemberg, J. Ethanol for a sustainable energy future. Science. 315 (5813), 808-810 (2007).
- Himmel, M. E., et al. Biomass recalcitrance: engineering plants and enzymes for biofuels production. Science. 315 (5813), 804-807 (2007).
- Mosier, N., et al. Features of promising technologies for pretreatment of lignocellulosic biomass. Bioresour.Technol. 96 (6), 673-686 (2005).
- Kumar, P., Barrett, D. M., Delwiche, M. J., Stroeve, P. Methods for pretreatment of lignocellulosic biomass for efficient hydrolysis and biofuel production. Ind Eng Chem Res. 48 (8), 3713-3729 (2009).
- Hu, F., Ragauskas, A. Suppression of pseudo-lignin formation under dilute acid pretreatment conditions. RSC Advances. 4 (9), 4317-4323 (2014).
- Chakar, F. S., Ragauskas, A. J. Review of current and future softwood kraft lignin process chemistry. Ind Crop Prod. 20 (2), 131-141 (2004).
- Mutjé, P., Pelach, M., Vilaseca, F., García, J., Jiménez, L. A comparative study of the effect of refining on organosolv pulp from olive trimmings and kraft pulp from eucalyptus wood. Bioresour.Technol. 96 (10), 1125-1129 (2005).
- Zhao, X., Cheng, K., Liu, D. Organosolv pretreatment of lignocellulosic biomass for enzymatic hydrolysis. Appl. Microbiol. Biotechnol. 82 (5), 815-827 (2009).
- Brandt, A., Gräsvik, J., Hallett, J. P., Welton, T. Deconstruction of lignocellulosic biomass with ionic liquids. Green Chem. 15, 550 (2012).
- Chen, L., et al. Inexpensive ionic liquids:[HSO 4]−-based solvent production at bulk scale). Green Chem. 16 (6), 3098-3106 (2014).
- Brandt, A., Chen, L., van Dongen, B. E., Welton, T., Hallett, J. P. Structural changes in lignins isolated using an acidic ionic liquid water mixture. Green Chem. 17, 5019-5034 (2015).
- Sluiter, A., et al. NREL/TP-510-42621. Determination of Total Solids in Biomass and Total Dissolved Solids in Liquid Process Samples. , (2008).
- Sluiter, A., et al. NREL/ TP - 510 - 42618Determination of Structural Carbohydrates and Lignin in Biomass. Determination of Structural Carbohydrates and Lignin in Biomass. , (2011).
- Resch, M. G., Baker, S. R., Decker, NREL/TP-5100-63351. Low Solids Enzymatic Saccharificatin of Lignocellulosic Biomass. , (2015).
- Brandt, A., Ray, M. J., To, T. Q., Leak, D. J., Murphy, R. J., Welton, T. Ionic liquid pretreatment of lignocellulosic biomass with ionic liquid-water mixtures. Green Chem. 13 (9), 2489-2499 (2011).
- Aver, K., Scortegagna, A., Fontana, R., Camassola, M. Saccharification of ionic-liquid-pretreated sugar cane bagasse using Penicillium echinulatum enzymes. J Taiwan Inst Chem Eng. 45 (5), 2060-2067 (2014).
- George, A., et al. Design of low-cost ionic liquids for lignocellulosic biomass pretreatment. Green Chem. 17 (3), 1728 (2015).
- Verdía, P., Brandt, A., Hallett, J. P., Ray, M. J., Welton, T. Fractionation of lignocellulosic biomass with the ionic liquid 1-butylimidazolium hydrogen sulfate. Green Chem. 16 (3), 1617-1627 (2014).
- Brandt, A., et al. Ionic liquid pretreatment of lignocellulosic biomass with ionic liquid-water mixtures. Green Chem. 13 (9), 2489-2499 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados