Method Article
التأسيس-بقايا محددة من Noncanonical الأحماض الأمينية في البروتينات نموذج باستخدام
In This Article
Summary
An easy-to-use, cell-free expression protocol for the residue-specific incorporation of noncanonical amino acid analogs into proteins, including downstream analysis, is presented for medical, pharmaceutic, structural and functional studies.
Abstract
مجموعة الكنسي من الأحماض الأمينية يؤدي إلى مجموعة واسعة جدا من وظيفة البروتين. ومع ذلك، فإن مجموعة من بقايا ما زالت تفرض قيود على التطبيقات البروتين المحتملة. دمج الأحماض الأمينية noncanonical يمكن تكبير هذا المجال. هناك طريقتان التكميلية لدمج الأحماض الأمينية noncanonical. لإدراجها في مواقع محددة، بالإضافة إلى الذاتية والأجهزة متعدية الكنسي، ويجب أن تقدم الزوج أمينوأسيل-الحمض الريبي النووي النقال-مخلقة-الحمض الريبي النووي النقال متعامد أن لا يتفاعل مع تلك الكنسي. ونتيجة لذلك، كودون الذي لم يتم تعيينه إلى الأحماض الأمينية الكنسي، وعادة ما رامزة توقف، مطلوب أيضا. هذا التوسع الشفرة الوراثية يمكن إدراج حمض أميني noncanonical في واحد الموقع، تعطى في غضون البروتين. ويصف العمل هنا عرض التأسيس-بقايا محددة حيث يتم إعادة تعيين الشفرة الوراثية داخل منظومة متعدية الذاتية. آلية الترجمة لccepts الأحماض الأمينية noncanonical كبديل لدمجه في مواقع المنصوص عليها بشكل قانوني، أي يتم استبدال كافة تواجدات حمض أميني الكنسي في البروتين واحد noncanonical. دمج الأحماض الأمينية noncanonical يمكن تغيير بنية البروتين، مما تسبب في الخصائص الفيزيائية والكيميائية تعديل كبير. غالبا ما يتصرف النظير الأحماض الأمينية Noncanonical باسم مثبطات نمو الخلايا المضيفين التعبير لأنها تعديل البروتينات الذاتية، التي تحد من إنتاج البروتين في الجسم الحي. المجراة دمج الأحماض الأمينية noncanonical السامة في البروتينات لا يزال تحديا من نوع خاص. هنا، يتم تقديم مقاربة خالية من الخلايا لاستبدال كامل من L-أرجينين من قبل noncanonical الأحماض الأمينية L-canavanine. انها تلتف حول الصعوبات الكامنة في الجسم الحي التعبير. بالإضافة إلى ذلك، يتم تضمين بروتوكول لإعداد البروتينات المستهدفة للتحليل الطيفي الشامل. يظهر ويمكن الاستعاضة عنها أن L-ليسين التي كتبها L-هيدروكسي-ليسين،وإن كان ذلك مع انخفاض كفاءة. من حيث المبدأ، أي التناظرية الأحماض الأمينية noncanonical يمكن إدراجها باستخدام طريقة عرض طالما يعترف الذاتية في المختبر نظام الترجمة عليه.
Introduction
الشفرة الوراثية هو عالمي في المجال الحيوي. رموز ذلك لمجموعة من 20 الأحماض الأمينية الكنسي، الذي مدد أحيانا selenocysteine 1 أو 2 pyrrolysine. ومن الريبوسوم أن يترجم الشفرة الوراثية مع مساعدة من tRNAs في سلاسل من الأحماض الأمينية التي أضعاف في البروتينات. المجموعات الوظيفية من الأحماض الأمينية الكنسي، إلى جانب التعديلات posttranslational، والمساهمة في مجموعة واسعة جدا من وظيفة البروتين 3،4. من حيث المبدأ، والقيود الوظيفية ويرجع ذلك إلى مجموعة محدودة من الأحماض الأمينية الكنسي يمكن التغلب عليها من خلال دمج أبعد من ذلك، الأحماض الأمينية noncanonical ([نكس]) التي تمكن كيمياء جديدة وظائف جديدة 3،4.
هناك نوعان من نهج تكميلية لإدماج نكس]: في الموقع- أو إدماج فضلات محددة. يستتبع الطريقة السابقة صعوبات فنية كبيرة، لأن مجموعة الكنسي أمينوأسيل-الحمض الريبي النووي النقال موالفةetases (AARS) وtRNAs لا بد من توسيع من قبل الزوج AARS-الحمض الريبي النووي النقال متعامد التي يجب أن لا تتفاعل مع آلية الترجمة الذاتية. على أساس الهندسة دقيق، يتضمن هذا النهج [نكس] كما الطفرات نقطة واحدة في مواقع البروتين المطلوب. يتم ترميز تأسيس الموقع المحدد للنكس] وراثيا من قبل كودون الذي لم يتم تعيينه إلى حمض أميني الكنسي (CAA)، وعادة ما توقف كودون 5-9. ينطوي هذا الأسلوب تغييرات في وظائف في موقع معين وليس عبر بروتين كامل 10-13.
في المقابل، يعتمد فضلات محددة التأسيس على الاعتراف الخاطئ من الأحماض الأمينية noncanonical به الآلية الترجمة الكنسي. يحدث التأسيس نظرا لعدم وجود خصوصية الركيزة لAARS. إدماج فضلات معينة من نكس]، بنيت على عمل كوهين وزملاء العمل 14، قد أدى إلى التطبيقات الهامة 3،10، من بينها وضع العلامات الحيوية متعامد 15-17 من البروتيناتأو توضيح بنية البروتينات في البلورات بالأشعة السينية (18).
كما يفضل AARS الطبيعية عموما الأحماض الأمينية وما شابه ذلك من أكثر من NCAA isostructural وفعال في الجسم الحي التأسيس-بقايا محددة وعادة ما يتطلب مضيف التعبير العوز الغذائي غير قادرة على تجميع التناظرية الكنسي من نكا. تزرع الخلايا المضيفة في متوسط النمو من شأنها أن توفر فقط على تركيز منخفض من الجهاز المركزي للمحاسبات مماثلة. الإرهاق في تركيبة مع مكملات التوالي مع الرابطة الوطنية لرياضة يجبر المضيف التعبير لدمج NCAA في البروتين نموذج في عدة مواقع، المنصوص عليها بشكل قانوني. وعلى النقيض من نهج في مواقع محددة، وهذا له بشكل عام لها تأثير عميق على هيكل بروتين كامل، مما يؤدي إلى تعديل كبير الخواص الفيزيائية والكيميائية للبروتينات 19،20. ومع ذلك، فإن معظم نكس] ومثبطات النمو للمضيف التعبير 3، وإدماجها في العديد من البروتوكول الاضافي الآخرينEINS إلى جانب تلك التي تهم خلال التعبير الجيني المؤتلف. وهذا يحد بوضوح النهج في الجسم الحي. إدراج في الجسم الحي من الأحماض الأمينية التي تكون سامة أو لها تأثير قوي على بنية البروتين يبقى تحديا من نوع خاص. ومع ذلك، فإن هذه الجزيئات هي من بين الأكثر واعدة لهندسة البروتينات مع وظائف غير عادية.
ومن الأمثلة على ذلك السامة، noncanonical، والتي تحدث بشكل طبيعي L-canavanine (يستطيع)، تناظرية من L-أرجينين (الارجنتين). أنه يؤثر على وكتل ARG المرتبطة مسارات رد فعل تنظيمية وتحفيزية، وجودها في الخلية الحية يمكن أن يؤدي إلى الموت الفوري 3،21-23. إدماجه في البروتينات في مواقع أرجينين يمكن أن تقلل من الاستقرار بروتين 21-23. نظرا لسمية الناتجة عن ذلك، لا يزال تعبير عن canavanine التي تحتوي على البروتينات في القولونية (إي كولاي) والمضيفين الآخرين التعبير الشائع تحديا. لهذه الأسباب، كاملة في الجسم الحي طتمت بشكل مناسب تأكدت ncorporation من يستطيع على جميع المناصب الارجنتين مرة واحدة فقط 24، وذلك باستخدام نظام إنتاج بروتين واحد من التفصيل. ومع ذلك، فقد اقترح هل يمكن كوكيل المضادة للسرطان 25-27، ونتيجة لمشجعا لأمراض المناعة الذاتية في الإنسان 28. بالإضافة إلى ذلك، لأنه يخضع لدراسات مختلفة عن سياستها المعادية للالأيض، مضاد للجراثيم، مضاد للفطريات وخصائص مضادة للفيروسات 25. هذه الخصائص تثير الطلب على كفاءة وسهلة لأداء وسائل للتعبير عن هل تحتوي على البروتينات عن الصيدلية والطبية والدراسات الفنية.
على الرغم من أن العديد من المشاكل التي ترتبط في الجسم الحي إنتاج يمكن التحايل باستخدام نظم التعبير خالية من الخلايا، في النهج بقايا محددة المختبر يكون فقط تم استكشافها بشكل سيئ. وقد تم الإبلاغ عن إدراج خالية من الخلايا فضلات معينة من التناظرية تريبتوفان 29 ومتعددة نكس] 30. وتستند هذه الأساليب على effic للغايةient T7 RNA البلمرة. يستتبع البلمرة T7 RNA مثل الجراثيم النسخ، مما يؤدي إلى خفض وظائف وراثية بالمقارنة مع النسخ الذاتية.
وذكرت والتأسيس-بقايا محددة كاملة من يمكن في بروتين نموذج في جميع المناصب الارجنتين مؤخرا 31، وذلك باستخدام نظام حرية التعبير خلية 32. وهناك تعديل طفيف في النظام نفسه تمكين دمج مواقع محددة النظير pyrrolysine المختلفة في البروتين نموذج عن طريق وقف كودون قمع 33. ويستند 33 على كل هاء - نظام خالية من الخلايا المستخدمة 31 القولونية نظام النسخ والترجمة. ومع ذلك، فإنه يمكن التعبير البروتين بكفاءة كما في أنظمة الجراثيم الحالية (0،5-1 ملغ / مل من البروتين المؤتلف) 32، مع الاحتفاظ بكثير من الأصلي نمطية النسخ والترجمة.
في هذا العمل، يتم توفير بروتوكول مفصلة عن كيفية RESIDالتأسيس-رق معين من نكس] لا يمكن أن تتحقق، وذلك باستخدام هذا كل E. القولونية نظام خالية من الخلايا 32. بالإضافة إلى ذلك، اقترح اتخاذ خطوات إضافية لإعداد البروتينات وأعرب عن تقييم مناسب عبر HPLC-ESI الطيفي الشامل. لتوسيع خصائص هذا النظام خالية من الخلايا، وهذا العمل لا يشير فقط إلى إدراج نشرت حول Can 31 ولكن أيضا يقدم بيانات جديدة تتعلق noncanonical-L يسين التناظرية L-هيدروكسي-ليسين.
بروتوكول التالية لدمج-بقايا محددة من نكس] هو التكيف لبروتوكول نشر مؤخرا في إن الرب 34. يصف بروتوكول الأخير كيفية تنفيذ كفاءة عالية التعبير خالية من الخلايا مع الأحماض الأمينية القياسية. وعلاوة على ذلك، فإنه يعرض إعداد المستخلص الخالي من الخلايا الخام، والحل الأحماض الأمينية، والحل الاسهم الطاقة وعازلة الطاقة المستخدمة في هذا النهج. يركز بروتوكول التالية على خطوات تعديل بالمقارنة مع ص السابقrotocol من أجل تمكين التأسيس-بقايا محددة من نكس]. ينصح pipets معايرة، وانخفاض ملزم نصائح ماصة وأنابيب الطرد المركزي الصغيرة لإعداد. في ما يلي، يتم استخدام الاختصارات IUPAC للأحماض الأمينية.
Protocol
الحذر! يرجى التشاور مع جميع بيانات سلامة المواد ذات الصلة (MSDS) قبل الاستخدام. العديد من المواد الكيميائية المستخدمة هي شديدة السمية. معدات الحماية الشخصية هو مطلوب (eyeshield، قناع الغبار، والقفازات، معطف المختبر، كامل طول السراويل، مغلقة اصبع القدم أحذية)، وكذلك العمل في غطاء الدخان.
1. إعداد الحل الأحماض الأمينية
- إعداد محلول المخزون من الرابطة الوطنية لرياضة (168 ملم)
ملاحظة: إعداد محلول المخزون من الرابطة الوطنية لرياضة يوصف لالتناظرية الارجنتين يمكن على سبيل المثال. التكيف وفقا لقيم نكس] البعض.- وضع أنبوب 1.5 مل رد فعل الصعود إلى توازن دقيق. تزن من 46.1 ملغ ل Can داخل الأنبوب رد فعل لإعداد 1 مل من محلول ملي 168. استخدام microspatula عقيمة. لخليط راسمي من الرابطة الوطنية لرياضة، مضاعفة تركيز المحلول.
- إضافة 977 ميكرولتر من ده معقم 2 O. تماما الدوامة حتى يمكن هو أناحل ن كاملة.
ملاحظة: للحصول على حجم حلا شاملا من 1 مل، والحجم المادي من الأحماض الأمينية حل لابد من تعويضها. للحصول على أي من الأحماض الأمينية، وتقدير نصف كتلة صلبة في ملغم مثل زيادة حجم المقابلة في ميكرولتر (100 ملغ الصلبة سيستغرق وبلغ حجم التداول 50 ميكرولتر في الحل) 35. يمكن حله معظم الأحماض الأمينية في هذا التركيز. إن لم يكن، والحد من تركيز حتى حل كامل. - مباشرة استخدام المحلول NCAA لإعداد الحلول الأحماض الأمينية في القسم 1.2 أو فلاش تجميده في النيتروجين السائل وتخزينه عند درجة حرارة -20 درجة مئوية. تنبيه! للسلامة، ارتداء eyeshield والبرد قفازات للحماية من السائل البقع النيتروجين.
- إعداد الحلول الأحماض الأمينية
ملاحظة: لإعداد الحلول الأحماض الأمينية، واستخدام عينات الأحماض الأمينية توفير L-إيزومرات 20 تربض في الأسهم منفصلحلول (1.5 مل، مخزنة مع HEPES / كوه، <0.1٪ نان 3، ودرجة الحموضة 7.5)، كل بتركيز 168 ملي، باستثناء L-ليسين (140 ملم). لإعداد محلية الصنع من هذه الحلول الأسهم (مخزنة مع KOH)، اتبع هذا البروتوكول 35.- ذوبان الجليد الحلول الأسهم من 20 كانياس (الأحماض الأمينية العينات أو معدة وفقا ل35) والرابطة الوطنية لرياضة (المعد في القسم 1.1) في RT.
- بعد ذوبان الجليد، دوامة كثيرا الحلول الأسهم لتنحل أي الأحماض الأمينية المترسبة. ونظرا لأن بعض الأحماض الأمينية هي أصعب حل، احتضان لهم في كتلة التدفئة عند 37 درجة مئوية حتى حل كامل. السيستئين قد لا تذوب تماما. وضع جميع الأحماض الأمينية على الجليد، باستثناء الأسباراجين، الفنيل ألانين والسيستئين - إبقاء هذه في RT لتجنب الأمطار.
- استخدام القيم التالية لاستخدام السابعة واحدة من مجموعة كاملة.
ملاحظة: تقليص بشكل مناسب للعمل مع وحدات التخزين الصغيرة وحفظ أجزاء عدة لمزيد من التجارب. تصعيد لincorporatأيون من نكس] إلى بروتينات النموذج على نطاق واسع. لمنع الذوبان المتكررة، التي من المرجح أن تقلل من الاستقرار من الأحماض الأمينية، وقسامة من الأحماض الأمينية حلول الأسهم الفردية إلى مجلدات من 200 ميكرولتر. هذا حجم قسامة 200 ميكرولتر وأحجام قسامة المستخدمة في حساب خطوة 1.2.4.1 لخسائر بسبب pipetting ل. - أولا، يعد الحل مزيج الرئيسي الأحماض الأمينية التي سيتم تقسيم في خطوة 1.2.4.3 لوضع اللمسات الأخيرة على إعداد 3 حلول الأحماض الأمينية المكونة بشكل مختلف (الأقسام 1.2.5 - 1.2.7). في هذه الحلول، والتركيز على جميع الأحماض الأمينية في 6 ملم، باستثناء لوي (5 ملم).
- نقل 1.4 مل من العقيمة O 2 DDH في أنبوب الطرد المركزي 15 مل. وضعه على الجليد. إضافة 175 ميكرولتر من كل حل الأمينية الأسهم حامض. إضافة احدا تلو الآخر، باستثناء محلول المخزون من الجهاز المركزي للمحاسبات (على سبيل المثال، الارجنتين) لتحل محلها الرابطة الوطنية لرياضة (على سبيل المثال، يمكن). دوامة جيدا بعد كل إضافة ووضع الحل مرة أخرى على الجليد.
ملاحظة:ليو هو في 5 مم في الحلول الأحماض الأمينية 3 املركبة بشكل مختلف، بالمقارنة مع 6 ملم لالأحماض الأمينية الأخرى. تركيز خفضت لا يقلل من كفاءة التعبير. رفع تصل إلى 6 ملي مناسبة أيضا. - نقل الحلول الأسهم الأحماض الأمينية في الترتيب التالي لتجنب الأمطار: علاء، الارجنتين، الأسباراجين، آسيا والمحيط الهادئ، GLN، حمض الغلوتاميك، الغليسين، صاحب، إيل، ليس، الأرصاد الجوية، الفنيل ألانين، برو، سر، منتدى المجالس الرومانسية، فال، التربتوفان، صور، ليو، والسيستئين. تذكر أن لا إضافة محلول المخزون من الجهاز المركزي للمحاسبات (على سبيل المثال، الارجنتين) التي هي مشابهة لنكا (على سبيل المثال، يمكن). وأخيرا، تماما الدوامة. احتضان عند 37 درجة مئوية لجعل الحل واضحة قدر الإمكان.
- تقسيم هذه الأحماض الأمينية الحل مزيج الرئيسي إلى ثلاثة أحجام متساوية من 1.35 مل. نقل كل من تقسيم المجلدات إلى 1.5 مل أنابيب رد فعل. الاحتفاظ بها على الجليد.
- نقل 1.4 مل من العقيمة O 2 DDH في أنبوب الطرد المركزي 15 مل. وضعه على الجليد. إضافة 175 ميكرولتر من كل حل الأمينية الأسهم حامض. إضافة احدا تلو الآخر، باستثناء محلول المخزون من الجهاز المركزي للمحاسبات (على سبيل المثال، الارجنتين) لتحل محلها الرابطة الوطنية لرياضة (على سبيل المثال، يمكن). دوامة جيدا بعد كل إضافة ووضع الحل مرة أخرى على الجليد.
- إعداد محلول حمض أميني الذي يتكون من جميع كانياس 20 بتركيز 6 مم لكل منهما، فيما عدا لوي الذي هو 5 ملم. لأول حجم سو 1.35 مل، نتيجة للانقسام في خطوة 1.2.4.3، إضافة 50 ميكرولتر من ملي حل 168 سهم من الجهاز المركزي للمحاسبات (على سبيل المثال، الارجنتين) التي هي مشابهة لنكا (على سبيل المثال، يمكن). تماما الدوامة.
- وضع مرة أخرى على الجليد. قسامة هذا الحل 1.4 مل في حجم 16 ميكرولتر في أنابيب رد فعل. لاحظ أن هذا الكتاب حل يؤدي تقريبا إلى 85 قسامات. تسمية هذه قسامات "+ الجهاز المركزي للمحاسبات" (على سبيل المثال، + الارجنتين).
- فلاش تجميد قسامات في النيتروجين السائل وتخزينه في -80 درجة مئوية. تنبيه! لسلامة من ارتداء اي eyeshield والبرد قفازات في الحماية من البقع النيتروجين السائل.
- إعداد محلول حمض أميني الذي يتكون من 19 كانياس باستثناء الجهاز المركزي للمحاسبات (على سبيل المثال، الارجنتين) التي هي مشابهة لنكا (على سبيل المثال، يمكن). إضافة كل الأحماض الأمينية إلى تركيز من 6 ملم، باستثناء لوي (5 ملم).
- إضافة 50 ميكرولتر من العقيمة O 2 DDH إلى المجلد الثاني من 1.35 مل، نتيجة للانقسامفي خطوة 1.2.4.3. تماما دوامة ووضع مرة أخرى على الجليد. قسامة هذا الحل 1.4 مل في حجم 16 ميكرولتر في أنابيب رد فعل. لاحظ أن هذا الكتاب حل يؤدي تقريبا إلى 85 قسامات. تسمية هذه قسامات "- الجهاز المركزي للمحاسبات" (على سبيل المثال، - الارجنتين).
- فلاش تجميد قسامات في النيتروجين السائل وتخزينه في -80 درجة مئوية. تنبيه! لسلامة من ارتداء اي eyeshield والبرد قفازات للحماية من البقع النيتروجين.
- إعداد خليط من الأحماض الأمينية التي تحتوي على 19 كانياس والرابطة الوطنية لرياضة (على سبيل المثال، يمكن) أن يستبدل واحدة الكنسي (على سبيل المثال، الارجنتين). إضافة كل الأحماض الأمينية إلى تركيز من 6 ملم، باستثناء لوي (5 ملم). الى الاخير حجم 1.35 مل، نتيجة للانقسام في خطوة 1.2.4.3، إضافة 50 ميكرولتر من ملي حل الأسهم 168 من الرابطة الوطنية لرياضة (على سبيل المثال، يمكن). تسميته "+ NCAA" (على سبيل المثال، يمكن +). تماما دوامة ووضع مرة أخرى على الجليد.
- قسامة هذا الحل 1.4 مل في حجم 16 & #181؛ ل في أنابيب رد فعل. لاحظ أن هذا الكتاب حل يؤدي تقريبا إلى 85 قسامات. تسمية هذه قسامات "+ NCAA" (مثل +، يمكن).
- فلاش تجميد قسامات في النيتروجين السائل وتخزينه في -80 درجة مئوية. تنبيه! لسلامة من ارتداء اي eyeshield والبرد قفازات للحماية من البقع النيتروجين.
ملاحظة: 16 مجلدا قسامة ميكرولتر المستخدمة في الخطوات 1.2.5.1، 1.2.6.1 و 1.2.7.1 أعلى قليلا مما هو مطلوب لحساب الخسائر الناجمة عن pipetting ل.
2. إعداد العازلة للطاقة
ملاحظة: كل دفعة من استخراج النفط الخام هي فريدة من نوعها وتتطلب تركيز Mg- و-K الغلوتامات 34 الأمثل. حجم قسامة استخراج النفط الخام يعتمد على تركيز البروتين 34. استخدام القالب حساب المقدمة (التكميلي مادة 1) لقيم مختلفة. البحث عن مزيد من التعليمات في خلفية المادة 1 الرقم أسطورة، explaining كيفية توظيف هذا القالب.
- إعداد وتخزينها في -80 درجة مئوية الحل 14X الطاقة واستخراج النفط الخام قسامات وفقا لبروتوكول معدلة 34. معايرة استخراج النفط الخام اعتمادا على تركيزات Mg- وK الغلوتامات لتحسين كفاءة التعبير 34.
ملاحظة: التشكيل النهائي لل14X حل الطاقة: 700 ملي HEPES (درجة الحموضة 8)، 21 ملي اعبي التنس المحترفين، 21 ملي GTP، 12.6 ملي CTP، 12.6 ملي UTP، 2.8 ملغ / مل الحمض الريبي النووي النقال، 3.64 ملي جنة الزراعة، 4.62 ملي NAD، 10.5 ملي المخيم، 0.95 ملم حمض الفولينيك، 14 ملي إنتاج الأسبرميدين، 420 مم 3-PGA. - ذوبان الجليد على الجليد الحل 100 ملم المغنيسيوم الغلوتامات الأسهم، 3 M K-الغلوتامات حل الأوراق المالية، حل 14X الطاقة و 40٪ PEG-8000 لتحضير مزيج الرئيسي. الاحتفاظ بها على الجليد.
- مزيج 9.18 ميكرولتر من محلول المخزون 100 ملي المغنيسيوم الغلوتامات، 3.06 ميكرولتر من محلول المخزون 3 M K-الغلوتامات، 21.86 ميكرولتر من 14X حل الطاقة، 15.3 ميكرولتر من 40٪ PEG-8000 و 1.6 ميكرولتر العقيمة ده 2 O في أنبوب رد فعل. تماما دوامة هذا الصاريإيه خلط بعد كل إضافة، والحفاظ على الجليد.
- قسامة المزيج الرئيسي (51 ميكرولتر) إلى حجم 16 ميكرولتر (3 قسامات) في أنابيب رد فعل. في كثير من الأحيان دوامة مزيج الرئيسي خلال aliquoting. فلاش تجميد قسامات في النيتروجين السائل.
ملاحظة: حجم قسامة 16 ميكرولتر فضلا عن حجم مزيج الرئيسي هي أعلى قليلا مما هو مطلوب لحساب الخسائر الناجمة عن pipetting ل. - استخدام مصفاة لجمع أنابيب عازلة الطاقة. تخزين أنابيب في -80 درجة مئوية. تنبيه! ارتداء eyeshield والبرد قفازات للحماية من البقع النيتروجين.
3. إعداد وتنفيذ ردود الفعل خالية من الخلايا لدمج بقايا محددة من نكس]
- أولا، يعد الحل ناقلات الحمض النووي في [ده 2 O.
- للتعبير البروتين ذات كفاءة عالية، واستخدام ناقلات التعبير pBEST-OR2-OR1 والعلاقات العامة-UTR1-deGFP-T500 32. استنساخ الجين الذي رموز لبروتين النموذج في هذا ناقلات 36،37 </ سوب>.
ملاحظة: يمكنك أيضا استخدام المروجين الأخرى التي تعترف بها σ 70 أيضا، ولكن لاحظ وربما يتم تخفيض أن كفاءة التعبير. - تحويل 37،38 متجه في E. كولاي سلالة KL 740 32 (ييل CGCS #: 4382)، وتنقية تضخيم ناقلات الحمض النووي 37،39 وقياس تركيز محلول الحمض النووي 40-42. تخزين محلول الحمض النووي في -20 درجة مئوية أو مباشرة استخدامها لإعداد رد فعل الخلايا رسوم (الخطوات 3.4.1، 3.4.2 و 3.4.3).
- للتعبير البروتين ذات كفاءة عالية، واستخدام ناقلات التعبير pBEST-OR2-OR1 والعلاقات العامة-UTR1-deGFP-T500 32. استنساخ الجين الذي رموز لبروتين النموذج في هذا ناقلات 36،37 </ سوب>.
- معايرة كفاءة التعبير خالية من الخلايا تبعا لتركيز ناقلات بناء استخدامها وفقا لبروتوكول معدلة 34. استخدام تركيز الأمثل الذي يؤدي إلى أعلى غلة البروتين لإعداد رد فعل خالية من الخلايا (الخطوات 3.4.1، 3.4.2 و 3.4.3).
ملاحظة: إعداد ردود الفعل خالية من الخلايا هو إيراد أمثلة على استخدام نانومتر حل سهم ناقلات الحمض النووي 90 الذي يؤدي إلى تركيز ناقلات النهائي من 10 نانومتر في خلية مجانارد فعل ويتبع القيم المثلى أعلاه من Mg- وK-الغلوتامات وكذلك حجم استخراج قسامة. استخدام القالب حساب لقيم مختلفة. - ذوبان الجليد على الجليد 3 استخراج النفط الخام قسامات كل 30 حجم ميكرولتر (أعدت وفقا لبروتوكول معدلة 34) (1)، الأحماض الأمينية حل قسامة المسمى "+ الجهاز المركزي للمحاسبات" (على سبيل المثال، + الارجنتين) (1)، الأحماض الأمينية حل قسامة المسمى "- الجهاز المركزي للمحاسبات" (على سبيل المثال ، - الارجنتين) و1 الأحماض الأمينية حل قسامة المسمى "+ NCAA" (على سبيل المثال، يمكن +) (المعد في أقسام 1.2.5 - 1.2.7) و 3 مخازن الطاقة قسامات (المعد في القسم 2) والحل ناقلات الحمض النووي ( أعد القسم 3.1).
ملاحظة: استخراج الخام اللزج قليلا وأنها قد تحتوي على فقاعات الهواء. إزالة فقاعات الهواء عن طريق الطرد المركزي في 10000 x ج لمدة 30 ثانية في 4 درجات مئوية. وضع استخراج قسامات الخام مرة أخرى على الجليد. - إعداد 3 ردود الفعل خالية من خلية مكونة بشكل مختلف (كل 90 ميكرولتر الحجم النهائي) عن طريق خلط استخراج النفط الخام (33.33٪) والطاقةعازلة (16.67٪)، 1 من 3 قسامات تتكون بشكل مختلف الأحماض الأمينية الحل (16.67٪) وحل ناقلات الحمض النووي. اختياريا، إضافة المزيد من الجزيئات الحيوية (DNA والبروتينات والحمض الريبي النووي النقال، وما إلى ذلك)، ولكن خفض مناسب حجم ده 2 O.
- إعداد خالية من الخلايا رد فعل المرجعية (90 ميكرولتر) التعبير عن بروتين نموذج معدلة.
- إضافة 15 ميكرولتر من العازلة الطاقة، 15 ميكرولتر من محلول حمض أميني قسامة المسمى "+ الجهاز المركزي للمحاسبات" (على سبيل المثال، + الارجنتين)، 10 ميكرولتر من 90 نانومتر حل ناقلات الحمض النووي و20 ميكرولتر من العقيمة O 2 DDH إلى 30 ميكرولتر من النفط الخام استخراج. مزيج من قبل pipetting صعودا وهبوطا، وبلطف دوامة بعد إضافة كل عنصر.
- قسامة 90 ميكرولتر من رد فعل خالية من الخلايا في 15 مجلدا متساوية من 6 ميكرولتر. نقل كل من أحجام 15 في أنبوب رد فعل منفصل. إغلاق الأنابيب ووضعها من جديد على الجليد. تسمية كل أنابيب رد فعل باسم "CFR (+ الجهاز المركزي للمحاسبات)" (على سبيل المثال، CFR (+ الارجنتين)).
- إعداد السيطرة خالية من الخلايا رد فعل سلبي (90 ميكرولتر)، التي لا يكون فيها الجهاز المركزي للمحاسبات (على سبيل المثال، الارجنتين) ولا التناظرية noncanonical (على سبيل المثال، يمكن) تضاف.
- إضافة 15 ميكرولتر من العازلة الطاقة، 15 ميكرولتر من محلول حمض أميني قسامة المسمى "- الجهاز المركزي للمحاسبات" (على سبيل المثال، - الارجنتين)، 10 ميكرولتر من 90 نانومتر حل ناقلات الحمض النووي و20 ميكرولتر من العقيمة O 2 DDH إلى 30 ميكرولتر من النفط الخام استخراج. مزيج من قبل pipetting صعودا وهبوطا، وبلطف دوامة بعد إضافة كل عنصر.
- قسامة 90 ميكرولتر من رد فعل خالية من الخلايا في 15 مجلدا متساوية من 6 ميكرولتر. نقل كل من أحجام 15 في أنبوب رد فعل منفصل. إغلاق الأنابيب ووضعها من جديد على الجليد. تسمية كل أنابيب رد فعل باسم "CFR (-cAA)" (على سبيل المثال، CFR (-Arg)).
- إعداد رد فعل خالية من الخلايا (90 ميكرولتر) التي من المفترض أن بقايا على وجه التحديد دمج NCAA (على سبيل المثال يمكن،) في البروتين نموذج التعبير عنها.
- إضافة 15ميكرولتر من العازلة الطاقة، 15 ميكرولتر من محلول حمض أميني قسامة المسمى "+ NCAA" (على سبيل المثال، يمكن +)، و 10 ميكرولتر من 90 نانومتر حل الحمض النووي و20 ميكرولتر من العقيمة O 2 DDH إلى 30 ميكرولتر من استخراج النفط الخام. مزيج من قبل pipetting صعودا وهبوطا، وبلطف دوامة بعد إضافة كل عنصر.
ملاحظة: يمكن خفض كفاءة التعبير بالمقارنة مع التعبير مع الأحماض الأمينية القياسية. إذا لزم الأمر، ببساطة رفع مستوى حجم رد الفعل خالية من الخلايا. - قسامة 90 ميكرولتر من رد فعل خالية من الخلايا في 15 مجلدا متساوية من 6 ميكرولتر. نقل كل من أحجام 15 في أنبوب رد فعل منفصل. إغلاق الأنابيب ووضعها من جديد على الجليد. لزيادة حجم رد الفعل، وفقا لذلك قسامة في أحجام مزيد من 6 ميكرولتر. تسمية كل أنابيب رد فعل باسم "CFR (+ NCAA)" (على سبيل المثال، CFR (+ يمكن)).
- إضافة 15ميكرولتر من العازلة الطاقة، 15 ميكرولتر من محلول حمض أميني قسامة المسمى "+ NCAA" (على سبيل المثال، يمكن +)، و 10 ميكرولتر من 90 نانومتر حل الحمض النووي و20 ميكرولتر من العقيمة O 2 DDH إلى 30 ميكرولتر من استخراج النفط الخام. مزيج من قبل pipetting صعودا وهبوطا، وبلطف دوامة بعد إضافة كل عنصر.
- إعداد خالية من الخلايا رد فعل المرجعية (90 ميكرولتر) التعبير عن بروتين نموذج معدلة.
- احتضان جميع أنابيب في 29 ° CO / N.
ملاحظة: كميات رد فعل فقط صغيرة تمكن فرق كافية من الأوكسجينusion في رد فعل أمر حاسم للتعبير البروتين كفاءة عالية. كميات رد فعل أكبر من 10 ميكرولتر تتطلب الأوكسجين النشط من خلال التحريض 34. لكميات كبيرة، وتقسيم التفاعل إلى كميات أصغر من 15 ميكرولتر. - بعد التعبير خالية من الخلايا، تجمع يتألف كل مماثل ردود الفعل خالية من الخلايا المنقسمة من 6 ميكرولتر. أولا، تجمع كل 15 ردود الفعل خالية من الخلايا المنقسمة من 6 ميكرولتر المسمى "CFR (+ الجهاز المركزي للمحاسبات)" (على سبيل المثال، CFR (+ الارجنتين)). ثم، تجمع كل 15 ردود الفعل خالية من الخلايا المنقسمة من 6 ميكرولتر المسمى "CFR (-cAA)" (على سبيل المثال، CFR (-Arg)). وأخيرا، تجمع كل 15 ردود الفعل خالية من الخلايا المنقسمة من 6 ميكرولتر المسمى "CFR (+ NCAA)" (على سبيل المثال، CFR (+ يمكن)). لزيادة حجم رد الفعل، وفقا لتجميع كميات إضافية من 6 ميكرولتر.
- التحقق من مستوى التعبير عن بروتين نموذج في كل ثلاثة المجمعة، تتكون بشكل مختلف ردود الفعل خالية من الخلايا عن طريق إجراء تغيير طبيعة SDS-PAGE 43،44 (القسم 4.1).
ملاحظة: استخدم هذا metho د لتقييم أولي للتجربة التأسيس. - إعداد البروتينات نموذج أعرب خالية من الخلايا لتحليل مناسب عن طريق HPLC-ESI الطيفي كتلة (القسم 4.4). أولا، تنقية 45 منهم (القسم 4.2). وأخيرا، تبادل (القسم 4.3) المخزن المؤقت لتجنب الضوضاء في الخلفية عالية خلال التحليل الطيفي الشامل.
ملاحظة: المقاطع 3.4.1، 3.4.2 و 3.4.3 تؤدي إلى خالية من الخلايا ظروف التفاعل النموذجية 34: 8،9-9،9 ملغ / مل بروتين (من استخراج النفط الخام)، 4،5 حتي 10،5 ملي المغنيسيوم، الغلوتامات، 40-160 ملم K-الغلوتامات، 1 ملم من كل الأحماض الأمينية إلا ليسين، 0.83 ملم ليسين، 50 ملي HEPES، 1.5 ملي اعبي التنس المحترفين وGTP، 0.9 ملي CTP وUTP، 0.2 ملغ / مل الحمض الريبي النووي النقال، 0.26 ملي جنة الزراعة، 0.33 ملي NAD، 0.75 ملي المخيم ، 0،068 ملم حمض الفولينيك، 1 ملم إنتاج الأسبرميدين، 30 ملم 3-PGA، 2٪ PEG-8000 و 10 نانومتر pBEST-OR2-OR1 والعلاقات العامة-UTR1-gene_of_model_protein-T500. إذا رغبت في ذلك، يمكن أن تتم إجراءات مختلفة من إعداد رد فعل خالية من الخلايا التي تؤدي إلى ظروف التفاعل أعلاه.
- SDS-PAGE من ردود الفعل خالية من الخلايا
ملاحظة: تنفيذ denaturating SDS-PAGE لتحليل سريع ومبدئي من البروتينات وأعرب دون أي تنقية أخرى أو الاستخراج، وتنفيذ الخطوات التالية.- ذوبان الجليد في مستوى البروتين على الجليد. تأكد من أنه يتكون من البروتينات مع أوزان جزيئية مماثلة للبروتين نموذج أعرب عن التعريب على هلام (الخطوة 4.1.13).
ملاحظة: وهنا، يوفر المعيار المستخدم البروتينات على نطاق واسع من الأوزان الجزيئية (الميوسين: 212 كيلو دالتون، ملزم المالتوز البروتين-β غالاكتوزيداز: 158 كيلو دالتون، بيتا غالاكتوزيداز: 116 كيلو دالتون، فسفوريلاز ب: 97 كيلو دالتون، الزلال في الدم : 66 كيلو دالتون، نازعة الجلوتاميك: 56 كيلو دالتون، المالتوز ملزم البروتين: 43 كيلو دالتون، اختزال thioredoxin: 35 كيلو دالتون، إيزوميراز triosephosphate: 27 كيلو دالتون، مثبط التربسين: 20 كيلو دالتون، لايsozyme: 14 كيلو دالتون، أبروتينين: 7 كيلو دالتون، الأنسولين ج: 3 كيلو دالتون، سلسلة B: 2 كيلو دالتون). - منذ ردود الفعل خالية من الخلايا هي لزجة قليلا نظرا لتركيز عالية من البروتين، وتمييع لهم العقيمة O 2 DDH 5-10 مرات من قبل SDS-PAGE لضمان الهجرة هلام المناسبة وتجنب التشبع بعد تلطيخ. حتى لا تضيع الكثير من العينة، وتمييع 1 ميكرولتر من رد فعل خالية من الخلايا في 4 ميكرولتر من ده معقم 2 O. إعداد التخفيف في أنابيب رد فعل، دوامة بدقة وتدور فترة وجيزة من السائل إلى أسفل مع جهاز للطرد المركزي مصغرة ل2-3 ثانية في 2000 ز س.
- إضافة 5 ميكرولتر من العازلة 2X تحميل 5 ميكرولتر من رد فعل خالية من الخلايا المخفف. تماما دوامة وتدور باستمرار مع جهاز للطرد المركزي مصغرة ل2-3 ثانية في 2000 ز س.
ملاحظة: هنا، بعد بالإضافة إلى ذلك، يتم حل الجزيئات الحيوية في 62.5 ملي تريس / الكلورين -، 10٪ الجلسرين، 2٪ SDS، و0.0025٪ برموفينول الأزرق في الرقم الهيدروجيني 6.8، تكوين نموذجي. باستخدام الأصباغ التحميل الأخرى التي تؤدي إلى مختلف قليلا التخفيف التعاونقد يكون nditions مناسبة أيضا. - تماما دوامة مستوى البروتين ونقل 15 ميكرولتر من ذلك في أنبوب رد فعل.
ملاحظة: اعتمادا على حجم جل ومعايير البروتين أخرى، يمكن أن حجم الموصى بها تختلف عن ما سبق. - وضع أنابيب رد فعل في كتلة التدفئة. معرفة ما اذا كان يتم إغلاق أغطية الأنابيب بشكل صحيح. الحرارة في 95-100 درجة مئوية لمدة 3-5 دقيقة. هل هذا لتفسد البروتينات وتمكين SDS التفاف حول العمود الفقري البروتين.
ملاحظة: بعض المعايير البروتين يجب أن لا تكون ساخنة، انظر تعليمات المورد. - وفي غضون ذلك، نقل المخزن المؤقت الوقوع في غرفة الكهربائي للهلام. محتوى 1X عازلة تشغيل 25 ملي تريس، 192 ملي الجلايسين، 0.1٪ SDS في درجة الحموضة 8.3 (مع حمض الهيدروكلوريك).
- إصلاح الجاهزة 4-20٪ التدرج تريس، جليكاين-SDS هلام (10 سم × 10 سم × 1 مم) إلى غرفة الكهربائي. إزالة المشط وشطف الآبار مع حقنة محملة العازلة على التوالي.
ملاحظة: STRO تركيز جليعتمد ngly على حجم وطبيعة البروتين نموذج التعبير عنها. تركيز أعلاه يفصل E. القولونية استخراج النفط الخام البروتينات وكذلك جزيئي منخفض البروتينات الوزن نموذج. المواد الهلامية الصب النفس هي مناسبة أيضا. - إزالة الأنابيب من كتلة التدفئة. تدور السائل إلى أسفل مع جهاز للطرد المركزي مصغرة ل2-3 ثانية في 2000 ز س. دوامة قريبا وكرر الغزل باستمرار ل2-3 ثانية في 2000 ز س.
- نقل 15 ميكرولتر من مستوى البروتين (24 - بروتين 48 ميكروغرام) و 10 ميكرولتر (11-22 ميكروغرام البروتين) من كل عينة في آبار والبدء الكهربائي. هنا، يتم تنفيذ SDS-PAGE على 125 فولت و 20 - 40 مللي أمبير لحوالي 90 دقيقة، وبروتوكول نموذجي.
- استخراج بعناية الجل من الكاسيت. نقله إلى الحل تحديد (50٪ الميثانول، وحمض الخليك 10٪، 40٪ [ده 2 O) لمدة 30 دقيقة. تنبيه! الميثانول سامة عن طريق الاستنشاق وعند التلامس مع الجلد. ارتداء القفازات الواقية والعمل تحت غطاء الدخان.
- نقل جل في حل تلطيخ (0.025٪ Coomassie الأزرق اللامع G-250، وحامض الخليك 10٪، 90٪ [ده 2 O). وصمة عار لمدة 60 دقيقة.
- نقل جل في حل destaining (حامض الخليك 10٪، 90٪ [ده 2 O) ل60-120 دقيقة.
ملاحظة: إصلاح، وتلطيخ وdestaining بقوة تعتمد على حجم وطبيعة البروتين المعبر عنه. ينطبق هذا البروتوكول لمجموعة واسعة من البروتينات ذات الأوزان الجزيئية الصغيرة بدلا من 46. - تهجير الهلام على الشفافية غير لامع على خلفية بيضاء أن يولد المقابل المناسب لعصابات بروتين الملون.
- ذوبان الجليد في مستوى البروتين على الجليد. تأكد من أنه يتكون من البروتينات مع أوزان جزيئية مماثلة للبروتين نموذج أعرب عن التعريب على هلام (الخطوة 4.1.13).
- تطهير 45 البروتينات نموذج الموسومة له من ردود الفعل خالية من الخلايا
ملاحظة: للحصول على تنقية البروتين، عدة طرق موجودة أن تحقيق نتائج مماثلة. هذا البروتوكول ينقي خالية من الخلايا البروتينات نموذج أعرب التي لديها C-محطة polyhistidine العلامة (صاحب العلامة). ويستخدم عدة تنقية مناسبة للبروتينات التي إكسبressed في حجم رد الفعل صغيرة من بروتين تعبير خالية من الخلايا. أنه مطابق لتنقية البروتينات نموذج الأم أو تعديلها. وهكذا، يوصف عموما على أساس من رد فعل واحد خالية من خلية واحدة.- لHPLC-ESI التحليل المناسب الطيفية كتلة، واستخراج وتنقية البروتينات نموذج من رد فعل خالية من الخلايا وتنفيذ الخطوات التالية.
- خلط كميات متساوية من 90-150 ميكرولتر من صاحب ملزم العازلة و90-150 ميكرولتر من رد فعل خالية من الخلايا. ماصة صعودا وهبوطا، تليها vortexing لطيف.
ملاحظة: استخدام صاحب ملزم عازلة يوصى. ومع ذلك، يمكن خالية من الخلايا المتوسطة الرد سيكون مادة أولية طالما البروتين نموذج قابل للذوبان، ودرجة الحموضة ما بين 7،5-8، ايميدازول / تركيز له هو <10 ملم، وتركيز عوامل اختزال القوي هو <15 مم ولا metal- وكلاء مخلبية موجودة. إذا تجاوز حجم الخليط الخاص بك 300 ميكرولتر، تقسيمه إلى كميات متساوية وقسامة أطروحات مجلدات في ص مختلفةأنابيب eaction للخطوات تنقية التالية. - إعداد نظام العمود. تماما دوامة الحل الأسهم من هلام صاحب تقارب حتى يذوب الراتنج هلام تماما. نقل 250 ميكرولتر من الراتنج هلام في العمود. استخدام 1 مل ماصة للالراتنج هلام لزج. وضع عمود في أنبوب جمع.
- أجهزة الطرد المركزي أنبوب العمود / جمع لمدة 5 - 10 ثانية على 13،000 - 15،000 ز س. تأكد من أن الراتنج هلام ينضب تماما. إذا لم يكن كذلك، تمديد الوقت الطرد المركزي التي كتبها إضافي 5-10 ثانية، ولكن الانتباه إلى أن جل تقارب لا تجفف على. تمديد وفقا لذلك الوقت الطرد المركزي في الخطوات 4.2.1.5، 4.2.1.7 و 4.2.1.9.
ملاحظة: يتم تصريف الراتنج هلام تماما إذا أصبحت قاسية ولا يبقى طاف على القمة. - نقل 150-300 ميكرولتر من المنطقة العازلة خالية من الخلايا رد فعل / صاحب ملزم إلى العمود. إذا تجاوز حجم مزيج حجم الموصى بها، وتقسيم أكثر من عدة أعمدة الدوران. Resuspend والراتنج هلام التي كتبها الابequent التنصت وvortexing لطيف خلال فترة حضانة من 2 دقيقة على الأقل. لكميات أكبر من 200 ميكرولتر، احتضان لمدة إضافية 1-2 دقيقة.
ملاحظة: فترة حضانة كافية ضروري لربط البروتينات نموذج لالراتنج هلام. - أجهزة الطرد المركزي أنبوب العمود / جمع لمدة 5 - 10 ثانية على 13،000 - 15،000 ز س. تجاهل التدفق من خلال وضع العمود مرة أخرى في أنبوب جمع.
- إضافة 250 ميكرولتر من صاحب غسل العازلة. Resuspend والراتنج هلام من خلال استغلال وvortexing لطيف.
- أجهزة الطرد المركزي أنبوب العمود / جمع لمدة 5 - 10 ثانية على 13،000 - 15،000 ز س. تجاهل التدفق من خلال وضع العمود مرة أخرى في أنبوب جمع. كرر الخطوة 4.2.1.6 وأجهزة الطرد المركزي مرة أخرى لمدة 5 - 10 ثانية على 13،000 - 15،000 ز س.
- وضع عمود في أنبوب رد فعل 1،5 مل القياسية. إضافة 150 ميكرولتر من شطف العازلة و resuspend الراتنج هلام من خلال استغلال وvortexing لطيف. تقليل حجم إلى 100 ميكرولتر لأعلى نموذج تنقية البروتين يخدعcentrations بعد شطف في الخطوة التالية 4.2.1.9.
ملاحظة: وفرة الإجمالية للبروتين نموذج تنقيته وربما يتم تخفيض بسبب الممكن شطف غير مكتمل من جميع البروتينات محددة الراتنج هلام، إذا تم تخفيض حجم شطف العازلة. - أجهزة الطرد المركزي أنبوب العمود / رد فعل لمدة 5 - 10 ثانية على 13،000 - 15،000 x ج ليخفف من البروتين النقي في شطف العازلة. إذا انشق قبل، تجميع كل الحلول في حل سهم واحد.
- قبل تنفيذ تبادل العازلة، تحديد تركيز البروتين باستخدام الأساليب القياسية، على سبيل المثال، برادفورد مقايسة 47،48.
ملاحظة: للحصول على HPLC-ESI الطيفي كتلة المناسب (القسم 4.4)، استخدام تركيزات البروتين المثلى التي عادة ما تكون حوالي 0.5 ملغ / مل مع وحدات التخزين المطلوبة من 20 - 50 ميكرولتر. إذا كان تركيز أقل من 0.2 ملغ / مل، والتركيز على حل البروتين بعد تبادل عازلة باستخدام مكثف الغزل فراغ. في هذه الحالة، أولا قراءة القسم 4.3.8 على التكيف على نحو ملائم برتقالي تبادلإيه.
- خلط كميات متساوية من 90-150 ميكرولتر من صاحب ملزم العازلة و90-150 ميكرولتر من رد فعل خالية من الخلايا. ماصة صعودا وهبوطا، تليها vortexing لطيف.
- لHPLC-ESI التحليل المناسب الطيفية كتلة، واستخراج وتنقية البروتينات نموذج من رد فعل خالية من الخلايا وتنفيذ الخطوات التالية.
- صرف عازلة للHPLC-ESI الطيفي كتلة
ملاحظة: صرف شطف العازلة صاحب العلامة لتجنب الضوضاء في الخلفية عالية في التحليل الطيفي الشامل نظرا لتركيز عال من ايميدازول (> 150 ملم) وغيرها من الأملاح مثل ناه 2 ص 4 (> 300 ملم) أو كلوريد الصوديوم (> 50 ملم) 49. يستخدم بروتوكول تبادل عازلة التالية هلام الترشيح نظام عمود الدوران prehydrated. يتم تنفيذ مطابق لأنها البروتينات نموذج الأم أو تعديلها. وهكذا، يوصف عموما على أساس من رد فعل واحد خالية من خلية واحدة. لاحظ أن هناك طرق الصرف أخرى سهلة لأداء العازلة، على سبيل المثال، وخراطيش مصغرة لغسيل الكلى.- إعداد 100 مل من العازلة تخزين البروتين (50 ملي تريس الكلورين درجة الحموضة 8، 100 مم كلوريد الصوديوم، و 10٪ الجلسرين). تزن بها إلى autoclavable 100 مل زجاجة 605.7 ملغ تريس، قاعدة، 584.4 ملغم كلوريد الصوديوم وإضافة 10 مل من الجلسرين. ملء تصل إلى ما يقرب من 80 مل وضبط قيمة الرقم الهيدروجيني إلى 8 من قبلdding هيدروكسيد الصوديوم. تحقق باطراد قيمة الرقم الهيدروجيني مع متر الرقم الهيدروجيني. وأخيرا، وملء ما يصل الى علامة 100 مل.
ملاحظة: استخدام هذا المخزن المؤقت لتحقيق الاستقرار في مجموعة واسعة من البروتينات نموذج وعدم تعكير صفو التحليل الطيفي الشامل، طالما يتم تنفيذ HPLC قبل القياس الطيفي الشامل. ومع ذلك، اعتمادا على طبيعة بروتين نموذجي وأعرب، استخدام مخازن أخرى قد تكون أفضل مناسبة. إذا البروتين الهدف الخاص بك ليست مستقرة في درجة الحموضة 8، وضبط درجة الحموضة وفقا لذلك. لا تستخدم التركيزات العالية. - الاحماء الأعمدة تدور جل الترشيح لمدة 15 دقيقة على الأقل لRT.
- Resuspend وهلام prehydrated من خلال استغلال طيف أو vortexing لوإزالة فقاعات الهواء.
- أولا إزالة الغطاء السفلي، ومن ثم اتخاذ الغطاء العلوي بعيدا. وضع عمود في أنبوب غسل (2 مل على الأقل). نقل أنبوب العمود / غسل في أجهزة الطرد المركزي. كل عمود يمتلك علامة التوجه. أجهزة الطرد المركزي في 1000 x ج لمدة 2 دقيقة لإزالة العازلة التخزين هلام. القرصايه ار دى التدفق من خلال.
ملاحظة: انتبه إلى المضي قدما في هذا الأمر. تأكد من أن عمود له نفس التوجه في جميع خطوات أخرى الطرد المركزي. - تضيف ما يصل الى 400 ميكرولتر من المخزن المؤقت تخزين البروتين. أجهزة الطرد المركزي لمدة 2 دقيقة في 1000 ز س. كرر هذا لتحميل تماما المخزن المؤقت تخزين البروتين في هلام. بعناية تضيف ما يصل الى 100 ميكرولتر من محلول البروتين النموذج النقي. ماصة مباشرة على مركز السرير هلام.
ملاحظة: أحجام الحل لتنقية البروتينات، وخاصة من البروتينات المعدلة، قد يكون أعلى. تقسيم هذه الحلول على مدى عدة أعمدة الصرف العازلة. يجب أن يكون البروتينات الأوزان الجزيئية أعلى من 5 كيلو دالتون لهذا النوع من التبادل العازلة. - وضع عمود في أنبوب جمع وأجهزة الطرد المركزي لمدة 2 دقيقة في 1000 ز س.
ملاحظة: هذه الخطوة تؤدي إلى التخفيف من البروتين النقي نموذج في المنطقة العازلة تخزين البروتين. إذا انشق قبل، تجميع كل الحلول في حل سهم واحد. - عشر فلاش تجميده حل البروتين في النيتروجين السائل ومخزن في -80 درجة مئوية أو مباشرة تحليلها عن طريق HPLC-ESI الطيفي كتلة 50 (القسم 4.4). تنبيه! ارتداء eyeshield والبرد قفازات للحماية من البقع النيتروجين.
- قم بالخطوات التالية لبروتوكول لتركيز محلول البروتين باستخدام فراغ المكثف الغزل الذي يتبخر بعناية المذيبات 51.
ملاحظة: يرجى ملء هذه الخطوات إذا كان تركيز البروتين منخفض جدا لHPLC-ESI الطيفي كتلة (<0.2 ملغ / مل). تركيز بروتين حجم حل والنموذج هو تقريبا نفس قبل وبعد الصرف العازلة. ووصف عملية الاعتقال من خلال المثال التالي: بعد تنقية صاحب العلامة، يذوب البروتين نموذج في 100 ميكرولتر صاحب شطف العازلة (الخطوة 4.2.1.9) ويحتوي على نسبة من 0.07 ملغ / مل (خطوة 4.2.1.10) .- للتأكد من أن تركيز البروتين وحجم حل وبعد تبخر فيأقل 0.2 ملغ / مل و 20 ميكرولتر، على التوالي، تمييع، قبل صرف العازلة، العازلة تخزين البروتين أعدت في الخطوة 4.3.1 ما لا يقل عن ثلاثة أضعاف ولكن في معظم خمسة أضعاف. تتبخر على قدم المساواة في ما يلي اثنين على الأقل الثالث (66.67 ميكرولتر) أو أربعة على الأكثر الخامس (80 ميكرولتر).
ملاحظة: التخفيف من المخزن المؤقت تخزين البروتين قبل تبادل عازلة أمر بالغ الأهمية أن تأخذ في الاعتبار أن قيم تركيز هذا المخزن المؤقت (الخطوة 4.3.1) لا تزال تتحقق على الرغم من التبخر. بعد التخفيف من المخزن المؤقت تخزين البروتين، أولا إجراء تبادل عازلة (الخطوات 4.3.2 - 4.3.6) قبل تنفيذ الخطوات التالية 4.3.8.2 - 4.3.8.4. - بعد تبادل العازلة، وضع 100 ميكرولتر كاملة من حل البروتين نموذج في أنبوب مفتوحة إلى المكثف الغزل فراغ.
ملاحظة: يذوب البروتين نموذج في المنطقة العازلة تخزين البروتين المخفف. انحدر باتجاه مركز دوران لتجنب السائل فقدان أثناء الدوران. ضمان أن فارغة مفتوحة من نفس الحجم منH 2 O يوضع بشكل متناظر لتحقيق التوازن في نظام الغزل. - إغلاق غطاء مكثف وبدء دوران. لضمان استقرار البروتين، والتركيز على RT أو في درجات حرارة منخفضة تصل إلى 30 درجة مئوية.
ملاحظة: إن المكثف المستخدمة يسرع تلقائيا إلى 170 x ج وتنص الفراغ. في ما يلي يسارع إلى سرعة قصوى لها 240 × ز. - كثيرا ما يقاطع عملية تركيز لمسح حجم السائل. وقف التركيز، وعندما يكون حجم الحل المتبقية ما بين 20 ميكرولتر و 33 ميكرولتر.
ملاحظة: وبناء على التكيف مع الخطوات 4.3.8.1 - 4.3.8.4 لكميات أخرى الحل (الخطوة 4.2.1.9) وتركيزات البروتين الأخرى (خطوة 4.2.1.10). فلاش تجميد الحل البروتين تتركز في النيتروجين السائل وتخزينه في -80 درجة مئوية، أو مباشرة تحليلها عن طريق HPLC-ESI الطيفي كتلة 50. الحذر! ارتداء eyeshield والبرد قفازات في الحماية من البقع النيتروجين.
- للتأكد من أن تركيز البروتين وحجم حل وبعد تبخر فيأقل 0.2 ملغ / مل و 20 ميكرولتر، على التوالي، تمييع، قبل صرف العازلة، العازلة تخزين البروتين أعدت في الخطوة 4.3.1 ما لا يقل عن ثلاثة أضعاف ولكن في معظم خمسة أضعاف. تتبخر على قدم المساواة في ما يلي اثنين على الأقل الثالث (66.67 ميكرولتر) أو أربعة على الأكثر الخامس (80 ميكرولتر).
- إعداد 100 مل من العازلة تخزين البروتين (50 ملي تريس الكلورين درجة الحموضة 8، 100 مم كلوريد الصوديوم، و 10٪ الجلسرين). تزن بها إلى autoclavable 100 مل زجاجة 605.7 ملغ تريس، قاعدة، 584.4 ملغم كلوريد الصوديوم وإضافة 10 مل من الجلسرين. ملء تصل إلى ما يقرب من 80 مل وضبط قيمة الرقم الهيدروجيني إلى 8 من قبلdding هيدروكسيد الصوديوم. تحقق باطراد قيمة الرقم الهيدروجيني مع متر الرقم الهيدروجيني. وأخيرا، وملء ما يصل الى علامة 100 مل.
- HPLC-ESI التحليل الطيفي كتلة 50 من البروتينات نموذج
- أداء الفصل HPLC من 5 - حل 15 ميكرولتر من البروتين (المعد في القسم 4.3) على عمود C5 عكس المرحلة (3 ميكرون، 100 × 2.1 مم) مع التدرج من 20٪ - 90٪ الأسيتونتريل و 0.1٪ من حمض الفورميك أكثر من 25 دقيقة ولاحق ESI قياس الطيف الكتلي مع الكشف على analysator كتلة الوقت من الطيران في حدود 300 - 3000 م / ض.
ملاحظة: اعتمادا على طبيعة بروتين نموذجي وأعرب، تستخدم المذيبات أو الأعمدة الأخرى التي قد تكون أفضل مناسبة. - Deconvolute قياس طيف الكتلة باستخدام البرمجيات المناسبة 52 لحساب الجماهير الصفر المسؤول.
- أداء الفصل HPLC من 5 - حل 15 ميكرولتر من البروتين (المعد في القسم 4.3) على عمود C5 عكس المرحلة (3 ميكرون، 100 × 2.1 مم) مع التدرج من 20٪ - 90٪ الأسيتونتريل و 0.1٪ من حمض الفورميك أكثر من 25 دقيقة ولاحق ESI قياس الطيف الكتلي مع الكشف على analysator كتلة الوقت من الطيران في حدود 300 - 3000 م / ض.
النتائج
ويوجه هذا البروتوكول من خلال إدراج فضلات معينة خالية من الخلايا من نكس] إلى بروتينات نموذج. ويقترح SDS-PAGE لتقييم أولي للتجربة التأسيس واتخاذ مزيد من الخطوات لإعداد البروتينات نموذجا لHPLC-ESI التحليل المناسب الطيفية كتلة.
هنا، يتم عرض نتائج ممثل من إدراج فضلات معينة خالية من الخلايا من التناظرية الارجنتين يمكن، وكذلك اليس التناظرية L-هيدروكسي-ليسين (HYL). الحلول الأحماض الأمينية المختلفة، وعازلة للطاقة، يتم إعداد ترميز الحمض النووي ناقلات للبروتين نموذج وردود الفعل خالية من الخلايا كما هو موضح أعلاه. ويرد رد فعل خالية من مرجع الخلية مع الحل الأحماض الأمينية التي تتكون من 20 كانياس. لكل تجربة، تم توفير السيطرة على رد فعل سلبي خالية من الخلايا مع الحل الأحماض الأمينية التي تفتقر إلى التناظرية الكنسي من نكا في السؤال. لكل approach، رد فعل واحد خالية من الخلايا يعبر عن بروتين نموذج في وجود محلول حمض أميني، حيث يتم استبدال الجهاز المركزي للمحاسبات من قبل التناظرية noncanonical. وأعدم أخوه العلامة تنقية وتبادل العازلة وHPLC-ESI التحليل الطيفي الشامل وفقا لبروتوكول الموصوفة أعلاه.
البروتين النموذج هو C-محطة صاحب الموسومة deGFP 32، نسخة اقتطاع من EGFP 53. ويمكن الاطلاع على حرف واحد تسلسل الأحماض الأمينية في (المواد التكميلية 2). هذا البروتين نموذج يحتوي على 6 الارجنتين و 18 مناصب ليس، على التوالي. متجه التعبير pBEST-OR2-OR1 والعلاقات العامة-UTR1-deGFP-T500.
في حالة دمج كامل للNCAA، يمكن للمرء أن يفترض أن رد الفعل سيطرة سلبية لا تعبر عن deGFP، منذ واحد من 20 كانياس مفقود. العكس من ذلك، يجب أن يكون deGFP كشف في اثنين من ردود الفعل الأخرى: واحد الأصلي في reference رد فعل خالية من الخلايا والبروتين المعدلة في رد فعل خالية من الخلايا التي يتم توفيرها مع NCAA.
ويبين الشكل 1A التمهيدية تقييم SDS-PAGE من إدراج التجربة علبة. رد الفعل إشارة خالية من الخلايا لديها أعلى مستوى التعبير deGFP. في رد فعل خالية من الخلايا التي يتم توفيرها مع العلبة، ويتم التعبير عن deGFP في تركيز أقل قليلا. ويمكن الكشف عن أي تعبير deGFP في السيطرة السلبية. هذه النتيجة SDS-PAGE تعتبر مؤشرا جيدا لدمج الناجح هل يمكن في deGFP البروتين المستهدف.
لإثبات التأسيس الكامل المفترضة يمكن في deGFP، سواء البروتينات نموذج النقاء، تصور في الشكل 1B، ويتم تحليل من خلال HPLC-ESI الطيفي الشامل. ويبين الشكل 1C أطياف الشامل deconvoluted من الجزيئات deGFP النقاء. كتلة deconvoluted من deGF ف التي يعبر عنها في رد فعل خالية من الخلايا المرجعية هي 26،192.8 دا. لdeGFP أعرب في علبة تحتوي على رد فعل خالية من الخلايا تظهر كتلة 26202.5 دا. الجماهير المتوقعة للdeGFP6Arg مواطن وdeGFP6Can تعديل مع الارجنتين يتم استبداله بالكامل من قبل هل يمكن هي 26193 دا و26204 دا على التوالي. الفرق كتلة 1.5 دا لdeGFP6Can هو داخل خطأ من deconvolution الطيف. وهكذا، وأكد الإدماج الكامل للهل يمكن في deGFP في جميع المناصب الارجنتين 6.
قمم اثنين من انخفاض كثافة تتوافق مع deGFP6Arg مواطن وdeGFP6Can المعدلة التي لم تحصل على fluorophore على ناضجة. يتم إنشاء fluorophore autocatalytically من القضاء ليا جزيء H 2، ويليه الأكسدة. وهذا يؤدي الى كتلة بنسبة 20 دا لو لا تمضي هذه العملية.
خريج "/>
الشكل 1. تقييم SDS-PAGE من يمكن ضمهما التجربة وHPLC-ESI الطيفي كتلة جزيئات deGFP خالية من الخلايا أعرب والنقاء. (أ) تقييم أولي لهذه التجربة يمكن ضمهما باستخدام SDS-PAGE. من اليسار إلى اليمين: مستوى البروتين، رد فعل خالية من الخلايا إشارة، السيطرة السلبية وردود الفعل خالية من الخلايا توفير يمكن بدلا من الارجنتين. (ب) SDS-PAGE بعد صاحب العلامة تنقية والعازلة تبادل الجزيئات deGFP التعبير عنها. من اليسار إلى اليمين: مستوى البروتين، deGFP تنقيته من رد الفعل إشارة، تنقية deGFP من رد الفعل هل يمكن تحتوي على. (ج) تأكيد الإدماج الكامل ل Can بواسطة HPLC-ESI الطيفي الشامل. الجماهير المتوقعة للdeGFP مواطن وdeGFP تعديل مع الارجنتين استبدال بالكامل من قبل هل يمكن هي 26193 دا و26204 دا على التوالي. وتطبيع كل الطيف لأعلى كثافة لها (التهم). يشار إلى مناصب الذروةفي دا. لأغراض التصور، يتم استخراج الممرات هلام من الصور هلام، انضم معا، يتم تحويلها إلى شكل مقياس الرمادية، هو الأمثل الحجم وتعزيز النقيض وكذلك السطوع. يتم عرض الممرات هلام الأصلية في خلفية المواد 3. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
ويبين الشكل 2A التمهيدية تقييم SDS-PAGE التجربة التأسيس HYL. في رد فعل خالية من الخلايا التي يتم توفيرها مع HYL، وأعرب عن deGFP. على النقيض من التجربة الأولى، فرقة deGFP ضعيفة ويمكن ملاحظة في رد فعل سلبي السيطرة. قد يكون هذا بسبب مخلفات اليس في التفاعلات خالية من الخلايا. وهذا يمكن التعبير deGFP خافت في رد فعل السيطرة السلبية، حيث يتم إضافة لا ليز ولا HYL.
لH PLC-ESI الطيفي الشامل، والجزيئات deGFP من رد فعل خالية من الخلايا المقدمة مع HYL هي النقاء ويتم تبادل المخزن المؤقت (الشكل 2B).
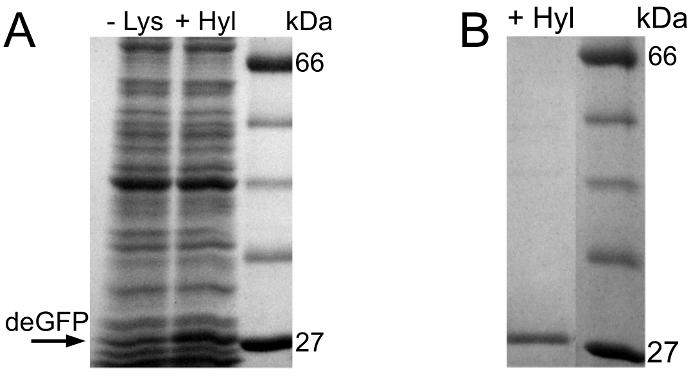
الرقم تقييم 2. SDS-PAGE التجربة التأسيس HYL (A) من اليسار إلى اليمين: سلبي السيطرة على رد فعل خالية من الخلايا، رد فعل خالية من الخلايا التي تحتوي على HYL ومستوى البروتين. (ب) SDS-PAGE بعد صاحب العلامة تنقية والعازلة تبادل الجزيئات deGFP التعبير عنها. من اليسار إلى اليمين: تنقية deGFP من HYL تحتوي على رد فعل ومستوى البروتين. لأغراض التصور، يتم استخراج الممرات هلام من الصور هلام، انضم معا، يتم تحويلها إلى شكل مقياس الرمادية، هو الأمثل الحجم وتعزيز النقيض وكذلك السطوع. يتم عرض الممرات هلام الأصلية في خلفية المادة 3.و = "https://www.jove.com/files/ftp_upload/54273/54273fig2large.jpg" الهدف = "_ فارغة"> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
ويبين الشكل 3 الطيف الكتلي deconvoluted من جزيئات deGFP تنقيته. الشكل 3A يؤكد فرضية بقايا اليس الموجودة بالفعل في ردود الفعل خالية من الخلايا. ذروة الغالبة من الطيف يتوافق مع الأم (كتلة المتوقع: 26193 دا) deGFP. مرة أخرى، يمكن الكشف عن جزيئات deGFP من 20 دا أعلى الجماعية التي لم تتطور fluorophore بهم. يتم تحميل بقايا اليس تفضيلي على الحمض الريبي النووي النقال اليس من الليزيل-الحمض الريبي النووي النقال-مخلقة مما يؤدي إلى مستوى التعبير عالية من deGFP18Lys مواطن.
الفرق الشامل بين HYL واليس هو 16 دا. بسبب وجود HYL التي هي في المنافسة على بقايا اليس يتم إنشاء جميع أنواع deGFP الممكنة (deGFP18Hyl،deGFP17Hly + 1Lys، ...، deGFP16Hyl + 2Lys) (الشكل 3B). وباعتراف الجميع، وذروة deGFP1Hyl + 17Lys تتداخل مع ذروة deGFP مواطن التي لا تنتج fluorophore لها (الشكل 3A) وكتلة من بعض القمم يختلف أكثر من 2 دا من كتلة المتوقعة. ويمكن أن يعزى هذا الاختلاف كتلة لضوضاء عالية نظرا لكميات قليلة من الأنواع deGFP. ومع ذلك، يتم تضمينها HYL عموما من قبل نظام خالية من الخلايا. المزيد من التحسينات التي ينبغي القيام به للقضاء على بقايا اليس في التفاعلات خالية من الخلايا.
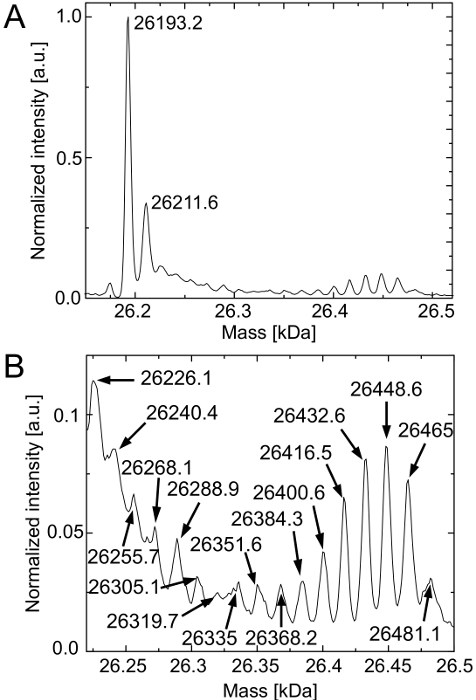
. الشكل 3. HPLC-ESI الطيفي كتلة جزيئات deGFP النقاء من رد فعل خالية من الخلايا التي تحتوي على HYL (أ) deGFP18Lys مواطن يتم الكشف الغالب (الجماهير المتوقع: مع fluorophore 26193 دا، دون fluorophore ناضجة 26213 دا). (B)التكبير يكشف وجود جميع أنواع deGFP الممكنة (deGFP18Hyl، deGFP17Hly + 1Lys، deGFP16Hyl + 2Lys، ...، deGFP1Hyl + 17Lys). الجماهير المتوقع هم 26193 دا + N س 16 دا (N = 1، ...، 18). وتطبيع الطيف لأعلى كثافة لها (التهم). يشار إلى مناصب الذروة في دا. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

التكميلي المواد 1. قالب حساب. وفي الباب 2، وإيراد أمثلة على إعداد مزيج الرئيسي عازلة الطاقة باستخدام مستخلص قسامات الخام من 30 ميكرولتر والأمثل Mg- وتركيزات K الغلوتامات من على التوالي 3 مم و 30 مم. هذا المثال يؤدي إلى وحدة تخزين مزيج الرئيسي يمكن أن ينتج 3 قسامات عازلة الطاقة. في ثانيةنشوئها 3، وإيراد أمثلة على إعداد رد فعل خالية من الخلايا باستخدام محلول 90 الاسهم الحمض النووي نانومتر مما يؤدي إلى تركيز ناقلات الحمض النووي الأمثل لل10 نانومتر في رد فعل خالية من الخلايا. يرجى النقر هنا لتحميل هذا الملف.
للحصول على التتبع المناسب، ومن الأمثلة على استخدام القالب حساب عن طريق إدخال هذه القيم النموذجية التي تختلف من المثال أعلاه: استخراج النفط الخام حجم: 28 ميكرولتر، مثلى المغنيسيوم، الغلوتامات: 2 مم، مثلى K-الغلوتامات: 40 مم، عدد من قسامات عازلة المطلوب: 100، الأمثل تركيز ناقلات في خالية من الخلايا رد فعل: 8 نانومتر، الحمض النووي الأسهم ناقلات الحل: 150 نانومتر.
أولا إدخال 28 ميكرولتر كما استخراج النفط الخام في حقل حجم البرتقال من قسم القالب الأول. ثم، أدخل إلى قسم القالب الثاني 2 مم لد 40 ملي بالشكل الأمثل Mg- وتركيزات-K الغلوتامات في حقول البرتقال. مع الأخذ بعين الاعتبار يحسب Mg- الأمثل وK-تركيزات، وتكوين منطقة عازلة الطاقة 15 ميكرولتر، فضلا عن المقابلة، الارتقاء قسامة 16 ميكرولتر. أدناه، وفقا لذلك إدخال 100 كما العدد المرغوب فيه من قسامات عازلة الطاقة (16 ميكرولتر). قالب يتكيف مجلدات من مكونات عازلة مختلفة لمزيج الرئيسي 1700 ميكرولتر على النحو التالي: 204 ميكرولتر من محلول المخزون 100 ملي المغنيسيوم الغلوتامات، 136 ميكرولتر من محلول المخزون 3 M K-الغلوتامات، 728.73 ميكرولتر من 14X حل الطاقة، 510 ميكرولتر 40٪ PEG-8000 و 121.27 ميكرولتر العقيمة ده 2 O. وأخيرا، في المقطع قالب الثالث، أدخل 8 نانومتر و 150 نانومتر كما تركيز ناقلات الأمثل في رد فعل خالية من الخلايا وعلى التوالي، ناقلات الحمض النووي تركيز الأسهم حل. قالب يتكيف على حجم المكونات المختلفة التي يجب أن تضاف إلى 28 ميكرولتر من استخراج النفط الخام إلى الانتهاء من إعداد 90 ميكرولتررد فعل خالية من الخلايا على النحو التالي: 15 ميكرولتر من العازلة الطاقة، و 15 ميكرولتر من أحد الحلول الأحماض الأمينية 3 املركبة بشكل مختلف، 4.80 ميكرولتر من حل ناقلات الحمض النووي (150 نيوتن متر)، و27.20 ميكرولتر من ده معقم 2 O.
تكميلية المادة 2. إلكتروني واحد تسلسل الأحماض الأمينية من البروتين نموذج deGFP. يحتوي هذا البروتين نموذج 6 الارجنتين و 18 مواقع اليس. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
تكميلية المادة 3. كامل طول والممرات هلام معدلة التي تتوافق مع الصور جل عرض الشكل 1 و 2. الممرات هلام المعروضة في كل الصورة الفردية يتم استخراج ubfigure من نفس هلام بولي أكريلاميد SDS. في الشكل 1 و 2 هذه الممرات وانضم معا لأغراض العرض. يشار إلى الأوزان الجزيئية للعصابات البروتين القياسية بجانب الأرقام. (A.1) الممرات هلام غير مقتطعة من الشكل 1A. من اليسار إلى اليمين: مستوى البروتين، رد فعل خالية من الخلايا إشارة، السيطرة السلبية وردود الفعل خالية من الخلايا توفير يمكن بدلا من الارجنتين. (A.2) الممرات هلام غير مقتطعة من الشكل 1B. من اليسار إلى اليمين: مستوى البروتين، deGFP تنقيته من رد الفعل إشارة، تنقية deGFP من رد الفعل هل يمكن تحتوي على. (B.1) الممرات هلام غير مقتطعة من الشكل 2A. من اليسار إلى اليمين: السيطرة على رد فعل خالية من الخلايا سلبي، رد فعل خالية من الخلايا التي تحتوي على HYL ومستوى البروتين. (B.2) الممرات هلام غير مقتطعة من الشكل 2B. من اليسار إلى اليمين: تنقية deGFP من HYL تحتوي على رد فعل ومستوى البروتين.د / 54273 / 54273supfig3large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
وسيلة سهلة لاستخدام نظام التعبير خالية من الخلايا باعتبارها استراتيجية قابلة للتطبيق لبقايا على وجه التحديد دمج نكس] إلى بروتينات، وتقدم. تحقيقا لهذه الغاية، وتستكمل استخراج النفط الخام مع الترميز ناقلات الحمض النووي للبروتين من الفائدة، وعازلة للطاقة والأحماض الأمينية المناظرة. لاحظ أن استخراج حجم قسامة الخام يعتمد على استخراج النفط الخام تركيز البروتين 34. تم تحسين كفاءة التعبير خالية من الخلايا تبعا لتركيز ناقلات بناء الحمض النووي. تختلف أحجام مكونات عازلة الطاقة وظيفة الأمثل Mg- وتركيزات K الغلوتامات من أجل تمكين عوائد عالية من البروتين نموذج أعرب خالية من الخلايا.
إجراء تقييم أولي للتجربة التأسيس ويمكن الحصول على أداء SDS-PAGE من خالية من الخلايا غير المكرر رد فعل المتوسطة. للاطلاع على تحليل أكثر تفصيلا، يقترح HPLC-ESI الطيفي الشامل باعتباره وسيلة للتحقق من اكتمال incor-بقايا محددةporation من الرابطة الوطنية لرياضة. تمهيدا لهذا الأخير، وتستخدم أنظمة عمود الدوران لتمكين تنقية صاحب العلامة والعازلة التبادل مع كميات صغيرة التي نستخدمها في هذا البروتوكول.
بما في ذلك HPLC-ESI الطيفي الشامل، بروتوكول بأكمله لا يمكن أن يؤديها في غضون 2 أيام. وهو لا يتضمن أي خطوات حاسمة بشكل خاص. ومع ذلك، أمثل تركيز Mg- وK-الغلوتامات وكذلك ناقلات الحمض النووي حاسمة من أجل التعبير عن عوائد عالية من البروتين نموذج. استخدام ناقلات التعبير كفاءة عالية pBEST-OR2-OR1 والعلاقات العامة-UTR1 gene_of_model_protein-T500 ينصح بشدة. شطف صاحب الموسومة البروتينات عادة ما يكون بسبب تركيز عال من ايميدازول (> 150 ملم) وغيرها من الأملاح مثل ناه 2 ص 4 (> 300 ملم) أو كلوريد الصوديوم (> 50 ملم) التي تولد الضوضاء في الخلفية عالية في التحليل الطيفي الشامل 49 . تبادل هذه المخازن شطف مع العازلة تخزين البروتين مناسبة استقرار المتواجد نموذجفي وجذريا يقلل من الضوضاء الخلفية خلال التحليل الطيفي الشامل.
ونتيجة لذلك يمكن، يحل محل الارجنتين في جميع المراكز الستة داخل البروتين نموذج. في نظام التعبير، ويمكن الكشف عن أي بقايا الارجنتين. هذا يبسط إدماج فضلات محددة النظير الارجنتين بالمقارنة مع أنظمة التعبير الأخرى التي تحتاج إلى مزيد من الاستراتيجيات نضوب 29،30. النهج خالية من الخلايا عرض تلتف القيود المتأصلة في الجسم الحي الأساليب التي من المقرر أن هل يمكن سمية، أو الاعتماد القوي على تسلسل مرنا في استراتيجيات الإنتاج بروتين واحد 24،31. وعلى عكس العاملين في نظام المختبر، في الجسم الحي انشقاق في وسعها لhomoserine وhydroxyguanidine لا تحدث 31.
ومع ذلك، فإن نظام خالية من الخلايا يحتفظ كمية كافية من ليز للتنافس مع النظير مثل HYL. ويظهر التحليل HPLC-ESI الطيفية كتلة أن البروتين نموذج يحتوي على كل، جanonical فضلا عن التناظرية noncanonical بنسب مختلفة. إدماج فضلات معينة من اليس من الممكن بشكل عام، ولكن لاستبدال كامل، استراتيجيات أخرى نضوب، أو AARS المصممة خصيصا والحمض الريبي النووي النقال الأمثل للاعتراف نكس] تحتاج إلى تطوير.
حققنا عوائد ممتازة للأعرب والبروتينات تعديل نموذج خالية من الخلايا عن طريق إضافة NCAA في نفس التركيز مثل تلك الكنسي. كفاءة التأسيس تعتمد على طبيعة الرابطة الوطنية لرياضة لإدراجها. بل قد يكون زيادة الغلة لا يزال قابلا للتحقيق عن طريق تحسين تركيز NCAA.
توضح النتائج المعروضة في تطبيق النظام المستخدم لدمج-بقايا محددة من نكس] طالما يتم قبولها من قبل النظام متعدية الذاتية الكنسي. لدمج-بقايا محددة من نكس] محددة، يحتاج المرء أخرى لمعرفة ما اذا كان بقايا من distur الجهاز المركزي للمحاسبات مماثلب نظام التعبير.
أنظمة النسخ الترجمة خالية من الخلايا يمكن هندستها من الكائنات الحية المختلفة للاستجابة لمطالب مختلفة 54. في كل E. القولونية الأجهزة النسخ الترجمة من نظام خالية من الخلايا يعرض هنا تمكن من استخدام الجراثيم و E. المروجين القولونية، وأنها يمكن أن تعمل بالتوازي أو بالتتابع في شلالات 55. انطباق العام وسهولة الاستخدام جعل طريقة أداة قوية لمزيد من البحث في سمية الأحماض الأمينية وتطبيق العلاجي.
Disclosures
The authors have nothing to disclose.
Acknowledgements
E.G. Worst and A. Ott acknowledge financial support by the Deutsche Forschungsgemeinschaft (DFG) within the collaborative research center SFB 1027 as well as Saarland University. E.G. Worst, A. Ott and V. Noireaux further acknowledge financial aid by the Human Frontiers Science Program Organization (HFSPO). The authors thank Tobias Baumann and Stefan Oehm (Institute of Chemistry, Technische Universität Berlin) for critical reading.
Materials
| Name | Company | Catalog Number | Comments |
| Protective eyewear | Sigma-Aldrich, St. Louis, USA | Z758841 | |
| Nitrile gloves (size S) | Sigma-Aldrich, St. Louis, USA | Z768960 | Catalog numbers other sizes: Z768979 for M, Z768987 for L and Z768995 for XL |
| Eppendorf Safe-Lock Tube 1.5 ml (PCR clean) | Eppendorf, Hamburg, Germany | 30123.328 | |
| Microbalance Discovery DV114CM | Ohaus, Greifensee, Switzerland | 80104140 | |
| Microspatula (L 6 5/8 in., stainless steel, rod diam. 0.09 in.) | Sigma-Aldrich, St. Louis, USA | Z243213 | |
| L-Canavanine | Sigma-Aldrich, St. Louis, USA | C9758 | Acute toxicity: wear eyeshields, dust mask, protective gloves |
| Hydroxylysine (racemic mixture) | Sigma-Aldrich, St. Louis, USA | H0377 | |
| Cryo-gloves (size S, water resistent) | Sigma-Aldrich, St. Louis, USA | Z183490 | Catalog numbers other sizes: Z183512 for M, Z183520 for L and Z183539 for XL |
| RTS Amino Acid Sampler | Biotechrabbit, Hennigsdorf, Germany | BR1401801 | For homemade preparation of amino acid stock solutions, follow this protocol35 and use the solid amino acid kit LAA21-1KT, L-proline (81709-25G), L-cysteine (30089-25G), L-histidine (53319-25G) and L-lysine (L5501-5G) (all from Sigma-Aldrich, St. Louis, USA) |
| HEPES | Sigma-Aldrich, St. Louis, USA | H6147 | |
| ATP | Sigma-Aldrich, St. Louis, USA | A8937 | |
| CTP | Affymetrix, Santa Clara, USA | 14121 | |
| GTP | Affymetrix, Santa Clara, USA | 16800 | |
| UTP | Affymetrix, Santa Clara, USA | 23160 | |
| tRNA (from E. coli, pack size 100 mg) | Sigma-Aldrich, St. Louis, USA | 10109541001 | Catalog number for pack size of 500 mg is 10109550001 |
| CoA | Sigma-Aldrich, St. Louis, USA | C4282 | |
| NAD (from yeast ) | Sigma-Aldrich, St. Louis, USA | N6522 | |
| cAMP | Sigma-Aldrich, St. Louis, USA | A9501 | |
| Folinic acid | Sigma-Aldrich, St. Louis, USA | F7878 | |
| 3-PGA | Sigma-Aldrich, St. Louis, USA | P8877 | |
| Mg-glutamate | Sigma-Aldrich, St. Louis, USA | 49605 | |
| K-glutamate | Sigma-Aldrich, St. Louis, USA | G1149 | |
| pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 | Addgene, Cambridge, USA | Plasmid #40019 | |
| 4-20% precast Tris-Glycine Gels (10 cm x 10 cm x 1 mm, 10 courses) | Anamed Elektrophorese, Groß-Bieberau / Rodau, Germany | TG 81610 | |
| SDS running buffer (10 x concentrate, 5,000 ml) | Anamed Elektrophorese, Groß-Bieberau / Rodau, Germany | TG 50001 | |
| SDS loading buffer (2 x concentrate, 50 ml) | Anamed Elektrophorese, Groß-Bieberau / Rodau, Germany | TG 05002 | |
| Unstained protein marker, broad range (2-212 kDa) | New England Biolabs, Ipswich, USA | P7702S | |
| Methanol | Merck, Darmstadt, Germany | 1060091011 | Toxic by inhalation, in contact with skin and if swallowed: wear protective gloves and work under fume hood |
| Acetic acid (99.8%) | VWR International, Darmstadt, Germany | 20104.447 | |
| Coomassie Blue G-250 (10 g) | Biozym Scientific, Hessisch Oldendorf, Germany | 902120 | |
| His-Spin Protein Miniprep kit | Zymo Research Europe, Freiburg, Germany | P2002 | Product also distributed by Zymo Research Corporation, Irvine, USA |
| Trizma Base | Sigma-Aldrich, St. Louis, USA | T1503 | |
| Hydrochloric acid | Sigma-Aldrich, St. Louis, USA | H1758 | |
| Glycerol, 99% | VWR International, Darmstadt, Germany | 24397.296DB | |
| CentriPure Z25 mini spin columns | Genaxxon bioscience, Ulm, Germany | CP-0205-Z100 | |
| Sodium chloride | Sigma-Aldrich, St. Louis, USA | S9888 | |
| Concentrator 5301 | Eppendorf, Hamburg, Germany | 5301 000.210 | |
| 2xYT | MP biomedicals, Santa Ana, USA | 113012032 | |
| Bacto-Agar | BD Diagnostics, Franklin Lakes, USA | 214010 | |
| Bead-beating tubes (polypropylene microvials) | Biospec, Bartlesville, USA | 522S | |
| Beads, 0.1 mm dia. | Biospec, Bartlesville, USA | 11079101 | |
| BL21 Rosetta 2 E. coli strain | Merck, Darmstadt, Germany | 71402 | |
| Bradford BSA protein assay Kit | Bio-Rad, München, Germany | 500-0201 | |
| Chloramphenicol | Sigma-Aldrich, St. Louis, USA | C1919 | |
| Cuvettes, 1.5 ml | Thermo Fisher Scientific, Waltham, USA | 14-955-127 | |
| DTT | Sigma-Aldrich, St. Louis, USA | D0632 | |
| Micro Bio-Spin Chromatography Columns | Bio-Rad, München, Germany | 732-6204 | |
| Nunc 384-well optical bottom plates | Thermo Fisher Scientific, Waltham, USA | 142761 | |
| Nunc sealing tape | Thermo Fisher Scientific, Waltham, USA | 232701 | |
| PEG-8000 | Promega, Madison, USA | V3011 | |
| Potassium phosphate dibasic solution | Sigma-Aldrich, St. Louis, USA | P8584 | |
| Potassium phosphate monobasic solution | Sigma-Aldrich, St. Louis, USA | P8709 | |
| Slide-A-Lyzer dialysis cassettes, 10k MWCO (Kit) | Thermo Fisher Scientific, Waltham, USA | 66382 | |
| Spermidine | Sigma-Aldrich, St. Louis, USA | 85558 | |
| 1 L centrifuge bottle | Beckman-Coulter, Brea, USA | A98813 | |
| 4 L Erlenmeyer flask | Kimble Chase, Vineland (NJ), USA | 26500-4000 | |
| Avanti J-26XP centrifuge | Beckman-Coulter, Brea, USA | 393127 | Or equivalent centrifuge able to centrifuge 1 L bottles. |
| Forma 480 orbital shaker | Thermo Fisher Scientific, Waltham, USA | 480 | Or equivalent shaker able to shake chest-size 6 x 4 L . |
| JLA-8.1000 rotor | Beckman-Coulter, Brea, USA | 363688 | Or equivalent 5,000 x g rotor for the centrifuge above, able to centrifuge 1 L bottles. |
| Mini-Beadbeater-1 | Biospec, Bartlesville, USA | 3110BX | |
| Microfuge 22R refrigerated microcentrifuge | Beckman-Coulter, Brea, USA | 368831 | Or equivalent centrifuge able to centrifuge 2 ml reaction tubes. |
| Heating block HLC HBT 130 | Labexchange, Burladingen, Germany | 24465 | Or equivalent heating block able to heat samples in reaction tubes up to 100 °C. |
| Eppendorf MiniSpin centrifuge | Eppendorf, Hamburg, Germany | 5452000018 | Or equivalent centrifuge able to centrifuge 2 ml reaction tubes. |
| IKA Vortex 3 (4 mm orbital shaker diameter, 0 - 2,500 rpm) | Sigma-Aldrich, St. Louis, USA | Z654760 | Or equivalent vortex. |
| Scotsman AF103 ice flaker machine | Kälte-Berlin, Berlin, Germany | AF103 | Or equivalent ice flaker machine. |
| MyTemp mini digital incubator | Sigma-Aldrich, St. Louis, USA | Z763314 | Or equivalent incubator able to heat samples at 29 °C. |
| EcoCell electrophoresis cell / chamber | Anamed Elektrophorese, Groß-Bieberau / Rodau, Germany | AN12005 | Or equivalent electrophoresis chamber able to perform vertical gel electrophoresis with the above precast gels or other gels used. |
| Power-phor power supply for electrophoresis cell / chamber | Anamed Elektrophorese, Groß-Bieberau / Rodau, Germany | AN12001 | Or equivalent power supply able to supply above used electrophoresis cell / chamber with power |
| VWR Signature Ergonomic High Performance Single-Channel Variable Volume Pipettors Starter Kit 1 | VWR International, Darmstadt, Germany | 613-5278 | Or equivalent micropipettes enabling to pipette similar volumes with the same precision |
| VWR Signature Ergonomic High Performance Single-Channel Variable Volume Pipettors Starter Kit 2 | VWR International, Darmstadt, Germany | 613-5279 | Or equivalent micropipettes enabling to pipette similar volumes with the same precision |
| Pipetman Tips Diamond D10ST (0.1 - 10 µl) | Gilson, Middleton, USA | F171101 | Or equivalent low-binding pipette tips enabling to pipette similar volumes with the same precision |
| Pipetman Tips Diamond D200ST (2 - 200 µl) | Gilson, Middleton, USA | F171301 | Or equivalent low-binding pipette tips enabling to pipette similar volumes with the same precision |
| Pipetman Tips Diamond D1000ST (100 - 1,000 µl) | Gilson, Middleton, USA | F171501 | Or equivalent low-binding pipette tips enabling to pipette similar volumes with the same precision |
| 50 ml centrifuge tubes with screw caps (sterile) | VWR International, Darmstadt, Germany | 50-0156 | |
| 15 ml centrifuge tubes with screw caps (sterile) | VWR International, Darmstadt, Germany | 525-0150 | |
| 14 ml polypropylene tubes (round bottom, two-position vent stopper, sterile) | Greiner Bio-One, Frickenhausen, Germany | 187262 | |
| Discovery BIO Wide Pore C5 HPLC Column (3 µm particle size, L x I.D. 10 cm x 2.1 mm) | Sigma-Aldrich, St. Louis, USA | 567227-U | |
| Agilent 1260 HPLC machine | Agilent Technologies, Santa Clara, USA | G1312B | |
| 6500 Series Accurate-Mass Quadrupole Time-of-Flight (Q-TOF) LC/MS | Agilent Technologies, Santa Clara, USA | G6530BA | |
| Acetonitrile | Sigma-Aldrich, St. Louis, USA | 270717 | |
| FLUOstar Omega microplate reader | BMG Labtech, Ortenberg, Germany | 415-101 | Or equivalent microplate reader able to measure the fluorescence of the expressed model protein |
| Hanna Checker pH meter | Sigma-Aldrich, St. Louis, USA | Z351091 | |
| Formic acid eluent additive for LC-MS | Sigma-Aldrich, St. Louis, USA | 56302 |
References
- Böck, A., et al. Selenocysteine: the 21st amino acid. Mol. Microbiol. 5 (3), 515-520 (1991).
- Srinivasan, G., James, C. M., Krzycki, J. A. Pyrrolysine Encoded by UAG in Archaea: Charging of a UAG-Decoding Specialized tRNA. Science. 296 (5572), 1459-1462 (2002).
- Budisa, N. Prolegomena to Future Experimental Efforts on Genetic Code Engineering by Expanding Its Amino Acid Repertoire. Angew. Chem. Int. Ed. Engl. 43, 6426-6463 (2004).
- Wang, L., Xie, J., Schultz, P. G. Expanding the Genetic Code. Annu. Rev. Biophys. Biomol. Struct. 35, 225-249 (2006).
- Chin, J. W. Expanding and Reprogramming the Genetic Code of Cells and Animals. Annu. Rev. Biochem. 83, 379-408 (2014).
- Neumann, H. Rewiring translation - Genetic code expansion and its applications. FEBS Lett. 586 (15), 2057-2064 (2012).
- Liu, C. C., Schultz, P. G. Adding New Chemistries to the Genetic Code. Annu. Rev. Biochem. 79, 413-444 (2010).
- Goerke, A. R., Swartz, J. R. High-Level Cell-Free Synthesis Yields of Proteins Containing Site-Specific Non-Natural Amino Acids. Biotechnol. Bioeng. 102 (2), 400-416 (2009).
- Albayrak, C., Swartz, J. R. Cell-free co-production of an orthogonal transfer RNA activates efficient site-specific non-natural amino acid incorporation. Nucleic Acids Res. 41 (11), 5949-5963 (2013).
- Johnson, J. A., Lu, Y. Y., Van Deventer, J. A., Tirrell, D. A. Residue-specific incorporation of non-canonical amino acids into proteins: recent developments and applications. Curr. Opin. Chem. Biol. 14 (6), 774-780 (2010).
- Xiu, X., Puskar, N. L., Shanata, J. A. P., Lester, H. A., Dougherty, D. A. Nicotine binding to brain receptors requires a strong cation-pi interaction. Nature. 458 (7237), 534-537 (2009).
- Grünewald, J., et al. Mechanistic studies of the immunochemical termination of self-tolerance with unnatural amino acids. Proc. Natl. Acad. Sci. USA. 106 (11), 4337-4342 (2009).
- Nikić, I., Lemke, E. A. Genetic code expansion enabled site-specific dual-color protein labeling: superresolution microscopy and beyond. Curr. Opin. Chem. Bio. 28, 164-173 (2015).
- Munier, R., Cohen, G. N. Incorporation d'analogues structuraux d'aminoacides dans les protéines bactériennes. Biochim. Biophys. Acta. 21 (3), 592-593 (1956).
- Lepthien, S., Merkel, L., Budisa, N. In Vivo Double and Triple Labeling of Proteins Using Synthetic Amino Acids. Angew. Chem. Int. Ed. 49 (32), 5446-5450 (2010).
- Dieterich, D. C., Link, A. J., Graumann, J., Tirrell, D. A., Schuman, E. M. Selective identification of newly synthesized proteins in mammalian cells using bioorthogonal noncanonical amino acid tagging (BONCAT). Proc. Natl. Acad. Sci. USA. 103 (25), 9482-9487 (2006).
- Dieterich, D. C., et al. In situ visualization and dynamics of newly synthesized proteins in rat hippocampal neurons. Nat. Neurosci. 13 (7), 897-905 (2011).
- Hendrickson, W. A., Horton, J. R., LeMaster, D. M. Selenomethionyl proteins produced for analysis by multiwavelength anomalous diffraction (MAD): a vehicle for direct determination of three-dimensional structure. EMBO J. 9 (5), 1665-1672 (1990).
- Hoesl, M. G., et al. Lipase Congeners Designed by Genetic Code Engineering. ChemCatChem. 3 (1), 213-221 (2011).
- Bae, J. H., et al. Expansion of the Genetic Code Enables Design of a Novel "Gold" Class of Green Fluorescent Proteins. J. Mol. Biol. 328 (5), 1071-1081 (2003).
- Schachtele, C. F., Rogers, P. Canavanine death in Escherichia coli. J. Mol. Biol. 14 (2), 474-489 (1965).
- Rosenthal, G. A. The biological effects and mode of action of L-canavanine, a structural analogue of L-arginine. Q. Rev. Biol. 52 (2), 155-178 (1977).
- Rosenthal, G. A., Dahlman, D. L. Incorporation of L-Canavanine into Proteins and the Expression of Its Antimetabolic Effects. J. Agric. Food Chem. 39 (5), 987-990 (1991).
- Ishida, Y., Park, J. H., Mao, L., Yamaguchi, Y., Inouye, M. Replacement of All Arginine Residues with Canavanine in MazF-bs mRNA Interferase Changes Its Specificity. J. Biol. Chem. 288 (11), 7564-7571 (2013).
- Thomas, D. A., Rosenthal, G. A., Gold, D. V., Dickey, K. Growth Inhibition of a Rat Colon Tumor by L-Canavanine. Cancer Res. 46 (6), 2898-2903 (1986).
- Bence, A. K., Worthen, D. R., Adams, V. R., Crooks, P. A. The antiproliferative and immunotoxic effects of L-canavanine and L-canaline. Anticancer Drugs. 13 (3), 313-320 (2002).
- Bence, A. K., Crooks, P. A. The Mechanism of L-Canavanine Cytotoxicity: Arginyl tRNA Synthetase as a Novel Target for Anticancer Drug Discovery. J. Enzyme Inhib. Med. Chem. 18 (5), 383-394 (2003).
- Akaogi, J., et al. Role of non-protein amino acid L-canavanine in autoimmunity. Autoimmun. Rev. 5 (6), 429-435 (2006).
- Singh-Blom, A., Hughes, R. A., Ellington, A. D. An amino acid depleted cell-free protein synthesis system for the incorporation of non-canonical amino acid analogs into proteins. J. Biotechnol. 178, 12-22 (2014).
- Oh, S. -. J., Lee, K. -. H., Kim, H. -. C., Catherine, C., Yun, H., Kim, D. -. M. Translational Incorporation of Multiple Unnatural Amino Acids in a Cell-free Protein Synthesis System. Bioprocess. Eng. 19 (3), 426-432 (2014).
- Worst, E. G., Exner, M. P., De Simone, A., Schenkelberger, M., Noireaux, V., Budisa, N., Ott, A. Cell-free expression with the toxic amino acid canavanine. Bioorg. Med. Chem. Lett. 25 (17), 3658-3660 (2015).
- Shin, J., Noireaux, V. Efficient cell-free expression with the endogenous E. Coli RNA polymerase and sigma factor 70. J. Biol. Eng. 4 (8), (2010).
- Chemla, Y., Ozer, E., Schlesinger, O., Noireaux, V., Alfonta, L. Genetically expanded cell-free protein synthesis using endogenous pyrrolysyl orthogonal translation system. Biotechnol. Bioeng. 112 (8), 1663-1672 (2015).
- Sun, Z. Z., Hayes, C. A., Shin, J., Caschera, F., Murray, R. M., Noireaux, V. Protocols for Implementing an Escherichia coli Based TX-TL Cell-Free Expression System for Synthetic Biology. J. Vis. Exp. (79), e50762 (2013).
- Caschera, F., Noireaux, V. Preparation of amino acid mixtures for cell-free expression systems. Biotechniques. 58 (1), 40-43 (2015).
- Green, M. R., Sambrook, J. . Molecular Cloning: A Laboratory Manual. , (2012).
- Froger, A., Hall, J. E. Transformation of Plasmid DNA into E. coli Using the Heat Shock Method. J. Vis. Exp. (6), e253 (2007).
- Zhang, S., Cahalan, M. D. Purifying Plasmid DNA from Bacterial Colonies Using the Qiagen Miniprep Kit. J. Vis. Exp. (6), e247 (2007).
- Moreno, L. A., Cox, K. L. Quantification of dsDNA using the Hitachi F-7000 Fluorescence Spectrophotometer and PicoGreen Dye. J. Vis. Exp. (45), e2465 (2010).
- Desjardins, P., Conklin, D. NanoDrop Microvolume Quantitation of Nucleic Acids. J. Vis. Exp. (45), e2699 (2010).
- Sukumaran, S. Concentration Determination of Nucleic Acids and Proteins Using the Micro-volume Bio-spec Nano Spectrophotometer. J. Vis. Exp. (48), e2699 (2011).
- Laemmli, U. K. Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Hochuli, E., Bannwarth, W., Döbeli, H., Gentz, R., Stüber, D. Genetic Approach to Facilitate Purification of Recombinant Proteins with a Novel Metal Chelate Adsorbent. Nature Biotechnology. 6 (11), 1321-1325 (1988).
- Schägger, H., Aquila, H., Von Jagow, G. Coomassie blue-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for direct visualization of polypeptides during electrophoresis. Anal. Biochem. 173 (1), 201-205 (1988).
- Bradford, M. M. A Rapid Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding. Anal Biochem. 72, 248-254 (1976).
- Ernst, O., Zor, T. Linearization of the Bradford Protein Assay. J. Vis. Exp. (38), e1918 (2010).
- Banerjee, S., Mazumdar, S. Electrospray Ionization Mass Spectrometry: A Technique to Access the Information beyond the Molecular Weight of the Analyte. Int. J. Anal. Chem. 2012, 1-40 (2012).
- Fujiwara, K., Nomura, S. M. Condensation of an additive-free cell extract to mimic the conditions of live cells. PLoS One. 8 (1), e54155 (2013).
- Zhang, Z., Marshall, A. G. A universal algorithm for fast and automated charge state deconvolution of electrospray mass-to-charge ratio spectra. J. Am. Soc. Mass. Spectrom. 9 (3), 225-233 (1998).
- Li, X., Zhang, G., Ngo, N., Zhao, X., Kain, S. R., Huang, C. C. Deletions of the Aequorea victoria Green Fluorescent Protein Define the Minimal Domain Required for Fluorescence. J. Biol. Chem. 272 (45), 28545-28549 (1997).
- Gagoski, D., Polinkovsky, M. E., Mureev, S., Kunert, A., Johnston, W., Gambin, Y., Alexandrov, K. Performance benchmarking of four cell-free protein expression systems. Biotechnol. Bioeng. 113 (2), 292-300 (2016).
- Shin, J., Noireaux, V. An E. coli Cell-Free Expression Toolbox: Application to Synthetic Gene Circuits and Artificial Cells. ACS Synth. Biol. 1 (1), 29-41 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved