Method Article
使用モデルタンパク質への非標準アミノ酸の残基特異的取り込み
要約
An easy-to-use, cell-free expression protocol for the residue-specific incorporation of noncanonical amino acid analogs into proteins, including downstream analysis, is presented for medical, pharmaceutic, structural and functional studies.
要約
アミノ酸の標準セットは、タンパク質機能の非常に広い範囲につながります。それにもかかわらず、残基のセットは、まだ潜在的なタンパク質の用途に制限を課しています。非標準アミノ酸の組み込みは、この範囲を拡大することができます。非標準アミノ酸の組込みのための2つの相補的アプローチがあります。部位特異的組み込みのために、内因性の標準的な翻訳機械に加えて、直交アミノアシルtRNAシンテターゼ-tRNAのペアは正規のものと相互作用しないように提供されなければなりません。したがって、標準的なアミノ酸、通常は終止コドンに割り当てられていないコドンは、また、必要とされます。この遺伝コードの拡張は、タンパク質内の単一の、所与の部位での非標準アミノ酸の取り込みを可能にします。ここで紹介する作品は、遺伝コードは、内因性翻訳システム内で再割り当てされ残基特異的取り込みを説明します。翻訳機械Aすなわち正準規定の場所でそれを組み込むための代理として非標準アミノ酸をccepts、タンパク質中の標準的なアミノ酸のすべてのオカレンスは、非標準1で置き換えられます。非標準アミノ酸の組み込みは、かなり変更された物理的および化学的特性を引き起こし、タンパク質の構造を変更することができます。それらは内因性タンパク質を修飾するため、非標準アミノ酸類似体は、多くの場合、 生体内のタンパク質産生を制限する、発現宿主のための細胞増殖抑制剤として作用する。タンパク質への毒性非標準アミノ酸のin vivo組込みは特に困難なままです。ここでは、非標準アミノ酸L-カナバニンによるL-アルギニンの完全な交換のための無細胞アプローチが提示されています。これは、in vivo発現の固有の困難を回避します。また、マススペクトル分析のための標的タンパク質を調製するためのプロトコルが含まれています。 L-リジン、L-ヒドロキシリジンで置き換えることができることが示されています低い効率ではあるが。原則的に、任意の非標準アミノ酸類似体であれば、内因性のインビトロ翻訳システムがそれを認識するように提示された方法を用いて組み込むことができます。
概要
遺伝コードは、生物圏に普遍的です。その時々セレノシステイン1またはピロリジン2によって拡張される20正規アミノ酸のセットをコードします。それは、タンパク質に折り畳まれるアミノ酸のチェーンへのtRNAの助けを借りて、遺伝コードを変換するリボソームです。標準的なアミノ酸の官能基は、翻訳後修飾と組み合わせて、タンパク質機能3,4の非常に広い範囲に寄与する。原理的には、標準的なによるアミノ酸の限定されたセットに機能的な制限は、さらに新たな化学および新しい機能3,4を可能にする非標準アミノ酸(ncAAs)を組み込むことによって克服することができます。
部位特異的または残基特異的組み込み:ncAAsの取り込みのための2つの相補的なアプローチがあります。前者の方法は、アミノアシルtRNAシンセのカノニカル集合ので、かなりの技術的な困難を伴いますetases酵素(aaRS)とtRNAが内在性翻訳機構と相互作用してはならない直交のaaRS-tRNAのペアによって拡張されなければなりません。慎重な工学に基づいた、このアプローチは、所望のタンパク質部位での単一点突然変異としてncAAsを内蔵しています。 ncAAsの部位特異的組み込みを遺伝子操作して、標準的なアミノ酸(CAA)、5-9コドン通常停止に割り当てられていないコドンによってコードされています。このメソッドは、指定されたサイトではなく、全体タンパク質10-13全体の機能の変化を伴います。
これとは対照的に、残基特異的組み込みは、標準的な翻訳機構によって非標準アミノ酸の誤認識に依存しています。混入が原因のaaRSの基質特異性の欠如が原因で発生します。コーエンと同僚14のワーク上に構築されたncAAsの残基特異的組込みは、それらの中で重要なアプリケーション3,10、タンパク質のバイオ直交ラベリング15-17につながっていますX線結晶18中のタンパク質のまたは構造解明。
天然のaaRSは、一般的に同形NCAA上で、それらの同族アミノ酸を好むように、 生体内残留物特異的組み込みで効率的には、通常、NCAAの標準的なアナログを合成することができない栄養要求性発現宿主を必要とします。宿主細胞は、類似CAAのみ低濃度を実現し、増殖培地中で培養されます。 NCAAでの連続補充と組み合わせて、その枯渇は、複数の正準規定の部位でのモデルタンパク質にNCAAを組み込むために発現宿主を強制します。部位特異的なアプローチとは対照的に、これは、一般にかなりタンパク質19,20の物理的および化学的性質を改変するためにつながる、タンパク質全体の構造に深い影響を与えます。それらは、他の多くのPROTに組み込まれているしかし、ncAAsのほとんどは、発現宿主3の成長阻害剤であります組換え遺伝子発現の間の関心のもの以外にもアインス。これは明らかに、in vivoでのアプローチを制限します。毒性であるか、またはタンパク質の構造に強い影響を有するアミノ酸のin vivo組込みは、特に困難なままです。しかし、これらの分子は、異常な機能を有するタンパク質を設計するために最も有望なの一つです。
一つの例は、毒性、非標準、天然に存在するL-カナバニン(CAN)、L-アルギニン(アルギニン)のアナログです。これは、影響し、ブロックのArg関連する規制や触媒反応経路を、そして生きた細胞中のその存在は即死3,21-23につながることができます。アルギニンの位置で、タンパク質への取り込みは、タンパク質の安定性21-23を低減することができます。得られた毒性、 大腸菌 (E. coli)および他の一般的な発現宿主中のタンパク質を含むカナバニンの発現が課題です。これらの理由から、完全なin vivoでの私すべてのArg位置で缶のncorporation適宜詳述単一タンパク質産生系を使用して、一度だけ24が確認されました。しかし、缶は、抗癌剤25-27として提案し、ヒト28における自己免疫疾患のための刺激としてれています。さらに、それは、その抗代謝、抗菌、抗真菌および抗ウイルス特性に関する種々の研究25の対象です。これらの特性は、効率的かつ簡単に行う表現する方法は、薬用医療・機能研究のためのタンパク質を含むことができますの需要を高めます。
インビボでの生産に接続されている多くの問題は、無細胞発現系を用いて回避することができるが、 インビトロでの残基特異的なアプローチは、不十分に検討されています。 L-トリプトファンアナログ29と複数のncAAs 30の無細胞残基特異的組み込みが報告されています。これらのメソッドは非常にefficに基づいていますT7 RNAポリメラーゼをient。 T7 RNAポリメラーゼは、それによって内因性の転写と比較して遺伝子の機能を低下させる、バクテリオファージのような転写を伴います。
すべてのArg位置でのモデルタンパク質への缶の完全な残基特異的組み込みは、最近、無細胞発現系32を使用して、31を報告しました。同じシステムのわずかな変更は、終止コドン抑制33を介してモデルタンパク質に異なるピロリジン類似体の部位特異的組み込みを可能にしました。採用無細胞系31から33 は、すべての E.に基づいています大腸菌転写-翻訳システム。オリジナルの転写-翻訳モジュールの多くを保持しながら、 - (組換えタンパク質の1mg / mlの0.5)32にもかかわらず、それは、効率的に、現在のバクテリオファージシステムのようなタンパク質の発現を可能にします。
この作業では、詳細なプロトコルがどのように残油に設けられています。ncAAsのUE固有の取り込みは、このすべてのEを使用して、実現することができます大腸菌無細胞系32。さらに、HPLC-ESI質量分析を介した適正な評価のために発現されたタンパク質を調製するためのさらなるステップが提案されています。この無細胞系の特性を展開するには、この作業は缶31の公開取り込みを参照してくださいだけでなく、非標準L-リジンアナログL-ヒドロキシリジンに関連する新たなデータを提供しません。
ncAAsの残基特異的組み込みのための以下のプロトコルは、最近Joveの34で発表されたプロトコルの適応です。後者のプロトコルは、標準アミノ酸で高効率な無細胞発現を実行する方法について説明します。また、粗無細胞抽出物、アミノ酸溶液、エネルギー原液と、このアプローチで使用されるエネルギーバッファの準備を示します。以下のプロトコルは、前のPと比較して変更されたステップに焦点を当てncAAsの残基特異的取り込みを可能にするためにrotocol。較正されたピペット、低結合ピペットチップおよびマイクロ遠心管を調製するために推奨されています。以下では、アミノ酸のIUPACの略語が使用されます。
プロトコル
注意!使用する前に、関連するすべての物質安全データシート(MSDS)を参照してください。使用される化学物質のいくつかは急性毒性があります。個人用保護が要求される機器だけでなく、ドラフト内で作業(アイシールド、防塵マスク、手袋、白衣、完全長ズボンは、靴のつま先を閉じました)。
1.アミノ酸溶液の調製
- NCAAのストック溶液調製(168ミリモル)
注:NCAAのストック溶液の調製は、例として、アルギニンアナログ缶に記載されています。したがって、他のncAAsの値を適応させます。- 天秤の上に1.5ミリリットルの反応管を配置します。 168 mMの溶液1mlを調製するための反応管の内側缶の46.1ミリグラムを秤量します。滅菌ミクロを使用してください。 NCAAのラセミ混合物のために、ストック溶液の濃度を倍増。
- 無菌のddH 2 Oの977μLを加えます徹底的に渦缶iがあるまでnは完全に溶解しました。
注:1ミリリットルの総溶液容量に関しては、溶解したアミノ酸の物理ボリュームが補償されなければなりません。アミノ酸のいずれかの場合は、マイクロリットルの対応する体積増加などmgの中の固体の質量の推定半分35(100 mgの固体は、溶液中の50μlの容量がかかります)。ほとんどのアミノ酸は、この濃度で溶解させることができます。ない場合は、完全に溶解するまで濃度を低下させます。 - 直接液体窒素中でそれを凍結し、-20℃で保存し、1.2節またはフラッシュ中のアミノ酸溶液の調製のためのNCAAの原液を使用しています。 注意!安全のため、液体から保護するアイシールドとクライオ手袋を着用窒素飛沫。
- アミノ酸溶液の調製
注:アミノ酸溶液の調製は、別々の在庫20 CAASのL異性体を提供するアミノ酸サンプラーを使用するためL-ロイシン(140 mM)のを除き、168 mMの濃度で、各(HEPES / KOH、<0.1%のNaN 3、pH7.5で緩衝さ1.5ミリリットル、)ソリューション、。これらのストック溶液(KOHで緩衝)の自家製の調製のために、このプロトコル35に従ってください。- 20 CAAS(アミノ酸サンプラーまたは35に従って調製)の、RTでNCAA(セクション1.1で調製した)のストック溶液を解凍します。
- 解凍後、頻繁に任意の沈殿したアミノ酸を再溶解するためにストック溶液をボルテックス。いくつかのアミノ酸は溶解が困難であるため、完全に溶解するまで37℃の加熱ブロックでそれらをインキュベートします。 Cysが完全に溶解しない場合があります。沈殿を避けるために、室温でこれらを維持 - のAsn、PheおよびCysから除いて、氷の上のすべてのアミノ酸を置きます。
- 完全なキットの7分の1を使用するには、次の値を使用します。
注:小さいボリュームで動作するようにし、さらなる実験のためのキットのパーツを保存するために適切にスケール・ダウン。 incorporatのためにスケールアップ大規模モデルタンパク質へのncAAsのイオン。アミノ酸の安定性が低下する可能性があり、頻繁融解を防止するために、200μLのボリュームに個々のアミノ酸ストック溶液をアリコート。この200μlのアリコート量やピペッティングによる損失について、ステップ1.2.4.1アカウントで使用されるアリコートボリューム。 - まず、3異なる構成アミノ酸溶液( - 1.2.7セクション1.2.5)の製造を完成させるためにステップ1.2.4.3に分割されたアミノ酸マスターミックス溶液を調製。これらの解決策では、レイ(5ミリモル)を除いて、6 mmにすべてのアミノ酸を濃縮します。
- 15ミリリットルの遠心分離管に無菌のddH 2 Oの1.4ミリリットルを転送します。氷の上に置きます。各アミノ酸原液175μlのを追加します。 NCAA( 例えば、缶)によって置換されるCAA( 例えば 、アルギニン) の原液を除いて 、次々に追加します。徹底的に各添加後ボルテックスし、氷上に戻って解決策を置きます。
注意:レイは、他のアミノ酸のための6mMのに比べ、3異なる合成アミノ酸溶液が5mmです。減少した濃度は、発現効率を低下させません。 6 mmまでスケールアップすることは同様に適切です。 - アラ、アルギニン、アスパラギン、Aspで、Glnの、グルタミン酸、グリシン、彼の、イル、リス、メット、Pheで、プロ、のSer、Thrで、ヴァル、のTrp、Tyrで、:沈殿を回避するには、次の順序で、アミノ酸ストック溶液を移しロイシン、およびCys。 NCAA( 例えば 、缶)に類似しているCAA( 例えば 、アルギニン)のストック溶液を追加しないようにしてください。最後に、徹底的にボルテックス。可能な限り解決策をクリアにするために、37℃でインキュベートします。
- 1.35ミリリットルの3つの等しいボリュームにこのアミノ酸マスターミックスのソリューションを分割します。 1.5ミリリットルの反応管に分割された各ボリュームを転送します。氷の上に保管しておいてください。
- 15ミリリットルの遠心分離管に無菌のddH 2 Oの1.4ミリリットルを転送します。氷の上に置きます。各アミノ酸原液175μlのを追加します。 NCAA( 例えば、缶)によって置換されるCAA( 例えば 、アルギニン) の原液を除いて 、次々に追加します。徹底的に各添加後ボルテックスし、氷上に戻って解決策を置きます。
- 5 mMでのLeuを除いて、6 mMの各濃度で全20 CAASで構成アミノ酸溶液を準備します。最初のボリュームOにFステップ1.2.4.3での分割の結果、1.35ミリリットルを、NCAA( 例えば 、缶)に類似しているCAA( 例えば 、アルギニン)の168 mMのストック溶液50μlを追加します。徹底的に渦。
- 氷上に戻って置きます。反応チューブに16μlの体積の中で、この1.4ミリリットルソリューションを等分。この溶液量は約85アリコートにつながることに注意してください。これらのアリコート「+ CAA」( 例えば、+アルギニン)をラベルを付けます。
- フラッシュ-80℃で液体窒素とストア内のアリコートを凍結する。 注意!安全のために、液体窒素の飛沫から保護するアイシールドとクライオ手袋を着用してください。
- NCAA( 例えば 、缶)に類似しているCAA( 例えば 、アルギニン)を除く19 CAASで構成されているアミノ酸溶液を準備します。レイ(5ミリモル)を除いて、6 mMの濃度に各アミノ酸を加えます。
- 分割の結果として、1.35ミリリットルの第二のボリュームに無菌のddH 2 O50μlのを追加します。ステップ1.2.4.3インチ徹底的にボルテックスし、氷上に戻しました。反応チューブに16μlの体積の中で、この1.4ミリリットルソリューションを等分。この溶液量は約85アリコートにつながることに注意してください。 「 - CAA」( 例えば、 - Argの)これらのアリコートにラベルを付けます。
- フラッシュ-80℃で液体窒素とストア内のアリコートを凍結する。 注意!安全のため、窒素飛沫から保護するアイシールドとクライオ手袋を着用してください。
- 標準的な1( 例えば 、アルギニン)を代入19 CAASとNCAA( 例えば、缶)が含まれているアミノ酸混合物を準備します。レイ(5ミリモル)を除いて、6 mMの濃度に各アミノ酸を加えます。最後の1.35ミリリットルのボリュームに、ステップ1.2.4.3での分割の結果として、( 例えば 、缶)NCAAの168 mMストック溶液50μlを追加します。 「+ NCAA」( 例えば 、+缶)それにラベルを付けます。徹底的にボルテックスし、氷上に戻しました。
- 16&#の容積のアリコートこの1.4ミリリットルソリューション181;リットル反応チューブに。この溶液量は約85アリコートにつながることに注意してください。これらのアリコート「+ NCAA」( 例えば、+缶)をラベルを付けます。
- フラッシュ-80℃で液体窒素とストア内のアリコートを凍結する。 注意!安全のため、窒素飛沫から保護するアイシールドとクライオ手袋を着用してください。
注:手順1.2.5.1、1.2.6.1と1.2.7.1で使用16μlのアリコートのボリュームはピペッティングによる損失を考慮するために必要とされるよりもわずかに高いです。
2.エネルギーバッファの準備
注:粗抽出物の各バッチは一意であり、MG-とK-グルタミン酸34の最適化された濃度を必要とします。粗抽出物のアリコートの容積は、タンパク質濃度34に依存します。異なる値のために提供計算テンプレート(補足資料1)を使用します。補足資料1図の凡例、explaのさらなる指示を探しますこのテンプレートを用いる方法をining。
- 変更されていないプロトコル34に従って、14倍のエネルギーソリューションと粗抽出物のアリコートを調製し、-80℃で保存。最適化された発現効率34 MG-とK-グルタミン酸濃度に応じて粗抽出物を調整します。
注:14Xエネルギーソリューションの最終組成は、700mMのHEPES(pHが8)、21 mMのATP、21 mMのGTP、12.6 mMのCTP、12.6 mMのUTP、2.8 mg / mlでのtRNA、3.64 mMのCoAを、4.62 mMのNAD、10.5 mMのcAMPを、0.95 mMのフォリン酸、14 mMのスペルミジン、420 mMの3-PGA。 - 氷上で解凍を100mMのMg-グルタミン酸原液、3 M K-グルタミン酸原液、14倍のエネルギーソリューションと40%PEG-8000は、マスターミックスを調製しました。氷の上に保管しておいてください。
- 100 mMのMgをグルタミン酸原液の9.18μlの、反応管内の3 M K-グルタミン酸原液、14倍のエネルギーソリューションの21.86μlを、40%PEG-8000の15.3μlを1.6μlの滅菌のddH 2 Oの3.06μLを混合します。徹底的にこのマストをボルテックスえー、各添加後に混合し、氷上で保管してください。
- 反応チューブに16μlの(3アリコート)のボリュームにマスターミックス(51μl)を等分。頻繁に分注時にマスターミックスをボルテックス。 Flashは液体窒素でアリコートを凍結します。
注:16μlのアリコートのボリュームだけでなく、マスターミックスボリュームがピペッティングによる損失を考慮するために必要なよりもわずかに高いです。 - エネルギーバッファチューブを収集するためにストレーナを使用します。 C。 注意 -80℃でチューブを保管してください!窒素飛沫から保護するアイシールドとクライオ手袋を着用してください。
ncAAsの残基特異的組み込みのための無細胞反応の調製と実行
- まず、のddH 2 O中にDNAベクター溶液を調製
- 非常に効率的なタンパク質発現のために、発現ベクターpBEST-OR2-OR1-PR-UTR1-deGFP-T500 32を使用します 。遺伝子のクローンを作成し、このベクトル36,37へのモデルタンパク質をコードします</ SUP>。
注:別の方法として、同様にσ70によって認識されている他のプロモーターを使用していますが、発現効率が低下することができることに注意してください。 - 37,38 E.のベクトルを変換します大腸菌株KL 740 32(エールCGCS番号:4382)は、増幅ベクターDNA 37,39を精製し、DNA溶液40から42の濃度を定量化します。 -20℃でDNA溶液を保存したり、直接細胞手数料反応の準備のためにそれを使用する(3.4.1、3.4.2および3.4.3ステップ)。
- 非常に効率的なタンパク質発現のために、発現ベクターpBEST-OR2-OR1-PR-UTR1-deGFP-T500 32を使用します 。遺伝子のクローンを作成し、このベクトル36,37へのモデルタンパク質をコードします</ SUP>。
- 変更されていないプロトコル34に従って使用ベクター構築物の濃度に応じて無細胞発現効率を調整します。無細胞反応の準備のための最高タンパク質収量(3.4.1、3.4.2および3.4.3ステップ)につながる最適濃度を使用してください。
注:無細胞反応の製剤は、無細胞に10nMの最終ベクター濃度をもたらす90 nMのベクターDNAストック溶液を使用して例示されています反応及びMG-とK-グルタミン酸の上記最適値と同様に抽出分量のボリュームに従います。異なる値の計算テンプレートを使用してください。 - ラベルされた氷3粗抽出物のアリコートに解凍(未修正のプロトコル34に従って調製)30μlの体積のそれぞれについて、1アミノ酸溶液のアリコートラベルされた「+ CAA」( 例えば 、+アルギニン)、1アミノ酸溶液のアリコート" - CAA」( 例えば 、 、 -のArg)および1「+ NCAA」( 例えば 、+缶)(セクション1.2.5で調製した標識アミノ酸溶液のアリコート-セクション2で調製)1.2.7、3エネルギーバッファのアリコート()およびベクターDNA溶液(セクション3.1で調製しました)。
注:粗抽出物は、わずかに粘性であり、それは気泡を含有してもよいです。 4℃で30秒間万×gで遠心分離して気泡を除去。氷の上で粗抽出物のアリコートを元に戻します。 - 粗抽出物(33.33パーセント)、エネルギーを混合することにより、3異なる合成無細胞反応(各90μlの最終容量)を準備緩衝液(16.67%)、3異なる構成アミノ酸溶液のアリコート(16.67%)とベクターDNA溶液1。任意に、さらなる生体分子(DNA、タンパク質のtRNA など )を追加したが、適宜のddH 2 Oの量を減少させます
- 未修正のモデルタンパク質を発現しているリファレンス無細胞反応(90μl)を準備します。
- 2 O原油の30μlにエネルギーバッファ15μlの、「+ CAA」( 例えば 、+アルギニン)、90 nMのベクターDNA溶液10μlおよび滅菌のddH20μlの標識されたアミノ酸溶液のアリコート15μlのを追加します。エキス。各成分の添加後にダウンして静かに渦をピペッティングにより混和します。
- 6μlに15等量の無細胞反応の90μLを分注し。別々の反応管に15の各ボリュームを転送します。チューブを閉じて、氷の上に戻します。 「CFR(+ CAA)」( 例えば 、CFR(+アルギニン))のように、すべての反応チューブにラベルを付けます。
- CAA( 例えば、アルギニン)も非標準アナログのいずれも陰性対照無細胞反応(90μl)を、準備し( 例えば、することができます)追加されます。
- エネルギーバッファ15μlのは、標識されたアミノ酸溶液のアリコート15μlのを追加」 - CAA」( 例えば、 -のArg)、原油の30μlの〜90 nMのベクターDNA溶液および無菌のddH 2 O20μlの10μlのエキス。各成分の添加後にダウンして静かに渦をピペッティングにより混和します。
- 6μlに15等量の無細胞反応の90μLを分注し。別々の反応管に15の各ボリュームを転送します。チューブを閉じて、氷の上に戻します。 「CFR(-cAA)」( 例えば、CFR(-Arg))のように、すべての反応チューブにラベルを付けます。
- 残基特異的に発現するモデルタンパク質にNCAA( 例えば、缶)を組み込むものとする無細胞反応(90μl)を準備します。
- 15を追加します。エネルギーバッファ、「+ NCAA」( 例えば、+缶)標識されたアミノ酸溶液のアリコート15μlの、90 nMのDNA溶液と粗抽出物30μlのに無菌のddH 2 O20μlの10μlのμlの。各成分の添加後にダウンして静かに渦をピペッティングにより混和します。
注:発現効率は、標準的なアミノ酸を有する発現と比較して減少させることができます。必要であれば、単に無細胞反応容量をスケールアップ。 - 6μlに15等量の無細胞反応の90μLを分注し。別々の反応管に15の各ボリュームを転送します。チューブを閉じて、氷の上に戻します。増加反応ボリュームの場合、それに応じて6μlにさらにボリュームに分注し。 「CFR(+ NCAA)」( 例えば、CFR(+缶))のように、すべての反応チューブにラベルを付けます。
- 15を追加します。エネルギーバッファ、「+ NCAA」( 例えば、+缶)標識されたアミノ酸溶液のアリコート15μlの、90 nMのDNA溶液と粗抽出物30μlのに無菌のddH 2 O20μlの10μlのμlの。各成分の添加後にダウンして静かに渦をピペッティングにより混和します。
- 未修正のモデルタンパク質を発現しているリファレンス無細胞反応(90μl)を準備します。
- 29°CO / Nですべてのチューブをインキュベートします。
注:のみの小さな反応体積は、十分な酸素の差分を有効にします高効率のタンパク質発現のために重要である反応にusion。 10μlを攪拌34を通した活性酸素を必要とするよりも、反応容積も大きいです。大ボリュームの場合、15μlのより小さなボリュームに反応を分割します。 - 無細胞発現の後、プールはすべて同一の6μlに分割無細胞反応を作曲しました。まず、プール「CFR(+ CAA)」と記された6μlのすべての15分割の無細胞反応( 例えば、CFR(+アルギニン))。その後、プールラベルされた6μlのすべての15の分割無細胞反応」CFR(-cAA)」( 例えば 、CFR(-Arg))。最後に、プールの標識6μlのすべての15の分割無細胞反応」CFR(+ NCAA)」( 例えば、CFR(+ CAN))。増加反応ボリュームの場合、それに応じて6μlとさらにボリュームをプール。
- 異なる変性SDS-PAGE 43,44(セクション4.1)を行うことにより、無細胞反応を構成し、プールされたすべての3つの中でモデルタンパク質の発現レベルを確認してください。
注:このメトを使用します。取り込み実験の予備的な評価のためにD。 - HPLC-ESI質量分析(セクション4.4)を介して適切な分析のための無細胞発現するモデルタンパク質を準備します。まず、45彼らは(セクション4.2)を浄化します。最後に、質量分析の際に高いバックグラウンドノイズを回避するために、バッファ(セクション4.3)を交換。
注:典型的な無細胞反応条件セクション3.4.1、3.4.2および3.4.3リード34:8.9 - (粗抽出物から)9.9 mg / mlでのタンパク質、4.5から10.5 mMのMgをグルタミン酸、40から160 mMのK-グルタミン酸、ロイシン、0.83 mMのロイシン、50mMのHEPES、1.5 mMのATPとGTP、0.9mMのCTPおよびUTP、0.2 mg / mlでのtRNA、0.26 mMのCoAを、0.33 mMのNAD、0.75 mMのcAMPを除く各アミノ酸の1 mMの、0.068 mMのフォリン酸、1 mMのスペルミジン、30mMの3-PGA、2%PEG-8000および10 nMのpBEST-OR2-OR1-PR-UTR1-gene_of_model_protein-T500。所望の場合、無細胞反応の調製の別の手順は、上記の反応条件をもたらすことを行うことができます。
- 無細胞反応のSDS-PAGE
注:任意のさらなる精製または抽出することなく、発現タンパク質の迅速かつ予備的な分析のために変性SDS-PAGEを実行し、次の手順を実行します。- 氷の上のタンパク質標準を解凍します。それはゲル上でその局在(ステップ4.1.13)のための表現モデルタンパク質に似た分子量を有するタンパク質で構成されていることを確認してください。
注:212キロダルトン、マルトース結合タンパク質βガラクトシダーゼ:158キロダルトン、βガラクトシダーゼ:116キロダルトン、ホスホリラーゼb:97キロダルトン、血清アルブミンここで、使用される標準は、広範囲の分子量(ミオシンを超えるタンパク質を提供:66 kDaの、グルタミン酸脱水素酵素:56キロダルトン、マルトース結合タンパク質:43 kDaの、チオレドキシン還元:35キロダルトン、トリオースリン酸イソメラーゼ:27キロダルトン、トリプシン阻害剤:20kDaの、LYsozyme:14 kDaの、アプロチニン:7キロダルトン、インスリンA:3キロダルトン、B鎖:2キロダルトン)。 - 適切なゲル移動を保証し、染色後に飽和を回避するために、SDS-PAGE前に10倍-無細胞反応は、高いタンパク質濃度にわずかに粘性であるため、無菌のddH 2 O 5それらを希釈します。あまりにも多くのサンプルを無駄にしないために、無菌のddH 2 Oの4μlの無細胞反応の1μLを希釈します反応チューブ中で希釈を準備し、徹底的にボルテックスまもなく2用のミニ遠心機で液体をスピンダウン - 2000 X gで3秒。
- 希釈された無細胞反応の5μlに2倍のローディングバッファー5μlを添加します。徹底的にボルテックスおよび2のためのミニ遠心機でスピンダウン - 2000 X gで3秒。
注記:ここでは、添加した後、生体分子は、62.5 mMトリス/ CLに溶解し- 、pH6.8で10%グリセロール、2%SDS、0.0025%ブロモフェノールブルー、典型的な組成物。わずかに異なる希釈共同につながる他のローディング染料を使用しましたnditionsも同様に適切であり得ます。 - 徹底的にタンパク質標準をボルテックスし、反応管にそれを15μlを移します。
注:ゲルサイズにし、他のタンパク質スタンダードのために応じて、推奨量は上記と異なることがあります。 - 加熱ブロックに反応チューブを置きます。チューブの蓋が正しく閉じているかどうかを確認してください。 5分 - 3用100°C - 95で加熱。タンパク質を変性させ、タンパク質骨格の周りにSDS-折り返しを有効にするためにこれを行います。
注:一部のタンパク質標準サプライヤーとの説明を参照してください、加熱されてはいけません。 - 一方、ゲル電気泳動チャンバにランニング緩衝液を移します。 1×ランニング緩衝液の含有量は、25 mMトリス、192 mMグリシン、(HClで)は、pH 8.3で0.1%SDSです。
- 20%勾配トリス - グリシンSDS電気泳動槽にゲル(10センチメートルのx 10センチメートル×1 mm)の - プレキャスト4を修正しました。櫛を削除し、ランニング緩衝液を負荷した注射器でウェルをすすいでください。
注:ゲル濃度のSTROngly表現モデルタンパク質の大きさや性質に依存します。上記の濃度は、Eを分離します大腸菌粗抽出タンパク質だけでなく、低分子量のモデルタンパク質。自己キャストゲルも適切です。 - 加熱ブロックからチューブを外します。 2000 X gで3秒 - 2のためのミニ遠心機で液体をスピンダウン。 2,000×gで3秒 - まもなく渦とは2のためにスピンダウン繰り返します。
- ウェルに各サンプルの - (22μgタンパク質11)と電気泳動を開始 - (48μgタンパク質24)と10μlのタンパク質標準の15μLを移します。約90分間40 MA、典型的なプロトコル - ここでは、SDS-PAGEを125 Vと20で行われます。
- 慎重にカセットからゲルを取り出します。 30分間固定液(50%メタノール、10%酢酸、40%のddH 2 O)にそれを転送する。 注意!メタノール吸入による毒性および皮膚に接触しています。ヒュームフードの下で保護手袋や作業を着用してください。
- 染色溶液(0.025%クマシーブリリアントブルーG-250、10%酢酸、90%のddH 2 O)にゲルを移します。 60分間染色します。
- 120分- 60用の脱色液(10%酢酸、90%のddH 2 O)にゲルを移します。
注:固定、染色と強く脱色は、発現されたタンパク質の大きさや性質に依存します。このプロトコルは、かなり小さい分子量46のタンパク質の広い範囲に適用されます。 - 染色されたタンパク質バンドのための適切なコントラストを生成白地にマット透明にゲルを置き換えます。
- 氷の上のタンパク質標準を解凍します。それはゲル上でその局在(ステップ4.1.13)のための表現モデルタンパク質に似た分子量を有するタンパク質で構成されていることを確認してください。
- 無細胞反応からのHisタグ化45モデルタンパク質の精製
注記:タンパク質の精製のために、いくつかの方法は、それが同様の結果をもたらす存在します。このプロトコルは、C末端hisタグ(Hisタグ)を持つ無細胞発現するモデルタンパク質を精製します。これは、関数expされるタンパク質に適した精製キットを使用しています無細胞タンパク質発現の小さな反応容量でressed。それは、天然または修飾モデルタンパク質の精製のために同じです。したがって、一般に、単一の無細胞反応に基づいて説明します。- 適切なHPLC-ESI質量分光分析のために、抽出し、無細胞反応からモデルタンパク質を精製し、次の手順を実行します。
- 彼の結合バッファーを150μlと90 - - 無細胞反応の150μlの90の等容量を混ぜます。上下ピペット、穏やかにボルテックスが続きます。
注:彼の結合緩衝液を使用することは推奨されます。しかしながら、無細胞反応媒体限りモデルタンパク質が可溶性であるように出発材料とすることができ、pHが7.5の間である - 、イミダゾール/彼の濃度は、<10 mMの8である、強力な還元剤の濃度は、<15 mMの無金属 - ですキレート剤が存在します。あなたの混合量が300μLを超えた場合、等量に分割し、アリコートを異なるRにボリュームを学位論文以下の精製工程のためのeactionチューブ。 - カラムシステムを準備します。ゲル状樹脂が完全に溶解するまで十分に彼の親和性ゲルのストック溶液をボルテックス。カラムにゲル状樹脂250μlのを転送します。粘性ゲル樹脂の1ミリリットルピペットチップを使用してください。コレクションチューブにカラムを置きます。
- 15000 Xグラム - 13,000で10秒 - 5のための遠心分離カラム/回収チューブ。ゲル樹脂が完全に消耗していることを確認してください。ない場合は、さらに5により遠心分離時間を延長 - 10秒が、アフィニティーゲルは、過乾燥されていないことに注意を払います。したがって手順4.2.1.5、4.2.1.7と4.2.1.9での遠心分離時間を延長します。
注:それは堅くなり、何の上清が上に残っていない場合にゲル状樹脂が完全に排出されます。 - カラムへの無細胞反応/彼の結合緩衝液300μlの - 150を転送します。混合量が推奨される量を超えた場合、いくつかのスピンカラムに分割。 FRによってゲル状樹脂を再懸濁equentタップし、穏やかにボルテックス少なくとも2分間のインキュベーション時間の間に。 2分 - 200μlのより大きなボリュームの場合、追加の1インキュベートします。
注:十分なインキュベーション時間は、ゲル樹脂をモデルタンパク質の結合のために重要です。 - 15000 Xグラム - 13,000で10秒 - 5のための遠心分離カラム/回収チューブ。フロースルーを捨て、バックコレクションチューブにカラムを配置します。
- 彼-の洗浄緩衝液250μLを加えます。タップし、穏やかにボルテックスすることによりゲル状の樹脂を再懸濁します。
- 15000 Xグラム - 13,000で10秒 - 5のための遠心分離カラム/回収チューブ。フロースルーを捨て、バックコレクションチューブにカラムを配置します。 15000のxグラム - 13,000で10秒 - 5のためにもう一度手順を繰り返し4.2.1.6および遠心分離機。
- 標準的な1.5ミリリットルの反応管に列を配置します。溶出バッファーを150μlを追加し、タップし、穏やかにボルテックスすることによりゲル状樹脂を懸濁します。高い精製したモデルタンパク質の詐欺のために100μlの体積を減らします次のステップ4.2.1.9での溶出後centrations。
注:溶出緩衝液の量が減少する場合、精製されたモデルタンパク質の全存在量は、原因すべてのゲル樹脂に結合したタンパク質の可能な不完全な溶出を低減することができます。 - 遠心カラム/反応管5のために - 13,000で10秒 - 15,000×gで溶出緩衝液中に精製されたタンパク質を希釈します。前に分割する場合、1ストック溶液に、すべてのソリューションをプール。
- 緩衝液交換を実行する前に、 例えば、標準的な方法を用いてタンパク質濃度を決定し、ブラッドフォード47,48をアッセイ。
注: - 50μlの適切なHPLC-ESI質量分析(セクション4.4)の場合、通常20の必要なボリュームで約0.5 mg / mlであり、最適なタンパク質濃度を使用します。濃度が0.2 mg / mlで未満の場合、回転真空濃縮器を用いて緩衝液交換した後、タンパク質溶液を濃縮します。この場合、最初に適切に交換するバフを適応させるためにセクション4.3.8を読んでえー。
- 彼の結合バッファーを150μlと90 - - 無細胞反応の150μlの90の等容量を混ぜます。上下ピペット、穏やかにボルテックスが続きます。
- 適切なHPLC-ESI質量分光分析のために、抽出し、無細胞反応からモデルタンパク質を精製し、次の手順を実行します。
- HPLC-ESI質量分析のための緩衝液交換
注:による高濃度のイミダゾール(> 150 mM)のなどのNaH 2 PO 4(> 300 mM)のまたはのNaCl(> 50 mM)のような他の塩に質量分光分析における高いバックグラウンドノイズを避けるために、Hisタグ溶出緩衝液を交換します49。以下の緩衝液交換プロトコルがprehydratedゲルろ過スピンカラムシステムを使用しています。これは、同じ天然のまたは修飾されたモデルタンパク質のために実行されます。したがって、一般に、単一の無細胞反応に基づいて説明します。他の簡単に行うバッファー交換方法、 例えば 、ミニ透析カートリッジがあることに注意してください。- タンパク質保存緩衝液(50mMのトリス-Cl pHが8、100mMのNaCl、10%グリセロール)を100mlの準備。 605.7 mgのTris塩基、584.4 mgの塩化ナトリウムをボトルとグリセロールの10ミリリットルを追加mlのオートクレーブ滅菌100に計り分けます。約80ミリリットルに埋めるとを8にpH値を調整しますddingのNaOH。着実にpHメーターでpH値をチェックしてください。最後に、100ミリリットルマークに埋めます。
注:限り、HPLCは、従来の質量分光測定を行うように、モデルタンパク質の広い範囲を安定化させ、質量分光分析を妨害しないようにこのバッファーを使用します。しかし、発現したモデルタンパク質の性質に応じて、よりよい適したかもしれない他のバッファを使用します。あなたの標的タンパク質がpH8で安定していない場合は、それに応じてpHを調整する。 より高いグリセロール濃度を使用しないでください。 - RTに少なくとも15分間、ゲルろ過スピンカラムをウォームアップ。
- 穏やかなタッピングまたはボルテックスによってprehydratedゲルを再懸濁し、気泡を除去。
- まず、底部キャップを削除してから、離れてトップキャップを取ります。洗浄管(少なくとも2ミリリットル)に列を配置します。遠心分離機に列/洗浄チューブを転送します。各列は、方位マークを有しています。ゲル保存緩衝液を除去するために、2分間千×gで遠心分離します。ディスクフロースルーをARD。
注:この順序で進行するために注意を払ってください。列はすべて、さらに遠心分離工程で同じ方向性を持っていることを確認してください。 - タンパク質貯蔵緩衝液の400μlにまで加えます。千×gで2分間遠心分離します。完全にゲルにタンパク質貯蔵バッファをロードするためにこれを繰り返します。慎重に精製されたモデルタンパク質の溶液100μlまで追加。ゲル床の中央に直接ピペットで。
注:精製タンパク質の溶液体積は、特に修飾されたタンパク質の、より高いかもしれません。いくつかのバッファ交換カラムの上に、このようなソリューションを分割します。タンパク質は、緩衝液交換のこの種の5キロダルトンより高い分子量を持っている必要があります。 - 千×gで2分間のコレクションチューブと遠心分離機に列を配置します。
注:このステップは、タンパク質貯蔵緩衝液中の精製されたモデルタンパク質の希釈をもたらします。前に分割する場合、1ストック溶液に、すべてのソリューションをプール。 - フラッシュ凍結番目直接Eタンパク質-80℃で液体窒素とストア内の溶液またはHPLC-ESI質量分析法50(セクション4.4)を介してそれを分析。 注意!窒素飛沫から保護するアイシールドとクライオ手袋を着用してください。
- 慎重に溶剤51を蒸発させる回転真空濃縮器を用いてタンパク質溶液を濃縮するためのプロトコルの次の手順を実行します。
注記:タンパク質濃度は、HPLC-ESI質量分析(<0.2 mg / mlで)のためには低すぎる場合は、これらのステップが必要とされます。溶液体積とモデルタンパク質の濃度が緩衝液交換の前後でほぼ同じです。濃縮プロセスは、以下の例により説明される:Hisタグ精製後、モデルタンパク質は、彼の溶出バッファー(ステップ4.2.1.9)100μLの中に溶解し、0.07 mg / mlで(ステップ4.2.1.10)の濃度を有しています。- タンパク質濃度と液量がで蒸発させた後であることを確実にするために、少なくとも0.2 mg / mlで、20μlを、それぞれ、緩衝液交換、せいぜい五倍は、少なくとも以下の3つのステップ4.3.1で製造したが、タンパク質の蓄積バッファの前に、希釈します。同様に第三の少なくとも二つ(66.67μl)を、または最大で4第五(80μl)を以下に蒸発します。
注:タンパク質貯蔵緩衝液の希釈緩衝液交換は、このバッファ(ステップ4.3.1)の濃度値がまだ蒸発にもかかわらず、実現されることを考慮に入れるために重要である前に。 4.3.8.4 - 4.3.8.2ステップ以下を実行する前に - タンパク質貯蔵緩衝液を希釈した後、最初のバッファー交換を行う(4.3.6 4.3.2ステップ)。 - 緩衝液交換した後、回転真空濃縮器に開放管でのモデルタンパク質溶液の完全な100μLを入れます。
注:モデルタンパク質を希釈タンパク質貯蔵緩衝液に溶解されます。回転中の液体の損失を回避するために、回転中心に向けて傾けます。ことを確認し、同じボリュームのオープンブランクH 2 Oは、対称的に回転するシステムのバランスをとるために配置されています。 - コンセントレータの蓋を閉じ、回転を開始。タンパク質の安定性を確保するために、室温でまたは30℃までの低温で濃縮しました。
注:使用コンセントレータは自動的に170 XGに加速し、真空を確立します。以下では、240×gでの最大速度まで加速します。 - 頻繁に液量を調査するために濃縮プロセスを中断。残りの溶液の体積は20μlの33μlの間にあるとき、濃度を停止します。
注:これにより4.3.8.1の手順を適合させる - 他のソリューションボリュームの4.3.8.4(ステップ4.2.1.9)および他のタンパク質濃度(ステップ4.2.1.10)。 Flashは-80℃で液体窒素とストア内の濃縮タンパク質溶液を凍結、または直接HPLC-ESI質量分析50を介してそれを分析します。注意!窒素飛沫から保護するアイシールドとクライオ手袋を着用してください。
- タンパク質濃度と液量がで蒸発させた後であることを確実にするために、少なくとも0.2 mg / mlで、20μlを、それぞれ、緩衝液交換、せいぜい五倍は、少なくとも以下の3つのステップ4.3.1で製造したが、タンパク質の蓄積バッファの前に、希釈します。同様に第三の少なくとも二つ(66.67μl)を、または最大で4第五(80μl)を以下に蒸発します。
- タンパク質保存緩衝液(50mMのトリス-Cl pHが8、100mMのNaCl、10%グリセロール)を100mlの準備。 605.7 mgのTris塩基、584.4 mgの塩化ナトリウムをボトルとグリセロールの10ミリリットルを追加mlのオートクレーブ滅菌100に計り分けます。約80ミリリットルに埋めるとを8にpH値を調整しますddingのNaOH。着実にpHメーターでpH値をチェックしてください。最後に、100ミリリットルマークに埋めます。
- モデルタンパク質のHPLC-ESI質量分析50
- 90%アセトニトリルおよび25以上のギ酸の0.1% - 20%の勾配でC5逆相カラム上で(セクション4.3で調製した)15μlのタンパク質溶液(3ミクロン、100×2.1ミリメートル) - 5のHPLC分離を行います3,000のm / z - 300の範囲内の飛行時間型質量分析器の検出と分およびその後のESI質量分析。
注:発現したモデルタンパク質の性質に応じて、よりよい適したかもしれない他の溶媒または列を使用しています。 - デコンボリューションは、ゼロチャージ質量を計算するために適切なソフトウェア52を使用して質量スペクトルを測定しました。
- 90%アセトニトリルおよび25以上のギ酸の0.1% - 20%の勾配でC5逆相カラム上で(セクション4.3で調製した)15μlのタンパク質溶液(3ミクロン、100×2.1ミリメートル) - 5のHPLC分離を行います3,000のm / z - 300の範囲内の飛行時間型質量分析器の検出と分およびその後のESI質量分析。
結果
このプロトコルは、モデルタンパク質へncAAsの無細胞残基特異的取り込みを介して案内します。これは、取り込み実験及び適切なHPLC-ESI質量分光分析のためのモデルタンパク質を調製するためのさらなる工程の予備的評価のためにSDS-PAGEを提案しています。
ここでは、代表のArgアナログの無細胞残基特異的取り込みの結果することができ、同様のLysアナログL-ヒドロキシリジン(HYL)が提示されています。異なるアミノ酸溶液、エネルギーバッファは、モデルタンパク質との無細胞反応のためのベクターDNAコードは、上述のように調製されます。基準無細胞反応は、20 CAASからなるアミノ酸溶液が設けられています。各実験では、陰性対照の無細胞反応は、問題のNCAAの標準的なアナログを欠くアミノ酸溶液が供給されます。各APPRのためoachは、一つのセルの無反応がCAAは、非標準アナログにより置換されたアミノ酸溶液、の存在下でのモデルタンパク質を発現します。 Hisタグ精製、緩衝液交換およびHPLC-ESI質量分析は、上記のプロトコルに従って実行されます。
モデルタンパク質は、C末端Hisタグ付きdeGFP 32、EGFP 53の短縮版です。その一文字アミノ酸配列は、(補足資料2)に見出すことができます。このモデルタンパク質は、6 ArgおよびLysの18位が含まれ、 それぞれの発現ベクターは、pBEST-OR2-OR1-PR-UTR1-deGFP-T500です。
NCAAの完全な取り込みの場合、1は20 CAASの1が欠落しているので、ネガティブコントロール反応は、deGFPを発現しないと仮定することができます。反対に、deGFPは、他の2つの反応において検出可能でなければなりません:REFEでネイティブ1無細胞反応とNCAAが設けられている無細胞反応で修飾されたタンパク質をrence。
図1Aは、CAN取り込み実験の予備的なSDS-PAGEの評価を示します。基準無細胞反応は、最高deGFP発現レベルを有します。缶を備えている無細胞反応において、deGFPは、わずかに低い濃度で発現されます。いいえdeGFP発現は陰性対照中で検出することができません。このSDS-PAGEの結果は、標的タンパク質deGFPに缶の成功取り込みのための良好な指標です。
、deGFPに図1Bに視覚化精製されたモデルタンパク質の両方を缶の仮定の完全な組み込みを証明するために、HPLC-ESI質量分析により分析される。 図1Cは、精製deGFP分子のデコンボリューションした質量スペクトルを示します。 DEGFのデコンボリューションした質量基準無細胞反応で発現されるPは26,192.8ダあります。 deGFPについて26202.5ダの質量が表示され、無細胞反応を含む缶で表現。完全に缶に置き換えられネイティブdeGFP6ArgおよびArgを有する改変deGFP6Canの予想質量はそれぞれ、26193ダおよび26204ダです。 deGFP6Can 1.5ダの質量差は、スペクトルのデコンボリューションの誤差の範囲内です。したがって、すべての6のArg位置でdeGFPに缶の完全な取り込みが確認されました。
減少強度の2つのピークは、ネイティブdeGFP6Argとその成熟した蛍光団を達成しませんでした修正deGFP6Canに対応しています。フルオロフォアは、自己触媒的酸化に続いて、H 2 O分子の脱離により生成されます。これは、このプロセスを続行しない場合は20ダ増加質量をもたらします。
PG "/>
無細胞発現させ、精製deGFP分子の取り込みができます実験およびHPLC-ESI質量分析の 図1. SDS-PAGE評価。(A)SDS-PAGEを使用して組み込むことができ、実験の予備的評価。左から右へ:タンパク質標準、基準の無細胞反応、陰性対照との無細胞反応缶の代わりにアルギニンの提供。 (B)Hisタグ精製後のSDS-PAGEおよび発現deGFP分子の緩衝液交換。左から右へ:タンパク質標準、基準反応から精製deGFP、反応を含む缶から精製deGFP。 (C)HPLC-ESI質量分光法による缶の完全な取り込みの確認。完全に缶に置き換えネイティブdeGFPおよびArgを有する改変deGFPの予想される質量は、それぞれ、26193ダおよび26204ダです。各スペクトルは、最も高い強度(カウント)に正規化されます。ピーク位置は、示されていますダインチ可視化のために、ゲルのレーンはゲル画像から抽出され、一緒に結合し、グレースケールフォーマットに変換され、サイズが最適化され、コントラスト並びに輝度が向上します。オリジナルゲルのレーンは、補足資料3に示されている。この図の拡大版をご覧になるにはこちらをクリックしてください。
図2Aは、HYLの取り込み実験の予備的なSDS-PAGEの評価を示します。 HYLが設けられている無細胞反応において、deGFPが表現されます。最初の実験とは対照的に、弱いdeGFPバンドは陰性対照反応で観察することができます。これは、無細胞反応でのLys残基が原因である可能性があります。これは、LysもHYLどちらが追加されている負の対照反応、中にかすかなdeGFP表現を可能にします。
Hの場合 PLC-ESI質量分析、HYLを備えた無細胞反応のdeGFP分子が精製され、バッファが( 図2B)で交換されます。
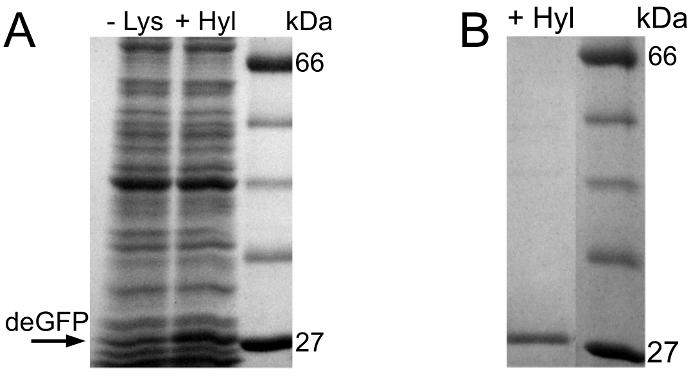
HYL取り込み実験の 図2 のSDS-PAGEの評価 (A)左から右へ:HYLおよびタンパク質標準を含有する陰性対照の無細胞反応、無細胞反応。 (B)Hisタグ精製後のSDS-PAGEおよび発現deGFP分子の緩衝液交換。 HYL含む反応およびタンパク質標準から精製deGFP:左から右へ。可視化のために、ゲルのレーンはゲル画像から抽出され、一緒に結合し、グレースケールフォーマットに変換され、サイズが最適化され、コントラスト並びに輝度が向上します。オリジナルゲルのレーンは、補足資料3に示されています。F = "https://www.jove.com/files/ftp_upload/54273/54273fig2large.jpg"ターゲット= "_空白">この図の拡大版をご覧になるにはこちらをクリックしてください。
図3は、精製deGFP分子のデコンボリューションした質量スペクトルを示す。 図3Aは、無細胞反応中に既に存在するLys残基の仮説を確認します。スペクトルの優勢なピークがネイティブdeGFP(:26193ダ予想質量)に対応しています。再び、それらのフルオロフォアを発症しなかった20ダより高い質量のdeGFP分子を検出することができます。リジン残基が優先的にネイティブdeGFP18Lysの高発現レベルにつながるリジルtRNAをシンテターゼによりtRNAのLysの上にロードされています。
HYL及びLys間の質量差は16ダです。原因(すべての可能なdeGFP種が生成されるのLys残基に競争の中でdeGFP18HylあるHYLの存在に、deGFP17Hly + 1Lys、...、deGFP16Hyl + 2Lys)( 図3B)。確かに、deGFP1Hyl + 17Lysのピークは、そのフルオロフォア( 図3A)と、いくつかのピークの質量が予想される質量から2つ以上のダを異なる点を生じなかったネイティブdeGFPのピークと重なっています。これらの質量差は、deGFP種の少量に高いノイズに起因することができます。しかし、HYLは一般的に無細胞系として援用されます。更なる改善は、無細胞反応でのLys残基を廃止するために行われなければなりません。
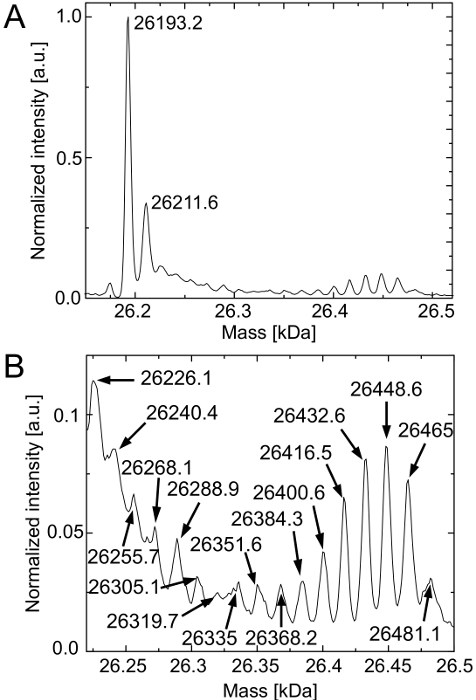
(成熟フルオロフォア26213ダことなく、フルオロフォア26193ダと予想される質量を)HYLを含有する無細胞反応の精製deGFP分子の 図3 HPLC-ESI質量分析 (A)ネイティブdeGFP18Lysは、主に検出されます。 (B)倍率は、すべての可能なdeGFP種(deGFP18Hyl、deGFP17Hly + 1Lys、deGFP16Hyl + 2Lys、...、deGFP1Hyl + 17Lys)の存在を明らかにしています。それらの予想される質量26193ダ+ Nは、16 DA(N = 1、...、18)×ています。スペクトルは、その最高強度(カウント)に正規化されます。ピークの位置はダに示されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。

補足資料1.計算テンプレート。セクション2では、エネルギーバッファマスターミックスの調製は、30μlの最適MG-それぞれ3 mMのと30mmのK-グルタミン酸濃度の粗抽出物のアリコートを用いて例示されています。この例では、3つのエネルギーバッファのアリコートをもたらすマスターミックス量をもたらします。秒でション3、無細胞反応の調製は、無細胞反応で10nmの最適なベクターDNA濃度につながる90 nmのDNAストック溶液を用いて例示されている。 このファイルをダウンロードするにはこちらをクリックしてください。
粗抽出量:28μlを、最適のMg-グルタミン酸:2 mMの、最適なK-グルタミン酸:40 mMの、多数の適切なトレーサビリティのために、計算テンプレートの使用は、上記の例とは異なるこれらの典型的な値を挿入することによって例示されます100、無細胞反応における最適ベクトル濃度:8 nMで、DNAベクター原液:150 nMの必要なバッファーのアリコートの。
まず最初のテンプレート部分のオレンジ色のフィールドに粗抽出量として28μLを入力します。そして、第2のテンプレートセクションに2 mMの入力最適なMG-とオレンジフィールドにK-グルタミン酸濃度をd 40 mMの。考慮すると、最適なMG-とK-濃度、15μlのエネルギー緩衝液の組成、ならびに対応する、スケールアップ16μlのアリコートが計算されます。以下は、それに応じてエネルギーバッファアリコート(16μl)を、所望の数として100を入力します。 100 mMのMgをグルタミン酸ストック溶液の204μlの、3 M K-グルタミン酸ストック溶液の136μlを、14倍のエネルギーソリューションの728.73μlを、510μlの:テンプレートには、次のように1700μlのマスターミックスのための異なる緩衝液成分のボリュームを適応させます40%のPEG-8000および121.27μlの滅菌のddH 2 O最後に、第3テンプレートセクションで、無細胞反応は、それぞれ、ベクターDNAストック溶液濃度の最適ベクトル濃度として8 nmおよび150 nMのを入力してください。テンプレートには、90μlに調製を完成させるために粗抽出物の28μlに添加しなければならないさまざまなコンポーネントのボリュームを適応させます無細胞反応を次のようにエネルギーバッファ15μlの、3異なる合成アミノ酸溶液の1の15μlを、ベクターDNA溶液(150 nM)をの4.80μlの、および無菌のddH 2 Oの27.20μLを
モデルタンパク質deGFPの補足資料2つの文字のアミノ酸配列。このモデルタンパク質は、6 Argおよび18 Lysの位置が含まれています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
補足資料3.全長、各個人の中で提示されたゲルの写真を提示し、図1及び2に対応する修正されていないゲルのレーンのゲルのレーン ubfigureは同じSDSポリアクリルアミドゲルから抽出されます。 図1及び図2において、これらのレーンは、プレゼンテーションのために一緒に結合されました。タンパク質標準のバンドの分子量は、図の横に示されています。 (A.1) 図1Aのuncroppedのゲルのレーン。左から右へ:タンパク質標準、基準の無細胞反応、陰性対照との無細胞反応缶の代わりにアルギニンの提供。 (A.2) 図1Bのuncroppedのゲルのレーン。左から右へ:タンパク質標準、基準反応から精製deGFP、反応を含む缶から精製deGFP。 (B.1) 図2Aのuncroppedのゲルのレーン。陰性対照の無細胞反応、HYLおよびタンパク質標準を含有する無細胞反応:左から右へ。 (B.2) 図2Bのuncroppedのゲルのレーン。 HYL含む反応およびタンパク質標準から精製deGFP:左から右へ。D / 54273 / 54273supfig3large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
- 簡単に-する残基特異的タンパク質にncAAsを組み込むための実行可能な戦略として、無細胞発現系を使用して、提示されています。この目的のために、粗抽出物は、目的のタンパク質、エネルギーバッファ及び対応するアミノ酸のためのベクターDNAコードが補充されます。粗抽出物のアリコート量が粗抽出タンパク質濃度34に依存することに注意してください。無細胞発現効率は、ベクターDNA構築濃度に応じて最適化されます。エネルギーバッファ成分の体積は、無細胞発現モデルタンパク質の高い収量を可能にするために最適化されたMG-及びKグルタミン酸濃度の関数として変化します。
取り込み実験の予備的な評価は、未精製、無細胞反応媒体のSDS-PAGEを行うことにより得ることができます。より詳細な分析のために、HPLC-ESI質量分析は、完全な、残基特異的incorをチェックするための手段として提案されていますNCAAのポレーション。後者のための準備として、スピンカラムシステムは、Hisタグ精製を可能にし、私たちは、このプロトコルで使用する小容量との交流をバッファするために使用されています。
HPLC-ESI質量分析を含む、全体のプロトコルは、2日以内に行うことができます。これは、任意の特に重要なステップが含まれていません。しかし、MG-とK-グルタミン酸のと同様に、ベクターDNAの濃度の最適化は、モデルタンパク質の高収量を表現するために重要です。高効率発現ベクターpBEST-OR2-OR1-PR-UTR1-gene_of_model_protein-T500の使用を強くお勧めします。 Hisタグ付きタンパク質の溶出が原因で高濃度のイミダゾール(> 150 mMの)および質量分光分析49における高いバックグラウンドノイズを発生する例えばNaH 2 PO 4(> 300 mM)のまたはのNaCl(> 50 mM)のような他の塩に通常であります。適切なタンパク質貯蔵緩衝液でこのような溶出緩衝液の交換は、モデルproteを安定化および大幅には、質量分光分析の間にバックグラウンドノイズを低減します。
その結果、モデルタンパク質内のすべての6つの位置でのArgを置き換えることができます。発現系では、何のArg残基は検出できません。これはさらに枯渇戦略29,30を必要とする他の発現系と比較してのArg類似体の残基特異的組み込みを簡素化します。提示された無細胞アプローチは、缶の毒性によるものであるin vivoでのアプローチの固有の制限、または単一のタンパク質の生産戦略24,31内のmRNA配列に強い依存性を回避します。 インビトロ系で採用に反して、缶のインビボでの切断はホモセリンするとヒドロキシグアニジンは、31を発生しません。
しかし、無細胞系は、HYLなどの類似体と競合するのLysの十分な量を保持しています。 HPLC-ESI質量分光分析は、C、モデルタンパク質の両方が含まれていることを示していますanonicalならびに異なる割合で非標準のアナログ。 Lysの残基特異的組込みは、一般的には可能ですが、ncAAsの認識のために最適化された完全な置換、さらに枯渇戦略、または特別に設計さのaaRSとtRNAのために開発される必要があります。
私たちは、正規のものと同じ濃度でNCAAを追加することにより、無細胞発現し、修正されたモデルタンパク質の優れた収率を達成しました。取り込み効率が組み込まれるNCAAの性質に依存します。さらに高い収率はまだNCAAの濃度を最適化することにより実現可能であるかもしれません。
提示された結果であれば、それらは標準的な内因性翻訳システムによって受け入れられるようncAAsの残基特異的組み込みのための採用システムの適用可能性を実証します。類似CAA disturの残基場合に、特定ncAAsの残基特異的取り込み、一つのさらなるニーズをチェックします発現系B。
無細胞転写翻訳系は、異なる要求54に応答するために、異なる生物から操作することができます。すべてのE.ここで紹介する無細胞系の大腸菌転写-翻訳機械は、バクテリオファージの使用を有効にしてE.大腸菌プロモーターは、それらは並行してまたは連続してカスケード55に作用することができます。一般的な適用性と使いやすさは、メソッドのアミノ酸の毒性および治療用途でのさらなる研究のための強力なツールとなっています。
開示事項
The authors have nothing to disclose.
謝辞
E.G. Worst and A. Ott acknowledge financial support by the Deutsche Forschungsgemeinschaft (DFG) within the collaborative research center SFB 1027 as well as Saarland University. E.G. Worst, A. Ott and V. Noireaux further acknowledge financial aid by the Human Frontiers Science Program Organization (HFSPO). The authors thank Tobias Baumann and Stefan Oehm (Institute of Chemistry, Technische Universität Berlin) for critical reading.
資料
| Name | Company | Catalog Number | Comments |
| Protective eyewear | Sigma-Aldrich, St. Louis, USA | Z758841 | |
| Nitrile gloves (size S) | Sigma-Aldrich, St. Louis, USA | Z768960 | Catalog numbers other sizes: Z768979 for M, Z768987 for L and Z768995 for XL |
| Eppendorf Safe-Lock Tube 1.5 ml (PCR clean) | Eppendorf, Hamburg, Germany | 30123.328 | |
| Microbalance Discovery DV114CM | Ohaus, Greifensee, Switzerland | 80104140 | |
| Microspatula (L 6 5/8 in., stainless steel, rod diam. 0.09 in.) | Sigma-Aldrich, St. Louis, USA | Z243213 | |
| L-Canavanine | Sigma-Aldrich, St. Louis, USA | C9758 | Acute toxicity: wear eyeshields, dust mask, protective gloves |
| Hydroxylysine (racemic mixture) | Sigma-Aldrich, St. Louis, USA | H0377 | |
| Cryo-gloves (size S, water resistent) | Sigma-Aldrich, St. Louis, USA | Z183490 | Catalog numbers other sizes: Z183512 for M, Z183520 for L and Z183539 for XL |
| RTS Amino Acid Sampler | Biotechrabbit, Hennigsdorf, Germany | BR1401801 | For homemade preparation of amino acid stock solutions, follow this protocol35 and use the solid amino acid kit LAA21-1KT, L-proline (81709-25G), L-cysteine (30089-25G), L-histidine (53319-25G) and L-lysine (L5501-5G) (all from Sigma-Aldrich, St. Louis, USA) |
| HEPES | Sigma-Aldrich, St. Louis, USA | H6147 | |
| ATP | Sigma-Aldrich, St. Louis, USA | A8937 | |
| CTP | Affymetrix, Santa Clara, USA | 14121 | |
| GTP | Affymetrix, Santa Clara, USA | 16800 | |
| UTP | Affymetrix, Santa Clara, USA | 23160 | |
| tRNA (from E. coli, pack size 100 mg) | Sigma-Aldrich, St. Louis, USA | 10109541001 | Catalog number for pack size of 500 mg is 10109550001 |
| CoA | Sigma-Aldrich, St. Louis, USA | C4282 | |
| NAD (from yeast ) | Sigma-Aldrich, St. Louis, USA | N6522 | |
| cAMP | Sigma-Aldrich, St. Louis, USA | A9501 | |
| Folinic acid | Sigma-Aldrich, St. Louis, USA | F7878 | |
| 3-PGA | Sigma-Aldrich, St. Louis, USA | P8877 | |
| Mg-glutamate | Sigma-Aldrich, St. Louis, USA | 49605 | |
| K-glutamate | Sigma-Aldrich, St. Louis, USA | G1149 | |
| pBEST-OR2-OR1-Pr-UTR1-deGFP-T500 | Addgene, Cambridge, USA | Plasmid #40019 | |
| 4-20% precast Tris-Glycine Gels (10 cm x 10 cm x 1 mm, 10 courses) | Anamed Elektrophorese, Groß-Bieberau / Rodau, Germany | TG 81610 | |
| SDS running buffer (10 x concentrate, 5,000 ml) | Anamed Elektrophorese, Groß-Bieberau / Rodau, Germany | TG 50001 | |
| SDS loading buffer (2 x concentrate, 50 ml) | Anamed Elektrophorese, Groß-Bieberau / Rodau, Germany | TG 05002 | |
| Unstained protein marker, broad range (2-212 kDa) | New England Biolabs, Ipswich, USA | P7702S | |
| Methanol | Merck, Darmstadt, Germany | 1060091011 | Toxic by inhalation, in contact with skin and if swallowed: wear protective gloves and work under fume hood |
| Acetic acid (99.8%) | VWR International, Darmstadt, Germany | 20104.447 | |
| Coomassie Blue G-250 (10 g) | Biozym Scientific, Hessisch Oldendorf, Germany | 902120 | |
| His-Spin Protein Miniprep kit | Zymo Research Europe, Freiburg, Germany | P2002 | Product also distributed by Zymo Research Corporation, Irvine, USA |
| Trizma Base | Sigma-Aldrich, St. Louis, USA | T1503 | |
| Hydrochloric acid | Sigma-Aldrich, St. Louis, USA | H1758 | |
| Glycerol, 99% | VWR International, Darmstadt, Germany | 24397.296DB | |
| CentriPure Z25 mini spin columns | Genaxxon bioscience, Ulm, Germany | CP-0205-Z100 | |
| Sodium chloride | Sigma-Aldrich, St. Louis, USA | S9888 | |
| Concentrator 5301 | Eppendorf, Hamburg, Germany | 5301 000.210 | |
| 2xYT | MP biomedicals, Santa Ana, USA | 113012032 | |
| Bacto-Agar | BD Diagnostics, Franklin Lakes, USA | 214010 | |
| Bead-beating tubes (polypropylene microvials) | Biospec, Bartlesville, USA | 522S | |
| Beads, 0.1 mm dia. | Biospec, Bartlesville, USA | 11079101 | |
| BL21 Rosetta 2 E. coli strain | Merck, Darmstadt, Germany | 71402 | |
| Bradford BSA protein assay Kit | Bio-Rad, München, Germany | 500-0201 | |
| Chloramphenicol | Sigma-Aldrich, St. Louis, USA | C1919 | |
| Cuvettes, 1.5 ml | Thermo Fisher Scientific, Waltham, USA | 14-955-127 | |
| DTT | Sigma-Aldrich, St. Louis, USA | D0632 | |
| Micro Bio-Spin Chromatography Columns | Bio-Rad, München, Germany | 732-6204 | |
| Nunc 384-well optical bottom plates | Thermo Fisher Scientific, Waltham, USA | 142761 | |
| Nunc sealing tape | Thermo Fisher Scientific, Waltham, USA | 232701 | |
| PEG-8000 | Promega, Madison, USA | V3011 | |
| Potassium phosphate dibasic solution | Sigma-Aldrich, St. Louis, USA | P8584 | |
| Potassium phosphate monobasic solution | Sigma-Aldrich, St. Louis, USA | P8709 | |
| Slide-A-Lyzer dialysis cassettes, 10k MWCO (Kit) | Thermo Fisher Scientific, Waltham, USA | 66382 | |
| Spermidine | Sigma-Aldrich, St. Louis, USA | 85558 | |
| 1 L centrifuge bottle | Beckman-Coulter, Brea, USA | A98813 | |
| 4 L Erlenmeyer flask | Kimble Chase, Vineland (NJ), USA | 26500-4000 | |
| Avanti J-26XP centrifuge | Beckman-Coulter, Brea, USA | 393127 | Or equivalent centrifuge able to centrifuge 1 L bottles. |
| Forma 480 orbital shaker | Thermo Fisher Scientific, Waltham, USA | 480 | Or equivalent shaker able to shake chest-size 6 x 4 L . |
| JLA-8.1000 rotor | Beckman-Coulter, Brea, USA | 363688 | Or equivalent 5,000 x g rotor for the centrifuge above, able to centrifuge 1 L bottles. |
| Mini-Beadbeater-1 | Biospec, Bartlesville, USA | 3110BX | |
| Microfuge 22R refrigerated microcentrifuge | Beckman-Coulter, Brea, USA | 368831 | Or equivalent centrifuge able to centrifuge 2 ml reaction tubes. |
| Heating block HLC HBT 130 | Labexchange, Burladingen, Germany | 24465 | Or equivalent heating block able to heat samples in reaction tubes up to 100 °C. |
| Eppendorf MiniSpin centrifuge | Eppendorf, Hamburg, Germany | 5452000018 | Or equivalent centrifuge able to centrifuge 2 ml reaction tubes. |
| IKA Vortex 3 (4 mm orbital shaker diameter, 0 - 2,500 rpm) | Sigma-Aldrich, St. Louis, USA | Z654760 | Or equivalent vortex. |
| Scotsman AF103 ice flaker machine | Kälte-Berlin, Berlin, Germany | AF103 | Or equivalent ice flaker machine. |
| MyTemp mini digital incubator | Sigma-Aldrich, St. Louis, USA | Z763314 | Or equivalent incubator able to heat samples at 29 °C. |
| EcoCell electrophoresis cell / chamber | Anamed Elektrophorese, Groß-Bieberau / Rodau, Germany | AN12005 | Or equivalent electrophoresis chamber able to perform vertical gel electrophoresis with the above precast gels or other gels used. |
| Power-phor power supply for electrophoresis cell / chamber | Anamed Elektrophorese, Groß-Bieberau / Rodau, Germany | AN12001 | Or equivalent power supply able to supply above used electrophoresis cell / chamber with power |
| VWR Signature Ergonomic High Performance Single-Channel Variable Volume Pipettors Starter Kit 1 | VWR International, Darmstadt, Germany | 613-5278 | Or equivalent micropipettes enabling to pipette similar volumes with the same precision |
| VWR Signature Ergonomic High Performance Single-Channel Variable Volume Pipettors Starter Kit 2 | VWR International, Darmstadt, Germany | 613-5279 | Or equivalent micropipettes enabling to pipette similar volumes with the same precision |
| Pipetman Tips Diamond D10ST (0.1 - 10 µl) | Gilson, Middleton, USA | F171101 | Or equivalent low-binding pipette tips enabling to pipette similar volumes with the same precision |
| Pipetman Tips Diamond D200ST (2 - 200 µl) | Gilson, Middleton, USA | F171301 | Or equivalent low-binding pipette tips enabling to pipette similar volumes with the same precision |
| Pipetman Tips Diamond D1000ST (100 - 1,000 µl) | Gilson, Middleton, USA | F171501 | Or equivalent low-binding pipette tips enabling to pipette similar volumes with the same precision |
| 50 ml centrifuge tubes with screw caps (sterile) | VWR International, Darmstadt, Germany | 50-0156 | |
| 15 ml centrifuge tubes with screw caps (sterile) | VWR International, Darmstadt, Germany | 525-0150 | |
| 14 ml polypropylene tubes (round bottom, two-position vent stopper, sterile) | Greiner Bio-One, Frickenhausen, Germany | 187262 | |
| Discovery BIO Wide Pore C5 HPLC Column (3 µm particle size, L x I.D. 10 cm x 2.1 mm) | Sigma-Aldrich, St. Louis, USA | 567227-U | |
| Agilent 1260 HPLC machine | Agilent Technologies, Santa Clara, USA | G1312B | |
| 6500 Series Accurate-Mass Quadrupole Time-of-Flight (Q-TOF) LC/MS | Agilent Technologies, Santa Clara, USA | G6530BA | |
| Acetonitrile | Sigma-Aldrich, St. Louis, USA | 270717 | |
| FLUOstar Omega microplate reader | BMG Labtech, Ortenberg, Germany | 415-101 | Or equivalent microplate reader able to measure the fluorescence of the expressed model protein |
| Hanna Checker pH meter | Sigma-Aldrich, St. Louis, USA | Z351091 | |
| Formic acid eluent additive for LC-MS | Sigma-Aldrich, St. Louis, USA | 56302 |
参考文献
- Böck, A., et al. Selenocysteine: the 21st amino acid. Mol. Microbiol. 5 (3), 515-520 (1991).
- Srinivasan, G., James, C. M., Krzycki, J. A. Pyrrolysine Encoded by UAG in Archaea: Charging of a UAG-Decoding Specialized tRNA. Science. 296 (5572), 1459-1462 (2002).
- Budisa, N. Prolegomena to Future Experimental Efforts on Genetic Code Engineering by Expanding Its Amino Acid Repertoire. Angew. Chem. Int. Ed. Engl. 43, 6426-6463 (2004).
- Wang, L., Xie, J., Schultz, P. G. Expanding the Genetic Code. Annu. Rev. Biophys. Biomol. Struct. 35, 225-249 (2006).
- Chin, J. W. Expanding and Reprogramming the Genetic Code of Cells and Animals. Annu. Rev. Biochem. 83, 379-408 (2014).
- Neumann, H. Rewiring translation - Genetic code expansion and its applications. FEBS Lett. 586 (15), 2057-2064 (2012).
- Liu, C. C., Schultz, P. G. Adding New Chemistries to the Genetic Code. Annu. Rev. Biochem. 79, 413-444 (2010).
- Goerke, A. R., Swartz, J. R. High-Level Cell-Free Synthesis Yields of Proteins Containing Site-Specific Non-Natural Amino Acids. Biotechnol. Bioeng. 102 (2), 400-416 (2009).
- Albayrak, C., Swartz, J. R. Cell-free co-production of an orthogonal transfer RNA activates efficient site-specific non-natural amino acid incorporation. Nucleic Acids Res. 41 (11), 5949-5963 (2013).
- Johnson, J. A., Lu, Y. Y., Van Deventer, J. A., Tirrell, D. A. Residue-specific incorporation of non-canonical amino acids into proteins: recent developments and applications. Curr. Opin. Chem. Biol. 14 (6), 774-780 (2010).
- Xiu, X., Puskar, N. L., Shanata, J. A. P., Lester, H. A., Dougherty, D. A. Nicotine binding to brain receptors requires a strong cation-pi interaction. Nature. 458 (7237), 534-537 (2009).
- Grünewald, J., et al. Mechanistic studies of the immunochemical termination of self-tolerance with unnatural amino acids. Proc. Natl. Acad. Sci. USA. 106 (11), 4337-4342 (2009).
- Nikić, I., Lemke, E. A. Genetic code expansion enabled site-specific dual-color protein labeling: superresolution microscopy and beyond. Curr. Opin. Chem. Bio. 28, 164-173 (2015).
- Munier, R., Cohen, G. N. Incorporation d'analogues structuraux d'aminoacides dans les protéines bactériennes. Biochim. Biophys. Acta. 21 (3), 592-593 (1956).
- Lepthien, S., Merkel, L., Budisa, N. In Vivo Double and Triple Labeling of Proteins Using Synthetic Amino Acids. Angew. Chem. Int. Ed. 49 (32), 5446-5450 (2010).
- Dieterich, D. C., Link, A. J., Graumann, J., Tirrell, D. A., Schuman, E. M. Selective identification of newly synthesized proteins in mammalian cells using bioorthogonal noncanonical amino acid tagging (BONCAT). Proc. Natl. Acad. Sci. USA. 103 (25), 9482-9487 (2006).
- Dieterich, D. C., et al. In situ visualization and dynamics of newly synthesized proteins in rat hippocampal neurons. Nat. Neurosci. 13 (7), 897-905 (2011).
- Hendrickson, W. A., Horton, J. R., LeMaster, D. M. Selenomethionyl proteins produced for analysis by multiwavelength anomalous diffraction (MAD): a vehicle for direct determination of three-dimensional structure. EMBO J. 9 (5), 1665-1672 (1990).
- Hoesl, M. G., et al. Lipase Congeners Designed by Genetic Code Engineering. ChemCatChem. 3 (1), 213-221 (2011).
- Bae, J. H., et al. Expansion of the Genetic Code Enables Design of a Novel "Gold" Class of Green Fluorescent Proteins. J. Mol. Biol. 328 (5), 1071-1081 (2003).
- Schachtele, C. F., Rogers, P. Canavanine death in Escherichia coli. J. Mol. Biol. 14 (2), 474-489 (1965).
- Rosenthal, G. A. The biological effects and mode of action of L-canavanine, a structural analogue of L-arginine. Q. Rev. Biol. 52 (2), 155-178 (1977).
- Rosenthal, G. A., Dahlman, D. L. Incorporation of L-Canavanine into Proteins and the Expression of Its Antimetabolic Effects. J. Agric. Food Chem. 39 (5), 987-990 (1991).
- Ishida, Y., Park, J. H., Mao, L., Yamaguchi, Y., Inouye, M. Replacement of All Arginine Residues with Canavanine in MazF-bs mRNA Interferase Changes Its Specificity. J. Biol. Chem. 288 (11), 7564-7571 (2013).
- Thomas, D. A., Rosenthal, G. A., Gold, D. V., Dickey, K. Growth Inhibition of a Rat Colon Tumor by L-Canavanine. Cancer Res. 46 (6), 2898-2903 (1986).
- Bence, A. K., Worthen, D. R., Adams, V. R., Crooks, P. A. The antiproliferative and immunotoxic effects of L-canavanine and L-canaline. Anticancer Drugs. 13 (3), 313-320 (2002).
- Bence, A. K., Crooks, P. A. The Mechanism of L-Canavanine Cytotoxicity: Arginyl tRNA Synthetase as a Novel Target for Anticancer Drug Discovery. J. Enzyme Inhib. Med. Chem. 18 (5), 383-394 (2003).
- Akaogi, J., et al. Role of non-protein amino acid L-canavanine in autoimmunity. Autoimmun. Rev. 5 (6), 429-435 (2006).
- Singh-Blom, A., Hughes, R. A., Ellington, A. D. An amino acid depleted cell-free protein synthesis system for the incorporation of non-canonical amino acid analogs into proteins. J. Biotechnol. 178, 12-22 (2014).
- Oh, S. -. J., Lee, K. -. H., Kim, H. -. C., Catherine, C., Yun, H., Kim, D. -. M. Translational Incorporation of Multiple Unnatural Amino Acids in a Cell-free Protein Synthesis System. Bioprocess. Eng. 19 (3), 426-432 (2014).
- Worst, E. G., Exner, M. P., De Simone, A., Schenkelberger, M., Noireaux, V., Budisa, N., Ott, A. Cell-free expression with the toxic amino acid canavanine. Bioorg. Med. Chem. Lett. 25 (17), 3658-3660 (2015).
- Shin, J., Noireaux, V. Efficient cell-free expression with the endogenous E. Coli RNA polymerase and sigma factor 70. J. Biol. Eng. 4 (8), (2010).
- Chemla, Y., Ozer, E., Schlesinger, O., Noireaux, V., Alfonta, L. Genetically expanded cell-free protein synthesis using endogenous pyrrolysyl orthogonal translation system. Biotechnol. Bioeng. 112 (8), 1663-1672 (2015).
- Sun, Z. Z., Hayes, C. A., Shin, J., Caschera, F., Murray, R. M., Noireaux, V. Protocols for Implementing an Escherichia coli Based TX-TL Cell-Free Expression System for Synthetic Biology. J. Vis. Exp. (79), e50762 (2013).
- Caschera, F., Noireaux, V. Preparation of amino acid mixtures for cell-free expression systems. Biotechniques. 58 (1), 40-43 (2015).
- Green, M. R., Sambrook, J. . Molecular Cloning: A Laboratory Manual. , (2012).
- Froger, A., Hall, J. E. Transformation of Plasmid DNA into E. coli Using the Heat Shock Method. J. Vis. Exp. (6), e253 (2007).
- Zhang, S., Cahalan, M. D. Purifying Plasmid DNA from Bacterial Colonies Using the Qiagen Miniprep Kit. J. Vis. Exp. (6), e247 (2007).
- Moreno, L. A., Cox, K. L. Quantification of dsDNA using the Hitachi F-7000 Fluorescence Spectrophotometer and PicoGreen Dye. J. Vis. Exp. (45), e2465 (2010).
- Desjardins, P., Conklin, D. NanoDrop Microvolume Quantitation of Nucleic Acids. J. Vis. Exp. (45), e2699 (2010).
- Sukumaran, S. Concentration Determination of Nucleic Acids and Proteins Using the Micro-volume Bio-spec Nano Spectrophotometer. J. Vis. Exp. (48), e2699 (2011).
- Laemmli, U. K. Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Hochuli, E., Bannwarth, W., Döbeli, H., Gentz, R., Stüber, D. Genetic Approach to Facilitate Purification of Recombinant Proteins with a Novel Metal Chelate Adsorbent. Nature Biotechnology. 6 (11), 1321-1325 (1988).
- Schägger, H., Aquila, H., Von Jagow, G. Coomassie blue-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for direct visualization of polypeptides during electrophoresis. Anal. Biochem. 173 (1), 201-205 (1988).
- Bradford, M. M. A Rapid Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding. Anal Biochem. 72, 248-254 (1976).
- Ernst, O., Zor, T. Linearization of the Bradford Protein Assay. J. Vis. Exp. (38), e1918 (2010).
- Banerjee, S., Mazumdar, S. Electrospray Ionization Mass Spectrometry: A Technique to Access the Information beyond the Molecular Weight of the Analyte. Int. J. Anal. Chem. 2012, 1-40 (2012).
- Fujiwara, K., Nomura, S. M. Condensation of an additive-free cell extract to mimic the conditions of live cells. PLoS One. 8 (1), e54155 (2013).
- Zhang, Z., Marshall, A. G. A universal algorithm for fast and automated charge state deconvolution of electrospray mass-to-charge ratio spectra. J. Am. Soc. Mass. Spectrom. 9 (3), 225-233 (1998).
- Li, X., Zhang, G., Ngo, N., Zhao, X., Kain, S. R., Huang, C. C. Deletions of the Aequorea victoria Green Fluorescent Protein Define the Minimal Domain Required for Fluorescence. J. Biol. Chem. 272 (45), 28545-28549 (1997).
- Gagoski, D., Polinkovsky, M. E., Mureev, S., Kunert, A., Johnston, W., Gambin, Y., Alexandrov, K. Performance benchmarking of four cell-free protein expression systems. Biotechnol. Bioeng. 113 (2), 292-300 (2016).
- Shin, J., Noireaux, V. An E. coli Cell-Free Expression Toolbox: Application to Synthetic Gene Circuits and Artificial Cells. ACS Synth. Biol. 1 (1), 29-41 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved