Method Article
إعداد والثقافة من الخلايا عضلي السلائف / Myoblasts الابتدائية من العضلات الهيكلية من الكبار والمسنين البشر
In This Article
Summary
يصف هذا البروتوكول وسيلة قوية، يمكن استنساخه وبسيطة من العزلة والثقافة من الخلايا بالخلايا العضلية الجذعية السلف من العضلات والهيكل العظمي من الكبار والمسنين. وتشمل العضلات المستخدمة هنا القدم وعضلات الساق. هذا النهج يمكن عزل السكان المخصب من myoblasts الأولية للدراسات وظيفية.
Abstract
الهيكل العظمي توازن العضلات يعتمد على نمو العضلات (تضخم)، وضمور والتجدد. أثناء الشيخوخة وفي العديد من الأمراض، يحدث تلف العضلات. ويرتبط فقدان كتلة العضلات وظيفة مع نوع من الألياف ضمور العضلات، نوع من الألياف التبديل، معيبة تجديد العضلات المرتبطة خلل في الخلايا الأقمار الصناعية، والخلايا الجذعية العضلية، والعمليات الفيزيولوجية المرضية الأخرى. وترتبط هذه التغييرات مع التغييرات في داخل الخلايا وكذلك المنافذ المحلية والنظامية. بالإضافة إلى نماذج القوارض الأكثر شيوعا للشيخوخة العضلات، وهناك حاجة لدراسة توازن العضلات والهزال باستخدام نماذج الإنسان، التي بسبب الآثار الأخلاقية، وتتألف في الغالب من في المختبر الثقافات. وعلى الرغم من الاستخدام الواسع لخلايا الإنسان عضلي السلف (البلدان المتوسطية الشريكة) وmyoblasts الأولية في تكون العضل، هناك بيانات محدودة عن استخدام بالخلايا العضلية الجذعية الابتدائي وmyotube مركزيا الثقافات الإنسانية لدراسة الآليات الجزيئية التي تنظم جوانب مختلفة من المصحف المرتبط بالعمرشركة كلي الهزال، والمساعدة في التحقق من صحة آليات الشيخوخة المقترحة في العضلات القوارض. استخدام البلدان المتوسطية الشريكة الإنسان، myoblasts الأولية وmyotubes معزولة عن الكبار والذين تتراوح أعمارهم بين الناس، ويقدم نموذجا ذات الصلة من الناحية الفسيولوجية من الآليات الجزيئية من العمليات المرتبطة نمو العضلات، وضمور والتجدد. نحن هنا تصف بالتفصيل بروتوكول قوي وغير مكلفة، يمكن استنساخه وكفاءة لعزل وصيانة البلدان المتوسطية الشريكة الإنسان ولها ذرية - myoblasts وmyotubes من عينات العضلات البشرية باستخدام الهضم الأنزيمي. وعلاوة على ذلك، فقد قررنا عدد مرور الذي myoblasts الأولية من الكبار والمسنين تخضع الشيخوخة في ثقافة في المختبر. وأخيرا، وتبين لنا القدرة ل transfect هذه myoblasts والقدرة على تميز التكاثري والتمايز قدراتها واقتراح ملاءمتها لإجراء الدراسات الفنية من الآليات الجزيئية لتكون العضل والعضلات تضييع في المختبر.
Introduction
فقدان Disease- والمرتبطة بالعمر التدريجي للكتلة وظيفة النتائج الهيكل العظمي والعضلات في الضعف، وانخفاض في القوة وانخفاض في نوعية حياة المسنين. حسابات العضلات والهيكل العظمي لحوالي 40٪ كتلة الجسم 1. أثناء الشيخوخة والمرض، وضمور تدريجي للmyofibers الفردية والحد من نوعية العضلات بسبب تسلل الدهون وتليف يحدث 1، 2، 3، 4، 5، 6. في الآونة الأخيرة، وقد اقترح أن الاختلافات بين الأنواع في شيخوخة العضلات والهيكل العظمي تحدث، وتحديدا تلك الخسارة الألياف العضلية التي تحدث في القوارض، قد لا يحدث في البشر (7). ومع ذلك، وتتميز ألياف العضلات المتبقية من الثدييات تتراوح أعمارهم من زيادة التعرض للتلف وتجديد ضعف 8. وتتوسط إصلاح العضلات الكبار والصيانة عن طريق الخلايا الأقمار الصناعية 9 و 10. على اصابة في العضلات والعظة الأخرى ذات الصلة، تصبح الخلايا الأقمار الصناعية تنشيط وتتكاثر. مجموعة فرعية من الخلايا ترجع إلى حالة سكون والباقي تقدم إلى myoblasts (خلايا عضلي السلف - المتوسطية الشريكة). هذه المساهمة في إصلاح من ليف عضلي القائمة 11. وظائف الخلايا الأقمار الصناعية تحدد نجاح تجديد العضلات والتغييرات في توافر خلية الأقمار الصناعية مع الشيخوخة أثبتت 12، 13، 14، 15. وعلاوة على ذلك، الخلايا الأقمار الصناعية من العضلات من البشر القديمة والقوارض تظهر تبديل الملف الشخصي النسخي وخفضت التجدد احتمال 16، 17، 18 و 19. كما تبين القمر خلايا العضلات من الفئران القديمة والبشر على الخضوع الشيخوخة مما أدى إلى انخفاض وظائفها 20.
خط الخلية الأكثر رسوخا مما يتيح دراسة توازن العضلات C2C12 الفئران خط الخلية 21. وتستخدم كمية كبيرة من الدراسات أيضا myoblasts الأولية الفئران 22. وقد أدت هذه الثقافات إلى فهم كبير من الفئران وتكون العضل الفقاريات وكذلك تجديد العضلات، وضمور myotube مركزيا / ليف عضلي، وعمليات تضخم تحدث أثناء أمراض العضلات والشيخوخة 23، 24، 25، 26. وفي الآونة الأخيرة، وقد وصفت العديد من المجموعات باستخدام myoblasts الأولية الإنسان لدراسة تكون العضل والشيخوخة العضلات. ومع ذلك، هناك عدم توافق في الآراء مع ريغارس الخلافات بين myoblasts الأولية معزولة عن العضلات من الكبار والبشر الذين تتراوح أعمارهم بين 27، 28، 29، 30، 31. وعلى الرغم من الاختلافات تميز في البيئة النظامية والمحلية التي تحدث خلال تطوير والشيخوخة والمرض 6، 32، 33، 34، في لا تزال المختبر بالخلايا العضلية الجذعية وmyotube مركزيا الثقافات الأدوات التي يمكن الوصول إليها لدراسة الآليات الجزيئية المرتبطة تنمية العضلات والنمو وضمور. بالإضافة إلى ذلك، توفر هذه الدراسات ليس فقط قوية، ولكن أيضا سريعة نسبيا وغير مكلفة وعالية الإنتاجية في أداة المختبر. وعلاوة على ذلك، الآثار الأخلاقية المرتبطة دراسات عضلات الإنسان تعني أن للتجارب الفنية التي تنطوي على التلاعب في التعبير الجيني لا تزال في المختبر الإنسان بالخلايا العضلية الجذعية وmyotube مركزيا الثقافات البديل الوحيد المتاح للكائنات نموذج الفقاريات.
هنا، وتبين لنا بروتوكول تجريبي بسيط لعزل قوية وغير مكلفة، وقابلة للتكرار من myoblasts الأولية، أو البلدان المتوسطية الشريكة، من العضلات الكبار والمسنين ووصف الظروف موحدة للثقافة في المختبر (الشكل 1). كما الثقافات الأولية من العضلات عادة ما تحتوي على الخلايا الليفية بالإضافة إلى myoblasts، ونحن نوصي خطوة preplating تهدف إلى تحسين نقاء وجودة myoblasts الأولية. لتلخيص، أنشأنا بروتوكول يسمح للعزلة فعالة وقابلة للتكرار، والثقافة، والدراسات الفنية من البلدان المتوسطية الشريكة / myoblasts الأولية المخصب وظيفية من العضلات والهيكل العظمي من الكبار والمسنين.
Protocol
تمت الموافقة على جميع التجارب التي تنطوي على الأنسجة البشرية الموصوفة هنا مقدما من قبل جامعة ليفربول، جامعة مستشفى Aintree وجنوب غرب ويلز بحوث جنة الأخلاقيات (الموافقة رقم: 13 / WA / 0374) تم تنفيذ والتجارب وفقا لإرشادات الممارسات الجيدة. جامعة ليفربول تصرفت كما ترعى الأخلاق لهذه الدراسة. ونظرا لجميع الجهات المانحة الموافقة المسبقة للالتحاق هذه الدراسة. تم عزل العضلات من الناس (BMI <25): الكبار: 30 ± 2.8 سنة، والذين تتراوح أعمارهم بين 69 ± 5 سنوات من العمر.
1. إعداد للثقافة
- طلاء للثقافة السطوح مع laminin
- يعد حل العاملة من 10 ميكروغرام / مل من laminin في 1X DPBS (Dulbecco والفوسفات مخزنة المالحة).
- ماصة الحد الأدنى من حل laminin لتغطية كامل سطح على الخلايا التي هي على وشك أن مطلي (الجدول 1). احتضان رانه ثقافة طبق لا يقل عن 30 دقيقة في ترطيب 37 درجة مئوية، و 5٪ CO 2 حاضنة قبل طلاء الخلايا. التعامل مع laminin بعناية، وتجنب استخدام دوامة. الحل العاملة من 10 ميكروغرام / مل laminin مخففة في DPBS يمكن تخزين عند 4 درجات مئوية وإعادة استخدامها عدة مرات.
- استخدام 60 ملم (20 سم 2) طبق بتري أو 2 بئر في لوحة 6 جيدا (2 × 10 سم 2) في ~ 18-19 ملغ من العضلات والهيكل العظمي لوحة الخلايا (5.50 × 10 4 خلايا في المجموع). أداء عد الخلايا في جميع الأوقات عند طلاء الخلايا للدراسات وظيفية.
وقد تم الحصول على عينات أصلا من جراحات القدم (باسطة خنصر اليد، الأمامية الظنبوبي أو أباهيم قدمية الخاطف عضلات) من المريضات (الكبار: 30 ± 2.8 سنة، الذين تتراوح أعمارهم بين 69 ± 5 سنوات من العمر، BMI <25) ملاحظة.
- إعداد الحل الأنزيمي
- إعداد 250 ملي CaCl حل 2 العمل: 277 ملغ من الأسهم CaCl 2 في 10 مل 1X DPBS. تصفية ماlution مع غشاء 0.2 ميكرون تصفية وتخزينها في 4 درجات مئوية.
- يعد حل العاملة من 1.5 U / مل من كولاجيناز D، و 2.4 U / مل من Dispase الثاني و 2.5 ملي CaCl 2 في DMEM المصل خالية (التعديل النسر Dulbecco ووالمتوسطة) (الجدول 2).
- تخلط جيدا وتصفية حل الأنزيمية عبر غشاء 0.2 ميكرون فلتر لتعقيم. إعداد الحل الأنزيمية مقدما وتجميد أسفل (-20 درجة مئوية) في قسامات لاستخدامها في المستقبل.
2. الأنسجة الهضم: الميكانيكية والأنزيمية التفكك
- بعد جمع العينة، والحفاظ على العضلات في 4 درجات مئوية في DPBS حتى الهضم. إعداد حجم الحد الأدنى من 2 مل من كولاجيناز-dispase-CaCl 2 الحل في 18-19 ملغ من الأنسجة العضلية ودافئة إلى 37 درجة مئوية قبل تفكك الأنسجة.
- تزج خزعة العضلات لفترة وجيزة في الايثانول 70٪، ويغسل DPBS الطازجة ووضع الأنسجة في طبق بتري جديد مع 1 مل من الأنزيميةحل.
- تجاهل الكثير من أنسجة متليفة والدهون قدر الإمكان وتمزق العضلات بسرعة ولكن بلطف الى قطع صغيرة ولكن يمكن تمييزها (حوالي> 0.5 ملم 2) مع مقص معقم أو مشرط جراحي (شفرة رقم 10).
- نقل العينة إلى أنبوب 50 مل مع 1 مل المتبقية من كولاجيناز-dispase-CaCl 2.
- احتضان الأنسجة عند 37 درجة مئوية تصل إلى 30 - 40 دقيقة. نقل الأنسجة العضلية من خلال استثارة بلطف أنبوب كل 5-10 دقيقة.
- معطف ماصات مع وسائل الإعلام لتجنب التصاق الخلايا نشرت على الجدران البلاستيكية من الماصات. إضافة 2 مجلدات من متوسط النمو العقيمة، على سبيل المثال، 4 مل من DMEM 20٪ FBS (مصل بقري جنيني)، 1٪ L-الجلوتامين و 1٪ P / S (البنسلين، الستربتوميسين)، لوقف عملية الهضم.
- الماصة صعودا وهبوطا عدة مرات مع 5 مل ماصة للمساعدة في الافراج عن الخلايا من الألياف العضلية.
ملاحظة: عادة ما يتم فصلها تماما العينة نظرا لصغر حجمها. However، إذا أجزاء من العضلات لا تزال، واستخدام حضانة الثانية مع القطع المتبقية من العضلات ومع حل الأنزيمية جديدة. - تصفية حل العضلات من خلال مصفاة الخلية 70 ميكرومتر على أنبوب مخروطي 50 مل. غسل الخلايا المتبقية مع المزيد من وسائل الاعلام ومرشح من خلال مصفاة.
- أجهزة الطرد المركزي في 443 x ج لمدة 5 دقائق على RT لخلايا بيليه. تجاهل طاف بعناية.
- حل بيليه إلى F-12 وسائل الإعلام (F-12 المغذيات مزيج لحم الخنزير)، و 20٪ FBS، 10٪ HS (الحصان المصل)، 1٪ P / S، 1٪ α الجلوتامين و 2.5 نانوغرام / مل من جمعية جيل المستقبل-ب ( المؤتلف الإنسان الأساسية الخلايا الليفية عامل النمو). هنا، استخدام 4 مل من وسائل الاعلام في 60 مم طبق بيتري.
3. البذر من الخلايا
- جمع سفينة الثقافة المغلفة سابقا مع 10 ميكروغرام / مل laminin من الحاضنة (القسم 1.1).
- إزالة بعناية تتجاوز laminin من الطبق الثقافة، وتجنب لمس السطح (أو أنها ستفسد بنية البروتين). غسلالطبق الثقافة مع DPBS (اختياري).
- لوحة الخلايا مباشرة على متن السفينة laminin المغلفة واحتضان لمدة 24 ساعة في ترطيب 37 درجة مئوية، و 5٪ CO 2 الحاضنة.
- تصور الخلايا تحت المجهر مشرق الميدان (100X مجموع التكبير) في اليوم التالي. جولة خلايا صغيرة تعلق على السطح ويمكن رؤية الحطام المتبقي في وسائل الإعلام والثقافة.
- تغيير وسائل الإعلام إلى الطازج F-12 وسائل الإعلام تستكمل مع FBS 20٪، 10٪ HS، 1٪ P / S، 1٪ α الجلوتامين و 2.5 نانوغرام / مل من جمعية جيل المستقبل-ب.
4. الثقافة والركض للخلايا
- تغيير وسائل الاعلام كل 2-3 د وتقسيم الخلايا في أقرب وقت مجموعات من الخلايا مرئية تحت المجهر (100X التكبير الكلي، مثلا في الشكل 2، الخلايا من الناس الذين تتراوح أعمارهم بين، مرور 0 بعد 7 د) من أجل تجنب عفوية التفاضل.
- في الممر الأول (P1)، وتغيير وسائل الإعلام إلى DMEM عالية الجلوكوز تستكمل مع FBS 20٪، 10٪ HS، 1٪P / S، 1٪ α الجلوتامين. تجنب استخدام جمعية جيل المستقبل-ب من هذه النقطة، وجمعية جيل المستقبل هو mitogen قويا وعاملا مهما في بداية ثقافة، ولكنها يمكن أن تعزز الخلايا الليفية فرط إذا استخدمت لفترة أطول في الثقافة.
- لالركض الخلايا:
- إزالة وسائل الإعلام وغسل الخلايا مرتين مع DPBS.
- إضافة حجم الحد الأدنى من 0.25٪ EDTA-التربسين لتغطية سطح الخلايا. صخرة بلطف لضمان تغطية جميع الخلايا عن طريق الحل مفرزة، واحتضان لمدة 10 ثانية في درجة حرارة الغرفة، وإزالته.
- احتضان خلايا في ترطيب 37 درجة مئوية، و 5٪ CO 2 حاضنة لل3-5 دقيقة. اضغط بلطف والاختيار تحت المجهر الضوء الساطع (100X مجموع التكبير) أن الخلايا يتم تقريب ولكن ليس فصل تماما من على سطح الأرض. إذا لوحظ أي تغيير في الخلايا، واحتضان لمدة 5 دقائق أكثر.
- إضافة 5 مل من النمو المتوسطة (ارتفاع الجلوكوز DMEM تستكمل مع FBS 20٪، 10٪ HS، 1٪ P / S، 1٪ α الجلوتامين) لجمع الخلايا، مزيجكذلك ونقل الخلايا مع وسائل الإعلام الجديدة في قارورة T75. غسل الخلايا المتبقية تكرار هذه الخطوة مع آخر 5 مل من النمو المتوسطة (10 مل في مجموع لقارورة T75 واحد).
- لpreplate (الأفضل في الممر الأول)، واحتضان خلايا في ترطيب 37 درجة مئوية، و 5٪ CO 2 الحاضنة لمدة 40 دقيقة. جمع طاف مع الخلايا التي لم تعلق واحتضان لهم في قارورة T75 الجديدة. وهذا ينبغي إثراء الثقافة في myoblasts، حيث أن معظم الخلايا الليفية يجب أن تعلق في القارورة الأولى.
- تغيير وسائل الاعلام كل 2-3 د وتقسيم الخلايا 1-4 بمجرد أن تصل إلى 70٪ confluency لأقصى قدر من العائد.
- للتمايز، وبمجرد أن خلايا صلت 70-80٪ confluency، تغيير ثقافة المتوسط إلى متوسطة التمايز (DM): DMEM عالية الجلوكوز تستكمل مع 2٪ HS، 1٪ P / S، 1٪ α الجلوتامين. ينبغي التمييز بين الخلايا داخل 5-7 د اعتمادا على جودة ونقاء بالخلايا العضلية الجذعية جulture.
5. بروتوكول تعداء
- البذور 50000 خلية / بئر في لوحة 12-جيدا لMF 20، الشيخوخة وقدرتها على البقاء المقايسات. ثقافة الخلايا على زلات غطاء أو في طبق المغلفة مع laminin. لKi67 تلطيخ، البذور 25000 خلية / بئر في لوحة ال 12 أيضا.
- لتعداء، اتبع الإجراء الخاص بالشركة المصنعة باستخدام 5 ميكرولتر من كاشف ترنسفكأيشن، و 100 نيوتن متر من السيطرة الرنا الميكروي تقليد أو المانع، و 100 نيوتن متر من الرنا الميكروي تقليد أو 100 نيوتن متر من المانع الرنا الميكروي لكل بئر، مع إجمالي حجم 1 مل.
- تغيير متوسطة التمايز 6 ساعات بعد ترنسفكأيشن (ارتفاع الجلوكوز DMEM تستكمل مع 2٪ HS، 1٪ P / S، 1٪ α الجلوتامين). للتجارب انتشار الأسلحة النووية، وصمة عار على الخلايا 2 د بعد ترنسفكأيشن. لالشيخوخة، 7 أيام بعد ترنسفكأيشن. ولتلطيخ MF20، بعد سبعة أيام ترنسفكأيشن.
6. المناعية للخلايا
- Ki67، MyoD وMF 20 المناعية
- إعداد كتلة 1 (10HS٪ و 0.1٪ تريتون-X في برنامج تلفزيوني) ومنع 2 (10٪ HS و 0.05٪ تريتون-X في الحلول PBS). استخدام 500 ميكرولتر من كاشف لكل بئر لوحة 12-جيدا.
ملاحظة: تنفيذ الخطوات التالية باستخدام شاكر للخطوات الحضانة. - إزالة وسائل الإعلام من الخلايا.
- شطف الخلايا مع برنامج تلفزيوني.
- إصلاح الخلايا مع الميثانول البارد لمدة 10 دقيقة على الكرسي الهزاز.
- إزالة الميثانول من الخلايا وشطف 3X مع برنامج تلفزيوني لمدة 5 دقائق في كل مرة.
- إضافة كتلة 1 الحل واحتضان الخلايا على الروك في RT لمدة 1 ساعة.
- إضافة حل الأجسام المضادة الأولية: لKi67 تلطيخ، استخدم الأرنب ماب لKi67 (1: 1000 تخفيف في كتلة 2)؛ لMyoD، استخدم MyoD1 (D8G3) XP الأرنب ماب (1: 100 التخفيف في كتلة 2)؛ لMF 20 تلطيخ، واستخدام MYH1E (MF 20) الأجسام المضادة الأولية (DSHB، 1: 1000 تخفيف في كتلة 2).
- احتضان الخلايا مع الأجسام المضادة الأولية لمدة 1 ساعة (RT) إلى O / N (4 درجات مئوية) على الكرسي الهزاز.
- جمع AB الأساسي (يمكن إعادة استخدامها عدة مرات إذا ستوالأحمر في 4 درجة مئوية).
- شطف الخلايا 3X مع برنامج تلفزيوني، 5 دقائق في كل مرة.
- إضافة الضد الثانوية المناسب: لKi67 أو تلطيخ MyoD، الماعز المضادة للأرنب مفتش (H + L) الضد الثانوية، اليكسا فلور 488 المترافقة (1: 1000 تخفيف في برنامج تلفزيوني)؛ لMF 20 تلطيخ والماعز المضادة للماوس مفتش (H + L) الضد الثانوية، اليكسا فلور 488 المترافقة (1: 1000 تخفيف في برنامج تلفزيوني).
- التفاف لوحة تحتوي على الخلايا واحتضان الضد الثانوية لمدة 2 ساعة في الظلام على الروك في RT.
- شطف الخلايا 3X مع برنامج تلفزيوني لمدة 5 دقائق في كل مرة.
- إضافة دابي حل (1: 1000 تخفيف في برنامج تلفزيوني) على الخلايا واحتضان على الروك في RT ل5-10 دقيقة.
- شطف الخلايا 3X مع برنامج تلفزيوني لمدة 5 دقائق في كل مرة.
- إضافة 1 مل من برنامج تلفزيوني جديد.
- تركيب الخلايا على زلات غطاء في حل التركيب أو ختم لوحة تحتوي على الخلايا في برنامج تلفزيوني مع بارافيلم لتجنب التبخر.
- تخزينها في 4 درجات مئوية.
- تصور الخلايا معالمجهر مضان في أقرب وقت ممكن (في موعد لا يتجاوز 2 أسابيع).
- إعداد كتلة 1 (10HS٪ و 0.1٪ تريتون-X في برنامج تلفزيوني) ومنع 2 (10٪ HS و 0.05٪ تريتون-X في الحلول PBS). استخدام 500 ميكرولتر من كاشف لكل بئر لوحة 12-جيدا.
- جدوى الفحص
- إزالة وسائل الإعلام من الخلايا.
- شطف الخلايا في برنامج تلفزيوني.
- إضافة 1: 1000 بروميد إيثيديوم و 1: 1000 البرتقال أكريدين مخففة في برنامج تلفزيوني.
الحذر: خذ الرعاية والعمل ضمن لوائح الصحة والسلامة - بروميد إيثيديوم هو مادة مسرطنة. - التفاف لوحة تحتوي على الخلايا في حل تلطيخ واحتضان في RT على الروك لمدة 5 دقائق.
- التقاط صور للخلايا مع المجهر مضان: قناة الخضراء لأكريدين البرتقالي، القناة الحمراء لبروميد إيثيديوم.
النتائج
وينبغي أن تكون البلدان المتوسطية الشريكة / myoblasts الأولية مرئية 24 ساعة بعد البذر على سطح المغلفة laminin (الشكل 2). هذه الخلايا يجب أن تعتمد على شكل مغزل مثل ويجب أن تعبر عن MyoD لا يزال في مرور 4 (الشكل 1A، B). الليفية يمكن تمييزها من قبل على التشكل النجوم مثل وعدم التعبير عن MyoD (الشكل 1B، C). مرة واحدة هي التي تعلق الخلايا في اليوم التالي، يجب أن يتم استبدال وسائل الإعلام مع وسائل الإعلام bFGF جديدة. يجب أن يتم استبدال وسائل الإعلام ثقافة كل 48 ساعة.
نتائج التمثيلية المعروضة هنا ونشرت بيانات من هدفنا مختبر 22 لدعم عزلتنا والثقافة بروتوكول وإظهار التقنيات المختلفة التي يمكن استخدامها للدراسات وظيفية من myoblasts الأولية الإنسان. انتشار بالخلايا العضلية الجذعية يمكن دراستها باستخدام Ki67 المناعية وجدوى استخدام staininز لفحص سلامة الخلية (الشكل 3). للتمايز، يجب تغيير ثقافة وسائل الإعلام إلى وسائل الإعلام التمايز. يجب Myotubes تشكل في 5-7 د ويكون الميوسين السلسلة الثقيلة الإيجابي (الشكل 3). لاحظ أن تشكيل myotube مركزيا قد تكون أقل فعالية عندما يتم عزل myoblasts من العضلات من الناس الذين تتراوح أعمارهم بين (الشكل 3). ويمكن أيضا أن الشيخوخة (SA-β غالاكتوزيداز) تلطيخ أن يؤديها من أجل إقامة النسبة المئوية للخلايا هرمة في الثقافة (الشكل 3). لاحظنا أن مع الثقافات أطول (الشكل 3، مرور 4)، والمزيد من myoblasts معزولة عن العضلات من الأشخاص الذين تتراوح أعمارهم تظهر الشيخوخة.
للدراسات وظيفية، والتعبير الجيني والرنا الميكروي يمكن التلاعب بها باستخدام تسليم بوساطة الكواشف ترنسفكأيشن محبة للدهون من ناقلات التعبير، الرناوات siRNAs، يقلد الرنا الميكروي وantimiRs (الشكل 4). وهذا يسمح لل40 -70٪ كفاءة ترنسفكأيشن مع مستويات الجين / الرنا الميكروي يجري حتى- أو لأسفل التنظيم ضمن نطاق الفسيولوجية (الشكل 4؛ 22).
| سفينة الثقافة | تقريبا. المنطقة (لكل بئر) | حجم 10 ميكروغرام / مل laminin |
| طبق 35 ملم | 10 سم 2 | 1 مل |
| طبق 60 ملم | 20 سم 2 | 2 مل |
| طبق 100 ملم | 60 سم 2 | 4 مل |
| 24-جيدا لوحة | 2 سم 2 | 200 ميكرولتر / جيد |
| 12-جيدا لوحة | 4 سم 2 | 500 ميكرولتر / جيد |
| 6-جيدا لوحة | 10 سم 2 | 1 مل / جيد |
| T25 | 25 سم 2 | 3 مل |
| T75 | 75 سم 2 | 5 مل |
الجدول 1. الحد الأدنى الموصى به وحدات التخزين من Laminin-DPBS الحل (10 ميكروغرام / مل) لطلاء الثقافة السطحية.
| نشاط / الكتلة المولية | تركيز النهائي | الكتلة أو الحجم اللازمة ل10 مل من محلول | |
| كولاجيناز D | 0.15 U / ملغ | 10 ملغ / مل (1.5 U / مل) | 100 ملغ |
| Dispase الثاني | 0.5 U / ملغ | 4.8 ملغ / مل (2.4 U / مل) | 48 ملغ |
| 250 ملي CaCl 2 | 1100.98 غرام / مول | 2.5 ملم | 100 ميكرولتر |
الجدول 2. إعداد انزيم لالعضلات الهضم.
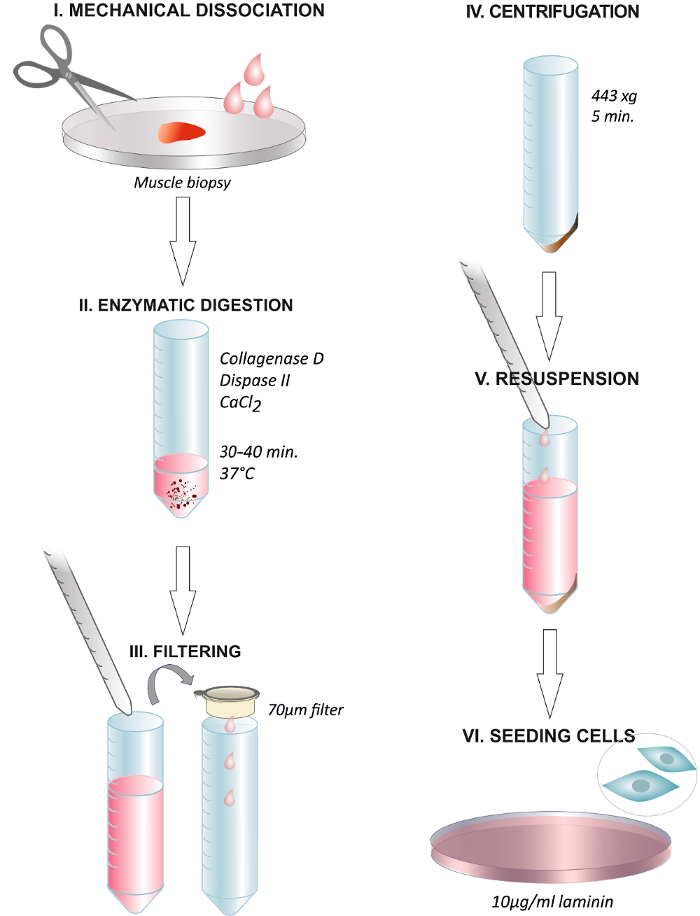
الشكل 1. الرسومية ملخص تلخيص خطوات من البروتوكول. تفكك خزعة العضلات الإنسان مع مقص أو مشرط جراحي مع (I). الحضانة مع الحل الأنزيمية عند 37 درجة مئوية لمدة 30 - 40 دقيقة (II). نهاية الهضم من خلال إضافة وسائل الإعلام نمو وتصفية حل من خلال مرشح غشاء 70 ميكرومتر في أنبوب الطرد المركزي (III). الطرد المركزي في 443 x ج لمدة 5 دقائق (IV). التخلص من طاف وإعادة التعليق في وسائل الإعلام نمو تحتوي على 2.5 نانوغرام / مل جمعية جيل المستقبل (V). طلاء الخلايا على طبق المغلفة مع 1081؛ ز / مل من laminin وتغيير وسائل الإعلام بعد 24 ساعة (السادس). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
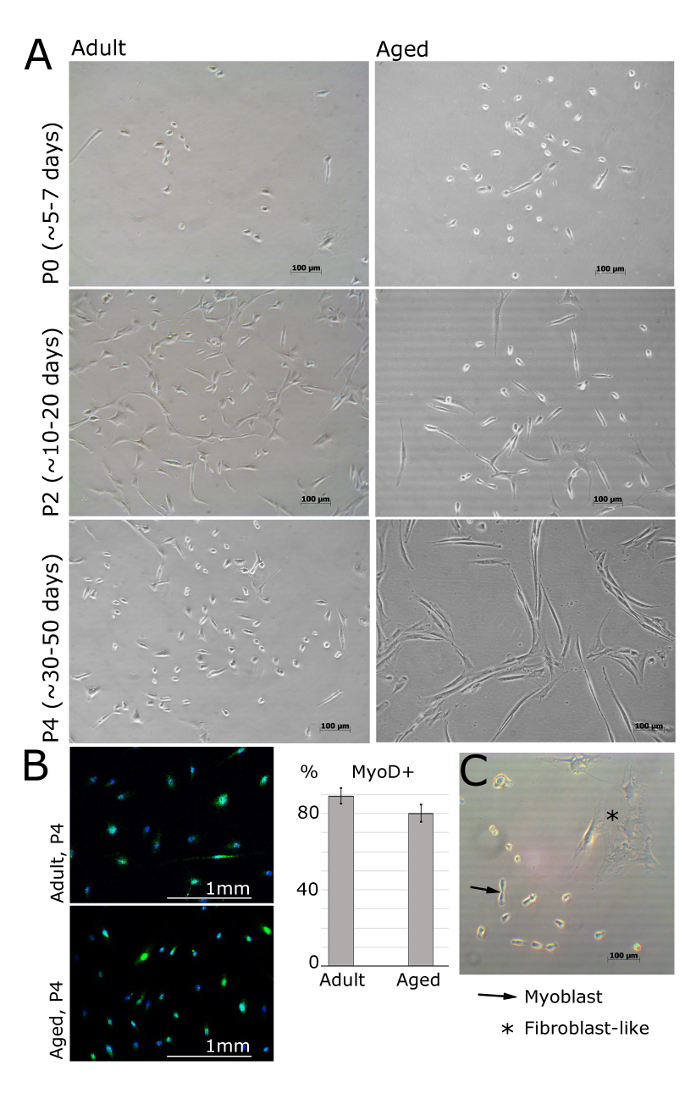
الشكل 2. Myoblasts المعزولة من العضلات من الكبار والمسنين البشر في مقاطع مختلفة. A. وتمثل الصور myoblasts معزولة عن باسطة الأصابع القصيرة، الظنبوبي الأمامي أو الخاطف أباهيم قدمية عضلات المرضى الإناث (الكبار: 30 ± 2.8 سنة، الذين تتراوح أعمارهم بين 69 ± 5 سنوات من العمر، BMI <25). في مرور 0 وبعد 5 أيام من مطلي، الخلايا لا تزال مستديرة وصغيرة، ولكن مرئية تحت المجهر الضوء الساطع (A). سوف Myoblasts ثم اعتماد شكل ممدود، مثل معروضة في مرور 2 (A). وأعرب عن MyoD في myoblasts لكن ليس في الخلايا الليفية (B). ويرد الكمي من الخلايا MyoD إيجابية. تظهر أشرطة الخطأ الانحراف المعياري؛ ن = 3 (ب). صورة ممثل مما يدل على الاختلافات بين بالخلايا العضلية الجذعية ومورفولوجيا الخلايا الليفية (C). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
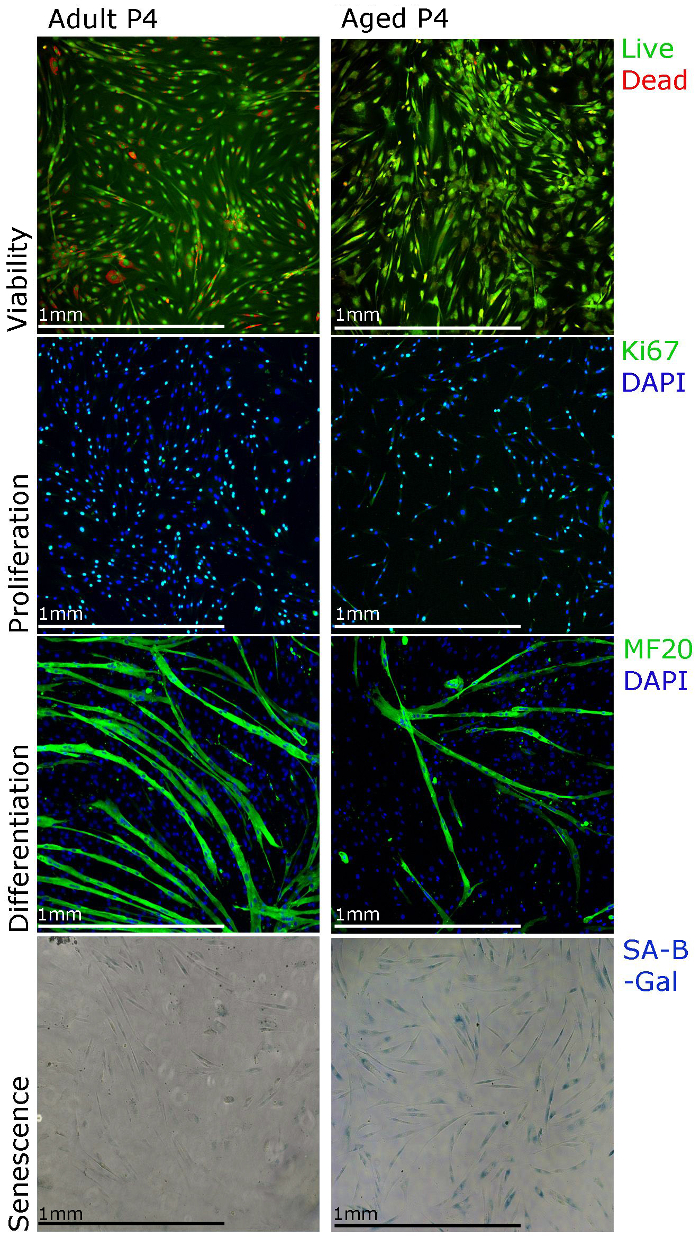
الشكل 3. Myoblasts الابتدائية الإنسان يمكن وصفها باستخدام تقنيات تلطيخ مختلفة. بقاء الخلايا يمكن تصور باستخدام تلطيخ لفحوصات بقاء الخلية، والانتشار يمكن تقييم باستخدام Ki67 المناعية، ويمكن تقييم التمايز باستخدام MF20 (السلسلة الثقيلة للميوسين) المناعية والشيخوخة يمكن تصور استخدام الشيخوخة المرتبطة بيتا غالاكتوزيداز (SA-β غالاكتوزيداز ) تلطيخ. ecsource.jove.com/files/ftp_upload/55047/55047fig3large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
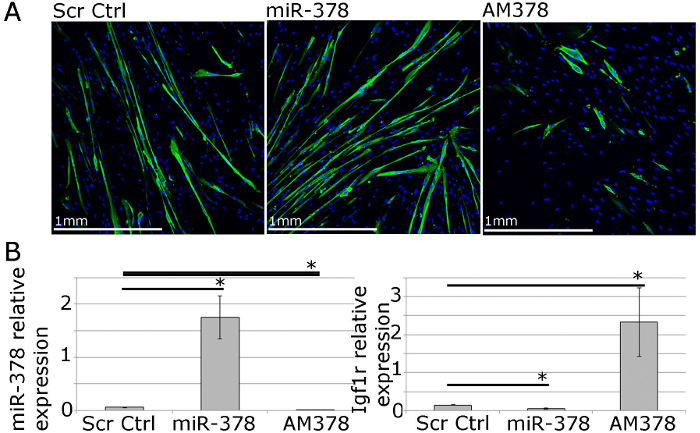
الشكل 4. Myoblasts الابتدائية الإنسان يمكن استخدامها للدراسات وظيفية من التوازن العضلات في المختبر. A. MF20 (الميوسين السلسلة الثقيلة) المناعية من myotubes الأساسي متباينة من البشر البالغين تظهر آثار overexpression أو تثبيط مير-378 على myotube مركزيا الحجم والعدد. B. QPCR يظهر التعبير النسبية من مير-378 وIgf1r، التحقق من صحة مير 378 الجين المستهدف، بعد مير 378 overexpression أو تثبيط في myoblasts الأولية الإنسان. التعبير بالنسبة إلى RNU-6 و β-2-المكروغلوبولين، على التوالي، ويرد. تظهر أشرطة الخطأ ووزارة شؤون المرأة. ن = 3، * - ف <0.05، طالبة اختبار (ت).JPG "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هنا، فإننا نقدم وسيلة بسيطة وقوية وغير مكلفة، يمكن استنساخه وفعالة من عزل خلايا العضلات السلف / myoblasts الأولية من الكبار والذين تتراوح أعمارهم بين البشر من الباسطة خنصر digitorium، الظنبوبي الأمامي أو أباهيم قدمية الخاطف عضلات. ويهدف هذا البروتوكول إلى السماح الدراسات التي تستخدم myoblasts الأولية الإنسان من الكبار والذين تتراوح أعمارهم بين البشر، وخصوصا عندما أساليب أكثر تطورا، مثل FACS- أو أجهزة ماكينتوش والفرز، وليس من الممكن أو غير عملي.
طريقة العزلة التي قدمت في هذه المخطوطة يستغرق حوالي 2 ساعة. خلال عزل العضلات، وجرفت العضلات في الايثانول 70٪ وذلك لتجنب التلوث. قبل الأنزيمية تفكك العضلات، وأنه من المهم لخفض العضلات الى قطع صغيرة ولكن واضحة، وتجنب تلف الخلايا من الكثير من تنميق. نتائج الهضم في تفكك myofibers والإفراج عن الخلايا الأقمار الصناعية وخلايا السلائف عضلي. في حالتنا ل~ 20 ملغ من الهيكل العظمي والعضلات، واحد 60 ملمكان (20 سم 2) طبق بتري المساحة الأنسب لحصاد الخلايا. وأظهرت الخلايا مطلي على سطح أكبر انخفاض انتشار الأسلحة النووية، في حين أن الخلايا مطلي على سطح أصغر أظهرت زيادة موت الخلايا وتراص.
على العزلة، كانت الخلايا المستزرعة وتوسعت على لوحات مغطاة laminin. استخدام الأسطح غير المغلفة تميل إلى التقليل من نجاح العزلة. لهذا السبب، وخلايا يمكن حصاده ويفضل أن يكون على السطح المطلي قبل مباشرة بعد العزلة. سوف الثقافات المخصب الليفية-تسود بدلا من الخلايا المشتقة myoblasts اذا ويتم حصاد الخلايا على سطح غير المغلفة مباشرة بعد العزلة. وبصرف النظر عن laminin، واستخدام حلول مرفق الخلية الأخرى مثل Matrigel والكواشف المعتمدة على الكولاجين يمكن استخدامها. ويمكن أن تشمل حلول طلاء عوامل النمو والمركبات الأخرى التي من شأنها تعزيز نمو الخلايا، ولكن هذه يمكن أن يغير من سلوك الخلية، وبالتالي فإن النتائج التجريبية. فيتجربتنا، 10 ميكروغرام / مل Laminin الحالي هو تركيز الأمثل والمناسب كاشف طلاء للخلايا الأقمار الصناعية والتعلق بالخلايا العضلية الجذعية وانتشار لأنها تفتقر إلى أي عامل النمو أو مكملة أخرى. وعلاوة على ذلك، Laminin الحالي هو موجود بشكل طبيعي في الصفيحة القاعدية، مرتبطة مباشرة إلى غمد الليف العضلي، والتي تلعب وظيفة أساسية في مرفق الخلية الأقمار الصناعية والهجرة من خلال الألياف الهيكل العظمي والعضلات.
قد يكون ملاحق من وسائل الإعلام ثقافة أيضا تأثير سلبي على سلوك بالخلايا العضلية الجذعية الأولية. لمجموعات عامل النمو سبيل المثال، مثل عوامل النمو FGFs أو IGFs، لها آثار عديد المظاهر على الثقافات بالخلايا العضلية الجذعية الأولية، مع جمعية جيل المستقبل-2 السيطرة على كل من مولد للتفتل وبرمجة موت الخلايا استجابة 31. ولذلك فمن الضروري للسيطرة بدقة الظروف والثقافة، وخصوصا بسبب الاختلافات في سلوك myoblasts الأولية معزولة عن العضلات الكبار والذين تتراوح أعمارهم بين الناس ومن المرجح جدا أن يكون راجعا إلى نقاء سو الثقافات واحتمال الخلايا الليفية اجتياح myoblasts في الثقافة خلال الثقافات على المدى الطويل 35. وقد استخدمنا 1 ساعة قبل الطلاء من الخلايا خلال تقسيم الأولى على سطح غير المغلفة من أجل تقليل التلوث من الثقافات مع الخلايا الليفية.
طريقة وصفنا هو المناسب لعزل الخلايا الاصلية عضلي من عضلات كل من الكبار والبشر العمر. تتكون الخلية معزولة من السكان ممثل عضلي من الخلايا كما يتضح من نسبة عالية من خلايا المنشأ العضلي (التعبير MyoD وخصائص عضلي تصور من قبل المناعية MF20 في الشكلان 1 و 2)، ويمكن استخدامها لتكون نموذجا في المختبر للدراسات وظيفية من العمليات المرتبطة توازن العضلات.
ووصفت الدراسات السابقة العزلة والاختلافات في الخصائص، أو عدم وجودها، من myoblasts الأولية الإنسان منالكبار والمسنين 6، 20، 27، 28، 29، 30، 31، 35، 3 6، 37، 38. وقد أثبتت وجود الشيخوخة و / أو غير وظيفية البلدان المتوسطية الشريكة الإنسان 6 و 20 و 22. ومع ذلك، كما تبين أن أي اختلاف في سلوك البلدان المتوسطية الشريكة الإنسان المعزولة حديثا 27. يسمح بروتوكول لدينا لعزل myoblasts الأولية التي تحتفظ على الأقل جزئيا ملامحهم مثل انخفاض التكاثري الشيخوخة المحتملة أو من myoblasts الأولية معزولة عن العضلات من الناس الذين تتراوح أعمارهم بين ويسمح استخدام هذهخلايا للدراسات وظيفية من الآليات الجزيئية للتوازن العضلات خلال الشيخوخة 22.
وmyoblasts الأولية معزولة باستخدام الطريقة الموصوفة هنا يمكن أن تستخدم ليس فقط للدراسات التمايز عضلي ولكن أيضا لتحقيق التغييرات داخل الخلايا، مثل التغيرات في التعبير الجيني التي تحدث في الخلايا السلائف عضلي الإنسان أثناء الشيخوخة. ومع ذلك، والتغيرات التي تحدث في الخلايا خلال ثقافة لفترات طويلة خارج الجسم تحتاج إلى أخذها في الاعتبار عند تحليل التغيرات المظهرية والوراثية التي تحدث أثناء الشيخوخة. نوصي باستخدام الخلايا المعزولة حديثا لهذا الغرض.
وعلاوة على ذلك، فإن الطريقة ثقافة بالخلايا العضلية الجذعية الأساسي هو موضح هنا يسمح للتوسع ونسبيا الثقافة على المدى الطويل من myoblasts الإنسان الأساسية، مما يسمح للدراسات وظيفية قوية في المختبر. لقد أظهرنا في وقت سابق ان الخلايا الاصلية عضلي المعزولة باستخدام طريقة لدينا يمكن أن تستخدم في كل من التنميط التعبير وفودراسات nctional من العمليات المرتبطة العضلات الشيخوخة 22. هذا الأسلوب ينطبق أيضا على عضلات الكبار والقوارض القديمة ويسمح لعزل ثقافة ثرية من myoblasts التي يمكن استخدامها لتحديد ملامح التغيرات الجينية وجينية أثناء الشيخوخة والدراسات الفنية (22). وتشمل القيود المفروضة على هذه الطريقة للاستخدام، إلى حد ما، يقطنها خليط سكاني من الخلايا بدلا من السكان نقية من خلايا الأقمار الصناعية، والتي يمكن الحصول عليها باستخدام أساليب أكثر تطورا نشرت 6، 28، 29، 39، 40، 41، 42، 43.
نقدم بروتوكول مبسط، وبأسعار معقولة، وقابلة للتكرار لعزل الخلايا myoblasts الأولية من الكبار والذين تتراوح أعمارهم بينالبشر. في تجربتنا، والمتاحة، وأساليب أكثر تطورا من العزلة وثقافة myoblasts الأولية الإنسان (مثل MACS- أو FACS فرز الخلايا الأقمار الصناعية) هي مثالية بالنسبة لبعض الأنواع من الدراسات، مثل التنميط التغييرات transcriptomic أو البروتين في الخلايا. ومع ذلك، وهذه الأساليب هي مكلفة، وتتطلب مستوى معينا على الأقل من الخبرة، ويمكن أن يكون من الصعب نظرا لمعدل التكاثري منخفضة من الثقافات بالخلايا العضلية الجذعية الأولية نقية والخلايا الليفية زيادة في النمو myoblasts.
نقدم بروتوكول استنساخه أن يسمح للعزلة بسيطة وثقافة myoblasts الأولية الإنسان للاستخدام في الدراسات وظيفية. بالإضافة إلى ذلك، فإننا نقترح استخدام laminin (42) والاستخدام المحدود للbFGF كعوامل رئيسية للثقافة ناجحة 44. ونقترح أيضا تجنب التوتر الناتجة عن الطرد المركزي عند تقسيم الخلايا وخطوة واحدة قبل الطلاء على مرور أول 45. لتلخيص، لديناالأمثل بروتوكول كفاءة لعزل وثقافة myoblasts الأولية / البلدان المتوسطية الشريكة من عضلات الكبار والبشر الذين تتراوح أعمارهم بين أن ينطبق أيضا على عضلات القوارض وتمكن التعبير والدراسات الوظيفية للتوازن العضلات.
Disclosures
There is nothing to disclose.
Acknowledgements
This work is supported by the Biotechnology and Biological Sciences Research Council (BBSRC; BB/L021668/1), the MRC and Arthritis Research UK as part of the MRC - Arthritis Research UK Centre for Integrated Research into Musculoskeletal Ageing (CIMA) and the Wellcome Trust Institutional Strategic Support Fund (097826/Z/11/A). The authors would like to thank Dr Dada Pisconti (University of Liverpool) for her expertise and advice in the isolation of muscle progenitor cells.
Materials
| Name | Company | Catalog Number | Comments |
| 60 mm Petri dishes | Greiner Bio One | 628160 | Cellstar Cell culture dish, PS, 60/15 MM, VENTS. |
| Cell culture plates (6-well) | Sigma-Aldrich | CLS3516 | Corning Costar cell culture plates. 6-well, flat bottom (Individually wrapped) . |
| Cell culture plates (12-well) | Greiner bio-one | 657 160 | Cellstar Cell culture Multiwell Plates. |
| Culture flasks | Greiner Bio One | 690175 (25 cm2); 658175 (75 cm2). | Cellstar Filter Cap Cell Culture Flasks. |
| Standard Disposable Scalpel | Granton | 91310 | Sterile stainless steel blade, pattern: 10. |
| Pipettes | Greiner bio-one | 606 180 (5 mL); 607 180 (10 mL); 760 180 (25 mL) | Cellstar Serological Pipettes. |
| Pasteur plastic pipettes | Starlab | E1414-0311 | 3.0 mL Graduated Pasteur Pipette (Sterile), Ind. Wrapped. |
| Syringe | BD | 300613 | 20 mL BD eccentric tip syringe. |
| 0.2 µm filters | Gilson | ALG422A | Sterile Syringe Filters CA 0.2 µm 33 mm Pk50. |
| Cell strainers | Fisher Scientific | 11597522 | Cell culture strainer sterile individually packed 70 µm polypropylene. |
| Collagenase D | Roche | 11088882001 | Collagenase D; Activity: ≥0.15 U/mg |
| Dispase II | Sigma-Aldrich | D4693 | Dispase II Protease from Bacillus polymyx. Activity: ≥0.5 U/mg solid. |
| CaCl2 | Sigma-Aldrich | 449709 | Calcium chloride, anhydrous, beads, −10 mesh, ≥99.9% trace metals basis |
| Laminin | Sigma-Aldrich | 114956-81-9 | Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane. 1 mg/mL. |
| DMEM-high glucose | Sigma-Aldrich | D5671 | Dulbecco’s Modified Eagle’s Medium - high glucose. With 4,500 mg/L glucose and sodium bicarbonate, without L-glutamine and sodium pyruvate. |
| F-12 media | Gibco | 21765029 | Ham's F-12 Nutrient Mix. 1x + L-glutamine. |
| FGF-b | PetroTech | 100-18B | Recombinant human basic Fibroblast Growth Factor. |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | Fetal Bovine Serum. |
| Horse serum (HS) | Sigma-Aldrich | H1270 | Horse Serum. Donor herd, USA origin, sterile-filtered. |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | Penicillin-Streptomycin with 10,000 units penicillin and 10 mg streptomycin per mL in 0.9% NaCl, sterile-filtered. |
| L-Glutamine | Sigma-Aldrich | G7513 | L-Glutamine solution. 200 mM, solution, sterile-filtered. |
| Trypsin-EDTA | Sigma-Aldrich | T4049 | Trypsin-EDTA solution. 0.25%, sterile-filtered. |
| TrypLE Express | Gibco | 12604-013 | TrypLE Express Enzyme (1x), no phenol red. |
| DPBS (cell culture) | Sigma-Aldrich | D8537 | Dulbecco’s Phosphate-buffered Saline. Modified, without calcium chloride and magnesium chloride. |
| PBS (immunostaining) | Sigma-Aldrich | P4417-50TAB | Phosphate-buffered saline tablet. One tablet per 200 mL of deionized water (0.01 M phosphate buffer, 0.0027 M potassium chloride and 0.137 M sodium chloride, pH 7.4). |
| Methanol | Fisher | M/4000/PC17 | Methanol Analytical Reagent Grade |
| Triton X-100 | Sigma-Aldrich | T8787 | Triton X-100 for molecular biology. |
| anti-MF 20 antibody | DSHB | MF20-c 2ea 211 µg/ml. | MYH1E (MF 20) Mouse mAb. |
| anti-MyoD antibody | Cell Signaling Technology | 13812P | MyoD1 (D8G3) XP Rabbit mAb. |
| anti-Ki67 antibody | Abcam | ab16667 | Rabbit mAb to Ki67 [SP6]. |
| Anti-mouse 488 secondary antibody | Invitrogen | A-11029 | Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate. |
| Anti-rabbit 488 secondary antibody | ThermoFisher Scientific | A-11034 | Goat anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate. |
| DAPI | Sigma-Aldrich | Sigma-Aldrich | DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) |
| Senescence β-Galactosidase Staining Kit | Cell Signaling Technology | 9860 | Senescence β-Galactosidase Staining kit. |
| DMSO | Sigma-Aldrich | 41639 | Dimethyl sulfoxide. BioUltra, for molecular biology, ≥99.5% (GC). |
| Acridine Orange | Sigma-Aldrich | A8097 | Acridine Orange hydrochloride solution, 10 mg/mL in H2O. |
| Ethidium bromide | Sigma-Aldrich | E1510 | Ethidium bromide solution. BioReagent, for molecular biology, 10 mg/mL in H2O. |
| Lipofectamine 2000 | ThermoFisher Scientific | 11668019 | Lipofectamine 2000 Transfection Reagent |
| Scramble control for transfections | Qiagen | 1027271 | miScript Inhibitor Neg. Control (5 nmol) |
| Hsa-miR-378a-3p miScript Primer Assay | Qiagen | 218300 | Hs_miR-422b_1 miScript Primer Assay (targets mature miRNA: hsa-miR-378a-3p). MIMAT0000732: 5'-ACUGGACUUGGAGUCAGAAGGC |
| Anti-hsa-miR-378a-3p miScript miRNA Inhibitor | Qiagen | 219300 | Anti-hsa-miR-378a-3p miScript miRNA Inhibitor (targets mature miRNA: hsa-miR-378a-3p). MIMAT0000732: 5'-ACUGGACUUGGAGUCAGAAGGC |
| Megafuge 2.0 R Centrifuge | Heraeus | 75003085 | n/a |
| Centrifuge rotor | Heraeus | 3360 | Heraeus Sepatech Megafuge Centrifuge Rotor BS4402/A. Max. radius: 15.5 cm. |
| Eclipse Ti-E Inverted Microscope System | Nikon | n/a | Eyepieces: CFI 10X/22; Total magnification: 100X (MF20, Live/dead and Ki67). |
| Axiovert 200 inverted microscope | Carl Zeiss | n/a | Eyepieces: Carl Zeiss 1016-758 W-PI 10X/25; Total magnification: 100X (Senescence β-Galactosidase Staining). |
| Axiovert 25 inverted microscope | Carl Zeiss | n/a | Eyepieces: E-PL 10X/20. Total magnification: 100X (bright field). |
| Diaphot Inverted Tissue Culture Microscope | Nikon | n/a | Eyepiece: CFWN 10X/20. Total magnification: 100X (bright field). |
| Hydromount | National Diagnostics | HS-106 | Hydromount |
References
- Hughes, V. A., et al. Longitudinal muscle strength changes in older adults: influence of muscle mass, physical activity, and health. J Gerontol A Biol Sci. 56, B209-B217 (2001).
- Ryall, J. G., Schertzer, J. D., Lynch, G. S. Cellular and molecular mechanisms underlying age-related skeletal muscle wasting and weakness. Biogerontology. 9, 213-228 (2008).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nat Cell Biol. 12, 143-152 (2010).
- Lexell, J., Taylor, C. C., Sjostrom, M. What is the cause of the ageing atrophy? Total number, size and proportion of different fiber types studied in whole vastus lateralis muscle from 15- to 83-year-old men. J Neurol Sci. 84, 275-294 (1988).
- Grounds, M. D. Reasons for the degeneration of ageing skeletal muscle: a central role for IGF-1 signalling. Biogerontology. 3, 19-24 (2002).
- Carlson, M. E., et al. Molecular aging and rejuvenation of human muscle stem cells. EMBO Mol Med. 1, 381-391 (2009).
- Brown, D. M., Goljanek-Whysall, K. microRNAs: Modulators of the underlying pathophysiology of sarcopenia?. Ageing Res Rev. 24, 263-273 (2015).
- Brooks, S. V., Faulkner, J. A. Contraction-induced injury: recovery of skeletal muscles in young and old mice. Am J Physiol. 258, C436-C442 (1990).
- Lepper, C., Partridge, T. A., Fan, C. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138, 3639-3646 (2011).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9, 493-495 (1961).
- Charge, S. B., Rudnicki, M. A. Cellular and molecular regulation of muscle regeneration. Physiol Rev. 84, 209-238 (2004).
- Brack, A. S., Rando, T. A. Intrinsic changes and extrinsic influences of myogenic stem cell function during aging. Stem cell Rev. 3, 226-237 (2007).
- Kadi, F., Charifi, N., Henriksson, J. The number of satellite cells in slow and fast fibres from human vastus lateralis muscle. Histochem Cell Biol. 126, 83-87 (2006).
- Verdijk, L. B., et al. Satellite cell content is specifically reduced in type II skeletal muscle fibers in the elderly. Am J Physiol Endocrinol Metab. 292, E151-E157 (2007).
- Collins, C. A., Zammit, P. S., Ruiz, A. P., Morgan, J. E., Partridge, T. A. A population of myogenic stem cells that survives skeletal muscle aging. Stem cells. 25, 885-894 (2007).
- Bortoli, S., et al. Gene expression profiling of human satellite cells during muscular aging using cDNA arrays. Gene. 321, 145-154 (2003).
- Thalacker-Mercer, A. E., Dell'Italia, L. J., Cui, X., Cross, J. M., Bamman, M. M. Differential genomic responses in old vs. young humans despite similar levels of modest muscle damage after resistance loading. Physiol Genomics. 40, 141-149 (2010).
- Jejurikar, S. S., et al. Aging increases the susceptibility of skeletal muscle derived satellite cells to apoptosis. Exp Gerontol. 41, 828-836 (2006).
- McArdle, A., Dillmann, W. H., Mestril, R., Faulkner, J. A., Jackson, M. J. Overexpression of HSP70 in mouse skeletal muscle protects against muscle damage and age-related muscle dysfunction. FASEB J. 18, 355-357 (2004).
- Sousa-Victor, P., et al. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 506, 316-321 (2014).
- Cornelison, D. D. Context matters: in vivo and in vitro influences on muscle satellite cell activity. J Cell Biochem. 105, 663-669 (2008).
- Soriano-Arroquia, A., McCormick, R., Molloy, A. P., McArdle, A., Goljanek-Whysall, K. Age-related changes in miR-143-3p:Igfbp5 interactions affect muscle regeneration. ageing cell. 15, 361-369 (2016).
- Goljanek-Whysall, K., et al. Regulation of multiple target genes by miR-1 and miR-206 is pivotal for C2C12 myoblast differentiation. J Cell Sci. 125, 3590-3600 (2012).
- Georgantas, R. W., et al. Inhibition of myogenic microRNAs 1, 133, and 206 by inflammatory cytokines links inflammation and muscle degeneration in adult inflammatory myopathies. Arthritis Rheumatol. 66, 1022-1033 (2014).
- Sharples, A. P., Al-Shanti, N., Stewart, C. E. C2 and C2C12 murine skeletal myoblast models of atrophic and hypertrophic potential: relevance to disease and ageing?. Journal of cellular physiology. 225, 240-250 (2010).
- Hidestrand, M., et al. Sca-1-expressing nonmyogenic cells contribute to fibrosis in aged skeletal muscle. J Gerontol A Biol Sci Med Sci. 63, 566-579 (2008).
- Alsharidah, M., et al. Primary human muscle precursor cells obtained from young and old donors produce similar proliferative, differentiation and senescent profiles in culture. ageing cell. 12, 333-344 (2013).
- Agley, C. C., Rowlerson, A. M., Velloso, C. P., Lazarus, N. L., Harridge, S. D. Isolation and quantitative immunocytochemical characterization of primary myogenic cells and fibroblasts from human skeletal muscle. J Vis Exp. , (2015).
- Pietrangelo, T., et al. Molecular basis of the myogenic profile of aged human skeletal muscle satellite cells during differentiation. Exp Gerontol. 44, 523-531 (2009).
- Webster, C., Pavlath, G. K., Parks, D. R., Walsh, F. S., Blau, H. M. Isolation of human myoblasts with the fluorescence-activated cell sorter. Exp Cell Res. 174, 252-265 (1988).
- Woods, K., Marrone, A., Smith, J. Programmed cell death and senescence in skeletal muscle stem cells. Annals of the New York Academy of Sciences. , 331-335 (2000).
- Chakkalakal, J. V., Jones, K. M., Basson, M. A., Brack, A. S. The aged niche disrupts muscle stem cell quiescence. Nature. 490, 355-360 (2012).
- Cornelison, D. D., et al. Essential and separable roles for Syndecan-3 and Syndecan-4 in skeletal muscle development and regeneration. Genes & development. 18, 2231-2236 (2004).
- Pisconti, A., Cornelison, D. D., Olguin, H. C., Antwine, T. L., Olwin, B. B. Syndecan-3 and Notch cooperate in regulating adult myogenesis. J Cell Biol. 190, 427-441 (2010).
- Schafer, R., et al. Age dependence of the human skeletal muscle stem cell in forming muscle tissue. Artificial organs. 30, 130-140 (2006).
- Castiglioni, A., et al. Isolation of progenitors that exhibit myogenic/osteogenic bipotency in vitro by fluorescence-activated cell sorting from human fetal muscle. Stem cell reports. 2, 92-106 (2014).
- Stewart, J. D., et al. Characterization of proliferating human skeletal muscle-derived cells in vitro: differential modulation of myoblast markers by TGF-beta2. J Cell Physiol. 196, 70-78 (2003).
- Wagner, W., et al. Aging and replicative senescence have related effects on human stem and progenitor cells. PloS one. 4, e5846 (2009).
- Gaster, M., Kristensen, S. R., Beck-Nielsen, H., Schroder, H. D. A cellular model system of differentiated human myotubes. APMIS : acta pathologica, microbiologica, et immunologica Scandinavica. 109, 735-744 (2001).
- Gaster, M., Beck-Nielsen, H., Schroder, H. D. Proliferation conditions for human satellite cells. The fractional content of satellite cells. APMIS : acta pathologica, microbiologica, et immunologica Scandinavica. 109, 726-734 (2001).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods Mol Biol. 798, 21-52 (2012).
- Chowdhury, S. R., et al. One-Step Purification of Human Skeletal Muscle Myoblasts and Subsequent Expansion Using Laminin-Coated Surface. Tissue engineering. Part C, Methods. 21, 1135-1142 (2015).
- Mamchaoui, K., et al. Immortalized pathological human myoblasts: towards a universal tool for the study of neuromuscular disorders. Skeletal muscle. 1, 34 (2011).
- Natarajan, A., Lemos, D. R., Rossi, F. M. Fibro/adipogenic progenitors: a double-edged sword in skeletal muscle regeneration. Cell cycle. 9, 2045-2046 (2010).
- Ciofani, G., et al. Hypergravity effects on myoblast proliferation and differentiation. J Biosci Bioeng. 113, 258-261 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved