Method Article
הכנה והתרבות של תאים מבשר myogenic / ראשי myoblasts מן שרירי השלד של מבוגר ובני אדם בני
In This Article
Summary
פרוטוקול זה מתאר שיטה חזקה, לשחזור ופשוטה של בידוד והתרבות של ובתאים myoblast מן שרירי השלד של מבוגרים וישישים. השרירים המשמשים כאן כוללים שרירי כף הרגל והרגל. גישה זו מאפשרת הבידוד של אוכלוסייה מועשרת של myoblasts העיקרי ללימודים תפקודיים.
Abstract
הומאוסטזיס שרירי שלד תלוי צמיחת שרירים (היפרטרופיה), ניוון והתחדשות. במהלך הזדקנות וכן בכמה מחלות, מבזבז שריר מתרחש. אובדן מסה ותפקוד שרירים קשור ניוון סוג הסיב שריר, מיתוג סוג הסיבים, התחדשות שריר פגומה הקשורות בתפקוד של תאי לווין, תאי גזע שריר, ותהליכי pathophysiological אחרים. שינויים אלו קשורים עם שינויים תאיים כמו גם נישות מקומיות ומערכתיות. בנוסף במודלים של מכרסמים הנפוצים ביותר של הזדקנות שרירה, יש צורך ללמוד הומאוסטזיס שרירים מבזבז באמצעות מודלים אנושיים, אשר בשל השלכות אתיות, מורכבים בעיקר של תרבויות במבחנה. למרות השימוש הנרחב של ובתאים myogenic אדם (MPCs) ו myoblasts העיקרי myogenesis, יש מידע מוגבל על שימוש תרבויות myoblast העיקרי אדם myotube ללמוד מנגנונים מולקולריים הסדרת היבטים שונים של mus הקשורים לגיללבזבז CLE ו מסייע תיקוף מנגנוני הזדקנות מוצע בשריר מכרסם. שימוש MPCs אדם, העיקרי myoblasts ו myotubes מבודד מאנשים מבוגרים בגילאי, מספק מודל רלוונטי מבחינה פיזיולוגית של מנגנונים מולקולריים של תהליכים הקשורים צמיחת שרירים, ניוון והתחדשות. כאן אנו מתארים בפרוטרוט פרוטוקול חזק, לא יקר, לשחזור ויעיל עבור הבידוד והתחזוקה של MPCs אדם וצאצאיהם - myoblasts ו myotubes ממדגמים אדם שריר באמצעות עיכול אנזימטי. יתר על כן, קבענו את מספר הקטע שבו myoblasts העיקרי ממבוגר ואנשים בגילאים לעבור הזדקנות ב תרבות חוץ גופייה. לבסוף, אנו מראים את היכולת transfect myoblasts אלה ויכלו לאפיין יכולת השגשוג והתמיינות שלהם ולהציע התאמת לביצוע מחקרים תפקודיים של מנגנונים מולקולריים של myogenesis ושרירים מבזבזים במבחנה.
Introduction
Disease- ו הקשורות לגיל אובדן הדרגתי של תוצאות הפונקציה ומסת שריר שלד בשברירי, ירידה בחוזק וירידה באיכות החיים של אנשים בגילים. שרירי שלד מהווים כ 40% מסת גוף 1. במהלך ההזדקנות ומחלות, ניוון הדרגתי של myofibers הפרט וצמצום איכות שרירים עקב חדירת שומן סיסטיק מתרחשת 1, 2, 3, 4, 5, 6. לאחרונה, הוצע כי הבדלים ספציפיים מינים בהזדקנות של שרירי השלד להתרחש, במיוחד כי אובדן סיבי השריר המתרחשים מכרסמים, לא יכול להתרחש אצל בני אדם 7. אף על פי כן, סיבי השריר הנותרים של יונקים בגיל מאופיינים רגישות מוגברת נזק והתחדשות לקוי 8. תיקון ותחזוקה שריר למבוגרים מתווך על ידי תאי לווין 9, 10. עם פציעה בשריר רמזים רלוונטיים אחרים, תאי לוויין להיות מופעל מתרבים. תת-קבוצה קטנה של התאים חוזרת למצב השקט והשאר מתקדם אל myoblasts (ובתאים myogenic - MPCs). אלה תורמים לתקן של myofiber קיימים 11. הפונקציונליות של תאי לווין קובעת את ההצלחה של התחדשות שריר ושינויים זמינים תא בלווין עם הזדקנות הודגם 12, 13, 14, 15. יתר על כן, תאי לווין מן השריר של בני אדם ומכרסמים ישנים להראות מתג פרופיל תעתיק והקטינו משובי פוטנציאל 16, 17, 18, 19. תאי לווין של שרירים מעכברים ישנים ובני האדם גם הוכחו לעבור הזדקנות וכתוצאה מכך הפונקציונלית המופחת שלהם 20.
שורת התא הוקמה ביותר המאפשרת המחקר של הומאוסטזיס שריר היא שורת תאים בעכברי C2C12 21. כמות משמעותית של מחקרים השתמשה גם myoblasts העיקרי בעכברים 22. תרבויות אלו הובילו להבנה משמעותית של murine ו myogenesis חוליות וכן התחדשות שריר, ניוון myotube / myofiber, ותהליכים היפרטרופיה המתרחשים במהלך מחלת שריר והזדקנות 23, 24, 25, 26. מאוחר יותר נאלצו כמה קבוצות תיארו באמצעות myoblasts העיקרי האדם ללמוד myogenesis והזדקנות שריר. עם זאת, יש חוסר הסכמה עם regards להבדלים בין myoblasts העיקרי שבודד השריר של מבוגרים ובני אדם בגילים 27, 28, 29, 30, 31. למרות ההבדלים מאופיינים בסביבה המערכתית ומקומית המתרחשת במהלך התפתחות, הזדקנות ומחלות 6, 32, 33, 34, במבחנת תרבויות myoblast ו myotube להישאר הכלים הנגישים ביותר ללימוד מנגנונים מולקולריים הקשורים בהתפתחות שרירים, צמיחה וניוון. בנוסף, מחקרים אלה מספקים לא רק חזקים, אבל גם מהירה יחסית, זולים תפוקה גבוהה בכלי במבחנה. יתר על כן, השלכות אתיות הקשורות מחקרים של שרירי אדם אומרות לניסויים פונקציונליים המעורבים מניפולציות של ביטוי גנים , במבחנת myoblast ו myotube אדם תרבויות נשארות החלופה היחידה העומדת בפני אורגניזמים מודל חוליות.
כאן, אנו מציגים פרוטוקול ניסוי פשוט לבידוד חזק, לא יקר, לשחזור של myoblasts העיקרי, או MPCs, מן השריר של מבוגרים ואנשים בגילאים ולתאר תנאים סטנדרטיים של במבחנת תרבות (איור 1). כפי תרבויות עיקריות מן השריר בדרך כלל מכילות פיברובלסטים בנוסף myoblasts, אנו ממליצים צעד preplating ופתח טוהר משופר ואיכות myoblasts העיקרי. לסיכום, הקמנו פרוטוקול המאפשר בידוד יעיל לשחזור, תרבות מחקרים תפקודיים של MPCs המועשר ופונקציונלי / myoblasts העיקרי מן שרירי שלד של מבוגרים וישישים.
Protocol
כל ניסויים מעורבים רקמה אנושית כפי שיתואר בהמשך אושרה מראש על ידי אוניברסיטת ליברפול, החולים Aintree החולים האוניברסיטאי ודרום מערב ויילס מחקר ועדת האתיקה (אישור No: 13 / WA / 0374) ואת הניסויים בוצעו על פי הנחיות אימון טוב. האוניברסיטה של ליברפול שמשה האתיקה חסה למחקר זה. כל התורמים נתנו הסכמה מדעת מצב הלימודים של מחקר זה. השרירים בודדו מאנשים (BMI <25): מבוגר: 30 ± 2.8 שנים ומיושן: 69 ± 5 שנים.
1. הכנה לתרבות
- ציפוי של תרבות משטחים עם laminin
- הכן פתרון עבודה של 10 מיקרוגרם / מ"ל של laminin ב 1x DPBS (בופר פוספט של Dulbecco).
- פיפטה כמות מינימלית של פתרון laminin כדי לכסות את פני השטח לחלוטין שעליו תאים הולכים להיות מצופה (לוח 1). דגירת tהוא מנת התרבות לפחות 30 דקות ב 37 humidified מעלות צלזיוס, 5% CO 2 באינקובטור לפני ציפוי התא. טפל laminin בזהירות, הימנעות משימוש מערבולת. הפתרון עובד של 10 מיקרוגרם / מ"ל laminin מדולל DPBS יכול להיות מאוחסן על 4 מעלות צלזיוס, שימוש חוזר כמה פעמים.
- השתמש 60 מ"מ (20 ס"מ 2) צלחת פטרי או 2 בארות בצלחת 6-היטב (2 x 10 ס"מ 2) לכל ~ 18 - 19 מ"ג של שרירי השלד כדי צלחת התאים (5.50 x 10 4 תאים בסך הכל). בצע ספירת תאים בכל העת כאשר תאי ציפוי ללימודים תפקודיים.
הערה: דוגמאות התקבלו במקור ניתוחים ברגל (brevis digitorum פושטים, קדמי tibialis או חוטף halluces שרירים) מהמטופלות (מבוגר: 30 ± 2.8 שנים, בגיל: 69 ± 5 שנים, BMI <25).
- הכנת פתרון האנזימטית
- הכן 250 מ"מ CaCl 2 פתרון עובד: 277 מ"ג של המניה CaCl 2 ב 10 מ"ל 1x DPBS. סנן את כל כךlution עם קרום 0.2 מיקרומטר מסנן ולאחסן ב 4 ° C..
- הכן פתרון עבודה של 1.5 U / mL של D collagenase, 2.4 U / mL של Dispase השנייה ו -2.5 מ"מ CaCl 2 ב סרום ללא DMEM (בינוני של הנשר שונה של Dulbecco) (טבלה 2).
- מערבבים היטב ולסנן הפתרון האנזימטית דרך קרום 0.2 מיקרומטר מסנן עבור עיקור. הכן את הפתרון האנזימטית מראש ולהקפיא למטה (-20 ° C) ב aliquots לשימוש עתידי.
2. עיכול רקמות: מכונה אנזימתי דיסוציאציה
- לאחר איסוף דגימה, לשמור שריר ב 4 מעלות צלזיוס DPBS עד לעיכול. כן נפח מינימאלי של 2 מיליליטר של תמיסת collagenase-dispase-CaCl 2 לכל 18 - 19 מ"ג של רקמת שריר ולחמם אותו עד 37 מעלות צלזיוס לפני ניתוק רקמה.
- לטבול את הביופסיה של השריר בקצרה אתנול 70%, לשטוף עם DPBS טרי למקם את הרקמה על צלחת פטרי חדשה עם 1 מיליליטר של האנזימטיתפִּתָרוֹן.
- בטל כמו הרבה רקמות fibrotic ושומן ככל האפשר ולקרוע את השריר במהירות אך בעדינות לחתיכות קטנות אבל להבדיל (כ> 0.5 מ"מ 2) עם מספריים סטריליות או אזמל כירורגי (להב מס '10).
- מעבירים את המדגם לתוך צינור 50 מ"ל עם 1 מ"ל הנותרים של 2 collagenase-dispase-CaCl.
- דגירת הרקמה ב 37 ° C עד 30 - 40 דקות. הזז את רקמת השריר על ידי בעדינות להסעיר את הצינור כל 5 - 10 דקות.
- מעיל טפטפות עם התקשורת כדי למנוע את הידבקות של תאים שוחרר לקירות הפלסטיק של טפטפות. מוסיפים 2 כרכים של מדיום הגידול סטרילי, למשל, 4 מ"ל של FBS DMEM 20% (בסרום שור עוברית), 1% L- גלוטמין ו -1% P / S (פניצילין, סטרפטומיצין), כדי לעצור את העיכול.
- Pipet מעלה ומטה מספר פעמים עם טפטפת מ"ל 5 כדי לסייע לשחרורו של תאים מן סיבי שריר.
הערה: המדגם בדרך כלל הוא ניתק לחלוטין בשל גודלו הקטן. However, אם שברי שריר עדיין להישאר, להשתמש דגירה שנייה עם החלקים הנותרים של שרירים עם פתרון האנזימטית טרי. - סנן הפתרון שריר דרך מסננת תא 70 מיקרומטר מעל צינור חרוטי 50 מ"ל. שוטפים את התאים הנותרים עם התקשורת ולסנן יותר דרך המסננת.
- צנטריפוגה ב 443 XG במשך 5 דקות ב RT עד גלולת התאים. בטל supernatant בזהירות.
- ממיסים את גלולה לתוך התקשורת F-12 (Mix מזין F-12 של הם), 20% FBS, 10% HS (סרום סוס), 1% P / S, 1% α-גלוטמין ו -2.5 ng / mL של-ב FGF ( פיברובלסטים בסיסיים אנושיים רקומביננטי גורם גדילה). הנה, השתמש 4 מ"ל של התקשורת לכל 60 מ"מ צלחת פטרי.
3. מתזמן של תאים
- אסוף את כלי התרבות מצופה בעבר עם 10 מיקרוגרם / מ"ל laminin מהחממה (סעיף 1.1).
- מוציאים בזהירות את עודף של laminin מצלחת התרבות, והימנע מלגעת השטח (או שזה יפריע מבנה חלבון). לִשְׁטוֹףמנת התרבות עם DPBS (אופציונאלי).
- פלייט התאים ישירות על כלי מצופה laminin דגירה במשך 24 שעות ב 37 מעלות צלזיוס humidified, 5% CO 2 באינקובטור.
- דמיינו את התאים תחת מיקרוסקופ שדה בהיר (הגדלה מוחלטת 100X) ביום שלמחרת. סיבוב תאים קטנים מחוברים אל פני השטח ואת פסולת הנותרים ניתן לראות בתקשורת ובתרבות.
- שנה את התקשורת למדיה F-12 טרי השלים עם FBS 20%, 10% HS, 1% P / S, 1% גלוטמין α ו -2.5 ng / mL של-ב FGF.
תרבות 4. Passaging של תאים
- שנה את התקשורת כל 2 - ד 3 ולפצל את התאים בהקדם קבוצות של תאים גלויים מתחת למיקרוסקופ (הגדלה מוחלטת 100X, דוגמה באיור 2, תאים מאנשים בני, מעבר 0, לאחר 7 ד) על מנת למנוע ספונטנית בידול.
- במעבר הראשון (P1), לשנות את התקשורת כדי DMEM גבוהה גלוקוז השלימו עם 20% FBS, 10% HS, 1%P / S, 1% α-גלוטמין. הימנע משימוש FGF-b מנקודה זו, כפי FGF היא mitogen חזק גורם חשוב בתחילת התרבות, אבל זה יכול לקדם יתר פיברובלסטים אם משתמש בו יותר בתרבות.
- לקבלת passaging תאים:
- הסר את התקשורת לשטוף את התאים פעמיים עם DPBS.
- הוספת נפח מינימלי של 0.25% EDTA-טריפסין כדי לכסות את פני השטח של התאים. רוק בעדינות על מנת להבטיח את כל התאים מכוסים על ידי פתרון ניתוק, דגירה במשך 10 שניות בטמפרטורת החדר, ולהסיר אותו.
- דגירה התאים 37 ° C humidified, 5% CO 2 באינקובטור במשך 3 - 5 דקות. קש בעדינות ולבדוק תחת מיקרוסקופ האור הבהירה (הגדלה מוחלטת 100X) כי התאים מעוגלים אך לא מנותקים לחלוטין מפני השטח. אם לא יחול שינוי הוא ציין בתאים, דגירה של 5 דקות יותר.
- הוסף 5 מ"ל של צמיחה בינוני (DMEM גבוהה גלוקוז השלימו עם 20% FBS, 10% HS, 1% P / S, 1% α-גלוטמין) כדי לאסוף את התאים, לערבבגם ולהעביר את התאים עם המדיה החדשה לתוך בקבוק T75. שוטפים את התאים הנותרים לחזור על שלב זה עם עוד 5 מ"ל של צמיחה בינוני (10 מ"ל בסך הכל עבור בקבוק T75 אחד).
- כדי preplate (עדיף במעבר הראשון), דגירה התאים humidified 37 מעלות צלזיוס, 5% CO 2 באינקובטור למשך 40 דקות. אסוף את supernatant עם תאים שלא לצרף דגירה אותם בבקבוק T75 חדש. זה אמור להעשיר את תרבות myoblasts, כמו רוב של פיברובלסטים צריך מצורף בבקבוק הראשון.
- שנה את התקשורת כל 2 - ד 3 ולפצל את תאי 1 עד 4 ברגע שהם מגיעים 70% confluency עבור תשואה מקסימלית.
- לבידול, פעם התאים הגיעו 70 - 80% confluency, לשנות את המדיום תרבות בידול בינוני (DM): DMEM גלוקוז גבוהה השלים עם 2% HS, 1% P / S, 1% α-גלוטמין. התאים צריכים להיות מובחן בתוך 5 - 7 ד בהתאם לאיכות והטוהר של ג myoblastulture.
5. transfections פרוטוקול
- זרע 50,000 תאים / גם בצלחת 12 גם עבור 20 MF, מבחני הזדקנות ואת הכדאיות. התרבות תאים על תלושי לכסות או בצלחת מצופה laminin. עבור מכתים Ki67, זרע 25,000 תאים / גם בצלחת 12 היטב.
- עבור transfections, בצע את ההליך של היצרן באמצעות 5 μL של מגיב transfection, 100 ננומטר שליטה microRNA לחקות או מעכב, 100 ננומטר של microRNA לחקות או 100 ננומטר של מעכבי microRNA לכל טוב, בהיקף כולל של 1 מ"ל.
- שנת הבידול בינוני 6 שעות לאחר transfection (DMEM גלוקוז גבוהה השלימה עם 2% HS, 1% P / S, 1% גלוטמין α). בניסויים התפשטות, להכתים את התאים 2 ד לאחר transfection; להזדקנות, 7 ד לאחר transfection; ו מכתים MF20, שבעה ימים לאחר transfection.
6. Immunostaining של תאים
- immunostaining Ki67, Myod ו MF 20
- הכן לחסום 1 (10HS% ו -0.1% Triton-X PBS) ולחסום 2 (HS 10% ו 0.05% Triton-X בפתרונות PBS). השתמש 500 μL של מגיב לכל טוב עבור צלחת 12-היטב.
הערה: בצע את השלבים הבאים באמצעות שייקר עבור צעדי הדגירה. - הסר את התקשורת בין התאים.
- יש לשטוף את התאים עם PBS.
- תקן את התאים עם מתנול קר למשך 10 דקות על כיסא נדנדה.
- הסר את מתנול מתאי ולשטוף 3x עם PBS במשך 5 דקות בכל פעם.
- הוסף בלוק 1 פתרון דגירה התאים על כיסא נדנדה ב RT במשך שעה 1.
- הוסף פתרון נוגדן ראשוני: מכתים Ki67, השתמש מב הארנב כדי Ki67 (1: 1,000 דילול בבלוק 2); עבור Myod, השתמש MyoD1 (D8G3) מב הארנב XP (1: 100 דילול בבלוק 2); במשך 20 מכתים MF, שימוש MYH1E (MF 20) נוגדן ראשוני (DSHB, 1: 1,000 דילול בבלוק 2).
- דגירה התאים עם נוגדן ראשוני עבור H 1 (RT) ל O / N (4 ° C) על כיסא נדנדה.
- אסוף את AB העיקרי (זה יכול להיות שימוש חוזר מספר פעמים אם STOאדום ב 4 ° C).
- שוטפים את התאים 3x עם PBS, 5 דקות בכל פעם.
- מוסיפים את נוגדנים משני המתאים: עבור Ki67 או מכתים Myod, IgG נגד ארנב עיזים (H + L) נוגדנים משני, Alexa פלואוריד 488 המצומד (1: 1,000 דילול ב PBS); עבור MF 20 מכתים, עיזים אנטי עכבר IgG (L H +) נוגדנים משני, Alexa פלואוריד 488 המצומד (1: 1,000 דילול ב PBS).
- עוטף את הצלחת המכילה את תאי דגירת נוגדנים משני עבור 2 שעות בחושך על כיסא נדנדה ב RT.
- שוטפים את התאים 3x עם PBS במשך 5 דקות בכל פעם.
- הוסף פתרון DAPI (1: דילול 1,000 PBS) על גבי תאים דגירה על נדנדה ב RT במשך 5 - 10 דק '.
- שוטפים את התאים 3x עם PBS במשך 5 דקות בכל פעם.
- הוסף 1 מ"ל של PBS טריים.
- הר התאים על התלושים לכסות בתמיסת הרכבה או לאטום את הצלחת המכילה את התאים ב- PBS עם Parafilm כדי למנוע אידוי.
- חנות ב 4 מעלות צלזיוס.
- דמיינו את התאים עםמיקרוסקופ פלואורסצנטי בהקדם האפשרי (לא יאוחר מ -2 שבועות).
- הכן לחסום 1 (10HS% ו -0.1% Triton-X PBS) ולחסום 2 (HS 10% ו 0.05% Triton-X בפתרונות PBS). השתמש 500 μL של מגיב לכל טוב עבור צלחת 12-היטב.
- assay הכדאיות
- הסר את התקשורת בין התאים.
- יש לשטוף את התאים PBS.
- הוסף 1: 1,000 ברומיד ethidium ו -1: 1,000 כתום acridine מדולל PBS.
זהירות: יש להיזהר ולעבוד בתוך תקנות בריאות ובטיחות - ברומיד ethidium הוא קרצינוגן. - עוטף את הצלחת המכילה את התאים בתמיסה מכתימה ו דגירה ב RT על הנדנדה במשך 5 דקות.
- צלמו תמונות של התאים עם מיקרוסקופ פלואורסצנטי: ערוץ ירוק כתום acridine; מסלול אדום עבור ברומיד ethidium.
תוצאות
MPCs / myoblasts העיקרי אמור להיות זריעת פוסט 24 שעות גלוי על פני השטח מצופה laminin (איור 2). התאים צריכים לאמץ צורת ציר דמוית וצריכים להביע Myod עדיין בעיצומו של מעבר 4 (איור 1 א ', ב'). פיברובלסטים ניתן להבחין על ידי המורפולוגיה כוכב דמוי שלהם וחוסר הבעת Myod (איור 1 ב ', ג'). ברגע שהתאים מחוברים למחרת, תקשורת צריכה להיות מוחלפת עם תקשורת טריה bFGF. התקשורת והתרבות צריכה להיות מוחלפת כל 48 שעות.
תוצאות הנציגים המוצגות כאן ופורסמו נתוני מטרת 22 במעבדה שלנו לתמוך פרוטוקול הבידוד והתרבות שלנו ולהפגין את הטכניקות השונות, שניתן להשתמש בם עבור מחקרים תפקודיים של myoblasts העיקרי אדם. התפשטות myoblast ניתן ללמוד באמצעות immunostaining Ki67 ואת הכדאיות באמצעות staining עבור assay כדאיות התא (איור 3). לבידול, התקשורת והתרבות צריכה להיות שונה למדיה בידול. Myotubes צריך להיווצר 5 - 7 ד ולהיות שרירן כבד שרשרת חיובית (איור 3). ראוי לציין, כי היווצרות myotube עשויה להיות פחות יעילה כאשר myoblasts מבודד מן השריר של אנשים בגילאי (איור 3). הזדקנות (SA-β-galactosidase) מכתים יכול גם להתבצע על מנת לקבוע את אחוז התאים מזדקנים בתרבות (איור 3). הבחנו כי עם תרבויות יותר (איור 3, מעבר 4), יותר myoblasts מבודד השריר של אנשים בגילאי להראות הזדקנות.
עבור מחקרים פונקציונלי, ביטוי גנים microRNA ניתן להשפיע באמצעות transfection lipophilic משלוח ריאגנטים בתיווך של וקטורים ביטוי, siRNAs, מחקה microRNA ו antimiRs (איור 4). זה מאפשר 40 -70% יעילים transfection עם רמות הגן / microRNA להיות למעלה או למטה מוסדר בטווח פיסיולוגי (איור 4; 22).
| כלי תרבות | כ. שטח (נפשות היטב) | נפח של 10 מיקרוגרם / מ"ל laminin |
| 35 מ"מ צלחת | 10 ס"מ 2 | 1 מ"ל |
| 60 מ"מ צלחת | 20 ס"מ 2 | 2 מ"ל |
| 100 מ"מ צלחת | 60 ס"מ 2 | 4 מ"ל |
| צלחת 24 גם | 2 ס"מ 2 | 200 μL / טוב |
| צלחת 12-היטב | 4 ס"מ 2 | 500 μL / טוב |
| 6-גם צלחת | 10 ס"מ 2 | 1 מ"ל / טוב |
| T25 | 25 ס"מ 2 | 3 מ"ל |
| T75 | 75 ס"מ 2 | 5 מ"ל |
טבלה 1. כרכים המינימלי המומלץ של Laminin-DPBS פתרון (10 מיקרוגרם / מ"ל) עבור Surface תרבות ציפוי.
| פעילות ספציפית / מסה מולרית | ריכוז סופי | מסה או נפח דרוש 10 מיליליטר פתרון | |
| collagenase D | 0.15 U / מ"ג | 10 מ"ג / מ"ל (1.5 U / mL) | 100 מ"ג |
| dispase II | 0.5 U / מ"ג | 4.8 מ"ג / מ"ל (2.4 U / mL) | 48 מ"ג |
| 250 מ"מ CaCl 2 | 110.98 G / mol | 2.5 מ"מ | 100 μL |
טבלה 2. הכנת אנזימים עבור שרירי עיכול.
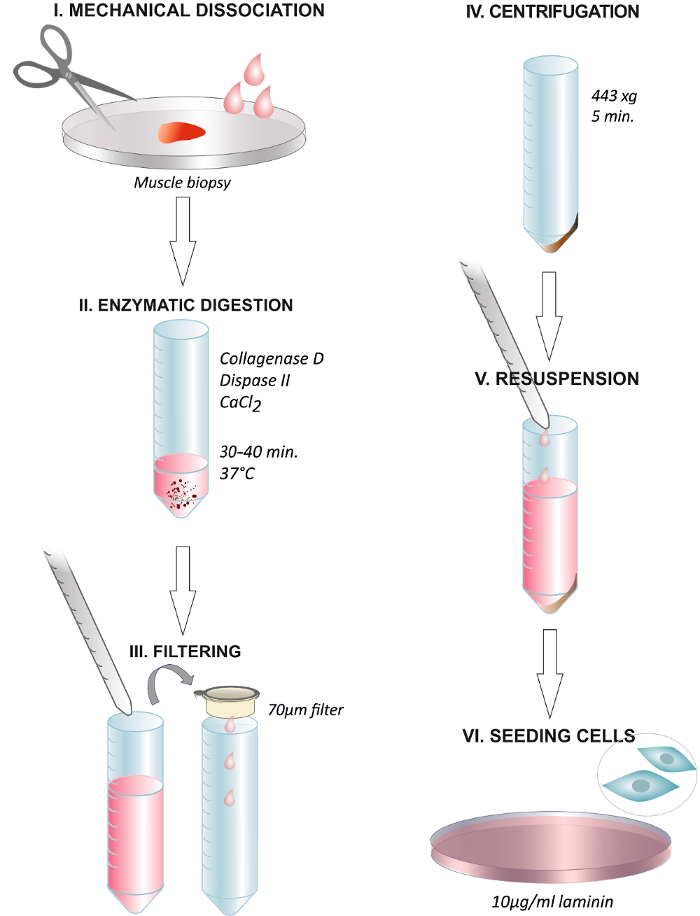
איור 1. תקציר גרפי בסיכום הצעדים לפרוטוקול. דיסוציאציה של הביופסיה של שריר אדם במספריים או בעזרת איזמל ניתוחים (I). דגירה עם הפתרון האנזימטית ב 37 מעלות צלזיוס במשך 30 - 40 דקות (II). סוף העיכול באמצעות הוספת תקשורת צמיחה וסינון הפתרון דרך פילטר ממברנה 70 מיקרומטר לתוך צינור צנטריפוגות (III). צנטריפוגה ב 443 XG במשך 5 דקות (IV). הזנחת את supernatant resuspending בתקשורת צמיחה המכיל 2.5 ng / mL FGF (V). ציפוי התאים על צלחת מצופה 1081; g / mL של laminin ושינוי בתקשורת אחרי 24 שעות (VI). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
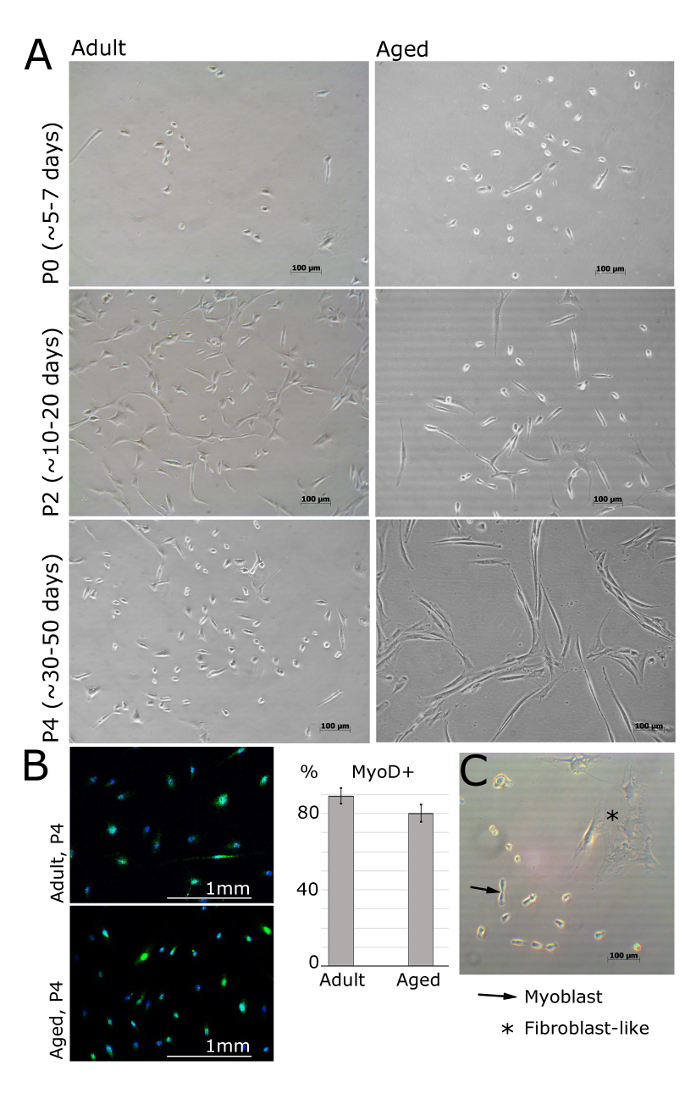
איור 2. myoblasts מבודד מן השרירים למבוגרים ובני אדם בנים ב מעברים שונים. א. תמונות מייצגות myoblasts מבודד brevis digitorum פושטים, tibialis שרירי halluces הקדמי או חוטף ממטופלות (מבוגר: 30 ± 2.8 שנים, בגיל: 69 ± 5 שנים, BMI <25). בשעה מעברת 0 ואחרי 5 ימים מיום שבו מצופה, תאים הם עדיין עגולים קטנים, אך גלויים תחת מיקרוסקופ האור הבהירה (א). Myoblasts אז יהיה לאמץ צורה מאורכת, כמו לראות ב מעבר 2 (א). Myod מתבטא myoblasts אך לא פיברובלסטים (B). כימות של תאי Myod-חיובי מוצגת; ברים שגיאים להראות סטיית התקן; n = 3 (ב). תמונת נציג הוכיחה את ההבדלים בין myoblast ומורפולוגיה פיברובלסטים (C). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
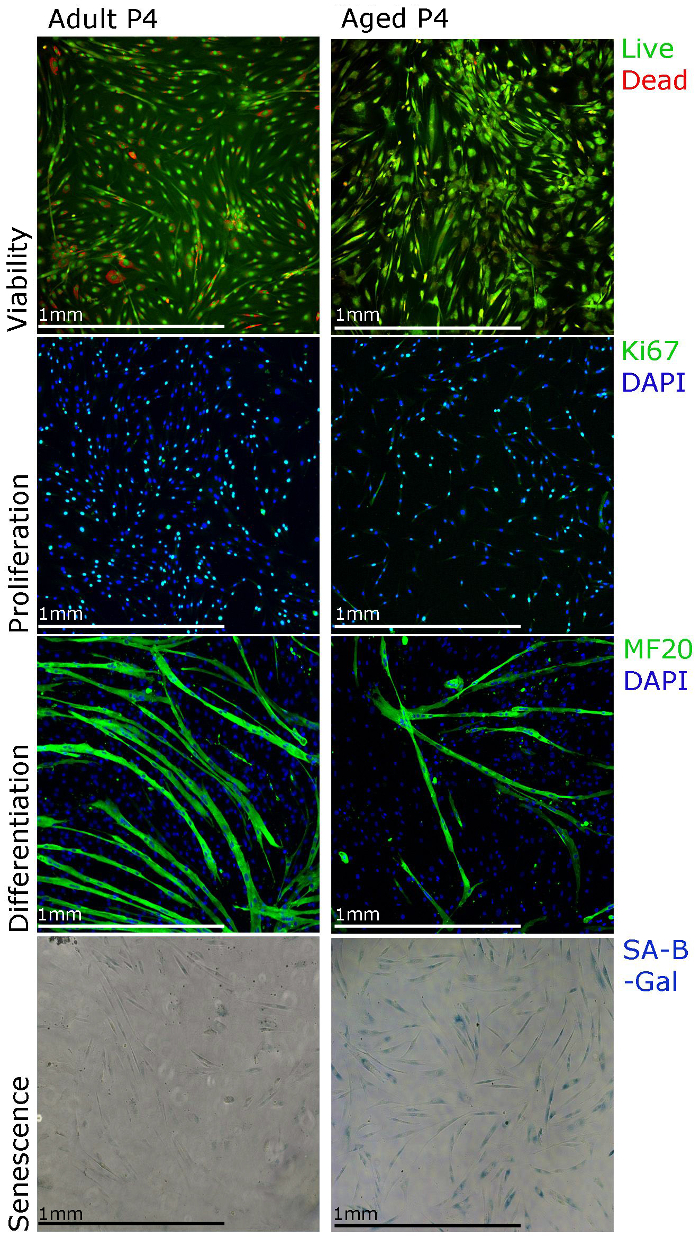
איור 3. myoblasts ראשוניים אדם ניתן לאפיין באמצעות טכניקות מכתימות שונות. הכדאיות של התאים ניתן דמיינו באמצעות מכתים עבור מבחני כדאיות התא, התפשטות ניתן להעריך באמצעות immunostaining Ki67, בידול ניתן להעריך באמצעות MF20 (שרשרת כבדה שרירן) immunostaining והזדקנות ניתן דמיינו באמצעות galactosidase בטא הקשורים להזדקנות (SA-β-galactosidase מכתים). ecsource.jove.com/files/ftp_upload/55047/55047fig3large.jpg "target =" _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
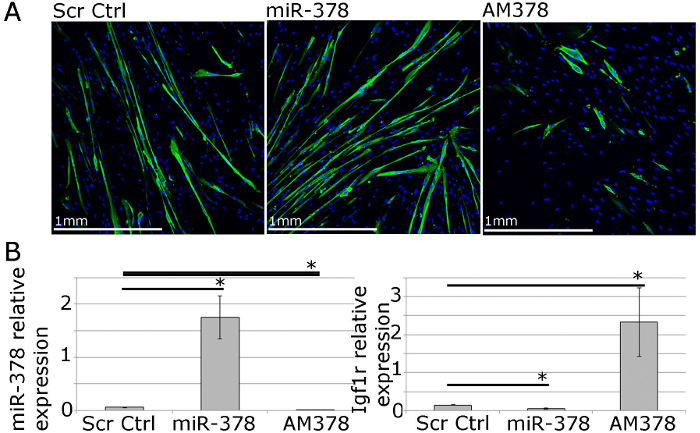
איור 4. אדם מן המעלה הראשונה myoblasts יכול לשמש מחקרים תפקודיים של הומאוסטזיס שרירים במבחנה. א MF20 (שרשרת כבדה שרירן) immunostaining של myotubes העיקרי הבדיל מבני אדם מבוגר המציג את ההשפעות של ביטוי יתר או עיכוב של miR-378 על הגודל ומספר myotube. ב qPCR מראה הביטוי היחסי של miR-378 ו IGF1R, גן המטרה miR-378 תוקף, לאחר miR-378 ביטוי יתר או עיכוב ב myoblasts העיקרי האדם. ביחס ביטוי Rnu-6 ו- β-2-microglobulin, בהתאמה, מוצג. ברים שגיאים להראות SEM; n = 3, * - p <0.05, מבחן T הסטודנטים.jpg "target =" _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
כאן, אנו מציגים שיטה פשוטה, חזקה, לא יקרה, לשחזור ויעילה של בידוד ובתאי שריר / myoblasts העיקרי מבני אדם בוגר בגילי brevis digitorium פושטים, שוקה קדמית או halluces חוטף שרירים. פרוטוקול זה נועד לאפשר מחקרים באמצעות myoblasts העיקרי אדם מבני אדם מבוגר ומיושן, במיוחד כאשר שיטות מתוחכמות יותר, כגון FACS- או MACS-מיון, אינם אפשריים או לא מעשי.
שיטת הבידוד הציגה בכתב היד הזה לוקחת כ 2 שעות. במהלך בידוד שריר, שריר נשטף ב 70% אתנול כדי למנוע זיהום. לפני האנזימטית דיסוציאציה של השריר, חשוב לחתוך את השריר לחתיכות קטנות אך גלוי, ולהימנע נזק לתאים מ מתייפייף יותר מדי. תוצאות העיכול של דיסוציאציה של myofibers ואת שחרורו של תאי לווין ותאיים מבשר myogenic. במקרה שלנו עבור ~ 20 מ"ג של שרירי השלד, אחד 60 מ"מ(20 ס"מ 2) צלחת פטרי היה שטח הפנים המתאים ביותר בשביל לאסוף את התאים. תאים מצופים על משטח גדול הראו התפשטות מופחתת, ואילו תאים צופה על משטח קטן והראה גדילת מוות של תאי התלכדות.
עם בידוד, התאים היו בתרבית והרחיב על צלחות מכוסי laminin. שימוש משטחים שאינם מצופים נטו להקטין את ההצלחה של הבידוד. מסיבה זו, תאים ניתן לקצור רצוי על משטח מראש צופה ישירות לאחר בידוד. תרבויות פיברובלסטים מועשרים תהיינה דומיננטיות ולא הנגזרות תאי myoblasts אם התאים נקצרים על משטח שאינו מצופה ישירות לאחר בידוד. מלבד laminin, השימוש פתרונות מצורף תאים אחרים כגון Matrigel ריאגנטים מבוססי קולגן יכול לשמש. פתרונות ציפוי עשויים לכלול גורמי גדילה ותרכובות אחרות אשר יקדמו צמיחת תאים, אבל אלה יכולים לשנות את התנהגות תא ולכן את תוצאות הניסוי. במניסיוננו, 10 מיקרוגרם / מיליליטר laminin הוא הריכוז האופטימלי מגיב ציפוי מתאים תאים בלווין מצורף myoblast ושגשוגם כפי שהוא חסר כל גורם גדילה או משלים אחר. יתר על כן, laminin קיים באופן טבעי את lamina הבסיס, מקושר ישירות אל sarcolemma, אשר ממלא תפקיד מפתח מצורף תא לווין וההגירה דרך סיב שרירי השלד.
התוספים של התקשורת והתרבות יכולים להיות גם השפעה מזיקה על ההתנהגות של myoblast העיקרי. לקבוצות גורם כדוגמת צמיחה, כגון FGFs או IGFs, יש תופעות pleiotropic על תרבויות myoblast העיקרי, עם FGF-2 שליטה הוא מוות של תאי mitogenic ומתוכנת תגובה 31. לכן, יש לשלוט תנאי התרבות בקפדנות, במיוחד בגלל ההבדלים בהתנהגות של myoblasts העיקרי שבודד שריר של אנשים מבוגרים בגילאי מאוד צפויים להיות בשל הטוהר of התרבויות ואת הסבירות של פיברובלסטים להתפשט על myoblasts בתרבות במהלך תרבויות לטווח ארוך 35. השתמשנו ציפוי מראש 1 שעות של התאים במהלך הפיצול הראשון על משטח שאינו מצופה כדי להקטין את הזיהום של התרבויות עם פיברובלסטים.
השיטה אנו מתארים מתאימה לבודדים ובתאי myogenic מהשרירים של שני מבוגרים ובני אדם בגילים. התא המבודד מורכב אוכלוסיית myogenic נציג של תאים כפי שצוין על ידי אחוז גבוה של תאי myogenic (ביטוי Myod ומאפייני myogenic דמיינו ידי immunostaining MF20 איורי 1 ו -2) ויכול לשמש מודל במבחנה ללימודים תפקודיים של תהליכים הקשורים הומאוסטזיס שריר.
מחקרים קודמים שאפיינה את הבידוד ההבדלים במאפייני, או היעדרה, של myoblasts העיקרי האדם מןמבוגרים ואנשים בגילאי 6, 20, 27, 28, 29, 30, 31, 35, 3 6, 37, 38. קיומו של MPCs אדם גריאטרי ו / או שאינו פונקציונלי הודגם 6, 20, 22. עם זאת, לא נמצא הבדל בהתנהגות של MPCs אדם מבודדים טרי כן הוכח 27. פרוטוקול שלנו מאפשר בידוד של myoblasts העיקרי שלפחות לשמור פנוטיפ שלהם חלקית, כגון הזדקנות או פוטנציאל שגשוג מופחת של myoblasts העיקרי שבודד שריר של אנשים בגילאי ומתיר שימוש אלהתאים ללימודים תפקודיים של מנגנונים מולקולריים של הומאוסטזיס שריר במהלך 22 הזדקנות.
Myoblasts העיקרי מבודד באמצעות השיטה המתוארת כאן יכול לשמש לא רק עבור מחקרים בידול myogenic אלא גם לחקור שינויים תאיים, כגון שינויים בביטוי הגנים המתרחשים בתאים מבשר אדם myogenic במהלך ההזדקנות. עם זאת, השינויים המתרחשים בתאים במהלך התרבות ממושכת vivo לשעבר צריכים להילקח בחשבון בעת ניתוח שינויים פנוטיפי ו גנוטיפ המתרחשים במהלך ההזדקנות. אנו ממליצים להשתמש תאים טריים מבודדים למטרה זו.
יתר על כן, שיטת תרבות myoblast העיקרי מתוארת כאן מאפשרת רחבה יחסית לתרבות לטווח הארוכה של myoblasts העיקרי אנושי, ובכך תאפשר מחקרים פונקציונליים במבחנה חזקה. הראינו בעבר כי ובתאי myogenic מבודדים באמצעות השיטה שלנו יכולים לשמש הוא פרופיל ביטוי פומחקרי nctional של תהליכים קשורים שריר הזדקנות 22. שיטה זו היא גם החלימה על השרירים של מבוגרים וילדים כאחד מכרסמים ישנים ומאפשרת בידוד של תרבות מועשרת של myoblasts שיכול לשמש פרופיל שינויים גנטיים אפיגנטיים במהלך הזדקנות ומחקרים תפקודיים 22. המגבלות של שיטה זו כוללות את השימוש, במידה זו או אחרת, אוכלוסייה מעורבת של תאים ולא אוכלוסייה טהורה של תאי לווין, אשר ניתן להשיג באמצעות שיטות שפורסמו מתוחכמות יותר 6, 28, 29, 39, 40, 41, 42, 43.
אנו מציגים פרוטוקול פשוט, זולים, לשחזור עבור הבידוד של תאי myoblasts העיקריים ממבוגר ומיושןבני אנוש. מניסיוננו, הזמין, שיטות מתוחכמות יותר של בידוד והתרבות של myoblasts העיקרי האדם (כגון MACS- או FACS-מסודרים תאי הלוויין) הם אידיאליים עבור סוגים מסוימים של מחקרים, כגון אפיון השינויים transcriptomic או proteomic בתאים. עם זאת, שיטות אלה הן יקרות, דורשות לפחות רמה מסוימת של מומחיות, וייתכן להוכיח קשה בשל שיעור השגשוג הנמוך של תרבויות myoblast העיקרי טהורות פיברובלסטים overgrowing myoblasts.
אנו מציגים פרוטוקול לשחזור המאפשר בידוד והתרבות פשוט של myoblasts העיקרי פרט לשימוש מחקרים תפקודיים. בנוסף, אנו מציעים את השימוש של laminin 42 והשימוש המוגבל של bFGF מהווה גורם משמעותי לתרבות מוצלחת 44. כמו כן, אנו מציעים הימנעות הלחץ שנוצר על ידי צנטריפוגה בזמן חלוקת התאים צעד מראש ציפוי אחד במעבר הראשון 45. לסיכום, יש לנומותאם פרוטוקול יעיל עבור בידוד וההתרבות של myoblasts / MPCs העיקרי מהשרירים של מבוגרים ובני אדם בגילאי כי הוא גם החלים על שהרירים מכרסמים ומאפשרים ביטוי ומחקרים תפקודיים של הומאוסטזיס שריר.
Disclosures
There is nothing to disclose.
Acknowledgements
This work is supported by the Biotechnology and Biological Sciences Research Council (BBSRC; BB/L021668/1), the MRC and Arthritis Research UK as part of the MRC - Arthritis Research UK Centre for Integrated Research into Musculoskeletal Ageing (CIMA) and the Wellcome Trust Institutional Strategic Support Fund (097826/Z/11/A). The authors would like to thank Dr Dada Pisconti (University of Liverpool) for her expertise and advice in the isolation of muscle progenitor cells.
Materials
| Name | Company | Catalog Number | Comments |
| 60 mm Petri dishes | Greiner Bio One | 628160 | Cellstar Cell culture dish, PS, 60/15 MM, VENTS. |
| Cell culture plates (6-well) | Sigma-Aldrich | CLS3516 | Corning Costar cell culture plates. 6-well, flat bottom (Individually wrapped) . |
| Cell culture plates (12-well) | Greiner bio-one | 657 160 | Cellstar Cell culture Multiwell Plates. |
| Culture flasks | Greiner Bio One | 690175 (25 cm2); 658175 (75 cm2). | Cellstar Filter Cap Cell Culture Flasks. |
| Standard Disposable Scalpel | Granton | 91310 | Sterile stainless steel blade, pattern: 10. |
| Pipettes | Greiner bio-one | 606 180 (5 mL); 607 180 (10 mL); 760 180 (25 mL) | Cellstar Serological Pipettes. |
| Pasteur plastic pipettes | Starlab | E1414-0311 | 3.0 mL Graduated Pasteur Pipette (Sterile), Ind. Wrapped. |
| Syringe | BD | 300613 | 20 mL BD eccentric tip syringe. |
| 0.2 µm filters | Gilson | ALG422A | Sterile Syringe Filters CA 0.2 µm 33 mm Pk50. |
| Cell strainers | Fisher Scientific | 11597522 | Cell culture strainer sterile individually packed 70 µm polypropylene. |
| Collagenase D | Roche | 11088882001 | Collagenase D; Activity: ≥0.15 U/mg |
| Dispase II | Sigma-Aldrich | D4693 | Dispase II Protease from Bacillus polymyx. Activity: ≥0.5 U/mg solid. |
| CaCl2 | Sigma-Aldrich | 449709 | Calcium chloride, anhydrous, beads, −10 mesh, ≥99.9% trace metals basis |
| Laminin | Sigma-Aldrich | 114956-81-9 | Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane. 1 mg/mL. |
| DMEM-high glucose | Sigma-Aldrich | D5671 | Dulbecco’s Modified Eagle’s Medium - high glucose. With 4,500 mg/L glucose and sodium bicarbonate, without L-glutamine and sodium pyruvate. |
| F-12 media | Gibco | 21765029 | Ham's F-12 Nutrient Mix. 1x + L-glutamine. |
| FGF-b | PetroTech | 100-18B | Recombinant human basic Fibroblast Growth Factor. |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | Fetal Bovine Serum. |
| Horse serum (HS) | Sigma-Aldrich | H1270 | Horse Serum. Donor herd, USA origin, sterile-filtered. |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | Penicillin-Streptomycin with 10,000 units penicillin and 10 mg streptomycin per mL in 0.9% NaCl, sterile-filtered. |
| L-Glutamine | Sigma-Aldrich | G7513 | L-Glutamine solution. 200 mM, solution, sterile-filtered. |
| Trypsin-EDTA | Sigma-Aldrich | T4049 | Trypsin-EDTA solution. 0.25%, sterile-filtered. |
| TrypLE Express | Gibco | 12604-013 | TrypLE Express Enzyme (1x), no phenol red. |
| DPBS (cell culture) | Sigma-Aldrich | D8537 | Dulbecco’s Phosphate-buffered Saline. Modified, without calcium chloride and magnesium chloride. |
| PBS (immunostaining) | Sigma-Aldrich | P4417-50TAB | Phosphate-buffered saline tablet. One tablet per 200 mL of deionized water (0.01 M phosphate buffer, 0.0027 M potassium chloride and 0.137 M sodium chloride, pH 7.4). |
| Methanol | Fisher | M/4000/PC17 | Methanol Analytical Reagent Grade |
| Triton X-100 | Sigma-Aldrich | T8787 | Triton X-100 for molecular biology. |
| anti-MF 20 antibody | DSHB | MF20-c 2ea 211 µg/ml. | MYH1E (MF 20) Mouse mAb. |
| anti-MyoD antibody | Cell Signaling Technology | 13812P | MyoD1 (D8G3) XP Rabbit mAb. |
| anti-Ki67 antibody | Abcam | ab16667 | Rabbit mAb to Ki67 [SP6]. |
| Anti-mouse 488 secondary antibody | Invitrogen | A-11029 | Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate. |
| Anti-rabbit 488 secondary antibody | ThermoFisher Scientific | A-11034 | Goat anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate. |
| DAPI | Sigma-Aldrich | Sigma-Aldrich | DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) |
| Senescence β-Galactosidase Staining Kit | Cell Signaling Technology | 9860 | Senescence β-Galactosidase Staining kit. |
| DMSO | Sigma-Aldrich | 41639 | Dimethyl sulfoxide. BioUltra, for molecular biology, ≥99.5% (GC). |
| Acridine Orange | Sigma-Aldrich | A8097 | Acridine Orange hydrochloride solution, 10 mg/mL in H2O. |
| Ethidium bromide | Sigma-Aldrich | E1510 | Ethidium bromide solution. BioReagent, for molecular biology, 10 mg/mL in H2O. |
| Lipofectamine 2000 | ThermoFisher Scientific | 11668019 | Lipofectamine 2000 Transfection Reagent |
| Scramble control for transfections | Qiagen | 1027271 | miScript Inhibitor Neg. Control (5 nmol) |
| Hsa-miR-378a-3p miScript Primer Assay | Qiagen | 218300 | Hs_miR-422b_1 miScript Primer Assay (targets mature miRNA: hsa-miR-378a-3p). MIMAT0000732: 5'-ACUGGACUUGGAGUCAGAAGGC |
| Anti-hsa-miR-378a-3p miScript miRNA Inhibitor | Qiagen | 219300 | Anti-hsa-miR-378a-3p miScript miRNA Inhibitor (targets mature miRNA: hsa-miR-378a-3p). MIMAT0000732: 5'-ACUGGACUUGGAGUCAGAAGGC |
| Megafuge 2.0 R Centrifuge | Heraeus | 75003085 | n/a |
| Centrifuge rotor | Heraeus | 3360 | Heraeus Sepatech Megafuge Centrifuge Rotor BS4402/A. Max. radius: 15.5 cm. |
| Eclipse Ti-E Inverted Microscope System | Nikon | n/a | Eyepieces: CFI 10X/22; Total magnification: 100X (MF20, Live/dead and Ki67). |
| Axiovert 200 inverted microscope | Carl Zeiss | n/a | Eyepieces: Carl Zeiss 1016-758 W-PI 10X/25; Total magnification: 100X (Senescence β-Galactosidase Staining). |
| Axiovert 25 inverted microscope | Carl Zeiss | n/a | Eyepieces: E-PL 10X/20. Total magnification: 100X (bright field). |
| Diaphot Inverted Tissue Culture Microscope | Nikon | n/a | Eyepiece: CFWN 10X/20. Total magnification: 100X (bright field). |
| Hydromount | National Diagnostics | HS-106 | Hydromount |
References
- Hughes, V. A., et al. Longitudinal muscle strength changes in older adults: influence of muscle mass, physical activity, and health. J Gerontol A Biol Sci. 56, B209-B217 (2001).
- Ryall, J. G., Schertzer, J. D., Lynch, G. S. Cellular and molecular mechanisms underlying age-related skeletal muscle wasting and weakness. Biogerontology. 9, 213-228 (2008).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nat Cell Biol. 12, 143-152 (2010).
- Lexell, J., Taylor, C. C., Sjostrom, M. What is the cause of the ageing atrophy? Total number, size and proportion of different fiber types studied in whole vastus lateralis muscle from 15- to 83-year-old men. J Neurol Sci. 84, 275-294 (1988).
- Grounds, M. D. Reasons for the degeneration of ageing skeletal muscle: a central role for IGF-1 signalling. Biogerontology. 3, 19-24 (2002).
- Carlson, M. E., et al. Molecular aging and rejuvenation of human muscle stem cells. EMBO Mol Med. 1, 381-391 (2009).
- Brown, D. M., Goljanek-Whysall, K. microRNAs: Modulators of the underlying pathophysiology of sarcopenia?. Ageing Res Rev. 24, 263-273 (2015).
- Brooks, S. V., Faulkner, J. A. Contraction-induced injury: recovery of skeletal muscles in young and old mice. Am J Physiol. 258, C436-C442 (1990).
- Lepper, C., Partridge, T. A., Fan, C. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138, 3639-3646 (2011).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9, 493-495 (1961).
- Charge, S. B., Rudnicki, M. A. Cellular and molecular regulation of muscle regeneration. Physiol Rev. 84, 209-238 (2004).
- Brack, A. S., Rando, T. A. Intrinsic changes and extrinsic influences of myogenic stem cell function during aging. Stem cell Rev. 3, 226-237 (2007).
- Kadi, F., Charifi, N., Henriksson, J. The number of satellite cells in slow and fast fibres from human vastus lateralis muscle. Histochem Cell Biol. 126, 83-87 (2006).
- Verdijk, L. B., et al. Satellite cell content is specifically reduced in type II skeletal muscle fibers in the elderly. Am J Physiol Endocrinol Metab. 292, E151-E157 (2007).
- Collins, C. A., Zammit, P. S., Ruiz, A. P., Morgan, J. E., Partridge, T. A. A population of myogenic stem cells that survives skeletal muscle aging. Stem cells. 25, 885-894 (2007).
- Bortoli, S., et al. Gene expression profiling of human satellite cells during muscular aging using cDNA arrays. Gene. 321, 145-154 (2003).
- Thalacker-Mercer, A. E., Dell'Italia, L. J., Cui, X., Cross, J. M., Bamman, M. M. Differential genomic responses in old vs. young humans despite similar levels of modest muscle damage after resistance loading. Physiol Genomics. 40, 141-149 (2010).
- Jejurikar, S. S., et al. Aging increases the susceptibility of skeletal muscle derived satellite cells to apoptosis. Exp Gerontol. 41, 828-836 (2006).
- McArdle, A., Dillmann, W. H., Mestril, R., Faulkner, J. A., Jackson, M. J. Overexpression of HSP70 in mouse skeletal muscle protects against muscle damage and age-related muscle dysfunction. FASEB J. 18, 355-357 (2004).
- Sousa-Victor, P., et al. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 506, 316-321 (2014).
- Cornelison, D. D. Context matters: in vivo and in vitro influences on muscle satellite cell activity. J Cell Biochem. 105, 663-669 (2008).
- Soriano-Arroquia, A., McCormick, R., Molloy, A. P., McArdle, A., Goljanek-Whysall, K. Age-related changes in miR-143-3p:Igfbp5 interactions affect muscle regeneration. ageing cell. 15, 361-369 (2016).
- Goljanek-Whysall, K., et al. Regulation of multiple target genes by miR-1 and miR-206 is pivotal for C2C12 myoblast differentiation. J Cell Sci. 125, 3590-3600 (2012).
- Georgantas, R. W., et al. Inhibition of myogenic microRNAs 1, 133, and 206 by inflammatory cytokines links inflammation and muscle degeneration in adult inflammatory myopathies. Arthritis Rheumatol. 66, 1022-1033 (2014).
- Sharples, A. P., Al-Shanti, N., Stewart, C. E. C2 and C2C12 murine skeletal myoblast models of atrophic and hypertrophic potential: relevance to disease and ageing?. Journal of cellular physiology. 225, 240-250 (2010).
- Hidestrand, M., et al. Sca-1-expressing nonmyogenic cells contribute to fibrosis in aged skeletal muscle. J Gerontol A Biol Sci Med Sci. 63, 566-579 (2008).
- Alsharidah, M., et al. Primary human muscle precursor cells obtained from young and old donors produce similar proliferative, differentiation and senescent profiles in culture. ageing cell. 12, 333-344 (2013).
- Agley, C. C., Rowlerson, A. M., Velloso, C. P., Lazarus, N. L., Harridge, S. D. Isolation and quantitative immunocytochemical characterization of primary myogenic cells and fibroblasts from human skeletal muscle. J Vis Exp. , (2015).
- Pietrangelo, T., et al. Molecular basis of the myogenic profile of aged human skeletal muscle satellite cells during differentiation. Exp Gerontol. 44, 523-531 (2009).
- Webster, C., Pavlath, G. K., Parks, D. R., Walsh, F. S., Blau, H. M. Isolation of human myoblasts with the fluorescence-activated cell sorter. Exp Cell Res. 174, 252-265 (1988).
- Woods, K., Marrone, A., Smith, J. Programmed cell death and senescence in skeletal muscle stem cells. Annals of the New York Academy of Sciences. , 331-335 (2000).
- Chakkalakal, J. V., Jones, K. M., Basson, M. A., Brack, A. S. The aged niche disrupts muscle stem cell quiescence. Nature. 490, 355-360 (2012).
- Cornelison, D. D., et al. Essential and separable roles for Syndecan-3 and Syndecan-4 in skeletal muscle development and regeneration. Genes & development. 18, 2231-2236 (2004).
- Pisconti, A., Cornelison, D. D., Olguin, H. C., Antwine, T. L., Olwin, B. B. Syndecan-3 and Notch cooperate in regulating adult myogenesis. J Cell Biol. 190, 427-441 (2010).
- Schafer, R., et al. Age dependence of the human skeletal muscle stem cell in forming muscle tissue. Artificial organs. 30, 130-140 (2006).
- Castiglioni, A., et al. Isolation of progenitors that exhibit myogenic/osteogenic bipotency in vitro by fluorescence-activated cell sorting from human fetal muscle. Stem cell reports. 2, 92-106 (2014).
- Stewart, J. D., et al. Characterization of proliferating human skeletal muscle-derived cells in vitro: differential modulation of myoblast markers by TGF-beta2. J Cell Physiol. 196, 70-78 (2003).
- Wagner, W., et al. Aging and replicative senescence have related effects on human stem and progenitor cells. PloS one. 4, e5846 (2009).
- Gaster, M., Kristensen, S. R., Beck-Nielsen, H., Schroder, H. D. A cellular model system of differentiated human myotubes. APMIS : acta pathologica, microbiologica, et immunologica Scandinavica. 109, 735-744 (2001).
- Gaster, M., Beck-Nielsen, H., Schroder, H. D. Proliferation conditions for human satellite cells. The fractional content of satellite cells. APMIS : acta pathologica, microbiologica, et immunologica Scandinavica. 109, 726-734 (2001).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods Mol Biol. 798, 21-52 (2012).
- Chowdhury, S. R., et al. One-Step Purification of Human Skeletal Muscle Myoblasts and Subsequent Expansion Using Laminin-Coated Surface. Tissue engineering. Part C, Methods. 21, 1135-1142 (2015).
- Mamchaoui, K., et al. Immortalized pathological human myoblasts: towards a universal tool for the study of neuromuscular disorders. Skeletal muscle. 1, 34 (2011).
- Natarajan, A., Lemos, D. R., Rossi, F. M. Fibro/adipogenic progenitors: a double-edged sword in skeletal muscle regeneration. Cell cycle. 9, 2045-2046 (2010).
- Ciofani, G., et al. Hypergravity effects on myoblast proliferation and differentiation. J Biosci Bioeng. 113, 258-261 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved