Method Article
Yetişkin ve Yaşlı İnsanların İskelet Kası miyojenik Öncü Hücreler / İlköğretim miyoblastların hazırlanması ve Kültür
Bu Makalede
Özet
Bu protokol, yetişkin ve yaşlı insanların iskelet kasından izole edilmesi ve miyoblast progenitör hücrelerin kültür sağlam tekrarlanabilir ve basit bir yöntem tarif eder. Burada kullanılan kaslar ayak ve bacak kaslarını içerir. Bu yaklaşım, fonksiyonel çalışmalar için birincil miyoblastların zenginleştirilmiş popülasyonun izolasyon sağlar.
Özet
İskelet kası homeostasis kas büyümesi (hipertrofisi), atrofi ve yenilenme bağlıdır. Yaşlanma sırasında ve çeşitli hastalıklarda, kas erimesi meydana gelir. kas kitlesi ve işlevi kaybı, kas lifi tipi atrofi, lif tipi anahtarlama, uydu hücreleri, kas kök hücreleri ve diğer patofizyolojik süreçlerin fonksiyon bozukluğu ile bağlantılı hatalı kas rejenerasyon ile ilişkilidir. Bu değişiklikler intrasellüler değişiklikler yanı sıra yerel ve sistemik nişler ile ilişkilidir. Kas yaşlanma en yaygın olarak kullanılan kemirgen modellerinde ek olarak, orada kas homeostazisini incelemek için bir ihtiyaçtır ve bağlı etik sonuçları açısından, ağırlıklı olarak, in vitro kültürleri oluşan insan modelleri kullanarak israf. İnsan miyojenik Progenitör Hücrelerinin (MPCs) ve Miyogenesis birincil miyoblastların geniş kullanılmasına rağmen, moleküler mekanizmalar yaşla ilişkili mus farklı yönlerini düzenleyen incelemek için insan primer myoblast ve mihotüp kültürleri kullanarak sınırlı veriler bulunmaktadırcle erimesi, kemirgen kas önerilen yaşlanma mekanizmaları doğrulama yardım. yetişkin ve yaşlı insanlardan izole insan MPCs, birincil iskelet hücreleri ve miyotüplerinden, kullanımı kas büyümesi, atrofi ve rejenerasyon ile ilişkili süreçlerin moleküler mekanizmaların fizyolojik ilgili bir model sağlar. enzimatik sindirim kullanılarak insan kas örneklerinden miyoblastların ve miyotüplerinden - Burada detaylı olarak izolasyon ve insan MPCs ve döl bakımı için, sağlam, ucuz, tekrarlanabilir ve verimli protokol açıklar. Ayrıca, yetişkin ve yaşlı insanların birincil miyoblastlar, bir in vitro kültür içinde yaşlanmaya uğrayabilir hangi kanal adedi belirledik. Son olarak, bu miyoblastları transferinde yeteneğini ve çoğalma ve farklılaşma kapasitesinin karakterize ve Miyogenesis ve kas in vitro israf moleküler mekanizmaların işlevsel çalışmalar gerçekleştirmek için uygunluğunun teklif yeteneğini gösterir.
Giriş
kırılganlık iskelet kas kitlesi ve fonksiyon sonuçlarının hastalıksız ve yaşa bağlı ilerleyici kaybı, yaşlı insanların yaşam kalitesini gücü ve azalma düşüş. İskelet kası yaklaşık% 40 vücut kütlesinin 1 oluşturmaktadır. Nedeniyle yağ ve fibroz infiltrasyonu, tek tek myofibers ve kas kalite azaltma ilerleyen kurumasının yaşlanma, hastalık sırasında, 1, 2, 3, 4, 5, 6 oluşur. Son zamanlarda, özellikle kemirgenlerde oluşan kas lifi kaybı, insanlarda 7 gerçekleşmeyebilir, iskelet kası yaşlanma türe özgü farklılıklar meydana geldiği önerilmiştir. Bununla birlikte, yaşlı memelilerin kalan kas lifleri hasar ve bozulmuş rejenerasyon artmış duyarlılık ile karakterizedir 8. Yetişkin kas tamir ve bakım uydu hücreleri 9, 10 aracılık eder. kas hasarı ve diğer ilgili ipuçları üzerine, uydu hücreleri aktive ve çoğalırlar olur. hücrelerin bir alt durgun durumuna geri döner ve geri kalan miyoblastlar (miyojenik Progenitör Hücrelerinin - MPCs) içine ilerler. Bunlar mevcut myofiber 11 onarmak için katkıda bulunur. Uydu hücrelerinin fonksiyonelliği, kas rejenerasyon başarı ve 12, 13, 14, 15 gösterilmiştir yaşlanma uydu hücre durumunu değişiklikleri tespit eder. Ayrıca, eski, insan ve kemirgen kas uydu hücreleri, bir transkripsiyon profil anahtar gösteren ve potansiyel rejeneratif azaltılmış 16, 17, 18, 19. Farelerin ve insanlardan elde edilen kas uydu hücreleri, aynı zamanda sınırlı işlevsellik 20 elde yaşlanmaya uğrayabilir gösterilmiştir.
Kas homeostazındaki çalışma sağlayan en köklü hücre hattı fare C2C12 hücre hattı 21'dir. Çalışmalarda önemli bir miktarı aynı zamanda murin primer miyoblastlar 22 kullandık. Bu kültürler, murin ve omurgalı Miyogenesis yanı sıra, kas rejenerasyonu miyotüp / myofiber atrofi ve kas hastalık sırasında oluşan ve 23, 24, 25, 26, yaşlanma hipertrofisi süreçlerinin önemli bir anlayışı yol açmıştır. Daha yakın zamanlarda, çeşitli gruplar Miyogenesis ve kas yaşlanmasını incelemek için insan primer miyoblastları kullanılarak tarif var. Ancak, regar ile fikir birliği eksikliği varYetişkin ve yaşlı insanlarda 27, 28, 29, 30, 31 kasından izole edilen primer miyoblastların arasındaki farklılıklara DS. Sistemik ve lokal çevre, yaşlanma ve hastalık 6, 32, 33, 34, gelişimi sırasında meydana gelen karakterize farklılıklara rağmen, in vitro myoblast ve mihotüp kültürleri kas gelişimi, büyümesi ve atrofi ile ilişkili moleküler mekanizmaları çalışmak için en erişilebilir araçları kalır. Buna ek olarak, bu çalışmalar sadece sağlam sağlar, ancak, aynı zamanda in vitro araç göreceli olarak hızlı, ucuz ve yüksek verimli. Ayrıca insan kas çalışmaları ile ilgili etik sonuçları bu gen ifadesinin manipülasyonları içeren fonksiyonel deneyler için ne anlama , In vitro insan myoblast ve mihotüp kültürleri omurgalı model organizmaların mevcut tek alternatif kalır.
Burada, yetişkin ve yaşlı insanların kas birincil iskelet hücreleri veya MPCs dayanıklı, ucuz ve yeniden üretilebilir bir izolasyon için basit bir deney protokolü göstermektedir in vitro kültürü (Şekil 1) standart koşullar açıklanmıştır. kas primer kültürlerinde genellikle iskelet hücreleri yanında fibroblastları içerdiğinden, biz gelişmiş saflık ve birincil miyoblastların kalitesi amaçlayan bir preplating adım öneriyoruz. Özetlemek gerekirse, verimli ve tekrarlanabilir izolasyonu, kültür ve yetişkin ve yaşlı insanların iskelet kasından zenginleştirilmiş fonksiyonel MPCs / primer miyoblastların fonksiyonel çalışmalar için izin veren bir protokol kurduk.
Protokol
Burada açıklanan insan dokusu içeren tüm deney Liverpool Üniversitesi, Üniversite Hastanesi Aintree Hastanesi ve Güney Batı Galler Araştırma Etik Komitesi tarafından önceden onaylanmış (Onay No: 13 / WA / 0374) ve deneyler iyi uygulama rehberlik göre yapıldı. etik Bu çalışma için sponsor olarak University of Liverpool davrandı. Tüm donörler Bu çalışmanın kayıt için bilgilendirilmiş onam verdik. kaslar insanlardan izole edilmiştir (VKİ <25): Yetişkin: 30 ± 2.8 yaşında ve yaşlı: 69 ± 5 yaşında.
Kültür 1. Hazırlık
- Kültür kaplanması laminin yüzeyler
- 1x DPBS laminin 10 ug / mL (Dulbecco Fosfat Tamponlu Salin) içindeki bir çalışma çözeltisi hazırlayın.
- Tamamen hücreleri (Tablo 1) kaplama edilecek olan yüzey üzerine kapsayacak şekilde laminin solüsyonu az miktarda pipetle. t inkübehücrelerin kaplama önce nemlendirilmiş 37 ° C de kültür çanak en az 30 dakika,% 5 CO2 kuluçka. girdabın kullanımından kaçınmanın, dikkatli laminin tutun. DPBS içinde seyreltilmiş 10 ug / ml laminin çalışma çözeltisi, 4 ° C de muhafaza edilebilir ve çok kez yeniden-kullanılmaktadır.
- 6-çukurlu plaka içindeki 60 mm (20 cm2) petri veya 2 kuyu kullanımı (2 x 10 cm2) ~ 18 başı - iskelet kası 19 mg hücreler (toplamda 5.50 x 10 4 hücre) plaka. fonksiyonel çalışmalar hücreleri kaplama yaparken her zaman hücre sayımını yapın.
NOT: Örnekler aslen kadın hastalarda (: 30 ± 2.8 yaşında, yaşlı: 69 ± 5 yaşında, BKİ <25 yetişkin) ayak ameliyatları (ekstansör digitorum brevis, tibialis anterior veya abdüktör halluces kaslar) elde edilmiştir.
- Enzimatik solüsyon hazırlanması
- 10 ml 1x DPBS stoklar CaCl2 277 mg: 250 mM CaCl2 çalışma çözeltisi hazırlayın. bu yüzden Filter4 ° C 'de 0.2 um'lik bir membran filtre ve mağaza ile dökülmesinden.
- Kolajenaz D 1.5 U / mL, Dispase II 2.4 U / mL ve serum içermeyen DMEM içinde 2.5 mM CaCl2 (Dulbecco Modifiye Eagle Ortamı) (Tablo 2) bir çalışma çözeltisi hazırlayın.
- İyice karıştırın ve sterilizasyon için 0.2 um'lik bir filtre zarı içinden enzimatik solüsyon filtre. önceden enzimatik çözüm hazırlayın ve aşağı donma (-20 ° C) ileride kullanılmak üzere alikotları.
2. Doku sindirimi: Mekanik ve Enzimatik ayrışma
- örnek toplama ardından, sindirim kadar DPBS içinde 4 ° C'de kas tutun. 18 başına kolajenaz-dispaz-CaCI2 çözeltisi 2 mL, minimum hacimde hazırlayın - kas dokusunun 19 mg ve doku kesilmeden önce, 37 ° C'ye ısıtın.
- Taze DPBS ile yıkanır, kısa bir süre için% 70 etanol içinde kas biyopsisi daldırın ve enzimatik 1 mL yeni bir Petri tabağına yerleştirin dokuçözüm.
- Mümkün olduğunca fibrotik ve yağ dokusunun atın ve küçük ama ayırt parçalar halinde hızlı fakat nazikçe kas gözyaşı (yaklaşık> 0.5 mm 2) steril makas veya cerrahi neşter (bıçak No. 10) ile.
- Kolajenaz-dispaz-CaCI2 kalan 1 ml, 50 ml tüp içine örnek aktarın.
- 40 dakika - 30 kadar, 37 ° C'de doku inkübe edin. 10 dk - tüp hafifçe her 5 çalkalayarak kas dokusu taşıyın.
- Coat medya ile pipetler pipetler plastik duvarlar bırakılan hücrelerin yapışmasını önlemek için. Sindirim durdurmak için, örneğin, steril büyüme ortamı 2 hacim, DMEM,% 20 FBS (Fetal Sığır Serumu),% 1 L-glutamin ve% 1 P / S (Penisilin-Streptomisin) 4 mL ekleyin.
- Pipet yukarı ve 5 ml pipet ile aşağı birkaç kez kas liflerinin hücrelerinin serbest yardımcı olur.
NOT: Numune genellikle tamamen kendi küçük boyutları nedeniyle ayrışmış. However, kas fragmanları yine kalırsa, kas kalan adet taze enzimatik solüsyon ile ikinci bir inkübasyon kullanın. - 50 ml konik tüp üzerinde 70 mikron hücre süzgecinden kas çözüm Filtre. süzgecinden daha fazla medya ve filtre kalan hücreleri yıkayın.
- pelet hücreleri oda sıcaklığında 5 dakika boyunca 443 x g'de santrifüjleyin. dikkatle süpernatant atın.
- F-12 ortamı (Ham F-12 besleyici karışımı),% 20 FBS, içine pelet çözülür,% 10 HS (at serumu),% 1 P / S,% 1 α-glutamin ve 2.5 ng / FGF-b ml ( Rekombinant insan temel fibroblast büyüme faktörü). Burada, 60 mm Petri çanağı başına ortam 4 mL kullanımı.
Hücreleri 3. Tohum
- Daha önce inkübatör (bölüm 1.1) 10 ug / mL laminin ile kaplanmış kültür damarı toplayın.
- Dikkatle kültürü çanak laminin fazlalığı kaldırmak ve yüzeye dokunmaktan kaçının (ya da protein yapısını bozacağı). Yıkama(Isteğe bağlı) DPBS ile kültür çanak.
- Laminin kaplanmış kabın doğrudan hücreler plaka ve nemlendirilmiş bir 37 ° C,% 5 CO2 inkübatöründe 24 saat süreyle inkübe edilir.
- Aydınlık alan mikroskobu (100X toplam büyütme) ertesi gün altında hücrelerin görselleştirmek. Yuvarlak küçük hücreler yüzeye bağlı ve kalan artıkları kültür ortamı içinde görülebilir.
- % 20 FBS,% 10 HS,% 1 P / S,% 1 α-glutamin ve 2.5 ng / FGF-b ml ile tamamlanabilir taze F-12 medya ortamı değiştirmek.
4. Kültür ve Hücre Pasajlanması
- 3 D ve spontan önlemek için hücre grupları (7 Gün sonra, 100X toplam büyütme, Şekil 2'de, örneğin, yaş insan gelen hücreler, geçit 0) mikroskop altında görülebilen en kısa sürede hücreleri bölme - Ortam her 2 değiştirme farklılaşma.
- İlk geçit (P1) 'de,% 20 FBS,% 10 HS,% 1 ile tamamlanabilir yüksek glukoz DMEM bir ortamP / S,% 1 α-glutamin. FGF kültürünün başında kuvvetli bir mitojen ve önemli bir faktör olduğu gibi, bu noktadan itibaren FGF-b kullanmaktan kaçının, ancak kültürde uzun kullanılırsa fibroblast üremesine teşvik edebilir.
- Hücre geçirilmesi için:
- Ortamı çıkarın ve DPBS ile iki kez hücreleri yıkayın.
- hücre yüzeyini kapsayacak şekilde,% 0.25 EDTA ile tripsin minimum hacim. , Tüm hücrelerin dekolmanı çözümü ile kaplıdır sağlamak, oda sıcaklığında 10 saniye süreyle inkübe ve çıkarmak için hafifçe sallayın.
- Nemlendirilmiş 37 ° C hücreleri inkübe, 3,% 5 CO2 inkübatöründe - 5 dak. hafifçe dokunun ve hücreler yuvarlak ama tamamen yüzeyden ayrılmış olmadığını parlak ışık mikroskobu (100X toplam büyütme) altında kontrol edin. herhangi bir değişiklik hücrelerde gözlenirse, 5 dakika daha inkübe edilir.
- 5 ml Büyüme Orta hücreleri toplamak için (yüksek glikoz DMEM% 20 FBS,% 10 HS,% 1 P / S,% 1 α-glutamin ile tamamlanmaktadır) ekleyin, karıştırıniyi ve T75 balona yeni medya hücreleri aktarın. Büyüme ortamının başka bir 5 ml bu adımı (bir T75 şişesinin için toplam 10 mi) tekrar geri kalan hücreler yıkanır.
- (Ilk geçit tercih edilir) preplate için, 40 dakika boyunca,% 5 CO2 kuluçka nemlendirilmiş 37 ° C hücreleri inkübe edin. Yeni T75 şişede ekleyebilirsiniz ve inkübe vermedi hücreleri ile süpernatant toplayın. fibroblast çoğu ilk şişede bağlı olması gerektiği gibi bu miyoblastların kültür zenginleştirmek gerekir.
- 3 d ve maksimum verim için% 70 confluency ulaşmak en kısa sürede 4'e kadar hücreler 1 bölünmüş - Ortam her 2 değiştirin.
- % 2 HS,% 1 P / S,% 1 α-glutamin ile tamamlanmaktadır yüksek glikoz DMEM: Farklılaşma Orta (DM) kültür ortamı değiştirmek,% 80 confluency - farklılaşması için, hücreler bir kez 70 ulaşmıştır. 7 gün myoblast c kalite ve saflık bağlı - hücreler 5 içinde ayırt edilmelidirulture.
5. Transfeksiyonlar Protokol
- Tohum 50,000 hücre / oyuk MF 20, yaşlanma ve canlılık deneyleri için 12 oyuklu plaka. Kapak slipleri üzerinde veya laminin ile kaplanmış bir tabak içinde kültür hücreleri. Ki67 boyama için, 12 oyuklu bir plaka içerisinde / oyuk 25,000 hücre tohum.
- Transfeksiyonlar için, 1 mL toplam hacim transfeksiyon reaktifi 5 uL, mıkroRNA taklit kontrol veya inhibitörün 100 nM, microRNA benzer veya oyuk başına mikroRNA inhibitörü, 100 nM, 100 nM kullanılarak üreticinin prosedürü izleyin.
- transfeksiyon sonra Farklılaşma Orta 6 saat değiştirin (yüksek glikoz DMEM% 2 HS,% 1 P / S,% 1 α-glutamin ile tamamlanmaktadır). çoğalma deneyleri için, transfeksiyondan sonra hücreler 2 d leke; yaşlanma için, transfeksiyondan sonra 7 gün; ve MF20 boyama için, yedi gün sonra transfeksiyon.
Hücrelerin 6. immün
- Ki67, MyoD ve MF 20 immün
- Hazırlayın Blok 1 (10% HS ve% 0.1 PBS içinde Triton-X) ve PBS) Çözeltilerin 2 (% 10 HS ve% 0.05 Triton-X bloke eder. 12 oyuklu plaka için oyuk başına reaktif 500 uL kullanın.
NOT: İnkübasyon için bir çalkalayıcı kullanarak aşağıdaki adımları uygulayın. - hücrelerden ortamı çıkarın.
- Hücrelerin PBS ile yıkayın.
- bir rocker 10 dakika süreyle soğuk metanol hücreleri saptamak.
- hücrelerinden metanol çıkarın ve her biri 5 dakika bir zaman boyunca PBS ile 3 kez yıkayın.
- 1 saat boyunca oda sıcaklığında bir rocker hücreleri blok 1 solüsyonu eklenir ve inkübe edilir.
- Primer antikor çözüm ekleyin: Ki67 boyama, Ki67 Tavşan mAb kullanın (1: blokta 1.000 seyreltme 2); Myod için, MyoD1 (D8G3) XP Tavşan mAb kullanın (1: blokta 100 seyreltme 2); MF 20 boyanma, kullanım MYH1E (MF 20) primer antikor için (DSHB, 1: blokta 1.000 seyreltme 2).
- bir rocker O 1 saat (RT) / N- (4 ° C), birincil antikor ile inkübe hücreleri.
- sto eğer birkaç kez yeniden kullanılabilir (birincil AB toplayınKırmızı), 4 ° C'de ilave edildi.
- Hücreler, PBS, 5 dakika, her seferinde 3 kere yıkayın.
- uygun bir ikincil antikor ekleyin: Ki67 ya MyoD boyama, keçi anti-tavşan IgG (H + L) ikincil antikor, Alexa Fluor 488 konjugatı (PBS içerisinde 1: 1000 seyrelti); (PBS içinde 1000 sulandırma 1) MF 20 boyama, keçi anti-fare IgG (H + L), ikincil antikor Alexa Fluor 488 konjügatı için.
- hücreleri ihtiva eden plaka sarın ve oda sıcaklığında bir rocker karanlıkta, 2 saat süreyle ikincil antikorla enkübe edilir.
- Hücreler, 5 dakika, her seferinde, PBS ile 3 kere yıkayın.
- hücreleri üzerine: (PBS 1000 seyreltme 1) ve 5 için oda sıcaklığında rocker inkübe - 10 dakika DAPI çözüm ekleyin.
- Hücreler, 5 dakika, her seferinde, PBS ile 3 kere yıkayın.
- Taze PBS 1 ml ekleyin.
- montaj çözümü kapak fişleri hücreleri bağlama veya buharlaşmayı önlemek için Parafilm ile PBS içinde hücreleri içeren plaka mühür.
- 4 ° C'de saklayın.
- ile hücrelerin görselleştirmekfloresan mikroskop kısa sürede (en geç 2 haftadan).
- Hazırlayın Blok 1 (10% HS ve% 0.1 PBS içinde Triton-X) ve PBS) Çözeltilerin 2 (% 10 HS ve% 0.05 Triton-X bloke eder. 12 oyuklu plaka için oyuk başına reaktif 500 uL kullanın.
- Canlılık Testi
- hücrelerden ortamı çıkarın.
- PBS hücrelerin durulayın.
- 1000 etidyum bromür ve 1: PBS içinde seyreltilmesi 1000 akridin turuncu 1 ekleyin.
Dikkat: Kendine iyi bak ve sağlık ve güvenlik yönetmeliklerine içinde çalışmak - etidyum bromür bir kanserojendir. - boyama çözeltisi hücreleri ihtiva eden plaka sarın ve 5 dakika rocker oda sıcaklığında inkübe edin.
- floresan mikroskop ile hücrelerin görüntüleri çekmek: akridin turuncu yeşil kanal; etidyum bromür yerine kırmızı kanalı.
Sonuçlar
MPCs / birincil miyoblastlar laminin kaplı bir yüzeye (Şekil 2) üzerine görünür 24 saat sonrası tohumlama olmalıdır. Hücreleri (Şekil 1A, B) iğ benzeri bir şekle benimsemeli ve pasaj 4 hala myod ifade etmelidir. Fibroblastlar da yıldız-benzeri morfolojisi ve MyoD (Şekil 1B, C) ekspresyonu olmaması ile ayırt edilebilir. Hücreler bir sonraki gün birleştirildikten sonra, ortam, taze bFGF ortamı ile değiştirilmesi gerekir. Kültür ortamı, her 48 saat değiştirilmelidir.
Temsilcisi sonuçları burada gösterilen ve bizim izolasyon ve kültür protokolünü destekleyen ve insan primer miyoblastların fonksiyonel çalışmalar için kullanılabilecek farklı teknikleri göstermek için laboratuar 22 amacı verileri yayınladı. Myoblast çoğalması lekelenme kullanarak Ki67 immün ve canlılığı ile ele alınabilirhücre canlılığı deneyi için gr (Şekil 3). farklılaşma, kültür ortamı farklılaşma medya değiştirilmelidir. Myotubes 5 oluşturmalıdır - 7 d ve ağır zincir pozitif (Şekil 3) miyozin olacak. Miyoblastlar yaşlı insanlar (Şekil 3) kas izole edildiğinde mihotüp oluşumu daha az verimli olabileceğini unutmayın. Yaşlılık (SA-β-galaktosidaz) boyama, aynı zamanda kültürdeki yaşlanmış hücrelerin yüzdesini tespit etmek için (Şekil 3) gerçekleştirilebilir. Daha uzun kültürleri (Şekil 3, geçiş 4) ile birlikte, yaşlı insanlar kasından izole fazla miyoblastlar yaşlanmayı göstermektedir görülmektedir.
Fonksiyonel çalışmalar için, geni ve mikroRNA sentezleme sentezleme vektörleri, siRNA, mıkroRNA taklit ve antimiRs (Şekil 4) lipofilik transfeksiyon reaktifleri aracılı teslim kullanılarak manipüle edilebilir. Bu 40 için izin verir -Gen / mikroRNA seviyeleri yukarı olmak üzere% 70 transfeksiyon verimi veya fizyolojik aralık (Şekil 4; 22) içinde düzenlenir aşağı.
| Kültür kabı | Yaklaşık. Konum (kuyu başına) | 10 ug / ml laminin Cilt |
| 35 mm çanak | 10 cm2 | 1 mL |
| 60 mm çanak | 20 cm2 | 2 mL |
| 100 mm tabak | 60 cm2 | 4 mL |
| 24 plaka | 2 cm2 | 200 uL / göz |
| 12-çukurlu plaka | 4 cm2 | 500 uL / göz |
| 6-yuvalı plaka | 10 cm2 | 1 mL / çukur |
| T25 | 25 cm2 | 3 mL |
| T75 | 75 cm 2 | 5 mL |
Tablo 1. Kaplama Kültür Yüzey Laminin-DPBS Çözüm (10 ug / ml) Önerilen Minimum Birimleri.
| Spesifik aktivite / Molar kütle | nihai konsantrasyon | 10 ml solüsyon için gerekli kütle veya hacim | |
| Kollajenaz D | 0.15 U / mg | 10 mg / ml (1.5 U / mL) | 100 mg |
| Dispase II | 0.5 U / mg | 4.8 mg / ml (2.4 U / mL) | 48 mg |
| 250 mM CaCl2 | 110.98 G / mol | 2.5 mM | 100 uL |
Tablo kas sindirim 2. Enzim Hazırlanması.
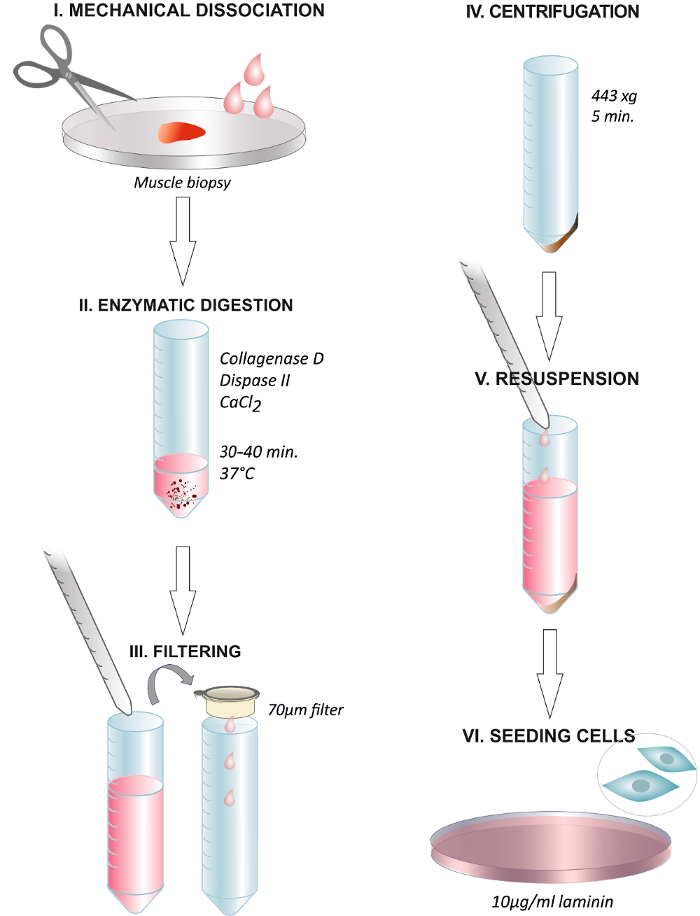
Protokolün Adımlar Özetleme Şekil 1. Grafik Özet. Makas veya cerrahi bir neşter (I) 'in, insan kas biyopsi ayrışma. 40 dakika boyunca (II) - 30 ve 37 ° C de enzimatik solüsyon ile inkubasyon yapılır. Bir santrifüj tüpüne 70 um'lik bir membran filtresinden çözeltisi büyüme ortamı ilave edilmesi ve süzme yoluyla sindirim sonu (III). 5 dakika boyunca (IV) 'ün 443 xg'de santrifüj. Süpernatant atılması ve 2.5 ng / ml, FGF (V) ihtiva eden büyüme ortamı içinde yeniden süspansiyona. 10 ile kaplanmış bir tabak üzerinde hücrelerin Kaplama81 g / laminin ve 24 saat (VI) daha sonra ortam değiştirme mi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
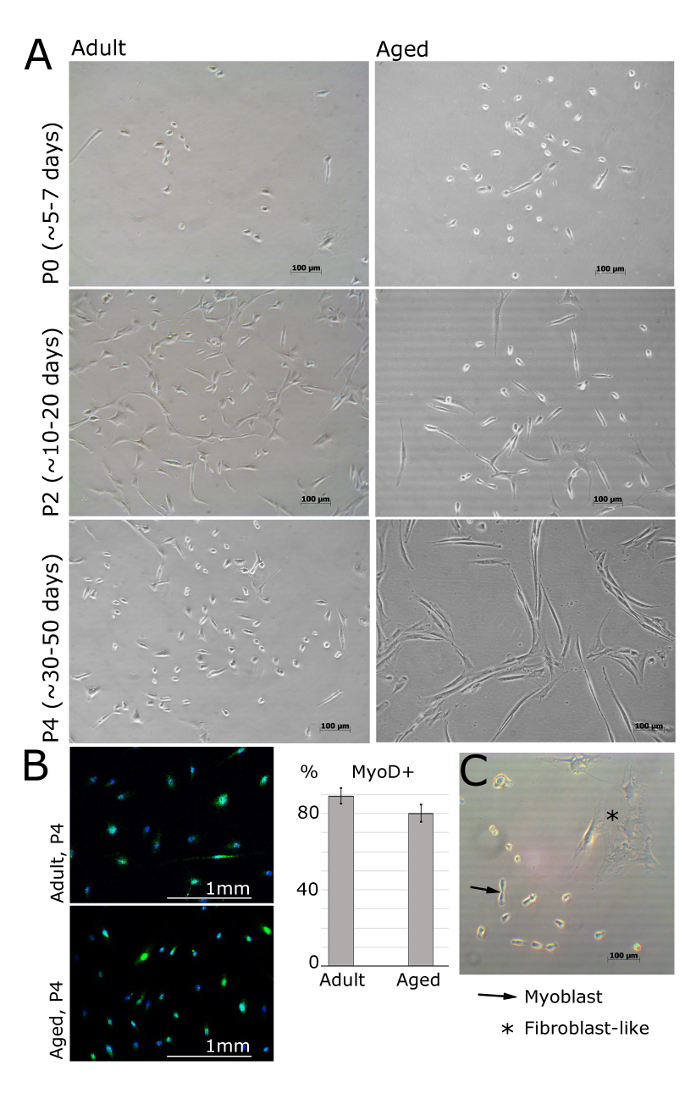
Farklı Passages de Yetişkin ve Yaşlı İnsanların Muscle İzole 2. miyoblastları rakam. Bir. (: Yaş 30 ± 2.8 yaşında,: 69 ± 5 yaşında, BKİ <25 yetişkin) Görüntüler ekstansör digitorum brevis, kadın hastaların tibialis anterior veya abdüktör halluces kas izole miyoblastları temsil etmektedir. Geçit 0 at ve kaplama olmak 5 gün sonra, hücreler hala yuvarlak ve küçük, ama görünen parlak ışık mikroskobu (A) altındadır. Geçit 2 (A) 'da gösterildiği gibi miyoblastlar, daha sonra uzun bir şekle kabul edecektir. MyoD fibroblastlar miyoblastların ifade değil, (B). MyoD pozitif hücrelerinin sayılmasına gösterilir; Hata çubukları, standart sapmayı gösterir; n = 3 (B). Myoblast ve fibroblast morfolojisi (C) arasındaki farkları gösteren Temsilcisi görüntü. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
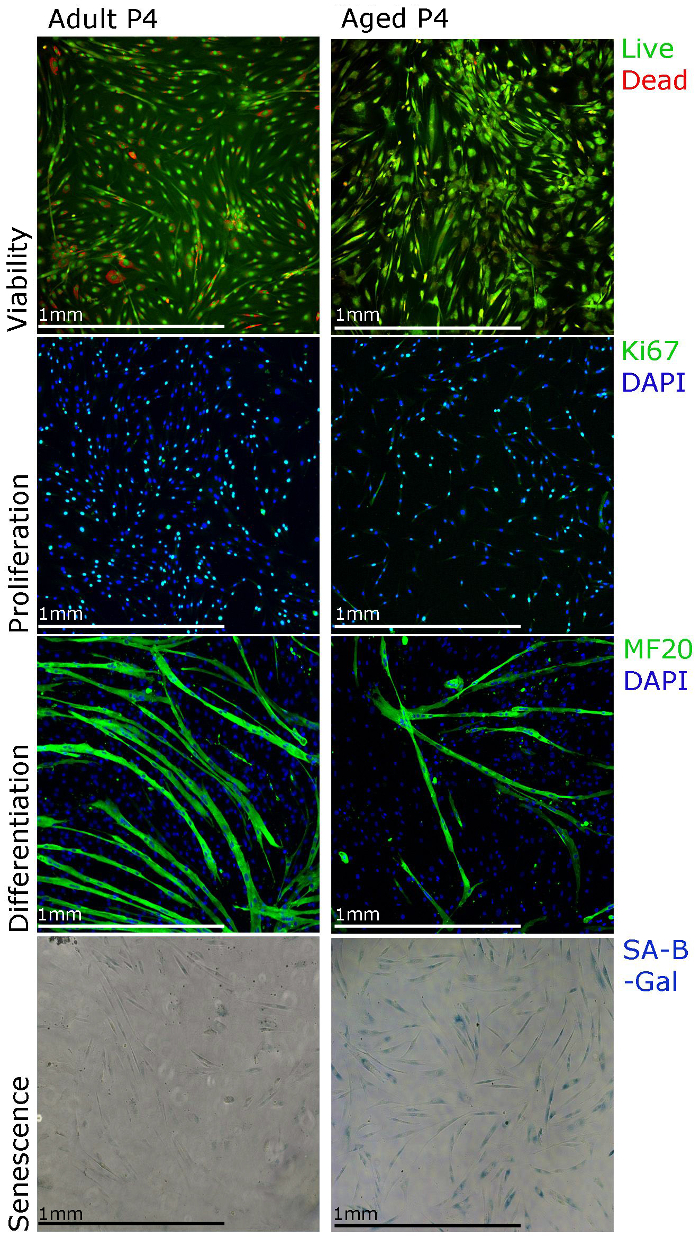
Şekil 3. İnsan İlköğretim miyoblastları Farklı Boyama Teknikleri Kullanılarak karakterize edilebilir. hücre canlılığı, hücre canlılığı deneyleri için lekeleme ile görüntülenmiştir edilebilir proliferasyon Ki67 immün kullanılarak değerlendirilebilir, farklılaşma MF20 kullanılarak değerlendirilebilir (miyozin ağır zincir), immün ve yaşlanma yaşlanması bağlantılı beta galaktosidaz, kullanılarak görüntülenebilir (SA-β-galaktosidaz ) boyama. ecsource.jove.com/files/ftp_upload/55047/55047fig3large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
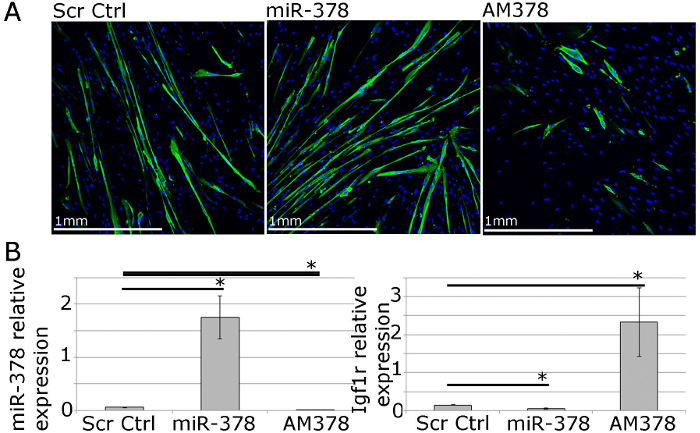
Şekil 4. İnsan İlköğretim miyoblastları İn Vitro kas Homoestaz Fonksiyonel Araştırmaları el Olabilir. A. MF20 (miyozin ağır zincir) mihotüp büyüklüğü ve sayısı miR-378 aşın veya inhibisyon etkilerini gösteren erişkin insanlardan farklı birincil miyotüplerinin immün. İnsan birincil iskelet hücreleri içinde miR-378 aşırı ekspresyonu veya inhibisyonuna aşağıdaki miR-378 ve IGF1R, valide miR-378, hedef genin göreceli ifadesini gösteren B. qPCR. Rnu-6 ve β-2-mikroglobulin Expression göre sırasıyla gösterilmiştir. Hata çubukları SEM'i göstermektedir; n = 3, * - p <0.05, Student T testi.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
Tartışmalar
Burada, ekstansör digitorium brevis, tibialis anterior veya abdüktör halluces kasları yetişkin ve yaşlı insanlarda kas progenitör hücre / birincil miyoblastları izole basit, sağlam, ucuz, tekrarlanabilir ve etkili yöntem mevcut. Bu protokol, FACS- veya MACS-sıralama olarak daha sofistike yöntemler, pratik mümkün ya da değil, özellikle de yetişkin ve yaşlı insanlardan insan birincil miyoblastları kullanarak çalışmalarını olanak sağlamayı amaçlamaktadır.
Bu yazıda sunulan izolasyon yöntemi, yaklaşık 2 saat sürer. kas izolasyonu sırasında kas kirlenmesini önlemek için% 70 etanol içinde yıkanmıştır. kas ayrışmasını enzimatik önce, küçük ama görünür parçalar halinde kas kesilmiş ve çok fazla kıyma haline gelme hücre hasarı önlemek için önemlidir. myofibers ayrışması ve uydu hücreleri ve kas kaynaklı öncü hücrelerin sürümünde sindirim sonuçları. iskelet kası ~ 20 mg, tek bir 60 mm yönelik halinde(20 cm 2) Petri kabı hücrelerini hasat için en uygun yüzey alanı oldu. Hücreler daha küçük bir yüzey hücre ölümü ve aglütinasyon artış gösterdi üzerine kaplandı ise daha büyük bir yüzeyi üzerine kaplanmış hücreler, azalmış bir çoğalma gösterdi.
izole üzerine, hücreler kültürlendi ve laminin kaplı plakalar üzerinde artmıştır. olmayan kaplı yüzeylerin kullanılmasını izolasyon başarısının azalma eğilimi. Bu nedenle, hücre tercihen, izole edildikten sonra, bir önceden kaplanmış bir yüzeye hasat edilebilir. hücreler, izolasyondan sonra olmayan bir kaplanmış yüzey üzerinde hasat halinde fibroblastlar ile zenginleştirilmiş kültürlerde miyoblastlar türetilmiş hücrelerden daha çok baskın olacak. Yanı sıra, laminin, bu tür Matrigel ve kollajen bazlı reaktifler olarak diğer hücre bağlanma çözeltilerinin kullanımı kullanılabilir. Kaplama çözeltileri hücre büyümesini teşvik, büyüme faktörleri ve diğer bileşikleri de içerebilir, ancak bu hücre davranışını ve bu nedenle deneysel sonuçlar değiştirebilir. İçindeherhangi bir büyüme faktörü veya diğer tamamlar yoksun olarak deneyim, 10 ug / ml laminin optimum konsantrasyonu ve uydu hücreleri ve miyoblast bağlanması ve çoğalması için uygun bir kaplama reaktifidir. Ayrıca, laminin doğrudan iskelet kas lifi ile uydu hücre eki ve göç önemli bir rol oynar sarcolemma, bağlantılı bazal lamina, doğal olarak bulunur.
kültür ortamı takviyeleri de birincil myoblast davranışı üzerinde olumsuz bir etkiye sahip olabilir. Bu tür FGFs veya IGF olarak örnek büyüme faktörü grupları için, FGF-2 mitojenik ve programlanmış hücre ölümü, cevabını 31 hem kontrol ile, birincil myoblast kültürlerinde çok yönlü etkileri vardır. Yetişkin ve yaşlı insanların kas izole primer miyoblastların davranış farklılıkları nedeniyle saflık o kadar olması çok muhtemeldir, çünkü özellikle titizlikle kültür koşullarını kontrol edilmesi gereklidirkültürler ve uzun vadeli kültürleri 35 sırasında kültüründe miyoblastları taşmasını fibroblastların olasılığı f. Bu fibroblastlar ile kültürlerin kirlenmesini azaltmak amacıyla olmayan bir kaplı yüzey üzerine ilk bölme boyunca hücrelerin 1 saatlik ön kaplama kullanılmıştır.
biz tarif yöntemi yetişkin ve yaşlı insanlarda hem de kasların miyojenik progenitör hücrelerin izole etmek için uygundur. Miyojenik hücre oranı yüksek gösterilen (Şekil 1 'de MF20 immün ile görünür MyoD ifade içi ve kas özellikleri ve 2) ve işlemlerin fonksiyonel çalışmalar için bir in vitro model olarak kullanılabilir, izole edilmiş hücre bir Örnek miyojenik topluluğundan oluşmaktadır kas homeostazı ile ilgili.
Daha önceki çalışmalar, insan primer miyoblastların izolasyonu ve özelliklerinin farklılıkları ya da bunun eksikliği, karakterize olanYetişkin ve yaşlı kişiler, 6, 20, 27, 28, 29, 30, 31, 35, 3 ila 6, 37, 38. Geriatrik ve / veya non-fonksiyonel insan MPCs varlığı, 22, 6 20 gösterilmiştir. Bununla birlikte, yeni izole edilmiş insan MPCs davranışında fark 27 gösterilmiştir. Bizim protokolü, yaşlı insanlar kasından izole edilen primer miyoblastların düşük çoğalma potansiyeli veya yaşlanma gibi en azından kısmen de olsa fenotipi muhafaza primer miyoblastların, izolasyonu sağlar ve bu kullanımına izin verir22 yaşlanma sırasında kas homeostazı moleküler mekanizmaların fonksiyonel çalışmalar için hücreleri.
Burada tarif edilen yöntem kullanılarak izole primer miyoblastlar miyojenik farklılaşma çalışmaları için değil, aynı zamanda bu tip yaşlanma sırasında insan miyojenik öncü hücrelerin meydana gelen gen ekspresyonunda değişikliklere gibi hücre içi değişiklikleri araştırmak için sadece kullanılabilir. Ancak, uzayan ex vivo kültür sırasında hücrelerde meydana gelen değişiklikler yaşlanma sırasında meydana gelen fenotipik ve genotipik değişiklikler analiz edilirken göz önünde bulundurulması gerekir. Biz bu amaçla taze izole edilmiş hücreleri kullanarak öneriyoruz.
Ayrıca, burada tarif edilen primer miyoblast kültür metodu sağlam in vitro fonksiyonel çalışmalar için izin genleşme ve insan primer miyoblastların nispeten uzun süreli kültür sağlar. Daha önce eden yöntemi kullanılarak izole miyojenik progenitör hücrelerin ekspresyon profili ve fu her ikisi için de kullanılabileceğini göstermiştirkas 22 yaşlanma ile ilişkili proseslerin nctional çalışmaları. Bu yöntem, aynı zamanda, yetişkin ve yaşlı kemirgenlerde kaslarına uygulanır ve yaşlanma ve fonksiyonel çalışmalar 22 içinde genetik ve epigenetik değişiklikler profil için kullanılabilir miyoblastların zenginleştirilmiş bir kültür izolasyonu sağlar. Bu yöntemin sınırları belli bir dereceye kadar kullanımı arasında, daha karmaşık, yayımlanmış yöntemler 6, 28, 29, 39, 40, 41, 42 kullanılarak elde edilebilir hücreleri yerine uydu hücreleri saf nüfusun karışık nüfusu 43.
Bu yetişkin ve yaşlı birincil miyoblastlar hücrelerin izolasyonu için, basitleştirilmiş, ekonomik ve yeniden üretilebilir bir protokol mevcutinsanlar. Bizim tecrübelerimize göre, (uydu hücreler-sınıflandırılmaktadır FACS gibi MACS- veya gibi) izolasyon ve insan primer miyoblastların kültürünün mevcut, daha sofistike yöntemler, hücrelerde transkriptomik veya proteomik değişiklikler profil olarak çalışmaların bazı türleri için idealdir. Bununla birlikte, bu yöntemler, pahalı uzman en azından bir düzeyde gerekir ve bağlı olarak saf birincil miyoblast kültürleri ve miyoblastlar overgrowing fibroblastlar düşük çoğalma oranı zor olabilir.
Biz fonksiyonel çalışmalarda kullanılmak üzere insan birincil miyoblastların basit izolasyonuna ve kültürünü izin veren bir tekrarlanabilir bir protokol mevcut. Buna ek olarak, laminin 42 kullanımı ve başarılı bir kültür 44 anahtar faktörler olarak bFGF sınırlı gerektiği sonucuna varılmıştır. Biz de hücreleri bölme ve ilk geçiş 45 az bir ön kaplama adım ne zaman santrifüj tarafından üretilen stres kaçınarak öneriyoruz. Elimizdeki, Özetlemek gerekirseizolasyon ve ayrıca kemirgenler kaslara geçerlidir ve ifade ve kas homeostasis işlevsel çalışmalar sağlayan yetişkin ve yaşlı insanların kas birincil miyoblastlar / MPCs kültürü için verimli bir protokol optimize edilmiş.
Açıklamalar
There is nothing to disclose.
Teşekkürler
This work is supported by the Biotechnology and Biological Sciences Research Council (BBSRC; BB/L021668/1), the MRC and Arthritis Research UK as part of the MRC - Arthritis Research UK Centre for Integrated Research into Musculoskeletal Ageing (CIMA) and the Wellcome Trust Institutional Strategic Support Fund (097826/Z/11/A). The authors would like to thank Dr Dada Pisconti (University of Liverpool) for her expertise and advice in the isolation of muscle progenitor cells.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 60 mm Petri dishes | Greiner Bio One | 628160 | Cellstar Cell culture dish, PS, 60/15 MM, VENTS. |
| Cell culture plates (6-well) | Sigma-Aldrich | CLS3516 | Corning Costar cell culture plates. 6-well, flat bottom (Individually wrapped) . |
| Cell culture plates (12-well) | Greiner bio-one | 657 160 | Cellstar Cell culture Multiwell Plates. |
| Culture flasks | Greiner Bio One | 690175 (25 cm2); 658175 (75 cm2). | Cellstar Filter Cap Cell Culture Flasks. |
| Standard Disposable Scalpel | Granton | 91310 | Sterile stainless steel blade, pattern: 10. |
| Pipettes | Greiner bio-one | 606 180 (5 mL); 607 180 (10 mL); 760 180 (25 mL) | Cellstar Serological Pipettes. |
| Pasteur plastic pipettes | Starlab | E1414-0311 | 3.0 mL Graduated Pasteur Pipette (Sterile), Ind. Wrapped. |
| Syringe | BD | 300613 | 20 mL BD eccentric tip syringe. |
| 0.2 µm filters | Gilson | ALG422A | Sterile Syringe Filters CA 0.2 µm 33 mm Pk50. |
| Cell strainers | Fisher Scientific | 11597522 | Cell culture strainer sterile individually packed 70 µm polypropylene. |
| Collagenase D | Roche | 11088882001 | Collagenase D; Activity: ≥0.15 U/mg |
| Dispase II | Sigma-Aldrich | D4693 | Dispase II Protease from Bacillus polymyx. Activity: ≥0.5 U/mg solid. |
| CaCl2 | Sigma-Aldrich | 449709 | Calcium chloride, anhydrous, beads, −10 mesh, ≥99.9% trace metals basis |
| Laminin | Sigma-Aldrich | 114956-81-9 | Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane. 1 mg/mL. |
| DMEM-high glucose | Sigma-Aldrich | D5671 | Dulbecco’s Modified Eagle’s Medium - high glucose. With 4,500 mg/L glucose and sodium bicarbonate, without L-glutamine and sodium pyruvate. |
| F-12 media | Gibco | 21765029 | Ham's F-12 Nutrient Mix. 1x + L-glutamine. |
| FGF-b | PetroTech | 100-18B | Recombinant human basic Fibroblast Growth Factor. |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | Fetal Bovine Serum. |
| Horse serum (HS) | Sigma-Aldrich | H1270 | Horse Serum. Donor herd, USA origin, sterile-filtered. |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | Penicillin-Streptomycin with 10,000 units penicillin and 10 mg streptomycin per mL in 0.9% NaCl, sterile-filtered. |
| L-Glutamine | Sigma-Aldrich | G7513 | L-Glutamine solution. 200 mM, solution, sterile-filtered. |
| Trypsin-EDTA | Sigma-Aldrich | T4049 | Trypsin-EDTA solution. 0.25%, sterile-filtered. |
| TrypLE Express | Gibco | 12604-013 | TrypLE Express Enzyme (1x), no phenol red. |
| DPBS (cell culture) | Sigma-Aldrich | D8537 | Dulbecco’s Phosphate-buffered Saline. Modified, without calcium chloride and magnesium chloride. |
| PBS (immunostaining) | Sigma-Aldrich | P4417-50TAB | Phosphate-buffered saline tablet. One tablet per 200 mL of deionized water (0.01 M phosphate buffer, 0.0027 M potassium chloride and 0.137 M sodium chloride, pH 7.4). |
| Methanol | Fisher | M/4000/PC17 | Methanol Analytical Reagent Grade |
| Triton X-100 | Sigma-Aldrich | T8787 | Triton X-100 for molecular biology. |
| anti-MF 20 antibody | DSHB | MF20-c 2ea 211 µg/ml. | MYH1E (MF 20) Mouse mAb. |
| anti-MyoD antibody | Cell Signaling Technology | 13812P | MyoD1 (D8G3) XP Rabbit mAb. |
| anti-Ki67 antibody | Abcam | ab16667 | Rabbit mAb to Ki67 [SP6]. |
| Anti-mouse 488 secondary antibody | Invitrogen | A-11029 | Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate. |
| Anti-rabbit 488 secondary antibody | ThermoFisher Scientific | A-11034 | Goat anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate. |
| DAPI | Sigma-Aldrich | Sigma-Aldrich | DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) |
| Senescence β-Galactosidase Staining Kit | Cell Signaling Technology | 9860 | Senescence β-Galactosidase Staining kit. |
| DMSO | Sigma-Aldrich | 41639 | Dimethyl sulfoxide. BioUltra, for molecular biology, ≥99.5% (GC). |
| Acridine Orange | Sigma-Aldrich | A8097 | Acridine Orange hydrochloride solution, 10 mg/mL in H2O. |
| Ethidium bromide | Sigma-Aldrich | E1510 | Ethidium bromide solution. BioReagent, for molecular biology, 10 mg/mL in H2O. |
| Lipofectamine 2000 | ThermoFisher Scientific | 11668019 | Lipofectamine 2000 Transfection Reagent |
| Scramble control for transfections | Qiagen | 1027271 | miScript Inhibitor Neg. Control (5 nmol) |
| Hsa-miR-378a-3p miScript Primer Assay | Qiagen | 218300 | Hs_miR-422b_1 miScript Primer Assay (targets mature miRNA: hsa-miR-378a-3p). MIMAT0000732: 5'-ACUGGACUUGGAGUCAGAAGGC |
| Anti-hsa-miR-378a-3p miScript miRNA Inhibitor | Qiagen | 219300 | Anti-hsa-miR-378a-3p miScript miRNA Inhibitor (targets mature miRNA: hsa-miR-378a-3p). MIMAT0000732: 5'-ACUGGACUUGGAGUCAGAAGGC |
| Megafuge 2.0 R Centrifuge | Heraeus | 75003085 | n/a |
| Centrifuge rotor | Heraeus | 3360 | Heraeus Sepatech Megafuge Centrifuge Rotor BS4402/A. Max. radius: 15.5 cm. |
| Eclipse Ti-E Inverted Microscope System | Nikon | n/a | Eyepieces: CFI 10X/22; Total magnification: 100X (MF20, Live/dead and Ki67). |
| Axiovert 200 inverted microscope | Carl Zeiss | n/a | Eyepieces: Carl Zeiss 1016-758 W-PI 10X/25; Total magnification: 100X (Senescence β-Galactosidase Staining). |
| Axiovert 25 inverted microscope | Carl Zeiss | n/a | Eyepieces: E-PL 10X/20. Total magnification: 100X (bright field). |
| Diaphot Inverted Tissue Culture Microscope | Nikon | n/a | Eyepiece: CFWN 10X/20. Total magnification: 100X (bright field). |
| Hydromount | National Diagnostics | HS-106 | Hydromount |
Referanslar
- Hughes, V. A., et al. Longitudinal muscle strength changes in older adults: influence of muscle mass, physical activity, and health. J Gerontol A Biol Sci. 56, B209-B217 (2001).
- Ryall, J. G., Schertzer, J. D., Lynch, G. S. Cellular and molecular mechanisms underlying age-related skeletal muscle wasting and weakness. Biogerontology. 9, 213-228 (2008).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nat Cell Biol. 12, 143-152 (2010).
- Lexell, J., Taylor, C. C., Sjostrom, M. What is the cause of the ageing atrophy? Total number, size and proportion of different fiber types studied in whole vastus lateralis muscle from 15- to 83-year-old men. J Neurol Sci. 84, 275-294 (1988).
- Grounds, M. D. Reasons for the degeneration of ageing skeletal muscle: a central role for IGF-1 signalling. Biogerontology. 3, 19-24 (2002).
- Carlson, M. E., et al. Molecular aging and rejuvenation of human muscle stem cells. EMBO Mol Med. 1, 381-391 (2009).
- Brown, D. M., Goljanek-Whysall, K. microRNAs: Modulators of the underlying pathophysiology of sarcopenia?. Ageing Res Rev. 24, 263-273 (2015).
- Brooks, S. V., Faulkner, J. A. Contraction-induced injury: recovery of skeletal muscles in young and old mice. Am J Physiol. 258, C436-C442 (1990).
- Lepper, C., Partridge, T. A., Fan, C. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138, 3639-3646 (2011).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9, 493-495 (1961).
- Charge, S. B., Rudnicki, M. A. Cellular and molecular regulation of muscle regeneration. Physiol Rev. 84, 209-238 (2004).
- Brack, A. S., Rando, T. A. Intrinsic changes and extrinsic influences of myogenic stem cell function during aging. Stem cell Rev. 3, 226-237 (2007).
- Kadi, F., Charifi, N., Henriksson, J. The number of satellite cells in slow and fast fibres from human vastus lateralis muscle. Histochem Cell Biol. 126, 83-87 (2006).
- Verdijk, L. B., et al. Satellite cell content is specifically reduced in type II skeletal muscle fibers in the elderly. Am J Physiol Endocrinol Metab. 292, E151-E157 (2007).
- Collins, C. A., Zammit, P. S., Ruiz, A. P., Morgan, J. E., Partridge, T. A. A population of myogenic stem cells that survives skeletal muscle aging. Stem cells. 25, 885-894 (2007).
- Bortoli, S., et al. Gene expression profiling of human satellite cells during muscular aging using cDNA arrays. Gene. 321, 145-154 (2003).
- Thalacker-Mercer, A. E., Dell'Italia, L. J., Cui, X., Cross, J. M., Bamman, M. M. Differential genomic responses in old vs. young humans despite similar levels of modest muscle damage after resistance loading. Physiol Genomics. 40, 141-149 (2010).
- Jejurikar, S. S., et al. Aging increases the susceptibility of skeletal muscle derived satellite cells to apoptosis. Exp Gerontol. 41, 828-836 (2006).
- McArdle, A., Dillmann, W. H., Mestril, R., Faulkner, J. A., Jackson, M. J. Overexpression of HSP70 in mouse skeletal muscle protects against muscle damage and age-related muscle dysfunction. FASEB J. 18, 355-357 (2004).
- Sousa-Victor, P., et al. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 506, 316-321 (2014).
- Cornelison, D. D. Context matters: in vivo and in vitro influences on muscle satellite cell activity. J Cell Biochem. 105, 663-669 (2008).
- Soriano-Arroquia, A., McCormick, R., Molloy, A. P., McArdle, A., Goljanek-Whysall, K. Age-related changes in miR-143-3p:Igfbp5 interactions affect muscle regeneration. ageing cell. 15, 361-369 (2016).
- Goljanek-Whysall, K., et al. Regulation of multiple target genes by miR-1 and miR-206 is pivotal for C2C12 myoblast differentiation. J Cell Sci. 125, 3590-3600 (2012).
- Georgantas, R. W., et al. Inhibition of myogenic microRNAs 1, 133, and 206 by inflammatory cytokines links inflammation and muscle degeneration in adult inflammatory myopathies. Arthritis Rheumatol. 66, 1022-1033 (2014).
- Sharples, A. P., Al-Shanti, N., Stewart, C. E. C2 and C2C12 murine skeletal myoblast models of atrophic and hypertrophic potential: relevance to disease and ageing?. Journal of cellular physiology. 225, 240-250 (2010).
- Hidestrand, M., et al. Sca-1-expressing nonmyogenic cells contribute to fibrosis in aged skeletal muscle. J Gerontol A Biol Sci Med Sci. 63, 566-579 (2008).
- Alsharidah, M., et al. Primary human muscle precursor cells obtained from young and old donors produce similar proliferative, differentiation and senescent profiles in culture. ageing cell. 12, 333-344 (2013).
- Agley, C. C., Rowlerson, A. M., Velloso, C. P., Lazarus, N. L., Harridge, S. D. Isolation and quantitative immunocytochemical characterization of primary myogenic cells and fibroblasts from human skeletal muscle. J Vis Exp. , (2015).
- Pietrangelo, T., et al. Molecular basis of the myogenic profile of aged human skeletal muscle satellite cells during differentiation. Exp Gerontol. 44, 523-531 (2009).
- Webster, C., Pavlath, G. K., Parks, D. R., Walsh, F. S., Blau, H. M. Isolation of human myoblasts with the fluorescence-activated cell sorter. Exp Cell Res. 174, 252-265 (1988).
- Woods, K., Marrone, A., Smith, J. Programmed cell death and senescence in skeletal muscle stem cells. Annals of the New York Academy of Sciences. , 331-335 (2000).
- Chakkalakal, J. V., Jones, K. M., Basson, M. A., Brack, A. S. The aged niche disrupts muscle stem cell quiescence. Nature. 490, 355-360 (2012).
- Cornelison, D. D., et al. Essential and separable roles for Syndecan-3 and Syndecan-4 in skeletal muscle development and regeneration. Genes & development. 18, 2231-2236 (2004).
- Pisconti, A., Cornelison, D. D., Olguin, H. C., Antwine, T. L., Olwin, B. B. Syndecan-3 and Notch cooperate in regulating adult myogenesis. J Cell Biol. 190, 427-441 (2010).
- Schafer, R., et al. Age dependence of the human skeletal muscle stem cell in forming muscle tissue. Artificial organs. 30, 130-140 (2006).
- Castiglioni, A., et al. Isolation of progenitors that exhibit myogenic/osteogenic bipotency in vitro by fluorescence-activated cell sorting from human fetal muscle. Stem cell reports. 2, 92-106 (2014).
- Stewart, J. D., et al. Characterization of proliferating human skeletal muscle-derived cells in vitro: differential modulation of myoblast markers by TGF-beta2. J Cell Physiol. 196, 70-78 (2003).
- Wagner, W., et al. Aging and replicative senescence have related effects on human stem and progenitor cells. PloS one. 4, e5846 (2009).
- Gaster, M., Kristensen, S. R., Beck-Nielsen, H., Schroder, H. D. A cellular model system of differentiated human myotubes. APMIS : acta pathologica, microbiologica, et immunologica Scandinavica. 109, 735-744 (2001).
- Gaster, M., Beck-Nielsen, H., Schroder, H. D. Proliferation conditions for human satellite cells. The fractional content of satellite cells. APMIS : acta pathologica, microbiologica, et immunologica Scandinavica. 109, 726-734 (2001).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods Mol Biol. 798, 21-52 (2012).
- Chowdhury, S. R., et al. One-Step Purification of Human Skeletal Muscle Myoblasts and Subsequent Expansion Using Laminin-Coated Surface. Tissue engineering. Part C, Methods. 21, 1135-1142 (2015).
- Mamchaoui, K., et al. Immortalized pathological human myoblasts: towards a universal tool for the study of neuromuscular disorders. Skeletal muscle. 1, 34 (2011).
- Natarajan, A., Lemos, D. R., Rossi, F. M. Fibro/adipogenic progenitors: a double-edged sword in skeletal muscle regeneration. Cell cycle. 9, 2045-2046 (2010).
- Ciofani, G., et al. Hypergravity effects on myoblast proliferation and differentiation. J Biosci Bioeng. 113, 258-261 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır