Method Article
Preparação e cultivo de células precursoras Miogênica / mioblastos primárias de músculo esquelético de Adulto e Idoso Humanos
Neste Artigo
Resumo
Este protocolo descreve um método robusto, simples e reprodutível de isolamento e cultivo de células progenitoras a partir de mioblastos de músculo esquelético de adultos e idosos. Os músculos usados aqui incluem músculos do pé e da perna. Esta abordagem permite o isolamento de uma população enriquecida de mioblastos primários para estudos funcionais.
Resumo
homeostase músculo esquelético depende do crescimento muscular (hipertrofia), atrofia e regeneração. Durante o envelhecimento e em várias doenças, perda de massa muscular ocorre. Perda de massa e função muscular está associada com o tipo de fibra muscular atrofia, tipo de fibra de comutação, regeneração muscular com defeito associado à disfunção das células satélites, células-tronco musculares e outros processos fisiopatológicos. Estas alterações estão associadas com alterações na intracelular, bem como nichos locais e sistémicos. Além dos modelos de roedores mais vulgarmente utilizados de envelhecimento muscular, existe uma necessidade de estudar a homeostase do músculo e desperdiçando utilizando modelos humanos, os quais devido às implicações éticas, consistem predominantemente de culturas in vitro. Apesar da ampla utilização de células humanas Miogênica progenitoras (PPM) e mioblastos primárias em myogenesis, há poucos dados sobre o uso de humanos mioblastos primário e miotubos culturas para estudar os mecanismos moleculares que regulam diferentes aspectos da mus associada à idadeemaciação CLE, auxiliando na validação dos mecanismos de envelhecimento proposto no músculo de roedores. O uso de PPM humanos, mioblastos primários e miotubos isoladas de adultos e idosos, pessoas fornece um modelo fisiologicamente relevante dos mecanismos moleculares dos processos associados com o crescimento muscular, atrofia e regeneração. Aqui descrevemos em pormenor um protocolo robusto, barato, eficiente e reprodutível para o isolamento e manutenção de PPM humanos e sua progénie - mioblastos e de miotubos de amostras de músculo humanas utilizando digestão enzimática. Além disso, foi determinado o número de passagens a que mioblastos primários de adultos e idosos submetidos a senescência em uma cultura in vitro. Finalmente, que mostram a capacidade de transfectar estas mioblastos e a capacidade de caracterizar a sua capacidade proliferativa e de diferenciação e propor a sua aptidão para a realização de estudos funcionais de mecanismos moleculares de miogénese e desgaste muscular in vitro.
Introdução
perda de doença- e relacionada com a idade progressiva de massa e função resultados músculo esquelético em fragilidade, a diminuição da força e diminuição da qualidade de vida das pessoas idosas. O músculo esquelético é responsável por aproximadamente 40% de massa corporal 1. Durante o envelhecimento e a doença, atrofia progressiva de miofibras individuais e redução da qualidade do músculo devido à infiltração de gordura e fibrose ocorre 1, 2, 3, 4, 5, 6. Recentemente, tem sido proposto que as diferenças específicas de espécies em envelhecimento do músculo esquelético ocorrer, especificamente que a perda de fibra muscular que ocorre em roedores, não pode ocorrer em humanos 7. No entanto, as restantes fibras musculares de mamíferos com idades são caracterizadas por um aumento da susceptibilidade a danos e a regeneração deficiente 8. Reparação muscular adulto e manutenção é mediada por células satélites 9, 10. Após a lesão muscular e outras pistas relevantes, as células satélites são ativados e proliferar. Um subconjunto das células retorna para o estado de repouso e o restante progride em mioblastos (células progenitoras Miogênica - PPM). Estes contribuem para reparar da myofiber existente 11. A funcionalidade das células satélite determina o sucesso da regeneração do músculo e as mudanças na disponibilidade de células satélites com o envelhecimento tem sido demonstrada 12, 13, 14, 15. Além disso, as células satélites do músculo de seres humanos velhos e roedores mostram um interruptor perfil transcricional e reduziu o potencial regenerador 16, 17, 18, 19. Células satélites do músculo a partir de ratinhos de idade e seres humanos também foram exibidas para submeter a senescência resultando na sua funcionalidade reduzida 20.
A linha de células mais estabelecido permitindo o estudo da homeostase muscular é linha de células C2C12 de murino 21. Uma quantidade significativa de estudos também têm utilizado mioblastos primários de murino 22. Estas culturas levaram a uma compreensão significativa de murino e miogénese vertebrado, bem como de regeneração muscular, atrofia de miotubos / fibra muscular, e hipertrofia processos que ocorrem durante a doença muscular e envelhecimento 23, 24, 25, 26. Mais recentemente, vários grupos têm descrito usando mioblastos primários humanos para estudar myogenesis e envelhecimento muscular. No entanto, há falta de consenso com regarDS para diferenças entre mioblastos primários isolados do músculo de adultos e seres humanos com idades entre 27, 28, 29, 30, 31. Apesar das diferenças, caracterizado por o meio ambiente sistémica e local que ocorrem durante o desenvolvimento, o envelhecimento e a doença 6, 32, 33, 34, In vitro de mioblastos e de miotubos culturas continuam a ser as ferramentas mais acessíveis para o estudo dos mecanismos moleculares associados com o desenvolvimento muscular, crescimento e atrofia. Além disso, estes estudos fornecem não apenas um robusto, mas também uma elevada taxa de transferência-relativamente rápida, de baixo custo e com a ferramenta vitro. Além disso, as implicações éticas associadas com estudos de músculos humanos significa que para experiências funcionais que envolvem manipulações de expressão gênica , In vitro humanos mioblastos e miotubos culturas continuam a ser a única alternativa disponível para organismos modelo vertebrados.
Aqui, mostramos um protocolo experimental simples para o isolamento robusto, barato e reprodutível de mioblastos primários, ou PPM, a partir do músculo do adulto e as pessoas com idade e descrevem as condições padronizadas de cultura in vitro (Figura 1). Como culturas primárias de músculo geralmente contêm fibroblastos, além de mioblastos, recomendamos um passo preplating visando uma melhor pureza e qualidade de mioblastos primários. Para resumir, nós estabelecemos um protocolo que permite o isolamento eficiente e reprodutível, da cultura e estudos funcionais de PPM / mioblastos primários enriquecidos e funcionais do músculo esquelético de adultos e idosos.
Protocolo
Todos experimentação envolvendo tecido humano aqui descrito foi previamente aprovado pela Universidade de Liverpool, Hospital Universitário de Aintree Hospital e Comitê de Ética South West Wales Research (Aprovação No: 13 / WA / 0374) e os experimentos foram realizados de acordo com orientações de boas práticas. A Universidade de Liverpool agiu como a ética patrocinar para este estudo. Todos os doadores deram consentimento informado para a inscrição deste estudo. Os músculos foram isolados de pessoas (IMC <25): adultos: 30 ± 2,8 anos de idade e idade: 69 ± 5 anos de idade.
1. Preparação para a Cultura
- Revestimento de superfícies de cultura com laminina
- Preparar uma solução de trabalho de 10 ug / ml de laminina em 1X DPBS (Dulbecco Salina Tamponada com Fosfato).
- Pipetar uma quantidade mínima de solução de laminina para cobrir completamente a superfície sobre a qual as células vão ser banhado (Tabela 1). incubar tele prato de cultura, pelo menos, 30 min numa atmosfera humidificada de 37 ° C, 5% de CO2 antes do plaqueamento das células. Lidar com laminina com cuidado, evitando o uso de vórtice. A solução de trabalho de 10 ug / ml de laminina diluída em DPBS pode ser armazenado a 4 ° C e re-utilizada várias vezes.
- Usar um 60 milímetros (20 cm2) numa caixa de Petri ou 2 poços de uma placa de 6 poços (2 x 10 cm2) por ~ 18-19 mg de músculo esquelético a chapear as células (5,50 x 10 4 células no total). Realizar contagem de células em todos os momentos quando chapeamento células para estudos funcionais.
NOTA: As amostras foram originalmente obtidas a partir de cirurgias no pé (extensor digitorum brevis, tibial anterior ou músculos abdutores hálux) de pacientes do sexo feminino (adulto: 30 ± 2,8 anos, idade: 69 ± 5 anos de idade, IMC <25).
- Preparação da solução enzimática
- Prepare 250 mM CaCl solução de 2 de trabalho: 277 mg de estoque CaCl 2 em 10 mL 1x DPBS. Filtra-se a assimlução com uma membrana de filtro de 0,2 um e armazenar a 4 ° C.
- Preparar uma solução de trabalho de 1,5 U / mL de colagenase D, 2,4 U / mL de Dispase II e CaCl 2 2,5 mM em DMEM isento de soro (de Dulbecco modificado por Eagle Médium) (Tabela 2).
- Misturar bem e filtra-se a solução enzimática através de uma membrana de filtro de 0,2 um para esterilização. Preparar a solução enzimática com antecedência e congelar para baixo (-20 ° C) em alíquotas para utilização futura.
2. Tissue Digestão: Mecânica e enzimática dissociação
- Após a recolha da amostra, manter músculo a 4 ° C em DPBS até a digestão. Preparar um volume mínimo de 2 ml de colagenase-dispase-CaCl2 por 18 - 19 mg de tecido do músculo e aquecê-la a 37 ° C antes da dissociação de tecidos.
- Imergir a biópsia do músculo brevemente em etanol a 70%, lava-se com DPBS frescos e colocar o tecido sobre uma nova placa de Petri com 1 mL de enzimáticosolução.
- Descarte tanto tecido fibrótico e gordura quanto possível e rasgar o músculo rapidamente, mas com cuidado em pequenos, mas distinguíveis peças (aproximadamente> 0,5 mm2) com tesoura estéril ou um bisturi cirúrgico (lâmina n º 10).
- Transferir a amostra para um tubo de 50 mL com os restantes 1 ml de colagenase-dispase-CaCl2.
- Incubar o tecido a 37 ° C até 30 - 40 min. Mover os tecidos musculares, agitando suavemente o tubo a cada 5-10 min.
- Revista as pipetas com meios para evitar a adesão das células libertadas para as paredes de plástico das pipetas. Adicionar 2 volumes de meio de crescimento estéril, por exemplo, 4 mL de meio DMEM 20% FBS (Soro Fetal Bovino), 1% de L-glutamina e 1% de P / S (Penicilina-Estreptomicina), para parar a digestão.
- Pipetar cima e para baixo várias vezes com uma pipeta de 5 mL para ajudar a libertação das células a partir das fibras musculares.
NOTA: A amostra é geralmente completamente dissociado devido ao seu pequeno tamanho. However, se fragmentos de músculos ainda permanecem, utilize uma segunda incubação com as peças restantes de músculo e com uma solução enzimática fresca. - Filtrar a solução através de músculo de um filtro celular de 70 pM ao longo de um tubo cónico de 50 mL. Lave as células restantes com mais meios e filtro através do filtro.
- Centrifugar a 443 xg durante 5 min à temperatura ambiente para sedimentar as células. Elimine o sobrenadante com cuidado.
- Dissolve-se o sedimento em F-12 media (-12 F mistura de nutrientes de Ham), 20% de FBS, 10% HS (Soro de Cavalo), 1% de P / S, 1% α-glutamina e 2,5 ng / mL de FGF-b ( recombinante humana de fibroblastos factor de Crescimento de base). Aqui, o uso de 4 ml de meio por 60 milímetros de Petri.
3. Sementeira de Células
- Recolhe-se o vaso de cultura previamente revestidos com 10 ng / ml de laminina da incubadora (secção 1.1).
- remova cuidadosamente o excesso de laminina da placa de cultura, e evite tocar a superfície (ou ele vai perturbar a estrutura da proteína). lavara placa de cultura com DPBS (opcional).
- Placa as células directamente sobre o recipiente revestido laminina e incubar durante 24 horas numa atmosfera humidificada a 37 ° C, 5% de CO2.
- Visualizar as células sob um microscópio de campo brilhante (100X ampliação total) no dia seguinte. Redondo células pequenas ligado à superfície e detritos remanescentes podem ser vistos no meio de cultura.
- Alterar a meios frescos para F-12 meios complementados com 20% de FBS, 10% HS, 1% de P / S, 1% α-glutamina e 2,5 ng / mL de FGF-b.
4. Cultura e Passaging de células
- Mudar os meios de comunicação a cada 2-3 d e dividir as células assim que os grupos de células são visíveis ao microscópio (ampliação de 100X total, o exemplo da Figura 2, as células de pessoas idosas, passagem 0, após 7 d), a fim de evitar espontânea diferenciação.
- Na primeira passagem (P1), altere a mídia para DMEM alta concentração de glicose complementado com 20% de FBS, 10% HS, 1%P / S, 1% α-glutamina. Evitar o uso de FGF-b a partir de este ponto, como o FGF é um agente mitogénico potente e factor importante no início da cultura, mas pode promover o crescimento excessivo de fibroblastos se utilizado mais tempo em cultura.
- Para passaging celular:
- Remova a mídia e lavar as células duas vezes com DPBS.
- Adicionar um volume mínimo de 0,25% de EDTA-tripsina para cobrir a superfície das células. Rocha suavemente para assegurar que todas as células estão cobertos pela solução de descolamento, incubar durante 10 segundos à temperatura ambiente, e removê-lo.
- Incubam-se as células numa atmosfera humidificada a 37 ° C, 5% de CO 2 incubadora durante 3-5 min. Toque suavemente e verificar sob o microscópio de luz brilhante (100X ampliação total) que as células são arredondados, mas não completamente separado da superfície. Se nenhuma alteração é observada nas células, incubar durante mais 5 min.
- Adicionar 5 ml de Meio de Crescimento (DMEM alta concentração de glicose complementado com 20% de FBS, 10% HS, 1% P / S, 1% α-glutamina) para recolher as células, misturabem e transferir as células com os novos meios de comunicação para um frasco T75. Lave as células restantes repetindo este passo com outro 5 ml de Meio de Crescimento (10 mL no total para um frasco T75).
- Para preplate (preferível na primeira passagem), incubar as células numa atmosfera humidificada a 37 ° C, 5% de CO2 durante 40 min. Recolher o sobrenadante com as células que não ligam e incubar-los em um novo frasco T75. Isto deverá enriquecer a cultura em mioblastos, como a maioria dos fibroblastos deve ter anexado no primeiro balão.
- Mudar os meios de comunicação a cada 2-3 d e dividir as células de 1 a 4, o mais rapidamente à medida que atingem 70% de confluência para um rendimento máximo.
- Para a diferenciação, uma vez que as células atingiram 70-80% de confluência, mudar o meio de cultura com a diferenciação médio (DM): DMEM-elevado teor de glucose complementado com 2% HS, 1% de P / S, 1% α-glutamina. As células devem ser diferenciados dentro de 5 - 7 d, dependendo da qualidade e pureza da c mioblastosultura.
5. Transfec�es Protocolo
- Semente de 50.000 células / poço numa placa de 12 poços para ensaios MF 20, senescência e viabilidade. células de cultura em lamelas ou em um prato revestido com laminina. Para a coloração de Ki67, semente de 25.000 células / poço numa placa de 12 poços.
- Para as transfecções, seguir o procedimento do fabricante, utilizando 5 mL de reagente de transfecção, 100 nM de controlo microARN imitar ou inibidor, 100 nM de microARN mímica ou 100 nM de inibidor de microARN por poço, com um volume total de 1 mL.
- Alterar a diferenciação Meio 6 h após transfecção (DMEM-elevado teor de glucose complementado com 2% HS, 1% de P / S, 1% α-glutamina). Para as experiências de proliferação, corar as células 2 d após a transfecção; para a senescência, 7 d após a transfecção; e para a coloração MF20, sete dias após a transfecção.
6. imunocoloração das células
- Ki67, MyoD e MF 20 imunocoloração
- Prepare bloco 1 (10HS% e 0,1% de Triton X em PBS) e bloquear dois (10% HS e 0,05% de Triton-X em soluções de PBS). Utilizar 500 ul de reagente por poço para uma placa de 12 poços.
NOTA: Execute os seguintes passos usando um agitador durante as etapas de incubação. - Remova a mídia a partir das células.
- Lavar as células com PBS.
- Fixar as células com metanol frio durante 10 minutos em uma cadeira de balanço.
- Remover o metanol a partir das células e lavar 3x com PBS durante 5 min de cada vez.
- Adicionar bloco de uma solução e incubar as células num agitador à temperatura ambiente durante 1 h.
- Adicionar solução de anticorpo primário: para a coloração Ki67, use mAb Coelho para Ki67 (diluição 1: 1.000 no bloco 2); para MyoD, use MyoD1 (D8G3) mAb XP coelho (diluição 1: 100 no bloco 2); para MF 20 coloração, o uso MYH1E (MF 20) anticorpo primário (DSHB, diluição 1: 1.000 no bloco 2).
- Incubam-se as células com o anticorpo primário durante 1 h (RT) para S / N (4 ° C) num agitador rotativo.
- Recolhe-se o AB primária (que pode ser re-utilizada várias vezes se stovermelho, a 4 ° C).
- Lavar as células 3x com PBS, 5 min cada vez.
- Adicionar o anticorpo secundário adequado: por coloração de Ki67 ou MyoD, IgG de cabra anti-coelho (H + L) anticorpo secundário, conjugado com Alexa Fluor 488 (diluição 1: 1000 em PBS); MF 20 para a coloração, de cabra anti-ratinho IgG (H + L) anticorpo secundário, conjugado com Alexa Fluor 488 (diluição 1: 1000 em PBS).
- Envolva a placa que contém as células e incuba-se o anticorpo secundário durante 2 h no escuro num agitador à temperatura ambiente.
- Lavar as células 3x com PBS durante 5 min de cada vez.
- Adicionar solução DAPI (1: 1000 de diluição em PBS) para as células e incuba-se no agitador à temperatura ambiente durante 5 - 10 min.
- Lavar as células 3x com PBS durante 5 min de cada vez.
- Adicionar 1 ml de PBS fresco.
- Montar as células nas lamelas na solução de montagem ou selar a placa que contém as células em PBS com Parafilm para evitar a evaporação.
- Armazenar a 4 ° C.
- Visualizar as células como microscópio de fluorescência mais rapidamente possível (o mais tardar 2 semanas).
- Prepare bloco 1 (10HS% e 0,1% de Triton X em PBS) e bloquear dois (10% HS e 0,05% de Triton-X em soluções de PBS). Utilizar 500 ul de reagente por poço para uma placa de 12 poços.
- ensaio de viabilidade
- Remova a mídia a partir das células.
- Lavar as células em PBS.
- Adicionar 1: 1000 de brometo de etídio e 1: 1000 de laranja acridina diluído em PBS.
Cuidado: Tome cuidado e trabalhar dentro de normas de saúde e segurança - brometo de etídio é um agente cancerígeno. - Envolva a placa que contém as células em solução de coloração e incubar à temperatura ambiente no agitador durante 5 min.
- Tome imagens das células com um microscópio de fluorescência: canal verde para laranja de acridina; canal vermelho para o brometo de etídio.
Resultados
PPM / mioblastos primários deve ser visível 24 h após a semeadura sobre a superfície revestida com laminina (Figura 2). As células devem adoptar uma forma fusiforme e deve expressar MyoD ainda na passagem 4 (Figura 1A, B). Os fibroblastos podem ser distinguidos pela sua morfologia semelhante a estrela e a falta de expressão de MyoD (Figura 1B, C). Uma vez que as células são ligadas no dia seguinte, os meios devem ser substituídos por meios frescos de bFGF. Os meios de cultura deve ser substituído a cada 48 h.
Os resultados representativos aqui mostrados e os dados publicados do nosso laboratório 22 objectivo de apoiar o nosso protocolo de isolamento e cultura e demonstram as diferentes técnicas que podem ser utilizadas para estudos funcionais de mioblastos primários humanos. a proliferação de mioblastos podem ser estudadas usando Ki67 imunocoloração e viabilidade usando staining para o ensaio de viabilidade celular (Figura 3). Para a diferenciação, os meios de cultura deve ser alterado para meios de diferenciação. Miotubos deve formar em 5-7 d e ser cadeia pesada de miosina positivo (Figura 3). Note-se que a formação de miotubos pode ser menos eficiente quando mioblastos são isoladas a partir do músculo de idosos (Figura 3). A senescência (SA-β-galactosidase) coloração também pode ser realizada a fim de estabelecer a percentagem de células senescentes na cultura (Figura 3). Observou-se que as culturas com mais longos (Figura 3, 4) de passagem, mais mioblastos isolados de músculo de idosos mostram senescência.
Para estudos funcionais, do gene e microARN expressão pode ser manipulado usando entrega de transfecção mediada por lipofílico reagentes de vectores de expressão, siRNAs, e imita antimiRs microRNA (Figura 4). Isto permite a 40 -70% de eficácia de transfecção com o gene de níveis / microRNA ser positiva ou negativa regulada dentro de uma gama fisiológica (Figura 4; 22).
| recipiente de cultura | Aprox. Área (por poço) | Volume de 10 ug / ml de laminina |
| prato de 35 milímetros | 10 cm 2 | 1 mL |
| prato 60 milímetros | 20 cm 2 | 2 ml |
| prato 100 milímetros | 60 cm 2 | 4 ml |
| placa de 24 poços | 2 cm 2 | 200 ^ l / poço |
| placa de 12 poços | 4 cm 2 | 500 ^ l / poço |
| placa de 6 poços | 10 cm 2 | 1 mL / poço |
| T25 | 25 cm 2 | 3 ml |
| T75 | 75 cm 2 | 5 ml |
Tabela 1. Recomendados volumes mínimos de laminina-DPBS Solution (10 ug / mL) para a Cultura Revestimento de superfície.
| Atividade específica / Massa molar | concentração final | Massa ou volume necessário para a solução de 10 ml | |
| colagenase D | 0,15 U / mg | 10 mg / ml (1,5 U / ml) | 100 mg |
| dispase II | 0,5 U / mg | 4,8 mg / mL (2,4 U / ml) | 48 mg |
| 250 mM de CaCl2 | 1100,98 g / mol | 2,5 mm | 100 uL |
Tabela 2. Preparação da Enzima para Muscle digestão.
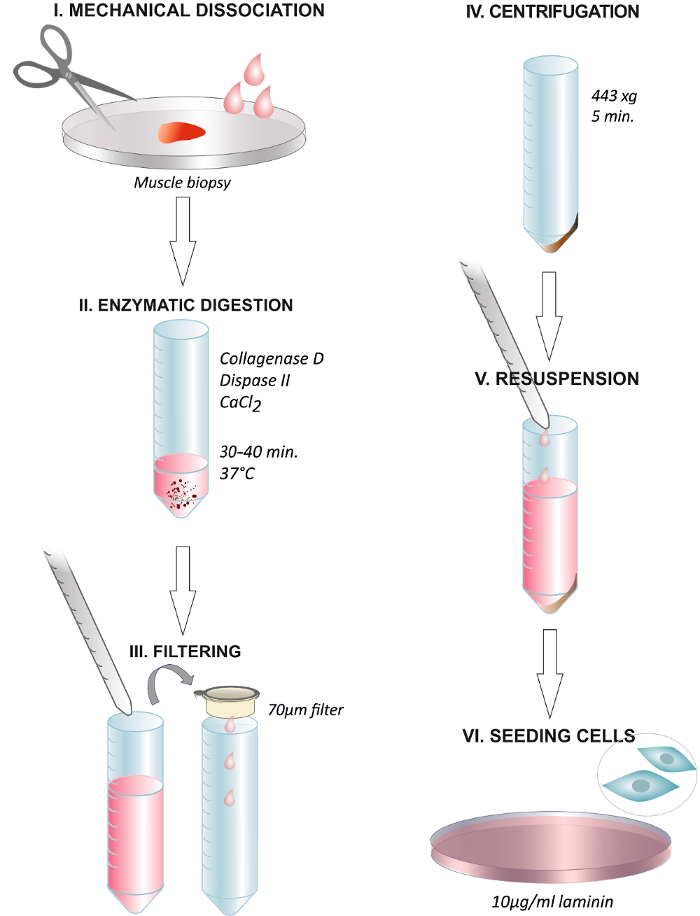
Figura 1. Gráfico Resumo Resumindo os passos do protocolo. A dissociação da biópsia do músculo humano com uma tesoura ou com um bisturi cirúrgico (I). A incubação com a solução enzimática a 37 ° C durante 30 - 40 min (II). Final da digestão através de adição de meio de crescimento e filtrar a solução através de um filtro de membrana de 70 ^ M para um tubo de centrífuga (III). A centrifugação a 443 xg durante 5 min (IV). Descartar o sobrenadante e ressuspender em meio de crescimento contendo 2,5 ng / ml de FGF (V). Plaqueamento das células em um prato revestido com 1081; g / ml de laminina e mudando a mídia após 24 h (VI). Por favor clique aqui para ver uma versão maior desta figura.
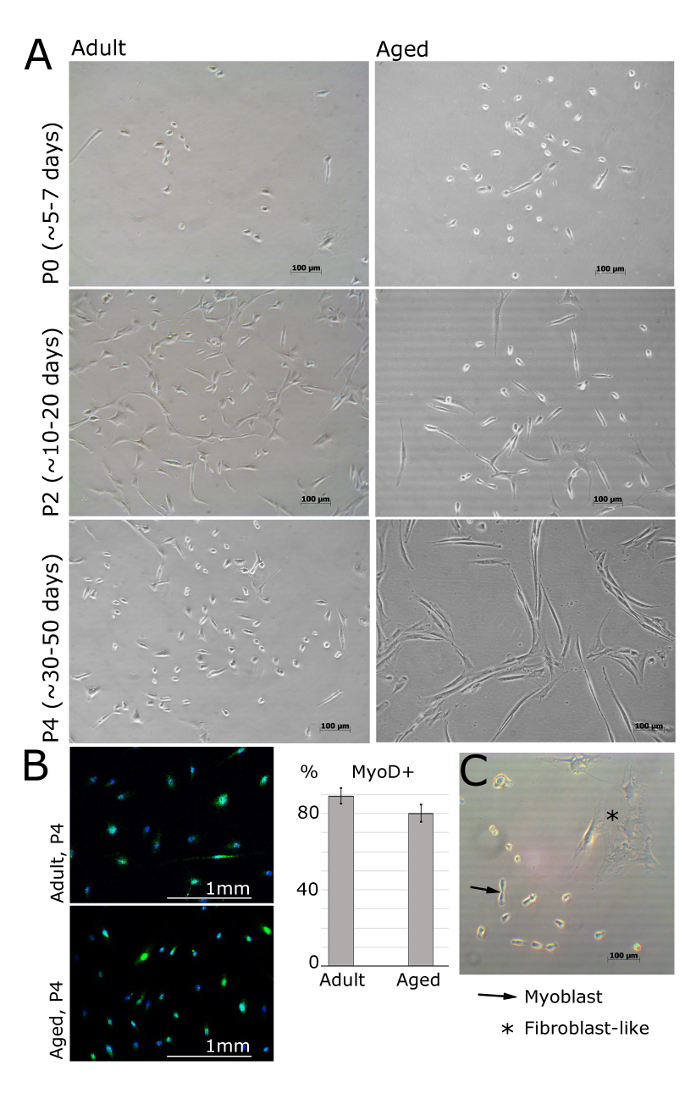
Figura 2. Os mioblastos isolados de músculo de Adultos e seres humanos com pelo passagens diferentes. Uma. Imagens representam mioblastos isolados de extensor curto dos dedos, tibial anterior ou abdutores hálux músculos de pacientes do sexo feminino (adulto: 30 ± 2,8 anos, idade: 69 ± 5 anos de idade, IMC <25). Na passagem 0 e depois de 5 dias de ser banhado, células ainda são redondos e pequenos, mas visíveis sob o microscópio de luz brilhante (A). Mioblastos, então, adotar uma forma alongada, como mostrado na passagem 2 (A). MyoD é expresso em mioblastos, mas não em fibroblastos (B). A quantificação de células positivas MyoD é mostrado; barras de erro mostram o desvio padrão; n = 3 (B). Imagem representativa demonstrar as diferenças entre a morfologia de fibroblastos e mioblastos (C). Por favor clique aqui para ver uma versão maior desta figura.
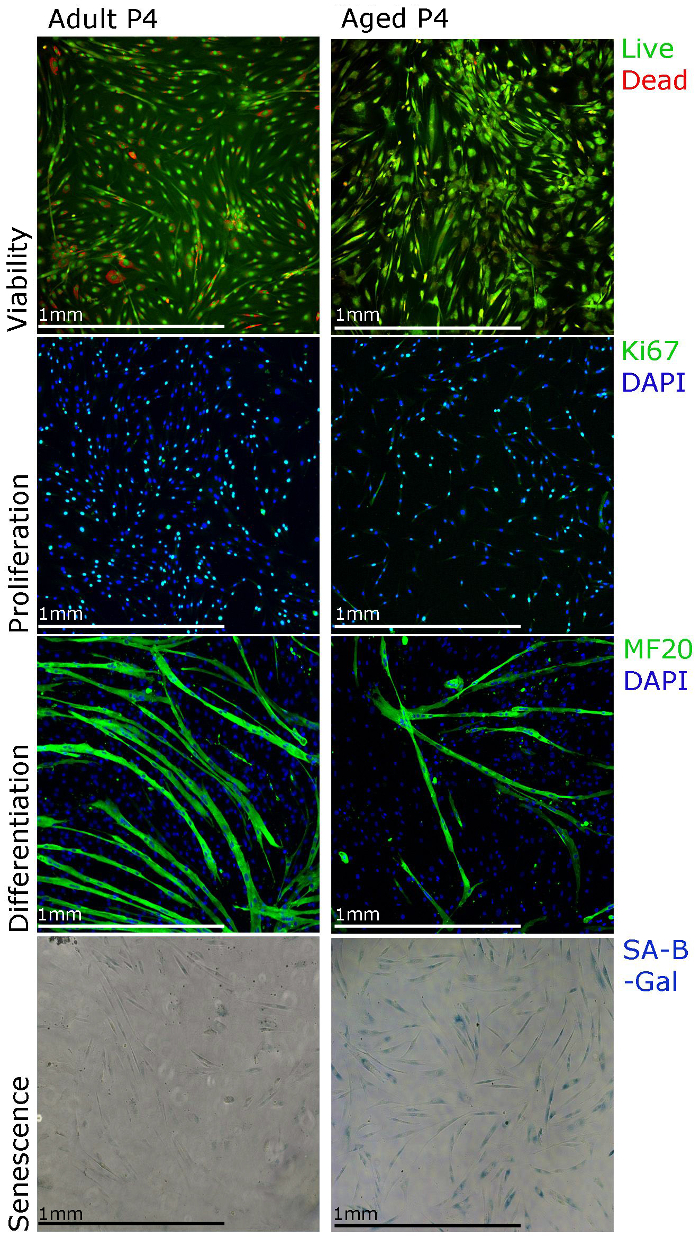
Figura 3. Os mioblastos primários humanos podem ser caracterizados utilizando diferentes técnicas de coloração. A viabilidade das células pode ser visualizada usando coloração por ensaios de viabilidade celular, a proliferação pode ser avaliada utilizando Ki67 imunocoloração, a diferenciação pode ser avaliada utilizando MF20 (cadeia de miosina pesada) imunocoloração e senescência pode ser visualizada utilizando SA-beta-gal (SA-β-galactosidase ) coloração. ecsource.jove.com/files/ftp_upload/55047/55047fig3large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
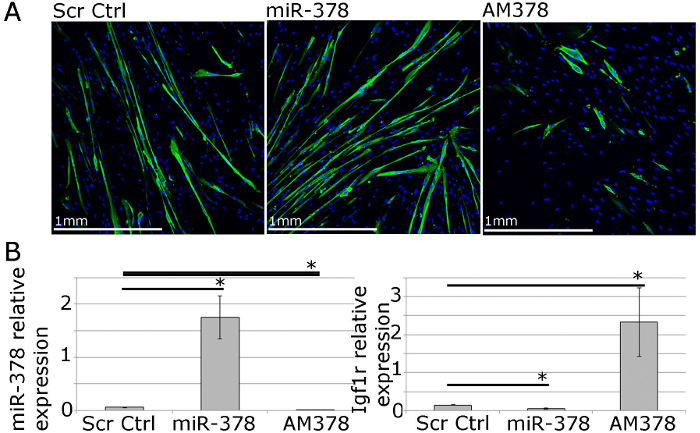
Figura 4. Os mioblastos primários humanos podem ser usados para estudos funcionais da homeostase Muscle In Vitro. A. MF20 (miosina de cadeia pesada) imunocoramento miotubos primários diferenciados de seres humanos adultos que mostram os efeitos da sobre-expressão ou inibição de miR-378 em miotubos tamanho e número. B. qPCR que mostra a expressão relativa de miR-378 e IGF1R, validado gene alvo de miR-378, a seguir o miR-378 sobre-expressão ou inibição em mioblastos primários humanos. Expressão em relação ao Rnu-6 e β-2-microglobulina, respectivamente, é mostrada. As barras de erro mostram SEM; n = 3, * - p <0,05, teste t de Student.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
Discussão
Aqui, apresentamos um método simples, robusto, barato, reprodutível e eficiente de isolar células progenitoras de músculo / mioblastos primários de adultos e idosos seres humanos de extensor brevis digitorium, tibial anterior ou hálux abdutores músculos. Este protocolo visa permitir estudos usando mioblastos primários humanos de adultos e idosos seres humanos, especialmente quando os métodos mais sofisticados, tais como FACS- ou MACS-ordenação, não são possíveis ou não prático.
O método de isolamento apresentada neste manuscrito demora cerca de 2 horas. Durante o isolamento, músculo foi lavado em etanol a 70%, a fim de evitar a contaminação. Antes da dissociação enzimática do músculo, é importante para reduzir o músculo, mas em pequenos pedaços visíveis, e evitar danos nas células do excesso de picagem. Os resultados de digestão na dissociação de fibras musculares ea liberação de células satélites e células precursoras miogênicas. No nosso caso para ~ 20 mg de músculo esquelético, um de 60 mm(20 cm2) uma placa de Petri foi a área de superfície mais adequada para a colheita das células. As células plaqueadas sobre uma superfície maior mostrou proliferação reduzida, enquanto que as células plaqueadas sobre uma superfície menor mostraram um aumento da morte celular e a aglutinação.
Após o isolamento, as células foram cultivadas e expandidas em placas cobertas de laminina. A utilização de superfícies não revestidas tenderam a diminuir o sucesso do isolamento. Por este motivo, as células podem ser colhidas de um modo preferido sobre uma superfície pré-revestido directamente após o isolamento. culturas de fibroblastos enriquecido predominará em vez de células de mioblastos-se derivados das células são colhidas sobre uma superfície não-revestido directamente após o isolamento. Além de laminina, a utilização de outras soluções, tais como a fixação das células de Matrigel e reagentes à base de colagénio podem ser usados. As soluções de revestimento podem incluir factores de crescimento e outros compostos que promovem o crescimento celular, mas estes poderiam alterar o comportamento das células e, por conseguinte, os resultados experimentais. Dentronossa experiência, 10 ug / ml de laminina é a concentração óptima e o reagente de revestimento apropriado para células satélite e de fixação de mioblastos e de proliferação, uma vez que carece de qualquer factor de crescimento ou outros complementos. Além disso, laminina está naturalmente presente na lâmina basal, directamente ligado ao sarcolema, que desempenha uma função chave na ligação de células satélite e migração através da fibra muscular esquelética.
Os suplementos do meio de cultura pode também ter uma influência prejudicial sobre o comportamento do primário de mioblastos. Por exemplo grupos de fatores de crescimento, tais como FGF ou IGF, ter efeitos pleiotrópicos sobre culturas de mioblastos primário, com o FGF-2 controlando tanto da resposta mitogénica e morte celular programada 31. Por conseguinte, é necessário controlar rigorosamente as condições de cultura, especialmente porque as diferenças no comportamento de mioblastos primários isolados de músculo de adultos com idade e pessoas são muito provável que seja devido à pureza óf as culturas e a probabilidade de fibroblastos ultrapassagem do mioblastos em cultura durante culturas a longo prazo 35. Usámos uma hora de pré-plaqueamento das células durante a primeira divisão para uma superfície não-revestidos, a fim de diminuir a contaminação das culturas com fibroblastos.
O método que descrevemos é apropriado para o isolamento de células progenitoras miog�icas dos músculos de ambos os seres humanos com idades compreendidas entre adulto e. A cula isolada consiste de uma população miogénica representativos de células, tal como indicado por uma alta percentagem de células miogénicas (expressão MyoD e propriedades miog�icas visualizadas por imunocoloração MF20 nas Figuras 1 e 2) e pode ser utilizado como um modelo in vitro para estudos funcionais de processos associados com a homeostase do músculo.
Estudos anteriores caracterizaram o isolamento e diferenças nas propriedades, ou a falta dela, de mioblastos primários humanos a partir deadultos e idosos 6, 20, 27, 28, 29, 30, 31, 35, 3 6, 37, 38. A existência de PPM humano geriátrica e / ou não-funcional tem sido demonstrada 6, 20, 22. No entanto, não houve diferença no comportamento de PPM humanos isolados de fresco também foi mostrado 27. Nosso protocolo permite o isolamento de mioblastos primários que retêm pelo menos parcialmente, o seu fenótipo, tal como um reduzido potencial proliferativo ou senescência de mioblastos primários isolados de músculo de idosos e permite a utilização de estescélulas para estudos funcionais dos mecanismos moleculares da homeostase do músculo durante o envelhecimento 22.
Os mioblastos primários isolados usando o método aqui descrito pode ser utilizado não só para os estudos de diferenciação, mas também miog�icas para investigar mudanças intracelulares, tais como alterações na expressão de genes que ocorrem em células precursoras miog�icas humanos durante o envelhecimento. No entanto, as mudanças que ocorrem nas células durante a cultura prolongada ex vivo precisam ser considerados quando se analisa alterações fenotípicas e genotípicas ocorrem durante o envelhecimento. Recomendamos a utilização de células recém-isoladas para esta finalidade.
Além disso, o método de cultura de mioblastos primários descritos aqui permite a expansão e relativamente cultura de longo prazo de mioblastos primários humanos, permitindo estudos funcionais in vitro robustos. Nós mostramos anteriormente que as células progenitoras miog�icas isolado utilizando o nosso método pode ser utilizado tanto para perfil de expressão e Fuestudos nctional de processos associados ao envelhecimento muscular 22. Este método é também aplicável para os músculos do adulto e roedores velhos e permite o isolamento de uma cultura enriquecida de mioblastos que pode ser utilizado para perfis de alterações genéticas e epigenética durante o envelhecimento e estudos funcionais 22. As limitações deste método incluem a utilização de, até certo ponto, a população mista de células, em vez de uma população pura de células satélites, que pode ser obtido usando métodos mais sofisticados publicados 6, 28, 29, 39, 40, 41, 42, 43.
Nós apresentamos um protocolo simplificado, acessível e reprodutível para o isolamento de células mioblastos primários de adultos e idososhumanos. Em nossa experiência, os métodos disponíveis, mais sofisticadas de isolamento e cultura de mioblastos primários humanos (como MACS- ou células satélites FACS-ordenadas) são ideais para alguns tipos de estudos, tais como perfis de mudanças transcriptomic ou proteômica nas células. No entanto, estes métodos são caros, requerem pelo menos algum nível de especialização, e pode revelar-se difícil devido à taxa proliferativa baixo de culturas e fibroblastos overgrowing mioblastos puros mioblastos primário.
Apresenta-se um protocolo reprodutível, que permite o isolamento e cultura simples de mioblastos humanos primários para utilização em estudos funcionais. Além disso, propomos a utilização da laminina 42 e o uso limitado de bFGF como factores-chave para uma cultura de sucesso 44. Propomos também evitando o estresse gerado por centrifugação quando a divisão das células e uma etapa de pré-metalização na primeira passagem 45. Para resumir, temosoptimizado um protocolo eficiente para o isolamento e cultura de mioblastos primários / PPM a partir dos músculos do adulto e seres humanos envelhecidos que também é aplicável para os músculos de roedores e permite a expressão e estudos funcionais da homeostase do músculo.
Divulgações
There is nothing to disclose.
Agradecimentos
This work is supported by the Biotechnology and Biological Sciences Research Council (BBSRC; BB/L021668/1), the MRC and Arthritis Research UK as part of the MRC - Arthritis Research UK Centre for Integrated Research into Musculoskeletal Ageing (CIMA) and the Wellcome Trust Institutional Strategic Support Fund (097826/Z/11/A). The authors would like to thank Dr Dada Pisconti (University of Liverpool) for her expertise and advice in the isolation of muscle progenitor cells.
Materiais
| Name | Company | Catalog Number | Comments |
| 60 mm Petri dishes | Greiner Bio One | 628160 | Cellstar Cell culture dish, PS, 60/15 MM, VENTS. |
| Cell culture plates (6-well) | Sigma-Aldrich | CLS3516 | Corning Costar cell culture plates. 6-well, flat bottom (Individually wrapped) . |
| Cell culture plates (12-well) | Greiner bio-one | 657 160 | Cellstar Cell culture Multiwell Plates. |
| Culture flasks | Greiner Bio One | 690175 (25 cm2); 658175 (75 cm2). | Cellstar Filter Cap Cell Culture Flasks. |
| Standard Disposable Scalpel | Granton | 91310 | Sterile stainless steel blade, pattern: 10. |
| Pipettes | Greiner bio-one | 606 180 (5 mL); 607 180 (10 mL); 760 180 (25 mL) | Cellstar Serological Pipettes. |
| Pasteur plastic pipettes | Starlab | E1414-0311 | 3.0 mL Graduated Pasteur Pipette (Sterile), Ind. Wrapped. |
| Syringe | BD | 300613 | 20 mL BD eccentric tip syringe. |
| 0.2 µm filters | Gilson | ALG422A | Sterile Syringe Filters CA 0.2 µm 33 mm Pk50. |
| Cell strainers | Fisher Scientific | 11597522 | Cell culture strainer sterile individually packed 70 µm polypropylene. |
| Collagenase D | Roche | 11088882001 | Collagenase D; Activity: ≥0.15 U/mg |
| Dispase II | Sigma-Aldrich | D4693 | Dispase II Protease from Bacillus polymyx. Activity: ≥0.5 U/mg solid. |
| CaCl2 | Sigma-Aldrich | 449709 | Calcium chloride, anhydrous, beads, −10 mesh, ≥99.9% trace metals basis |
| Laminin | Sigma-Aldrich | 114956-81-9 | Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane. 1 mg/mL. |
| DMEM-high glucose | Sigma-Aldrich | D5671 | Dulbecco’s Modified Eagle’s Medium - high glucose. With 4,500 mg/L glucose and sodium bicarbonate, without L-glutamine and sodium pyruvate. |
| F-12 media | Gibco | 21765029 | Ham's F-12 Nutrient Mix. 1x + L-glutamine. |
| FGF-b | PetroTech | 100-18B | Recombinant human basic Fibroblast Growth Factor. |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | Fetal Bovine Serum. |
| Horse serum (HS) | Sigma-Aldrich | H1270 | Horse Serum. Donor herd, USA origin, sterile-filtered. |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | Penicillin-Streptomycin with 10,000 units penicillin and 10 mg streptomycin per mL in 0.9% NaCl, sterile-filtered. |
| L-Glutamine | Sigma-Aldrich | G7513 | L-Glutamine solution. 200 mM, solution, sterile-filtered. |
| Trypsin-EDTA | Sigma-Aldrich | T4049 | Trypsin-EDTA solution. 0.25%, sterile-filtered. |
| TrypLE Express | Gibco | 12604-013 | TrypLE Express Enzyme (1x), no phenol red. |
| DPBS (cell culture) | Sigma-Aldrich | D8537 | Dulbecco’s Phosphate-buffered Saline. Modified, without calcium chloride and magnesium chloride. |
| PBS (immunostaining) | Sigma-Aldrich | P4417-50TAB | Phosphate-buffered saline tablet. One tablet per 200 mL of deionized water (0.01 M phosphate buffer, 0.0027 M potassium chloride and 0.137 M sodium chloride, pH 7.4). |
| Methanol | Fisher | M/4000/PC17 | Methanol Analytical Reagent Grade |
| Triton X-100 | Sigma-Aldrich | T8787 | Triton X-100 for molecular biology. |
| anti-MF 20 antibody | DSHB | MF20-c 2ea 211 µg/ml. | MYH1E (MF 20) Mouse mAb. |
| anti-MyoD antibody | Cell Signaling Technology | 13812P | MyoD1 (D8G3) XP Rabbit mAb. |
| anti-Ki67 antibody | Abcam | ab16667 | Rabbit mAb to Ki67 [SP6]. |
| Anti-mouse 488 secondary antibody | Invitrogen | A-11029 | Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate. |
| Anti-rabbit 488 secondary antibody | ThermoFisher Scientific | A-11034 | Goat anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate. |
| DAPI | Sigma-Aldrich | Sigma-Aldrich | DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) |
| Senescence β-Galactosidase Staining Kit | Cell Signaling Technology | 9860 | Senescence β-Galactosidase Staining kit. |
| DMSO | Sigma-Aldrich | 41639 | Dimethyl sulfoxide. BioUltra, for molecular biology, ≥99.5% (GC). |
| Acridine Orange | Sigma-Aldrich | A8097 | Acridine Orange hydrochloride solution, 10 mg/mL in H2O. |
| Ethidium bromide | Sigma-Aldrich | E1510 | Ethidium bromide solution. BioReagent, for molecular biology, 10 mg/mL in H2O. |
| Lipofectamine 2000 | ThermoFisher Scientific | 11668019 | Lipofectamine 2000 Transfection Reagent |
| Scramble control for transfections | Qiagen | 1027271 | miScript Inhibitor Neg. Control (5 nmol) |
| Hsa-miR-378a-3p miScript Primer Assay | Qiagen | 218300 | Hs_miR-422b_1 miScript Primer Assay (targets mature miRNA: hsa-miR-378a-3p). MIMAT0000732: 5'-ACUGGACUUGGAGUCAGAAGGC |
| Anti-hsa-miR-378a-3p miScript miRNA Inhibitor | Qiagen | 219300 | Anti-hsa-miR-378a-3p miScript miRNA Inhibitor (targets mature miRNA: hsa-miR-378a-3p). MIMAT0000732: 5'-ACUGGACUUGGAGUCAGAAGGC |
| Megafuge 2.0 R Centrifuge | Heraeus | 75003085 | n/a |
| Centrifuge rotor | Heraeus | 3360 | Heraeus Sepatech Megafuge Centrifuge Rotor BS4402/A. Max. radius: 15.5 cm. |
| Eclipse Ti-E Inverted Microscope System | Nikon | n/a | Eyepieces: CFI 10X/22; Total magnification: 100X (MF20, Live/dead and Ki67). |
| Axiovert 200 inverted microscope | Carl Zeiss | n/a | Eyepieces: Carl Zeiss 1016-758 W-PI 10X/25; Total magnification: 100X (Senescence β-Galactosidase Staining). |
| Axiovert 25 inverted microscope | Carl Zeiss | n/a | Eyepieces: E-PL 10X/20. Total magnification: 100X (bright field). |
| Diaphot Inverted Tissue Culture Microscope | Nikon | n/a | Eyepiece: CFWN 10X/20. Total magnification: 100X (bright field). |
| Hydromount | National Diagnostics | HS-106 | Hydromount |
Referências
- Hughes, V. A., et al. Longitudinal muscle strength changes in older adults: influence of muscle mass, physical activity, and health. J Gerontol A Biol Sci. 56, B209-B217 (2001).
- Ryall, J. G., Schertzer, J. D., Lynch, G. S. Cellular and molecular mechanisms underlying age-related skeletal muscle wasting and weakness. Biogerontology. 9, 213-228 (2008).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nat Cell Biol. 12, 143-152 (2010).
- Lexell, J., Taylor, C. C., Sjostrom, M. What is the cause of the ageing atrophy? Total number, size and proportion of different fiber types studied in whole vastus lateralis muscle from 15- to 83-year-old men. J Neurol Sci. 84, 275-294 (1988).
- Grounds, M. D. Reasons for the degeneration of ageing skeletal muscle: a central role for IGF-1 signalling. Biogerontology. 3, 19-24 (2002).
- Carlson, M. E., et al. Molecular aging and rejuvenation of human muscle stem cells. EMBO Mol Med. 1, 381-391 (2009).
- Brown, D. M., Goljanek-Whysall, K. microRNAs: Modulators of the underlying pathophysiology of sarcopenia?. Ageing Res Rev. 24, 263-273 (2015).
- Brooks, S. V., Faulkner, J. A. Contraction-induced injury: recovery of skeletal muscles in young and old mice. Am J Physiol. 258, C436-C442 (1990).
- Lepper, C., Partridge, T. A., Fan, C. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138, 3639-3646 (2011).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9, 493-495 (1961).
- Charge, S. B., Rudnicki, M. A. Cellular and molecular regulation of muscle regeneration. Physiol Rev. 84, 209-238 (2004).
- Brack, A. S., Rando, T. A. Intrinsic changes and extrinsic influences of myogenic stem cell function during aging. Stem cell Rev. 3, 226-237 (2007).
- Kadi, F., Charifi, N., Henriksson, J. The number of satellite cells in slow and fast fibres from human vastus lateralis muscle. Histochem Cell Biol. 126, 83-87 (2006).
- Verdijk, L. B., et al. Satellite cell content is specifically reduced in type II skeletal muscle fibers in the elderly. Am J Physiol Endocrinol Metab. 292, E151-E157 (2007).
- Collins, C. A., Zammit, P. S., Ruiz, A. P., Morgan, J. E., Partridge, T. A. A population of myogenic stem cells that survives skeletal muscle aging. Stem cells. 25, 885-894 (2007).
- Bortoli, S., et al. Gene expression profiling of human satellite cells during muscular aging using cDNA arrays. Gene. 321, 145-154 (2003).
- Thalacker-Mercer, A. E., Dell'Italia, L. J., Cui, X., Cross, J. M., Bamman, M. M. Differential genomic responses in old vs. young humans despite similar levels of modest muscle damage after resistance loading. Physiol Genomics. 40, 141-149 (2010).
- Jejurikar, S. S., et al. Aging increases the susceptibility of skeletal muscle derived satellite cells to apoptosis. Exp Gerontol. 41, 828-836 (2006).
- McArdle, A., Dillmann, W. H., Mestril, R., Faulkner, J. A., Jackson, M. J. Overexpression of HSP70 in mouse skeletal muscle protects against muscle damage and age-related muscle dysfunction. FASEB J. 18, 355-357 (2004).
- Sousa-Victor, P., et al. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 506, 316-321 (2014).
- Cornelison, D. D. Context matters: in vivo and in vitro influences on muscle satellite cell activity. J Cell Biochem. 105, 663-669 (2008).
- Soriano-Arroquia, A., McCormick, R., Molloy, A. P., McArdle, A., Goljanek-Whysall, K. Age-related changes in miR-143-3p:Igfbp5 interactions affect muscle regeneration. ageing cell. 15, 361-369 (2016).
- Goljanek-Whysall, K., et al. Regulation of multiple target genes by miR-1 and miR-206 is pivotal for C2C12 myoblast differentiation. J Cell Sci. 125, 3590-3600 (2012).
- Georgantas, R. W., et al. Inhibition of myogenic microRNAs 1, 133, and 206 by inflammatory cytokines links inflammation and muscle degeneration in adult inflammatory myopathies. Arthritis Rheumatol. 66, 1022-1033 (2014).
- Sharples, A. P., Al-Shanti, N., Stewart, C. E. C2 and C2C12 murine skeletal myoblast models of atrophic and hypertrophic potential: relevance to disease and ageing?. Journal of cellular physiology. 225, 240-250 (2010).
- Hidestrand, M., et al. Sca-1-expressing nonmyogenic cells contribute to fibrosis in aged skeletal muscle. J Gerontol A Biol Sci Med Sci. 63, 566-579 (2008).
- Alsharidah, M., et al. Primary human muscle precursor cells obtained from young and old donors produce similar proliferative, differentiation and senescent profiles in culture. ageing cell. 12, 333-344 (2013).
- Agley, C. C., Rowlerson, A. M., Velloso, C. P., Lazarus, N. L., Harridge, S. D. Isolation and quantitative immunocytochemical characterization of primary myogenic cells and fibroblasts from human skeletal muscle. J Vis Exp. , (2015).
- Pietrangelo, T., et al. Molecular basis of the myogenic profile of aged human skeletal muscle satellite cells during differentiation. Exp Gerontol. 44, 523-531 (2009).
- Webster, C., Pavlath, G. K., Parks, D. R., Walsh, F. S., Blau, H. M. Isolation of human myoblasts with the fluorescence-activated cell sorter. Exp Cell Res. 174, 252-265 (1988).
- Woods, K., Marrone, A., Smith, J. Programmed cell death and senescence in skeletal muscle stem cells. Annals of the New York Academy of Sciences. , 331-335 (2000).
- Chakkalakal, J. V., Jones, K. M., Basson, M. A., Brack, A. S. The aged niche disrupts muscle stem cell quiescence. Nature. 490, 355-360 (2012).
- Cornelison, D. D., et al. Essential and separable roles for Syndecan-3 and Syndecan-4 in skeletal muscle development and regeneration. Genes & development. 18, 2231-2236 (2004).
- Pisconti, A., Cornelison, D. D., Olguin, H. C., Antwine, T. L., Olwin, B. B. Syndecan-3 and Notch cooperate in regulating adult myogenesis. J Cell Biol. 190, 427-441 (2010).
- Schafer, R., et al. Age dependence of the human skeletal muscle stem cell in forming muscle tissue. Artificial organs. 30, 130-140 (2006).
- Castiglioni, A., et al. Isolation of progenitors that exhibit myogenic/osteogenic bipotency in vitro by fluorescence-activated cell sorting from human fetal muscle. Stem cell reports. 2, 92-106 (2014).
- Stewart, J. D., et al. Characterization of proliferating human skeletal muscle-derived cells in vitro: differential modulation of myoblast markers by TGF-beta2. J Cell Physiol. 196, 70-78 (2003).
- Wagner, W., et al. Aging and replicative senescence have related effects on human stem and progenitor cells. PloS one. 4, e5846 (2009).
- Gaster, M., Kristensen, S. R., Beck-Nielsen, H., Schroder, H. D. A cellular model system of differentiated human myotubes. APMIS : acta pathologica, microbiologica, et immunologica Scandinavica. 109, 735-744 (2001).
- Gaster, M., Beck-Nielsen, H., Schroder, H. D. Proliferation conditions for human satellite cells. The fractional content of satellite cells. APMIS : acta pathologica, microbiologica, et immunologica Scandinavica. 109, 726-734 (2001).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods Mol Biol. 798, 21-52 (2012).
- Chowdhury, S. R., et al. One-Step Purification of Human Skeletal Muscle Myoblasts and Subsequent Expansion Using Laminin-Coated Surface. Tissue engineering. Part C, Methods. 21, 1135-1142 (2015).
- Mamchaoui, K., et al. Immortalized pathological human myoblasts: towards a universal tool for the study of neuromuscular disorders. Skeletal muscle. 1, 34 (2011).
- Natarajan, A., Lemos, D. R., Rossi, F. M. Fibro/adipogenic progenitors: a double-edged sword in skeletal muscle regeneration. Cell cycle. 9, 2045-2046 (2010).
- Ciofani, G., et al. Hypergravity effects on myoblast proliferation and differentiation. J Biosci Bioeng. 113, 258-261 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados