Method Article
Подготовка и культура Миогенный прогениторных клеток / Первичные миобластов из скелетной мышце взрослых и выдержана Людей
В этой статье
Резюме
Этот протокол описывает надежный, воспроизводимый и простой метод выделения и культивирования клеток-предшественников миобластов из скелетных мышц взрослых и пожилых людей. Мышцы, используемые здесь, включают в себя ноги и мышцы ног. Такой подход делает возможным выделение обогащенного населения первичных миобластов для функциональных исследований.
Аннотация
Скелетных мышц гомеостаз зависит от роста мышц (гипертрофия), атрофии и регенерации. В процессе старения и при некоторых заболеваниях, происходит потеря мышечной массы. Потеря мышечной массы и функции связана с типом мышечных волокон атрофии, переключение типа волокон, дефектной регенерации мышц, связанных с дисфункцией сателлитных клеток, мышечных стволовых клеток и других патофизиологических процессов. Эти изменения связаны с изменениями в внутриклеточным, а также местных и системных ниш. Помимо наиболее часто используемых моделях грызунов мышечной старения, существует необходимость в изучении мышечной гомеостаз и тратить с использованием человеческих моделей, которые из - за этических последствий, состоят преимущественно из культур в пробирке. Несмотря на широкое использование Миогенный клеток-предшественников человека (ПДК) и первичных миобластов в миогенезе, есть ограниченные данные об использовании первичных миобластов и myotube культуры человека для изучения молекулярных механизмов, регулирующих различные аспекты возрастного MusНКУ атрофия, пособничество в проверке механизмов старения, предложенный в грызуна мышцы. Использование человеческих MPCs, первичных миобластов и мышечных трубочек, выделенных из взрослых и пожилых людей, обеспечивает физиологически соответствующую модель молекулярных механизмов процессов, связанных с ростом мышц, атрофии и регенерации. Здесь мы опишем подробно надежный, недорогой, воспроизводимый и эффективный протокол для изоляции и поддержания человеческих MPCs и их потомков - миобластов и мышечных трубочек из образцов мышц человека с помощью ферментативного расщепления. Кроме того, мы определили номер прохода , при котором первичные миобласты от взрослых и пожилых людей подвергнуто старении в культуре в пробирке. И, наконец, мы покажем возможность трансфекции этих миобластов и способность характеризовать их пролиферативную и дифференцировку потенциала и предложить их пригодность для проведения функциональных исследований молекулярных механизмов миогенез и атрофии мышц в пробирке.
Введение
И признаков заболевания, связанных с возрастом прогрессирующей потерей массы и функциональных результатов скелетных мышц в хрупкости, снижение прочности и снижения качества жизни пожилых людей. Скелетных мышц составляет около 40% массы тела 1. Во время старения и болезней, прогрессирующую атрофию отдельных миофибрилл и снижение качества мышц за счет инфильтрации жира и фиброза происходит 1, 2, 3, 4, 5, 6. В последнее время было предложено , что присущие конкретным видам различия в старении скелетных мышц происходит, в частности , что потери мышечных волокон происходит у грызунов, не может происходить в организме человека 7. Тем не менее, оставшиеся мышечные волокна стареющей млекопитающих характеризуются повышенной восприимчивостью к повреждению и нарушению регенерации 8. Ремонт взрослых мышц и поддержание опосредуется сателлитных клеток 9, 10. После травмы мышц и другие соответствующие сигналы, спутниковые клетки активируются и пролиферируют. Подмножество клеток возвращается в исходное состояние, а остаток прогрессирует в миобластов (Миогенный клетки-предшественники - ПДК). Они способствуют ремонт существующего мышечное волокно 11. Функциональность сателлитных клеток определяет успех регенерации мышц и изменения в доступности спутниковых клеток со старением были продемонстрированы 12, 13, 14, 15. Кроме того, клетки - сателлиты от мышцы старых людей и грызунов показывают транскрипционный переключатель профиля и уменьшенный регенеративный потенциал 16, 17, 18, 19. Спутниковые клетки мышц от старых мышей и человека, также было показано , чтобы пройти физиологическое старение , что приводит к их ограниченной функциональностью 20.
Наиболее создана клеточная линия позволяет исследование мышечной гомеостаза является клеточная линия 21 мышиный C2C12. Значительное количество исследований также использовали мышиные первичные миобласты 22. Эти культуры привели к значительному пониманию мышиных и позвоночного миогенезе, а также регенерации мышц, myotube / мышечное волокно атрофии и гипертрофии процессов , происходящих при мышечных заболеваний и старения 23, 24, 25, 26. Совсем недавно, несколько групп описали с использованием первичных миобластов человека для изучения миогенез и старение мышц. Тем не менее, есть отсутствие консенсуса с РегарDS -за различий между первичными миобластов , выделенных из мышцы взрослых и пожилых людей 27, 28, 29, 30, 31. Несмотря на различия , характеризуемых в системное и локальное окружение возникающие в процессе развития, старения и болезней 6, 32, 33, 34, в пробирке миобластов и myotube культуры остаются наиболее доступными инструментами для изучения молекулярных механизмов , связанных с развитием мышц, роста и атрофии. Кроме того, эти исследования обеспечивают не только надежной, но и относительно быстрым, недорогим и с высокой пропускной способностью в пробирке инструментом. Кроме того, этические последствия, связанные с изучением человеческих мышц означает, что для проведения функциональных экспериментов, связанных с манипуляциями экспрессии генов В пробирке миобластов и myotube культуры человека остаются единственной альтернативой доступным для позвоночных животных модельных организмов.
Здесь мы покажем простой экспериментальный протокол для надежной, недорогой, и воспроизводимым изоляции первичных миобластов, или MPCs, от мышц взрослых и пожилых людей , и описывают стандартные условия культуры в пробирке (рисунок 1). Как первичные культуры из мышц, как правило, содержат фибробласты в дополнение к миобластов, мы рекомендуем шаг перед металлизацией, нацеленную на улучшение чистоты и качества первичных миобластов. Подводя итог, мы установили протокол, разрешающий для эффективной и воспроизводимой изоляции, культуры и функциональных исследований, обогащенных и функциональных MPCs / первичных миобластов из скелетных мышц взрослых и пожилых людей.
протокол
Все эксперименты с участием ткани человека, описанный здесь не был утвержден заранее Ливерпульского университета, университетской больницы Aintree больницы и Комитета по этике Юго-Западного Уэльса исследований (утверждения №: 13 / WA / 0374) и эксперименты были проведены в соответствии с надлежащей практике. Университет Ливерпуля выступила спонсором этики для этого исследования. Все доноры дали информированное согласие на зачисление данного исследования. Мышцы были изолированы от людей (ИМТ <25): взрослый: 30 ± 2,8 лет и в возрасте: 69 ± 5 лет.
1. Подготовка к культуре
- Покрытие культуры поверхностей с ламинина
- Подготовка рабочего раствора 10 мкг / мл ламинина в 1x ДЗФР (Дульбекко фосфатно-солевом буферном).
- Пипетировать минимальное количество ламининовым раствора , чтобы полностью покрыть поверхность , на которой клетки будут высевали (таблица 1). Выдержите тон культуры блюдо по крайней мере 30 минут в увлажненной 37 ° C, 5% CO 2 инкубаторе перед тем металлизированный клетки. Ручка ламинин осторожно, избегая использования вихря. Рабочий раствор 10 мкг / мл ламинина разводили в ДЗФР можно хранить при температуре 4 ° С и повторно использовали несколько раз.
- Используйте 60 мм (20 см 2) чашки Петри или 2 скважины в 6-луночный планшет (2 х 10 см 2) на ~ 18 - 19 мг скелетных мышц к пластине клеток (5,50 х 10 4 клеток в общей сложности). Выполнить подсчет клеток в любое время, когда металлизированный клеток для функциональных исследований.
Примечание: Образцы были первоначально получены из стопы операций (разгибатель Brevis, передней большеберцовой или отводящих мышц halluces) женщин-пациентов (взрослых: 30 ± 2,8 лет, в возрасте: 69 ± 5 лет, ИМТ <25).
- Получение ферментного раствора
- Подготовьте 250 мМ CaCl 2 рабочего раствора: 277 мг складе CaCl 2 в 10 мл 1x ДЗФР. Фильтр таклюция с фильтром 0,2 мкм мембрану и хранят при температуре 4 ° С.
- Приготовить рабочий раствор 1,5 Ед / мл коллагеназы D, 2,4 ед / мл диспаза II и 2,5 мМ CaCl 2 в бессывороточной DMEM (модифицированную Dilbecco орла Medium) (таблица 2).
- Хорошо перемешать и профильтровать раствор ферментативную через фильтр 0,2 мкм мембраны для стерилизации. Приготовьте ферментативной раствор заранее и заморозить вниз (-20 ° С) в виде аликвот для использования в будущем.
2. Ткань Пищеварение: Механическая и ферментативная диссоциация
- После взятия пробы, держать мышцы при 4 ° С в ДЗФР до пищеварения. Подготовьте минимальный объем 2 мл коллагеназы-диспаза-CaCl 2 раствора на 18 - 19 мг мышечной ткани и нагреть его до 37 ° С перед тем диссоциации ткани.
- Погрузить биопсии мышц на короткое время в 70% этаноле, промывают свежим ДЗФР и поместите ткань на новую чашку Петри с 1 мл ферментативнойрешение.
- Откажитесь столько фиброзной и жировой ткани , как это возможно , и разрыв мышцы быстро , но осторожно , в небольших , но различимых частей (примерно> 0,5 мм 2) стерильными ножницами или хирургическим скальпелем (лезвие № 10).
- Перенести пробу в 50 мл пробирку с оставшимися 1 мл коллагеназы-диспаза-CaCl 2.
- Инкубируйте ткани при 37 ° С до 30 - 40 мин. Перемещение мышечной ткани, осторожно перемешивая трубку каждые 5 - 10 мин.
- Покрывают пипетки со средствами массовой информации, чтобы избежать прилипания высвобожденных клеток к пластику стенок пипеток. Добавьте 2 объема стерильной среды роста, например, 4 мл DMEM 20% FBS (эмбриональной бычьей сыворотки), 1% L-глутамина и 1% P / S (пенициллин-стрептомицин), чтобы остановить пищеварение.
- Пипеткой вверх и вниз несколько раз с 5 мл пипетки, чтобы помочь высвобождение клеток из мышечных волокон.
Примечание: Образец обычно полностью диссоциирует из-за его небольшого размера. ЧАСowever, если фрагменты мышц все еще остаются, использовать второй инкубации с оставшимися кусками мышц и со свежим ферментативной раствором. - Фильтр решение мышц по линиям ячейки фильтра 70 мкм в течение 50 мл коническую трубку. Вымойте оставшиеся клетки с большим количеством информации и фильтра через сетчатый фильтр.
- Центрифуга при 443 х г в течение 5 мин при комнатной температуре для осаждения клеток. тщательно Удалите супернатант.
- Растворить осадок в F-12 средах (Хэма F-12, питательная смесь), 20% FBS, 10% HS (лошадиной сыворотки), 1% P / S, 1% α-глутамина и 2,5 нг / мл FGF-б ( Рекомбинантный человеческий Основной фактор роста фибробластов). Здесь используют 4 мл среды на 60 мм чашках Петри.
3. Посев клеток
- Собирают культуральный сосуд, предварительно покрытые 10 мкг / мл ламинина из инкубатора (раздел 1.1).
- Осторожно удалите избыток ламинин из культуральной чашке, и не прикасайтесь к поверхности (или он будет нарушать структуру белка). мытькультура блюдо с ДЗФР (по желанию).
- Пластинчатый клетки непосредственно на ламинин покрытием судна и инкубировать в течение 24 ч в увлажненной 37 ° С, 5% СО 2 инкубаторе.
- Визуализируйте клетки под ярко-поле микроскопа (100X общее увеличение) на следующий день. Круглые мелкие клетки прикреплены к поверхности, а остальные обломки можно увидеть в культуральной среде.
- Изменение носителя для свежих F-12 средств массовой информации, дополненные 20% FBS, 10% HS, 1% P / S, 1% альфа-глутамина и 2,5 нг / мл FGF-б.
4. Культура и пассажи клеток
- Изменение в средствах массовой информации каждые 2 - 3 d и разделить клетки , как только группы клеток видны под микроскопом (общее увеличение 100X, например , на рисунке 2, клетки из пожилых людей, прохождение 0, через 7 суток), чтобы избежать спонтанной дифференциация.
- При первом проходе (P1), измените носитель на DMEM с высоким содержанием глюкозы, дополненной 20% FBS, 10% HS, 1%P / S, 1% α-глютамин. Избегайте использования FGF-B с этой точки, а FGF, является сильным митогеном и важным фактором в начале культуры, но она может способствовать фибробластический разрастание, если используется больше в культуре.
- Для клеток пассажей:
- Выньте материал и промыть клетки дважды с ДЗФР.
- Добавить минимальный объем 0,25% ЭДТА-трипсина, чтобы покрыть поверхность клеток. Рок осторожно, чтобы гарантировать, что все клетки покрыты отрывного раствором, инкубировать в течение 10 секунд при комнатной температуре, и удалить его.
- Инкубируйте клетки в увлажненной 37 ° С, 5% СО 2 инкубаторе в течение 3 - 5 мин. Нажмите мягко и проверить под ярким световым микроскопом (100X общее увеличение), что клетки округляются, но не полностью отделен от поверхности. Если никаких изменений не наблюдается в клетках, инкубировать в течение еще 5 мин.
- Добавляют 5 мл питательной Среда Игла (DMEM с высоким глюкоза дополнена 20% FBS, 10% HS, 1% P / S, 1% α-глутаминовой) для сбора клеток, перемешатьну и перенести клетки с новыми медиа в T75 колбу. Вымойте оставшиеся клетки Повторяя этот шаг с еще 5 мл питательной среды (10 мл в общей сложности за одну T75 колбу).
- Для preplate (предпочтительнее при первом прохождении), инкубировать клетки в увлажненной 37 ° С, 5% СО 2 инкубаторе в течение 40 мин. Соберите супернатант с клетками, которые не прикрепляются и инкубировать их в новом T75 колбу. Это должно обогатить культуру в миобластов, так как большинство из фибробластов должны были присоединены в первой колбе.
- Изменение средств массовой информации каждые 2 - 3 d и разделить ячеек от 1 до 4, как только они достигают 70% слитности для получения максимального урожая.
- Для дифференциации, как только клетки достигали 70 - 80% сплошности, изменение культуральной среды с дифференциацией среды (DM): DMEM с высоким глюкозы, дополненную 2% HS, 1% P / S, 1% альфа-глутамина. Клетки должны быть дифференцированы в пределах 5 - 7 дней в зависимости от качества и чистоты миобластов Culture.
5. Протокол Трансфекция
- Семенной 50000 клеток / лунку в 12-луночный планшет для MF 20, стареющих и жизнеспособность анализов. Культура клеток на покровных стеклах или в чашке, покрытой ламинина. Для Ki67 окрашивания семян 25000 клеток / лунку в 12-луночного планшета.
- Для трансфекциях, следуйте процедуре изготовителя с использованием 5 мкл реагента трансфекции, 100 нМ управления микроРНК имитируют или ингибитора, 100 нМ микроРНК мимической или 100 нМ ингибитора микроРНК на лунку, с общим объемом 1 мл.
- Изменение к дифференцировке Средний 6 ч после трансфекции (DMEM с высоким содержанием глюкозы дополняется 2% HS, 1% P / S, 1% α-глутамин). Для экспериментов пролиферации, окрасить клеткам 2 D после трансфекции; для старении, 7 дней после трансфекции; и для MF20 окрашивания, через семь дней после трансфекции.
6. Иммунологическое клеток
- Ki67, MyoD и MF 20 иммунное
- Подготовьте блок 1 (10% ГВ и 0,1% Тритон-Х в PBS) и блокируют 2 (10% HS и 0,05% Triton-X в растворах PBS). С помощью 500 мкл реагента на лунку в течение 12-луночного планшета.
Примечание: Выполните следующие действия с помощью шейкера для инкубации. - Извлеките носитель из клеток.
- Промыть клетки с PBS.
- Закрепить клетки с холодным метанолом в течение 10 мин на качалке.
- Удалите метанол из клеток и прополоскать 3 раза с PBS в течение 5 мин каждый раз.
- Добавить блок 1 раствор и инкубировать клетки на качалке при комнатной температуре в течение 1 ч.
- Добавьте раствор первичного антитела: для Ki67 окрашивания используйте Кролика МАБ Ki67 (1: 1000 разведение в блоке 2); для MyoD, используйте MyoD1 (D8G3) XP Кролик мАт (разведение 1: 100 в блоке 2); для MF 20 окрашивания, используется MYH1E (MF 20) первичного антитела (DSHB, 1: 1000 разбавления в блоке 2).
- Инкубируйте клетки с первичными антителами в течение 1 ч (RT) до O / N (4 ° С) на качалке.
- Сбор первичной AB (она может быть использована повторно несколько раз, если STOкрасный при температуре 4 ° С).
- Промойте клетки 3 раза с PBS, 5 мин каждый раз.
- Добавьте соответствующие вторичные антитела: для Ki67 или MyoD окрашивания, козы против кроличьего IgG (H + L) вторичным антителом, Alexa Fluor 488 конъюгат (1: 1000 разведение в PBS); для MF 20 окрашивания, козьего антитела против мышиных IgG (H + L) вторичным антителом, Alexa Fluor 488 конъюгата (1: 1000 разбавление в PBS).
- Обертка пластину, содержащую клетки и инкубировать вторичное антитело в течение 2 ч в темноте на качалке при комнатной температуре.
- Промыть клетки в 3 раза с PBS в течение 5 минут каждый раз.
- Добавить DAPI раствор (1: 1000 разведения в PBS) на клетки и инкубировать на качалке при комнатной температуре в течение 5 - 10 мин.
- Промыть клетки в 3 раза с PBS в течение 5 минут каждый раз.
- Добавить 1 мл свежего PBS.
- Установите клетки на покровных стеклах в монтажном растворе или запечатать пластину, содержащую клетки в PBS с Parafilm, чтобы избежать испарения.
- Хранить при температуре 4 ° С.
- Визуализируйте клетки сфлуоресцентного микроскопа как можно скорее (не позднее, чем за 2 недели).
- Подготовьте блок 1 (10% ГВ и 0,1% Тритон-Х в PBS) и блокируют 2 (10% HS и 0,05% Triton-X в растворах PBS). С помощью 500 мкл реагента на лунку в течение 12-луночного планшета.
- Жизнеспособность анализ
- Извлеките носитель из клеток.
- Промыть клетки в PBS.
- Добавьте 1: 1000 бромид этидия и 1: 1000 акридинового оранжевого, разбавленный в PBS.
Внимание: Соблюдайте осторожность и работать в рамках правил гигиены и безопасности - этидийбромид является канцерогеном. - Обертка пластину, содержащую клетки в окрашивающего раствора и инкубируют при комнатной температуре на качалке в течение 5 мин.
- Возьмите изображения клеток с флуоресцентным микроскопом: зеленый канал для акридинового оранжевого; красный канал для этилиденбромида.
Результаты
/ Первичные ПДК миобласты должны быть видны через 24 ч после высева на поверхность ламинин покрытием (рисунок 2). Клетки должны принять шпиндель-образную форму и должен выразить MyoD еще в канал 4 (рисунок 1А, Б). Фибробласты можно отличить по их звездчатой морфологии и отсутствие экспрессии MyoD (рис 1B, C). После того, как клетки прикрепляются на следующий день, средства массовой информации должны быть заменены на свежую среду, bFGF. Средства массовой культуры следует заменять каждые 48 ч.
Представительные результаты , показанные здесь и опубликованы данные из нашей лаборатории 22 целью поддержать нашу изоляцию и культуру протокола и демонстрируют различные методы , которые могут быть использованы для функциональных исследований первичных миобластов человека. пролиферацию миобластов могут быть исследованы с помощью Ki67 иммунное окрашивание и жизнеспособность используя staininг для жизнеспособности клеток анализа (рисунок 3). Для дифференциации, культура СМИ должна быть изменена на дифференциации средств массовой информации. Мышечные трубки должны формироваться в 5 - 7 дней и быть тяжелой цепи миозина положительной (рисунок 3). Следует отметить , что формирование myotube может быть менее эффективным , когда миобласты изолированы от мышцы пожилых людей (рисунок 3). Старение (SA-β-галактозидазы) окрашивание также может быть выполнено для того , чтобы установить процент стареющих клеток в культуре (рисунок 3). Мы заметили , что с более длинными культурами (рисунок 3, прохождение 4), более миобластов , выделенных из мышцы пожилых людей показывают старении.
Для функциональных исследований, экспрессия генов и микроРНК можно манипулировать с помощью липофильный реагентов трансфекции-опосредованной доставки векторов экспрессии, миРНК, микроРНК мимики и antimiRs (рисунок 4). Это позволяет 40 -70% эффективности трансфекции уровни гена / микроРНК быть вверх или вниз регулируется в пределах физиологического диапазона (рис 4; 22).
| Культура судно | Прибл. Область (на лунку) | Объем 10 мкг / мл ламинина |
| 35 мм блюдо | 10 см 2 | 1 мл |
| 60 мм блюдо | 20 см 2 | 2 мл |
| 100 мм блюдо | 60 см 2 | 4 мл |
| 24-луночный планшет | 2 см 2 | 200 мкл / лунку |
| 12-луночный планшет | 4 см 2 | 500 мкл / лунку |
| 6-луночный планшет | 10 см 2 | 1 мл / лунку |
| T25 | 25 см 2 | 3 мл |
| T75 | 75 см 2 | 5 мл |
Таблица 1. Рекомендуемые минимальные объемы Laminin-DPBS раствора (10 мкг / мл) для покрытия культуры поверхности.
| Удельная активность / Молярная масса | Конечная концентрация | Масса или объем , необходимый для 10 мл раствора | |
| коллагеназы D | 0,15 Ед / мг | 10 мг / мл (1,5 ед / мл) | 100 мг |
| диспазу II | 0,5 ед / мг | 4,8 мг / мл (2,4 Ед / мл) | 48 мг |
| 250 мМ CaCl 2 | 1100,98 г / моль | 2,5 мМ | 100 мкл |
Таблица 2. Фермент Подготовка к Muscle пищеварении.
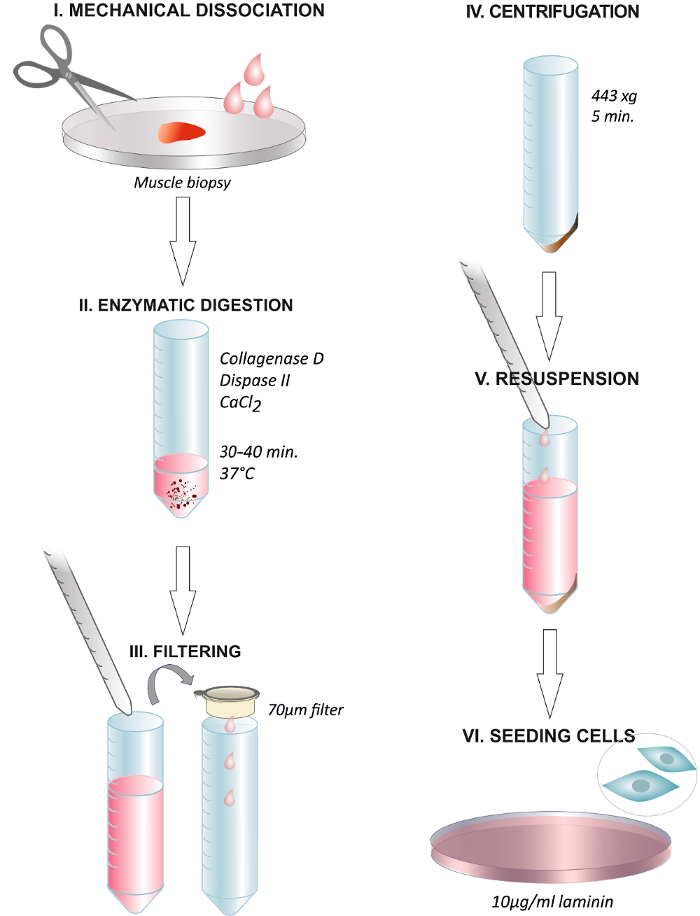
Рисунок 1. Графическое Подводя итог Шаги Протокола Аннотация. Разобщение биопсии мышц человека с помощью ножниц или с хирургическим скальпелем (I). Инкубация с раствором ферментативного при 37 ° С в течение 30 - 40 мин (II). Конец перевариванию посредством добавления в культуральную среду и фильтрации раствора через мембранный фильтр с диаметром 70 мкм , в центрифужную пробирку (III). Центрифугирование при 443 х г в течение 5 мин (IV). Отбрасывание супернатант и ресуспендирования в питательной среды , содержащей 2,5 нг / мл FGF (V). Покрытие клеток на чашку, покрытую 1081; г / мл ламинина и смену носителя через 24 ч (VI). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
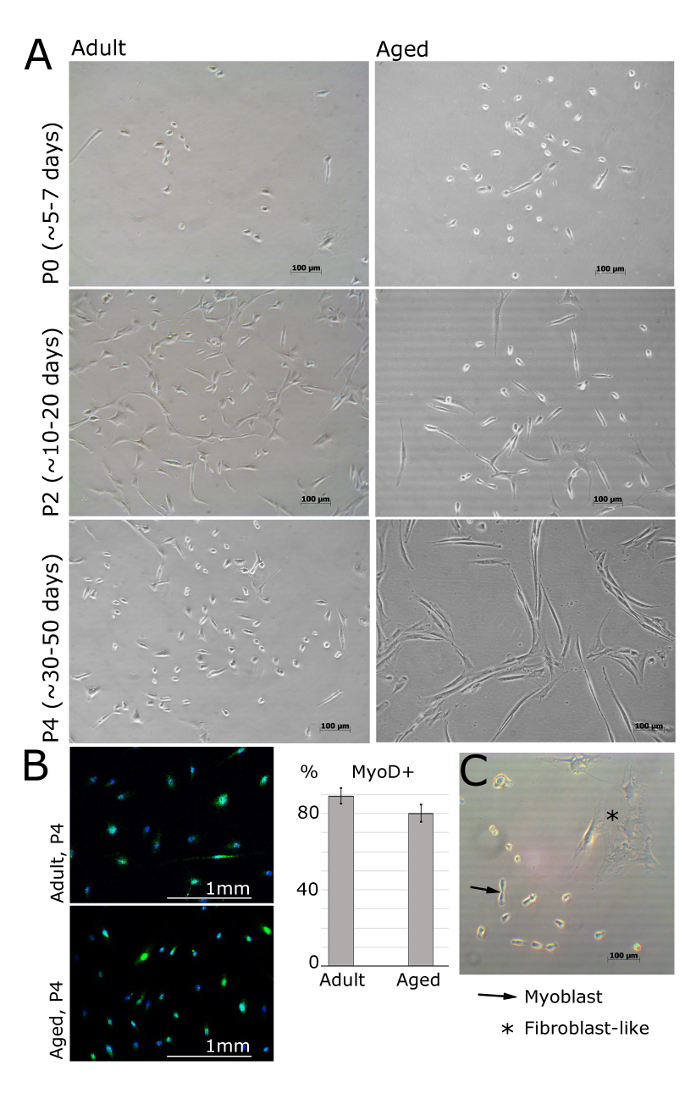
Рисунок 2. миобластов изолированы от мышце взрослых и старческого возраста человека при различных пассажей. A. Изображения представляют миобластов, выделенных из разгибателя Brevis, передней большеберцовой или отводящих halluces мышц пациентов женского пола (для взрослых: 30 ± 2,8 лет, в возрасте: 69 ± 5 лет, ИМТ <25). При прохождении 0 и через 5 дней посевом клетки по - прежнему круглые и маленькие, но видны под ярким световым микроскопом (A). Миобластов будет принимать удлиненную форму, как показано на прохождение 2 (A). MyoD выражается в миобластов, но не в фибробластах (В). Количественное Myod-положительных клеток показан; Столбики ошибок показывают стандартное отклонение; п = 3 (В). Представитель изображения демонстрирует различия между миобластов и фибробластов морфологии (С). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
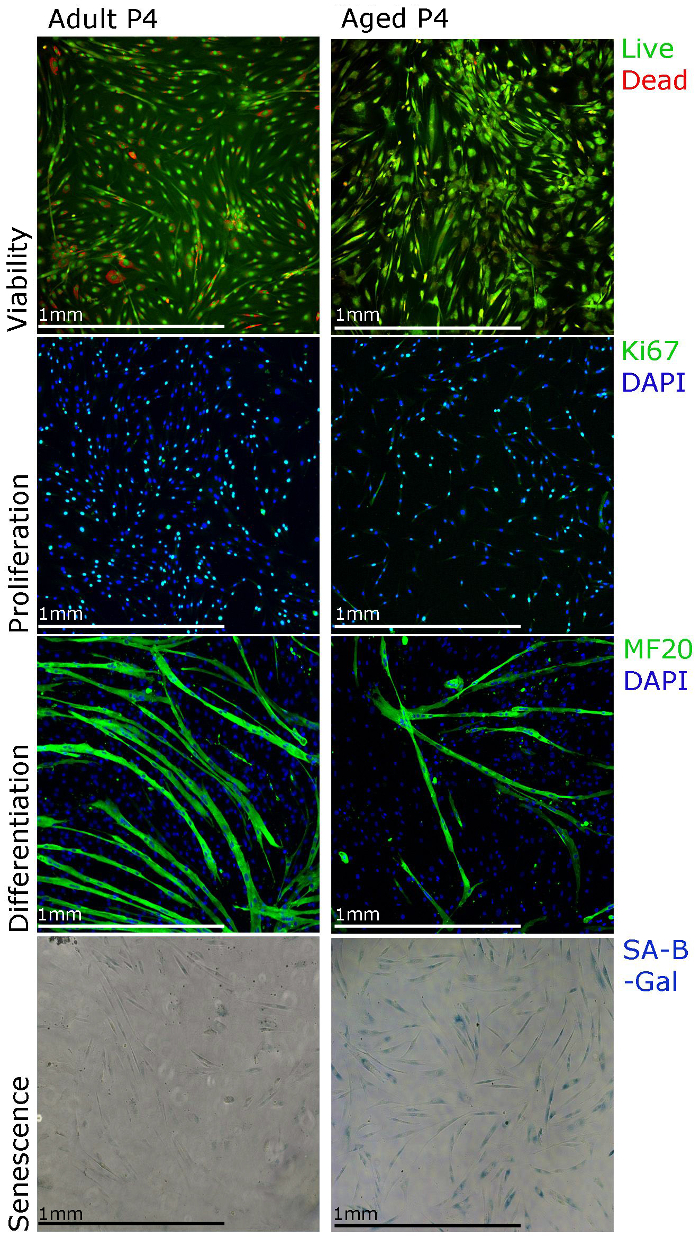
Рисунок 3. Человеческие Первичные миобластов может быть охарактеризован с использованием различных методов окрашиванием. Жизнеспособность клеток могут быть визуализированы с помощью окрашивания на жизнеспособность клеток анализов пролиферации может быть оценена с помощью Ki67 иммунное окрашивание, дифференцировка которых может быть оценена с использованием MF20 (тяжелой цепи миозина) иммунное и Старение можно визуализировать с помощью старении, связанный бета-галактозидазы (SA-β-галактозидазы ) окрашивание. ecsource.jove.com/files/ftp_upload/55047/55047fig3large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
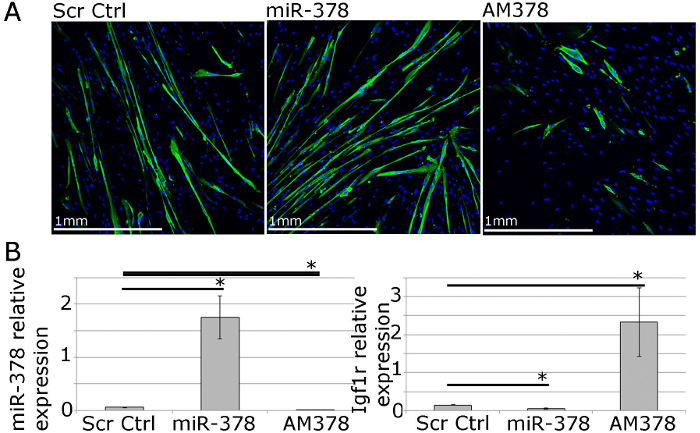
Рисунок 4. Человеческие Первичные миобластов могут быть использованы для функциональных исследований мышечных гомеостаза In Vitro. А. MF20 (тяжелой цепи миозина) иммунное дифференцированных первичных мышечных трубках от взрослых людей , показывающих влияние избыточной экспрессии или ингибирования микроРНК-378 на myotube размера и количества. B. КПЦР показывает относительную экспрессию микроРНК-378 и IGF1R, подтвержденным микроРНК-378 гена - мишени, следуя микроРНК-378 экспрессией или торможения в первичных миобластов человека. Выражение по отношению к РНЕ-6 и & beta; -2-микроглобулина, соответственно, показан. Столбики ошибок показывают SEM; п = 3, * - р <0,05, т-критерий Стьюдента.JPG "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Здесь мы представляем простой, надежный, недорогой, воспроизводимый и эффективный способ выделения мышечных клеток-предшественников / первичные миобласты от взрослых и пожилых людей от экстензорного digitorium Brevis, передней большеберцовой или отводящих halluces мышц. Этот протокол направлен на исследования позволяют с использованием первичных миобластов человека от взрослых и пожилых людей, особенно, когда более сложные методы, такие как FACS- или MACS-Сортировочная, не представляется возможным или не практично.
Способ изоляции представлена в этой рукописи занимает около 2-х часов. Во время изоляции мышц, мышцы промывали в 70% этаноле, с тем, чтобы избежать загрязнения. До начала ферментативной диссоциации мышцы, важно, чтобы сократить мышцы на небольшие, но видимые глазом кусочки, и во избежание повреждения клеток от слишком большого измельчения. Результаты пищеварения при диссоциации миофибрилл и высвобождения клеток-сателлитов и миогенных клеток-предшественников. В нашем случае для ~ 20 мг скелетных мышц, один 60 мм(20 см 2) Петри является наиболее подходящим площадь поверхности для сбора клеток. Клетки высевали на большей поверхности показали пониженную пролиферацию, тогда как клетки высевали на меньшую поверхность показали повышенную гибель клеток и склейку.
После изоляции, клетки культивировали и расширена на ламинин покрытых пластин. Применение непокрытых поверхностей имели тенденцию к снижению успех изоляции. По этой причине, клетки могут быть предпочтительно собирают на предварительно покрытой поверхности непосредственно после выделения. Фибробласты-обогащенные культуры будет преобладать, а не миобластов клетки, полученные, если клетки собирают на не покрытой поверхности непосредственно после выделения. Помимо ламинин, может использоваться применение других решений прикрепление клеток, таких как Матригель и на основе коллагена реагентов. Лакокрасочные решения могут включать факторы роста и другие соединения, которые будут способствовать росту клеток, но они могут изменить поведение клеток и, следовательно, экспериментальные результаты. ВНаш опыт, 10 мкг / мл ламинина оптимальная концентрация и подходящим реагентом для покрытия сателлитных клеток и миобластов прикрепления и пролиферации, как он испытывает недостаток в любой фактор роста или другие комплементы. Кроме того, ламинин естественным образом присутствует в базальной мембране, непосредственно связанной с сарколеммой, который играет ключевую роль в приложении спутниковой и миграции клеток через скелетных мышечных волокон.
Добавки из культуральной среды могут также оказывать вредное воздействие на поведение первичного миобластов. Для групп факторов роста, например , таких , как FGFs или ИФР, имеют плейотропных воздействия на первичные миобластов культур, с FGF-2 контроля как митогенетический и запрограммированную гибель клеток ответ 31. Поэтому необходимо строго контролировать условия культивирования, в особенности из-за различия в поведении первичных миобластов, выделенных из мышцы у взрослых и пожилых людей, очень вероятно, связано с чистотой Oе культур и вероятность фибробластов обгонных миобластов в культуре в течение длительных культур 35. Мы использовали 1-часовой предварительной металлизацию клеток в течение первого расщепления на не покрытой поверхности с целью уменьшения загрязнения культур фибробластов.
Метод, который мы описали подходит для выделения миогенные клеток-предшественников из мышц взрослых и пожилых людей. Выделенный элемент состоит из репрезентативного миогенным популяции клеток , как показано высокий процент миогенных клеток (выражение MyoD и миогенных свойствами , визуализированных с помощью MF20 иммунным окрашиванием на рисунках 1 и 2) и могут быть использованы в качестве модели в пробирке для функциональных исследований процессов связано с мышечной гомеостаза.
Предыдущие исследования характеризуют изоляцию и различия в свойствах, или об отсутствии таковых первичных миобластов человека отвзрослых и пожилых людей , 6, 20, 27, 28, 29, 30, 31, 35, 3 6, 37, 38. Существование гериатрических и / или нефункциональные человека MPCs было продемонстрировано 6, 20, 22. Тем не менее, никакой разницы в поведении свежеизолированных человека MPCs не было также показано 27. Наш протокол позволяет для выделения первичных миобластов, что, по меньшей мере, частично сохраняют их фенотипа, такие как снижение пролиферативного потенциала или старении первичных миобластов, выделенных из мышцы пожилых людей и позволяет использовать этиКлетки для функциональных исследований молекулярных механизмов мышечной гомеостаза при старении 22.
Первичные миобласты, выделенные с использованием способа, описанного здесь, может быть использован не только для миогенных исследований дифференциации, но и для исследования внутриклеточных изменений, таких как изменения в экспрессии генов, происходящих в клетках миогенных предшественников человека в процессе старения. Тем не менее, изменения , которые происходят в клетках при длительном экс естественных условиях культуры необходимо учитывать при анализе фенотипических и генотипических изменений , происходящих в процессе старения. Рекомендуется использовать свежеизолированных клетки для этой цели.
Кроме того, способ культивирования первичных миобластов , описанный здесь позволяет для расширения и относительно долгосрочной культуры первичных миобластов человека, что обеспечивает надежные функциональных исследований в лабораторных условиях . Ранее мы показали, что миогенные клетки-предшественники, выделенные с помощью нашего метода можно использовать для экспрессии обоих профилировании и фуnctional исследования процессов , связанных со старением мышц 22. Этот метод также применим к мышцам взрослых и старых грызунов и позволяет для изоляции культуру , обогащенную миобластов , которые могут использоваться для хронометража генетических и эпигенетических изменений в процессе старения и функциональных исследований 22. Ограничения этого метода включают использование, в некоторой степени, смешанная популяция клеток , а не чистой популяции клеток - сателлитов, которые могут быть получены с использованием более сложных опубликованных методов 6, 28, 29, 39, 40, 41, 42, 43.
Мы представляем упрощенную, по доступным ценам, и воспроизводимый протокол для выделения первичных миобластов клеток от взрослых и в возрастелюди. По нашему опыту, доступные, более сложные методы выделения и культуры первичных миобластов человека (таких как MACS- или FACS-отсортированные клетки-сателлиты) идеально подходят для некоторых видов исследований, таких как профилирование транскриптомных или протеомические изменения в клетках. Тем не менее, эти методы являются дорогостоящими, требуют, по крайней мере, некоторый уровень знаний, и может оказаться затруднительным из-за низкой пролиферативной скорости чистых первичных миобластов культур и фибробластов зарастания миобластов.
Мы представляем воспроизводимый протокол, который позволяет простую изоляцию и культуру первичных миобластов человека для использования в функциональных исследованиях. Кроме того, мы предлагаем использовать ламинина 42 и ограниченное использование bFGF в качестве ключевых факторов для успешной культуры 44. Мы также предлагаем избежать стресса , порожденную центрифугированием при разделении клеток и один этап предварительного покрытия при первом прохождении 45. Подводя итог, мы имеемоптимизированный эффективный протокол для изоляции и культуры первичных миобластов / MPCs из мышц взрослых и пожилых людей, которые также применимы к мышцам грызунов и обеспечивает экспрессию и функциональные исследования мышечной гомеостаза.
Раскрытие информации
There is nothing to disclose.
Благодарности
This work is supported by the Biotechnology and Biological Sciences Research Council (BBSRC; BB/L021668/1), the MRC and Arthritis Research UK as part of the MRC - Arthritis Research UK Centre for Integrated Research into Musculoskeletal Ageing (CIMA) and the Wellcome Trust Institutional Strategic Support Fund (097826/Z/11/A). The authors would like to thank Dr Dada Pisconti (University of Liverpool) for her expertise and advice in the isolation of muscle progenitor cells.
Материалы
| Name | Company | Catalog Number | Comments |
| 60 mm Petri dishes | Greiner Bio One | 628160 | Cellstar Cell culture dish, PS, 60/15 MM, VENTS. |
| Cell culture plates (6-well) | Sigma-Aldrich | CLS3516 | Corning Costar cell culture plates. 6-well, flat bottom (Individually wrapped) . |
| Cell culture plates (12-well) | Greiner bio-one | 657 160 | Cellstar Cell culture Multiwell Plates. |
| Culture flasks | Greiner Bio One | 690175 (25 cm2); 658175 (75 cm2). | Cellstar Filter Cap Cell Culture Flasks. |
| Standard Disposable Scalpel | Granton | 91310 | Sterile stainless steel blade, pattern: 10. |
| Pipettes | Greiner bio-one | 606 180 (5 mL); 607 180 (10 mL); 760 180 (25 mL) | Cellstar Serological Pipettes. |
| Pasteur plastic pipettes | Starlab | E1414-0311 | 3.0 mL Graduated Pasteur Pipette (Sterile), Ind. Wrapped. |
| Syringe | BD | 300613 | 20 mL BD eccentric tip syringe. |
| 0.2 µm filters | Gilson | ALG422A | Sterile Syringe Filters CA 0.2 µm 33 mm Pk50. |
| Cell strainers | Fisher Scientific | 11597522 | Cell culture strainer sterile individually packed 70 µm polypropylene. |
| Collagenase D | Roche | 11088882001 | Collagenase D; Activity: ≥0.15 U/mg |
| Dispase II | Sigma-Aldrich | D4693 | Dispase II Protease from Bacillus polymyx. Activity: ≥0.5 U/mg solid. |
| CaCl2 | Sigma-Aldrich | 449709 | Calcium chloride, anhydrous, beads, −10 mesh, ≥99.9% trace metals basis |
| Laminin | Sigma-Aldrich | 114956-81-9 | Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane. 1 mg/mL. |
| DMEM-high glucose | Sigma-Aldrich | D5671 | Dulbecco’s Modified Eagle’s Medium - high glucose. With 4,500 mg/L glucose and sodium bicarbonate, without L-glutamine and sodium pyruvate. |
| F-12 media | Gibco | 21765029 | Ham's F-12 Nutrient Mix. 1x + L-glutamine. |
| FGF-b | PetroTech | 100-18B | Recombinant human basic Fibroblast Growth Factor. |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | Fetal Bovine Serum. |
| Horse serum (HS) | Sigma-Aldrich | H1270 | Horse Serum. Donor herd, USA origin, sterile-filtered. |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | Penicillin-Streptomycin with 10,000 units penicillin and 10 mg streptomycin per mL in 0.9% NaCl, sterile-filtered. |
| L-Glutamine | Sigma-Aldrich | G7513 | L-Glutamine solution. 200 mM, solution, sterile-filtered. |
| Trypsin-EDTA | Sigma-Aldrich | T4049 | Trypsin-EDTA solution. 0.25%, sterile-filtered. |
| TrypLE Express | Gibco | 12604-013 | TrypLE Express Enzyme (1x), no phenol red. |
| DPBS (cell culture) | Sigma-Aldrich | D8537 | Dulbecco’s Phosphate-buffered Saline. Modified, without calcium chloride and magnesium chloride. |
| PBS (immunostaining) | Sigma-Aldrich | P4417-50TAB | Phosphate-buffered saline tablet. One tablet per 200 mL of deionized water (0.01 M phosphate buffer, 0.0027 M potassium chloride and 0.137 M sodium chloride, pH 7.4). |
| Methanol | Fisher | M/4000/PC17 | Methanol Analytical Reagent Grade |
| Triton X-100 | Sigma-Aldrich | T8787 | Triton X-100 for molecular biology. |
| anti-MF 20 antibody | DSHB | MF20-c 2ea 211 µg/ml. | MYH1E (MF 20) Mouse mAb. |
| anti-MyoD antibody | Cell Signaling Technology | 13812P | MyoD1 (D8G3) XP Rabbit mAb. |
| anti-Ki67 antibody | Abcam | ab16667 | Rabbit mAb to Ki67 [SP6]. |
| Anti-mouse 488 secondary antibody | Invitrogen | A-11029 | Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate. |
| Anti-rabbit 488 secondary antibody | ThermoFisher Scientific | A-11034 | Goat anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate. |
| DAPI | Sigma-Aldrich | Sigma-Aldrich | DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) |
| Senescence β-Galactosidase Staining Kit | Cell Signaling Technology | 9860 | Senescence β-Galactosidase Staining kit. |
| DMSO | Sigma-Aldrich | 41639 | Dimethyl sulfoxide. BioUltra, for molecular biology, ≥99.5% (GC). |
| Acridine Orange | Sigma-Aldrich | A8097 | Acridine Orange hydrochloride solution, 10 mg/mL in H2O. |
| Ethidium bromide | Sigma-Aldrich | E1510 | Ethidium bromide solution. BioReagent, for molecular biology, 10 mg/mL in H2O. |
| Lipofectamine 2000 | ThermoFisher Scientific | 11668019 | Lipofectamine 2000 Transfection Reagent |
| Scramble control for transfections | Qiagen | 1027271 | miScript Inhibitor Neg. Control (5 nmol) |
| Hsa-miR-378a-3p miScript Primer Assay | Qiagen | 218300 | Hs_miR-422b_1 miScript Primer Assay (targets mature miRNA: hsa-miR-378a-3p). MIMAT0000732: 5'-ACUGGACUUGGAGUCAGAAGGC |
| Anti-hsa-miR-378a-3p miScript miRNA Inhibitor | Qiagen | 219300 | Anti-hsa-miR-378a-3p miScript miRNA Inhibitor (targets mature miRNA: hsa-miR-378a-3p). MIMAT0000732: 5'-ACUGGACUUGGAGUCAGAAGGC |
| Megafuge 2.0 R Centrifuge | Heraeus | 75003085 | n/a |
| Centrifuge rotor | Heraeus | 3360 | Heraeus Sepatech Megafuge Centrifuge Rotor BS4402/A. Max. radius: 15.5 cm. |
| Eclipse Ti-E Inverted Microscope System | Nikon | n/a | Eyepieces: CFI 10X/22; Total magnification: 100X (MF20, Live/dead and Ki67). |
| Axiovert 200 inverted microscope | Carl Zeiss | n/a | Eyepieces: Carl Zeiss 1016-758 W-PI 10X/25; Total magnification: 100X (Senescence β-Galactosidase Staining). |
| Axiovert 25 inverted microscope | Carl Zeiss | n/a | Eyepieces: E-PL 10X/20. Total magnification: 100X (bright field). |
| Diaphot Inverted Tissue Culture Microscope | Nikon | n/a | Eyepiece: CFWN 10X/20. Total magnification: 100X (bright field). |
| Hydromount | National Diagnostics | HS-106 | Hydromount |
Ссылки
- Hughes, V. A., et al. Longitudinal muscle strength changes in older adults: influence of muscle mass, physical activity, and health. J Gerontol A Biol Sci. 56, B209-B217 (2001).
- Ryall, J. G., Schertzer, J. D., Lynch, G. S. Cellular and molecular mechanisms underlying age-related skeletal muscle wasting and weakness. Biogerontology. 9, 213-228 (2008).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nat Cell Biol. 12, 143-152 (2010).
- Lexell, J., Taylor, C. C., Sjostrom, M. What is the cause of the ageing atrophy? Total number, size and proportion of different fiber types studied in whole vastus lateralis muscle from 15- to 83-year-old men. J Neurol Sci. 84, 275-294 (1988).
- Grounds, M. D. Reasons for the degeneration of ageing skeletal muscle: a central role for IGF-1 signalling. Biogerontology. 3, 19-24 (2002).
- Carlson, M. E., et al. Molecular aging and rejuvenation of human muscle stem cells. EMBO Mol Med. 1, 381-391 (2009).
- Brown, D. M., Goljanek-Whysall, K. microRNAs: Modulators of the underlying pathophysiology of sarcopenia?. Ageing Res Rev. 24, 263-273 (2015).
- Brooks, S. V., Faulkner, J. A. Contraction-induced injury: recovery of skeletal muscles in young and old mice. Am J Physiol. 258, C436-C442 (1990).
- Lepper, C., Partridge, T. A., Fan, C. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138, 3639-3646 (2011).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9, 493-495 (1961).
- Charge, S. B., Rudnicki, M. A. Cellular and molecular regulation of muscle regeneration. Physiol Rev. 84, 209-238 (2004).
- Brack, A. S., Rando, T. A. Intrinsic changes and extrinsic influences of myogenic stem cell function during aging. Stem cell Rev. 3, 226-237 (2007).
- Kadi, F., Charifi, N., Henriksson, J. The number of satellite cells in slow and fast fibres from human vastus lateralis muscle. Histochem Cell Biol. 126, 83-87 (2006).
- Verdijk, L. B., et al. Satellite cell content is specifically reduced in type II skeletal muscle fibers in the elderly. Am J Physiol Endocrinol Metab. 292, E151-E157 (2007).
- Collins, C. A., Zammit, P. S., Ruiz, A. P., Morgan, J. E., Partridge, T. A. A population of myogenic stem cells that survives skeletal muscle aging. Stem cells. 25, 885-894 (2007).
- Bortoli, S., et al. Gene expression profiling of human satellite cells during muscular aging using cDNA arrays. Gene. 321, 145-154 (2003).
- Thalacker-Mercer, A. E., Dell'Italia, L. J., Cui, X., Cross, J. M., Bamman, M. M. Differential genomic responses in old vs. young humans despite similar levels of modest muscle damage after resistance loading. Physiol Genomics. 40, 141-149 (2010).
- Jejurikar, S. S., et al. Aging increases the susceptibility of skeletal muscle derived satellite cells to apoptosis. Exp Gerontol. 41, 828-836 (2006).
- McArdle, A., Dillmann, W. H., Mestril, R., Faulkner, J. A., Jackson, M. J. Overexpression of HSP70 in mouse skeletal muscle protects against muscle damage and age-related muscle dysfunction. FASEB J. 18, 355-357 (2004).
- Sousa-Victor, P., et al. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 506, 316-321 (2014).
- Cornelison, D. D. Context matters: in vivo and in vitro influences on muscle satellite cell activity. J Cell Biochem. 105, 663-669 (2008).
- Soriano-Arroquia, A., McCormick, R., Molloy, A. P., McArdle, A., Goljanek-Whysall, K. Age-related changes in miR-143-3p:Igfbp5 interactions affect muscle regeneration. ageing cell. 15, 361-369 (2016).
- Goljanek-Whysall, K., et al. Regulation of multiple target genes by miR-1 and miR-206 is pivotal for C2C12 myoblast differentiation. J Cell Sci. 125, 3590-3600 (2012).
- Georgantas, R. W., et al. Inhibition of myogenic microRNAs 1, 133, and 206 by inflammatory cytokines links inflammation and muscle degeneration in adult inflammatory myopathies. Arthritis Rheumatol. 66, 1022-1033 (2014).
- Sharples, A. P., Al-Shanti, N., Stewart, C. E. C2 and C2C12 murine skeletal myoblast models of atrophic and hypertrophic potential: relevance to disease and ageing?. Journal of cellular physiology. 225, 240-250 (2010).
- Hidestrand, M., et al. Sca-1-expressing nonmyogenic cells contribute to fibrosis in aged skeletal muscle. J Gerontol A Biol Sci Med Sci. 63, 566-579 (2008).
- Alsharidah, M., et al. Primary human muscle precursor cells obtained from young and old donors produce similar proliferative, differentiation and senescent profiles in culture. ageing cell. 12, 333-344 (2013).
- Agley, C. C., Rowlerson, A. M., Velloso, C. P., Lazarus, N. L., Harridge, S. D. Isolation and quantitative immunocytochemical characterization of primary myogenic cells and fibroblasts from human skeletal muscle. J Vis Exp. , (2015).
- Pietrangelo, T., et al. Molecular basis of the myogenic profile of aged human skeletal muscle satellite cells during differentiation. Exp Gerontol. 44, 523-531 (2009).
- Webster, C., Pavlath, G. K., Parks, D. R., Walsh, F. S., Blau, H. M. Isolation of human myoblasts with the fluorescence-activated cell sorter. Exp Cell Res. 174, 252-265 (1988).
- Woods, K., Marrone, A., Smith, J. Programmed cell death and senescence in skeletal muscle stem cells. Annals of the New York Academy of Sciences. , 331-335 (2000).
- Chakkalakal, J. V., Jones, K. M., Basson, M. A., Brack, A. S. The aged niche disrupts muscle stem cell quiescence. Nature. 490, 355-360 (2012).
- Cornelison, D. D., et al. Essential and separable roles for Syndecan-3 and Syndecan-4 in skeletal muscle development and regeneration. Genes & development. 18, 2231-2236 (2004).
- Pisconti, A., Cornelison, D. D., Olguin, H. C., Antwine, T. L., Olwin, B. B. Syndecan-3 and Notch cooperate in regulating adult myogenesis. J Cell Biol. 190, 427-441 (2010).
- Schafer, R., et al. Age dependence of the human skeletal muscle stem cell in forming muscle tissue. Artificial organs. 30, 130-140 (2006).
- Castiglioni, A., et al. Isolation of progenitors that exhibit myogenic/osteogenic bipotency in vitro by fluorescence-activated cell sorting from human fetal muscle. Stem cell reports. 2, 92-106 (2014).
- Stewart, J. D., et al. Characterization of proliferating human skeletal muscle-derived cells in vitro: differential modulation of myoblast markers by TGF-beta2. J Cell Physiol. 196, 70-78 (2003).
- Wagner, W., et al. Aging and replicative senescence have related effects on human stem and progenitor cells. PloS one. 4, e5846 (2009).
- Gaster, M., Kristensen, S. R., Beck-Nielsen, H., Schroder, H. D. A cellular model system of differentiated human myotubes. APMIS : acta pathologica, microbiologica, et immunologica Scandinavica. 109, 735-744 (2001).
- Gaster, M., Beck-Nielsen, H., Schroder, H. D. Proliferation conditions for human satellite cells. The fractional content of satellite cells. APMIS : acta pathologica, microbiologica, et immunologica Scandinavica. 109, 726-734 (2001).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods Mol Biol. 798, 21-52 (2012).
- Chowdhury, S. R., et al. One-Step Purification of Human Skeletal Muscle Myoblasts and Subsequent Expansion Using Laminin-Coated Surface. Tissue engineering. Part C, Methods. 21, 1135-1142 (2015).
- Mamchaoui, K., et al. Immortalized pathological human myoblasts: towards a universal tool for the study of neuromuscular disorders. Skeletal muscle. 1, 34 (2011).
- Natarajan, A., Lemos, D. R., Rossi, F. M. Fibro/adipogenic progenitors: a double-edged sword in skeletal muscle regeneration. Cell cycle. 9, 2045-2046 (2010).
- Ciofani, G., et al. Hypergravity effects on myoblast proliferation and differentiation. J Biosci Bioeng. 113, 258-261 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены