A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
رصد مفاعليه Astrocyte والانتشار في المختبر تحت ظروف أشبه بالسكتة
* These authors contributed equally
In This Article
Summary
السكتة الدماغية هي حدثاً معقدة التي يتعرض مساهمة محددة من أستروسيتيس إلى المنطقة المتضررة من الدماغ للأوكسجين الجلوكوز الحرمان (الجزء) من الصعب على الدراسة. يقدم هذا المقال منهجية للحصول على أستروسيتيس معزولة ودراسة تفاعلية وانتشار ظروف الاستثمارات.
Abstract
السكتة الدماغية إصابة في الدماغ معقدة الناجمة عن خثرة أو صمة عرقلة تدفق الدم إلى أجزاء من المخ. وهذا يؤدي إلى الحرمان من الأوكسجين والجلوكوز، مما يتسبب في فشل الطاقة وموت الخلايا العصبية. بعد إهانة السكتة الدماغية، يصبح رد الفعل astrocytes وتتكاثر حول موقع الإصابة كما أنه يتطور. وبموجب هذا السيناريو، من الصعب دراسة مساهمة محددة من أستروسيتيس إلى منطقة الدماغ يتعرض إلى الاسكيمية. ولذلك، يقدم هذا المقال منهجية لدراسة مفاعليه astrocyte الأولية والانتشار في إطار نموذج في المختبر لبيئة مثل الاسكيمية، يطلق الأكسجين الجلوكوز الحرمان (الجزء). أستروسيتيس كانت معزولة من يوم 1-4-الفئران حديثي الولادة القديمة والعدد غير محدد من الخلايا أستروسيتيك وقيمت باستخدام علامة astrocyte انتقائية البروتين حمضية فيبريلاري الدبقية (توصيني) وتلطيخ النووية. يمكن تخصيص الفترة التي astrocytes يتعرضون لحالة الاستثمارات، فضلا عن النسبة المئوية للأوكسجين فهي تتعرض ل. هذه المرونة يسمح للعلماء لوصف مدة الشرط الدماغية تشبه في مجموعات مختلفة من الخلايا في المختبر. تتناول هذه المقالة الأطر الزمنية للاستثمارات التي تحفز مفاعليه astrocyte ومورفولوجيا الضخامي والانتشار كما تقاس الفلورة استخدام تنتشر مستضد النووية الخلية (منها). إلى جانب الانتشار، astrocytes الخضوع للطاقة، والأكسدة، وتستجيب للاستثمارات عن طريق الإفراج عن عوامل قابلة للذوبان في المتوسط الخلية. ويمكن جمع هذه الوسيلة والمستخدمة لتحليل آثار الجزيئات الصادرة عن أستروسيتيس في الثقافات الخلايا العصبية الأولية دون تدخل من خلية إلى خلية. في ملخص، يمكن استخدام هذا النموذج ثقافة الخلية الابتدائية كفاءة لفهم دور astrocytes المعزولة عند الإصابة.
Introduction
ويعرف "الحادة العصبية اختلال وظيفي المنشأ الأوعية الدموية مع التطور السريع أو المفاجئ من الأعراض والعلامات، المقابلة لمشاركة المجالات المحورية في الدماغ"1،2السكتة الدماغية. هناك نوعان من السكتة الدماغية: النزفية والدماغية. عند الخلل في الأوعية الدموية بسبب تمدد الأوعية الدموية أو عطل، مصحوبة بضعف مع تمزق الخلفي للشريان، وهذا هو ما يسمى السكتة الدماغية النزفية3 التي، في معظم الحالات، يؤدي إلى الموت. عند خثرة أو صمة يعوق تدفق الدم، يسبب حرمان مؤقت من الأوكسجين والجلوكوز إلى منطقة الدماغ، فإنه يسمى السكتة الدماغية4. فشل لتغذية الخلايا حول المنطقة المتضررة أو الدماغية الأساسية يؤدي إلى اختلال التماثل الساكن والتمثيل الغذائي والخلل نشطة، وموت الخلايا العصبية، والتهاب5، الذي يمكن أن يؤدي إلى إعاقة مدى الحياة للمرضى6.
السكتة الدماغية هو إصابة المتعددة العوامل التي تنطوي على عدة أنواع من الخلايا التي تتفاعل وممارسة آثارها في نقاط زمنية مختلفة. إنشاء العديد من التفاعلات بيئة صعبة لدراسة سلوك الخلايا الفردية. لذا، كيف يمكننا دراسة المساهمة من نوع الخلية المحددة ضمن هذه بيئة معقدة؟ يتكون نموذج مقبولة في المختبر من الاسكيمية تعريض الخلايا للحرمان من الأوكسجين والجلوكوز (الجزء)، لفترة زمنية معينة، تليها استعادة الخلايا على بيئة نورموكسيك. يحاكي هذا النظام والسكتات دماغية تليها ضخه الدم. في هذا الأسلوب، تتعرض الخلايا أو الأنسجة إلى وسائط خالية من السكر في بيئة إزالة الأوكسجين، استخدام دائرة التاكسج متخصصة. يمكن أن تختلف فترة حضانة المرض الجزء من بضع دقائق يصل إلى 24 ح، اعتماداً على فرضية أن يريد أن يكون اختبار. وقد أظهرت الدراسات أن تبعاً لأوقات الجزء والبيئة نورموكسيك، تعمل محددة من السكتة الدماغية (أيالحاد أو الفمية) يمكن أن يتحقق. الابتدائي astrocytes معزولة، يتعرض للاستثمارات مع استعادة الخلفي لظروف نورموكسيك، ونموذج خلوية مدروسة تحاكي السكتة الدماغية في المختبر7. استخدام الجزء من الممكن الكشف عن الآليات الجزيئية مستقلة من الخلايا المعزولة تحت بيئة شبيهة بالسكتة الدماغية.
كما يزيد من معرفتنا بعلم الأحياء أستروسيتي، أصبح من الواضح أنها حاسمة للحفاظ على نقاط الاشتباك العصبي واستدامة التنمية وإصلاح، واللدونه العصبية8. تحت الظروف العادية، الإفراج عن astrocytes والرد على السيتوكينات والمستقطبات وعوامل النمو وجليوترانسميتيرس، الحفاظ على توازن التمثيل الغذائي والتوازن داخل نهايات5،9. في neuroinflammation الحادة، مثل السكتة الدماغية، هذه الخلايا يمكن أن يصبح رد الفعل تظهر أوفيريكسبريشن طويلة الأجل من البروتين حمضية فيبريلاري الدبقية (توصيني) وإظهار تضخم في بهم مورفولوجيا5،10، 11 , 12-تطور احتشاء الدماغية، التوازن تقدمه astrocytes يصبح المتضررة، فيما يتعلق بامتصاص الغلوتامات العادي، واستقلاب الطاقة، وتبادل الجزيئات النشطة، ومضادات الأكسدة نشاط13.
Astrocytes المعاد تنشيطها تتكاثر حول الأنسجة احتشاء في حين تهاجر الكريات البيضاء نحو المنطقة ليسيونيد14. ويمكن قياس انتشار أستروسيتيك باستخدام علامات مثل تكاثر الخلايا النووية مستضد (منها) و Ki67 وبروموديوكسيوريديني (بردو)15. يتم إنشاء هذه الاستجابة التكاثري بطريقة تعتمد على الوقت ويساعد على تشكيل ندبة الدبقية، صفيف أستروسيتيس رد الفعل لا رجعة فيه على طول حمة الموقع معطوب بعد إصابة9. واحدة من أولى مهام هذا الندبة الحد من التسرب الخلايا المناعية من هذه المنطقة. ومع ذلك، وقد أظهرت الدراسات أن الندبة يصبح عائقا مادية لمحاور عصبية تمديد، كما أنها تفرج عن الجزيئات التي تحول دون نمو محواري، وإنشاء حاجز مادي يحول دون توسيع نطاق حول المنطقة المضرورة16محاور عصبية. ومع ذلك، هناك أدلة علمية تبين أن بعد إصابة حبل الشوكي، تماما منع تشكيل ندبة الدبقية يمكن أن يضر بالتجديد لمحاور عصبية17. وبالتالي، يجب النظر في السياق الذي يتم قياس استجابة أستروسيتيك محددة، بناء الإطار للضرر الذي درس.
يمكن تطبيق المنهجية المقدمة لدراسة وظيفة فردية astrocytes بعد الأكسجين الجلوكوز الحرمان ومن الممكن تعديله تبعاً للأسئلة التي يريد المحقق للإجابة. على سبيل المثال، إلى جانب علامات المعرب عنها في أوقات مختلفة من الاستثمارات وتغيير الخصائص المورفولوجية، supernatants من astrocytes يتعرضون للجزء يمكن كذلك تحليل لتحديد العوامل القابلة للذوبان صدر عن هذه الخلايا، أو استخدامها كوسائل الإعلام مكيفة لتقييم ما التأثير في خلايا الدماغ الأخرى. ويمكن هذا النهج دراسات حول مفاعليه أستروسيتي التي يمكن أن تؤدي إلى الكشف عن العوامل التي تحكم وتعدل استجابتها في سيناريو السكتة الدماغية.
Protocol
بعد الولادة الفئران (سبراغ داولي) 1-4 أيام القديمة تستخدم لعزل كورتيسيس. أسلوب القتل الرحيم هو قطع الرأس، كما وافقت عليها المبادئ التوجيهية للمعاهد الوطنية للصحة-
1. إعداد الأدوات والمواد اللازمة لجراحة
- تعقيم الأدوات في اﻷوتوكﻻف (درجة الحرارة: 121 درجة مئوية، وضغط: 15 رطل/بوصة مربعة، والوقت: 30 دقيقة) باستخدام مربع الصلب أو لحظة ختم الحقيبة التعقيم. انظر المواد في الجدول للمواد-
2. إكمال "إعداد دميم"
- في كوب لتر واحد يحتوي على 700 مل يعقم ماء، أضف دولبيكو ' s النسر التعديل ' s مسحوق المتوسطة في درجة حرارة الغرفة-
- إضافة بيكربونات الصوديوم 3.7 غرام/لتر، بينما هو آثار الحل مع محرض مغناطيسي.
- ضبط ال pH إلى 7.4، يعقم المياه إعادة التخزين يصل إلى 1 لتر، ثم تصفية. تكملة لأغراض الثقافة، وحدة التخزين المطلوبة لوسائل الإعلام مع 10% FBS و 1% البنسلين/ستربتوميسين، والدافئة في 37 ˚C. انظر المواد في الجدول للمواد-
ملاحظة: تم تعديل درجة الحموضة إلى 7.4 عبر إدخال مسرى مقياس الأس الهيدروجيني في وسائل الإعلام. يجب إثارة وسائل الإعلام، ثم ببطء أضف 1 من هيدروكسيد الصوديوم م استخدام قطارة.
3. الابتدائي "أستروسيتي الثقافة"
ملاحظة: بعد البذر، خلية الإعلام يجب أن تتغير كل ثلاثة أيام، ويمكن أن تكون الخلايا المزروعة تصل إلى كونفلوينسي (11-13 يوما). اليوم الثالث، اضغط قارورة عدة مرات إلى رفع ميكروجليال الخلايا والخلايا oligodendrocyte السلف قبالة الثقافة, قم بإزالة كافة ' القديم ' وسائل الإعلام، يغسل مرتين باستخدام 10 مل من برنامج تلفزيوني، ونضح برنامج تلفزيوني، ثم إضافة جديدة من وسائط الإعلام الجديدة. انظر المواد في الجدول للمواد-
- تشريح الدماغ الفئران حديثي الولادة
- إجراء التشريح في غطاء زراعة الأنسجة. الحصول على 1-4 أيام القديمة الجراء الفئران حديثي الولادة (2 أدمغة الفئران تستخدم كل قارورة 2 75 سم)-
- إعداد ثلاثة أطباق بيتري 60 ملم و "الماصة؛" 5 مل دميم كاملة في كل.
ملاحظة: أنها يمكن أن تكون مقسمة على النحو التالي: #1 لكل الفئران الدماغ، #2 لكل كورتيسيس من العقول، و #3 لجميع كورتيسيس مقشرة (دون السحايا). - فهم ألجرو ورذاذ مع الإيثانول 70%. قطع رأس ذلك وتجاهل الجسم في حاوية نفايات صغيرة واقية.
- استخدام الملقط تشريح الصغرى، عقد الرئيس وقطع الجلد على قمة الرأس لفضح الجمجمة.
- مع زوج آخر من مقص، جعل " ر " شق بدءاً من الجزء الخلفي الجمجمة نحو الآنف. استخدام زوج من الملقط لإزالة الجمجمة بلطف.
- إزالة الدماغ مكشوفة مع زوج من ملاقط والدماغ في واحدة من أطباق بيتري سابقا مليئة بالمتوسطة-
- استخدام مجموعة أخرى من الصكوك العقيمة للخطوات اللاحقة-
- استخدام ملقط تشريح الصغير برفق وضع الدماغ واحدة على غطاء المقلوب طبق بيتري 60 ملم. عندما يتم وضع طبق بتري على شاش معقم، فمن الممكن لعرض الدماغ وضوح، وأنه من الأسهل لتشريح.
- المطرد في الدماغ مع ملقط تشريح الصغرى وفصل في نصف الكرة الدماغي باغاظة بلطف على طول الشق خط الوسط مع نهاية حادة ملقط تشريح الصغرى.
- انحرف وقشر كورتيسيس، تاركة وراءها هذه المسألة الأبيض، ونقلها إلى طبق بيتري، المسمى سابقا #2. كرر هذا الإجراء لجميع العقول، يجمع بين جميع كورتيسيس تشريح في طبق بتري المسمى #2-
- إخراج الحصين من أسفل كل قشرة وتجاهل عليه.
- استخدام الملقط الصغير تشريح وبيتري 60 مم للطف قشر السحايا من الفصوص القشرية الفردية، ووضعها في طبق بتري المسمى #3-
- تفكك النسيج: أسلوب خلاط الخالطون
- من أجل تعليق الأنسجة/متوسطة (مقشرة كورتيسيس الدماغ) في كيس خلاط العقيمة وإضافة المتوسطة ما يكفي لجلب إجمالي حجم الحقيبة لمل 5.
- وضع الحقيبة في الخلاط الخالطون، ترك حوالي 2 سم الكيس مرئية فوق الباب مغلق. تفكك خلية يتم خلال 2.5 دقيقة بسرعة عالية-
ملاحظة: بدلاً من ذلك، يمكن أن يتم هذا بإغلاق الحقيبة وقصف بلطف أنه مع كوب في غطاء محرك السيارة. تأكد من استخدام قطعة قماش بين حقيبة والكأس لتجنب الاحتكاك. - من أجل تعليق خلية في غربال مش رقم 60 وثم من أجل التدفق التي تمت تصفيتها من خلال على منخل رقم 100، السماح له بتصفية بواسطة الجاذبية.
- استخدام 15 مل أنابيب الطرد المركزي تعليق خلية في ز 200 x في الطرد مركزي سريرية (يفضل أن يكون البديل دلو الدوار) للحد الأدنى 5
- من أجل إيقاف المادة طافية في كوب، ثم استخدام ماصة مصلية، إعادة تعليق وتنأى بيليه الخلايا في مدة أقصاها 5 مل من وسائل الإعلام-
- عد الخلايا
- مع ميكروبيبيتي، جمع 100 ميليلتر من تعليق خلية في أنبوب ميكروسينتريفوجي 1.5 مل وإضافة 100 ميليلتر من تريبان الأزرق-
- إدراج 10 ميليلتر من تعليق المجمعة في هيموسيتوميتير وحساب كافة الخلايا التي تكون قابلة للتطبيق في الزوايا الأربعة للمربع. الصيغ لحساب كثافة الخلايا قبل إعداد قوارير
- :
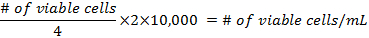
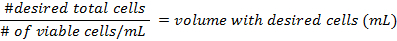
- إضافة خلايا على الأقل 500,000 كل 25 سم 2 قارورة. "الماصة؛" يصل إلى 5 مل دميم في كل قارورة. الخليط يجب أن لا تصل إلى الرقبة قارورة. مكان لهم في حاضنة 37 درجة مئوية في 5% CO 2، لمدة 3 أيام، ثم قم بتغيير وسائل الإعلام-
- تقنيات تنقية أستروسيتي: تغيير وسائط الإعلام، استراتيجيات الميكانيكية والكيميائية
ملاحظة: معدل الأيض astrocytes مرتفع مقارنة بأنواع الخلايا الأخرى، ولذلك في تغذويا حرم الظروف، هذه الخلايا تظهر معدلات بقاء منخفضة بعد بضعة أيام. خلافا أستروسيتيس، ميكروجليا لا تتأثر بالحرمان التغذوي، وتنتشر في مثل هذه البيئات 18. للحفاظ على انخفاض عدد خلايا microglial، تغيير أصحاب وسائل الإعلام ثقافة الخلية أستروجليال كل 3 أيام. هذا التغيير المستمر في وسائط الإعلام خلية ستنخفض أيضا السكان ميكروجليال التي يمكن أن تنمو على رأس المونولاير خلية أستروسيتيك في قارورة 19. ماصة- استخدام باستور نضح وسائط الإعلام مع خلايا microglial غير ملتصقة كل من قوارير. أغسل أي حطام خلفها استخدام PBS العقيمة التي تمت تصفيتها لكل من قوارير بطريقة دروبويسي (5 مل في قارورة). إضافة
- دميم العقيمة التي تمت تصفيتها (مع المضادات الحيوية والجنين المصل البقري) دروبويسي لكل قارورة (5 مل في قارورة). تحرض بلطف في حركة دائرية تغطي كامل السطح.
- الخلايا مكان في 37 &176 #؛ ج حاضنة في 5% CO 2 لمدة 8-10 أيام حتى تصل قوارير كونفلوينسي (> تغطية لوحة 95%).
ملاحظة: عدة بروتوكولات أظهرت أنه عندما تصل أستروسيتيس إلى كونفلوينسي، الطرق الميكانيكية، مثل الهز الثقافة من 2 إلى 24 ساعة، يؤدي إلى مفرزة الخلايا التي تقع على رأس هذه أستروسيتيس، ميكروجليا والسلائف أساسا الخلايا 19 ، 20-
-تخفض - عدم أستروسيتيك الخلايا في الثقافة بأداء تهتز المداري 180 لفة في الدقيقة لمدة 30 دقيقة. بعد إزالة الخلايا في المادة طافية، هو بيبيتيد وسائط جديدة في قارورة (~ 15 مل)-
- للقضاء على الخلايا oligodendrocyte السلف، زيادة سرعة الهز إلى 200 لفة في الدقيقة 6 ح 21 ، ، من 22 23 والمادة طافية aspirate بيبيت وسائط جديدة-
ملاحظة: لتقليل وجود microglia في الثقافات، يمكن استخدام اثنين من الأساليب الكيميائية تسلسلياً (ليس في نفس الوقت) في منهجية ثقافة الخلية الابتدائية: أرابينوز السيتوزين (ارا-ج) وللوسين الميثيل إستر (البورصة) 24- - على الفور عندما تصل الخلايا كونفلوينسي (100%)، 3-4 أيام بعد الإزالة الميكانيكية ل microglia، هذه الخلايا يمكن علاجها مع 8 ميكرومتر من السيتوزين أرابينوز مجمع أنتيميتوتيك (ارا-ج) في دميم لمدة 5 أيام (تغيير إلى ج ارا الطازجة في دميم يوميا)-
ملاحظة: نقطة الوقت لإضافة ج ارا بالغة الأهمية حيث أن هذا المركب هو المخدرات أنتيميتوتيك، أن يقلل من العدد من سرعة تقسيم الخلايا مثل ميكروجليا 19 ، 25 والليفية 26 . على النقيض من microglia، عندما المتلاقية، وقف astrocytes تنتشر عن طريق تثبيط الاتصال 27- - السماح ليومين للخلايا للتعافي من العلاج ارا-ج. استخدام
- لزيادة خفض التلوث microglial، بعد التوصل إلى خلايا كونفلوينسي، 50 مم للأم-leucine إستر الميثيل (البورصة) في دميم ثابتة عند درجة الحموضة 7.4، عن ح 1 في 37 ˚C.
ملاحظة: النظام الإيكولوجي البحري الكبير تعبر غشاء الخلايا والعضيات، وبعد أن تحلل، يتراكم L-ليوسيني المنتجة في ليسوسوميس من هذه الخلايا. ويؤدي تراكم هذه الأحماض الأمينية إلى تورم ناضح وتمزق ليسوسوميس ، من 28 29. النظام الإيكولوجي البحري الكبير وفعالة جداً في القضاء على microglia، بالمقارنة مع 20 ، الخلايا الأخرى 30-
4. زراعة أستروسيتيس في لوحات 6-بئر
- كوفيرسليبس طلاء مع بولي-د-يسين
- ساترة وضع واحد في كل 35 ملم بيتري طبق، ثم إضافة 100 ميليلتر من حل كل ساترة بولي-د-يسين المخفف وانتظر حاء – 1
- إزالة بولي-د-يسين ويغسل مرتين مع 2 مل من الماء المعقم. إزالة المياه
- وانتظر كوفيرسليبس لتجف داخل غطاء محرك السيارة. تخزين كوفيرسليبس في-20 درجة مئوية لمدة تصل إلى أسبوعين.
ملاحظة: تجميد الحل بولي-د-يسين المخفف؛ يمكن تخزينه لمدة تصل إلى أسبوعين.
- تريبسينيزيشن
- استخدام ماصة باستور، نضح المتوسطة من قوارير. إضافة 5 مل/قارورة من PBS العقيمة التي تمت تصفيتها بلطف شطف الخلايا.
- Aspirate إيقاف برنامج تلفزيوني، ثم قم بإضافة 5 مل/قارورة العقيمة التي تمت تصفيتها 0.25% التربسين و 0.5 مم أدتا إلى حل. طرأت قارورة ˚C 37، 5% CO 2 حاضنة للحد الأدنى 10
ملاحظة: بينما هي تفرخ الخلايا، الحارة 5 مل/قارورة من دميم كاملة جديدة في 37 درجة مئوية. - بعد 10 دقيقة من الحضانة، تحرض للتأكد من أن كافة الخلايا التي انطلق قارورة. بسرعة إضافة 5 مل دميم كاملة الحارة لكل قارورة، لتحييد التربسين.
- بلطف "الماصة؛" الخلايا صعودا وهبوطاً عدة مرات لتفريق أي " كتل ". نقل الخلايا مع وقف التنفيذ من قوارير اثنين إلى أنبوب الطرد مركزي مخروطية 15 مل.
- الطرد المركزي لمدة 5 دقائق في 200 x ز جمع بيليه الخلية. إعادة تعليق بيليه في 500 ميليلتر من المتوسطة والمضي قدما لوضع الخلايا في قوارير.
ملاحظة: أمثلة من تحليلات تتم مع الخلايا: 1) النسخ العكسي تفاعل البوليميراز المتسلسل (RT-PCR) لتحليل التعبير الجيني؛ 2) الغربية وصمة عار تقييم تعبير البروتين؛ 3) التدفق الخلوي التحليل لتحديد عدد الخلايا العصبية السلف والبروتينات للفائدة؛ 4) الفلورة لتحليل التعبير البروتين والتعريب-
- أستروسيتيس استمطار
- بعد علاج astrocytes الأولية مع التربسين (الرجوع إلى 4.2)، جمع 100 ميكروليتر من تعليق خلية في أنبوب ميكروسينتريفوجي 1.5 مل وإضافة 100 ميكروليتر من 0.5% تريبان الأزرق-
- ميكروليتر 10 إضافة تعليق المجمعة في تريبان الأزرق إلى هيموسيتوميتير وحساب كافة الخلايا التي تكون قابلة للتطبيق-
- استخدام الصيغ في الخطوة 3، 3 لحساب كثافة الخلايا قبل إعداد في قوارير.
- تحضير جيد متعدد الأطباق بإضافة أحد العقيمة، بولي-د-يسين المغلفة ساترة لكل بئر. "الماصة؛" الخلايا 50,000 وملء بقية وحدة التخزين في كل طبق متعدد جيدا مع الطازجة المتوسطة (حوالي 2 مل)-
- ضع الأطباق جيدا متعددة في حاضنة 37 ˚C 5% CO 2 في، وبعد 5-7 أيام، أستروسيتيس قد تنمو وتغطي كامل السطح من كوفيرسليبس-
5. بروتوكول الاستثمارات "الابتدائي أستروسيتيس"
- "دولبيكو الملحق" من إعداد الجزء المتوسط ' s تعديل النسر ' s خالية من متوسط الجلوكوز مع بيكربونات الصوديوم 3.7 غرام/لتر، و 1% البنسلين/ستربتوميسين. انظر المواد في الجدول 4-
- تطهير 20 مل المتوسطة الحرة الجلوكوز بالسطح مع 95% N 2/5% CO 2 لمدة 10 دقيقة في تدفق من 15 لتر في الدقيقة (المشار إليها مع تدفق متر) عن طريق إدراج ماصة مصلية إلى نظام الغاز في الأجل المتوسط.
ملاحظة: بعد تطهير المتوسط للاوكسيجين، ضبط درجة الحموضة في 7.4 (راجع الملاحظة في الخطوة 2، 1)- - تصفية إقصاء المتوسط خالية من السكر باستخدام نظام تصفية أنبوب 50 مل.
ملاحظة: جعل الطازجة متوسط الاستثمارات لكل تجربة، ومحتدما مع 95% N 2/5% CO 2 قبل استخدام، للتأكد من تعرض الخلايا لبيئة إزالة الأوكسجين.
- الإجراء التجريبي
- داخل غطاء زراعة الأنسجة، قم بإزالة الوسائط أستروسيتي من كوفيرسليبس المعدة مسبقاً (راجع الخطوة 4.3.5) ويغسل مع برنامج تلفزيوني الخلوية مرتين لإزالة أي الجلوكوز في الخلايا-
- إضافة 2 مل من وسائط الإعلام الجزء لكل منهما جيدا ووضع الأطباق جيدا متعددة داخل قاعة نقص مع الجميع أغطية الاتصال خليط الغاز صمام مدخل
- وترك صمام خروج مفتوحة. مسح الدائرة مع خليط الغاز من 95% N 2/5% CO 2، في 15 لتر في الدقيقة للحد الأدنى 5
- وقف تدفق الغاز، وأول مرة أغلق المشبك في صمام الخروج، ثم أغلق المشبك في الأنبوب صمام مدخل الغاز-
ملاحظة: ضمان وجود لا تسرب للغاز بتغطية ختم الدائرة بالماء والصابون. إذا كان الختم أمنا، ينبغي أن تشكل لا فقاعات. - ضع الدائرة بأكملها إلى حاضنة الثقافة الخلية في 37 درجة مئوية ل 1 ح أو ح 6 في الجزء.
- بعد وقت الحضانة أكثر، نضح وسائط الإعلام الجزء وعناية عملية بيبيت 2 مل دميم كاملة لكل سم 4.67 2 جيدا نورموكسيك 24 h.
6. بروتوكول "إعداد الفلورة Astrocyte الأولية"
ملاحظة: لتقييم نقاء astrocyte، أنواع الخلايا الدماغ مختلفة مثل الخلايا العصبية، وميكروجليا، وأوليجوديندروسيتيس ويمكن الكشف عنها بواسطة الفلورة استخدام علامات خلية مختلفة. يمكن استخدام علامات الانتشار، ومنها، ويوديد propidium (PI) على astrocytes الأساسية تتعرض للاستثمارات تليها شروط نورموكسيك. انظر المواد في الجدول للمواد-
- إعداد الفلورة
ملاحظة: هذا بروتوكول الفلورة عامة، يمكن إجراء تعديلات طفيفة على تحقيق إشارة أمثل (مثلاً، أطول من فترات حضانة، درجة حرارة الحضانة). يمكن استخدام كل علامة من الجدول 1 وفقا للشركة المصنعة ' بروتوكول s.- لتقييم جدوى الخلية، يمكن أن تكون الخلايا المحتضنة لمدة 5 دقائق في 37 درجة مئوية مع PI (5 ميكرومتر في دميم كاملة) وتغسل مرتين مع 2 مل من برنامج تلفزيوني للخلايا 5 دقيقة تبين تلطيخ PI قابلة للتطبيق أقل.
ملاحظة: استخدام الخلايا تعامل في خطوة 5.2.6- - لإصلاح الخلايا بعد تلطيخ PI، إضافة 2 مل من 4% فورمالين الواحدة 4.67 سم 2 أيضا، لمدة 20 دقيقة في 4 ˚C. لعينات المسمى مع منها، تحديد الحل المفضل هو الميثانول لمدة 10 دقائق في 4 ˚C-
تنبيه: الفورمالين والميثانول ومواد سامة.
ملاحظة: تحقق دائماً من جسم معين بروتوكولات من كل شركة. - تغسل الخلايا مع 2 مل من برنامج تلفزيوني لمدة 5 دقائق وكرر هذه الخطوة 3 مرات.
- احتضان خلايا في عرقلة الحل (الفاعل غير الأيونية 0.5%، 10% FBS في برنامج تلفزيوني) مدة 30 دقيقة في درجة حرارة الغرفة مع الهز لطيف.
- تغسل الخلايا مع 2 مل من برنامج تلفزيوني لمدة 5 دقائق، وتكرار الغسيل 3 مرات.
- احتضانها في 4 درجات مئوية، بين عشية وضحاها (ح 16)، مع جسم الأولية (منها، توصيني) في حل من 1% FBS في برنامج تلفزيوني.
- إزالة الحل جسم الأولية وغسل الخلايا مع 2 مل من برنامج تلفزيوني لمدة 5 دقائق، وكرر هذه الخطوة 3 مرات.
- إينكوباتي مع الجسم المضاد الثانوي مترافق مع فلوروفوري في حل من 1% FBS في برنامج تلفزيوني، عن ح 1، في درجة حرارة الغرفة-
- تغسل الخلايا مع 2 مل من برنامج تلفزيوني لمدة 5 دقائق، كرر هذه الخطوة 3 مرات. أضف 1 ميكروغرام/مل من DAPI (4 '، 6 '-دياميدينو-2-فينيليندولي) لمدة 5 دقائق وصمة عار نواة الخلية.
- تغسل الخلايا مع 2 مل من برنامج تلفزيوني 5 دقيقة، وكرر هذه الخطوة مرتين وتبقى في برنامج تلفزيوني.
- إعداد كوفيرسليبس على شريحة مجهر استخدام المتوسط المتصاعد.
- لتقييم جدوى الخلية، يمكن أن تكون الخلايا المحتضنة لمدة 5 دقائق في 37 درجة مئوية مع PI (5 ميكرومتر في دميم كاملة) وتغسل مرتين مع 2 مل من برنامج تلفزيوني للخلايا 5 دقيقة تبين تلطيخ PI قابلة للتطبيق أقل.
- [كنفوكل] مجهر
- بعد إعداد المجهر، ضع الجانب ساترة إلى أسفل على المسرح المجهر.
- باستخدام البرمجيات، وحدد شعاع ليزر في 543nm لجسم مترافق توصيني-Cy3-
7. خلية "تحليل الجدوى"
- تريبسينيزي وقياس أستروسيتيس باتباع الخطوات 4، 3 و 4-4-
- إضافة 1 × 10 4 خلايا/بئر إلى لوحات 96-جيدا وتنمو لهم إلى كونفلوينسي-
- استخدام المنهجية من الخطوة 5، يعرض لوحات 96-جيدا مثقف إلى أما نورموكسيك ح 1 الجزء أو الجزء 6 س.
- "الاستثمارات بعد" العلاج، نورموكسيك وسائل الإعلام إضافة إلى كافة الخلايا ح 24 وتقاس صلاحية استخدام مقايسة كاشف MTT (تستخدم كالشركة المصنعة ' الإشارة إلى تعليمات s).
- من حل MTT 5 ملغ/مل، إضافة 10% الحجم الإجمالي لكل بئر واحتضانها ح 3 في 37 ˚C مع الكاشف MTT. قم بإزالة الوسائط
- والبلورات باستخدام 200 ميليلتر ثنائي ميثيل سلفوكسيد ريسوسبيند. قراءة اللوحة في جهاز المطياف الضوئي في 570 نانومتر.
ملاحظة: سوف ترتبط امتصاص انخفض بالنسبة إلى الخلايا التحكم بأقل جدوى.
النتائج
أحد الشواغل الرئيسية للثقافة أستروسيتيك الأساسي هو وجود خلايا أخرى مثل oligodendrocytes والخلايا الليفية، الخلايا العصبية وميكروجليا. في الشكل 1، خلايا معزولة من كورتيسيس الفئران كانت التغييرات الوسائط كل 3 أيام وكانت أما غير المعالجة أو المعالجة مع إضافة النظ?...
Discussion
ويصف هذا البروتوكول عزل أستروسيتيس من كورتيسيس الفئران. في هذا الأسلوب، من المهم لتقليل التلوث بأنواع الخلوية الأخرى مثل ميكروجليا، أوليجوديندروسيتيس، والخلايا الليفية. لتقليل عدد microglia، يمكن اتخاذ عدة خطوات: تغيير الإعلام والمداري تهتز، والعلاجات الكيميائية. مجرد تأكيد ثقافة النقاء ا?...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
الكتاب أريد أن أشكر بيرالدي لوبيز باولا للمساعدة التقنية. A.H.M. تشعر بالامتنان للمنح 8G12MD007600 و NS083924 U54 معتمدة من هذا المنشور. ونحن نشكر المعاهد الوطنية للصحة-نيمهد-G12-MD007583 منحة لدعم مرفق. D.E.R.A. تشعر بالامتنان للزمالة المقدمة من نيهنيجمس-R25GM110513. ونحن ممتنون لاستخدام "منطقة الأجهزة المشتركة" ومنح المعونة من الدكتورة بريسيلا سانابريا لاستخدام مرفق التصوير الضوئي للبرنامج ركمي ب G12MD007583. وبالإضافة إلى ذلك، نود أن نشكر خوسيه باديلا لدورة البارز في تصوير وتحرير البروتوكول البصرية.
Materials
| Name | Company | Catalog Number | Comments |
| Instruments for Surgery - Step 1 | |||
| Operating scissor 5.5” | Roboz Company | RS-6812 | Tools used to decapitate the rats. |
| Curved forceps 7” | Roboz Company | RS-5271 | Holds the skin of the rat while the skull is removed. |
| Micro-dissecting scissors 4” | Roboz Company | RS-5882 | Cuts both the skin and skull of the rat. |
| Micro-dissecting forceps 4” angled, fine sharp | Roboz Company | RS-5095 | Holds the skin of the rat while the skull is removed. |
| Micro-dissecting forceps 4” slightly curved 0.8 | Roboz Company | RS-5135 | Tool used to separate cortices. |
| Micro-dissecting tweezers | Roboz Company | RS-4972 | Peels brain meninges. |
| Dissection microscope | Olympus | SZX16 | Important for removing the meninge from the cortices. |
| DMEM Preparation - step 2 | |||
| Dulbecco’s Modified Eagle’s Medium (DMEM) | GibCo. Company | 11995-065 | Supports the growth of cells. |
| Sodium bicarbonate | Sigma-Aldrich Company | S7277 | Supplement for the cell culture media. |
| Fetal bovine serum (FBS) | GibCo. Company | 10437-010 | Serum-supplement for the cell culture. |
| Penicillin-Streptomycin | GibCo. Company | 15140-148 | Inhibits the growth of bacterias in the cell culture. |
| Filter System 1L with 0.22um pore | Corning | 431098 | |
| Astrocyte culture - step 3 | |||
| Serological pipets 5mL | VWR | 89130-896 | To pipette DMEM to containers with cells. |
| Serological pipets 10mL | VWR | 89130-898 | To pipette DMEM to containers with cells. |
| Serological pipets 25mL | VWR | 89130-900 | To pipette DMEM to containers with cells. |
| Centrifuge conical tube 15mL | Santa Cruz Biotechnology | sc-200250 | |
| Safe-lock tube 1.5mL | Eppendorf | 022363204 | |
| Barrier Tips 200 uL | Santa Cruz Biotechnology | sc-201725 | |
| Barrier Tips 1 mL | Santa Cruz Biotechnology | sc-201727 | |
| Biohazard Orange Bag 14 x 19" | VWR | 14220-048 | |
| 60mm petri dishes | Falcon | 351007 | |
| Sterile gauze pads | Honeywell Safety | 89133-086 | |
| Stomacher 80 Biomaster | Sewar Lab System | 030010019 | Triturate the brain tissue. |
| Stomacher 80 Blender Sterile Bags | Sewar Lab System | BA6040 | Sterile bag for the stomacher cell homogenizer. |
| Beaker 400mL | Pyrex | 1000 | |
| Sterile cell dissociation sieve, mesh #60 | Sigma-Aldrich Company | S1020 | To obtain a uniform single cell suspension. |
| Sterile cell dissociation sieve, mesh #100 | Sigma-Aldrich Company | S3895 | To obtain a uniform single cell suspension. |
| Invert phase microscope | Nikon | Eclypse Ti-S | Verify cells for contamination or abnormal cell growth. |
| 75cm2 sterile flasks | Falcon | 353136 | |
| Multi-well plate | Falcon | 353046 | |
| Micro cover glasses (coverslips), 18mm, round | VWR | 48380-046 | |
| Bright-Line hemacytometer | Sigma-Aldrich Company | Z359629 | |
| Pasteur pipettes | Fisher Scientific | 13-678-20D | |
| Ethyl alcohol | Sigma-Aldrich Company | E7023 | |
| L-leucine methyl ester hydrochloride 98% (LME) | Sigma-Aldrich Company | L1002 | Promotes the elimination of microglia cells in the primary cortical astrocyte cultutre. |
| Cytosine β-D-arabinofuranoside (Ara-C) | Sigma-Aldrich Company | C1768 | |
| Poly-D-Lysine Hydrobromide, mol wt 70,000-150,000 | Sigma-Aldrich Company | P0899 | |
| Trypsin/EDTA | GibCo. Company | 15400-054 | |
| Trypan Blue | Sigma-Aldrich Company | T8154 | |
| Phosphate buffer saline (PBS) tablets | Calbiochem | 524650 | |
| Sterile Water | Sigma-Aldrich Company | W3500 | |
| OGD Medium Preparation - step 5 | |||
| Centrifuge conical tube 50 mL | VWR | 89039-658 | |
| Dulbecco’s modified Eagle’s medium-free glucose | Sigma-Aldrich Company | D5030 | Supports the growth of cells. |
| Sodium bicarbonate | Sigma-Aldrich Company | S7277 | Supplement for the cell culture media. |
| Penicillin-Streptomycin | GibCo. Company | 15140-148 | Inhibits the growth of bacterias in the cell culture. |
| 200mM L-glutamine | GibCo. Company | 25030-081 | Amino acid that supplements the growth of cells. |
| Phospahet buffer saline (PBS) tablets | Calbiochem | 524650 | |
| Filter System 50mL with 0.22um pore | Corning | 430320 | |
| Centrifuge conical tube 50 mL | VWR | 89039-658 | |
| Single Flow Meter | Billups-Rothenberg | SMF3001 | Measure gas flow in oxygen purge. |
| Hypoxia Incubator Chamber | StemCell | 27310 | Generates a hypoxic environment for the cell culture. |
| Traceable Dissolved Oxygen Meter | VWR | 21800-022 | |
| 95% N2/ 5% CO2 Gas Mixture | Linde | Purges the environment of oxygen. | |
| primary astrocyte immunofluorescence - step 6 | |||
| Phosphate buffer saline (PBS) tablets | Calbiochem | 524650 | |
| Formaline Solution Neutral Buffer 10% | Sigma-Aldrich | HT501128 | Solution used to fix cells. |
| Methanol | Fisher | A4544 | Solution used to fix cells. |
| Non-ionic surfactant (Triton X-100) | Sigma-Aldrich | T8787 | |
| Fetal bovine serum (FBS) | GibCo. Company | 10437-010 | Serum-supplement for the cell culture. |
| Anti-NeuN | Cell Signaling | 24307 | Detects mature neurons, serves to validate the astrocytic culture. |
| Anti-PCNA | Cell Signaling | 2586 | Detects proliferating cells. |
| Propidium Iodide (PI) | Sigma-Aldrich Company | P4170 | Apoptosis staining. |
| Anti-Olig1 | Abcam | AB68105 | Detects mature oligodendrocytes. |
| Anti-Iba1+ | Wako | 016-20001 | Detects microglial cells. |
| Anti-GFAP Conjugated with Cy3 | Sigma-Aldrich Company | C9205 | Detects reactive astrocytes in the treated cells. |
| Alexa Fluor 488 | Molecular Probe Life Technology | A1101 | Anti-Mouse Secondary Antibody |
| Alexa Fluor 555 | Molecular Probe Life Technology | A21428 | Anti-Rabbit Secondary Antibody |
| 4’,6’-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich Company | D9542 | Nuclear staining |
| Confocal microscope | Olympus |
References
- Goldstein, L. B., Bertels, C., Davis, J. N. Interrater reliability of the NIH stroke scale. Arch Neurol. 46 (6), 660-662 (1989).
- Hinkle, J. L., Guanci, M. M. Acute ischemic stroke review. J Neurosci Nurs. 39 (5), 285-293 (2007).
- Kassner, A., Merali, Z. Assessment of Blood-Brain Barrier Disruption in Stroke. Stroke. 46 (11), 3310-3315 (2015).
- Moskowitz, M. A., Lo, E. H., Iadecola, C. The science of stroke: mechanisms in search of treatments. Neuron. 67 (2), 181-198 (2010).
- Ben Haim, L., Carrillo-de Sauvage, M. A., Ceyzeriat, K., Escartin, C. Elusive roles for reactive astrocytes in neurodegenerative diseases. Front Cell Neurosci. 9, 278 (2015).
- Broderick, J., et al. Guidelines for the Management of Spontaneous Intracerebral Hemorrhage in Adults 2007 Update: A Guideline From the American Heart Association/American Stroke Association Stroke Council, High Blood Pressure Research Council, and the Quality of Care and Outcomes in Research Interdisciplinary Working Group: The American Academy of Neurology affirms the value of this guideline as an educational tool for neurologists. Stroke. 38 (6), 2001-2023 (2007).
- Wang, R., et al. Oxygen-glucose deprivation induced glial scar-like change in astrocytes. PLoS One. 7 (5), e37574 (2012).
- Sofroniew, M. V. Reactive astrocytes in neural repair and protection. The Neuroscientist. 11 (5), 400-407 (2005).
- Sofroniew, M. V., Vinters, H. V. Astrocytes: biology and pathology. Acta neuropathologica. 119 (1), 7-35 (2010).
- Souza, D. G., Bellaver, B., Souza, D. O., Quincozes-Santos, A. Characterization of adult rat astrocyte cultures. PLoS One. 8 (3), e60282 (2013).
- Puschmann, T. B., et al. HB-EGF affects astrocyte morphology, proliferation, differentiation, and the expression of intermediate filament proteins. J Neurochem. 128 (6), 878-889 (2014).
- Robinson, C., Apgar, C., Shapiro, L. A. Astrocyte Hypertrophy Contributes to Aberrant Neurogenesis after Traumatic Brain Injury. Neural Plast. , 1347987 (2016).
- Brekke, E., Berger, H. R., Wideroe, M., Sonnewald, U., Morken, T. S. Glucose and Intermediary Metabolism and Astrocyte-Neuron Interactions Following Neonatal Hypoxia-Ischemia in Rat. Neurochem Res. , (2016).
- Cekanaviciute, E., et al. Astrocytic transforming growth factor-beta signaling reduces subacute neuroinflammation after stroke in mice. Glia. 62 (8), 1227-1240 (2014).
- Zhu, Z., et al. Inhibiting cell cycle progression reduces reactive astrogliosis initiated by scratch injury in vitro and by cerebral ischemia in vivo. Glia. 55 (5), 546-558 (2007).
- Bovolenta, P., Wandosell, F., Nieto-Sampedro, M. Neurite outgrowth over resting and reactive astrocytes. Restor Neurol Neurosci. 2 (4), 221-228 (1991).
- Anderson, M. A., et al. Astrocyte scar formation aids central nervous system axon regeneration. Nature. 532 (7598), 195-200 (2016).
- Hao, C., Richardson, A., Fedoroff, S. Macrophage-like cells originate from neuroepithelium in culture: characterization and properties of the macrophage-like cells. Int J Dev Neurosci. 9 (1), 1-14 (1991).
- Saura, J. Microglial cells in astroglial cultures: a cautionary note. J Neuroinflammation. 4, 26 (2007).
- Giulian, D., Baker, T. J. Characterization of ameboid microglia isolated from developing mammalian brain. J Neurosci. 6 (8), 2163-2178 (1986).
- Schildge, S., Bohrer, C., Beck, K., Schachtrup, C. Isolation and culture of mouse cortical astrocytes. J Vis Exp. (71), (2013).
- Armstrong, R. C. Isolation and characterization of immature oligodendrocyte lineage cells. Methods. 16 (3), 282-292 (1998).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85 (3), 890-902 (1980).
- Pont-Lezica, L., Colasse, S., Bessis, A. Depletion of microglia from primary cellular cultures. Methods Mol Biol. 1041, 55-61 (2013).
- Svensson, M., Aldskogius, H. Synaptic density of axotomized hypoglossal motorneurons following pharmacological blockade of the microglial cell proliferation. Exp Neurol. 120 (1), 123-131 (1993).
- Wong, V. K., Shapourifar-Tehrani, S., Kitada, S., Choo, P. H., Lee, D. A. Inhibition of rabbit ocular fibroblast proliferation by 5-fluorouracil and cytosine arabinoside. J Ocul Pharmacol. 7 (1), 27-39 (1991).
- Nakatsuji, Y., Miller, R. H. Density dependent modulation of cell cycle protein expression in astrocytes. J Neurosci Res. 66 (3), 487-496 (2001).
- Reeves, J. P. Accumulation of amino acids by lysosomes incubated with amino acid methyl esters. J Biol Chem. 254 (18), 8914-8921 (1979).
- Thiele, D. L., Kurosaka, M., Lipsky, P. E. Phenotype of the accessory cell necessary for mitogen-stimulated T and B cell responses in human peripheral blood: delineation by its sensitivity to the lysosomotropic agent, L-leucine methyl ester. J Immunol. 131 (5), 2282-2290 (1983).
- Hamby, M. E., Uliasz, T. F., Hewett, S. J., Hewett, J. A. Characterization of an improved procedure for the removal of microglia from confluent monolayers of primary astrocytes. J Neurosci Methods. 150 (1), 128-137 (2006).
- Corvalan, V., Cole, R., de Vellis, J., Hagiwara, S. Neuronal modulation of calcium channel activity in cultured rat astrocytes. Proc Natl Acad Sci U S A. 87 (11), 4345-4348 (1990).
- Butler, I. B., Schoonen, M. A., Rickard, D. T. Removal of dissolved oxygen from water: A comparison of four common techniques. Talanta. 41 (2), 211-215 (1994).
- Tasca, C. I., Dal-Cim, T., Cimarosti, H. In vitro oxygen-glucose deprivation to study ischemic cell death. Methods Mol Biol. 1254, 197-210 (2015).
- Wu, D., Yotnda, P. Induction and testing of hypoxia in cell culture. J Vis Exp. (54), (2011).
- Rivera-Aponte, D., et al. Hyperglycemia reduces functional expression of astrocytic Kir4. 1 channels and glial glutamate uptake. Neuroscience. 310, 216-223 (2015).
- Berger, R., Garnier, Y., Pfeiffer, D., Jensen, A. Lipopolysaccharides do not alter metabolic disturbances in hippocampal slices of fetal guinea pigs after oxygen-glucose deprivation. Pediatric research. 48 (4), 531-535 (2000).
- Anderson, T. R., Jarvis, C. R., Biedermann, A. J., Molnar, C., Andrew, R. D. Blocking the anoxic depolarization protects without functional compromise following simulated stroke in cortical brain slices. Journal of neurophysiology. 93 (2), 963-979 (2005).
- Jarvis, C. R., Anderson, T. R., Andrew, R. D. Anoxic depolarization mediates acute damage independent of glutamate in neocortical brain slices. Cerebral Cortex. 11 (3), 249-259 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved