Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Überwachung der Astrozyten Reaktivität und Proliferation in Vitro unter ischämischen-ähnlichen Bedingungen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Ischämischen Schlaganfall ist schwer zu lernen ist ein komplexer Vorgang, in dem der spezifische Beitrag der Astrozyten, die betroffene Hirnregion Glukose Sauerstoffmangel (OGD) ausgesetzt. Dieser Artikel stellt eine Methode zur isolierte Astrozyten zu erhalten und ihre Reaktivität und Verbreitung unter OGD Bedingungen zu studieren.
Zusammenfassung
Ischämischen Schlaganfall ist eine komplexe-Hirn-Trauma durch einen Thrombus oder Lungenembolie behindern Blutfluss in Teilen des Gehirns verursacht. Dies führt zur Entziehung von Sauerstoff und Glukose, die Energie Versagen und neuronalen Tod verursacht. Nach eine Beleidigung des ischämischen Schlaganfalls Astrozyten werden reaktive und vermehren sich um die Verletzung Aufstellungsort, wie es sich entwickelt. In diesem Szenario ist es schwierig, den spezifischen Beitrag der Astrozyten, die Region des Gehirns ausgesetzt Ischämie zu studieren. Dieser Artikel stellt daher eine Methode zur primären Astrozyten Reaktivität und Verbreitung unter einem in Vitro Modell einer Ischämie-ähnlichen Umgebung, genannt Glukose Sauerstoffmangel (OGD) zu studieren. Astrozyten wurden isoliert von 1-4 Tage-alten Neugeborenen Ratten und die Anzahl der unspezifischen astrocytic Zellen wurde anhand Astrozyten selektive Marker Glial Fibrillary sauren Protein (GFAP) und nukleare Färbung. Der Zeitraum, in dem Astrozyten OGD Zustand ausgesetzt sind, sowie der Sauerstoffgehalt anpassbar, denen sie ausgesetzt sind. Diese Flexibilität ermöglicht es Wissenschaftlern, die Dauer der ischämischen-ähnlichen Zustand in verschiedene Gruppen von Zellen in Vitrozu charakterisieren. Dieser Artikel beschreibt die Zeitrahmen von OGD, die Astrozyten Reaktivität, hypertrophe Morphologie und Verbreitung gemessen durch Immunfluoreszenz mit wuchernden Cell Nuclear Antigen (PCNA) induzieren. Neben der Verbreitung Astrozyten Energie- und oxidativen Stress zu unterziehen, und reagieren auf OGD durch Loslassen lösliche Faktoren in der Zelle-Medium. Dieses Medium kann gesammelt und verwendet, um die Auswirkungen von Molekülen veröffentlicht von Astrozyten im neuronalen Primärkulturen ohne Zell-Zell-Interaktion zu analysieren. Zusammenfassend lässt sich sagen diese Primärzelle Kulturmodells effizient einsetzbar zu verstehen, die Rolle der isolierten Astrozyten auf Verletzungen.
Einleitung
Schlaganfall ist definiert als "eine akute neurologische Dysfunktion vaskulären Ursprungs mit plötzlichen oder schnelle Entwicklung der Symptome und Zeichen, entsprechend der Beteiligung der Schwerpunkte im Gehirn"1,2. Es gibt zwei Arten von Schlaganfällen: ischämische und hämorrhagische. Wenn vaskuläre Dysfunktion verursacht wird, entweder durch ein Aneurysma oder eine arteriovenöse Fehlfunktion, begleitet durch eine Schwächung mit hinteren Ruptur einer Arterie ist dies hämorrhagischer Schlaganfall3 bezeichnet, die in den meisten Fällen zum Tod führt. Wenn ein Thrombus oder eine Lungenembolie Blutfluss behindert, verursacht eine vorübergehende Entziehung von Sauerstoff und Glukose zu einer Region des Gehirns, ischämischen Schlaganfall4heißt es. Bei Nichtbeachtung nähren Zellen um das betroffene Gebiet oder ischämischen Kern führt zu eine homöostatische und metabolische Ungleichgewicht, energetische Dysfunktion, neuronalen Tod und Entzündung5, die eine lebenslange Behinderung für Patienten6auslösen können.
Ischämischen Schlaganfall ist eine multifaktorielle Verletzungen, an denen verschiedene Arten von Zellen, die reagieren und üben ihre Wirkungen zu unterschiedlichen Zeitpunkten. Viele Interaktionen erstellen ein schwierigen Umfelds um das Verhalten einzelner Zellen untersuchen. Also, wie wir den Beitrag von einem bestimmten Zelltyp unter einem komplexen Umfeld zu studieren? Eine anerkannter in-vitro- Modell der Ischämie besteht aus auszusetzen Zellen Sauerstoff und Glukose Deprivation (OGD), für einen bestimmten Zeitraum, gefolgt von der Wiederherstellung der Zellen zu einer inklusieve Umgebung. Dieses System simuliert einen ischämischen Schlaganfall gefolgt von Blut Reperfusion. Bei dieser Methode sind Zellen oder Geweben eine Glukose-freie Medien in einem Umfeld von Sauerstoff, mit einer spezialisierten hypoxischen Kammer gesäubert ausgesetzt. Die OGD Inkubationszeit variiert von wenigen Minuten bis zu 24 Stunden, abhängig von der Hypothese, die getestet werden will. Studien haben gezeigt, dass je nach den Zeiten der OGD und inklusieve Umwelt, bestimmten Phänotypen eines Schlaganfalls (d.h.akute oder subchronische) erreicht werden. Primäre isolierte Astrozyten, OGD mit hinteren Restaurierung inklusieve Bedingungen ausgesetzt ist ein gut untersuchten zellulären Modell, Schlaganfall in-vitro-7zu imitieren. OGD ist möglich, die unabhängige molekularen Mechanismen der isolierten Zellen unter einem Schlaganfall-ähnliche Umgebung zu offenbaren.
Mit zunehmender unser Wissen der Astrozyten Biologie deutlich geworden, dass sie entscheidend für die Aufrechterhaltung der Synapsen und Aufrechterhaltung neuronaler Plastizität, Reparatur und Entwicklung8sind. Unter normalen Bedingungen Astrozyten freizugeben und reagieren auf Zytokine, Chemokine, Wachstumsfaktoren und Gliotransmitters, metabolic-Balance und Homöostase innerhalb von Synapsen5,9zu halten. In akuten Neuroinflammation, wie ischämischen Schlaganfall können diese Zellen reaktive werden, zeigen eine langfristige Überexpression des Glial Fibrillary sauren Protein (GFAP) und zeigen Hypertrophie in ihrer Morphologie5,10, 11 , 12. wie der ischämischen Infarkt entwickelt, die Homöostase von Astrozyten bereitgestellt wird betroffen, bei normalen Glutamat-Aufnahme, Energiestoffwechsel, Austausch von aktiven Molekülen und antioxidative Aktivität13.
Reaktivierte Astrozyten vermehren um das Infarkt-Gewebe während Leukozyten in Richtung der lesioned Bereich14migrieren. Astrocytic Verbreitung kann mit Hilfe von Markern wie wuchernden Cell nuclear Antigen (PCNA), Ki67 und Bromodeoxyuridine (BrdU)15gemessen werden. Diese proliferative Reaktion wird in einer zeitabhängigen Weise erzeugt und es hilft bilden die glial Narbe, ein Array von irreversibel reaktive Astrocyten entlang das Parenchym der beschädigten Seite nach einer Verletzung-9. Eine der ersten Funktionen dieser Narbe ist die Immunzelle Extravasation aus diesem Bereich zu begrenzen. Studien haben jedoch gezeigt, dass die Narbe ein physisches Hindernis für Axone wird zu erweitern, wie sie release-Moleküle axonale Wachstum hemmen, und erstellen Sie eine physische Barriere, die verhindert, dass Axone erweitern um den verletzten Bereich16. Dennoch gibt es wissenschaftliche Beweise dafür, dass nach einer Rückenmarksverletzung ganz glialen Narbenbildung zu vermeiden die Regeneration der Axone17beeinträchtigen kann. So, der Kontext, in der die spezifischen astrocytic Reaktion gemessen wird, muss auf dem Rahmen der Verletzung studierte berücksichtigt werden.
Die vorgestellte Methode kann angewendet werden, um die individuelle Funktion der Astrozyten nach Glukose Sauerstoffmangel zu untersuchen und es kann geändert werden, je nach Fragestellung, die der Prüfer beantworten will. Z. B. neben der morphologischen Veränderungen und die Marker OGD zeitversetzt zum Ausdruck gebracht, die Überstände von Astrozyten OGD ausgesetzt können analysiert werden, weiter um lösliche Faktoren von diesen Zellen freigegeben wird, oder als konditionierten Medium zur Beurteilung zu identifizieren sein Wirkung in anderen Gehirnzellen. Dieser Ansatz ermöglicht Untersuchungen zur Reaktivität von Astrozyten, die die Aufklärung der Faktoren führen könnte, die Regeln und modulieren ihre Antwort in einem Szenario mit ischämischen Schlaganfall.
Protokoll
postnatale Ratten (Sprague-Dawley) 1-4 Tage alt werden verwendet, um die Rinde zu isolieren. Die Methode der Euthanasie ist Enthauptung, wie von NIH Richtlinien genehmigt.
1. Vorbereitung der Instrumente und Materialien für Chirurgie
- Instrumente der Sterilisation in einem Autoklaven (Temperatur: 121 ° c, Druck: 15 Psi, Zeit: 30 Minuten) mit einem Stahlkasten oder Abdichtung Sterilisation Beutel sofort. Materialien in der Tabelle der Materialien zu sehen.
2. Füllen Sie DMEM Vorbereitung
- In einer 1 Liter-Becher mit 700 mL autoklaviert Wasser, fügen Sie hinzu Dulbecco ' s Modified Eagle ' s mittlere Pulver bei Raumtemperatur.
- 3,7 g/L Natriumbicarbonat, hinzufügen, während die Lösung mit einem Magnetrührer gerührt ist.
- Anpassen der pH-Wert 7,4 mit autoklaviert Wasser bringen Volumen bis zu 1 L, dann filtern. Zwecken der Kultur ergänzen die gewünschte Lautstärke von Medien mit 10 % FBS und 1 % Penicillin/Streptomycin und Warm bei 37 ° c. Materialien in der Tabelle der Materialien zu sehen.
Hinweis: Der pH-Wert wurde auf 7,4 über einfügen die pH-Meter-Elektrode in den Medien eingestellt. Die Medien müssen unter Rühren, langsam fügen Sie 1 M NaOH mit einer Pipette.
3. Astrozyten Primärkultur
Hinweis: Zelle Medien müssen nach der Aussaat, alle drei Tage gewechselt und die Zellen bis zur Konfluenz (11-13 Tage) angebaut werden können. Am dritten Tag, tippen Sie auf die Flasche mehrmals zu Aufzug Microglial Zellen und Oligodendrozyt Vorläuferzellen aus der Kultur, entfernen Sie alle die ' alten ' Medien, waschen zweimal mit 10 mL PBS, Aspirieren der PBS, dann frische neue Medien hinzufügen. Materialien in der Tabelle der Materialien zu sehen.
- Dissektion des Neugeborenen Rattengehirn
- führen die Zerlegung in einer Gewebekultur-Haube. Erhalten Sie 1-4 Tage alten Neugeborenen Ratten Welpen (2 Ratte Gehirn pro 75 cm 2 Kolben verwendet werden).
- Bereiten drei 60 mm Petrischalen und komplette DMEM auf jeweils 5 mL pipette.
Hinweis: Sie können wie folgt unterteilt werden: #1 für jede Ratte Gehirn, #2 für den Cortex des Gehirns und #3 für die geschälte Rinde (ohne Hirnhaut). - Fassen die Pup und Spray mit 70 % Ethanol. Enthaupten sie und entsorgen Sie den Körper in einem kleinen Biohazard Abfallbehälter.
- Mit der Mikro-sezieren Pinzette, halten Sie den Kopf und schneiden Sie die Haut auf dem Kopf des Schädels aussetzen.
- Mit einem anderen Schere, machen eine " T " Einschnitt ausgehend von der Rückseite des Schädels in Richtung Nase. Verwenden Sie eine Zange, entfernen vorsichtig den Schädel.
- Der exponierten Gehirn mit einer Pinzette entfernen und setzen Sie das Gehirn in einem der zuvor mit Medium gefüllt Petrischalen.
- Verwenden Sie einen anderen Satz von sterilen Instrumenten für die nachfolgenden Schritte.
- Verwenden Mikro sezieren Zange vorsichtig ein Gehirn auf den umgekehrten Deckel einer 60 mm Petrischale platzieren. Wenn die Petrischale auf sterile Gaze gelegt wird, ist es möglich, das Gehirn klar zu sehen und es ist einfacher, sezieren.
- Stabilisieren das Gehirn mit Mikro-sezieren Zangen und trennen die zerebrale Hemisphäre durch sanft Hänseleien entlang der Mittellinie Fissur mit dem scharfen Ende der Zange Micro sezieren.
- Lenken und schälen die Rinde, so dass hinter der weißen Substanz, und übertragen Sie sie auf einer Petrischale, vorher mit der Bezeichnung #2. Wiederholen Sie den Vorgang für alle Gehirne, kombinieren die seziert Cortex in der Petrischale mit der Bezeichnung #2.
- Im Hippocampus von unterhalb jedes Kortex herausnehmen und entsorgen Sie it.
- Der Mikro-sezieren Pinzette und ein Petri-60 mm verwenden, um die Hirnhaut aus den einzelnen kortikalen Lappen vorsichtig schälen, und legen Sie sie in der Petrischale mit der Bezeichnung #3.
- Gewebe Dissoziation: Homogenisator Mixer Methode
- Gewebe/Medium Aussetzung (geschälte Rinde des Gehirns) in die sterile Mixer Tasche gießen und fügen Sie genügend Mittel um das Gesamtvolumen im Beutel zu 5 mL.
- Legen Sie den Beutel in den Homogenisator Mixer, so dass ca. 2 cm der Tasche über der geschlossenen Tür sichtbar. Die Zelle Dissoziation erfolgt während 2,5 min mit hoher Geschwindigkeit.
Hinweis: Alternativ kann dies durch das Schließen der Tasche und klopfte es sanft mit einem Becher in der Kapuze. Achten Sie darauf, ein Tuch zwischen Beutel und Becher verwenden, um Reibung zu vermeiden. - Die Zellsuspension in eine Zahl 60 Sieb gießen und gießen Sie dann die gefilterten Durchströmung auf die Nummer 100 Sieb, so dass es zu filtern, durch die Schwerkraft.
- Verwendung von 15 mL Röhrchen Zentrifugieren die Zellsuspension bei 200 X g in einer klinischen Zentrifuge (vorzugsweise Schaukel Eimer Rotor) für 5 min.
- Der Überstand in ein Becherglas abgießen, dann wieder auszusetzen und distanzieren das Pellet von Zellen in maximal 5 mL der Medien mit einer serologischen Pipette,.
- Zellzählung
- mit einer Mikropipette sammeln 100 µL Zellsuspension in einem 1,5 mL Microcentrifuge Schlauch und fügen Trypan Blau 100 µL.
- 10 µL der gesammelten Suspension in die Hemocytometer einfügen und zählt alle Zellen, die in den vier Ecken des Quadrats entwicklungsfähig sind.
- Die Formeln für die Berechnung der Dichte der Zellen vor der Zubereitung der Fläschchen sind:
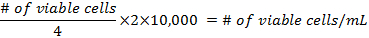
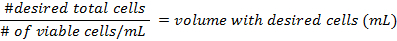
- mindestens 500.000 Zellen pro 25 cm 2 Kolben hinzufügen. Pipette bis zu 5 mL DMEM in jedem Kolben. Die Mischung sollte nicht den Hals der Flasche erreicht. Legen Sie sie in einem 37 ° C Inkubator an 5 % CO 2, 3 Tage, dann wechseln Sie das Medium.
- Astrozyten Reinigungstechniken: Medienwechsel, mechanische und chemische Strategien
Hinweis: die metabolische Rate der Astrozyten ist hoch im Vergleich zu anderen Zelltypen, daher in ernährungsphysiologisch Bedingungen, beraubt, diese Zellen zeigen geringe Überlebensraten nach ein paar Tagen. Im Gegensatz zu Astrozyten Mikroglia ernährungsphysiologischen Mangel nicht betroffen sind und vermehren sich in solchen Umgebungen 18. Um eine reduzierte Anzahl von Mikroglia-Zellen zu erhalten, ändern die Autoren die Astroglial Zellkulturmedien alle 3 Tage. Diese konstante Änderung in Zelle Medien wird auch die Mikroglia Bevölkerung verringern, die auf der Oberseite der astrocytic Zelle Monolayer in die Küvette 19 wachsen können.- Verwendung einer Pasteur Pipette zu aspirieren Sie die Medien mit nicht-anhaftende Microglial Zellen aus dem Fläschchen. Wash jeglichen Schmutz links hinter der Verwendung steril filtriert PBS zu jedem der den Kolben in gewissem Sinne tropfenweise (5 mL/Flasche).
- Steril filtriert DMEM (mit antibiotischen und fötalen Rinderserum) tropfenweise hinzufügen, jede Flasche (5 mL/Flasche). Sanft in kreisenden Bewegungen auf die gesamte Oberfläche agitieren.
- Ortszellen in einem 37 ° C Inkubator an 5 % CO 2 für 8-10 Tage bis die Kolben Konfluenz erreichen (> 95 % Plattenabdeckung).
Hinweis: Einige Protokolle haben gezeigt, dass wenn Astrozyten Konfluenz erreichen, mechanische Methoden, z. B. schütteln die Kultur von 2 bis 24 h, führt zu die Ablösung der Zellen, die auf diese Astrozyten, hauptsächlich Mikroglia und Vorläufer Zellen liegen 19 , 20. - Non-astrocytic Zellen werden in der Kultur durch Durchführung von orbital Schütteln bei 180 u/min für 30 min reduziert. Nach dem Entfernen von Zellen im Überstand, ist frische Medien in die Flasche (~ 15 mL) pipettiert.
- , Die Oligodendrozyt Vorläuferzellen zu beseitigen schütteln Geschwindigkeit bis 200 u/min für 6 h 21 , 22 , 23, Aspirat überstand und Pipettieren frische Medien erhöhen.
Hinweis: Um das Vorhandensein von Mikroglia in den Kulturen zu verringern, können zwei chemischen Methoden nacheinander verwendet werden (nicht gleichzeitig) in der Primärzelle Kultur Methodik: Arabinose Cytosin (Ara-C) und L-Leucin Methyl Ester (LME) 24. - Sofort, wenn Zellen Konfluenz (100 %) erreichen, 3-4 Tage nach der mechanischen Entfernung der Mikroglia, diese Zellen können mit behandelt werden 8 µM antimitotic zusammengesetzte Arabinose Cytosin (Ara-C) in DMEM für 5 Tage (Wechsel täglich frische Ara-c in DMEM).
Hinweis: Der Zeitpunkt, Ara-C hinzuzufügen ist kritisch, da diese Verbindung ist ein antimitotic Medikament, das reduziert die Anzahl der sich schnell teilenden Zellen wie Mikroglia 19 , 25 und Fibroblasten 26 . Im Gegensatz zu Mikroglia, wenn konfluierende, Astrozyten stoppen wuchern über Kontakt Hemmung 27. - 2 Tage für Zellen von Ara-C-Behandlung erholen lassen.
- Zur weiteren Verringerung die Mikroglia Kontamination nach Konfluenz, Zellen zu erreichen verwenden Sie 50 mM von L-Leucin Methylester (LME) in DMEM behoben bei pH 7,4, für 1 h bei 37 ° c.
Hinweis: LME durchquert die Membran von Zellen und Organellen und das L-Leucin produziert nach hydrolysiert werden, sammelt sich in den Lysosomen dieser Zellen. Die Anhäufung dieser Aminosäure führt zu einer osmotischen Schwellung und Bruch der Lysosomen 28 , 29. LME ist sehr effektiv bei der Beseitigung der Mikroglia, im Vergleich zu anderen Zellen 20 , 30.
4. Anbau von Astrozyten im 6-Well-Platten
- Beschichtung Deckgläsern mit Poly-D-Lysin
- Put ein Deckglas in jedem 35 mm Petrischale dann hinzufügen 100 µL der verdünnten Poly-D-Lysin-Lösung für jedes Deckglas und warten 1H.
- Die Poly-D-Lysin zu entfernen und waschen zweimal mit 2 mL sterilem Wasser.
- Wasser entfernen und warten auf Deckgläsern im Inneren der Haube zu trocknen. Speichern der Deckgläsern bei-20 ° C bis zu zwei Wochen.
Hinweis: Die verdünnte Lösung von Poly-D-Lysin Einfrieren; Es kann bis zu zwei Wochen gelagert werden.
- Trypsinization
- mit einer Pasteurpipette aspirieren Sie das Medium aus den Kolben. Hinzufügen von 5 mL/Flasche steril filtriert PBS, die Zellen sanft spülen.
- Aspirat aus der PBS und fügen Sie dann 5 mL/Flasche steril filtriert 0,25 % Trypsin und 0,5 mM EDTA Lösung. Legen Sie die Flasche in die 37 ° c, 5 % CO 2 Inkubator für 10 min.
Hinweis: Während die Zellen Inkubation sind, warm 5 mL/Flasche mit frischen komplette DMEM bei 37 ° c - Nach 10 min Inkubation, schütteln, um sicherzustellen, dass alle Zellen aus der Küvette gehoben werden. Jede Flasche, die Trypsin zu neutralisieren schnell die 5 mL warme komplette DMEM hinzufügen.
- Pipette vorsichtig die Zellen nach oben und unten mehrmals zu brechen alle " Klumpen ". Übertragen von suspendierten Zellen aus zwei Kolben zu einem konischen Zentrifugenröhrchen 15 mL.
- Zentrifuge für 5 min bei 200 X g Zelle Pellet zu sammeln. Wieder auszusetzen das Pellet in 500 µL Medium und fahren Sie mit Zellen in den Flaschen platzieren.
Hinweis: Beispiele für Analysen mit Zellen gebildet werden: 1) Reverse Transkription Polymerase-Kettenreaktion (RT-PCR) zur Analyse der Genexpression; (2) Western-Blot, Protein-Expression zu bewerten; (3) Flow-Zytometrie-Analyse, die Anzahl der neuronalen Vorläuferzellen und interessierender Proteine zu quantifizieren; (4) Immunfluoreszenz, Protein-Expression und Lokalisation analysieren.
- Aussaat Astrozyten
- nach der Behandlung der primären Astrocyten mit Trypsin (siehe 4.2), sammeln 100 μl Zellsuspension in einem 1,5 mL Microcentrifuge Schlauch und fügen 100 μL von 0,5 % Trypan blau.
- Fügen Sie 10 μL der gesammelten Suspension in Trypan blau auf der Hemocytometer und zählt alle Zellen, die entwicklungsfähig sind.
- Verwenden Sie die Formeln zur Berechnung der Dichte der Zellen vor der Zubereitung der Fläschchen im Schritt 3.3.
- Vorbereitung der Multi-Brunnen Gerichte durch Hinzufügen eines sterilen, beschichtete Poly-D-Lysin Deckglas in jede Vertiefung. Pipette die 50.000 Zellen und füllen den Rest des Bandes in jedem Multi-gut Gericht mit frischem Medium (ca. 2 mL).
- Legen Sie die Multi-gut Speisen in der 37 ˚C Inkubator an 5 % CO 2, nach 5-7 Tagen, Astrozyten können wachsen und die gesamte Oberfläche von der Deckgläsern.
5. OGD Protokoll für primäre Astrozyten
- mittlerer Vorbereitung OGD
- Ergänzung Dulbecco ' s geändert Eagle ' s Medium-freie Glukose mit Natriumbicarbonat 3,7 g/L und 1 % Penicillin/Streptomycin. Finden Sie unter Materialien in Tabelle 4.
- Bereinigen 20 mL des Mediums Glukose frei von sprudelnden mit 95 % N 2 / 5 % CO 2 für 10 min bei einen Durchfluss von 15 L/min (angegeben mit dem Durchflussmesser) durch Einfügen einer serologischen Pipette an der Gasanlage in das Medium.
Hinweis: Nach dem Spülen des Mediums Sauerstoff, anpassen den pH-Wert bei 7,4 (siehe Schritt 2.1 vermerken). - Filtern die gelöschten Glukose-freie Medium mit einem 50 mL Tube-Filter-System.
Hinweis: Machen frische OGD-Medium für jedes Experiment, sprudelt mit 95 % N 2 / 5 % CO 2 bevor Sie verwenden, um sicherzustellen, dass die Zellen einer Umgebung bereinigt Sauerstoff ausgesetzt sind.
- Versuchsdurchführung
- in der Gewebekultur Kapuze, Astrozyten Medien aus vorbereiteten Deckgläsern (siehe Schritt 4.3.5) entfernen und waschen mit zellulären PBS zweimal, Glukose in die Zellen zu entfernen.
- Add 2 mL der OGD Medien zu jedem gut und legen Sie die Multi-gut Speisen in der Hypoxie Kammer mit ihren Deckeln off
- Das Gasgemisch an das Ventil Eingang anschließen und die Ausfahrt Ventil offen lassen. Spülen Sie die Kammer mit dem Gasgemisch von 95 % N 2 / 5 % CO 2, bei 15 L/min für 5 min.
- Den Gasstrom zu stoppen und zuerst schließen Sie die Klemme am Ausgang Ventil, dann schließen Sie die Klemme am Gas Eingang Ventil Schlauch.
Hinweis: Sicherzustellen Sie, dass kein Gasaustritt durch Abdecken der Dichtung der Kammer mit Wasser und Seife. Wenn die Dichtung nicht sicher ist, sollte keine Luftblasen bilden. - Legen Sie die ganze Kammer in der Zelle-Kultur-Inkubator bei 37 ° C für 1 h oder 6 h in OGD.
- Nach Inkubationszeit vorbei, Aspirieren OGD-Medien und sorgfältig verarbeiten Pipettieren 2 mL des kompletten DMEM jedes 4,67 cm 2 auch für die inklusieve 24 h.
6. Protokoll für primäre Astrozyten Immunfluoreszenz Vorbereitung
Hinweis: um Astrozyten Reinheit zu beurteilen, verschiedenen Zelltypen wie Neuronen, Mikroglia und Oligodendrozyten durch nachgewiesen werden können Immunfluoreszenz mit verschiedenen Zell-Markern. Proliferationsmarker PCNA und Propidium Jodid (PI) einsetzbar auf primäre Astrozyten OGD gefolgt von inklusieve Bedingungen ausgesetzt. Materialien in der Tabelle der Materialien zu sehen.
- Immunfluoreszenz Vorbereitung
Hinweis: Dies ist eine allgemeine Immunfluoreszenz-Protokoll, geringfügige Änderungen können durchgeführt werden, um ein optimales Signal (z.B., längere Inkubationszeiten zu erreichen Inkubationstemperatur). Jeder Marker aus Tabelle 1 nach Angaben des Herstellers verwendet werden ' s-Protokoll.- Auszuwertende Zellviabilität, Zellen inkubiert werden können, für 5 min bei 37 ° C mit PI (5 µM im kompletten DMEM) und zweimal mit 2 mL PBS waschen, für mind. 5 Zellen, die PI Färbung zeigen weniger rentabel sind.
Hinweis: Verwendung der Zellen im Schritt 5.2.6 behandelt. - Zellen nach PI Färbung, beheben fügen 2 mL 4 % Formalin pro 4,67 cm 2 gut, für 20 min bei 4 ° c. Für Proben mit PCNA gekennzeichnet, ist die bevorzugte Festlegunglösung Methanol für 10 min bei 4 ° c.
Vorsicht: Formalin und Methanol giftig sind.
Hinweis: Überprüfen Sie immer spezifischer Antikörper Protokolle aus den einzelnen Unternehmen. - Zellen mit 2 mL PBS für 5 min waschen und wiederholen Sie diesen Schritt 3 Mal.
- Zellen blockieren Lösung inkubieren (0,5 % nicht-ionische Tenside, 10 % FBS mit PBS-Puffer) für 30 min bei Raumtemperatur mit sanft schütteln.
- Der Zellen mit 2 mL PBS für 5 min waschen, waschen 3 Mal wiederholen.
- Bei 4 ° C über Nacht (16 h), mit primären Antikörper (PCNA, GFAP) in einer Lösung von 1 % inkubieren FBS in PBS.
- Entfernen Sie die primären Antikörper-Lösung, die Zellen mit 2 mL PBS für 5 min waschen und wiederholen Sie diesen Schritt 3 Mal.
- Inkubation mit Sekundärantikörpers konjugiert mit Fluorophor in einer Lösung von 1 % FBS mit PBS-Puffer für 1 h bei Raumtemperatur.
- Waschen der Zellen mit 2 mL PBS für 5 min, wiederholen Sie diesen Schritt 3 Mal. Fügen Sie 1 µg/mL DAPI (4 ', 6 ' - Diamidino - 2-Phenylindole) für 5 min, Zellkerne zu beflecken.
- Zellen mit 2 mL PBS 5 min waschen, wiederholen Sie diesen Schritt zweimal und halten in PBS.
- Bereiten die Deckgläsern auf einen Objektträger mit Eindeckmedium.
- Auszuwertende Zellviabilität, Zellen inkubiert werden können, für 5 min bei 37 ° C mit PI (5 µM im kompletten DMEM) und zweimal mit 2 mL PBS waschen, für mind. 5 Zellen, die PI Färbung zeigen weniger rentabel sind.
- Confocal Mikroskop
- nach dem Einrichten des Mikroskops, legen die Deckglas Seite nach unten auf den Mikroskoptisch.
- Mit der Software, wählen Sie einen Laserstrahl auf 543nm für GFAP-Cy3 konjugierten Antikörper.
7. Handy-Lebensfähigkeit Assay
- Trypsinize und Quantifizierung der Astrozyten durch folgende Schritte 4.3 und 4.4.
- Fügen Sie 1 x 10 4 Zellen/Well, 96-Well Platten und wachsen sie zu Konfluenz.
- Mit der Methodik von Schritt 5, kultivierte 96-Well-Platten, entweder inklusieve 1 h OGD aussetzen oder 6 h OGD.
- Nach OGD Behandlung, inklusieve Medien werden hinzugefügt, um alle Zellen für 24 h und Lebensfähigkeit wird mittels MTT-Reagenz-Assay gemessen (nutzen Sie als Hersteller ' s Angaben hervorgehen).
- Von 5 mg/mL MTT Lösung, fügen Sie 10 % des Gesamtvolumens in jede Vertiefung und 3 h bei 37 ° c mit dem MTT-Reagenz inkubieren.
- Entfernen von Medien und Kristalle mit 200 µL Dimethyl Sulfoxid aufzuwirbeln. Lesen Sie die Platte in einem Spektrophotometer bei 570 nm.
Hinweis: Eine verminderte Absorption relativ Kontrollzellen wird korrelieren mit weniger Lebensfähigkeit.
Ergebnisse
Eines der Hauptanliegen der astrocytic Primärkultur ist das Vorhandensein von anderen Zellen wie Neuronen, Oligodendrozyten, Fibroblasten und Mikroglia. In Abbildung 1isolierte Zellen von Ratte Cortex hatten Medien Änderungen alle 3 Tage und waren entweder unbehandelt oder behandelt mit hinzugefügt LME für 1 h 24 h später, Zellen wurden Immunostained für GFAP und counterstained mit DAPI. Unbehandelte Zellen zeigte einen Durchschnitt von 39 % nicht-GFAP ...
Diskussion
Dieses Protokoll beschreibt die Isolation der Astrozyten aus Ratte Cortex. Bei dieser Methode ist es entscheidend, Kontamination mit anderen zellulären Arten wie Mikroglia, Oligodendrozyten und Fibroblasten zu verringern. Um die Anzahl der Mikroglia zu reduzieren, können mehrere Schritte unternommen werden: Ändern der Medien, Orbital, rütteln und chemischen Behandlungen. Wenn Kultur Reinheit durch Immunfluoreszenz mittels selektiver zellulären Marker oder für die prominentesten Zelle Verunreinigungen bestätigt ist...
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren möchten Paola López Pieraldi für die technische Unterstützung zu danken. A.H.M. ist dankbar für die Zuschüsse 8G12MD007600 und U54-NS083924, die diese Publikation unterstützt. Wir danken NIH-NIMHD-G12-MD007583-Stipendium für die Anlage-Unterstützung. D.E.R.A. ist dankbar für die Gemeinschaft von NIHNIGMS-R25GM110513 zur Verfügung gestellt. Wir sind dankbar für die Nutzung des gemeinsamen Instrumentierung und Gewährung der Beihilfe von Dr. Priscila Sanabria für den Einsatz der optischen Bildgebung Anlage des Programms RCMI durch G12MD007583. Darüber hinaus wollen wir danke Jose Padilla für seine herausragende Rolle in Filmen und schneiden das visuelle Protokoll.
Materialien
| Name | Company | Catalog Number | Comments |
| Instruments for Surgery - Step 1 | |||
| Operating scissor 5.5” | Roboz Company | RS-6812 | Tools used to decapitate the rats. |
| Curved forceps 7” | Roboz Company | RS-5271 | Holds the skin of the rat while the skull is removed. |
| Micro-dissecting scissors 4” | Roboz Company | RS-5882 | Cuts both the skin and skull of the rat. |
| Micro-dissecting forceps 4” angled, fine sharp | Roboz Company | RS-5095 | Holds the skin of the rat while the skull is removed. |
| Micro-dissecting forceps 4” slightly curved 0.8 | Roboz Company | RS-5135 | Tool used to separate cortices. |
| Micro-dissecting tweezers | Roboz Company | RS-4972 | Peels brain meninges. |
| Dissection microscope | Olympus | SZX16 | Important for removing the meninge from the cortices. |
| DMEM Preparation - step 2 | |||
| Dulbecco’s Modified Eagle’s Medium (DMEM) | GibCo. Company | 11995-065 | Supports the growth of cells. |
| Sodium bicarbonate | Sigma-Aldrich Company | S7277 | Supplement for the cell culture media. |
| Fetal bovine serum (FBS) | GibCo. Company | 10437-010 | Serum-supplement for the cell culture. |
| Penicillin-Streptomycin | GibCo. Company | 15140-148 | Inhibits the growth of bacterias in the cell culture. |
| Filter System 1L with 0.22um pore | Corning | 431098 | |
| Astrocyte culture - step 3 | |||
| Serological pipets 5mL | VWR | 89130-896 | To pipette DMEM to containers with cells. |
| Serological pipets 10mL | VWR | 89130-898 | To pipette DMEM to containers with cells. |
| Serological pipets 25mL | VWR | 89130-900 | To pipette DMEM to containers with cells. |
| Centrifuge conical tube 15mL | Santa Cruz Biotechnology | sc-200250 | |
| Safe-lock tube 1.5mL | Eppendorf | 022363204 | |
| Barrier Tips 200 uL | Santa Cruz Biotechnology | sc-201725 | |
| Barrier Tips 1 mL | Santa Cruz Biotechnology | sc-201727 | |
| Biohazard Orange Bag 14 x 19" | VWR | 14220-048 | |
| 60mm petri dishes | Falcon | 351007 | |
| Sterile gauze pads | Honeywell Safety | 89133-086 | |
| Stomacher 80 Biomaster | Sewar Lab System | 030010019 | Triturate the brain tissue. |
| Stomacher 80 Blender Sterile Bags | Sewar Lab System | BA6040 | Sterile bag for the stomacher cell homogenizer. |
| Beaker 400mL | Pyrex | 1000 | |
| Sterile cell dissociation sieve, mesh #60 | Sigma-Aldrich Company | S1020 | To obtain a uniform single cell suspension. |
| Sterile cell dissociation sieve, mesh #100 | Sigma-Aldrich Company | S3895 | To obtain a uniform single cell suspension. |
| Invert phase microscope | Nikon | Eclypse Ti-S | Verify cells for contamination or abnormal cell growth. |
| 75cm2 sterile flasks | Falcon | 353136 | |
| Multi-well plate | Falcon | 353046 | |
| Micro cover glasses (coverslips), 18mm, round | VWR | 48380-046 | |
| Bright-Line hemacytometer | Sigma-Aldrich Company | Z359629 | |
| Pasteur pipettes | Fisher Scientific | 13-678-20D | |
| Ethyl alcohol | Sigma-Aldrich Company | E7023 | |
| L-leucine methyl ester hydrochloride 98% (LME) | Sigma-Aldrich Company | L1002 | Promotes the elimination of microglia cells in the primary cortical astrocyte cultutre. |
| Cytosine β-D-arabinofuranoside (Ara-C) | Sigma-Aldrich Company | C1768 | |
| Poly-D-Lysine Hydrobromide, mol wt 70,000-150,000 | Sigma-Aldrich Company | P0899 | |
| Trypsin/EDTA | GibCo. Company | 15400-054 | |
| Trypan Blue | Sigma-Aldrich Company | T8154 | |
| Phosphate buffer saline (PBS) tablets | Calbiochem | 524650 | |
| Sterile Water | Sigma-Aldrich Company | W3500 | |
| OGD Medium Preparation - step 5 | |||
| Centrifuge conical tube 50 mL | VWR | 89039-658 | |
| Dulbecco’s modified Eagle’s medium-free glucose | Sigma-Aldrich Company | D5030 | Supports the growth of cells. |
| Sodium bicarbonate | Sigma-Aldrich Company | S7277 | Supplement for the cell culture media. |
| Penicillin-Streptomycin | GibCo. Company | 15140-148 | Inhibits the growth of bacterias in the cell culture. |
| 200mM L-glutamine | GibCo. Company | 25030-081 | Amino acid that supplements the growth of cells. |
| Phospahet buffer saline (PBS) tablets | Calbiochem | 524650 | |
| Filter System 50mL with 0.22um pore | Corning | 430320 | |
| Centrifuge conical tube 50 mL | VWR | 89039-658 | |
| Single Flow Meter | Billups-Rothenberg | SMF3001 | Measure gas flow in oxygen purge. |
| Hypoxia Incubator Chamber | StemCell | 27310 | Generates a hypoxic environment for the cell culture. |
| Traceable Dissolved Oxygen Meter | VWR | 21800-022 | |
| 95% N2/ 5% CO2 Gas Mixture | Linde | Purges the environment of oxygen. | |
| primary astrocyte immunofluorescence - step 6 | |||
| Phosphate buffer saline (PBS) tablets | Calbiochem | 524650 | |
| Formaline Solution Neutral Buffer 10% | Sigma-Aldrich | HT501128 | Solution used to fix cells. |
| Methanol | Fisher | A4544 | Solution used to fix cells. |
| Non-ionic surfactant (Triton X-100) | Sigma-Aldrich | T8787 | |
| Fetal bovine serum (FBS) | GibCo. Company | 10437-010 | Serum-supplement for the cell culture. |
| Anti-NeuN | Cell Signaling | 24307 | Detects mature neurons, serves to validate the astrocytic culture. |
| Anti-PCNA | Cell Signaling | 2586 | Detects proliferating cells. |
| Propidium Iodide (PI) | Sigma-Aldrich Company | P4170 | Apoptosis staining. |
| Anti-Olig1 | Abcam | AB68105 | Detects mature oligodendrocytes. |
| Anti-Iba1+ | Wako | 016-20001 | Detects microglial cells. |
| Anti-GFAP Conjugated with Cy3 | Sigma-Aldrich Company | C9205 | Detects reactive astrocytes in the treated cells. |
| Alexa Fluor 488 | Molecular Probe Life Technology | A1101 | Anti-Mouse Secondary Antibody |
| Alexa Fluor 555 | Molecular Probe Life Technology | A21428 | Anti-Rabbit Secondary Antibody |
| 4’,6’-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich Company | D9542 | Nuclear staining |
| Confocal microscope | Olympus |
Referenzen
- Goldstein, L. B., Bertels, C., Davis, J. N. Interrater reliability of the NIH stroke scale. Arch Neurol. 46 (6), 660-662 (1989).
- Hinkle, J. L., Guanci, M. M. Acute ischemic stroke review. J Neurosci Nurs. 39 (5), 285-293 (2007).
- Kassner, A., Merali, Z. Assessment of Blood-Brain Barrier Disruption in Stroke. Stroke. 46 (11), 3310-3315 (2015).
- Moskowitz, M. A., Lo, E. H., Iadecola, C. The science of stroke: mechanisms in search of treatments. Neuron. 67 (2), 181-198 (2010).
- Ben Haim, L., Carrillo-de Sauvage, M. A., Ceyzeriat, K., Escartin, C. Elusive roles for reactive astrocytes in neurodegenerative diseases. Front Cell Neurosci. 9, 278 (2015).
- Broderick, J., et al. Guidelines for the Management of Spontaneous Intracerebral Hemorrhage in Adults 2007 Update: A Guideline From the American Heart Association/American Stroke Association Stroke Council, High Blood Pressure Research Council, and the Quality of Care and Outcomes in Research Interdisciplinary Working Group: The American Academy of Neurology affirms the value of this guideline as an educational tool for neurologists. Stroke. 38 (6), 2001-2023 (2007).
- Wang, R., et al. Oxygen-glucose deprivation induced glial scar-like change in astrocytes. PLoS One. 7 (5), e37574 (2012).
- Sofroniew, M. V. Reactive astrocytes in neural repair and protection. The Neuroscientist. 11 (5), 400-407 (2005).
- Sofroniew, M. V., Vinters, H. V. Astrocytes: biology and pathology. Acta neuropathologica. 119 (1), 7-35 (2010).
- Souza, D. G., Bellaver, B., Souza, D. O., Quincozes-Santos, A. Characterization of adult rat astrocyte cultures. PLoS One. 8 (3), e60282 (2013).
- Puschmann, T. B., et al. HB-EGF affects astrocyte morphology, proliferation, differentiation, and the expression of intermediate filament proteins. J Neurochem. 128 (6), 878-889 (2014).
- Robinson, C., Apgar, C., Shapiro, L. A. Astrocyte Hypertrophy Contributes to Aberrant Neurogenesis after Traumatic Brain Injury. Neural Plast. , 1347987 (2016).
- Brekke, E., Berger, H. R., Wideroe, M., Sonnewald, U., Morken, T. S. Glucose and Intermediary Metabolism and Astrocyte-Neuron Interactions Following Neonatal Hypoxia-Ischemia in Rat. Neurochem Res. , (2016).
- Cekanaviciute, E., et al. Astrocytic transforming growth factor-beta signaling reduces subacute neuroinflammation after stroke in mice. Glia. 62 (8), 1227-1240 (2014).
- Zhu, Z., et al. Inhibiting cell cycle progression reduces reactive astrogliosis initiated by scratch injury in vitro and by cerebral ischemia in vivo. Glia. 55 (5), 546-558 (2007).
- Bovolenta, P., Wandosell, F., Nieto-Sampedro, M. Neurite outgrowth over resting and reactive astrocytes. Restor Neurol Neurosci. 2 (4), 221-228 (1991).
- Anderson, M. A., et al. Astrocyte scar formation aids central nervous system axon regeneration. Nature. 532 (7598), 195-200 (2016).
- Hao, C., Richardson, A., Fedoroff, S. Macrophage-like cells originate from neuroepithelium in culture: characterization and properties of the macrophage-like cells. Int J Dev Neurosci. 9 (1), 1-14 (1991).
- Saura, J. Microglial cells in astroglial cultures: a cautionary note. J Neuroinflammation. 4, 26 (2007).
- Giulian, D., Baker, T. J. Characterization of ameboid microglia isolated from developing mammalian brain. J Neurosci. 6 (8), 2163-2178 (1986).
- Schildge, S., Bohrer, C., Beck, K., Schachtrup, C. Isolation and culture of mouse cortical astrocytes. J Vis Exp. (71), (2013).
- Armstrong, R. C. Isolation and characterization of immature oligodendrocyte lineage cells. Methods. 16 (3), 282-292 (1998).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85 (3), 890-902 (1980).
- Pont-Lezica, L., Colasse, S., Bessis, A. Depletion of microglia from primary cellular cultures. Methods Mol Biol. 1041, 55-61 (2013).
- Svensson, M., Aldskogius, H. Synaptic density of axotomized hypoglossal motorneurons following pharmacological blockade of the microglial cell proliferation. Exp Neurol. 120 (1), 123-131 (1993).
- Wong, V. K., Shapourifar-Tehrani, S., Kitada, S., Choo, P. H., Lee, D. A. Inhibition of rabbit ocular fibroblast proliferation by 5-fluorouracil and cytosine arabinoside. J Ocul Pharmacol. 7 (1), 27-39 (1991).
- Nakatsuji, Y., Miller, R. H. Density dependent modulation of cell cycle protein expression in astrocytes. J Neurosci Res. 66 (3), 487-496 (2001).
- Reeves, J. P. Accumulation of amino acids by lysosomes incubated with amino acid methyl esters. J Biol Chem. 254 (18), 8914-8921 (1979).
- Thiele, D. L., Kurosaka, M., Lipsky, P. E. Phenotype of the accessory cell necessary for mitogen-stimulated T and B cell responses in human peripheral blood: delineation by its sensitivity to the lysosomotropic agent, L-leucine methyl ester. J Immunol. 131 (5), 2282-2290 (1983).
- Hamby, M. E., Uliasz, T. F., Hewett, S. J., Hewett, J. A. Characterization of an improved procedure for the removal of microglia from confluent monolayers of primary astrocytes. J Neurosci Methods. 150 (1), 128-137 (2006).
- Corvalan, V., Cole, R., de Vellis, J., Hagiwara, S. Neuronal modulation of calcium channel activity in cultured rat astrocytes. Proc Natl Acad Sci U S A. 87 (11), 4345-4348 (1990).
- Butler, I. B., Schoonen, M. A., Rickard, D. T. Removal of dissolved oxygen from water: A comparison of four common techniques. Talanta. 41 (2), 211-215 (1994).
- Tasca, C. I., Dal-Cim, T., Cimarosti, H. In vitro oxygen-glucose deprivation to study ischemic cell death. Methods Mol Biol. 1254, 197-210 (2015).
- Wu, D., Yotnda, P. Induction and testing of hypoxia in cell culture. J Vis Exp. (54), (2011).
- Rivera-Aponte, D., et al. Hyperglycemia reduces functional expression of astrocytic Kir4. 1 channels and glial glutamate uptake. Neuroscience. 310, 216-223 (2015).
- Berger, R., Garnier, Y., Pfeiffer, D., Jensen, A. Lipopolysaccharides do not alter metabolic disturbances in hippocampal slices of fetal guinea pigs after oxygen-glucose deprivation. Pediatric research. 48 (4), 531-535 (2000).
- Anderson, T. R., Jarvis, C. R., Biedermann, A. J., Molnar, C., Andrew, R. D. Blocking the anoxic depolarization protects without functional compromise following simulated stroke in cortical brain slices. Journal of neurophysiology. 93 (2), 963-979 (2005).
- Jarvis, C. R., Anderson, T. R., Andrew, R. D. Anoxic depolarization mediates acute damage independent of glutamate in neocortical brain slices. Cerebral Cortex. 11 (3), 249-259 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten