É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Monitoramento de Astrocyte de reatividade e proliferação in Vitro sob condições isquêmicas
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Acidente vascular cerebral isquêmico é um evento complexo, no qual a contribuição específica dos astrócitos à região afetada do cérebro exposto a privação de oxigênio glicose (OGH) é difícil de estudar. Este artigo apresenta uma metodologia para obter isolados astrócitos e estudar sua reatividade e proliferação em condições OGH.
Resumo
Acidente vascular cerebral isquêmico é uma lesão complexa do cérebro causada por um trombo ou êmbolo obstruindo o fluxo sanguíneo para partes do cérebro. Isto leva à privação de oxigênio e glicose, o que faz com que a falha de energia e morte neuronal. Depois de um insulto isquêmico, astrócitos tornar-se reativa e proliferam em torno do local da lesão, como ela se desenvolve. Sob esse cenário, é difícil estudar a contribuição específica dos astrócitos, a região do cérebro exposto à isquemia. Portanto, este artigo apresenta uma metodologia para estudar a reatividade astrocyte primária e proliferação sob um modelo in vitro de um ambiente, como isquemia, chamado de privação de oxigênio glicose (OGH). Astrócitos foram isolados a partir de dia 1-4-velhos ratos Neonatais e o número de células hamartomas específico foi avaliada utilizando marcador seletivo de astrocyte gliais de proteína ácida fibrilar (GFAP) e coloração nuclear. O período em que astrócitos estão sujeitos à condição de OGH pode ser personalizado, bem como a percentagem de oxigênio que estão expostos. Essa flexibilidade permite aos cientistas caracterizar a duração do estado isquêmico, como em diferentes grupos de células in vitro. Este artigo discute os prazos de OGH que induzem a reatividade astrocyte, morfologia hipertrófica e proliferação, como medido por imunofluorescência usando Proliferating Cell Nuclear Antigen (PCNA). Além de proliferação, astrócitos passam por energia e estresse oxidativo e respondem a OGH pela liberação de fatores solúveis no meio de célula. Este meio pode ser coletado e utilizado para analisar os efeitos das moléculas lançados por astrócitos em culturas neuronal preliminares sem interação célula a célula. Em resumo, este modelo de cultura celular primária pode ser usado com eficiência para entender o papel dos astrócitos isolados após lesão.
Introdução
Traço é definido como "uma aguda disfunção neurológica de origem vascular com súbito ou rápido desenvolvimento de sintomas e sinais, correspondentes à participação de áreas focais no cérebro"1,2. Existem dois tipos de AVC: isquêmico e hemorrágico. Quando a disfunção vascular é causada por um aneurisma ou uma avaria arteriovenosa, acompanhado pelo enfraquecimento com posterior ruptura de uma artéria, este é denominado acidente vascular cerebral hemorrágico3 que, na maioria dos casos, leva à morte. Quando um trombo ou um êmbolo obstrui o fluxo sanguíneo, causando uma temporária privação de oxigênio e glicose para uma região do cérebro, é chamado de acidente vascular cerebral isquêmico4. Falha para nutrir as células ao redor da área afetada ou núcleo isquêmico leva a um desequilíbrio homeostático e metabólico, disfunção energética, morte neuronal e inflamação5, que pode induzir a uma deficiência ao longo da vida para pacientes6.
Acidente vascular cerebral isquêmico é uma lesão multifatorial, envolvendo vários tipos de células que reagem e exercem seus efeitos nos pontos de tempo diferentes. Muitas interações criam um ambiente difícil para estudar o comportamento de células individuais. Então, como é que estudamos o contributo de um tipo de célula específica em um ambiente tão complexo? Um modelo aceito em vitro de isquemia consiste em expor as células à privação de oxigênio e glicose (OGH), durante um determinado período, seguido da restauração das células para um ambiente normoxic. Este sistema simula um acidente vascular cerebral isquêmico seguido de reperfusão de sangue. Neste método, as células ou tecidos são expostos a uma mídia livre de glicose em um ambiente purificado de oxigênio, utilizando uma câmara especializada hipóxica. O tempo de incubação OGH pode variar de alguns minutos até 24 h, dependendo da hipótese de que quer ser testado. Estudos têm mostrado que, dependendo da época do OGH e normoxic ambiente, fenótipos específicos do curso (ou seja, aguda ou subcrónica) pode ser alcançado. Primários isolados astrócitos, expostos a OGH com posterior restauração às condições normoxic, é um modelo de celular bem estudado para imitar o traço in-vitro7. Usando OGH é possível revelar os mecanismos moleculares independentes de células isoladas em um ambiente semelhante ao curso.
À medida que aumenta nosso conhecimento da biologia de astrocyte, tornou-se evidente que eles são cruciais para manter as sinapses e sustentar de reparação, desenvolvimento e plasticidade neural8. Em condições normais, astrócitos liberar e respondem às citocinas, quimiocinas, factores de crescimento e gliotransmitters, mantendo o equilíbrio metabólico e homeostase dentro sinapses5,9. Em neuroinflammation aguda, tais como acidente vascular cerebral isquêmico, estas células podem tornar-se reativa, mostrar uma superexpressão de longo prazo de Glial fibrilar ácida proteína (GFAP) e mostrar hipertrofia em sua morfologia5,10, 11 , 12. como o infarto isquêmico se desenvolve, a homeostase fornecida por astrócitos torna-se afetado, em relação a captação de glutamato normal, metabolismo energético, troca de moléculas ativas e antioxidante atividade13.
Reativados astrócitos proliferam em torno do tecido de infarto enquanto leucócitos migram para o lesado área14. Hamartomas proliferação pode ser medida usando marcadores como antígeno nuclear de proliferação celular (PCNA), Ki67 e bromodeoxyuridine (BrdU)15. Esta resposta proliferativa é gerada de forma dependente do tempo e ajuda a formar a cicatriz glial, uma matriz de astrócitos reativos irreversivelmente ao longo do parênquima do local danificado após uma lesão de9. Uma das funções iniciais desta cicatriz é limitar o extravasamento de células imunes dessa área. No entanto, estudos têm mostrado que a cicatriz se torna um impedimento físico para axônios estender, como eles liberam moléculas inibindo o crescimento axonal e criar uma barreira física, impedindo que os axônios estendendo-se ao redor da área lesada16. No entanto, há evidências científicas mostrando que após uma lesão na medula espinhal, impedir completamente a formação de cicatriz glial pode prejudicar a regeneração de axônios17. Assim, o contexto no qual é medida a resposta hamartomas específica, deve ser considerado em cima do quadro da lesão estudada.
A metodologia apresentada pode ser aplicada para estudar a função individualizada de astrócitos após privação de glicose oxigênio e ele pode ser modificado dependendo as perguntas que o investigador quer responder. Por exemplo, além da alteração morfológica e os marcadores expressados em momentos diferentes do OGH, os sobrenadantes de astrócitos expostos a OGH podem ser mais analisados para identificar fatores solúveis liberados por essas células, ou usado como uma mídia condicionada para avaliar sua efeito em outras células do cérebro. Esta abordagem permite estudos sobre reatividade astrocyte que poderia levar a elucidação dos fatores que governam e modulam sua resposta em um cenário acidente vascular cerebral isquêmico.
Protocolo
pós-natal ratos (Sprague Dawley) 1-4 dias de idade são usados para isolar os córtices. O método de eutanásia é decapitação, conforme aprovado pelas diretrizes do NIH.
1. preparação de instrumentos e materiais para cirurgia
- instrumentos esterilize em autoclave (temperatura: 121 ° c, pressão: 15 libras por polegada quadrada, tempo: 30 minutos) usando uma caixa de aço ou uma mágica instantânea selagem bolsa de esterilização. Ver os materiais na Tabela de materiais.
2. Concluir a preparação de DMEM
- em um copo de um litro contendo 700 mL de água esterilizada, adicionar Dulbecco ' s Modified Eagle ' s médio pó à temperatura ambiente.
- Adicionar 3,7 g/L de bicarbonato de sódio, enquanto a solução é agitada com um agitador magnético.
- Ajustar o pH para 7,4, com água esterilizada trazer o volume até 1 L e, em seguida, filtrar. Para fins de cultura, completar o volume desejado de mídia com 10% FBS e 1% penicilina/estreptomicina e morno em 37 ˚ c. Ver os materiais na Tabela de materiais.
Nota: O pH foi ajustado para 7,4 através de inserir o eletrodo medidor de pH em meios de comunicação. Então a mídia deve ser agitação, adicionar lentamente 1 M NaOH, usando um conta-gotas.
3. Cultura primária de Astrocyte
Nota: após a semeadura, mídia celular deve ser alterada a cada três dias e as células podem ser cultivadas até confluência (dias 11-13). No terceiro dia, toque o frasco várias vezes para elevador microglial células e as células progenitoras oligodendrocyte fora da cultura, remover todos os ' velho ' mídia, lavar duas vezes com 10 mL de PBS, aspirar a PBS, em seguida, adicionar mídia nova fresca. Ver os materiais na Tabela de materiais.
- De dissecação do cérebro de rato recém-nascido
- executar a dissecação de um capuz de cultura de tecidos. Obter o 1-4 dias velho filhotes recém-nascidos (2 cérebros de ratos são usados por balão de 75 cm 2).
- Preparar três pratos de petri 60mm e pipetar 5 mL de DMEM completa em cada um.
Nota: Eles podem ser divididos da seguinte forma: #1 para cada rato no cérebro, #2 para todos os córtices dos cérebros e #3 para todos os córtices pelados (sem as meninges). - Segure o filhote e spray com etanol a 70%. Decapitá-lo e descartar o corpo em um recipiente de resíduos de risco biológico pequeno.
- Usando as pinças microdissecando, segure a cabeça e cortar a pele em cima da cabeça para expor o crânio.
- Com outro par de tesouras, fazer um " T " incisão começando da parte de trás do crânio em direção ao nariz. Usar um par de pinças para remover suavemente o crânio.
- Remover o cérebro exposto com um par de pinças e colocar o cérebro em um dos pratos petri previamente preenchidos com meio.
- Usar um outro conjunto de instrumentos esterilizados para as etapas subsequentes.
- Usar fórceps microdissecando delicadamente, colocar um cérebro na pálpebra invertida de um prato de petri de 60 mm. Quando o prato de petri é colocado em gaze estéril, é possível ver claramente o cérebro, e é mais fácil dissecar.
- Firme o cérebro com pinças microdissecando e separe o hemisfério cerebral por provocando suavemente ao longo da fissura mediana com a ponta da pinça microdissecando.
- Transferir e descasque os córtices, deixando para trás a matéria branca e transferi-los para um prato de petri, previamente rotulado #2. Repita o procedimento para todos os cérebros, combinando todos os córtices dissecados no prato de petri rotulados #2.
- Retire o hipocampo de debaixo de cada córtex e descartá-lo
- Usar a pinça microdissecando e uma petri 60mm para descasque delicadamente as meninges de lóbulos corticais individuais e colocá-los no prato de petri rotulado #3.
- Dissociação de tecido: método de misturador homogeneizador
- despeje o saco estéril liquidificador suspensão de tecido/médio (córtices descascadas do cérebro) e adicionar suficiente médio para trazer o volume total no saco de 5 mL.
- Coloque o saco dentro o misturador homogeneizador, deixando aproximadamente 2 cm do saco visível acima da porta fechada. A dissociação de célula é feita durante 2,5 min em alta velocidade.
Nota: Como alternativa, isso pode ser feito, fechando o saco e batendo-lo suavemente com um copo no bairro. Certifique-se de usar um pano entre o saco e o copo para evitar atritos. - Despeje a suspensão de células em uma peneira de malha de número 60 e em seguida despeje o fluxo do filtrado através para a peneira de número 100, permitindo-lhe filtrar por gravidade.
- Usando 15 mL tubos, centrifugar a suspensão de célula x 200 g em uma centrífuga clínica (de preferência balanço balde rotor) 5 min.
- Decantar o sobrenadante em um copo, em seguida, usando uma pipeta sorológica, re-suspender e dissociar o pellet de células em um prazo máximo de 5 mL de mídia.
- Celular contando
- com uma micropipeta, coletar 100 µ l de suspensão de células em um tubo de microcentrifugadora de 1,5 mL e adicionar 100 µ l de azul trypan.
- Inserir 10 µ l da suspensão coletada no hemocytometer e contar todas as células que são viáveis nos quatro cantos da Praça.
- As fórmulas para o cálculo da densidade das células antes de preparar os frascos são:
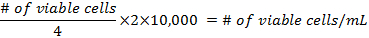
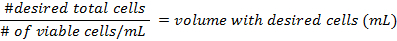
- adicionar pelo menos 500.000 células por balão de 25 cm 2. Pipete até 5 mL de DMEM para cada balão. A mistura não deve alcançar o pescoço do balão. Colocá-los numa incubadora 37 ° C em 5% CO 2, por 3 dias e, em seguida, alterar a mídia.
- Técnicas de purificação de astrocyte: mídia alterar, mecânicas e químicas estratégias
Nota: a taxa metabólica de astrócitos é elevada em comparação com outros tipos de células, portanto, em nutricionalmente sem condições, estas células apresentam taxas de sobrevivência baixa depois de alguns dias. Ao contrário de astrócitos, micróglia não são afetados pela privação nutricional e proliferam em tais ambientes, 18. Para manter um número reduzido de células microglial, os autores mudam os meios de cultura de células de Ralevic cada 3 dias. Esta mudança constante nos meios de comunicação celular também irá diminuir a população de microglial que pode crescer em cima a monocamada celular hamartomas no balão 19.- Uso um Pasteur pipeta para aspirar a mídia com células não-aderentes microglial de cada um dos frascos. Lavagem de todos os resíduos deixados para trás usando PBS estéril filtrada a cada um dos frascos de forma gota a gota (5 mL/frasco).
- Adicionar o filtrado estéril DMEM (com soro bovino fetal e antibiótico) gota a gota a cada balão (5 mL/frasco). Agitar suavemente em movimentos circulares para cobrir toda a superfície.
- Lugar as células em um 37 ° C incubadora a 5% de CO 2 por 8-10 dias até os frascos alcançar confluência (> 95% de cobertura de chapa).
Nota: Vários protocolos têm mostrado que, quando astrócitos alcançar confluência, métodos mecânicos, tais como a cultura de 2 a 24 h, a tremer conduz para o destacamento de células que se encontram em cima destes astrócitos, principalmente microglia e precursor de células 19 , 20. - Células Non-hamartomas é reduzidos em cultura através da realização de agitação orbital a 180 rpm por 30 min. Depois de remover células no sobrenadante, mídia fresca é pipetada para o balão (~ 15 mL).
- Para eliminar as células progenitoras oligodendrocyte, aumentar a velocidade de agitação para 200 rpm para 6 h 21 , 22 , 23, aspirado de sobrenadante e pipetar fresco mídia.
Nota: Para diminuir a presença de micróglia nas culturas, dois métodos químicos podem ser usados em sequência (não simultaneamente) na metodologia de cultura celular primária: citosina arabinosa (Ara-C) e L-leucina metil éster (LME) 24. - Imediatamente quando células alcançar confluência (100%), 3-4 dias após a remoção mecânica de micróglia, estas células podem ser tratadas com 8 µM da antimitóticas citosina arabinosa composta (Ara-C) em DMEM por 5 dias (mudança diariamente ao fresco Ara-C em DMEM).
Nota: Ponto para adicionar Ara-C de tempo é crítico, uma vez que este composto é uma droga antimitóticas, que reduz o número de células, dividindo rapidamente como micróglia 19 , 25 e fibroblastos 26 . Em contraste com microglia, quando confluentes, astrócitos param proliferando através de da inibição de contato 27. - Permitir que 2 dias para as células para se recuperar do tratamento de Ara-C.
- Para reduzir ainda mais a contaminação microglial, depois que células alcançar confluência, usa a 50mm de éster metílico de L-leucina (LME) em DMEM fixado em pH 7,4, por 1h em 37 ˚ c.
Nota: LME atravessa a membrana das células e organelas, e após ser hidrolisado, a L-leucina produzido acumula-se nos lisossomos dessas células. A acumulação deste aminoácido leva a um edema osmótica e ruptura dos lisossomos 28 , 29. LME é altamente eficaz em eliminar microglia, em comparação com outras células 20 , 30.
4. Cultivando os astrócitos em placas boas 6
- revestimento lamelas com poli-lisina-D
- colocar uma lamela em cada prato de petri de 35 milímetros, em seguida adicionar 100 µ l da solução diluída para cada lamela poli-D-lisina e esperar 1 h.
- Remover o poli-D-lisina e lavar duas vezes com água estéril de 2 mL.
- Remover água e esperar por lamelas secar o interior do capô. Armazenar as lamelas a-20 ° C por até duas semanas.
Nota: Congelar a solução diluída de poli-D-lisina; pode ser armazenado por até duas semanas.
- Trypsinization
- com uma pipeta Pasteur, Aspire o meio dos frascos. Adicionar 5 mL/frasco de PBS estéril filtrada para lavar delicadamente as células.
- Aspirado fora da PBS e em seguida, adicione 5 mL/frasco estéril filtrada 0,25% tripsina e 0,5 mM da solução de EDTA. Colocar o balão o ˚ c 37, 5% CO 2 incubadora durante 10 min.
Nota: Enquanto as células estão incubando, aquecer 5 mL/frasco de fresco DMEM completa em 37 ° C. - Após 10 min de incubação, agitar para certificar-se de todas as células são levantadas fora do frasco. Adicionar rapidamente a 5 mL de DMEM completa quente a cada balão, para neutralizar a tripsina.
- Pipetar suavemente as células acima e para baixo várias vezes para quebrar qualquer " grupos ". Transferência de células suspensas de dois balões para um tubo de centrifuga conico de 15 mL.
- Centrifugar durante 5 min à x 200 g para coletar o centrifugado. Ressuspender o pellet em 500 µ l de meio e prosseguir para colocar as células em balões a.
Nota: Exemplos de análises deve ser feita com células: 1) reação em cadeia do polymerase transcrição reversa (RT-PCR) para analisar a expressão do gene; 2) Western blot para avaliar a expressão de proteínas; 3) análise de citometria de fluxo de para quantificar o número de células progenitoras neurais e proteínas de interesse; 4) imunofluorescência para analisar a expressão da proteína e localização.
- a semeadura de astrócitos
- após o tratamento os astrócitos primários com tripsina (ver 4.2), coletar 100 μL da suspensão de células em um tubo de microcentrifugadora de 1,5 mL e adicionar 100 μL de 0,5% trypan azul.
- Adicionar 10 μL da suspensão coletada em trypan azul para o hemocytometer e contar todas as células que são viáveis.
- Use as fórmulas na etapa 3.3 para calcular a densidade das células antes de preparar os frascos.
- Preparar o poço de vários pratos, adicionando um estéril, poli-D-lisina revestido lamela a cada poço. Pipetar as 50.000 células e preencher o restante do volume em cada prato multi bem com meio fresco (cerca de 2 mL).
- Coloque os pratos multi bem dentro da incubadora 37 ˚ c a 5% de CO 2 e, depois de 5-7 dias, astrócitos podem crescer e cobrir toda a superfície das lamelas.
5. OGH protocolo para astrócitos primário
- preparação média OGH
- Dulbecco suplemento ' s modificado águia ' glicose livre médio de s com 3,7 g/L de bicarbonato de sódio e 1% penicilina/estreptomicina. Ver os materiais na tabela 4.
- Purga 20 mL do meio livre de glicose por borbulhamento com 95% N 2 / 5% de CO 2 por 10 min a um caudal de 15 L/min (indicado com o medidor de fluxo) através da inserção de uma pipeta sorológica para o sistema de gás no meio de.
Nota: Após a purga o meio de oxigênio, ajustar o pH em 7,4 (consulte a nota no passo 2.1). - Filtrar o meio livre de glicose eliminado usando um sistema de filtro do tubo de 50 mL.
Nota: Fazer meio OGH fresco para cada experimento, borbulhando com 95% N 2 / 5% de CO 2 antes de utilizar, para assegurar que as células estão expostas a um ambiente purificado de oxigênio.
- Procedimento experimental
- dentro do capô de cultura de tecidos, remover mídia astrocyte de lamelas previamente preparadas (consulte a etapa 4.3.5) e lavagem com PBS celular duas vezes para remover qualquer glicose nas células.
- Adicionar 2 mL da mídia OGH a cada bem e coloque os pratos multi bem dentro da câmara de hipóxia com folga suas tampas
- Conectar-se a mistura de gás para a válvula de entrada e deixar a válvula de saída aberta. Lave a câmara com a mistura de gás de 95% N 2 / 5% CO 2, a 15 L/min para 5 min.
- Parar o fluxo de gás e primeiro feche a fixação da válvula de saída, em seguida, feche a braçadeira do tubo de válvula de entrada de gás.
Nota: Certifique-se de não há nenhum escapamento do gás, abrangendo o selo da câmara com água e sabão. Se o selo for seguro, sem bolhas formam. - Coloque a câmara inteira dentro da incubadora de cultura de célula a 37 ° C por 1 h ou h 6 em OGH.
- Depois que acabou o tempo de incubação, aspirar a mídia OGH e cuidadosamente Pipetar 2 mL de DMEM completa para cada 4,67 cm 2 bem para o normoxic processar 24 h.
6. Protocolo para a preparação de imunofluorescência primário Astrocyte
Nota: para avaliar a pureza de astrocyte, células cerebrais diferentes tipos tais como os neurônios, oligodendrócitos e micróglia podem ser detectados por imunofluorescência utilizando marcadores de célula diferente. Marcadores de proliferação, PCNA e iodeto de propidium (PI) podem ser usados em astrócitos principais expostos a OGH seguido por normoxic condições. Ver os materiais na Tabela de materiais.
- Preparação de imunofluorescência
Nota: este é um protocolo geral de imunofluorescência, pequenas modificações podem ser executadas para alcançar uma óptima do sinal (por exemplo, longos períodos de incubação, temperatura de incubação). Cada marcador da tabela 1 pode ser usado de acordo com o fabricante ' protocolo s.- Para avaliar a viabilidade celular, as células podem ser incubadas por 5 min a 37 ° C com PI (5 µM em DMEM completa) e lavar duas vezes com 2 mL de PBS para 5 min. de células que mostram coloração PI são menos viáveis.
Nota: Uso as células tratadas na etapa 5.2.6. - Corrigir células após coloração de PI, adicionar 2 mL de formol a 4% por 4,67 cm 2 bem, 20 minutos a 4 ˚ c. Para amostras rotuladas com PCNA, a solução preferida de fixação é metanol durante 10 minutos a 4 ˚ c.
Atenção: Formol e metanol são tóxicos.
Nota: Verifique sempre os protocolos de anticorpo específico de cada empresa. - Lavar as células com 2 mL de PBS durante 5 min e repita este passo 3 vezes.
- Incubar células em solução de bloqueio (tensoativo não-iônico de 0,5%, 10% FBS em PBS) por 30 min à temperatura ambiente com agitação suave.
- Lavar as células com 2 mL de PBS durante 5 min, repetir a lavagem 3 vezes.
- Incubar a 4 ° C, durante a noite (16 h), com o anticorpo primário (PCNA, GFAP) em uma solução de 1% FBS em PBS.
- Remover a solução de anticorpo primário, lavam-se as células com 2 mL de PBS durante 5 min e repita este passo 3 vezes.
- Incubar com anticorpo secundário conjugado com fluoróforo em uma solução de 1% FBS em PBS, por 1h, à temperatura ambiente.
- Lavar as células com 2 mL de PBS durante 5 minutos, repita este passo 3 vezes. Adicionar 1 µ g/mL de DAPI (4 ', 6 ' - diamidino - 2-phenylindole) por 5 min manchar o núcleo de células.
- Lavar as células com 2 mL de PBS 5 min, repetir esta etapa duas vezes e manter em PBS.
- Preparar as lamelas em uma corrediça do microscópio usando o meio de montagem.
- Para avaliar a viabilidade celular, as células podem ser incubadas por 5 min a 37 ° C com PI (5 µM em DMEM completa) e lavar duas vezes com 2 mL de PBS para 5 min. de células que mostram coloração PI são menos viáveis.
- Microscópio confocal
- após a criação do microscópio, coloque o lado de lamela para baixo no palco microscópio.
- Usando o software, selecione um feixe de laser em 543nm para GFAP-Cy3 anticorpo conjugado.
7. Ensaio da viabilidade de células
- Trypsinize e quantificar astrócitos seguindo as etapas 4.3 e 4.4.
- Adicionar 1 x 10 4 células/poço para placas de 96 poços e cultivá-las a confluência.
- Usando a metodologia da etapa 5, expor culturas placas de 96 poços para quer normoxic 1h OGH ou 6 h OGH.
- OGH após tratamento, normoxic mídia é adicionada a todas as células para 24h e viabilidade é medida usando o ensaio de reagente MTT (usar como fabricante ' instruções s indicam).
- De uma solução MTT 5 mg/mL, adicionar 10% do volume total a cada poço e incubar durante 3 h a 37 ˚ c com o reagente MTT.
- Remover mídia e ressuspender cristais usando 200 µ l dimetil sulfóxido. Leia a placa em espectrofotómetro a 570 nm.
Nota: Uma diminuição da absorvância em relação a células de controle será correlacionar com menor viabilidade.
Resultados
Uma das principais preocupações da cultura hamartomas primária é a presença de outras células, como neurônios, oligodendrócitos, micróglia e fibroblastos. Na Figura 1, células isoladas de córtices rato tinham alterações de mídia a cada 3 dias em foram ou não tratada ou tratada com adicionado LME para 1 h. 24 horas mais tarde, as células foram immunostained para GFAP e counterstained com DAPI. Células não tratadas mostraram uma média de 39% ...
Discussão
Este protocolo descreve o isolamento de astrócitos de córtices de rato. Neste método, é fundamental para diminuir a contaminação com outros tipos celulares como fibroblasto, oligodendrócitos e micróglia. Para reduzir o número de micróglia, várias medidas podem ser tomadas: mudando a mídia, orbital tremendo e tratamentos químicos. Uma vez que a pureza da cultura é confirmada por imunofluorescência usando marcadores celulares seletivas ou para os contaminantes mais proeminentes de célula, experiências pode...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores querem agradecer Paola López Pieraldi pela assistência técnica. A.H.M é grato para o 8G12MD007600 de subsídios e U54-NS083924 que suporte esta publicação. Agradecemos a subvenção de NIH-NIMHD-G12-MD007583 para o suporte de instalação. D.E.R.A. é grato para a bolsa fornecida pelo NIHNIGMS-R25GM110513. Estamos gratos pelo uso da área comum de instrumentação e a ajuda do Dr. Priscila Sanabria para o uso da instalação de imagem óptico do programa RCMI por conceder G12MD007583. Além disso, queremos agradecer seu papel proeminente em filmagem e edição do protocolo visual Jose Padilla.
Materiais
| Name | Company | Catalog Number | Comments |
| Instruments for Surgery - Step 1 | |||
| Operating scissor 5.5” | Roboz Company | RS-6812 | Tools used to decapitate the rats. |
| Curved forceps 7” | Roboz Company | RS-5271 | Holds the skin of the rat while the skull is removed. |
| Micro-dissecting scissors 4” | Roboz Company | RS-5882 | Cuts both the skin and skull of the rat. |
| Micro-dissecting forceps 4” angled, fine sharp | Roboz Company | RS-5095 | Holds the skin of the rat while the skull is removed. |
| Micro-dissecting forceps 4” slightly curved 0.8 | Roboz Company | RS-5135 | Tool used to separate cortices. |
| Micro-dissecting tweezers | Roboz Company | RS-4972 | Peels brain meninges. |
| Dissection microscope | Olympus | SZX16 | Important for removing the meninge from the cortices. |
| DMEM Preparation - step 2 | |||
| Dulbecco’s Modified Eagle’s Medium (DMEM) | GibCo. Company | 11995-065 | Supports the growth of cells. |
| Sodium bicarbonate | Sigma-Aldrich Company | S7277 | Supplement for the cell culture media. |
| Fetal bovine serum (FBS) | GibCo. Company | 10437-010 | Serum-supplement for the cell culture. |
| Penicillin-Streptomycin | GibCo. Company | 15140-148 | Inhibits the growth of bacterias in the cell culture. |
| Filter System 1L with 0.22um pore | Corning | 431098 | |
| Astrocyte culture - step 3 | |||
| Serological pipets 5mL | VWR | 89130-896 | To pipette DMEM to containers with cells. |
| Serological pipets 10mL | VWR | 89130-898 | To pipette DMEM to containers with cells. |
| Serological pipets 25mL | VWR | 89130-900 | To pipette DMEM to containers with cells. |
| Centrifuge conical tube 15mL | Santa Cruz Biotechnology | sc-200250 | |
| Safe-lock tube 1.5mL | Eppendorf | 022363204 | |
| Barrier Tips 200 uL | Santa Cruz Biotechnology | sc-201725 | |
| Barrier Tips 1 mL | Santa Cruz Biotechnology | sc-201727 | |
| Biohazard Orange Bag 14 x 19" | VWR | 14220-048 | |
| 60mm petri dishes | Falcon | 351007 | |
| Sterile gauze pads | Honeywell Safety | 89133-086 | |
| Stomacher 80 Biomaster | Sewar Lab System | 030010019 | Triturate the brain tissue. |
| Stomacher 80 Blender Sterile Bags | Sewar Lab System | BA6040 | Sterile bag for the stomacher cell homogenizer. |
| Beaker 400mL | Pyrex | 1000 | |
| Sterile cell dissociation sieve, mesh #60 | Sigma-Aldrich Company | S1020 | To obtain a uniform single cell suspension. |
| Sterile cell dissociation sieve, mesh #100 | Sigma-Aldrich Company | S3895 | To obtain a uniform single cell suspension. |
| Invert phase microscope | Nikon | Eclypse Ti-S | Verify cells for contamination or abnormal cell growth. |
| 75cm2 sterile flasks | Falcon | 353136 | |
| Multi-well plate | Falcon | 353046 | |
| Micro cover glasses (coverslips), 18mm, round | VWR | 48380-046 | |
| Bright-Line hemacytometer | Sigma-Aldrich Company | Z359629 | |
| Pasteur pipettes | Fisher Scientific | 13-678-20D | |
| Ethyl alcohol | Sigma-Aldrich Company | E7023 | |
| L-leucine methyl ester hydrochloride 98% (LME) | Sigma-Aldrich Company | L1002 | Promotes the elimination of microglia cells in the primary cortical astrocyte cultutre. |
| Cytosine β-D-arabinofuranoside (Ara-C) | Sigma-Aldrich Company | C1768 | |
| Poly-D-Lysine Hydrobromide, mol wt 70,000-150,000 | Sigma-Aldrich Company | P0899 | |
| Trypsin/EDTA | GibCo. Company | 15400-054 | |
| Trypan Blue | Sigma-Aldrich Company | T8154 | |
| Phosphate buffer saline (PBS) tablets | Calbiochem | 524650 | |
| Sterile Water | Sigma-Aldrich Company | W3500 | |
| OGD Medium Preparation - step 5 | |||
| Centrifuge conical tube 50 mL | VWR | 89039-658 | |
| Dulbecco’s modified Eagle’s medium-free glucose | Sigma-Aldrich Company | D5030 | Supports the growth of cells. |
| Sodium bicarbonate | Sigma-Aldrich Company | S7277 | Supplement for the cell culture media. |
| Penicillin-Streptomycin | GibCo. Company | 15140-148 | Inhibits the growth of bacterias in the cell culture. |
| 200mM L-glutamine | GibCo. Company | 25030-081 | Amino acid that supplements the growth of cells. |
| Phospahet buffer saline (PBS) tablets | Calbiochem | 524650 | |
| Filter System 50mL with 0.22um pore | Corning | 430320 | |
| Centrifuge conical tube 50 mL | VWR | 89039-658 | |
| Single Flow Meter | Billups-Rothenberg | SMF3001 | Measure gas flow in oxygen purge. |
| Hypoxia Incubator Chamber | StemCell | 27310 | Generates a hypoxic environment for the cell culture. |
| Traceable Dissolved Oxygen Meter | VWR | 21800-022 | |
| 95% N2/ 5% CO2 Gas Mixture | Linde | Purges the environment of oxygen. | |
| primary astrocyte immunofluorescence - step 6 | |||
| Phosphate buffer saline (PBS) tablets | Calbiochem | 524650 | |
| Formaline Solution Neutral Buffer 10% | Sigma-Aldrich | HT501128 | Solution used to fix cells. |
| Methanol | Fisher | A4544 | Solution used to fix cells. |
| Non-ionic surfactant (Triton X-100) | Sigma-Aldrich | T8787 | |
| Fetal bovine serum (FBS) | GibCo. Company | 10437-010 | Serum-supplement for the cell culture. |
| Anti-NeuN | Cell Signaling | 24307 | Detects mature neurons, serves to validate the astrocytic culture. |
| Anti-PCNA | Cell Signaling | 2586 | Detects proliferating cells. |
| Propidium Iodide (PI) | Sigma-Aldrich Company | P4170 | Apoptosis staining. |
| Anti-Olig1 | Abcam | AB68105 | Detects mature oligodendrocytes. |
| Anti-Iba1+ | Wako | 016-20001 | Detects microglial cells. |
| Anti-GFAP Conjugated with Cy3 | Sigma-Aldrich Company | C9205 | Detects reactive astrocytes in the treated cells. |
| Alexa Fluor 488 | Molecular Probe Life Technology | A1101 | Anti-Mouse Secondary Antibody |
| Alexa Fluor 555 | Molecular Probe Life Technology | A21428 | Anti-Rabbit Secondary Antibody |
| 4’,6’-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich Company | D9542 | Nuclear staining |
| Confocal microscope | Olympus |
Referências
- Goldstein, L. B., Bertels, C., Davis, J. N. Interrater reliability of the NIH stroke scale. Arch Neurol. 46 (6), 660-662 (1989).
- Hinkle, J. L., Guanci, M. M. Acute ischemic stroke review. J Neurosci Nurs. 39 (5), 285-293 (2007).
- Kassner, A., Merali, Z. Assessment of Blood-Brain Barrier Disruption in Stroke. Stroke. 46 (11), 3310-3315 (2015).
- Moskowitz, M. A., Lo, E. H., Iadecola, C. The science of stroke: mechanisms in search of treatments. Neuron. 67 (2), 181-198 (2010).
- Ben Haim, L., Carrillo-de Sauvage, M. A., Ceyzeriat, K., Escartin, C. Elusive roles for reactive astrocytes in neurodegenerative diseases. Front Cell Neurosci. 9, 278 (2015).
- Broderick, J., et al. Guidelines for the Management of Spontaneous Intracerebral Hemorrhage in Adults 2007 Update: A Guideline From the American Heart Association/American Stroke Association Stroke Council, High Blood Pressure Research Council, and the Quality of Care and Outcomes in Research Interdisciplinary Working Group: The American Academy of Neurology affirms the value of this guideline as an educational tool for neurologists. Stroke. 38 (6), 2001-2023 (2007).
- Wang, R., et al. Oxygen-glucose deprivation induced glial scar-like change in astrocytes. PLoS One. 7 (5), e37574 (2012).
- Sofroniew, M. V. Reactive astrocytes in neural repair and protection. The Neuroscientist. 11 (5), 400-407 (2005).
- Sofroniew, M. V., Vinters, H. V. Astrocytes: biology and pathology. Acta neuropathologica. 119 (1), 7-35 (2010).
- Souza, D. G., Bellaver, B., Souza, D. O., Quincozes-Santos, A. Characterization of adult rat astrocyte cultures. PLoS One. 8 (3), e60282 (2013).
- Puschmann, T. B., et al. HB-EGF affects astrocyte morphology, proliferation, differentiation, and the expression of intermediate filament proteins. J Neurochem. 128 (6), 878-889 (2014).
- Robinson, C., Apgar, C., Shapiro, L. A. Astrocyte Hypertrophy Contributes to Aberrant Neurogenesis after Traumatic Brain Injury. Neural Plast. , 1347987 (2016).
- Brekke, E., Berger, H. R., Wideroe, M., Sonnewald, U., Morken, T. S. Glucose and Intermediary Metabolism and Astrocyte-Neuron Interactions Following Neonatal Hypoxia-Ischemia in Rat. Neurochem Res. , (2016).
- Cekanaviciute, E., et al. Astrocytic transforming growth factor-beta signaling reduces subacute neuroinflammation after stroke in mice. Glia. 62 (8), 1227-1240 (2014).
- Zhu, Z., et al. Inhibiting cell cycle progression reduces reactive astrogliosis initiated by scratch injury in vitro and by cerebral ischemia in vivo. Glia. 55 (5), 546-558 (2007).
- Bovolenta, P., Wandosell, F., Nieto-Sampedro, M. Neurite outgrowth over resting and reactive astrocytes. Restor Neurol Neurosci. 2 (4), 221-228 (1991).
- Anderson, M. A., et al. Astrocyte scar formation aids central nervous system axon regeneration. Nature. 532 (7598), 195-200 (2016).
- Hao, C., Richardson, A., Fedoroff, S. Macrophage-like cells originate from neuroepithelium in culture: characterization and properties of the macrophage-like cells. Int J Dev Neurosci. 9 (1), 1-14 (1991).
- Saura, J. Microglial cells in astroglial cultures: a cautionary note. J Neuroinflammation. 4, 26 (2007).
- Giulian, D., Baker, T. J. Characterization of ameboid microglia isolated from developing mammalian brain. J Neurosci. 6 (8), 2163-2178 (1986).
- Schildge, S., Bohrer, C., Beck, K., Schachtrup, C. Isolation and culture of mouse cortical astrocytes. J Vis Exp. (71), (2013).
- Armstrong, R. C. Isolation and characterization of immature oligodendrocyte lineage cells. Methods. 16 (3), 282-292 (1998).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85 (3), 890-902 (1980).
- Pont-Lezica, L., Colasse, S., Bessis, A. Depletion of microglia from primary cellular cultures. Methods Mol Biol. 1041, 55-61 (2013).
- Svensson, M., Aldskogius, H. Synaptic density of axotomized hypoglossal motorneurons following pharmacological blockade of the microglial cell proliferation. Exp Neurol. 120 (1), 123-131 (1993).
- Wong, V. K., Shapourifar-Tehrani, S., Kitada, S., Choo, P. H., Lee, D. A. Inhibition of rabbit ocular fibroblast proliferation by 5-fluorouracil and cytosine arabinoside. J Ocul Pharmacol. 7 (1), 27-39 (1991).
- Nakatsuji, Y., Miller, R. H. Density dependent modulation of cell cycle protein expression in astrocytes. J Neurosci Res. 66 (3), 487-496 (2001).
- Reeves, J. P. Accumulation of amino acids by lysosomes incubated with amino acid methyl esters. J Biol Chem. 254 (18), 8914-8921 (1979).
- Thiele, D. L., Kurosaka, M., Lipsky, P. E. Phenotype of the accessory cell necessary for mitogen-stimulated T and B cell responses in human peripheral blood: delineation by its sensitivity to the lysosomotropic agent, L-leucine methyl ester. J Immunol. 131 (5), 2282-2290 (1983).
- Hamby, M. E., Uliasz, T. F., Hewett, S. J., Hewett, J. A. Characterization of an improved procedure for the removal of microglia from confluent monolayers of primary astrocytes. J Neurosci Methods. 150 (1), 128-137 (2006).
- Corvalan, V., Cole, R., de Vellis, J., Hagiwara, S. Neuronal modulation of calcium channel activity in cultured rat astrocytes. Proc Natl Acad Sci U S A. 87 (11), 4345-4348 (1990).
- Butler, I. B., Schoonen, M. A., Rickard, D. T. Removal of dissolved oxygen from water: A comparison of four common techniques. Talanta. 41 (2), 211-215 (1994).
- Tasca, C. I., Dal-Cim, T., Cimarosti, H. In vitro oxygen-glucose deprivation to study ischemic cell death. Methods Mol Biol. 1254, 197-210 (2015).
- Wu, D., Yotnda, P. Induction and testing of hypoxia in cell culture. J Vis Exp. (54), (2011).
- Rivera-Aponte, D., et al. Hyperglycemia reduces functional expression of astrocytic Kir4. 1 channels and glial glutamate uptake. Neuroscience. 310, 216-223 (2015).
- Berger, R., Garnier, Y., Pfeiffer, D., Jensen, A. Lipopolysaccharides do not alter metabolic disturbances in hippocampal slices of fetal guinea pigs after oxygen-glucose deprivation. Pediatric research. 48 (4), 531-535 (2000).
- Anderson, T. R., Jarvis, C. R., Biedermann, A. J., Molnar, C., Andrew, R. D. Blocking the anoxic depolarization protects without functional compromise following simulated stroke in cortical brain slices. Journal of neurophysiology. 93 (2), 963-979 (2005).
- Jarvis, C. R., Anderson, T. R., Andrew, R. D. Anoxic depolarization mediates acute damage independent of glutamate in neocortical brain slices. Cerebral Cortex. 11 (3), 249-259 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados